Bài viết Bộ trao đổi nhiệt và độ ẩm và bộ lọc hệ thống dây máy thở: sử dụng trong gây mê và chăm sóc đặc biệt. Phần 1 – Lịch sử, nguyên tắc và hiệu quả được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Heat and moiture exchangers and breathing system filters: their use in anaesthesia and intensive care. Part 1 – history, principles and efficiency
1. Tóm lược
Bộ trao đổi nhiệt và độ ẩm (HME) và bộ lọc hệ thống dây máy thở (filter) nhằm thay thế các chức năng làm ấm, làm ẩm và lọc bình thường của đường hô hấp trên khi các cấu trúc này bị nối tắt trong khi gây mê và chăm sóc đặc biệt. Hướng dẫn về việc sử dụng chúng tiếp tục phát triển. Mục đích của phần này là để mô tả các nguyên tắc hoạt động và hiệu quả của chúng, và tóm tắt những phát hiện từ các nghiên cứu lâm sàng và phòng thí nghiệm. Dựa trên các nghiên cứu trước đây, một mục tiêu tối thiểu thích hợp cho đầu ra là độ ẩm 30 và 20 mg/L đối với sử dụng trong thời gian dài trong chăm sóc đặc biệt và sử dụng thời gian ngắn trong gây mê.
Thực tế có tái sử dụng hệ thống dây máy thở trong gây mê, miễn là nó được bảo vệ bằng bộ lọc, giả định rằng bộ lọc có hiệu quả. Tuy nhiên, có sự thay đổi lớn trong hiệu suất lọc khí, và nước ngưng tụ bị ô nhiễm có khả năng đi qua một số bộ lọc dưới áp lực đặc hiệu gặp phải trong quá trình thông khí cơ học.
Khi khí quản của bệnh nhân được đặt nội khí quản hoặc thiết bị đường thở trên thanh môn (supraglottic airway device) được đặt, thì các chức năng làm ấm, làm ẩm và lọc của đường hô hấp trên bình thường sẽ bị bỏ qua. Do đó, khí cung cấp cho bệnh nhân cần phải được điều hòa nhân tạo để thay thế các chức năng bị mất này [1]. Bộ trao đổi nhiệt và độ ẩm (HME) nhằm bảo tồn một phần nhiệt độ và hơi thở thở ra của bệnh nhân và điều hòa khí hít vào bằng cách làm ấm và làm ẩm nó [2]. Các bộ lọc hệ thống dây máy thở được thiết kế để giảm sự lây truyền vi khuẩn và các vật chất khác trong hệ thống dây máy thở [3].
Có năm loại thiết bị [1]. Đó là:
- Bộ trao đổi nhiệt và độ ẩm không có bộ lọc (HME)
- Chỉ là bộ lọc tĩnh điện (electrostatic filter)
- Chỉ là bộ lọc xếp li (pleated filter)
- Bộ lọc tĩnh điện với HME
- Bộ lọc xếp li với HME.
Các thiết bị chứa cả bộ lọc và HME được gọi là bộ lọc trao đổi nhiệt và độ ẩm (HMEF, heat- and moisture-exchanging filters). Các thuật ngữ ‘tĩnh điện’ và ‘xếp li’ được sử dụng để phân biệt hai loại bộ lọc phổ biến, thì không đúng hẳn, vì cả hai loại đều phụ thuộc vào mức độ điện tích để giữ các hạt trong vật liệu lọc, và cả hai loại vật liệu đều có thể được xếp li. Sự khác biệt chính giữa hai loại là mật độ của các sợi. Đối với vật liệu lọc ‘tĩnh điện’, mật độ của sợi tương đối thấp và tích điện trên các sợi là cao (hoặc là fibrillated, hoặc là triboelectric-charged [1]).
Đối với các bộ lọc ‘xếp li’, mật độ của sợi cao: điều này làm tăng sức đề kháng với lưu lượng khí; xếp li vật liệu làm tăng diện tích bề mặt và do đó làm giảm sức đề kháng. Loại bộ lọc này cũng được gọi là “kị nước” – “hydrophobic” (như bề mặt của vật liệu lọc đẩy nước) hoặc “cơ khí” – “mechanical”. Đối với đánh giá này, các thuật ngữ ‘tĩnh điện’ và ‘xếp li’ sẽ được sử dụng để phân biệt hai loại bộ lọc.
2. Bộ trao đổi nhiệt và độ ẩm (heat and moisture exchangers)
2.1 Phát triển mang tính lịch sử
Bộ trao đổi nhiệt và độ ẩm bắt đầu sử dụng trong những năm 1950 sau khi đưa vào thủ thuật mở khí quản để tạo điều kiện thông khí cơ học của phổi. Trong báo cáo của ông về dịch bệnh bại liệt ở Đan Mạch năm 1952, Lassen nói rằng, khi sử dụng kỹ thuật thông khí nhân tạo và thông khí áp lực dương, “một máy làm ẩm tốt là điều cần thiết: nếu không thì sự cô đặc dịch tiết có thể xảy ra” [4]. Drägerwerk [5], Wally [6] và Koch et al. [7] tất cả đã mô tả các thiết bị tương tự ngay sau báo cáo của Lassen để cung cấp một phương tiện thụ động làm ẩm khí hít vào, mặc dù Julius Jeffreys đã mô tả một thiết bị tương tự vào năm 1842 [8]. Những phát triển này và các diễn biến khác được mô tả trong Bảng 1.
Bảng 1. Lịch sử phát triển của bộ trao đổi nhiệt và độ ẩm (HME) và các bộ lọc.
| 1842 Jeffreys mô tả nhu cầu và giải pháp cho vấn đề làm ẩm khí [8] và mô tả “Respirator” bao gồm các lớp dây kim loại mịn bọc trong da. Các lớp dây kim loại được cách ly nhiệt với nhau để tăng gradient nhiệt độ qua thiết bị, do đó làm tăng hiệu suất duy trì độ ẩm. 1952 Lassen mô tả các kỹ thuật được sử dụng để thông khí nhân tạo ở bệnh nhân trong bệnh dịch bại liệt năm 1952 tại Copenhagen (thở máy và thở áp lực dương) và lưu ý rằng “máy tạo độ ẩm tốt là điều cần thiết: nếu không thì sự cô đặc dịch tiết có thể xảy ra’ [4] 1953 Marshall và Spalding mô tả máy tạo độ ẩm và ấm hoạt động đầu tiên [9] 1954 Drägerwerk cấp bằng sáng chế thiết bị trao đổi nhiệt và độ ẩm thụ động [5] 1956 Walley mô tả một máy tạo độ ẩm thụ động dành cho bệnh nhân thở qua ống nội khí quản [6] bao gồm một hình trụ ‘Perspex’, như lớp cách điện, chứa một cuộn gạc đồng mạ bạc 1960 Lo ngại về sự ra đời của vi khuẩn trong không khí vào máy thở được sử dụng ở trẻ sơ sinh, Sykes mô tả bằng cách sử dụng một miếng bông để lọc khí [10] 1963 Bishop mô tả bộ lọc ‘Hộp găng tay’ được thiết kế để sử dụng trên đầu vào của máy thở có chứa phần tử lọc bao gồm giấy thủy tinh có nếp gấp có lớp mô bằng thủy tinh. Bộ lọc có thể được khử trùng sau khi sử dụng [11] 1963 Mapleson mô tả Garthur HME bao gồm 10 gạc dây niken hình tròn, đường kính 5 cm, được kẹp lại với nhau như một đơn vị dùng để sử dụng giữa bệnh nhân và hệ thống dây máy thở [12]. Các gạc được cách ly nhiệt với nhau. Thiết bị này được đặt trong một thùng hợp kim nhôm, từ đó nó có thể được loại bỏ để làm sạch hoặc thay thế 1967 Hellewell mô tả việc sử dụng các bộ lọc Williams trên các cổng hít vào và thở ra của máy thở bao gồm giấy thủy tinh bịt kín trong một vỏ bằng thép không gỉ bằng cao su silicon [13]. Bộ lọc chịu được nhiệt độ lên đến 260°C và có thể được khử trùng bằng ethylene oxide, hơi formaldehyde hoặc bằng hấp tiệt trùng 1972 Spence và Melville đã mô tả một máy tạo độ ẩm mới hoạt động với một dây nóng để ngăn chặn sự ngưng tụ trong ống cung cấp, trở thành máy tạo độ ẩm Fisher và Paykel [14] 1973 Mitchell và Gamble mô tả một phương pháp để đảm bảo rằng bề mặt lọc là kị nước để ngăn chặn các vấn đề với sự gia tăng sức đề kháng với dòng khí của các bộ lọc gây ra bởi nước xâm nhập [15] 1976 Nguyên mẫu bộ lọc dùng một lần được mô tả bởi Lumley và được sản xuất bởi Pall Medical [16] 1976 HME dùng một lần mô tả bao gồm một cuộn giấy gợn sóng chứa trong vỏ nhựa. HME này có hai cấu hình: một có đầu nối 15 mm ở mỗi đầu để nối giữa ống nội khí quản và đầu nối Y của hệ thống thở [17], đầu kia có đầu nối 15 mm để gắn vào ống mở khí quản [18] 1979 Siemens Servo 150 HME với muối hút ẩm được bổ sung để cải thiện độ ẩm ‐ bảo tồn hiệu suất [19] 1984 Chalon mô tả việc sử dụng một bộ lọc kỵ nước xếp li giữa bệnh nhân và hệ thống dây máy thở để làm ẩm và lọc khí được cung cấp cho bệnh nhân trong khi gây mê [20] 1987 Gallagher mô tả việc sử dụng một bộ lọc kỵ nước xếp li giữa bệnh nhân và hệ thống dây máy thở để làm ẩm và lọc khí cung cấp cho bệnh nhân trong chăm sóc đặc biệt [21] 1990 Bộ lọc được mô tả sử dụng vật liệu lọc tĩnh điện và một lớp HME để cung cấp cả lọc và làm ẩm [22] 1992 Một bộ lọc được mô tả kết hợp cả một bộ lọc kỵ nước xếp li và một lớp HME để cung cấp cả lọc và làm ẩm [23] |
2.2 Mức độ ẩm khi thở bình thường
Khi khí hít vào được làm ấm, ẩm và cung cấp cho bệnh nhân, nhiệt độ và độ ẩm của khí phải gần với mức tìm thấy trong đường thở của bệnh nhân trong khi thở bình thường. Ví dụ, nếu khí quản của bệnh nhân được đặt nội khí quản, khí được cung cấp ở cuối ống nội khí quản phải có cùng nhiệt độ và độ ẩm như không khí hít vào khi thở bình thường ở mức đó.
Cole đo nhiệt độ và độ ẩm của không khí hít vào trong khi thở bình thường và tăng thông khí (thông khí từ 7–42 L/phút) và nhận thấy nhiệt độ và độ ẩm ở vùng họng là 32–34°C với độ ẩm 32 mg/L [24]. Trong công việc tiếp theo, ông đã chứng minh rằng nhiệt độ không khí trong họng hầu như thay đổi từ 31 đến 37°C trong một loạt các điều kiện không khí hít vào từ “bắc cực” sang “nhiệt đới” [25]. Độ ẩm tương đối luôn gần 100% (độ ẩm của không khí bão hòa hoàn toàn với hơi nước ở nhiệt độ 31°C là 32 mg/L).
Ingelstedt đo nhiệt độ và độ ẩm của không khí được hít vào và thở ra bằng cách chọc dò màng giáp nhẫn và đặt một cảm biến trong vùng dưới thanh môn [26]. Trong lúc thở mũi, nhiệt độ tối thiểu trong thì hít vào và độ ẩm hít vào là 32,3°C và 35 mg/L, tương ứng; trong khi thở bằng miệng, nhiệt độ tối thiểu trong hít vào và độ ẩm hít vào là 30,5°C và 29 mg/L, tương ứng. Sau đó, Déry et al. cũng đo nhiệt độ và độ ẩm của khí hít vào ở người gây mê và tìm thấy nhiệt độ trung bình và độ ẩm tương đối là 30,8°C và 85,8%, tương ứng ngay dưới carina [27], tương đương với độ ẩm 27,3 mg/L.
Dựa trên những nghiên cứu, Chamney khuyến cáo rằng khí được cung cấp cho những bệnh nhân có đường hô hấp trên đã được nối tắt nên được làm ấm đến ít nhất 30°C và được làm ẩm đến ít nhất 30 mg/L [28].
Một số HME và HMEF (nhưng không phải sản phẩm chỉ là lọc khí) có thể cung cấp đầu ra độ ẩm từ 30 mg/L trở lên [29-34].
2.3 Các mối nguy hiểm do độ ẩm không đủ
Khi đường hô hấp trên bị nối tắt và khí có độ ẩm không đủ được đưa trực tiếp vào khí quản, tổn thương có thể xảy ra với lớp lót khí quản. Đặc biệt, độ ẩm không đầy đủ có thể gây ra rối loạn chức năng nhày-lông chuyển (mucociliary), trong đó ảnh hưởng lớp lót lông chuyển hô hấp và chức năng di chuyển chất lỏng và chất nhầy về phía thanh quản.
Williams et al. mô tả một loạt các rối loạn chức năng có thể xảy ra trong đường hô hấp nếu độ ẩm và nhiệt độ của khí được đưa đến bệnh nhân không phải là tối ưu [35]. Đó là (theo thứ tự mức độ nghiêm trọng của rối loạn chức năng):
1. Không có rối loạn chức năng rõ ràng, nhưng khí hít vào có nhiệt độ và độ ẩm thấp hơn nhiệt độ cơ thể và áp suất bão hòa (BTPS) (tức là 37°C và 44 mg/L)
2. Chất nhờn đặc, gây chậm vận chuyển nhày-lông chuyển
3. Vận chuyển nhày-lông chuyển dừng lại
4. Cilia ngừng đập
5. Tổn thương tế bào
6. Giảm độ giãn nở và dung tích cặn chức năng của phổi, xẹp phổi, và shunt.
Williams et al. sử dụng số liệu từ 17 nghiên cứu được công bố, điều tra ảnh hưởng của các mức độ ẩm khác nhau lên đường hô hấp để thiết lập một mô hình rối loạn chức năng về độ ẩm (sự khác biệt giữa mức độ ẩm và điều kiện BTPS). Mức độ ẩm tối ưu được xác định bởi Williams et al. là điều kiện BTPS, điều kiện này không thiếu độ ẩm. Tuy nhiên, từ mô hình, không có bằng chứng cho thấy rối loạn chức năng quan trọng về mặt lâm sàng sẽ xảy ra nếu thiếu độ ẩm vào khoảng −11 mg/L, do đó độ ẩm hít vào tối thiểu có thể chấp nhận được khoảng 33 mg/L. Hơn nữa, chỉ có hai trong số 17 nghiên cứu trên con người; 15 nghiên cứu còn lại được tiến hành trên nhiều loài động vật có vú khác nhau (chuột, thỏ, chó, lợn và lợn guinea).
Ấn bản đầu tiên của tiêu chuẩn quốc tế về độ ẩm cho sử dụng trong y tế đã được xuất bản năm 1988 [36]. Nó cho biết độ ẩm tối thiểu cần thiết để ngăn ngừa sự cô đặc dịch tiết (đặc lại do mất nước) ở bệnh nhân có đường hô hấp trên bị nối tắt là 30 mg/L, tương đương với mức thâm hụt độ ẩm là −14 mg/L. Trong lần xuất bản thứ hai (xuất bản năm 1997) và thứ ba (xuất bản năm 2007), điều này đã tăng lên 33 mg/L, mặc dù không có lý do gì ngoài việc nói rằng “đường hô hấp trên cung cấp 75% nhiệt và độ ẩm cung cấp cho phế nang” và “máy tạo ẩm và ấm cần cung cấp nhiệt và độ ẩm còn thiếu” [37].
2.4 Yêu cầu độ ẩm trong gây mê
Trong khi gây mê, so với chăm sóc đặc biệt, thời gian của nối tắt của đường hô hấp trên thì ngắn hơn nhiều. Mô hình độ ẩm và độ phơi nhiễm độ ẩm của Williams và cộng sự về sự rối loạn chức năng đường hô hấp [35] cho thấy mức độ ẩm thấp hơn có thể được dung nạp trong một thời gian ngắn mà không gây rối loạn chức năng. Kleemann đề xuất mức tối thiểu là 20 mg/L [38], đủ để ngăn chặn tổn thương biểu mô khí phế quản trong 10 giờ thở máy.
Mức độ ẩm này có thể được cung cấp trong khi gây mê khi sử dụng hệ thống thở vòng tròn (circle breathing system); phản ứng của carbon dioxide thải ra với chất hấp thụ carbon dioxide (ví dụ vôi soda) tạo ra hơi nước có thể làm ẩm đầy đủ các khí hít vào, đặc biệt là nếu dòng khí tươi (fresh gas flows) thấp được sử dụng [38-41]. Do đó, việc sử dụng thêm HME trong tình huống này có lẽ không bắt buộc. Tuy nhiên, việc sử dụng bộ lọc tại cổng kết nối bệnh nhân, để bảo vệ hệ thống dây máy thở và bệnh nhân, vẫn có thể làm giảm sự mất độ ẩm của bệnh nhân và do đó tăng độ ẩm của khí cho bệnh nhân, ngay cả khi bộ lọc có cung lượng tạo độ ẩm thấp [42].
3. Bộ lọc hệ thống máy thở (Breathing system filters)
3.1 Phát triển mang tính lịch sử
Các bộ lọc đã sử dụng đầu tiên để loại bỏ vi khuẩn từ khí cung cấp cho bệnh nhân vào đầu những năm 1960. Tuy nhiên, sớm hơn nhiều, vào năm 1873, Skinner đã phản đối nguyên tắc thở thông qua bộ máy mà những người khác đã sử dụng [43]. Năm 1952, Joseph báo cáo trường hợp lây nhiễm chéo viêm amiđan được coi là phát sinh từ sự lan truyền qua không khí từ các túi dự trữ (reservoir bags) bị ô nhiễm [44]. Williams et al. mô tả cái chết của năm bệnh nhân trong một khoa năm 1960, có khả năng đã xảy ra vì lây nhiễm qua không khí do Pseudomonas pyocyanea [45].
Bishop et al. mô tả một trường hợp bệnh nhân nhiễm P. pyocyanea và sau đó chết [46]. Bệnh nhân đã nhận được thông khí cơ học sau phẫu thuật của phổi. Hệ thống dây máy thở của máy thở sau đó được phát hiện là bị ô nhiễm nặng nề với vi khuẩn. Bishop sau đó mô tả việc sử dụng một bộ lọc được đặt trên cổng vào máy thở của không khí để ngăn chặn bất kỳ vi khuẩn nào ở không khí trong phòng bị cuốn vào và được đưa vào bệnh nhân (vị trí 2 trong Hình 1) [11].
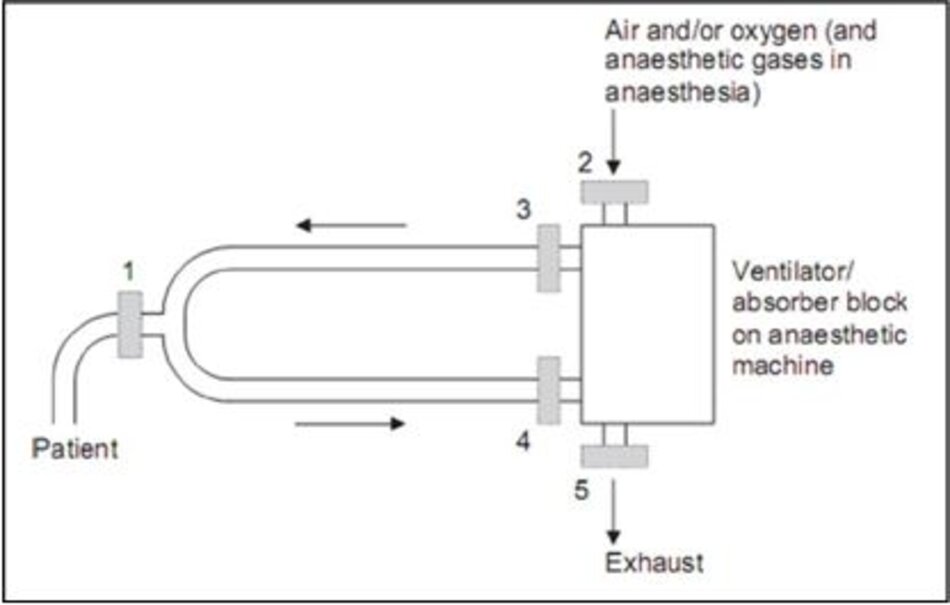
Tầm quan trọng của công việc này được nhấn mạnh bởi các báo cáo về tử vong do nhiễm chéo. Ví dụ, Phillips và Spencer mô tả cách tất cả tám bệnh nhân nhận được thông khí cơ học cho đợt cấp của bệnh phổi mãn ở một khoa bị nhiễm P. aeruginosa, với hai bệnh nhân tử vong [47].
Những phát triển hơn nữa đã thấy sự ra đời của các bộ lọc phù hợp để đặt ở các vị trí 3, 4 và 5 trong Hình 1. Hiệu suất các bộ lọc đầy bị thách thức với sự lây nhiễm vi khuẩn [33, 48-52] và, sau khi công bố tiêu chuẩn cho bộ lọc hệ thống máy thở [3], bởi các hạt natri clorua có kích thước hạt thâm nhập lớn nhất đối với vật liệu lọc [31, 53].
Phương pháp này dựa trên đó để thử nghiệm các thiết bị bảo vệ hô hấp [54]. Nói chung, hiệu suất lọc của bộ lọc xếp li vượt trội so với bộ lọc tĩnh điện (Hình 2).
![Hình 2 Sự thâm nhập thông qua các bộ lọc chống lại việc giảm áp lực. Dữ liệu được lấy từ [31]. Thâm nhập và giảm áp lực được đo tại lưu lượng 15 và 30 L/phút cho các bộ lọc dành cho bệnh nhi và người lớn, tương ứng. Thâm nhập (%) = 100 - hiệu quả lọc (%). Kích thước của mỗi 'bong bóng' có liên quan đến thể tích nội bộ của bộ lọc. N95, N99 và N100 đề cập đến ba loại thiết bị bảo vệ hô hấp khi được thử với natri clorua [54]: N95, tốt hơn hiệu suất lọc 95% (<5% độ thâm nhập); N99, hiệu quả tốt hơn 99% (<1% thâm nhập); N100 tốt hơn hiệu suất 99,97% (thâm nhập<0,03%). bộ lọc tĩnh điện dành cho người lớn; bộ lọc tĩnh điện nhi; bộ lọc xếp li cho người lớn; bộ lọc xếp li trẻ em. Tất cả các bộ lọc xếp li ít nhất là N99, không có bộ lọc tĩnh điện nào là N100, một số bộ lọc tĩnh điện không phải là N95.](https://www.healcentral.org/wp-content/uploads/2021/02/b12_anh_2.jpg)
3.2 Ảnh hưởng của các bộ lọc đến tỷ lệ lây nhiễm chéo
Tuy nhiên, vào năm 1981, hai nghiên cứu đã được công bố điều tra hiệu quả của việc sử dụng các bộ lọc về tỷ lệ viêm phổi ở những bệnh nhân trải qua gây mê [55, 56]. Garibaldi et al. [55] so sánh việc sử dụng một hệ thống thở dùng một lần được sử dụng với các bộ lọc gắn vào cả cổng hít vào và các cổng thở ra của hộp hấp thụ, với hệ thống thở dùng một lần mà không có bất kỳ bộ lọc nào. Mặc dù không thấy khác biệt, có thể giả định rằng mỗi hệ thống thở một lần chỉ được sử dụng cho một bệnh nhân.
Feeley et al. [56] so sánh việc sử dụng một hệ thống thở vô trùng dùng một lần với một bộ lọc “được đặt trên phần gần của nhánh hít vào” với hệ thống thở cao su tái sử dụng mà không có bộ lọc. Trong cả hai nghiên cứu, tỷ lệ mắc bệnh viêm phổi tương tự nhau ở cả nhóm lọc và nhóm không lọc.
Một bài bình luận đi kèm kết luận rằng việc sử dụng các bộ lọc nên được dừng lại cho đến khi có bằng chứng để đưa ra kết luận của cả hai nghiên cứu [57]. Tuy nhiên, không nghiên cứu nào nhận xét về các kỹ thuật tái sử dụng cho phần còn lại của hệ thống vòng tròn, bao gồm cả bộ phận hấp thụ và thông khí hoặc bất kỳ sự nhiễm bẩn nào được tìm thấy trong các vật phẩm này. Ngoài ra, không nghiên cứu nào giải quyết vấn đề đặt bộ lọc tại cổng kết nối bệnh nhân.
Kỹ thuật này lần đầu tiên được mô tả bởi Chalon et al. vào năm 1984 [20] sử dụng một bộ lọc đặt giữa bệnh nhân và hệ thống dây máy thở (vị trí 1, hình 1). Điều này hoạt động như một bộ lọc (bảo vệ bệnh nhân khỏi bất kỳ sự nhiễm bẩn nào trong hệ thống dây máy thở và bảo vệ hệ hô hấp của bệnh nhân) và HME.
Ba phương pháp sau đó đã được sử dụng phổ biến:
- một hệ thống dây máy thở sử dụng duy nhất được sử dụng cho nhiều bệnh nhân được bảo vệ bởi bộ lọc hệ thống dây máy thở; hoặc
- hệ thống dây máy thở được xử lý sau mỗi bệnh nhân; hoặc
- một hệ thống dây máy thở tái sử dụng đã được tái xử lý trước khi được sử dụng cho bệnh nhân tiếp theo.
Phương pháp đầu tiên trở nên phổ biến ở các vùng của châu Âu mặc dù không phải ở Mỹ [58]. Tuy nhiên, các biện pháp phòng ngừa này không được theo dõi phổ biến, và các hệ thống dây máy thở không có bộ lọc được sử dụng trên nhiều bệnh nhân mà không cần tái chế. Chant et al. mô tả một loạt các trường hợp nhiễm chéo với viêm gan C xảy ra trong một danh sách phẫu thuật vào năm 1993 [59] khi kỹ thuật này được sử dụng. Điều này củng cố khuyến nghị sử dụng bộ lọc nếu hệ thống dây máy thở được sử dụng cho nhiều bệnh nhân mà không được tái xử lý [60]. Một trường hợp thứ hai, bệnh nhân có nhiễm chéo với viêm gan C cũng đã được báo cáo [61].
Việc bổ sung một bộ lọc tại cổng kết nối bệnh nhân đã được chứng minh là ngăn ngừa sự nhiễm bẩn của hệ thống dây máy thở [62-65] và bộ lọc làm giảm nồng độ vi khuẩn lây nhiễm qua không khí khi được thử nghiệm in vitro [33, 48-52]. Tuy nhiên, gần đây sử dụng kỹ thuật phát quang sinh học (bioluminescence technique) đã chứng minh rằng sự bẩn hữu cơ của mặt phía bên máy thở của các bộ lọc và hệ thống dây máy thở có thể xảy ra trong khi gây mê [66, 67]. Do đó, giả định rằng hệ thống dây máy thở vẫn không có vi khuẩn khi bộ lọc được sử dụng có thể không phù hợp. Điều này được hỗ trợ bởi một nghiên cứu trong đó mức độ ô nhiễm được đo trong hệ thống dây máy thở được sử dụng cho nhiều bệnh nhân gây mê trong khoảng thời gian 24, 48 hoặc 72 giờ, với bộ lọc tĩnh điện được sử dụng giữa bệnh nhân và hệ thống dây máy thở; ô nhiễm đã được tìm thấy trong 5,6% của các hệ thống dây máy thở sau 72 giờ sử dụng [68]. Ở Anh, thực hành phổ biến là sử dụng hệ thống thở trong tối đa một tuần.
Mặc dù được sử dụng trong gần 50 năm, vẫn không có bằng chứng cho thấy việc sử dụng các bộ lọc làm giảm tỷ lệ nhiễm trùng hậu phẫu; ngược lại, có một số bằng chứng cho thấy nguy cơ mắc các bệnh nhiễm trùng đường hô hấp dưới từ các hệ thống dây máy thở dùng chung mà không sử dụng các bộ lọc là rất thấp. Van Hassel et al. báo cáo tỷ lệ nhiễm trùng đường hô hấp dưới cho bệnh nhân sau gây mê toàn thân hoặc khu vực, nơi hệ thống dây máy thở được làm sạch hàng ngày và tiệt trùng, và bộ lọc chỉ được sử dụng cho bệnh nhân nghi ngờ hoặc nhiễm trùng đường hô hấp quá mức và nhiễm trùng Mycobacterium tuberculosis và virus suy giảm miễn dịch ở người [69]. Mỗi hệ thống dây máy thở sạch và tiệt trùng được sử dụng cho từ ba đến bảy bệnh nhân. Sau 9 năm theo dõi 53.800 bệnh nhân, tỷ lệ nhiễm khuẩn đường hô hấp dưới sau khi gây mê toàn thân hoặc khu vực chỉ là 0,1 và 0,2%, tương ứng, sử dụng quy trình này và bệnh nhân không được gộp lại.
Tuy nhiên, đối với nghiên cứu quan sát lớn này, hai kỹ thuật gây mê đã được sử dụng: một hệ thống nửa kín và một hệ thống mở. Dòng khí được sử dụng lần lượt là 3 và 6–9 lít/phút. Kỹ thuật lưu lượng khí tươi thấp không được sử dụng. Khi sử dụng một kỹ thuật như vậy, việc đưa vào dòng khí tươi khô lưu lượng thấp vào hệ thống dây máy thở là không đủ để ngăn sự ngưng tụ xảy ra. Nước được tạo ra từ phản ứng của khí carbon dioxide từ thở ra và chất hấp thụ carbon dioxide. Ngưng tụ đặt ra một mối nguy hiểm khác cho bệnh nhân, đặc biệt nếu bộ dây bị nhiễm bẩn.
3.3 Sự lây nhiễm vi sinh vật qua chất lỏng
Các tác giả của báo cáo trường hợp nhiễm chéo viêm gan C cho thấy nhiễm chéo xảy ra khi đờm bệnh nhân nhiễm virus viêm gan C đi vào hệ thống dây máy thở, sau đó hoạt động như một nơi dự trữ vi trùng cho những bệnh nhân còn lại trong danh sách [59]. Do đó, các bộ lọc sẽ ngăn chặn việc lây truyền qua chất lỏng (đờm trong trường hợp này) từ bệnh nhân đến hệ thống dây máy thở [60].
Đổi lại, nếu bất kỳ sự nhiễm bẩn nào xâm nhập vào hệ thống dây máy thở và sự ngưng tụ có mặt, việc vận động hệ thống dây máy thở trong quá trình này có thể làm cho chất lỏng bị ô nhiễm đi vào bộ lọc. Nếu có đủ lượng chất lỏng để bao phủ bề mặt của bộ lọc ở phía máy (phụ thuộc vào hướng của vật liệu lọc [70]), thì nó sẽ gây cản trở việc cung cấp nhịp thở tiếp theo của máy thở. Khi máy thở cố gắng cung cấp hơi thở, áp lực trong hệ thống dây máy thở sẽ tăng trên mức giới hạn cài đặt và báo động sẽ xảy ra, cảnh báo cho người gây mê có tắc nghẽn xảy ra. Thông thường, giới hạn áp suất cao là 30-40 cmH2O. Do đó, bộ lọc sẽ có thể chịu được mức áp suất đó mà không cho phép lây nhiễm qua chất lỏng. Để đảm bảo an toàn, hướng dẫn mới đây do Hội Gây mê và ICU Đức đề xuất sử dụng bộ lọc có thể chịu được áp lực 60 hectopascals (khoảng 60 cmH 2O) hoặc 20 hectopascals trên áp lực thông khí tối đa trong hệ thống dây máy thở [71].
Áp suất cần thiết để ép chất lỏng thông qua các bộ lọc tĩnh điện thấp hơn mức này [49-51, 70, 72, 73]. Bất kỳ vi khuẩn nào có trong chất lỏng cũng sẽ đi qua bộ lọc [49-51, 73], có khả năng gây ô nhiễm và lây nhiễm chéo. Ngược lại, các bộ lọc xếp li thường ngăn chặn sự đi qua của nước và bất kỳ vi khuẩn nào có thể chứa trong nước đó, và loại bộ lọc này có thể chịu được áp suất lên trên mức này.
Do đó, đối với các hệ thống thở vòng tròn với lưu lượng khí tươi thấp, không nên sử dụng các bộ lọc tĩnh điện vì có nguy cơ cho đi qua chất lỏng bị ô nhiễm từ hệ thống dây máy thở trực tiếp vào đường hô hấp của bệnh nhân.
Ngược lại, trong chăm sóc đặc biệt, việc sử dụng HME và bộ lọc ở vị trí 1 (Hình 1) giữ cho hệ thống dây máy thở khô. Điều này rất quan trọng vì bộ dây máy thở sẽ nhanh chóng bị vi khuẩn xâm chiếm: Craven et al. đã chứng minh rằng 33% bộ dây máy thở đã bị xâm nhiễm vi khuẩn (colonization) sau 2 giờ, 67% sau 12 giờ và 80% sau 24 giờ [74]. Chất ngưng tụ bị ô nhiễm trong bộ dây máy thở là yếu tố nguy cơ đã biết cho nhiễm chéo và phát triển viêm phổi [75].
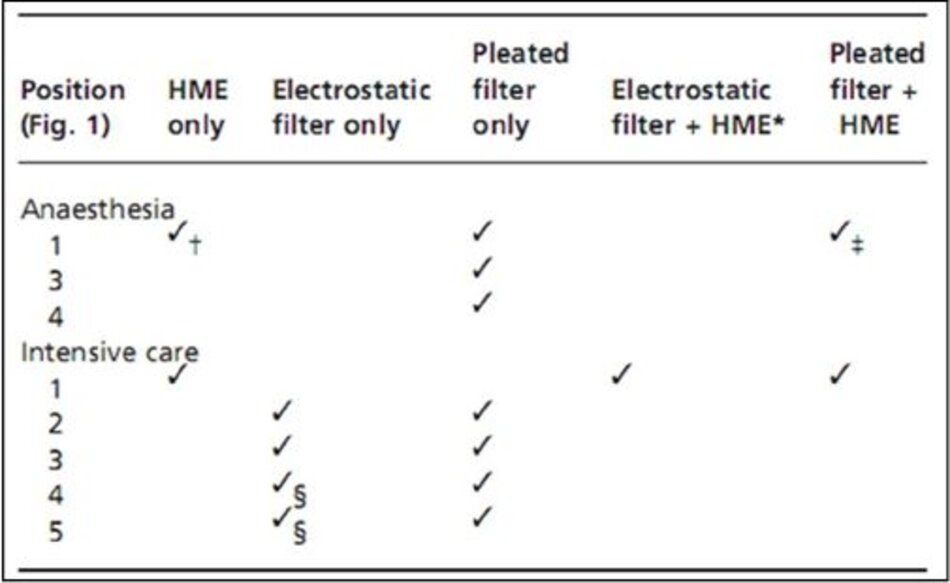
Một đề xuất cho các vị trí mà các loại thiết bị khác nhau có thể được sử dụng trong các hệ thống dây máy thở được đưa ra trong Bảng 2.
Bảng 2. Các vị trí thích hợp của các loại thiết bị khác nhau.
3.4 Hiệu suất làm ẩm của HME và bộ lọc trong chăm sóc đặc biệt
Đối với hệ thống thông khí cơ học dài hạn, khi các đường hô hấp trên bị bỏ qua, mức độ ẩm tối thiểu cần thiết là khoảng 30 mg/L để tránh sự cô đặc của các chất tiết [28, 36]. Tầm quan trọng của việc lựa chọn một phương pháp làm ẩm thích hợp đã được chứng minh khi các bộ lọc đầu tiên bắt đầu được sử dụng làm phương tiện duy nhất để làm ẩm khí hít vào. Gallagher et al.
tuyên bố rằng một bộ lọc hệ thống dây máy thở đặc biệt, Pall BB50T, có thể được sử dụng làm phương pháp duy nhất làm ẩm ở những bệnh nhân được thông khí lâu dài sau khi tiến hành một nghiên cứu trên 28 bệnh nhân thở máy trong tối đa 22 ngày [21]. Tuy nhiên, trong một bình luận về nghiên cứu này, Turner và Wright đã báo cáo một bệnh nhân trong đó ống nội khí quản đã bị tắc một phần bằng chất dịch khô khi bộ lọc này được sử dụng làm phương tiện duy nhất để làm ẩm [76].
Hơn nữa, trong một loạt trường hợp của 170 bệnh nhân mà độ ẩm đã được cung cấp một lần chỉ bởi bộ lọc này, ống nội khí quản của 15 bệnh nhân đã bị tắc nghẽn với chất tiết [77]. 81 bệnh nhân tiếp theo nhận được độ ẩm từ máy tạo độ ẩm ấm, và chỉ xảy ra một ca tắc ống nội khí quản. Nó đã được ghi nhận rằng hầu hết các tắc ống nội khí quản xảy ra ở những bệnh nhân nhận được thông khí lớn hơn 10 lít/phút. Tuy nhiên, kết luận của nghiên cứu này là yếu, đặc biệt vì nó không phải là một thử nghiệm có kiểm soát, trong đó bệnh nhân được phân bổ ngẫu nhiên [78].

Martin et al. so sánh bộ lọc Pall với máy làm ẩm và ấm, nhưng nghiên cứu đã kết thúc sớm hơn dự kiến khi bệnh nhân trong nhóm lọc Pall qua đời vì ống nội khí quản bị tắc hoàn toàn bởi chất tiết [79]. Misset et al. cũng so sánh bộ lọc Pall với máy tạo độ ẩm trong thử nghiệm ngẫu nhiên có đối chứng và báo cáo tỷ lệ tắc ống nội khí quản cao hơn trong nhóm lọc mặc dù điều này không có ý nghĩa thống kê (4 ca (13%) so với 2 ca (8%)) [80] ; tuy nhiên, một nghiên cứu tương tự của Roustan et al.
tìm thấy tỷ lệ tắc nghẽn ống nội khí quản lớn hơn đáng kể trong nhóm lọc so với nhóm dùng máy tạo độ ẩm (9/55 so với 0/61): ba trong số 9 trường hợp tắc nghẽn là gây tắc nghẽn hoàn toàn dẫn đến ngạt cấp tính [81]. Sottiaux, bình luận về nghiên cứu của Misset và cộng sự, cũng đã ngừng nghiên cứu so sánh bộ lọc Pall với các bộ lọc khác sớm hơn kế hoạch sau khi một số ống nội khí quản bị tắc trong nhóm lọc Pall [82]. Chỉ có hai ca tắc ống nội khí quản xảy ra trong nghiên cứu của Sidhu et al.
[83] khi 35 bệnh nhân nhận được độ ẩm từ bộ lọc Pall trong hơn 10 ngày; tuy nhiên, trong nghiên cứu này, việc nhỏ nước muối và hút qua nội khí quản thường xuyên (ít nhất 4 giờ) được thực hiện và nước muối được phun khí dung nếu các chất tiết bị đặc. Villafane et al. so sánh việc giảm đường kính trong của ống nội khí quản do tắc bởi chất tiết ở những bệnh nhân nhận được độ ẩm từ ba thiết bị khác nhau: bộ lọc Pall; DAR Hygrobac; và máy tạo độ ẩm Fisher và Paykel [84]. Bốn tắc nghẽn hoàn toàn đã xảy ra, ba ở bệnh nhân với bộ lọc Pall và một với máy tạo độ ẩm Fisher và Paykel.
Cung lượng độ ẩm của bộ lọc Pall đặc biệt này (các thiết bị lọc khác từ Pall có độ ẩm lớn hơn) được đo trong phòng thí nghiệm bởi nhiều nhóm: cung lượng độ ẩm tương ứng là 21,1, 21,2 và 20,9 mg/L trong ba nghiên cứu [32, 34, 85]. Mebius cũng đo hiệu suất của thiết bị này và cho giá trị hiệu quả khoảng 54% (đọc từ đồ thị) ở 34°C [33]. Ông cho rằng độ ẩm 37,5 mg/L đối với không khí bão hòa hoàn toàn với hơi nước ở 34°C.
Điều này ngụ ý rằng đầu ra độ ẩm là 0,54 × 37,5 = 20,25 mg/L, phù hợp với các nghiên cứu khác. Có nguy cơ bị tắc ống nội khí quản nhiều hơn do chất tiết khi sử dụng thông khí phút cao hơn [77, 79].
Ở thể tích khí lưu thông thấp hơn, độ ẩm của bộ lọc Pall lớn hơn. Ví dụ, cung lượng độ ẩm 26,5 mg/L với thể tích khí lưu thông 0,5 lít cho thiết bị này [85]. Điều này là phổ biến đối với tất cả các thiết bị được thử nghiệm, mặc dù việc giảm cung lượng độ ẩm khi tăng thể tích khí lưu thông rỏ rệt hơn đối với một số thiết bị so với các thiết bị khác.
Tuy nhiên, việc tăng thể tích khí lưu thông ngày càng hiếm khi được thực hiện trong chăm sóc đặc biệt, và do đó việc giảm độ ẩm của các HME và các bộ lọc khi thể tích khí lưu thông tăng lên có lẽ không còn phù hợp nữa.
Hơn nữa, các nghiên cứu tiếp theo so sánh hiệu suất của HME và bộ lọc với máy làm ẩm và ấm, trong đó HME hoặc bộ lọc có độ ẩm được đoở phòng thí nghiệm trên 30 mg/L, đã không chứng minh bất kỳ sự gia tăng bệnh suất hoặc tử vong nào do việc sử dụng các thiết bị cụ thể [86-88]. Hơn nữa, không có bằng chứng cho thấy rằng việc tăng độ ẩm của thiết bị lên hơn 30 mg/L có bất kỳ tác dụng có lợi nào đối với kết quả bệnh nhân.
4. Kết luận
Yêu cầu độ ẩm cho bệnh nhân có đường hô hấp trên bị nối tắt khác nhau tùy thuộc vào việc nối tắt xảy ra trong gây mê hoặc chăm sóc đặc biệt, như rối loạn chức năng của bộ nhày-lông chuyển phụ thuộc vào thời gian tiếp xúc với độ ẩm không đủ. Đối với chăm sóc đặc biệt, độ ẩm tối thiểu mục tiêu là 30 mg/L.
Để gây mê, độ ẩm tối thiểu mục tiêu thích hợp là 20 mg/L. Hệ thống thở vòng tròn sử dụng kỹ thuật dòng chảy thấp có thể cung cấp 20 mg/L hơi nước. Việc sử dụng HME bổ sung có thể không cần thiết trong tình huống này, mặc dù các bộ lọc kỵ nước sẽ vẫn làm tăng độ ẩm được cung cấp bởi hệ thống dây máy thở vòng tròn nếu chúng được sử dụng để bảo vệ hệ thống dây máy thở. Hệ thống thở vòng có thể chứa ngưng tụ: chất lỏng này có thể đi qua các bộ lọc tĩnh điện mật độ thấp dưới áp lực thường gặp trong gây mê, do đó không thể sử dụng bộ lọc tĩnh điện với hệ thống thở vòng tròn.
5. References
1 Wilkes AR. Breathing filters, humidifiers and nebulizers. In: Davey AJ, Diba A, eds. Ward’s Anaesthetic Equipment, 5th edn. London: WB Saunders, 2005: 291–303.
2 British Standards Institution. Anaesthetic and Respiratory Equipment – Heat and Moisture Exchangers (HMEs) for Humidifying Respired Gases in Humans – Part 1: HMEs for Use with Minimum Tidal Volumes of 250 ml (BS EN ISO 9360‐1:2009). London: British Standards Institution, 2009.
3 British Standards Institution. Breathing System Filters for Anaesthetic and Respiratory Use – Part 1: Salt Test Method to Assess Filtration Performance (BS EN ISO 23328‐1:2008).
London: British Standards Institution, 2008.
4 Lassen HCA. A preliminary report on the 1952 epidemic of poliomyelitis in Copenhagen with special reference to the treatment of acute respiratory insufficiency. Lancet 1953; i: 37–41.
5 Drägerwerk Lübeck. Deutsches Patentamt Patentschrift 1 169 615. Lübeck: Drägerwerk, 27 August, 1954.
6 Walley RV. Humidifier for use with tracheotomy and positive‐pressure respiration. Lancet 1956; 26: 781–2.
7 Koch H, Allander C, Ingelstedt S, Toremalm NG. A method for humidifying inspired air in posttracheotomy care. Annals of Otology, Rhinology and Laryngology 1958; 67: 991–1000.
8 Jeffreys J. On artificial climates for the restoration and preservation of health. London Medical Gazette 1842; 30: 285–92.
9 Marshall J, Spalding JMK. Humidification in positive‐pressure respiration for bulbospinal paralysis. Lancet 1953; ii: 1022–4.
10 Sykes MK. Intermittent positive pressure respiration. Anaesthesia 1960; 15: 401–10.
11 Bishop C, Roper WAG, Williams SR. The use of an absolute filter to sterilize the inspiratory air during intermittent positive pressure ventilation. British Journal of Anaesthesia 1963; 35: 32–4.
12 Mapleson WW, Morgan JG, Hillard EK. Assessment of condenser‐humidifiers with special reference to a multiple‐gauze model. British Medical Journal 1963; 1: 300–5.
13 Hellewell J, Jeanes AL, Watkin RR, Gibbs FJ. The Williams bacterial filter. Anaesthesia 1967; 22: 497–503.
14 Spence M, Melville AW. A new humidifier. Anesthesiology 1972; 36: 89–93.
15 Mitchell NJ, Gamble DR. Evaluation of the new “Williams” anaesthetic filter. British Medical Journal 1973; ii: 6534.
16 Lumley J, Holdcroft A, Gaya H, Darlow HM, Adams DJ. Expiratory bacterial filters. Lancet 1976; ii: 22–3.
17 Steward DJ. A disposable condenser humidifier for use during anaesthesia. Canadian Anaesthetists Society Journal 1976; 23: 191–5.
18 Walker AKY, Bethune DW. A comparative study of condenser humidifiers. Anaesthesia 1976; 31: 1086–93.
19 Gedeon A, Mebius C. The hygroscopic condenser humidifier. Anaesthesia 1979; 34: 1043–7.
20 Chalon J, Markham JP, Ali MM, Ramanathan S, Turndorf H. The Pall Ultipor breathing
circuit filter – an efficient heat and moisture exchanger. Anesthesia and Analgesia 1984; 63: 566–70.
21 Gallagher I, Strangeways JEM, Allt‐Graham J. Contamination control in long‐term ventilation.Anaesthesia 1987; 42: 476–81.
22 Bickler PE, Sessler DI. Efficiency of airway heat and moisture exchangers in anaesthetized humans. Anesthesia and Analgesia 1990; 71: 415–8.
23 Jackson C, Webb AR. An evaluation of the heat and moisture exchange performance of four ventilator circuit filters. Intensive Care Medicine 1992; 18: 264–8.
24 Cole P. Some aspects of temperature, moisture and heat relationships in the upper respiratory tract. Journal of Laryngology 1953; 67: 449–56.
25 Cole P. Further observations on the conditioning of respiratory air. Journal of Laryngology1953; 67: 669–81.
26 Ingelstedt S. Studies on the conditioning of air in the respiratory tract. Acta Oto- Laryngologica1956; 131(Suppl.): 1–80.
27 Déry R, Pelletier J, Jacques A, Clavet M, Houde JJ. Humidity in Anaesthesiology III. Heat and moisture patterns in the respiratory tract during anaesthesia with the semi‐closed system.Canadian Anaesthetists Society Journal 1967; 14: 287–98.
28 Chamney AR. Humidification requirements and techniques. Including a review of the performance of equipment in current use. Anaesthesia 1969; 24: 602–17.
29 Lucato JJ, Adams AB, Souza R, Torquato JA, Carvalho CR, Marini JJ. Evaluating humidity recovery efficiency of currently available heat and moisture exchangers: a respiratory system model study. Clinics (Sao Paulo) 2009; 64: 585–90.
30 Lellouche F, Taillé S, Lefrançois F, et al. Humidification performance of 48 passive airway humidifiers: comparison with manufacturer data. Chest 2009; 135: 276–86.
31 Medicines and Healthcare Products Regulatory Agency. Breathing System Filters. An Assessment of 104 Different Breathing System Filters. Evaluation 04005 . London: Medicines and Healthcare products Regulatory Agency, 2004.
32 Branson RD, Davis K Jr. Evaluation of 21 passive humidifiers according to the ISO 9360 standard: moisture output, dead space and flow resistance. Respiratory Care 1996; 41: 736– 43.
33 Mebius C. Heat and moisture exchangers with bacterial filters: a laboratory study. Acta Anaesthesiologica Scandinavica 1992; 36: 572–6.
34 Eckerbom B, Lindholm C‐E. Performance evaluation of six heat and moisture exchangers according to the Draft International Standard (ISO/DIS 9360). Acta Anaesthesiologica Scandinavica1990; 34: 404–9.
35 Williams R, Rankin N, Smith T, Galler D, Seakins P. Relationship between the humidity and temperature of inspired gas and the function of the airway mucosa. Critical Care
Medicine 1996; 24: 1920–9.
36 International Organization for Standardization. Humidifiers for Medical Use – Safety Requirements (ISO 8185:1988). Geneva: International Organization for Standardization, 1988.
37 British Standards Institution. Respiratory Tract Humidifiers for Medical Use – Particular Requirements for Respiratory Humidification Systems (BS EN ISO 8185:2007). London: British Standards Institution, 2007.
38 Kleemann PP. Humidity of anaesthetic gases with respect to low flow anaesthesia.Anaesthesia and Intensive Care 1994; 22: 396–408.
39 Bengtson JP, Sonander H, Stenqvist O. Preservation of humidity and heat of respiratory gases during anaesthesia – a laboratory investigation. Acta Anaesthesiologica
Scandinavica 1987; 31: 127–31.
40 Bengtson JP, Bengtson A, Stenqvist O. The circle system as a humidifier. British Journal of Anaesthesia 1989; 63: 453–7.
41 Bengtson JP, Bengtson A, Sonander H, Stenqvist O. Humidity of the Bain and circle systems reassessed. Anesthesia and Analgesia 1989; 69: 83–6.
42 Wilkes AR. The moisture‐conserving performance of breathing system filters in use with simulated circle anaesthesia breathing systems. Anaesthesia 2004; 59: 271–7.
43 Skinner T. Anaesthesia and inhalers. British Medical Journal 1873; 1: 353–4.
44 Joseph JM. Disease transmission by inefficiently sanitized anesthetizing apparatus. Journal of the American Medical Association 1952; 149: 1196–8.
45 Williams R, Williams ED, Hyams DE. Cross‐infection with pseudomonas pycocyanea. Lancet1960; 1: 376–9.
46 Bishop C, Potts MW, Molloy PJ. A method of sterilization for the Barnet respirator. British Journal of Anaesthesia 1962; 34: 121–3.
47 Phillips I, Spencer G. Pseudomonas aeruginosa cross‐infection. Lancet 1965;ii: 1325–7.
48 Holton J, Webb AR. An evaluation of the microbial retention performance of three ventilator‐ circuit filters. Intensive Care Medicine 1994; 20: 233–7.
49 Lee MG, Ford JL, Hunt PB, Ireland DS, Swanson PW. Bacterial retention properties of heat and moisture exchange filters. British Journal of Anaesthesia 1992; 69: 522–5.
50 Hedley RM, Allt‐Graham J. A comparison of the filtration properties of heat and moisture exchangers. Anaesthesia 1992; 47: 414–20.
51 Vandenbroucke‐Grauls CMJE, Teeuw KB, Ballemans K, Lavooij C, Cornelisse PB, Verhoef J.Bacterial and viral removal efficiency, heat and moisture exchange properties of four filtration devices. Journal of Hospital Infection 1995; 29: 45–56.
52 Wilkes AR, Benbough JE, Speight SE, Harmer M. The bacterial and viral filtration performance of breathing system filters. Anaesthesia 2000; 55: 458–65.
53 Wilkes AR. Measuring the filtration performance of breathing system filters using sodium chloride particles. Anaesthesia 2002; 57: 162–8.
54 National Institute for Occupational Safety and Health (NIOSH). Respiratory Protective Devices. Code of Federal Regulations, Title 42, Part 84. Morgantown, WV, USA: National Institute for Occupational Safety and Health, 1995.
55 Garibaldi RA, Britt MR, Webster C, Pace NL. Failure of bacterial filters to reduce the incidence of pneumonia after inhalation anesthesia. Anesthesiology 1981; 54: 364–8.
56 Feeley TW, Hamilton WK, Xavier B, Moyers J. Sterile anesthesia breathing circuits do not prevent postoperative pulmonary infection. Anesthesiology 1981; 54: 369–72.
57 Mazze RI. Bacterial air filters. Anesthesiology 1981; 54: 359–60.
58 Egger Halbeis CB, Macario A, Brock‐Utne JG. The reuse of anesthesia breathing systems: another difference of opinion and practice between the United States and Europe. Journal of Clinical Anesthesia 2008; 20: 81–3.
59 Chant K, Kociuba K, Munro R, et al. Investigation of possible patient‐to‐patient transmission of Hepatitis C in a hospital. New South Wales Public Health Bulletin 1994; 5: 47–51.
60 Blood Borne Viruses Advisory Panel. A Report Received by Council of the Association of Anaesthetists on Blood Borne Viruses and Anaesthesia: An Update (January 1996). London: The Association of Anaesthetists of Great Britain and Ireland, 1996.
61 Heinsen A, Bendtsen F, Fomsgaard A. A phylogenetic analysis elucidating a case of patient‐ to‐patient transmission of hepatitis C virus during surgery. Journal of Hospital Infection2000;46: 309–13.
62 Vézina DP, Trépanier CA, Lessard MR, Gourdeau M, Tremblay C. Anesthesia breathing circuits protected by the DAR Barrierbac S breathing filter have a low bacterial contamination rate.Canadian Journal of Anesthesia 2001; 48: 748–54.
63 Vezina DP, Trépanier CA, Lessard MR, Gourdeau M, Tremblay C, Guidoin R. An in vivoevaluation of the mycobacterial filtration efficacy of three breathing filters used in anesthesia.Anesthesiology 2004; 101: 104–9.
64 Daggan R, Zefeiridis A, Steinberg D, Larijani G, Gratz I, Goldberg ME. High‐quality filtration allows reuse of anesthesia breathing circuits resulting in cost savings and reduced medical waste.Journal of Clinical Anesthesia 1999; 11: 536–9.
65 Rathgeber J, Kietzmann D, Mergeryan H, Hub R, Züchner K, Kettler D. Prevention of patient bacterial contamination of anaesthesia‐circle‐systems: a clinical study of the contamination risk and performance of different heat and moisture exchangers with electret filter
(HMEF). European Journal of Anaesthesiology 1997; 14: 368–73.
66 Rees LM, Sheraton TE, Modestini C, Wilkes AR, Hall JE. Assessing the efficacy of HME filters at preventing contamination of breathing systems. Anaesthesia 2007; 62: 67–71.
67 Dugani S, Kumar A, Wilkes AR. Influence of patient factors on the efficacy of breathing system filters at preventing contamination of breathing systems. Anaesthesia 2010; 65: 468– 72.
68 Hartmann D, Jung M, Neubert TR, Susin C, Nonnenmacher C, Mutters R. Microbiological risk of anaesthetic breathing circuits after extended use. Acta Anaesthesiologica Scandinavica 2008; 52: 432–6.
69 van Hassel S, Lazeaux M, Leenders M, Kaan JA, Mintjes J. Bacterial filters in anesthesia: results of 9 years surveillance. Infection Control and Hospital Epidemiology 1999; 20: 58–
60.
70 Wilkes AR. The ability of breathing system filters to prevent liquid contamination of breathing systems: a laboratory study. Anaesthesia 2002; 57: 33–9.
71 Kramer A, Kranabetter R, Rathgeber J,et al. Infection prevention during anaesthesia ventilation by the use of breathing system filters (BSF): joint recommendation by German Society of Hospital Hygiene (DGKH) and German Society for Anaesthesiology and Intensive Care (DGAI).GMS Krankenhaushygiene Interdisziplinär 2010; 5: 1–19.
72 Cann C, Hampson MA, Wilkes AR, Hall JE. The pressure required to force liquid through breathing system filters. Anaesthesia 2006; 61: 492–7.
73 Scott DHT, Fraser S, Willson P, Drummond GB, Baillie JK. Passage of pathogenic microorganisms through breathing system filters used in anaesthesia and intensive care.Anaesthesia 2010; 65: 670–3.
74 Craven DE, Goularte TA, Make BJ. Contaminated condensate in mechanical ventilator circuits.American Journal of Respiratory Disease 1984; 129: 625–8.
75 Gorman LJ, Sanai L, Notman AW, Grant IS, Masterson RG. Cross infection in an intensive care unit by Klebsiella pneumoniae from ventilator condensate. Journal of Hospital Infection 1993; 23: 27–34.
76 Turner DAB, Wright EM. Efficiency of heat and moisture exchangers. Anaesthesia 1987; 42: 1117–8.
77 Cohen IL, Weinberg PF, Fein A, Rowinski GS. Endotracheal tube occlusion associated with the use of heat and moisture exchangers in the intensive care unit. Critical Care
Medicine 1988; 16: 277–9.
78 Ippolito G. Endotracheal tube occlusion, use of heat moisture exchangers, and nosocomial pneumonia. Critical Care Medicine 1990; 18: 348–9.
79 Martin C, Perrin G, Gevaudan M‐J, Saux P, Gouin F. Heat and moisture exchangers and vaporizing humidifiers in the intensive care unit. Chest 1990; 97: 144–9.
80 Misset B, Escudier B, Rivara D, Leclercq B, Nitenberg G. Heat and moisture exchanger vs heated humidifier during long‐term mechanical ventilation. A prospective randomized study. Chest1991; 100: 160–3.
81 Roustan JP, Kienlen J, Aubus P, Aubus S, du Cailar J. Comparison of hydrophobic heat and moisture exchangers with heated humidifier during prolonged mechanical
ventilation. Intensive Care Medicine 1992; 18: 97–100.
82 Sottiaux T. Use of a heat and moisture exchanger during long‐term mechanical ventilation.Chest 1992; 102: 979.
83 Sidhu VS, Henderson SJ, Allt‐Graham J. A heat and moisture exchanging filter in long‐term ventilation. Clinical Intensive Care 1994; 5: 289–92.
84 Villafane MC, Cinnella G, Lofaso F, et al. Gradual reduction of endotracheal tube diameter during mechanical ventilation via different humidification devices. Anesthesiology 1996; 85: 1341–9.
85 Medical Devices Directorate. Heat and Moisture Exchanger (HME). Pall BB22‐ 15F. Evaluation 93 . London: Medical Devices Directorate, 1991.
86 Boyer A, Thiéry G, Lasry S, et al. Long‐term mechanical ventilation with hygroscopic heat and moisture exchangers used for 48 hours: a prospective clinical, hygrometric, and bacteriologic study. Critical Care Medicine 2003; 31: 823–9.
87 Ricard J‐D, Le Mière E, Markowicz P, et al. Efficiency and safety of mechanical ventilation with a heat and moisture exchanger changed only once a week. American Journal of Respiratory and Critical Care Medicine 2000; 161: 104–9.
88 Markowicz P, Ricard JD, Dreyfuss D, et al. Safety, efficacy and cost effectiveness of mechanical ventilation with humidifying filters changed every 48 hours: a prospective, randomized study.Critical Care Medicine 2000; 28: 665–71.