Bài viết Hỗ trợ thông khí được điều chỉnh bằng thần kinh từ bài viết gốc: Neurally Adjusted Ventilatory Assist: A Ventilation Tool or a Ventilation Toy? của tác giả Walter Verbrugghe and Philippe G Jorens được biên dịch bởi BS. Đặng Thanh Tuấn – BV Nhi Đồng 1.
1. Tóm tắt
Thông khí cơ học, kể từ khi được đưa vào thực hành lâm sàng, đã trải qua một sự phát triển lớn từ thông khí kiểm soát sang các phương thức thông khí hỗ trợkhác nhau. Hỗtrợthông khíđượcđiều chỉnh bằng thần kinh (Neurally adjusted ventilatory assist, NAVA) là sự phát triển mới nhất. Việc thực hiện NAVA đòi hỏi sự ra đời của một ống thông để đo hoạt động điện của cơ hoành ( electrical activity of the diaphragm, EAdi). Ngược lại với các chế độ thông khí hỗ trợ thông thường, NAVA dựa vào EAdi để kích hoạt nhịp thở của máy thở và để điều chỉnh hỗ trợ thông khí cho hệ thống truyền động thần kinh (neural drive). Biên độ của hỗ trợ máy thở được xác định bằng EAdi tức thời và mức NAVA do bác sĩ lâm sàng thiết lập. Mức NAVA khuếch đại tín hiệu EAdi và xác định hỗ trợ máy thở tức thời trên cơ sở từng nhịp thở. Dữ liệu thực nghiệm và lâm sàng cho thấy sự đồng bộ bệnh nhân – máy thở (patient-ventilator synchrony) tốt hơn với NAVA. Không đồng bộ bệnh nhân – máy thở chiếm ở 25% bệnh nhân thở máy trong khoa chăm sóc đặc biệt và có thể góp phần làm bệnh nhân khó chịu, giấc ngủ bị phân mảnh, sử dụng nhiều thuốc an thần, phát triển cơn mê sảng, tổn thương phổi do máy thở, thở máy kéo dài và cuối cùng là tử vong. Với NAVA, sự phụ thuộc vào tín hiệu EAdi, cùng với hệ thống truyền động thông khí nguyên vẹn và phản xạ thở còn nguyên vẹn, cho phép tích hợp máy thở trong khớp nối thần kinh – thông khí (neuro- ventilatory coupling) ở mức độ cao hơn so với các chế độ thông khí thông thường. Chỉ theo dõi đơn giản tín hiệu EAdi có thể cung cấp cho bác sĩ lâm sàng thông tin quan trọng để hướng dẫn xử trí máy thở, đặc biệt là trong quá trình cai máy. Mặc dù, cho đến nay, rất ít bằng chứng chứng minh tính ưu việt của NAVA đối với các điểm kết thúc có liên quan về mặt lâm sàng, nhưng có vẻ như rõ ràng là một số quần thể bệnh nhân (ví dụ, COPD và trẻ nhỏ) có một tỷ lệ lớn hiện tượng không đồng bộ bệnh nhân máy thở, có thể được hưởng lợi từ công cụ thở máy mới này.
2. Giới thiệu
Thở máy là một trong những kỹ thuật được áp dụng phổ biến trong điều trị bệnh nhân suy hô hấp tại khoa hồi sức tích cực (ICU). Tiên lượng của những bệnh nhân này không chỉ được xác định bởi tình trạng cơ bản, mà còn bởi chiến lược thở máy mà bác sĩ lâm sàng theo đuổi.1
Theo quan điểm sinh lý, thở máy được chỉ định khi có sự khác biệt rõ rệt giữa mức độ nỗ lực hô hấp cần thiết để duy trì trao đổi khí thích hợp và khả năng hoạt động của hệ hô hấp. Các mục tiêu chính của cơ chế thở máy là phục hồi chức năng trao đổi khí và giảm gắng sức của cơ hô hấp. Cách tiếp cận này cho phép những bệnh nhân bị bệnh nặng hồi phục sau bệnh cấp tính của họ.
3. Từ thông khí cơ học kiểm soát đến thông khí cơ học hỗ trợ
Ban đầu, máy thở là một máy chạy bằng máy bơm, được thiết kế để cung cấp hỗn hợp oxy-không khí đến bệnh nhân với thể tích và tần số ổn định (thở máy kiểm soát). Tuy nhiên, những loại máy thở ban đầu đó không tính đến nỗ lực hô hấp của chính bệnh nhân. Chu kỳ hô hấp thần kinh của bệnh nhân thở máy thường chỉ bị ức chế một phần, và nó thường không đồng bộ với tần số và thể tích do máy thở cung cấp. Trong những điều kiện như vậy, việc sử dụng thuốc an thần thường là sự cân bằng để cải thiện sự đồng bộ bệnh nhân – máy thở và cuối cùng là cho phép thông khí và trao đổi khí đầy đủ.
Từ đầu những năm 1980, một thế hệ máy thở mới đã được phát triển có thể hỗ trợ thông khí cơ học. Các máy thở này được trang bị một cảm biến khí nén (pneumatic sensor) được thiết kế để phát hiện thời điểm bắt đầu nỗ lực hít vào ( inspiratory effort) của bệnh nhân. Cơ chế cảm biến khí nén phát hiện sự hít vào, bằng cách đảo ngược dòng thở ra (cảm biến lưu lượng, flow sensor) hoặc bằng sự sụt giảm áp lực (cảm biến áp lực, pressure sensor) được tạo ra bởi nỗ lực hít vào của bệnh nhân. Đáp lại, máy thở sẽ hỗ trợ nỗ lực hít vào của bệnh nhân thông qua việc hỗtrợ tạo áp lực hít vào đã được thiết lập trước đó. Khi lưu lượng khí hít vào giảm tốc về cuối giai đoạn hít vào, còn khoảng 25–30% lưu lượng khí tối đa, van thở ra của máy sẽ được mở để bệnh nhân có thểthởra. Chế độthông khí nàyđược gọi
là thông khí hỗ trợ áp lực (pressure support ventilation, PSV) hoặc hỗ trợ thở tự phát (assisted spontaneous breathing). Các chế độ thông khí hỗ trợ được đặc trưng bởi sự đồng bộ về thời gian hít vào giữa nỗ lực hít vào của bệnh nhân (hít vào thần kinh) và việc máy thở cung cấp lưu lượng hít vào (hít vào cơ học).
Mặc dù có lợi thế về tính đồng bộ thời gian hít vào trong các chế độ thông khí hỗ trợ, nghiên cứu gần đây cho thấy rằng các chế độ này ảnh hưởng đến sự không đồng bộ bệnh nhân – máy thở rõ rệt. Thông thường, ở những bệnh nhân COPD có thể có sự không đồng bộ về thời gian giữa giai đoạn thở ra của chu kỳ thở (thở ra thần kinh) và mở van thở ra của máy thở (thở ra cơ học).2,3 Trong phần sau của chương này, sự không đồng bộ của máy thở có liên quan đến các kết cục bất lợi.4,5
Để giải quyết những vấn đề này, một chế độ thông khí mới, thông khí hỗ trợ tỷ lệ (proportional assist ventilation, PAV), đã được đề xuất. PAV cung cấp thông khí hỗ trợ áp lực được hỗ trợ bằng một thuật toán phức tạp dựa trên độ giãn nởvà sức cản của đường thở. PAV cải thiện đồng bộ thời gian và cho phép điều chỉnh biên độ và độ dốc của dòng thông khí hỗ trợ cho nhu cầu thông khí của bệnh nhân (đồng bộ dòng, flow synchrony). Việc thực hiện đúng PAV ngụ ý ước tính sức cản đường thở và độ giãn nở, điều này trong thực hành lâm sàng có thể khó thực hiện. Ngoài ra, PAV chỉ có sẵn trên một số máy thở hạn chế và cho đến nay vẫn chưa được các bác sĩ lâm sàng áp dụng rộng rãi.
Sựphát triển mới nhất trong lĩnh vực này, mới chỉ được cung cấp cho các bác sĩ lâm sàng gần đây, là hỗ trợ thông khí được điều chỉnh bằng thần kinh (NAVA). Phương thức thở máy hỗ trợ mới này cung cấp hỗ trợ áp lực tỷ lệ thuận dựa trên các phép đo hoạt động điện của cơ hoành (EAdi), đóng vai trò như một đại diện cho đầu ra tế bào thần kinh của trung tâm hô hấp.
4. Khớp nối thần kinh – thông khí
Khớp nối thần kinh – thông khí là một quá trình phức tạp phối hợp giữa thông khí thần kinh và thông khí cơ học. Trung tâm hô hấp thần kinh nằm trong tủy sống của hệ thần kinh trung ương. Thông qua một mạng lưới dao động của các tế bào thần kinh hít vào và thở ra, nó điều khiển chu kỳ thở và tạo ra kiểu hô hấp. Trung tâm hô hấp chịu ảnh hưởng và điều chỉnh bởi các tín hiệu từ các bộ phận khác của não, bao gồm cả từ vỏ não vận động, để chúng ta có thể kiểm soát nhịp thở một cách có ý thứcởmột mứcđộnàođó. Tất cảnhững tín hiệu này được điều phối trong cầu não; cuối cùng chúng quyết định hoạt động thần kinh hô hấp của chúng ta. Thông tin này được tích hợp và điều chỉnh bởi tủy sống thông qua các phản xạ bắt nguồn từ các thụ thể ở phổi, lồng ngực và các cơ hô hấp. Tín hiệu thần kinh bắt đầu, thông qua dây thần kinh hoành, điện thế hoạt động của sợi cơ của cơ hoành, dẫn đến sự co cơ học của cơ hoành. Cường độ của sự co cơ này phụ thuộc vào số lượng đơn vị vận động được kích hoạt, lần lượt được xác định bởi cường độ và tần số của hoạt động thần kinh. Sự hoạt hóa của cơ hô hấp dẫn đến sự giãn nở của lồng ngực thông qua việc tạo ra một áp lực âm trong lồng ngực, gây ra sự giãn nở của phổi và một áp lực âm phế nang, tạo ra một luồng khí hít vào trong quá trình thở tự phát. Trong toàn bộ chu kỳ thở, trung tâm hô hấp liên tục bị ảnh hưởng bởi một cơ chế phản hồi thần kinh (neural feedback mechanism) phức tạp bắt nguồn từ các thụ thể nằm trong não và ở cấp độ ngoại vi.
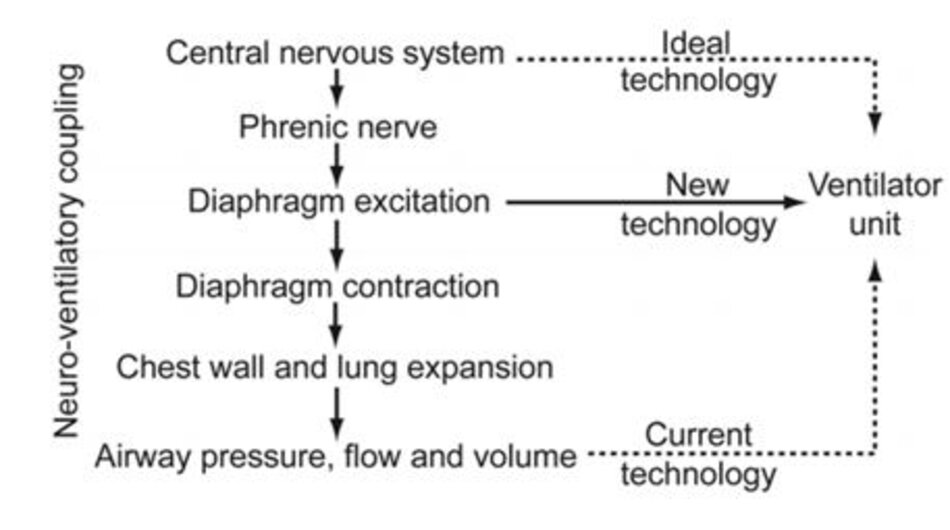
Dođó, khớp nối thần kinh – thông khí có thể được xem như một sự tương tác phức tạp dẫn đến việc bắt đầu và điều hòa chu kỳ hô hấp. Cho đến ngày nay, chúng ta vẫn thiếu một thiết bị có thể đo hoạt động thần kinh được tạo ra bởi trung tâm hô hấp và phản hồi thần kinh. Thế hệ máy thở hiện nay được trang bị cảm biến lưu lượng, áp lực và thể tích. Tuy nhiên, những thay đổi về lưu lượng, áp lực và thể tích chỉ đơn thuần là kết quả của khớp nối thần kinh – thông khí. Biết rằng, ở những người khỏe mạnh, thời gian chờ giữa hoạt động thần kinh và bắt đầu hít vào là dưới 20 ms, có vẻ hợp lý khi giả định rằng một cảm biến nằm xa hơn về phía thượng lưu là mong muốn (Hình 1). Việc tích hợp máy thở với khớp nối thần kinh – thông khí mức độ cao hơn – ít nhất về lý thuyết – cũng có lợi cho sự đồng bộ bệnh nhân – máy thở được nâng cao hơn nhiều.6–8
5. Không đồng bộ bệnh nhân – máy thở
Các điểm quan trọng trong chu kỳ hô hấp là (1) kích hoạt (thời điểm mà máy thở được kích hoạt và bắt đầu hỗtrợhô hấhít vào), (2) chu kỳ(thời điểm mà van thở ra của bộ dây máy thở được mở), và (3) mức độ và tốc độ điều áp trong giai đoạn hít vào.
Đánh giá đầy đủ về sự không đồng bộ bệnh nhân – máy thở nằm ngoài phạm vi của bài báo này. Vì vậy, chúng tôi giới thiệu người đọc đến các bài đánh giá xuất sắc khác. 4,9,10 Về cơ bản, theo quan điểm sinh lý, sự không đồng bộ bệnh nhân – máy thở có thể được chia thành sự không đồng bộ về thời gian và sự không đồng bộ về lưu lượng.
Sự không đồng bộ về thời gian đề cập đến sự khác biệt giữa thời gian của chu kỳ hô hấp thần kinh của bệnh nhân và chu kỳ hô hấp của máy thở. Sự không đồng bộ về thời gian có thể liên quan đến sự bắt đầu của giai đoạn hit vào (Hình 2) hoặc sự bắt đầu của giai đoạn thởra (Hình 3). Tự động kích hoạt (bắt đầu hỗ trợ cơ học mà không có nỗ lực hít vào) và các nỗ lực không hiệu quả (không có hỗ trợ cơ học mặc dù có nỗ lực hít vào, xem Hình 2) đều có thể được coi là cực điểm của sự không đồng bộ về thời gian.
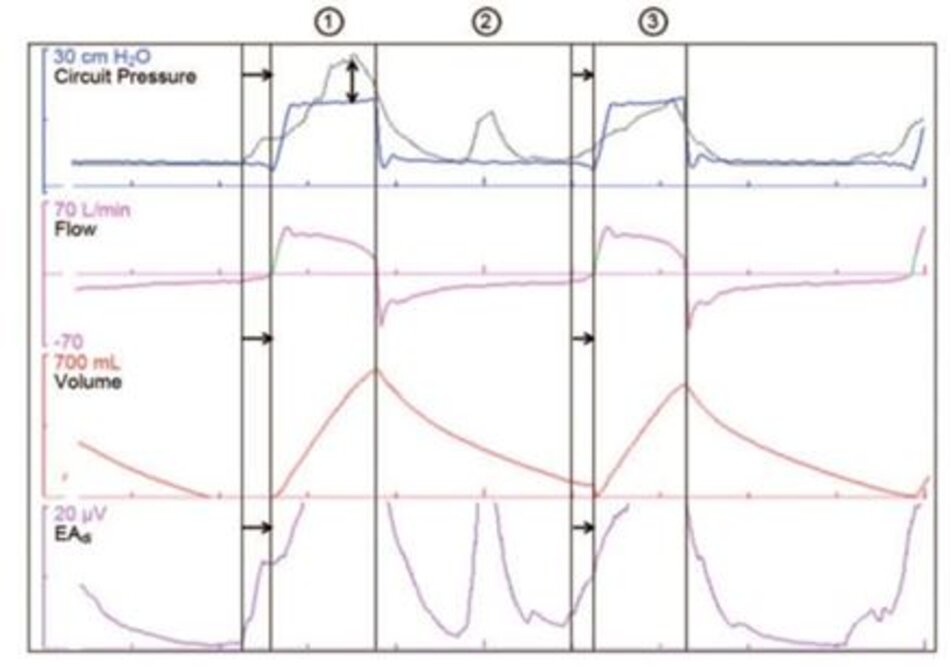
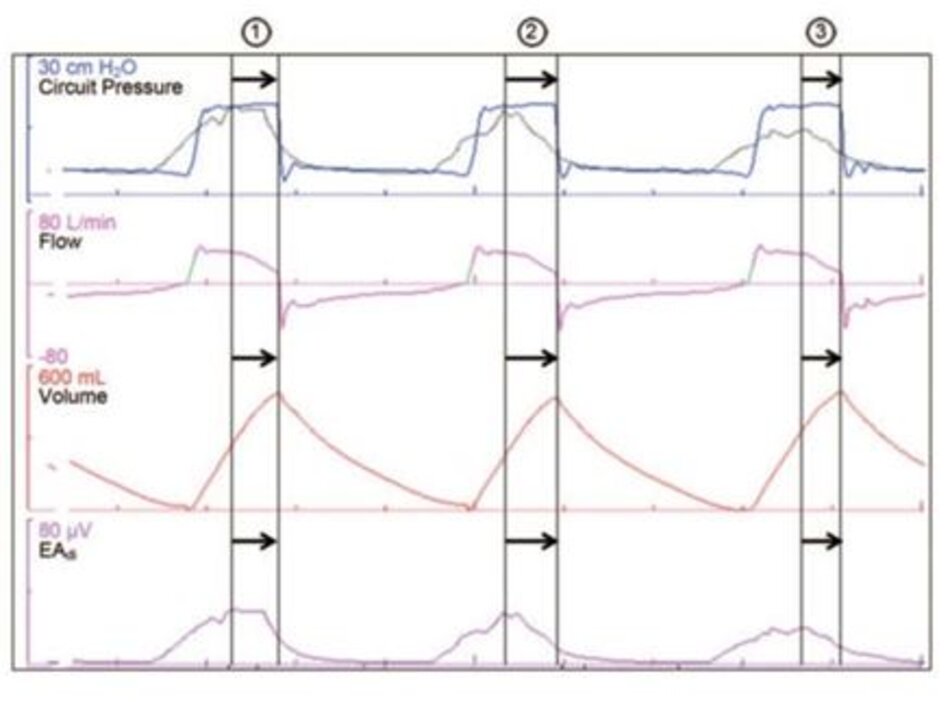
Sự không đồng bộ hỗ trợ lưu lượng đề cập đến sự khác biệt giữa biên độ của đầu ra hô hấp thần kinh và mức độ hỗ trợ hít vào do máy thở cung cấp. Sự khôngđồng bộ của hỗ trợ lưu lượng có thể liên quan đến tốc độ lưu lượng hoặc biên độ của hỗ trợ thông khí cơ học (xem Hình 2). Có rất ít dữ liệu có sẵn về sự không đồng bộ hỗ trợ lưu lượng. Trong mọi trường hợp, một sự thay đổi “sinh lý” trong thể tích khí lưu thông và nhịp thở sẽ có vẻ hợp lý.
6. Tầm quan trọng của sự đồng bộ bệnh nhân – máy thở
Không đồng bộ bệnh nhân – máy thở có thể xảy ra ở 25% bệnh nhân thở máy hỗ trợ.3–5,11,12 Không đồng bộbệnh nhân – máy thở xảy ra chủ yếu ở những bệnh nhân có tần số hô hấp nội tại cao, ở những bệnh nhân tắc nghẽn đường thở mãn tính và ở những bệnh nhân những người được thở với mức hỗ trợ áp lực cao dẫn đến thể tích khí lưu thông vượt quá thể tích thông thường của họ.3,4 Sự không đồng bộbệnh nhân – máy thở có thể do các yếu tố liên quan đến bệnh lý của bệnh nhân và các yếu tố kỹ thuật (cài đặt máy thở không phù hợp hoặc lỗi kỹ thuật máy thở).9,10
Yếu tố quyết định chính liên quan đến bệnh nhân của sự không đồng bộ bệnh nhân – máy thở đáng kể trong các chế độ thông khí hỗ trợ là sự hiện diện của PEEP nội tại và siêu bơm phồng phổi động. Loại thứ hai, như thường thấy ở bệnh nhân COPD, dẫn đến rút ngắn cơ hít vào, với vùng cơ hô hấp giảm và vị trí cơ hoành nằm ngang hơn. Đến lượt nó, điều này làm ảnh hưởng đến sức mạnh cơ hoành, dẫn đến việc kích hoạt máy thở bị trì hoãn so với lúc bắt đầu hít vào thần kinh. Hơn nữa, nếu áp lực hít vào tăng quá chậm, hoặc áp lực quá cao, thì việc mở van thở ra của máy thở sẽ xảy ra sau khi bắt đầu hết thời gian thần kinh, dẫn đến bơm phồng phổi cơ học tiếp tục sau khi bắt đầu thở ra thần kinh. Áp lực hít vào tăng quá mức sẽ dẫn đến thể tích khí lưu thông quá mức, kích hoạt phản xạ Hering-Breuer, và do đó làm suy giảm thêm hô hấp thần kinh của bệnh nhân. Nếu thể tích phút cao dẫn đến nhiễm kiềm hô hấp, sau đó phản xạ hô hấp sẽ bị suy giảm nhiều hơn, dẫn đến ngưng thở.13
Các yếu tố kỹ thuật như cài đặt không đủ ngưỡng kích hoạt khí nén cũng có thể dẫn đến tình trạng không đồng bộ bệnh nhân – máy thở. Ngưỡng kích hoạt hít vào quá nhạy cảm, cũng như rò rỉ không khí từ bộ dây thở, có thể dẫn đến tự động kích hoạt. Ngược lại, ngưỡng kích hoạt khí nén quá cao sẽ dẫn đến bơm phồng phổi cơ học bị trì hoãn quá mức hoặc trong những tình huống cực đoan sẽ dẫn đến không có bơm phồng phổi cơ học.2
Sự không đồng bộ bệnh nhân – máy thở có liên quan đến (1) tăng nhu cầu an thần và phong tỏa thần kinh cơ, (2) tăng áp lực xuyên phổi, với nguy cơ chấn thương phổi và tổn thương phổi do máy thở, và (3) thời gian thở máy kéo dài.3– 5,11,12 Ngoài ra, tăng cường sự đồng bộ bệnh nhân – máy thở có liên quan đến sự thoải mái hơn của bệnh nhân và chất lượng giấc ngủ tốt hơn.14 Chất lượng giấc ngủ không đủ có liên quan đến nguy cơ mê sảng cao hơn và có thể góp phần dẫn đến tử vong. Thông khí kéo dài có liên quan đến nguy cơ cao hơn bị viêm phổi do thở máy, thời gian nằm ICU kéo dài, tỷlệmởkhí quản cao hơn và chi phí cao hơn – cuối cùng nhưng không kém phần quan trọng. Có vẻ như tình trạng không đồng bộ này tự nó có thể dẫn đến tử vong cao hơn.5
7. Hỗ trợ thông khí được điều chỉnh bằng thần kinh
NAVA có thể được coi là một phương thức hỗ trợ thông khí cơ học trong đó mức độ hỗ trợ thông khí tỷ lệ thuận với hoạt động điện cơ hoành (EAdi). Cơ hoành là cơ hô hấp chính. Hoạt động điện được tạo ra bởi cơ hoành, như được ghi lại bởi tín hiệu EAdi, là thước đo nỗ lực thần kinh của bệnh nhân. Theo cách này, máy thở được “kết nối” với trung tâm hô hấp của chính bệnh nhân. Thời gian và cường độ của tín hiệu EAdi xác định cả thời gian và cường độ của máy trợ thở, dẫn đến mức độ đồng bộ cao giữa chu kỳ hô hấp thần kinh và lưu lượng của máy thở. Trái ngược với hầu hết các phương thức thông thường của thông khí hỗ trợ chỉ sử dụng một bộ kích hoạt khí nén, NAVA tận dụng tín hiệu EAdi như một bộ kích hoạt “điện”.
Việc thực hiện NAVA như một chế độ thông khí hỗ trợ giả định rằng EAdi là một thước đo đáng tin cậy cho hệ thống truyền động hô hấp thần kinh của bệnh nhân.15 Hơn nữa, khớp nối thần kinh – thông khí của bệnh nhân cần phải nguyên vẹn để cường độ của tín hiệu EAdi (như một biểu thức của hoạt động thần kinh của trung tâm hô hấp) tỷ lệ với yêu cầu thông khí của bệnh nhân. Điều này ngụ ý rằng tất cả các thụ thể của cơ chếphản hồi của hệ thống hô hấp đều có đủ chức năng và các tín hiệu của chúng được trung tâm hô hấp giải thích một cách chính xác. Tuy nhiên, ở những bệnh nhân nặng, cơ chế phản hồi này và bản thân trung tâm hô hấp có thể bị ảnh hưởng và tổn hại theo nhiều cách khác nhau. Chấn thương phổi, chấn thương hệ thần kinh trung ương hoặc ngoại vi, thuốc an thần và giảm đau, hoặc bản thân chế độ thở máy đều có thể ảnh hưởng đến cơ chế phản hồi phức tạp này.16,17
7.1 Tín hiệu điện từ cơ hoành
Tín hiệu EAdi là tổng hoạt động điện của cơ hoành. Tín hiệu EAdi này bao gồm cả tần số và cường độ của hoạt động cơ hoành và được biểu thị bằng microvolt (μV). Tín hiệu EAdi được đo xuyên thực quản bằng ống thông EAdi, ống thông này có 8 vi điện cực lưỡng cực gắn trên đầu ống thông dạ dày. Nóđượcđặt gần cơ hoành, nơi có thể đo tín hiệu EAdi. Tín hiệu EAdi là kết quả của một thuật toán phức tạp lọc tín hiệu điện của cơ hoành từ các tín hiệu điện phát ra từ tim, thực quản và các cơ xung quanh khác.18,19 Tín hiệu thu được được khuếch đại và hiển thị dưới dạng đường cong EAdi. Cho đến nay, NAVA chỉ có sẵn trên máy thở Servo-i (Maquet Critical Care, Solna, Thụy Điển).
Trước khi thực hiện thở máy với NAVA, bác sĩ hô hấp phải đặt đúng ống thông EAdi để thu được tín hiệu EAdi chính xác. Trong thực tế, vị trí chính xác của điện cực được xác định dựa trên một số tiêu chí20:
- Tham chiếu giải phẫu dựa trên khoảng cách giả định giữa bờ cơ hoành và đỉnh, và được tính bằng công thức
- Tín hiệu điện tâm đồ, có thể được hiển thị trên một màn hình cụ thể trên bảng điều khiển máy thở và do sóng P và sóng QRS, biểu thị vị trí của điện cực.
- Sự đồng bộ của tín hiệu EAdi với độ lệch âm của đường cong áp lực đường thở trong một nỗ lực tạo hít vào chống lại một đường thở nhân tạo bị tắc
Về nguyên tắc, người ta phải luôn có thể bắt được tín hiệu EAdi, ngoại trừ những trường hợp có khiếm khuyết giải phẫu lớn (ví dụ, thoát vị hoành); ngưng thở trung ương không có điều khiển của trung khu hô hấp (ví dụ: dùng an thần, tổn thương não); hoặc trong trường hợp không có hoạt động điện cơ hoành (ví dụ, tổn thương dây thần kinh hoành, thuốc giãn cơ).
Tuy nhiên, việc đặt ống thông mũi dạ dày bị lệch có thể làm gián đoạn tín hiệu EAdi, do đó việc thông khí với NAVA có thể bị cản trở hoặc thậm chí không thể thực hiện được. Tuy nhiên, máy thở được trang bị cơ chế an toàn chuyển sang chế độ thông khí hỗ trợ áp lực nếu không phát hiện thấy tín hiệu EAdi. Hơn nữa, nếu bệnh nhân không có biểu hiện hô hấp tự phát, thì máy thở sẽ được phép chuyển sang thởmáy kiểm soát áp lực, nhờcơ chếan toàn bổ sung.
7.2 Giải thích tín hiệu cơ hoành
Giá trị tuyệt đối của tín hiệu EAdi cho thấy sự thay đổi đáng kể giữa các cá thể. Do đó, người ta không thể đưa ra giá trị bình thường cho tín hiệu EAdi. Mặc dù không hoàn toàn rõ ràng chính xác yếu tố nào đóng vai trò ở đây, nhưng chúng được cho là có cả bản chất giải phẫu và sinh lý học. Đối với các khía cạnh giải phẫu, người ta cho rằng khoảng cách từ cơ đến điện cực có thể khác nhau ở mỗi bệnh nhân. Ngoài ra, mật độ đơn vị vận động của cơ hoành cũng có thể khác nhau giữa các cá nhân, do đó cường độ hoạt động điện của cơ hoành đo được cũng có thể khác nhau.
Về mặt sinh lý, người ta giả định rằng sự huy động riêng lẻ của cơ hoành và các đơn vị vận động làm cơ sở cho tín hiệu EAdi cao hơn hoặc thấp hơn. Việc huy động đơn vị vận động này được xác định bởi dự trữ sinh lý của khớp nối thần kinh – thông khí. Ở một người “khỏe mạnh” khi nghỉ ngơi, tín hiệu EAdi thấp hơn ở một bệnh nhân phổi mãn tính ở trạng thái nghỉ ngơi. Có lẽ cái thứ hai là một biểu hiện của một dự trữ sinh lý hạn chế của khớp nối thần kinh – thông khí. Một bệnh nhân suy hô hấp có tín hiệu EAdi cao quá mức là một biểu hiện của sự dự trữ không đủcủa khớp nối thần kinh – thông khí, không đáp ứng được nhu cầu hô hấp của bệnh nhân.
Tín hiệu EAdi cũng có thể thay đổi trong từng cá nhân, tùy thuộc vào giai đoạn bệnh và dự trữ sinh lý của hệ thống hô hấp.24 Do đó, sự phát triển của tín hiệu EAdi có thể được sử dụng như một thước đo sự tiến triển của chức năng hô hấp và có thể giúp ích dự đoán sự thành công của cai máy thở.
7.4 Chu kỳ hô hấp trong thông khí tự phát được hỗ trợ với NAVA
Bơm phồng phổi cơ học bắt đầu khi máy thở phát hiện độ lệch của tín hiệu EAdi lớn hơn ngưỡng đã đặt (chủ yếu là 0,5 μV). Trong giai đoạn hít vào của chu kỳ hô hấp, thiết bị trợ giúp cơ học được điều chỉnh để phù hợp với tín hiệu EAdi tức thời, được đo sau mỗi 16 ms và được khuếch đại bởi một mức NAVA đã đặt. Kết quả hỗ trợ áp lực trên PEEP (tính bằng cm H2O) bằng với mức NAVA (tính bằng cm H2O/μV) nhân với tín hiệu EAdi (tính bằng μV). Điều này có nghĩa là trợ giúp cơ học cuối cùng do máy thở trong NAVA cung cấp sẽ tỷ lệ với đầu ra thần kinh được đo bằng tín hiệu EAdi. Vì tín hiệu EAdi có thể có sự thay đổi giữa nhịp thở và nhịp thở, nên cũng có thể có sự thay đổi từ nhịp thở đến nhịp thở trong thể tích khí lưu thông với NAVA. Khi tín hiệu EAdi đạt tới 40-70% tín hiệu EAdi đỉnh, máy thở ngừng hỗ trợ thở và mở van thở ra.
Ngoài “bộ kích hoạt EAdi” dựa trên tín hiệu EAdi, vẫn có thể kích hoạt bằng khí nén với NAVA. Cả hai trình kích hoạt hoạt động kết hợp trên cơ sở ai đến trước được phục vụ trước. Để dự phòng, nếu tín hiệu EAdi biến mất hoàn toàn, máy thở sẽ chuyển sang chế độthông khí hỗ trợ áp lực. Cuối cùng, như một phương án dự phòng thứ hai, máy thở có thể chuyển sang thông khí kiểm soát áp lực nếu các nỗ lực hít vào tự phát biến mất.
Trong thực tế, điều này có nghĩa là khi bệnh nhân hoàn thành chu kỳ hô hấp trên NAVA, thời gian và cường độ của hỗ trợ thông khí sẽ tương ứng với thời gian và cường độ của chu kỳ hô hấp thần kinh. Vì sự đồng bộ của bệnh nhân – máy thở được đảm bảo đầy đủ trong suốt chu kỳ hô hấp với NAVA, người ta có thểlập luận rằng chu kỳthởcủa một bệnh nhân thở bằng NAVA được tích hợp ở mức độ cao hơn vào cơ chế khớp nối thần kinh – thông khí.25
7.5 Mức NAVA
Giả định rằng NAVA cho phép tích hợp máy hít vào khớp nối thần kinh – thông khí ngụ ý rằng bệnh nhân kiểm soát áp lực xuyên phổi trong chu kỳ hô hấp thông qua phản hồi đối với hoạt động hô hấp thần kinh, được đo trên cơ sở tín hiệu EAdi. Mức NAVA cho một bệnh nhân cụthểtrong một tình huống cụ thể dựa trên nguyên tắc đó.
Bác sĩ điều trị hô hấp đặt mức NAVA bằng quy trình chuẩn độ theo kinh nghiệm 26 với sự tăng dần của hỗ trợ máy thở. Trong quy trình chuẩn độ này, bệnh nhân sẽ tuần tự trải qua giai đoạn hỗ trợ dưới mức, giai đoạn hỗ trợ đầy đủ và cuối cùng là giai đoạn hỗ trợ quá mức. Điều quan trọng là bác sĩ lâm sàng nhận biết được các giai đoạn này để chọn mức hỗ trợ thông khí thích hợp.
Một bệnh nhân suy hô hấp được thở máy với mức NAVA quá thấp, dẫn đến áp lực tăng không đủ, sẽ dẫn đến việc hỗ trợ máy thở không bù được nhu cầu hô hấp. Về mặt lâm sàng, bệnh nhân sẽ có biểu hiện thở nhanh nông. Đầu ra thần kinh của trung tâm hô hấp sẽbiểu hiện cườngđộcao quá mức, dẫn đến tín hiệu EAdi cao như một dấu hiệu của tình trạng suy hô hấp.
Nếu mức NAVA tăng dần cùng với áp lực hít vào ngày càng tăng, thì biên độ của tín hiệu EAdi sẽ giảm dần cho đến khi đạt được mức bình nguyên trong đó thể tích khí lưu thông không đổi. Bệnh nhân hiện đang ở trong “vùng thoải mái” với thể tích phút đáp ứng nhu cầu hô hấp của anh ta khi cơ hô hấp được giải phóng tối đa.
Nếu mức NAVA được tăng thêm, dẫn đến tăng áp lực quá mức, biên độ của tín hiệu EAdi sẽ giảm, nhưng cùng với sự gia tăng của thể tích khí lưu thông. Sau đó, bệnh nhân ở trong một vùng mất bù quá mức. Mức áp lực cao như vậy có thể nguy hiểm vì phổi quá căng và nguy cơ tổn thương phổi do máy thở. Tuy nhiên, ngay cả ở mức NAVA cao quá mức, tín hiệu EAdi sẽ không bao giờ biến mất hoàn toàn. Hình 4 cho thấy một ví dụ về quy trình chuẩn độ NAVA.
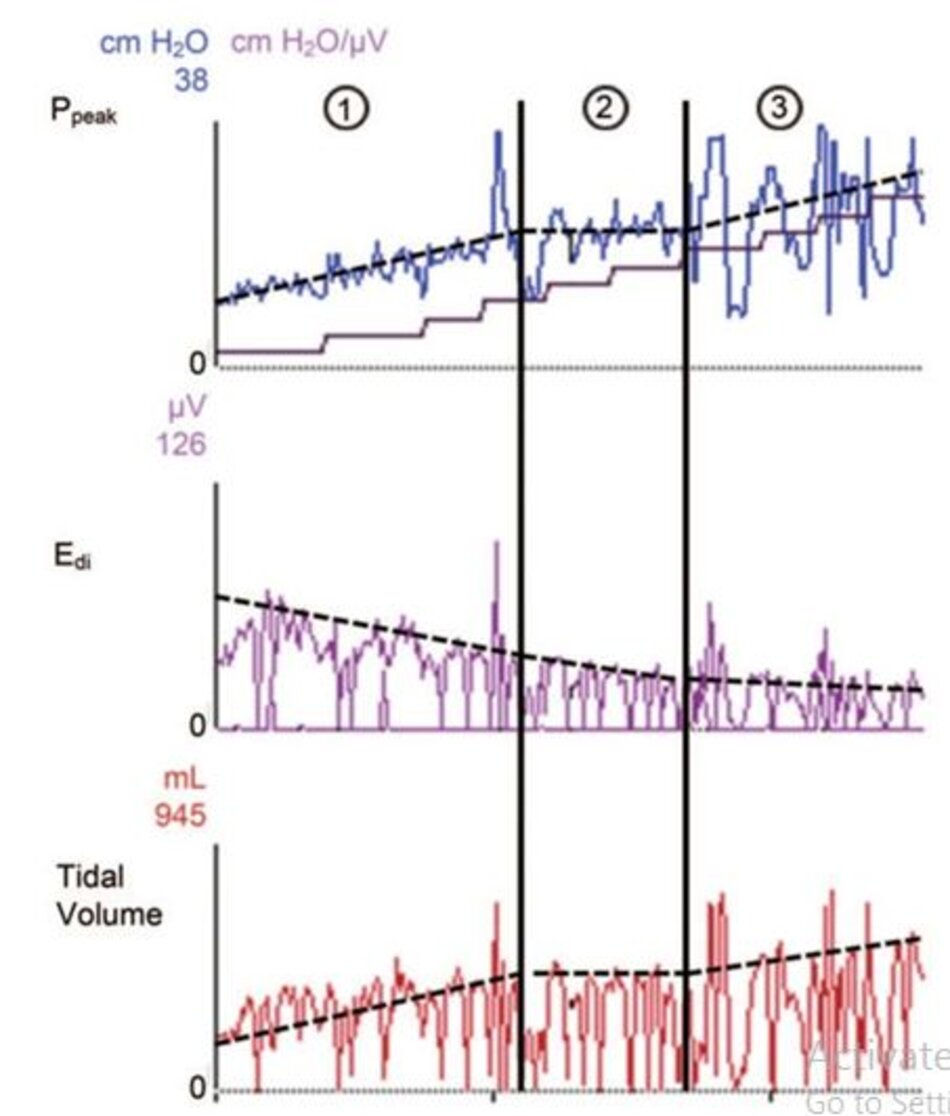
Trong cái gọi là “vùng thoải mái”, thể tích khí lưu thông được xác định bởi chính bệnh nhân. Trong vùng này, bệnh nhân “chọn” thể tích khí lưu thông và tần số thở đáp ứng nhu cầu hô hấp của mình. Nói cách khác, bệnh nhân quyết định phần lớn áp lực CO2 động mạch. Kinh nghiệm cho thấy rằng những bệnh nhân được thở bằng NAVA có thể duy trì PaCO2 và thể tích khí lưu thông ở mức chấp nhận được với kiểu thở thay đổi hơn, so với thông khí hỗ trợ bằng áp lực.
8. Các lợi ích và ứng dụng tiềm năng của NAVA
Kinh nghiệm lâm sàng với NAVA ở người là ít. Tuy nhiên, dựa trên các nguyên tắc sinh lý học lành mạnh, có nhiều ứng dụng tiềm năng tồn tại.
8.1 Chuẩn độ mức hỗ trợ áp lực
Việc theo dõi tín hiệu EAdi cho phép chuẩn độ mức hỗtrợ áp lực trong thở máy hỗ trợ phù hợp hơn với nhu cầu của bệnh nhân.27 Đặc biệt hơn, tín hiệu EAdi có thể giúp nhận biết các tình huống mà mức hỗtrợ áp lực được đặt quá cao.
Cài đặt hỗ trợ áp lực cao quá mức dẫn đến hít vào cơ học kéo dài, tiếp tục sau khoảng thời gian của giai đoạn hít vào thần kinh và đến giai đoạn thở ra thần kinh. Ở những bệnh nhân mà phản xạ Hering- Breuer còn nguyên vẹn, giai đoạn thở ra thần kinh cũng sẽ bị kéo dài, dẫn đến giảm tần số hô hấp. Theo truyền thống, tần số hô hấp thấp ở những bệnh nhân được thông khí hỗ trợ bằng áp lực được coi là một dấu hiệu của “sự cải thiện”. Tuy nhiên, nếu hỗ trợ áp lực được đặt quá cao, điều này thực tế có thể là biểu hiện của sự ức chế thần kinh đối với chức năng hô hấp gây ra bởi sự không đồng bộ bệnh nhân – máy thở.28 Nguyên nhân là do bệnh nhân thực sự được hỗ trợ áp lực quá mức, và bác sĩ lâm sàng có ấn tượng rằng mức hỗ trợ áp lực không thể giảm và bệnh nhân không thể cai máy được. Loại hỗ trợ không đồng bộ này chỉ có thể được chẩn đoán bằng cách theo dõi tín hiệu EAdi.
Hơn nữa, mức hỗ trợ áp lực quá mức có thể gây ra chứng ngưng thở, do đó tín hiệu EAdi vẫn ở trạng thái “phẳng”. Kết hợp với việc tự động kích hoạt gây ra bởi bộ kích hoạt khí nén quá nhạy, điều này có thể gây hiểu lầm cho bác sĩ lâm sàng vì trong tình huống này, nhịp hô hấp không còn đại diện cho hoạt động của cơ hoành. Tình huống này cũng chỉ có thể được nhận biết thông qua việc giám sát tín hiệu EAdi.29
8.2 Chuẩn độ mức PEEP và hoạt động của cơ hoành
Ngoài ra, theo dõi tín hiệu EAdi, đặc biệt ở trẻ nhỏ, cũng có thể hữu ích trong việc nhận biết hoạt động của cơ hoành và cải thiện cài đặt PEEP. Người ta đã ghi nhận rằng chủ yếu trẻ nhỏ (<1 tuổi) không chỉ chứng tỏ sự không đồng bộ bệnh nhân – máy thở rõ rệt, mà còn hoạt động trương lực của cơ hoành vẫn tồn tại trong giai đoạn thở ra của chu kỳ hô hấp. EAdi trương lực (tonic EAdi) được coi là một cơ chế để bảo vệ khỏi sự mất huy động phổi bằng cách duy trì thể tích phổi cuối kỳ thở ra trong tổn thương phổi cấp tính. EAdi trương lực này có tác động tiêu cực đến EAdi phasic. Chuẩn độ mức PEEP phù hợp với tín hiệu EAdi có thể tối ưu hóa mô hình hô hấp và giảm hoạt động của cơ hoành, cho phép bệnh nhân duy trì thông khí tự phát trong NAVA.30,31 Dữ liệu quan sát từ các quần thể nhỏ cho thấy NAVA ở những bệnh nhân này là khả thi và có vẻ dung nạp tốt.32,33
8.3 NAVA trong thông khí không xâm lấn
Việc sử dụng tiêu chí chuyển chu kỳ bằng khí nén trong thông khí không xâm lấn dễ bị rò rỉ khí, đây là một vấn đề quan trọng, thường xảy ra xung quanh mặt nạ. Sự rò rỉ như vậy có thể gây ra sự không đồng bộ bệnh nhân – máy thở và có thể làm hỏng hệ thống thông khí không xâm lấn. Tín hiệu EAdi không bị ảnh hưởng bởi rò rỉ không khí và do đó có thể được sử dụng như một tiêu chí về chu kỳ “điện”, về mặt lý thuyết đảm bảo sự đồng bộ bệnh nhân – máy thởtốt hơn. Ởnhững người tình nguyện khỏe mạnh, thông khí không xâm lấn với NAVA dường như cải thiện sự thoải mái của bệnh nhân, có thể cải thiện khả năng chịu đựng của bệnh nhân.
8.4 Theo dõi tín hiệu cơ hoành trong quá trình thông khí cơ học và cai máy
Có thể cho rằng mục đích quan trọng nhất của việc theo dõi tín hiệu EAdi là chẩn đoán chính hoạt động của cơ hoành. Tín hiệu EAdi có thể giúp xác định độsâu an thần và chiến lược thở máy thích hợp. An thần dựa trên EAdi có thể làm giảm việc sử dụng thuốc an thần sâu và rút ngắn thời gian thở máy. Vì tình trạng không hoạt động cơ hoành kéo dài có thể góp phần vào sự phát triển của teo cơ hoành, việc theo dõi định tính hoạt động của cơ hoành với tín hiệu EAdi có thể hữu ích trong việc ngăn ngừa rối loạn chức năng cơ hoành do máy thở.36 Theo dõi định lượng tín hiệu EAdi, chẳng hạn như sự tiến triển của tín hiệu EAdi và phản ứng của tín hiệu EAdi với tải trọng của máy thở áp đặt, có thể được sử dụng như một thông số cai máy bổ sung. Các thử nghiệm cai máy có thể khám phá xem liệu sự gia tăng quan trọng trong tín hiệu EAdi có thể đóng vai trò như một yếu tố dự báo cho sự thất bại của quá trình cai máy hay không. Mặt khác, sự “bình thường hóa” của tín hiệu EAdi có thể dự báo việc cai máy thành công và rút ống nội khí quản. Tuy nhiên, lợi ích tiềm năng của tín hiệu EAdi như một thông số giám sát mới vẫn mang tính suy đoán cho đến khi các thử nghiệm lâm sàng chứng minh ngược lại.
8.5 Thông khí cơ học bảo vệ phổi
Các thí nghiệm trên động vật cho thấy NAVA có tác dụng bảo vệ phổi, so với thông khí thể tích khí lưu thông thấp trong tổn thương phổi cấp tính sớm. Với NAVA, các con vật được phép chọn kiểu thở của riêng mình, dẫn đến sự co cơ hoành được bảo toàn và hoạt động của tim tốt hơn. Từ quan điểm sinh lý, người ta có thể suy đoán rằng thông khí tự phát với tăng cường đồng bộbệnh nhân – máy thở thông qua NAVA có thể làm giảm nguy cơ tổn thương phổi do máy thở.36
9. Chỉ định cho NAVA
Thật khó để xác định các chỉ định rõ ràng cho thở máy với NAVA. Hầu hết các nghiên cứu cho đến nay là các nghiên cứu sinh lý học được thực hiện trên động vật và người khỏe mạnh. Có thể, những bệnh nhân không đồng bộ bệnh nhân – máy thở chính có nhiều khả năng được hưởng lợi từ NAVA. Nhóm này có thể bao gồm trẻ nhỏ và bệnh nhân COPD, những người thường biểu hiện PEEP nội tại và siêu bơm phồng phổi động. Tuy nhiên, tất cả những bệnh nhân được thở máy có thể duy trì thông khí hỗ trợ tự phát với trung khu thông khí thần kinh còn nguyên vẹn, và những người không có chống chỉ định đặt sonde dạ dày, đều đủ tiêu chuẩn. Rõ ràng, cần có các thử nghiệm lâm sàng lớn trong ICU để làm rõ vấn đề này.
10. Kết luận
Từ quan điểm sinh lý, NAVA là một công cụ thú vị mới đã được giới thiệu gần đây trong thực hành lâm sàng. Tính năng độc đáo của nó là dựa vào EAdi để kích hoạt chu kỳ hô hấp và cung cấp hỗ trợ tỷ lệ hài hòa với trung khu thần kinh của bệnh nhân trên cơ sở từng nhịp thở. NAVA cung cấp sự đồng bộ bệnh nhân – máy thở tốt hơn so với các phương thức thông khí hỗ trợ hiện có khác. Mặc dù cho đến nay, không có bằng chứng trực tiếp nào từ các thử nghiệm lâm sàng trên người cho thấy sự đồng bộ bệnh nhân – máy thở với NAVA mang lại kết quả tốt hơn, nhưng nó vẫn là một công cụ rất hứa hẹn cho cả bác sĩ lâm sàng và các nhà nghiên cứu làm việc trong lĩnh vực thở máy. Mặt khác, cả hai cải tiến về chi phí ống thông EAdi và tính khả dụng trên nhiều máy thở đều cần thiết trước khi có thể áp dụng rộng rãi chế độ này trong tương lai.
11. Tài liệu tham khảo
1. ↵ Metnitz PG, Metnitz B, Moreno RP, Bauer P, Del Sorbo L, Hoermann C, et al. Epidemiology of mechanical ventilation: analysis of the SAPS 3 database. Intensive Care Med 2009;35(5):816–825.CrossRefPubMedGoogle Scholar
2. ↵ Gurevitch MJ, Gelmont D. Importance of trigger sensitivity to ventilator response delay in advanced chronic obstructive pulmonary disease with respiratory failure. Crit Care Med 1989;17(4):354–359.PubMedGoogle Scholar
3. ↵Fabry B, Guttmann J, Eberhard L, Bauer T, Haberthur C, Wolff G. An analysis of desynchronization between the spontaneously breathing patient and ventilator during inspiratory pressure support. Chest 1995;107(5):1387– 1394.CrossRefPubMedGoogle Scholar
4. ↵ Chao DC, Scheinhorn DJ, Stearn-Hassenpflug M. Patient-ventilator trigger asynchrony in prolonged mechanical ventilation. Chest 1997;112(6):1592–1599.PubMedGoogle Scholar
5. ↵ Thille AW, Rodriguez P, Cabello B, Lellouche F, Brochard L. Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive Care Med 2006;32(10):1515–1522.CrossRefPubMedGoogle Scholar
6. ↵ Sinderby C, Navalesi P, Beck J, Skrobik Y, Comtois N, Friberg S, et al. Neural control of mechanical ventilation in respiratory failure. Nat Med 1999;5(12):1433–1436.CrossRefPubMedGoogle Scholar
7. ↵ Beck J, Campoccia F, Allo JC, Brander L, Brunet F, Slutsky AS, et al. Improved synchrony and respiratory unloading by neurally adjusted ventilatory assist (NAVA) in lung-injured rabbits. Pediatr Res 2007;61(3):289– 294.CrossRefPubMedGoogle Scholar
8. ↵ Lecomte F, Brander L, Jalde F, Beck J, Qui H, Elie C, et al. Physiological response to increasing levels of neurally adjusted ventilatory assist (NAVA). Respir Physiol Neurobiol 2009;166(2):117–124.CrossRefPubMedGoogle Scholar
9. ↵ Sassoon CS, Foster GT. Patient-ventilator asynchrony. Curr Opin Crit Care 2001;7(1):28–33.CrossRefPubMedGoogle Scholar
10. ↵ Kondili E, Xirouchaki N, Georgopoulos D. Modulation and treatment of patient-ventilator dyssynchrony. Curr Opin Crit Care 2007;13(1):84–89.PubMedGoogle Scholar
11. ↵ Varon J, Fromm R, Rodarte J. Prevalence of patient ventilator asynchrony in critically ill patients. Chest 1994;106(Suppl):141S.CrossRefGoogle Scholar
12. ↵ de Wit M, Miller KB, Green DA, Ostman HE, Gennings C, Epstein SK. Ineffective triggering predicts increased duration of mechanical ventilation. Crit Care Med 2009;37(10):2740–2745.CrossRefPubMedGoogle Scholar
13. ↵ Patessio A, Purro A, Appendini L. Patient-ventilator mismatch during pressure support ventilation in patients with intrinsic PEEP (abstract). Am Rev Respir Dis 1994;149(Suppl):A65.Google Scholar
14. ↵ Bosma K, Ferreyra G, Ambrogio C, Pasero D, Mirabella L, Braghiroli A, et al. Patient-ventilator interaction and sleep in mechanically ventilated patients: pressure support versus proportional assist ventilation. Crit Care Med 2007;35(4):1048–1054.CrossRefPubMedGoogle Scholar
15. ↵ Beck J, Gottfried SB, Navalesi P, Skrobik Y, Comtois N, Rossini M, et al. Electrical activity of the diaphragm during pressure support ventilation in acute respiratory failure. Am J Respir Crit Care Med 2001;164(3):419–424.PubMedGoogle Scholar
16. ↵ Mitrouska J, Xirouchaki N, Patakas D, Siafakas N, Georgopoulos D. Effects of chemical feedback on respiratory motor and ventilatory output during different modes of assisted mechanical ventilation. Eur Respir J 1999;13(4):873– 882.Abstract/FREE Full TextGoogle Scholar
17. ↵ Nava S, Bruschi C, Fracchia C, Braschi A, Rubini F. Patient-ventilator interaction and inspiratory effort during pressure support ventilation in patients with different pathologies. Eur Respir J 1997;10(1):177–183.Abstract/FREE Full TextGoogle Scholar
18. ↵ Beck J, Sinderby C, Lindstrom L, Grassino A. Diaphragm interference pattern EMG and compound muscle action potentials: effects of chest wall configuration. J Appl Physiol 1997;82(2):520–530.Abstract/FREE Full TextGoogle Scholar
19. ↵ Sinderby CA, Beck JC, Lindstrom LH, Grassino AE. Enhancement of signal quality in esophageal recordings of diaphragm EMG. J Appl Physiol 1997;82(4):1370–1377.Abstract/FREE Full TextGoogle Scholar
20. ↵ Barwing J, Ambold M, Linden N, Quintel M, Moerer O. Evaluation of the catheter positioning for neurally adjusted ventilatory assist. Intensive Care Med 2009;35(10):1809–1814.CrossRefPubMedGoogle Scholar
21. ↵ Sinderby C, Beck J, Spahija J, Weinberg J, Grassino A. Voluntary activation of the human diaphragm in health and disease. J Appl Physiol 1998;85(6):2146–2158.Abstract/FREE Full TextGoogle Scholar
22. Beck J, Weinberg J, Hamnegard CH, Spahija J, Olofson J, Grimby G, et al. Diaphragmatic function in advanced Duchenne muscular dystrophy. Neuromuscul Disord 2006;16(3):161–167.CrossRefPubMedGoogle Scholar
23. ↵ Sinderby C, Beck J, Spahija J, de Marchie M, Lacroix J, Navalesi P, et al. Inspiratory muscle unloading by neurally adjusted ventilatory assist during maximal inspiratory efforts in healthy subjects. Chest 2007;131(3):711– 717.CrossRefPubMedGoogle Scholar
24. ↵ Sinderby C, Spahija J, Beck J, Kaminski D, Yan S, Comtois N, et al. Diaphragm activation during exercise in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;163(7):1637–1641.CrossRefPubMedGoogle Scholar
25. ↵ Sinderby C, Beck J. Proportional assist ventilation and neurally adjusted ventilatory assist–better approaches to patient ventilator synchrony? Clin Chest Med 2008;29(2):329–342, vii.CrossRefPubMedGoogle Scholar
26. ↵ Colombo D, Cammarota G, Bergamaschi V, De Lucia M, Corte FD, Navalesi P. Physiologic response to varying levels of pressure support and neurally adjusted ventilatory assist in patients with acute respiratory failure. Intensive Care Med 2008;34(11):2010–2018.CrossRefPubMedGoogle Scholar
27. ↵ Brander L, Leong-Poi H, Beck J, Brunet F, Hutchison SJ, Slutsky AS, et al. Titration and implementation of neurally adjusted ventilatory assist in critically ill patients. Chest 2009;135(3):695–703.CrossRefPubMedGoogle Scholar
28. ↵ Rice AJ, Nakayama HC, Haverkamp HC, Pegelow DF, Skatrud JB, Dempsey JA. Controlled versus assisted mechanical ventilation effects on respiratory motor output in sleeping humans. Am J Respir Crit Care Med 2003;168(1):92–101.CrossRefPubMedGoogle Scholar
29. ↵ Vincent JSinderby C, Brander L, Beck CJ. Is one fixed level of assist sufficient to mechanically ventilate spontaneously breathing patients? In: Vincent J editor. Yearbook of intensive care and emergency medicine. New York: Springer; 2007:348–357.Google Scholar
30. ↵ Allo JC, Beck JC, Brander L, Brunet F, Slutsky AS, Sinderby CA. Influence of neurally adjusted ventilatory assist and positive end-expiratory pressure on breathing pattern in rabbits with acute lung injury. Crit Care Med 2006;34(12):2997–3004.PubMedGoogle Scholar
31. ↵ Emeriaud G, Beck J, Tucci M, Lacroix J, Sinderby C. Diaphragm electrical activity during expiration in mechanically ventilated infants. Pediatr Res 2006;59(5):705–710.CrossRefPubMedGoogle Scholar
32. ↵ Breatnach C, Conlon NP, Stack M, Healy M, O’Hare BP. A prospective crossover comparison of neurally adjusted ventilatory assist and pressure-support ventilation in a pediatric and neonatal intensive care unit population. Pediatr Crit Care Med 2010;11(1):7–11.CrossRefPubMedGoogle Scholar
33. ↵ Bengtsson JA, Edberg KE. Neurally adjusted ventilatory assist in children: an observational study. Pediatr Crit Care Med 2010;11(2):253–257.CrossRefPubMedGoogle Scholar
34. ↵ Beck J, Brander L, Slutsky AS, Reilly MC, Dunn MS, Sinderby C. Non-invasive neurally adjusted ventilatory assist in rabbits with acute lung injury. Intensive Care Med 2008;34(2):316–323.CrossRefPubMedGoogle Scholar
35. ↵ Moerer O, Beck J, Brander L, Costa R, Quintel M, Slutsky AS, et al. Subject-ventilator synchrony during neural versus pneumatically triggered non-invasive helmet ventilation. Intensive Care Med 2008;34(9):1615– 1623.PubMedGoogle Scholar
36. ↵ Brander L, Sinderby C, Lecomte F, Leong-Poi H, Bell D, Beck J, et al. Neurally adjusted ventilatory assist decreases ventilator-induced lung injury and non-pulmonary organ dysfunction in rabbits with acute lung injury. Intensive Care Med 2009;35(11):1979–1989.CrossRefPubMedGoogle Scholar