Tác giả: Bác sĩ Đặng Thanh Tuấn
Tóm tắt
Giới thiệu Các thay đổi về thể tích phổi cuối thì thở ra (ΔEELV) trong đáp ứng với những thay đổi của PEEP (ΔPEEP) chưa được báo cáo ở bệnh nhân thở máy với ARDS. Mục đích của nghiên cứu này là xác định tính hữu dụng của phép đo ΔEELV trong việc xác định PEEP tối ưu ở bệnh nhân ARDS.
Phương pháp 9 bệnh nhân bị ARDS được tuyển chọn. ΔEELV được đo bằng các từ kế (magnetometers) trong quá trình thử nghiệm PEEP giảm dần. Sự thay đổi PaO2 (ΔPaO2) được đo đồng thời. Độ giãn nở hệ thống hô hấp tĩnh (CRS), ΔPaO2/ΔPEEP, và ΔEELV/ΔPEEP được tính ở mỗi mức PEEP.
Kết quả Đối với nhóm, ΔEELV giảm 1,09 ± 0,13 L (trung bình ± SD) vì PEEP đã được giảm từ 20 đến 0 cm H2O với sự biến đổi lớn nhất trong ΔEELV xảy ra trong khoảng giữa của đường cong PEEP giảm dần. Các giá trị tối ưu cho CRS, ΔEELV/ΔPEEP, và ΔPaO2/ΔPEEP có thể được xác định cho mỗi bệnh nhân và xảy ra ở mức PEEP từ 10 đến 17,5 cm H2O. Có sự tương quan đáng kể (r = 0.712, p = 0.047) giữa ΔPaO2/ΔPEEP và ΔEELV/ΔPEEP.
Kết luận ΔEELV có thể được đo từ đường cong PEEP giảm dần. Vì ΔEELV có tương quan cao với ΔPaO2 nên các biện pháp của ΔPaO2/ΔPEEP có thể cung cấp một đại diện cho các biện pháp của ΔEELV/ΔPEEP. Kết hợp các biện pháp của ΔEELV/ΔPEEP với các biện pháp của CRS có thể cung cấp một phương pháp mới để xác định PEEP tối ưu ở bệnh nhân ARDS.
Giới thiệu
Phổi ở bệnh nhân có hội chứng suy hô hấp cấp (ARDS) được đặc trưng bởi các phế nang xẹp hoàn toàn và phổi bình thường liền kề với các phế nang bị xẹp một phần nhưng có thể huy động được. Những phát hiện bệnh lý này góp phần làm giảm thể tích phổi cuối thì thở ra (EELV, end- expiratory lung volumes), giảm độ giãn nở phổi, và tăng shunt phổi [2]. Các chiến lược thông khí cơ học như việc sử dụng các thể tích khí lưu thông (VT, tidal volume) thấp nhằm mục đích hạn chế sự giãn phổi bình thường, kết hợp với áp lực dương cuối thì thở ra (PEEP, positive end-expiratory pressure) có thể làm giảm tỷ lệ tổn thương phổi do thở máy gây ra và cải thiện sự sống còn tổng thể [3-7]. Mức thấp nhất của PEEP dẫn đến EELV khi đóng cửa phế nang được ngăn ngừa khi thở ra kết thúc mà không có ảnh hưởng xấu huyết động được gọi là PEEP tối ưu. Xác định và kê toa “PEEP tối ưu” có thể có lợi ích về tử vong đã được gán cho tác động ngăn ngừa quá trình mở hoặc đóng cửa của các phế nang trong quá trình thông khí cơ học [8, 9]. CT ngực được coi là tiêu chuẩn vàng để đánh giá ảnh hưởng của PEEP đối với vùng thông khí của phổi [10, 11]. Tuy nhiên, việc áp dụng CT như một công cụ để đánh giá PEEP bị giới hạn bởi những nhược điểm hiển nhiên của việc quét CT nhiều lần (nghĩa là phải di chuyển bệnh nhân thở máy và sự phơi nhiễm phóng xạ quá mức). Hơn nữa, các nghiên cứu CT chỉ đơn giản cho thấy rằng có thể có phổi huy động nhưng không cung cấp hướng dẫn về mức PEEP được sử dụng. Do đó, những nỗ lực xác định PEEP tối ưu đã tập trung vào các phép đo khác dễ thực hiện hơn. Sự đồng thuận về cách xác định PEEP tối ưu cho một bệnh nhân nhất định với ARDS vẫn còn chưa rõ ràng.
Trong các nghiên cứu trước đó, PEEP tối ưu đã được xác định bằng cách xác định điểm uốn dưới trên nhánh hít vào của đường cong áp lực (P-V) [3, 12-14] hoặc bằng cách xác định điểm thay đổi tối đa trong độ giãn nở toàn bộ hệ thống hô hấp (CRS, total respiratory system compliance) trong quá trình vận hành PEEP tăng lên [15]. Tuy nhiên, xác định điểm uốn thấp của đường cong P-V có thể là thách thức, và thiết lập PEEP từ một phép đo sự tương thích hô hấp hoặc đường cong P-V hít vào không phải là lý tưởng vì việc huy động phổi vẫn tiếp tục trong thời kỳ bơm phồng phổi lên [16]. Mô hình máy tính cho thấy các thử nghiệm PEEP giảm dần sẽ cung cấp một phương pháp thống nhất hơn để xác định PEEP tối ưu hơn các thử nghiệm PEEP tăng lên [17]. Đối với cùng mức PEEP, Tỷ lệ shunt được giảm khi sử dụng kiểu giảm PEEP thay vì gia tăng PEEP, cho thấy rằng mối quan hệ giữa PEEP tối ưu và độ giãn nở tối đa có thể chính xác hơn [18, 19]. Do đó, một số tác giả đã gợi ý sử dụng đường cong PEEP giảm để xác định PEEP tối ưu [18-20].
Đo lường sự thay đổi thể tích phổi cuối thì thở ra (ΔEELV) trong một thử nghiệm PEEP giảm có thể cung cấp một phương pháp thay thế khác để xác định PEEP tối ưu. Độ lớn của ΔEELV thay đổi theo các phạm vi khác nhau của PEEP với những thay đổi lớn nhất trong ΔEELV xảy ra trong phạm vi mức PEEP mà nơi đó việc huy động các phế nang là tối ưu. Ngược lại, những thay đổi nhỏ hơn của ΔEELV sẽ xảy ra trong phạm vi của PEEP, mà nơi đó phế nang hoặc bị quá căng hoặc bị xẹp. Các phép đo của ΔEELV/ΔPEEP sẽ cung cấp một phương pháp thay thế để xác định PEEP tối ưu bằng cách chọn một mức PEEP trong đó ΔEELV/ΔPEEP là tối đa. Vì quá trình oxy hóa được cải thiện khi các phế nang được huy động, chúng tôi hy vọng sự thay đổi PaO2 (ΔPaO2) sẽ song hành với sự thay đổi của ΔEELV. Theo chúng tôi, không có nghiên cứu trước đây nào đo được ΔEELV ở bệnh nhân ARDS hoặc sử dụng ΔEELV để xác định mức PEEP tối ưu ở bệnh nhân ARDS.
Phương pháp
Đối tượng
Chín bệnh nhân nhập viện điều trị tại Bệnh viện Rhode Island (Providence, RI) với ALI/ARDS đã được nhận vào. Bệnh nhân được xem xét ghi danh nếu họ được chẩn đoán ALI/ARDS theo các định nghĩa của hiệp hội được công bố [21]. Tất cả bệnh nhân được ghi danh trong vòng 72 giờ chẩn đoán ALI/ARDS. Bệnh nhân bị loại trừ nếu có mất ổn định về huyết động (MAP < 60 mmHg) hoặc nhịp tim < 45 hoặc > 150. Protocol đã được Uỷ ban bảo vệ con người ở bệnh viện Rhode Island chấp thuận và tất cả các đối tượng đều đã có thông báo thỏa thuận thu được từ người chăm sóc sức khoẻ của bệnh nhân trước khi đăng ký.
Thiết bị đo / hiệu chuẩn
Bệnh nhân đã được nghiên cứu trong khi đang được thông khí với máy thở Siemens Servo Ventilation 900C hoặc 300 (Siemens AB, Berlin, Đức). Một catheter phân tích liên tục trong máu động mạch (Diametrics Medical, St. Paul, MN) được hiệu chuẩn (Trendscare Calibrator SCU 7007, Diametrics, St. Paul, MN) và đặt vào động mạch quay của tất cả các bệnh nhân. Ống thông này cho phép hiển thị liên tục dữ liệu khí máu động mạch trong thời gian thực. Những thay đổi trong PaO2 (ΔPaO2) được tính cho mỗi cấp của PEEP. Hiệu chuẩn đã được thực hiện trước và sau khi giao thức.
Sự thay đổi thể tích phổi cuối thì thở ra (ΔEELV) được đo bằng hai cặp cuộn từ kế. Một cặp được đặt phía trước trên xương ức dưới và phía sau cùng một mức độ trên xương sống. Một cặp thứ hai được đặt phía trước 1cm phía trên rốn và phía sau cùng một mức độ trên xương sống. Sự thay đổi về khoảng cách giữa hai xương sườn (ΔRC) và bụng (ΔAb) và sự thay đổi khoảng cách giữa xương ức phía dưới và rốn (ΔXi) được đo trong khi thở khí thở máy do PEEP giảm từ 20 cm H2O xuống PEEP = zero (ZEEP).
Trong đó α, β, và γ đại diện cho hệ số thể tích chuyển động cho RC, Ab, và Xi tương ứng. Các từ kế được hiệu chuẩn với một đồng hồ đo lưu lượng và các hệ số chuyển động khối lượng được xác định bằng phân tích hồi quy tuyến tính nhiều như đã mô tả trước đây [22]. Các tín hiệu từ kế lấy mẫu ở tốc độ 15 Hz. Giá trị của VT bắt nguồn từ phương trình 1 đã được sử dụng để xây dựng một spirogram như PEEP đã được giảm. Thể tích phổi cuối thì thở ra (EELV) được xác định trên spirogram ở mỗi mức PEEP. EELV tại ZEEP đã được chỉ định một giá trị bằng 0. Những thay đổi của EELV (ΔEELV) được tính như là sự khác biệt trong EELV giữa mỗi mức PEEP như đã mô tả [23].
Protocol
Máy thở đã được thiết lập để cung cấp một thể tích khí lưu thông 6 mL/kg trọng lượng cơ thể lý tưởng bằng cách sử dụng một chế độ kiểm soát thể tích. Tất cả các bệnh nhân đều được an thần bằng cách sử dụng kết hợp lorazepam và morphine sulfate và làm liệt cơ với atracurium 0,3-0,6 mg/kg. Tiếp theo, PEEP được tăng lên đến 20 cm H2O trong 30 phút để huy động phổi, trong khi tiếp tục FiO2 là 100% và thở máy theo kiểm soát thể tích. PEEP giảm xuống mỗi 2,5 cm H2O từ 20 cm H2O đến ZEEP hoặc đến khi độ bão hòa oxy dưới 85%. Các thử nghiệm đã được ngưng nếu bệnh nhân bị bất ổn định huyết động (MAP < 60 mmHg); hoặc nhịp tim < 45 hoặc > 150 tại bất kỳ thời điểm nào trong thời gian thử nghiệm PEEP giảm dần. Khoảng cách giữa các mức PEEP trong thủ thuật là 3-5 phút. Thời gian này đã được chọn để cho phép ổn định các phép đo PaO2. Áp lực bình được đo tại cuối thì hít vào. Áp lực bình nguyên, ΔEELV và ΔPaO2 được đo tại mỗi mức PEEP.
Tính toán
Tất cả các thông số được tính toán từ dữ liệu thu được trong giai đoạn PEEP giảm dần. Độ giản nở hệ thống hô hấp tĩnh (CRS) được tính = VT/(áp lực cao nguyên – PEEP). ΔEELV/ΔPEEP, ΔPaO2/ΔPEEP và CRS được tính ở mỗi mức PEEP. Sau đó chúng tôi đã vẽ ra các mối quan hệ sau: CRS so với PEEP, ΔEELV/ΔPEEP so với PEEP và ΔPaO2/ΔEELV so với PEEP. Chúng tôi xác định PEEP tối ưu như mức PEEP liên quan đến (1) CRS tối đa, (2) tối đa ΔEELV/ΔPEEP và (3) ΔPaO2/ΔPEEP tối đa.
Phân tích
Phân tích thống kê được thực hiện bằng cách sử dụng SPSS phiên bản 21 (IBM, Chicago, IL, USA). Trừ trường hợp quy định khác, các giá trị được trình bày dưới dạng trung bình ± SD. Dữ liệu đã được kiểm tra tính bình thường bằng cách sử dụng phép thử Shapiro-Wilkes bình thường cùng với các đồ thị p-p và kiểm tra biểu đồ và hộp đồ. Sự tương quan giữa ΔPaO2 và ΔEELV và giữa ΔPaO2/ΔPEEP và ΔEELV/ΔPEEP được tính bằng cách sử dụng thử nghiệm rho của Spearman hai phía do sự không chắc chắn của một mối quan hệ tuyến tính và độ lệch của các biến. Tất cả giá trị p < 0,05 được coi là có ý nghĩa thống kê.
Kết quả
Đặc điểm bệnh nhân ban đầu
Tuổi trung bình của bệnh nhân là 46. Bốn trong số sáu bệnh nhân là nam giới, 6 trong số 9 người bị ARDS thứ phát do viêm phổi, và ba trong chín người bị ARDS thứ phát do các nguyên nhân ngoài phổi. PaO2/FiO2 trung bình là 146 và điểm số tổn thương phổi là 3,25 tại thời điểm ghi danh. Tất cả bệnh nhân đều phát triển ARDS trong vòng 3 ngày kể từ ngày nằm viện và 6 trong số 9 bệnh nhân sống sót sau khi xuất viện.
Thử nghiệm PEEP suy giảm
Khi mức PEEP giảm từ 20 cm H2O xuống 0 cm H2O (ZEEP), thì sự giảm EELV dự kiến. Đối với nhóm, ΔEELV giảm 1,09 ± 0,13 L (trung bình ± SD) với tỷ lệ ΔEELV giảm xuống nhiều nhất giữa 15 và 10 cm H2O và ít nhất là giữa 10 cm H2O và ZEEP. Chúng tôi xác định ΔEELV/ΔPEEP cho mỗi lần giảm 2,5 cm H2O trong PEEP. Vì sự suy giảm lớn nhất của ΔEELV nằm ở khoảng giữa PEEP, ΔEELV/ΔPEEP lớn nhất trong cùng khoảng (Hình 1). Các giá trị thấp của ΔEELV/ΔPEEP đo ở mức cao (20-17,5 cmH2O) và thấp (7,5 và 0 cmH2O) của PEEP có thể phản ánh sự hiện diện của các phế nang quá căng và xẹp phế nang. Giữa 17,5 và 7,5 cmH2O, các phế nang được huy động có thể được làm dịu tối ưu tạo ra các giá trị phù hợp nhất trong phạm vi này. Từ kiểm tra của hình 1, PEEP tối ưu sẽ ở mức 15 cm H2O nơi ΔEELV / ΔPEEP lớn nhất.
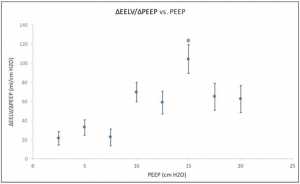
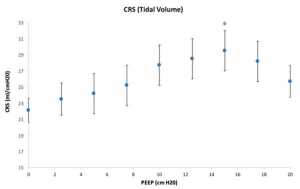
Các giá trị của CRS được mô tả trong Hình 2. Trái với ΔEELV/ΔPEEP, được tạo ra từ sự thay đổi trạng thái ổn định của thể tích trong 3-5 phút cho mỗi cấp PEEP, CRS bắt nguồn từ áp lực bình nguyên cuối thì hít vào trong thở bình thường chỉ kéo dài vài giây cuối hít vào. Mặc dù sự khác biệt này, mối quan hệ giữa CRS và PEEP tương tự như giữa ΔEELV/ΔPEEP và PEEP (Hình 1) với CRS tối đa và ΔEELV/ΔPEEP tối đa xảy ra ở 15 cmH2O. Tuy nhiên, cường độ và phạm vi của các giá trị cho ΔEELV/ΔPEEP lớn hơn CRS. Điều này có thể phản ánh sự khác biệt về sự khác nhau về áp lực và thể tích khác nhau theo chu kỳ được sử dụng để tính ΔEELV/ΔPEEP và CRS tương ứng [21].
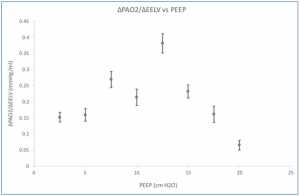
Vì ΔEELV không được đo thường xuyên tại giường, nên chúng tôi đã đánh giá liệu ΔPaO2 có thể cung cấp giá trị đại diện cho ΔEELV hay không. Khi có thêm nhiều phổi được huy động khi EELV tăng, PaO2 sẽ tăng lên. Thật vậy, sự thay đổi tích lũy của các biến này thể hiện mối quan hệ như vậy (Hình 3). Điều này cũng cho thấy ở mức PEEP cao, sự thay đổi EELV ít hiệu quả làm tăng PaO2 (nghĩa là giảm ΔPaO2/ΔEELV) (Hình 4). Điều này có thể là do sự căng chướng quá mức của một số đơn vị phế nang khi thể tích phổi cao. Mối quan hệ giữa ΔPaO2/ΔPEEP và PEEP tương tự như giữa ΔEELV/ΔPEEP và PEEP (Hình 1), và có sự tương quan giữa ΔEELV/ΔPEEP và ΔPaO2/ΔPEEP (r = 0.712, p = 0.047).
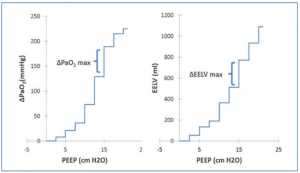
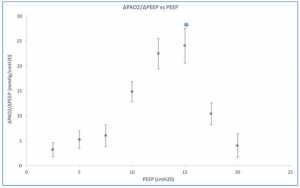
thay đổi giữa các bệnh nhân cá thể làm nổi bật tầm quan trọng của việc đánh giá PEEP tối ưu cho mỗi bệnh nhân. Khi sử dụng cả ba phương pháp để xác định PEEP tối ưu (CRS, ΔEELV/ΔPEEP, và ΔPaO2/ΔPEEP), có sự đồng thuận giữa các bệnh nhân với các giá trị là giống nhau ở 5 trong số 9 đối tượng (Bảng 1).

Thảo luận
Các phát hiện chính của nghiên cứu này có thể được tóm tắt như sau:
1) thay đổi EELV có thể được đo tại giường bệnh nhân thở máy bị ARDS;
2) những thay đổi lớn nhất trong EELV xảy ra trong khoảng giữa của đường cong PEEP giảm dần;
3) ΔEELV/ΔPEEP khác với các mức PEEP khác nhau;
4) ΔEELV tương quan có ý nghĩa với ΔPaO2;
5) các biện pháp của ΔPaO2/ΔPEEP có thể cung cấp một đại diện cho các biện pháp của ΔEELV khi xác định PEEP tối ưu; và
6) ΔEELV/ΔPEEP và ΔPaO2/ΔPEEP có thể được sử dụng để xác định PEEP tối ưu.
Chúng tôi thấy rằng ΔEELV/ΔPEEP và CRS tối đa xảy ra ở mức PEEP gần như giống nhau đối với nhóm, lần lượt là 15,2 ± 0,5 và 14,7 ± 0,6 cm H2O. Tuy nhiên, PEEP tối ưu được xác định dễ dàng hơn bằng cách sử dụng các giá trị của ΔEELV/ΔPEEP. Lý tưởng nhất là việc xác định PEEP tối ưu phải có khả năng tái tạo và không cần đào tạo chuyên môn hoặc thiết bị. Do các phép đo ΔEELV khó có thể đạt được tại giường, nên chúng tôi đã đánh giá liệu PaO2 có thể được sử dụng làm đại diện cho các phép đo của ΔEELV hay không. Khi huy động phế nang, bệnh nhân ARDS [2, 18] giảm phân suất shunt và giảm thiếu oxy máu. Các nhà nghiên cứu trước đây cũng đã quan sát thấy mối quan hệ giữa tái xẹp phế nang và suy giảm PaO2 [24]. Trong nghiên cứu này, ý kiến cho rằng ΔPaO2 có thể được sử dụng như một biến thay thế cho ΔEELV được hỗ trợ bởi các phát hiện của chúng tôi rằng ΔEELV và ΔPaO2 đáp ứng tương tự như PEEP (Hình 3) có tương quan đáng kể và giá trị PEEP tối ưu bắt nguồn từ ΔPaO2/ΔPEEP chặt chẽ xấp xỉ được xác định từ ΔEELV/ΔPEEP, lần lượt là 13,5 ± 0,6 và 14,7 ± 0,6 cm H2O.
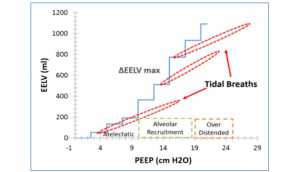
Để đánh giá toàn bộ thể tích phổi tham gia trao đổi khí trong quá trình thông khí cơ học (EELV cộng thể tích cuối thì hít vào), chúng tôi kết hợp các phép đo ΔEELV/ΔPEEP và CRS (Hình 6). Trước tiên, chúng tôi đã xác định ba vùng của PEEP dựa trên sự khác biệt trong ΔEELV/ΔPEEP (Hình 1) mà chúng tôi suy đoán đại diện cho phổi bị xẹp, phổi được bơm phồng bình thường, và phổi quá căng phế nang. Tiếp theo, chúng tôi thêm thể tích khí lưu thông trong mỗi vùng dựa trên các giá trị tương ứng của CRS. Xây dựng một cốt truyện như vậy có thể xác định PEEP tối ưu được xác định như thế nào. Về lý thuyết, một giá trị của PEEP sẽ được chọn để tránh quá căng phổi ở cuối thì hít vào. Lý tưởng là, nhịp thở sẽ bắt đầu và kết thúc trong một phạm vi của PEEP nơi ΔEELV là lớn nhất. Nhịp thở giữa trong hình 6 gần hoàn thành điều này. Tuy nhiên, đối với cốt truyện này, PEEP tốt nhất sẽ được đặt ở 10-12 cm H2O ngay dưới mức tối ưu của PEEP được xác định bởi ΔEELV/ΔPEEP và CRS một mình (Hình 1, 2). Delmonica et al. tương tự đã chứng minh tầm quan trọng của việc đánh giá EELV để đo lường sự huy động phổi do PEEP [25]. Ngược lại với cách tiếp cận của chúng tôi, họ sử dụng kỹ thuật rửa nitơ. Chụp cắt lớp trở kháng điện (EIT) có thể cung cấp một phương pháp giám sát EELV khác. Tuy nhiên, kỹ thuật này đòi hỏi sự bố trí của nhiều cảm biến xung quanh chu vi của khung xương sườn và chỉ giới hạn trong việc mô tả sự thay đổi trong thể tích phổi ở vùng chứ không phải là sự thay đổi tổng thể của EELV [26].
Cần lưu ý rằng mặc dù PEEP tối ưu được xác định bởi ba phương pháp khác nhau trong 9 bệnh nhân có sự thống nhất cao ở từng bệnh nhân, PEEP tối ưu giữa các bệnh nhân dao động từ 10 đến 17,5 cm H2O (Bảng 1). Điểm này lặp lại những phát hiện của Talmor et al. PEEP tối ưu là không đồng nhất giữa các bệnh nhân và đòi hỏi một cách tiếp cận tinh vi hơn so với một kích thước phù hợp với tất cả – one-size-fits-all [27]. Ở mức cao nhất của PEEP, có thể có sự căng chướng quá mức của các phế nang thông thường [28]. Dữ liệu của chúng tôi cho thấy rằng sử dụng các biện pháp kết hợp của ΔEELV/ΔPEEP và CRS, một mức PEEP có thể được cung cấp để giảm thiểu quá căng chướng phế nang ở cuối thì hít vào.
Một số hạn chế của nghiên cứu này cần lưu ý. Thứ nhất, nghiên cứu của chúng tôi đánh giá tổng thể sinh lý phổi và chúng tôi không thể bình luận về sinh lý khu vực. Tuy nhiên, chúng ta sẽ tranh cãi rằng cho đến khi công nghệ thông khí phát triển tới mức nó có thể phân phối một lượng PEEP khác nhau tới các khu vực được lựa chọn của phổi bị tổn thương không đồng đều thì biện pháp này vẫn sẽ cung cấp một số hướng dẫn trong việc lựa chọn một thiết lập PEEP tối ưu trong ARDS. Thứ hai, một số cuộc tranh luận tồn tại liên quan đến CRS như là một biện pháp huy động/tái xẹp các đơn vị phổi trong các bệnh nhân ARDS [29, 30]. Chúng tôi cho rằng các biện pháp của ΔEELV/ΔPEEP có thể phản ánh tốt hơn việc huy động/tái xẹp hơn là các biện pháp của CRS vì chúng đại diện cho sự thay đổi trạng thái của áp lực và thể tích. Cuối cùng, trong khi chúng tôi cảm thấy rằng chúng ta đạt được cân bằng ở trạng thái ổn định giữa các thay đổi PEEP giảm dần, một số tài liệu cho thấy rằng 5 phút có thể không đủ để đạt được trạng thái ổn định [31].
Kết luận
Cuối cùng, chúng tôi xác định được PEEP tối ưu từ các phép đo trị số tối đa của ΔEELV/ΔPEEP, CRS và ΔPaO2/ΔPEEP và mối liên hệ mạnh mẽ giữa ΔPaO2 và ΔEELV. Bằng cách kết hợp các biện pháp của CRS và ΔEELV/ΔPEEP, bác sĩ lâm sàng có thể chọn một mức PEEP cho phép thông khí trên phổi có độ giãn nở tối ưu và có khả năng giảm thiểu sự xuất hiện của việc xẹp phổi cũng như quá căng chướng phế nang. Mặc dù đo ΔEELV/ΔPEEP yêu cầu thiết bị đặc biệt, phép đo ΔPaO2/ΔPEEP có thể được thực hiện tại giường mà không cần sử dụng thiết bị chuyên dụng và có thể cung cấp một đại diện cho ΔEELV/ΔPEEP.





