Alphachymotrypsin được biết đến là một loại peptide có tác dụng chống viêm được dùng phổ biến hiện nay. Tuy nhiên không phải ai cũng biết đến cơ chế tác dụng của thuốc cũng như các thử nghiệm chứng minh tác dụng của thuốc. Ở bài viết này https://www.healcentral.org xin được trả lời các câu hỏi: Alphachymotrypsin là thuốc gì? Alphachymotrypsin có tác dụng gì? Cơ chế tác dụng của Alphachymotrypsin là gì?… Dưới đây là thông tin chi tiết.
Lịch sử nghiên cứu và phát triển
Chymotrypsin là một serine endopeptidase được sản xuất từ tế bào ngoại tiết của tụy. Chymotrypsin được thủy phân từ chymotrypsinogen và được hoạt hóa bởi trypsin. Khi trypsin thủy phân lysine và arginine, chymotrypsin tách chọn lọc các liên kết peptide hình thành từ amino acid có nhân thơm (tyrosine, phenylalanine và tryptophan) (Hedstrom và các cộng sự 1992). Hai dạng nổi bật nhất của chymotrypsin là chymotrypsin A và chymotrypsin B, được tìm thấy với tỉ lệ ngang nhau trong tụy gia súc. Chúng là những protein giống nhau đến 80%, có một số đặc điểm phân giải protein khác nhau đáng kể (Hartley 1964, Meloun và các cộng sự 1966, Smillie và các cộng sự 1968 và Gráf và các cộng sự 2004).
Đầu những năm 1900, Vernon đã đề xuất rằng các chế phẩm tuyến tụy có thể tạo ra một chất hoạt hóa nội tại của các enzyme của chính nó (Vernon 1901). Các thí nghiệm đông sữa Vernon đã xác định có ít nhất hai loại enzyme và một loại ổn định hơn loại kia (Vernon 1902). Tuy nhiên, ý tưởng này đã không được chấp nhận rộng rãi cho đến tận năm 1934, khi Kunitz và Northrop xác nhận sự hiện diện của một loại enzyme khác ngoài trypsin, đặt tên là chymotrypsin. Họ đã có thể kết tinh chymotrypsin, cũng như tiền chất không hoạt động là chymotrypsinogen (Kunitz và Northrop 1934). Năm 1938, Kunitz đã phân lập các dạng hoạt động khác nhau của chymotrypsin, đặt tên chúng là alpha, beta và gamma (Kunitz 1938).
Đầu những năm 1940, Fruton và Bergmann đã nghiên cứu thêm về tính đặc hiệu của chymotrypsin, báo cáo về một số cơ chất mới (Fruton và Bergmann 1942). Jacobsen sớm xác định các dạng bổ sung của chymotrypsin, đặt tên là delta và pi (Jacobsen 1947). Năm 1948, Schwert đã xác định được trọng lượng phân tử của chymotrypsin và chymotrypsinogen.
Năm 1954, bằng chứng đầu tiên về cơ chế ba bước của chymotrypsin thủy phân cơ chất amide và ester đã được báo cáo bởi Hartley và Kilby, những người đã đưa ra giả thuyết về sự hiện diện của một acyl enzyme trung gian, điều sau đó đã được chứng minh là đúng (Henderson 1970). Năm 1955, Laskowski đã thu được một chymotrypsinogen tinh thể thứ hai, đặt tên là chymotrypsinogen B. Năm 1964, Hartley đã xác định trình tự amino acid của chymotrypsin A, sau đó được tinh chế bởi Meloun và các cộng sự vào năm 1966. Năm 1968, Smillie và các cộng sự xác định trình tự amino acid của chymotrypsin B, cho thấy 80% trình tự giống với chymotrypsin A. Trong suốt những năm 1970 và 1980, nhiều nghiên cứu đã được thực hiện để hiểu rõ hơn cơ chế hoạt động và xác định sự khác biệt về trình tự amino acid giữa trypsin và chymotrypsin (Steitz và các cộng sự 1969, Cohen và các cộng sự 1981, Asbóth và Polgár 1983 và Gráf và các cộng sự 1988).
Vào những năm 1990, chymotrypsin đã được tinh chế từ các nguồn khác bao gồm cá tuyết Đại Tây Dương (Ásgeirsson và Bjarnason 1991) và lạc đà (Al-Ajlan và Bailey 1997). Công việc cũng bắt đầu điều tra các chất ức chế (Baek và các cộng sự 1990), và Frigerio và các cộng sự làm sáng tỏ cấu trúc tinh thể của chymotrypsin bò đến độ phân giải 2.0 Å (Frigerio và các cộng sự 1992).
Nghiên cứu gần đây đã điều tra sự gấp và biến tính của chymotrypsin ở một khoảng nồng độ (Ghaouar và các cộng sự 2010), tương tác của chymotrypsin với cơ chất hạt nano (You và các cộng sự 2006 và Jordan và các cộng sự 2009), và tăng tính ổn định của chymotrypsin bằng liên kết các phân tử PEG (Castellanos và các cộng sự 2005 và Rodríguez-Martínez và các cộng sự 2009).
Dược lực học
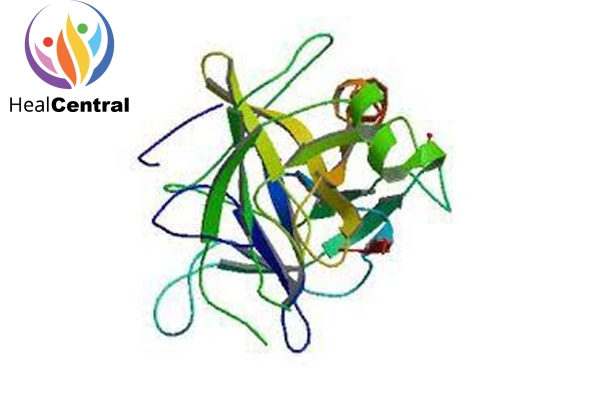
Alphachymotrypsin là một dạng của chymotrypsin, loại dùng làm thuốc là chymotripsinogen từ tụy bò được hoạt hóa. Đây là một enzyme chịu trách nhiệm thủy phân một phần chuỗi polypeptide tạo thành các peptide mạch ngắn hơn. Enzyme này cắt chọn lọc vị trí liên kết peptide như hình dưới.
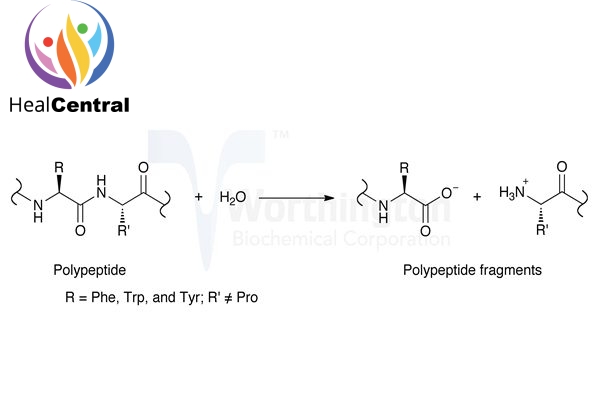
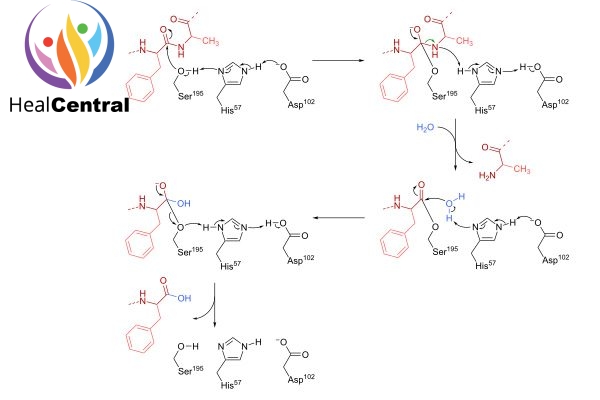
Phản ứng xúc tác thủy phân xảy ra ban đầu theo cơ chế cộng hợp ái nhân. Một nhóm ái nhân (nucleophile) là nhóm hydroxy (-OH) của serine 195 tấn công nhóm carbonyl (=CO) trong liên kết peptide, nhanh chóng tạo liên kết hóa trị với cơ chất, tạo thành hợp chất trung gian. Cùng với histidine 57 và acid aspartic 102, chúng trở thành bộ ba trong trung tâm hoạt động của enzyme.
Phản ứng của chymotrypsin với cơ chất diễn ra trong hai giai đoạn, pha đầu “bùng nổ” khi bắt đầu phản ứng và pha cân bằng theo động học Michaelis-Menten. Cách thức hoạt động của chymotrypsin được giải thích khi quá trình thủy phân diễn ra theo hai bước. Đầu tiên, acyl hóa cơ chất để tạo thành chất trung gian acyl enzyme, sau đó deacyl hóa để đưa enzyme trở lại trạng thái ban đầu. Cụ thể các bước phản ứng được diễn giải trên hình. Ngoài ra, các amino acid 189-195, 214-220, và 225-228 tạo thành một túi liên kết với cơ chất chính gọi là túi S1.
Alphachymotrypsin còn có tác dụng thủy phân ester và amide trong ống nghiệm. Do đó người ta sử dụng N-acetyl-L-phenylalanine p-nitrophenyl amide là chất tương tự cơ chất để xét nghiệm enzyme.
Hoạt động của alphachymotrypsin đã được nghiên cứu với sự có mặt đồng thời của hai cơ chất khác nhau, mỗi chất có trong hỗn hợp phản ứng ở nồng độ bão hòa. Hỗn hợp của hai ester bị thủy phân ở tốc độ trung gian giữa tốc độ thủy phân của mỗi ester khi có mặt một mình, cho thấy trong trường hợp này đã xảy ra thủy phân cạnh tranh. Ngược lại, tốc độ thủy phân trong hỗn hợp casein với gelatin hoặc protein với ester bằng tổng tốc độ thủy phân các cơ chất riêng biệt, cho thấy trong các trường hợp này các chất được thủy phân độc lập, không cạnh tranh. Các nghiên cứu về tác dụng của chất ức chế đậu nành trên chymotrypsin chỉ ra rằng cơ chế ức chế với cơ chất là protein khác với khi sử dụng ester, cung cấp thêm bằng chứng cho thấy alphachymotrypsin phản ứng khác nhau với ester và protein. Những kết quả này chỉ ra rằng nếu chymotrypsin tạo thành các phức cụ thể với cơ chất của nó, thì nó phải có ít nhất ba trung tâm hoạt động riêng biệt. Tuy nhiên, có bằng chứng hóa học độc lập cho thấy các hoạt tính phân giải protein và ester của enzyme này nằm trong cùng một trung tâm hoạt động. Nếu điều này là đúng, các quan sát thử nghiệm được báo cáo ở đây không thể giải thích được trừ khi enzyme này không tạo thành phức hợp Michaelis cụ thể với cơ chất của nó.
Một số thử nghiệm lâm sàng

Thử nghiệm lâm sàng ngẫu nhiên đánh giá hiệu quả và khả năng dung nạp của trypsin : chymotrypsin khi so sánh với serratiopeptidase và trypsin : bromelain : rutoside trong quản lí vết thương.
Liệu pháp enzyme toàn thân có thể đóng một vai trò quan trọng trong việc duy trì các quá trình viêm bình thường trong cơ thể và do đó giúp hỗ trợ và tăng tốc độ chữa lành ổ viêm. Trong hoạt động chống viêm, các enzyme thủy phân các tế bào hoại tử và thông qua việc vô hiệu hóa các chất trung gian và các sản phẩm độc hại, chúng giúp giảm phù nề và giảm đau.
Nghiên cứu được thực hiện tại Đại học Y khoa Grant, Mumbai, Ấn Độ là một thử nghiệm lâm sàng so sánh hiệu quả và khả năng dung nạp của ba nhóm thuốc enzyme dùng đường uống là trypsin : chymotrypsin (TC) (Chymoral Forte), viên nén serratiopeptidase (S) 5 mg dùng đường uống và viên nén dùng đường uống chứa trypsin 48 mg, bromelain 90 mg, và rutoside 100 mg (TBR) để đánh giá khả năng chữa lành vết thương của chúng trong vết thương sau phẫu thuật chỉnh hình.

Kết quả: Tổng cộng có 75 bệnh nhân được sàng lọc, chọn ngẫu nhiên và chia thành ba nhóm theo tỷ lệ 1:1:1 nhận 1 trong 3 phương pháp điều trị. Ở nhóm sử dụng TC, ban đỏ đã giảm đáng kể từ 3.44 vào ngày 3 xuống còn 1.16 vào ngày 10 (P < 0.01). Có sự giảm đáng kể điểm số ban đỏ ở nhóm sử dụng TC so với nhóm sử dụng S và TBR (P < 0.05) ở mỗi lần tái khám. Tương tự giảm kích thích tại chỗ, chảy mủ vết thương, phù nề, sự cứng lại và điểm nhạy cảm khi kết thúc điều trị bằng TC cuối nghiên cứu cao hơn đáng kể so với quan sát ở hai nhóm còn lại. Ngoài ra, TC cho thấy giảm đau đáng kể trên thang điểm VAS (P < 0.01). Đánh giá toàn cầu về đáp ứng trị liệu về hiệu quả và khả năng dung nạp được báo cáo từ tốt đến xuất sắc ở 88% và 92% bệnh nhân dùng TC so với 12% và 8% bệnh nhân dùng S và 12% và 8% bệnh nhân dùng TBR.
Kết luận: TC là giải pháp tốt hơn cho các triệu chứng viêm sau phẫu thuật chỉnh hình so với S và TBR, tạo điều kiện chữa lành tổn thương tốt hơn.
Dược động học
Hiện nay các dữ liệu dược động học của alphachymotrypsin chưa có sẵn.
Chỉ định và liều dùng
Các trường hợp viêm, phù nề do chấn thương, tai nạn, phẫu thuật, áp xe:
8.4 mg (thường tương đương 2 viên uống)/lần x 3-4 lần/ngày.

Với các thuốc dùng đường khác: Dùng theo chỉ định cụ thể của bác sĩ.
Đặc biệt thuốc được biết không độc với thận và gan nên có thể dùng ở những bệnh nhân chức năng gan hoặc thận suy giảm thay cho nhóm NSAIDs.
Làm tan dây chằng mảnh trong phẫu thuật nhãn khoa: Hiện nay không dùng nữa.
Tác dụng phụ
Rối loạn tiêu hóa: Đau bụng, đầy hơi, khó tiêu, buồn nôn, nôn, tiêu chảy, táo bón… nhưng ít gặp.
Phản ứng dị ứng: Phát ban, ngứa, đỏ, nặng hơn là phù mạch, sốc phản vệ (hiếm gặp). Thường xảy ra khi dùng thuốc đường tiêm, chưa thấy xảy ra với đường uống.
Tăng nhãn áp tạm thời, viêm màng bồ đào: Chỉ xảy ra với chế phẩm nhỏ mắt khi phẫu thuật nhãn khoa.
Rối loạn đông máu: Nguy cơ xuất huyết tăng lên.
Lưu ý và thận trọng
Thận trọng với các phản ứng dị ứng có thể xảy ra, người có tiền sử dị ứng, đặc biệt là các sản phẩm có nguồn gốc từ bò. Có thể test thử dị ứng trước khi sử dụng thuốc nếu cần.
Thận trọng với bệnh nhân glaucom nếu phải sử dùng chế phẩm đường nhỏ mắt.
Thận trọng với bệnh nhân bị rối loạn đông máu.
Thận trọng với bệnh nhân mắc hội chứng thận hư, khí phế thũng, COPD (bệnh phổi tắc nghẽn mạn tính).
Phụ nữ mang thai và đang cho con bú: Có thể sử dụng được.
Tương tác thuốc
Dùng cùng acetylcystein: Không khuyến nghị. Tác dụng hiệp đồng làm loãng đờm có thể gây bít đường thở bệnh nhân.
Dùng cùng các thuốc chống đông máu (wafarin…): Tăng nguy cơ chảy máu.
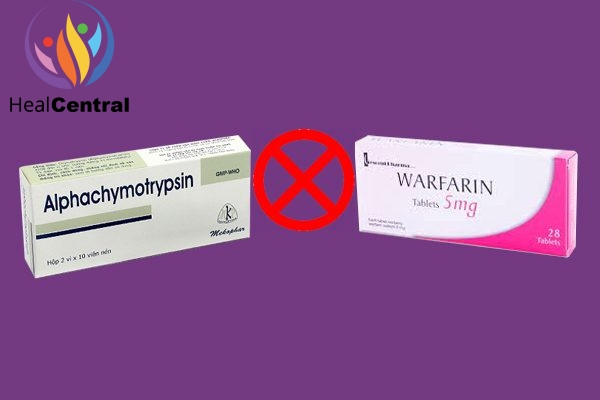
Chống chỉ định
Quá mẫn cảm với alphachymotrypsin hoặc bất cứ thành phần nào của thuốc.
Bệnh nhân thiếu hụt enzyme α1-antitrypsin.
Tài liệu tham khảo:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC528565/




Thưa dược sĩ, cháu muốn hỏi dược sĩ là sự khác nhau về tác dụng kháng viêm của alphachymotrypsin và medrol là gì ạ ?
Alphachymotrypsin là chất chống phù nề và kháng viêm dạng men, Medrol là kháng viêm Corticoid.