Bài viết Bình minh của thông khí vòng kín sinh lý – Tổng quan được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: The dawn of physiological closed-loop ventilation – a review
Tóm tắt
Mức độ tự động hóa trong thông khí cơ học đã tăng đều đặn trong vài thập kỷ qua. Gần đây đã có sự quan tâm mới trong kiểm soát vòng kín sinh lý (PCLC, physiological closed-loop control) của thông khí. Sự phát triển của các hệ thống này đã đi theo một con đường tương tự như thông khí lâm sàng thủ công, bắt đầu bằng việc đảm bảo trao đổi khí tối ưu và chuyển sang phòng ngừa tổn thương phổi do máy thở. Các hệ thống hiện đang nhắm đến bao gồm cả hai khía cạnh và các hệ thống thương mại ban đầu đang xuất hiện. Những phát triển này vẫn chưa được biết đến với nhiều bác sĩ lâm sàng và do đó, hạn chế việc áp dụng chúng vào môi trường lâm sàng. Tổng quan này cho thấy sự tiến hóa của kiểm soát vòng kín sinh lý của thở máy.
Giới thiệu
Các hệ thống vòng kín được thiết kế để tự động điều chỉnh một biến (variable) đã cho xung quanh điểm đặt (set point) mong muốn. Các ví dụ quanh cuộc sống hàng ngày của chúng ta, từ kiểm soát hành trình duy trì tốc độ chính xác trên đường cao tốc, đến tự động lái máy bay hiện đại một cách an toàn.
Các hệ thống y tế hiện đại đang ngày càng kết hợp những tiến bộ công nghệ này. Các ứng dụng y tế của kiểm soát vòng kín có thể được chia thành các hệ thống kiểm soát một biến vật lý của thiết bị y tế và các hệ thống kiểm soát một biến sinh lý của bệnh nhân [1]. Nhiều thiết bị y tế đã kết hợp các hệ thống kiểm soát vòng kín bên trong thiết bị. Một ví dụ là quy định nội bộ của nồng độ oxy hít vào đến giá trị được đặt ra bởi bác sĩ lâm sàng. Nếu có một số tương tác ngược giữa bệnh nhân và thiết bị y tế, hệ thống sẽ hướng đến bệnh nhân. Việc kiểm soát áp lực đường thở trong quá trình thông khí kiểm soát áp lực là một ví dụ như vậy, bởi vì có sự tương tác giữa thiết bị và bệnh nhân. Ở đây, bộ kiểm soát cũng tập trung vào thiết bị y tế.
Điều chỉnh một biến số sinh lý của bệnh nhân được gọi là kiểm soát vòng kín sinh lý (PCLC). Với sự theo dõi sinh lý rộng rãi trong môi trường lâm sàng ngày nay, PCLC đang trở nên phổ biến hơn bao giờ hết. Trong trường hợp này, bệnh nhân là trọng tâm của vòng kiểm soát và phép đo sinh lý được đưa trở lại bộ kiểm soát. PCLC gần đây đã được các cơ quan quản lý đưa lên, với một tiêu chuẩn quốc tế được phát triển riêng cho nó, cụ thể là tiêu chuẩn IEC 60601-1-10 [2] và một hội thảo công cộng do Cục Quản lý Thực phẩm và Dược phẩm tổ chức vào năm 2015 với Nhà xuất bản Parvinian et al. năm 2018 [3].
Điều quan trọng, PCLC cho phép tự động hóa một số nhiệm vụ trị liệu hiện đang được thực hiện bởi nhân viên y tế. Chăm sóc khẩn cấp và đặc biệt được cho là được hưởng lợi từ sự tự động hóa gia tăng, vì những môi trường căng thẳng cao độ này có lực lượng lao động bị thu hẹp, như dự kiến của Angus et al. [4]. Nguồn cung nhân viên y tế hạn chế này, cùng với thực hành sử dụng nhiều lao động để cài đặt máy thở chính xác [5, 6] có nghĩa là việc chăm sóc bệnh nhân đúng cách, được cá nhân hóa sẽ trở nên khó khăn hơn trong tương lai. Chi phí cao để giữ bệnh nhân trên máy thở [7, 8] cũng sẽ tăng hơn nữa. Nếu một số cài đặt máy thở được điều chỉnh tự động, điều này sẽ tăng thời gian và công suất của nhân viên y tế.
Mặc dù đã lấy lại được sự chú ý gần đây, PCLC của thông khí cơ học cũng đã tồn tại hơn nửa thế kỷ. Tương tự như các hướng dẫn về thở máy đã phát triển theo thời gian, từ tập trung vào trao đổi khí tối ưu đến giảm tổn thương phổi do máy thở [9], có thể thấy một xu hướng tương tự trong nghiên cứu về PCLC cho thở máy. Tổng quan này nhằm mục đích cho thấy sự phát triển của PCLC của thở máy và mối quan hệ chặt chẽ với các mục tiêu lâm sàng của thở máy.
Phạm vi và định nghĩa
Các tiêu chí tìm kiếm cho bài viết này là như sau. Đầu tiên, tài liệu liên quan được xác định từ các kết hợp tìm kiếm cơ sở dữ liệu của các từ khóa: vòng kín, kiểm soát, phản hồi và tự động hóa kết hợp với thông khí, thông khí cơ học và thông khí nhân tạo. Thứ hai, việc tìm kiếm được thu hẹp chỉ bao gồm các hệ thống sử dụng các biến số sinh lý dành riêng cho bệnh nhân để kiểm soát phản hồi. Các biến số sinh lý có thể được gộp lỏng lẻo thành oxy, carbon dioxide, cơ học hô hấp và nhu cầu của bệnh nhân. Thứ ba, giai đoạn cai máy cho đến nay được hưởng lợi nhiều nhất từ tự động hóa và do đó được thêm vào như một từ khóa tìm kiếm bổ sung. Cuối cùng, chỉ có tài liệu bao gồm các nghiên cứu với bệnh nhân hoặc động vật trung bình/lớn được đưa vào. Tài liệu bổ sung mở rộng về các phương pháp lý thuyết và kết quả mô phỏng tồn tại, nhưng những điều này vẫn cần được xác nhận bằng thực nghiệm.
Hơn nữa, các đánh giá trước đây về thông khí cơ học vòng kín tồn tại và cung cấp thêm tài liệu liên quan. Brunner đã trình bày một bản thảo đầu tiên quan trọng mô tả lịch sử và các nguyên tắc của thông khí vòng kín [10]. Nhận xét về kiểm soát vòng kín tiên tiến trong thông khí cơ học đã được cung cấp bởi Lellouche et al. [11], Wysocki et al. [12] và Branson [13].
Để trình bày một đánh giá chính xác, các chế độ thông khí và kiểu thở không được thảo luận; những điều này đã được đề cập ở nơi khác, (ví dụ, Chatbrun et al. [14]). Ngoài ra, các phương pháp thông khí khác, chẳng hạn như thông khí lỏng (liquid ventilation), tiếng ồn (noisy ventilation) và thông khí tần số cao (high- frequency ventilation), nằm ngoài phạm vi của bài viết này.
Khái niệm về thông khí vòng kín sinh lý
Mục tiêu chính của thông khí cơ học là khắc phục và duy trì trao đổi khí đầy đủ. Thông khí bảo vệ cho bệnh nhân thở máy đã trở thành một mục tiêu quan trọng khác trong thở máy. Thực hành lâm sàng hiện nay để chọn cài đặt máy thở là rất phức tạp và dựa trên kiến thức chuyên môn. Các bác sĩ lâm sàng hiện đại dựa vào các biến số sinh lý cổ điển để thở máy, chẳng hạn như bão hòa oxy mao mạch ngoại biên (SpO2), CO2 cuối triều (etCO2) và phân tích khí máu (PaO2, PaCO2, pH). Ngoài ra, các bác sĩ lâm sàng xem xét các hướng dẫn bảo vệ, các thông số huyết động (nhịp tim, huyết áp, tưới máu) và các biến xuất phát như tỷ lệ P/F, sự khác biệt áp lực riêng phần oxy phế nang-mao mạch (PA-aDO2), shunt, áp lực xuyên phổi và năng lượng cơ học, trong số những thứ khác [9].
Sự tương tác giữa bác sĩ lâm sàng, máy thở và bệnh nhân tạo thành một hệ thống vòng kín thủ công hoặc hệ thống bác sĩ lâm sàng trong vòng lặp (“clinician-in-the-loop” system). Điều này được thể hiện trong sơ đồ khối trong Hình 1. Ở đây, bác sĩ lâm sàng đóng vai trò là người kiểm soát và so sánh các phép đo sinh lý và dẫn xuất có sẵn với một mục tiêu kiểm soát xác định trước khi quyết định cài đặt máy thở thích hợp (truyền động).
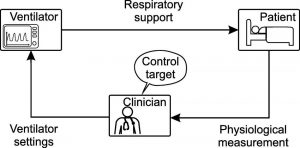
Hệ thống bác sĩ lâm sàng này tốn nhiều công sức và thời gian, vì sự hiện diện của bác sĩ lâm sàng là luôn luôn cần thiết. Cần có sự chú ý đầy đủ của bác sĩ lâm sàng để điều chỉnh cài đặt máy thở nếu trạng thái bệnh nhân thay đổi và để đáp ứng nhu cầu điều trị mới. Nếu bác sĩ lâm sàng không có mặt, hệ thống sẽ trở thành một hệ thống vòng hở, không thể đáp ứng nếu oxy hoặc thông khí không đủ do tình trạng bệnh nhân xấu đi hoặc rối loạn bên ngoài. Điều này có thể dẫn đến bệnh nhân được thông khí kém và không được thông khí bảo vệ, với những hậu quả thảm khốc có thể xảy ra.
Đặc điểm của thông khí vòng kín
Hệ thống vòng kín tự động (automated closed-loop system) (còn được gọi là kiểm soát phản hồi) (feedback control) có thể được tiến hành để giữ bệnh nhân ở một mục tiêu được chỉ định và đáp ứng với các rối loạn mà không cần sự hiện diện của bác sĩ lâm sàng. Dưới đây, một bộ kiểm soát đảm nhận nhiệm vụ điều chỉnh các cài đặt máy thở. Vòng kiểm soát mới được mô tả trong hình 2 và hiển thị phép trừ của giá trị đo được từ giá trị đích và lỗi được đưa vào bộ kiểm soát. Sau đó, bộ kiểm soát sẽ tự động quyết định cài đặt máy thở chính xác để giảm thiểu lỗi.
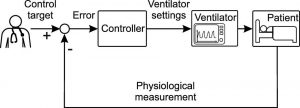
Điều quan trọng, bác sĩ lâm sàng tập trung vào việc thay đổi lựa chọn các mục tiêu được cá nhân hóa, điều chỉnh các biến bổ sung cho thông khí, chẳng hạn như huyết động học và dịch truyền, và theo dõi hệ thống. Cần lưu ý rằng các hệ thống PCLC hiện tại giới hạn dữ liệu đo lường của chúng ở các biến thông khí cổ điển, như sẽ được trình bày sau. Đánh giá xuất phát, chẳng hạn như tỷ lệ P/F, stress và strain, hoặc tương tác tim-phổi, chưa được sử dụng.
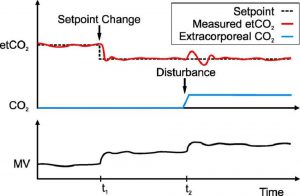
Các mục tiêu của một hệ thống vòng kín tự động có thể được chia thành theo dõi điểm đặt và loại bỏ nhiễu. Trong hầu hết các trường hợp, kiểm soát điểm đặt chỉ có liên quan khi bật bộ kiểm soát, vì nó mô tả phản ứng động của hệ thống cho đến khi đạt được mục tiêu. Thay đổi điểm đặt là rất hiếm trong môi trường lâm sàng. Ví dụ, mục tiêu SpO2 có thể ở mức 88-95% và hiếm khi thay đổi. Tuy nhiên, sự ngăn ngừa xáo trộn là anh hùng thực sự trong PCLC, vì nó liên quan đến phản ứng của hệ thống đối với các xáo trộn và đưa bệnh nhân trở lại phạm vi mục tiêu. Rối loạn có thể có nhiều hình thức khác nhau, cả bên trong (bệnh nặng hơn, cứng phổi, tăng sản xuất CO2) và bên ngoài (ngắt kết nối, nhiệt độ phòng). Hai mục tiêu được hiển thị cho một ví dụ minh họa trong Hình 3, với thay đổi điểm đặt ở t1 và nhiễu (tăng cực nhiều CO2) ở t2.
Sự phát triển của kiểm soát sinh lý tự động có thể được phân loại theo hai trình kiểm soát: mục tiêu kiểm soát và thiết kế bộ kiểm soát. Mục tiêu kiểm soát được quyết định một mặt bằng các phép đo và cảm biến có sẵn, một số trong đó đã được mô tả ở trên. Mặt khác, việc thay đổi bằng chứng lâm sàng và hướng dẫn đưa ra các mục tiêu kiểm soát mới. Trình kiểm soát thứ hai, thiết kế bộ kiểm soát, vẫn là một vấn đề kỹ thuật và nằm ngoài phạm vi của bài viết này. Một tổng quan ngắn gọn được đưa ra ở đây chỉ để tạo điều kiện cho sự hiểu biết. Một sự phát triển tự nhiên về sự phức tạp của các bộ kiểm soát đi kèm với việc sử dụng máy tính và khả năng tính toán ngày càng tăng của chúng, và mô hình chi tiết của hệ hô hấp, được sử dụng để kiểm tra và tổng hợp bộ kiểm soát.
Bộ kiểm soát tỷ lệ, tích phân và đạo hàm (PID, proportional, integral, and derivative) đơn giản ban đầu được sử dụng [15, 16]. Tổng kết hành động PID này là bộ kiểm soát phổ biến nhất được sử dụng trong hầu hết các ngành công nghiệp hiện nay. Điều chỉnh (thiết lập bộ kiểm soát này) là tĩnh, có nghĩa là bộ kiểm soát cần được điều chỉnh cho mọi bệnh nhân. Để khắc phục điều này, có thể sử dụng các bộ kiểm soát thích ứng [17-19], thay đổi các tham số của bộ kiểm soát để thích ứng với bệnh nhân hoặc kịch bản. Một mô hình toán học của hệ thống là cần thiết cho việc này, nhưng những tiến bộ gần đây trong mô hình hệ thống hô hấp đã cho phép sử dụng ngày càng tăng của chúng. Bộ kiểm soát tối ưu cố gắng giải quyết vấn đề tối ưu hóa, chẳng hạn như tối thiểu hóa hàm chi phí, trong việc tính toán biến số truyền động [20]. Kiểm soát dự báo mô hình (MPC, Model predictive control) là một ví dụ khác về bộ kiểm soát tiên tiến sử dụng mô hình động của hệ thống [21, 22]. Nó tối ưu hóa các cài đặt máy thở hiện tại cho trạng thái hiện tại, đồng thời dự đoán các sự kiện trong tương lai. Cuối cùng, cũng đã tăng cường sử dụng kiểm soát mờ [23, 24]. Bộ kiểm soát mờ (fuzzy controller) là một luật kiểm soát dựa trên quy tắc, trong đó các quy tắc ngôn ngữ (ví dụ: quy tắc if-then-other) được làm mờ (blurred) để làm cho kiểm soát linh hoạt hơn. Các hệ thống này rất phổ biến trong môi trường lâm sàng, vì kiến thức chuyên môn dựa trên ngôn ngữ của các bác sĩ lâm sàng được chuyển vào thiết kế của bộ kiểm soát (không phải là trường hợp trong kiểm soát PID). Bộ kiểm soát mạnh mẽ hơn có thể được giới thiệu trong tương lai. Chúng được thiết kế với sự không chắc chắn trong tâm trí và có thể kiểm soát hiệu suất của hệ thống ngay cả trong trường hợp xấu nhất.
Lịch sử kiểm soát vòng kín sinh lý
PCLC của thông khí bao gồm một loạt các mục tiêu kiểm soát. Chúng có thể được gộp thành các bộ kiểm soát tập trung vào trao đổi khí, cơ học phổi (thông khí bảo vệ), nhu cầu của bệnh nhân và tự động hóa các giao thức lâm sàng.
Kiểm soát dựa trên trao đổi khí
Ứng dụng đầu tiên của PCLC trong thở máy đã được trình bày bởi Saxton vào năm 1953, với một ấn phẩm xuất hiện vào năm 1957 [15], trong đó nhóm của ông đã áp dụng kiểm soát phản hồi cho phổi sắt để điều chỉnh etCO2. Trong cùng một thập kỷ, Frumin đã phát triển một hệ thống gây mê tự động, kết hợp hệ thống kiểm soát phản hồi etCO2 [16, 25]. Cả hai hệ thống đều sử dụng áp lực thông khí làm biến số kích hoạt và có thể giữ CO2 cuối triều ở mục tiêu đã đặt.
Năm 1971, Mitamura et al. đã kiểm soát CO2 thở ra hỗn hợp bằng cả thể tích khí lưu thông (VT) và tần số thở (f) [20]. Hệ thống của họ đã có thể giữ PCO2 ở mục tiêu, ngay cả khi nạp CO2 ngoài cơ thể. Các nhóm khác tập trung vào cài đặt VT hoặc f tự động, với bác sĩ lâm sàng cài đặt biến khác theo cách thủ công [26, 27]. Kiểm soát kỹ thuật số sử dụng máy tính để kiểm soát CO2 bắt đầu với Coles et al. vào năm 1973 [26], và số lượng ấn phẩm về kiểm soát phản hồi trong thông khí tăng lên. Coles et al. cho thấy hệ thống PCLC duy trì etCO2 ở mục tiêu tốt hơn so với kiểm soát thủ công [26].
Sự sẵn có của các cảm biến nội mạch để đo pH hoặc PaCO2 đã giới thiệu các hệ thống kiểm soát vòng kín mới. Schulz et al. đã sử dụng cảm biến và kiểm soát phản hồi như vậy để đáp ứng với thay đổi điểm đặt trong PaCO2 [28]. Tuy nhiên, động lực phản hồi của hệ thống của họ bị hạn chế bởi thời gian phản hồi chậm của cảm biến. Một vấn đề cảm biến tương tự gây ra hệ thống của Coon et al. [29] dao động. Tuy nhiên, các cảm biến nội mạch liên tục không thể có sẵn trên thị trường và việc sử dụng chúng đã chấm dứt. Không có bất kỳ sự thay thế lâm sàng nào, việc kiểm soát CO2 một lần nữa dựa trên phép đo etCO2. Tuy nhiên, sự khác biệt ngày càng tăng giữa PaCO2 và etCO2 trong phổi bệnh lý đòi hỏi phải bù [20, 28, 30]. Phương pháp tiếp cận dựa trên các nguyên tắc đầu tiên để liên kết etCO2 và PaCO2 đã được trình bày bởi Ohlson et al. [30], nhưng các tác giả không thể bù một cách chính xác khi xuất hiện một biến thiên lớn của cung lượng tim.
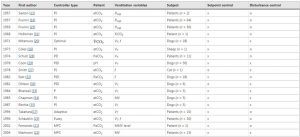
Một danh sách đầy đủ các hệ thống kiểm soát phản hồi CO2 (hệ thống kiểm soát thông khí) trong 50 năm qua được trình bày trong Bảng 1. Tất cả các hệ thống được trình bày cho đến nay đều bị giới hạn trong các nghiên cứu bằng chứng.
Trọng tâm chủ yếu tập trung vào việc kiểm soát CO2 cho đến đầu những năm 1970, nhưng vào năm 1975, Mitamura [36] đã phát triển một hệ thống kiểm soát kép cho cả CO2 và O2. Ở đây, SpO2 được đo bằng máy đo trái tai và bộ kiểm soát bật tắt được sử dụng để thay đổi hàm lượng oxy hít vào. Bộ kiểm soát đã có thể khắc phục tình trạng thiếu oxy.
Chỉ kiểm soát oxy được thực hiện ở trẻ non tháng bởi Beddis et al. [37] năm 1979; điều này đã được thực hiện bằng cách sử dụng cảm biến điện cực oxy bên trong động mạch rốn. Để đánh giá hệ thống của họ, họ đã so sánh thời gian dành cho mục tiêu oxy hóa bằng bộ kiểm soát với hệ thống bác sĩ lâm sàng. Số liệu này cũng được sử dụng bởi những người khác [38-44] và hệ thống tự động tốt hoặc tốt hơn so với quy trình thủ công trong mọi trường hợp.
Yu et al. sau đó sử dụng một máy đo oxy trên lưỡi để kiểm soát quá trình oxy hóa và thực hiện một bộ kiểm soát thích nghi ở chó [19]. Hệ thống này đã có thể khắc phục tình trạng thiếu oxy và bù đắp cho các rối loạn, chẳng hạn như thay đổi PEEP và thông khí một phổi. Năm 1991, East et al. [45] đã sử dụng cả FiO2 và PEEP để kiểm soát PaO2. Việc thay đổi FiO2 hay PEEP được dựa trên các phác đồ lâm sàng trước đó và hệ thống giữ cho bệnh nhân ở mục tiêu oxy hóa trong tối đa 6 giờ [45].
Tài liệu tiếp theo về kiểm soát oxy được tóm tắt trong Bảng 2. Kiểm soát oxy bằng cách sử dụng FiO2 vẫn là một lĩnh vực nghiên cứu tích cực, đặc biệt là ở trẻ sơ sinh. Một đánh giá gần đây về kiểm soát oxy đã được Claure và Bancalari công bố vào năm 2013 [46]. Các hệ thống được trình bày bởi Claure et al. [41], Urschitz et al. [42] và Gajdos et al. [44] đã được phát triển hơn nữa và hiện có bán trên thị trường với tên gọi là Avea-CLiO2 (CareFusion, Yorba Linda, CA, USA), CLAC (Löwenstein Medical GmbH & Co. Gackenbach, Đức), tương ứng.
Điều quan trọng, việc kiểm soát oxy chủ yếu chỉ giới hạn ở việc chỉ sử dụng FiO2. Điều này phản ánh chặt chẽ những khó khăn lâm sàng trong việc lựa chọn chính xác PEEP không chỉ bởi vì oxy đơn thuần không phải là phép đo đáng tin cậy của PEEP tốt.
Một nhược điểm lớn của hầu hết các chiến lược thông khí vòng kín được trình bày là chúng chỉ tập trung vào trao đổi khí và không xem xét cơ học phổi và định lượng tác hại. Trên thực tế, việc đạt được kiểm soát CO2 thích hợp có thể đòi hỏi VT hoặc áp lực hít vào đỉnh quá mức, có thể gây tổn thương phổi do máy thở (VILI). Với các chiến lược thông khí lâm sàng trở nên tập trung vào việc bảo vệ và ngăn ngừa VILI, yêu cầu này cũng cần được đưa vào kiểm soát vòng kín. Do đó, kiểm soát xem xét cơ học phổi được trình bày tiếp theo.
Kiểm soát xem xét cơ học phổi
Mitamura et al. coi việc giảm thiểu công thông khí là mục tiêu xa hơn của bộ kiểm soát của họ sớm nhất là năm 1971 [20]. Ý tưởng có liên quan chặt chẽ với ý tưởng của Otis et al. [50] từ năm 1950, điều này cho thấy tồn tại sự kết hợp tối ưu giữa nhịp thở và thể tích khí lưu thông cho công hô hấp tối thiểu. Cách tiếp cận này cũng được sử dụng bởi Tehrani [51] và Laubcher [52] vào năm 1991 và 1994, tương ứng. Laubcher et al. cho thấy bộ kiểm soát của họ có thể thích ứng với cơ chế hô hấp cá nhân trong một nghiên cứu trên sáu bệnh nhân.

Laubcher và các đồng nghiệp đã nâng cấp bộ kiểm soát thông khí phổi thích ứng (ALV) (1994) lên phiên bản mới hơn gọi là thông khí hỗ trợ thích ứng (ASV). Arnal et al. [53] đã thử nghiệm bộ kiểm soát ASV trên 243 bệnh nhân với các tình trạng phổi hô hấp khác nhau và cho thấy khả năng của bộ kiểm soát trong việc lựa chọn các kết hợp VT-f liên quan đến cơ học phổi cá nhân hóa thực tế.
Rudowski et al.. [54] đã giải quyết mối quan tâm của VILI trực tiếp với chỉ số công suất hô hấp tối đa (peak respiratory power index), như một chỉ số về chấn thương phổi, năm 1991. Bộ kiểm soát của họ điều chỉnh cài đặt máy thở để giảm chỉ số công suất hô hấp, trong khi vẫn đảm bảo trao đổi khí đầy đủ. Một nghiên cứu với sáu bệnh nhân cho thấy kết quả đầy hứa hẹn.
Nhiều hệ thống hiện đại không trực tiếp kiểm soát máy thở bằng cơ học phổi, mà áp dụng các giới hạn cứng để đảm bảo rằng thể tích và áp lực khí lưu thông nằm trong giới hạn nhất định, dựa trên bằng chứng.
Kiểm soát dựa trên nhu cầu của bệnh nhân
Điều cũng quan trọng cần lưu ý ở đây là phần lớn các tài liệu được trình bày cho đến nay chỉ xem xét thông khí có kiểm soát (bắt buộc), tức là, bệnh nhân bị động. Tuy nhiên, trong nhiều trường hợp, bệnh nhân được phép hoặc dự kiến thở tự nhiên, có nghĩa là nhu cầu của bệnh nhân trở nên quan trọng. Công việc ban đầu được thực hiện bởi Younes et al. với thông khí hỗ trợ tỷ lệ (PAV) năm 1992 [55]. Hệ thống kiểm soát phản hồi tích cực này đã khuếch đại nỗ lực của bệnh nhân, theo cơ chế hô hấp và mức độ hỗ trợ do người vận hành đặt ra. Điều này đảm bảo đồng bộ, trong khi tự động thích ứng với tải bệnh nhân. Đối với phiên bản ban đầu của PAV, bác sĩ lâm sàng yêu cầu kiến thức về cơ học hô hấp của bệnh nhân để thiết lập mức tăng kiểm soát thích hợp, nhưng phiên bản mới hơn, được gọi là PAV+, tự động ước tính cơ học hô hấp một mình [56, 57].
Năm 1996, Iotti et al. đề xuất thông khí kiểm soát vòng kín P0.1, theo đó giảm áp lực tắc đường thở trong 0,1 giây đầu tiên được sử dụng để ước tính công của bệnh nhân [58]. Hai bộ kiểm soát độc lập, một cho P0.1 và một cho thể tích phế nang, được đưa vào một thuật toán kiểm soát hợp nhất làm thay đổi mức hỗ trợ áp lực. Các tác giả cho thấy hoạt động hít vào của bệnh nhân có thể được ổn định ở mức mong muốn bằng cách sử dụng P0.1, do đó cho phép giảm tải các cơ hô hấp.
Một khớp nối trực tiếp với đầu ra thần kinh sinh lý của hệ hô hấp sẽ hữu ích cho việc hỗ trợ tối ưu trong quá trình thở tự nhiên. Một nỗ lực kết hợp máy hô hấp với hoạt động thần kinh cơ hoành đã được thực hiện vào năm 1970 trên động vật [59], nhưng điều này không khả thi ở người. Thay vào đó, Sinderby et al. [60] đã sử dụng hoạt động điện cơ hoành (Eadi, diaphragmatic electrical activity) cho khớp nối thông khí thần kinh để điều chỉnh mức độ hỗ trợ thông khí. Hệ thống này đòi hỏi phải đặt ống thông thực quản. Hệ thống này có sẵn trên thị trường dưới dạng hỗ trợ thông khí điều chỉnh thần kinh (NAVA, neurally adjusted ventilatory assist) (Maquet Critical Care AB, Solna, Thụy Điển). Cải thiện đồng bộ bệnh nhân – máy thở cho hệ thống này được thể hiện bởi tài liệu [61], nhưng các tác giả lưu ý rằng tác động lâm sàng của chúng vẫn cần được xác định.
Tự động hóa các giao thức lâm sàng
Đã có nhiều cách tiếp cận khác nhau để tin học hóa các phác đồ lâm sàng mà nhân viên y tế sử dụng để điều chỉnh các thiết lập máy thở cơ học. Các hệ thống hỗ trợ quyết định trên máy vi tính này không tạo ra các thay đổi tích cực đối với máy thở mà chỉ đề xuất thay đổi; bác sĩ lâm sàng phải có mặt để thực hiện thay đổi và, do đó, họ đại diện cho các hệ thống lâm sàng cổ điển. Một đánh giá tài liệu của các hệ thống này được đưa ra trong [62].
Pomprapa et al. tự động hóa giao thức ARDSNet (autoARDSNet) và thử nghiệm hệ thống trong một nghiên cứu thử nghiệm với bảy con lợn [63]. Hệ thống giữ cho động vật ở các mục tiêu oxy hóa và pH trong thời gian 4 giờ, thậm chí bù cho sự mất kết nối giữa máy thở và bệnh nhân.
Hệ thống tự động cao
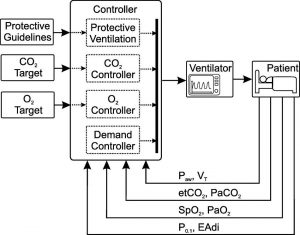
Học viện và ngành công nghiệp đã bắt đầu trình bày các hệ thống hoàn toàn tự động và thậm chí hoàn toàn tự động dựa trên đỉnh cao của tất cả các loại mục tiêu kiểm soát được trình bày ở trên. Điều này liên quan đến việc giữ cân bằng nội môi khí chấp nhận được, đảm bảo đồng bộ bệnh nhân – máy thở và ngăn ngừa VILI. Cấu trúc liên kết cho một vòng kiểm soát như vậy được hiển thị trong Hình 4.
INTELLiVENT® – ASV® (Hamilton Medical AG, Bonaduz, Thụy Sĩ) có bán trên thị trường là một ví dụ về hệ thống tự động hóa cao. Các mục tiêu kiểm soát là etCO2 và SpO2. Ngoài ra, người dùng phải cung cấp một số dữ liệu bệnh nhân, được sử dụng để ước tính cơ học phổi. Kiểm soát oxy đạt được bằng cách thay đổi PEEP hoặc FiO2, theo hướng dẫn lâm sàng từ giao thức ARDSNet. Kiểm soát thông khí (loại bỏ CO2) được kiểm soát bởi một vòng kiểm soát xếp tầng, bao gồm bộ kiểm soát ASV được mô tả ở trên.
Một hệ thống tự động cao khác đã được trình bày bởi Schwaiberger et al. năm 2018 [64]. EtCO2 được kiểm soát bằng kiểm soát mờ; các nguyên tắc của khái niệm phổi mở [65] đã được sử dụng để cải thiện oxy hóa và thông khí VT thấp đảm bảo đạt được thông khí bảo vệ [66]. Một nghiên cứu thí điểm trên tám con lợn cho thấy kết quả đầy hứa hẹn nhưng các thử nghiệm lâm sàng vẫn đang chờ xử lý. Hơn nữa, hệ thống này chỉ được áp dụng cho bệnh nhân thụ động.
Cai máy
Giai đoạn cuối cùng của thông khí cơ học đã chứng kiến một số hệ thống vòng kín tiên tiến nhất trở nên có sẵn trên thị trường. Các mục tiêu kiểm soát tương tự được trình bày ở trên cũng đúng với giai đoạn cai máy, nhưng một mục tiêu bổ sung trong quá trình cai máy là giảm sự phụ thuộc của bệnh nhân vào máy thở và kiểm tra xem bệnh nhân có thể được hỗ trợ cơ học hoàn toàn không.
Cách tiếp cận đầu tiên để cai máy tự động được thực hiện bởi Hewlett et al. vào năm 1977 [67] với thông khí phút bắt buộc.
Tuy nhiên, phương pháp cai máy sinh lý tự động đầu tiên được đề xuất bởi Chopin et al. năm 1989 [68]. Trong phương pháp thông khí bắt buộc carbon dioxide (CO2MV) của họ, các tác giả đã sử dụng etCO2 và bộ kiểm soát dựa trên quy tắc để chuyển đổi giữa thông khí tự phát và kiểm soát. Năm 1991, Strickland và Hasson [69] đã sử dụng phương pháp đo SpO2, nhịp thở và thông khí phút để tự động thiết lập tần số thông khí bắt buộc ngắt quãng đồng bộ và mức độ thông khí hỗ trợ áp lực (PSV). Cai máy được coi là hoàn thành khi hỗ trợ áp lực đã đạt đến không; hơi thở bắt buộc ≤ 2 lần/phút là bắt buộc và khí máu cho thấy bằng chứng đầy đủ.
Dojat et al. [70] đã phát triển hệ thống GANESH, sử dụng etCO2, nhịp thở và VT làm đầu vào cho bộ kiểm soát dựa trên quy tắc của họ để đặt mức PSV. Mục tiêu của chiến lược này là đưa bệnh nhân vào vùng thoải mái, tại thời điểm cai máy vĩnh viễn được dự kiến. Hệ thống này được phát triển hơn nữa, được gọi là NéoGanesh, và được trình bày vào năm 1997 [71] với một kiến thức tinh vi và bộ kiểm soát lý luận tạm thời. Cuối cùng, hệ thống này có sẵn dưới dạng SmartCare®/PS từ Dräger (Drägerwerk AG, Lzigeck, Đức).
Bộ kiểm soát ALV của Laubcher et al. được mô tả trước đây được sử dụng để cai máy bởi Linton và các đồng nghiệp vào năm 1994 [72]. Mở rộng trên ALV, ASV đã được phát triển. Với một bệnh nhân có khả năng bắt đầu thở tự nhiên, thuật toán ASV sẽ tự động giảm áp lực hít vào. Một khi tất cả các hơi thở là tự nhiên và trao đổi khí ổn định được đảm bảo, cai máy được coi là hoàn thành. Không có phản hồi trực tiếp về trao đổi khí trong các phiên bản đầu tiên. Điều này đã thay đổi khi giới thiệu INTELLiVENT® – ASV®.
Đánh giá thông khí vòng kín sinh lý thương mại
Các bài báo được trình bày cho đến nay đã chỉ ra các phương pháp mới trong việc áp dụng kiểm soát vòng kín sinh lý vào thở máy và có thể kiểm tra các hệ thống trên động vật trung bình/lớn hoặc một số ít bệnh nhân. Tính khả dụng thương mại của một số hệ thống này đã cho phép các nghiên cứu lâm sàng được thực hiện. Brogi et al.. đã đánh giá hệ thống và phân tích tổng hợp các hệ thống vòng kín trong môi trường lâm sàng. Năm nghiên cứu sử dụng điều chỉnh FiO2 tự động dựa trên các phép đo SpO2 và ba nghiên cứu điều tra kiểm soát thông khí (etCO2) đã được đưa vào tổng quan. Thời gian ở vùng mục tiêu dài hơn cho các hệ thống tự động trong tất cả các nghiên cứu [73]. Hệ thống NAVA được đánh giá trong một nghiên cứu của Demoule et al. và so với thông khí với PSV. Sự không đồng bộ bệnh nhân – máy thở đã giảm mặc dù không làm tăng xác suất còn lại ở chế độ thở máy một phần [74]. Rose et al. đã thực hiện tổng quan hệ thống của Burrane và phân tích tổng hợp các thử nghiệm lâm sàng so sánh cai máy tự động và không tự động [75]. Tổng quan bao gồm 21 thử nghiệm, tổng cộng 1676 bệnh nhân và bao gồm các hệ thống tự động như SmartCare®/PS, ALV và INTELLiVENT® – ASV®. Họ phát hiện ra rằng thời gian cai máy và thông khí đã giảm đáng kể bởi các hệ thống tự động [75]. Điều quan trọng, không có tác động mạnh mẽ đến tỷ lệ tử vong đã được tìm thấy. Burns et al. đã sử dụng hệ thống SmartCare để so sánh kiểm soát vòng khép kín cai máy với cai máy dựa trên giao thức thủ công [76]. Họ kết luận rằng cai máy tự động cho thấy kết quả đầy hứa hẹn, nhưng cần điều tra thêm [76]. Một nghiên cứu ngẫu nhiên có kiểm soát của Lellouche et al. cho thấy số lượng can thiệp cần thiết của nhân viên lâm sàng đã giảm khi sử dụng hệ thống thông khí hoàn toàn tự động, do đó, giảm khối lượng công việc của nhân viên [77]. Arnal et al. cho thấy INTELLiVENT® – ASV® đã giảm số lần thay đổi cài đặt máy thở thủ công ở bệnh nhân ICU [6]. Họ kết luận thêm rằng điều này có thể làm tăng hiệu quả của lực lượng lao động [6].
Những phân tích đầu tiên của các nghiên cứu lâm sàng cho thấy hứa hẹn rằng việc áp dụng PCLC vào thở máy có thể làm giảm khối lượng công việc của nhân viên lâm sàng và giữ cho bệnh nhân trong vùng mục tiêu oxy hóa và thông khí được cá nhân hóa một cách an toàn. Tuy nhiên, liệu hệ thống hoàn toàn tự động sẽ dẫn đến tỷ lệ tử vong được cải thiện vẫn là một câu hỏi mở.
Quan điểm
Sự phát triển của PCLC trong thông khí cơ học tiếp tục được thúc đẩy bởi các thiết kế bộ kiểm soát mới, mô hình cải tiến, phương thức cảm biến mới và các chiến lược thông khí tốt hơn.
Thiết kế bộ kiểm soát cải tiến là cần thiết để xem xét các hiệu ứng ghép chéo của cài đặt máy thở. Kiểm soát CO2 bằng cách thay đổi MV sẽ ảnh hưởng gián tiếp đến quá trình oxy hóa mà không được xem xét bởi bất kỳ hệ thống PCLC nào được trình bày.
Các phép đo và kỹ thuật hình ảnh mới đang được áp dụng trong lâm sàng của bác sĩ lâm sàng, có thể được sử dụng để kiểm soát tự động trong tương lai. Áp lực xuyên phổi, xuất phát từ việc trừ đi áp lực thực quản đo được từ áp lực đường thở, đang được nghiên cứu như một cách tiếp cận để tìm ra thiết lập PEEP thích hợp [78]. Chụp cắt lớp trở kháng điện (EIT, Electrical impedance tomography), như một kỹ thuật đo lường, được chấp nhận để chuẩn độ PEEP và cũng có được cái nhìn sâu sắc về phổi thông khí. Các đánh giá gần đây về chụp cắt lớp trở kháng điện được trình bày bởi [79-81].
Đánh giá có nguồn gốc, chẳng hạn như DA-aPO2 hoặc stress và strain để thông khí bảo vệ, cần được đưa vào hệ thống PCLC. Các ảnh hưởng huyết động của thay đổi máy thở (ví dụ, tăng PEEP) cũng cần được tính bởi hệ thống PCLC. Hơn nữa, bệnh sử của bệnh nhân nên được xem xét bởi hệ thống PCLC.
Với hầu hết dữ liệu được số hóa, điều hợp lý là dữ liệu này sẽ có sẵn cho máy thở trong tương lai. Trong một thế giới y tế mạng như vậy, tất cả dữ liệu sẽ được chuyển giữa tất cả các thiết bị y tế và dữ liệu này sẽ cho phép trí tuệ nhân tạo được áp dụng cho thở máy. Prasad và các đồng nghiệp đã mô tả một hệ thống hỗ trợ quyết định dựa trên trí tuệ nhân tạo [82].
Mặc dù có nhiều ưu điểm đi kèm với PCLC, nhưng những nguy hiểm có thể không bị lãng quên. Lỗi cảm biến, nhiễu không thể đoán trước và lỗi phần mềm vẫn là vấn đề trong bất kỳ hệ thống tự động nào và các khái niệm an toàn cần được phát triển để đảm bảo không gây hại cho bệnh nhân. Kuck và Johnson [83] xây dựng ba định luật về tự động hóa trong gây mê độc đáo: (1) không gây hại, (2) minh bạch và (3) giảm khối lượng công việc nhận thức. Một cách tiếp cận tương tự nên được thực hiện trong sự phát triển hơn nữa của kiểm soát vòng kín của thông khí cơ học.
Kết luận
Việc áp dụng PCLC vào thông khí cơ học đã bắt đầu từ hơn nửa thế kỷ trước và tất cả các nghiên cứu này đang bắt đầu mang lại kết quả dẫn đến máy thở tự động cao. Khi các hệ thống đầu tiên này trở nên có sẵn trên thị trường, dự kiến sẽ có nhiều hơn nữa, được cung cấp công nghệ mới từ ngành công nghiệp và học viện, và như vậy, bình minh của thông khí vòng kín sinh lý chắc chắn đã đến.





