Bài viết Đánh giá lại Permissive Hypercapnia trong ARDS được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Re-examining Permissive Hypercapnia in ARDS: A Narrative Review
Thông khí bảo vệ phổi (LPV) đã trở thành nền tảng cho việc quản lý bệnh nhân ARDS. Một nhóm bệnh nhân không thể dung nạp LPV mà không có CO2 tăng đáng kể. Ở những bệnh nhân này, sự tăng thán (CO2) cho phép (permissive hypercapnia) được sử dụng. Mặc dù được cho là lành tính, ngày càng rõ ràng rằng mức độ CO2 tăng cao có tác động sinh lý đáng kể. Trong bài tổng quan này, chúng tôi nêu bật các ảnh hưởng của permissive hypercapnia lên các cơ quan nội tạng có liên quan ở cả mô hình động vật và nghiên cứu lâm sàng. Chúng tôi cũng khám phá mối liên quan giữa tăng CO2, tâm phế cấp (acute cor pulmonale) và tử vong tại ICU. Chúng tôi kết luận với một bài đánh giá ngắn gọn về các liệu pháp thay thế cho quản lý CO2 hiện đang được điều tra ở những bệnh nhân ARDS ở mức độ vừa phải đến nặng.
Sự hiểu biết tốt hơn về sinh lý bệnh học và quản lý lâm sàng của ARDS đã dẫn đến thông khí bảo vệ phổi (LPV, lung-protective ventilation) trở thành nền tảng của việc quản lý. Các chiến lược ban đầu của ARDS đã được thiết kế để đạt được sự thông khí về thể tích khí lưu thông 10-15 mL/kg trọng lượng cơ thể dự đoán (PBW, predicted body weight).[1] Các chiến lược thông khí thể tích cao, áp lực cao đã được sử dụng để vượt qua các vùng phổi đông đặc bằng một nỗ lực để đạt được lượng oxy hóa động mạch và mức CO2 bình thường.[2,3] Khái niệm này đã được bác bỏ khi cuộc khảo sát ARMA của ARDSnetwork đã chứng minh được lợi ích đáng kể về tử vong (giảm 22%) với LPV giới hạn áp lực và thể tích (6 mL/kg so với 12 mL/kg PBW).[1] LPV có thể cải thiện các kết cục thông qua một số cơ chế, bao gồm giảm sức căng (stretch) và lực kéo (sheer forces) lên trên thành phế nang (volutrauma và barotrauma), ít huy động/tái xẹp theo chu kỳ hơn các vùng phổi xẹp (atelectrauma), và sự suy giảm đáp ứng cytokine toàn thân (biotrauma).[4] Thật không may, tử vong ở ARDS trầm trọng vẫn còn cao hơn 40%.[5] Một hệ quả của thể tích khí lưu thông thấp là giảm khả năng thanh thải CO2 do thông khí phút giảm. Một nhóm bệnh nhân không thể dung nạp LPV mà không có PaCO2 tăng đáng kể. Ở những bệnh nhân này, sử dụng tần số thở cao hơn để tăng thông khí phút và giảm PaCO2, hoặc tăng thán cho phép (permissive hypercapnia) để tạo điều kiện thông khí thể khí thấp được sử dụng. Mặc dù ban đầu được cho là lành tính hoặc thậm chí bảo vệ, ngày càng trở nên rõ ràng rằng mức độ CO2 tăng cao có tác động sinh lý đáng kể mà trên thực tế có thể gây hại. Tổng quan này phác họa cả di chứng sinh lý và lâm sàng của permissive hypercapnia trong ARDS.
Tác động của toan máu do tăng CO2 máu trong thực nghiệm trên động vật
Đáp ứng Cytokine
Áp lực động mạch CO2 bình thường trong khoảng từ 35 đến 45 mm Hg. Phân loại tăng CO2 máu được xác định khác nhau nhưng sẽ được đề cập đến trong tổng quan này là nhẹ, trung bình và nặng theo khoảng từ 46 đến 50, 50 đến 75 và > 75 mm Hg, tương ứng.[6] Ở mức độ phân tử, toan máu do tăng CO2 máu ức chế sự sản sinh các cytokine gây viêm và đã làm giảm tình trạng viêm trong tổn thương phổi do thở máy gây ra bởi sự ức chế tăng cường chuỗi kappa của các tế bào hoạt hóa B (NF-κB) và interleukin 8 (IL-8).[7,8] Toan máu tăng CO2 máu làm giảm các phản ứng oxy hóa trong mô phổi chuột bị tổn thương endotoxin.[9] Toan máu tăng CO2 máu cũng liên quan đến VILI ít nghiêm trọng hơn trong phổi thỏ được tưới máu riêng biệt ex vivo [10] và in vivo.[11] Điều này đã được đề xuất bởi một số nhóm, tăng CO2 máu điều trị có thể mang lại lợi ích cho ARDS.[12,13,14] Và mặc dù giảm các tổn thương oxy hóa của cơ thể người sẽ có lợi trong nhiều trường hợp, toan máu tăng CO2 máu có thể gây nguy hiểm khi ARDS là phổi nhiễm trùng, và các gốc tự do tạo ra có thể đóng một vai trò trong việc gây ra thương tích và tử vong do vi khuẩn.
Ở cấp độ tế bào, tăng CO2 máu đơn giản làm giảm sự giải phóng IL-8 khỏi các neutrophil bị kích thích bời lipopolysaccharide,[16] trong khi toan máu tăng CO2 máu làm giảm sự tuyển chọn và chức năng của bạch cầu phổi. Điều này dẫn đến đáp ứng viêm của vật chủ giảm nhưng với giảm chi phí hoạt động diệt khuẩn qua trung gian miễn dịch trong phổi.[14] Hoạt động diệt khuẩn qua trung gian miễn dịch cũng được hỗ trợ bởi một nghiên cứu cho thấy rằng những con chuột bị viêm phổi do Pseudomonas aeruginosa tiếp xúc với tăng CO2 máu sẽ làm suy giảm chức năng bạch cầu trung tính và có tỷ lệ tử vong cao hơn so với các đối tác tiếp xúc với không khí.[17]
Các nghiên cứu bổ sung, sử dụng sự suy giảm bạch cầu trung tính và tổn thương phổi do trung gian Escherichia coli đã phát hiện thấy toan máu tăng CO2 máu có lợi cho sự oxy hóa và độ giãn nở phổi; Tuy nhiên, không có sự thay đổi nào trong viêm phổi hoặc tổn thương mô học giữa tăng CO2 máu và normocapnia.[18] Toan máu tăng CO2 máu đơn thuần tăng cường các phản ứng viêm kết hợp với nitric oxide và các chất nitrate thứ cấp trong tế bào biểu mô phổi của bào thai phơi nhiễm với lipopolysaccharide và cytokine viêm.[19] Thời gian toan máu tăng CO2 máu có thể ảnh hưởng đến các tác động của nó, vì sự suy giảm các chỉ số mô học và sinh lý của mức độ nghiêm trọng của bệnh được quan sát thấy với chứng toan máu tăng CO2 máu trong thời gian ngắn (< 6 giờ)[20] và trong các mô hình tổn thương phổi cấp tính (ALI) liên quan đến nhiễm trùng huyết toàn thân.[21] Ngược lại, các mô hình sử dụng ALI liên quan nhiễm trùng tại phổi cho thấy không có sự khác biệt về chỉ số sinh lý và mô học về tổn thương phổi so với toan máu tăng CO2 máu[22] hoặc chỉ số mô học trầm trọng hơn và các vi khuẩn trong phổi cao hơn trong thời gian kéo dài tình trạng toan máu tăng CO2 máu (> 48 giờ) không được điều trị kháng sinh thích hợp.[23]
Sự ức chế sự phục hồi và chức năng tế bào biểu mô phổi
Toan máu tăng CO2 máu làm giảm khả năng lành vết thương ở phổi nhờ hai cơ chế.[24,25] Trước tiên, nó làm chậm sự sửa chữa biểu mô của tổn thương màng tế bào gây ra do lực kéo căng (stretch).[24] Thứ hai, nó ức chế việc sửa chữa tổn thương tế bào biểu mô phổi gây ra do thở máy, có thể thông qua sự ức chế NF-κB, bằng cách giảm sự di chuyển của tế bào và làm thay đổi hoạt động của metalloproteinase ma trận.[25] Gần đây, các nghiên cứu lâm sàng đã hỗ trợ cho những phát hiện này, tăng CO2 màng phổi liên quan với rò màng phổi – phế nang kéo dài sau cắt phổi.[26] Cuối cùng, tăng CO2 máu ngắn hạn, đã được chứng minh là làm giảm chức năng của các tế bào biểu mô phế nang, dẫn đến giảm hấp thụ dịch phế nang.
Các tác động trên thận
Toan máu tăng CO2 máu cấp tính đã cho thấy có một vài ảnh hưởng trực tiếp đến mạch máu thận trong cơ thể. Đối với chó, nó làm giảm lưu lượng huyết tương thận,[28,29,30] làm tăng sức đề kháng của mạch máu thận,[30] kích thích hoạt tính mạnh mẽ của hệ thống renin-angiotensin-aldosterone,[30,31] góp phần làm giảm phóng thích vasopressin không do áp lực thẩm thấu, và làm giảm bài tiết nước tự do của thận. Apoptosis gây ra do thiếu máu cục bộ của các tế bào ống thận được quan sát thấy khi tăng CO2 máu và thiếu oxy máu xảy ra đồng thời.[32] Ở người, tình trạng thiếu oxy máu và tăng CO2 máu trầm trọng có liên quan đến giảm chức năng thận,[33] trong khi nồng độ noradrenaline huyết tương tăng cao có liên quan đến sự tăng CO2 máu.[34] Ngoài ra, có một mối liên hệ tiềm năng với tăng nhu cầu thẩm phân máu ở bệnh nhân thở máy với tình trạng tăng CO2 máu.
Các tác động trên cơ hoành và cơ vân
Toan máu tăng CO2 máu đã được chứng minh để điều chỉnh đáp ứng cơ hoành của chuột thông qua sự thay đổi qua trung gian tế bào nội mô đối với trương lực động mạch cơ hoành. Toan máu tăng CO2 máu với trị số CO2 < 80 mm Hg gây tăng trương lực thần kinh. Ngược lại, toan máu tăng CO2 máu với các trị số CO2 > 80 mm Hg ức chế trương lực cơ thông qua các cơ chế ức chế phụ thuộc vào tế bào nội mô. CO2 có giá trị khoảng 100 mm Hg dường như ức chế trương lực cơ bằng cả cơ chế ức chế phụ thuộc vào tế bào nội mô và các tác động trực tiếp của CO2 trên trương lực cơ trơn động mạch.[36] Ngoài ra, teo cơ vân cũng có liên quan đến CO2 máu tăng cả in vitro lẫn in vivo.[37] Có thể có liên quan đến nhóm bệnh nhân ARDS và bệnh phổi mãn tính cơ bản trong đó teo cơ tương quan với kết cục lâm sàng tồi tệ hơn.
Tuần hoàn phổi
Toan máu tăng CO2 máu gây co thắt mạch máu trên động vật thực nghiệm.[38,39] Đặc biệt, nó tương quan với sự gia tăng có ý nghĩa áp lực động mạch phổi trung bình (mPAP) và kháng lực mạch máu phổi (PVR) ở những mô hình lợn không ARDS39 và ARDS,[38] tương ứng.
Buffered Hypercapnic Toan máu
Các nghiên cứu tiền cứu đã điều tra xem liệu tăng CO2 máu hoặc toan hô hấp có liên quan đến các ảnh hưởng sinh lý trong các mô hình ALI hay không. Dữ liệu từ mô hình thú gặm nhấm tổn thương phổi do sử dụng E coli hoặc do tác động gây ra bởi endotoxin cho thấy tổn thương phổi tồi tệ hơn và làm giảm tình trạng lành vết thương trong renal buffered hypercapnic toan máu khi so sánh với nhóm chứng PaCO2 máu bình thường sau 6 giờ LPV.[40] Hơn nữa, ALI do nhiễm khuẩn huyết ở chuột gíc cũng tương tự mức độ tổn thương sinh lý và mô học trong cả bicarbonate-buffered hypercapnic toan máu và các động vật đối chứng nonbuffered normocapnic.
Mặc dù các bằng chứng từ các nghiên cứu trước khi nghiên cứu về động vật cung cấp rất ít ý kiến cho rằng toan máu tăng CO2 máu có ảnh hưởng trực tiếp đến ALI nhưng nó làm nổi bật sự cần thiết phải nghiên cứu thêm. Ngoài ra, một chiến lược sử dụng tăng CO2 máu kéo dài với nhiễm trùng phổi không được điều trị chứng tỏ bằng chứng về sự nguy hại nếu không có biện pháp kháng sinh thích hợp.[23]
Các nghiên cứu lâm sàng của Permissive Hypercapnia ở ARDS
Các tác động tim phổi của Hypercapnia
Hypercapnia gây ra những thay đổi về sinh lý trong tuần hoàn phổi và hệ thống (Hình 1). Đối với những bệnh nhân khỏe mạnh, tăng toan máu tăng CO2 máu gây ra sự dịch chuyển sang bên phải của đường cong phân li của oxy-hemogloblin [42] và làm giảm sự đề kháng mạch máu.[43] Ở những bệnh nhân tim phổi, những người đã trải qua phẫu thuật bắc cầu mạch vành, hypercapnia làm giảm co bóp cơ tim toàn phần; tuy nhiên, tăng nhịp tim thông qua giao cảm hỗ trợ để duy trì cung lượng tim khi dự phòng bù lại.[44] Chức năng tâm thất phải (RV) đặc biệt bị ảnh hưởng trong việc thiết lập tăng CO2 máu sau khi phẫu thuật, tăng thể tích tâm trương tâm thất phải, giảm phân suất tống máu thất phải và tăng đáng kể chỉ số công co bóp thất phải. Những quan sát này là một phần do tăng PVR do tác dụng làm co mạch trực tiếp của chứng toan máu tăng CO2 máu đối với hệ mạch máu phổi và sự gia tăng đi kèm trong mPAP.[45,46,47] Ở bệnh nhân bệnh phổi mãn tính không có ARDS, Enson và cộng sự đã chứng minh rằng nhiễm toan hô hấp, nhưng không phải là tăng CO2 máu đơn thuần, gây ra tăng PVR và mPAP. Ngoài ra, nghiên cứu của họ cho thấy sự gia tăng mPAP có thể nhạy hơn với tình trạng giảm oxy máu ở các giá trị pH thấp hơn. Sự không chắc chắn vẫn liên quan đến sự đóng góp của tăng CO2 máu và tình trạng nhiễm toan hô hấp gia tăng ở PVR và mPAP ở bệnh nhân ARDS.
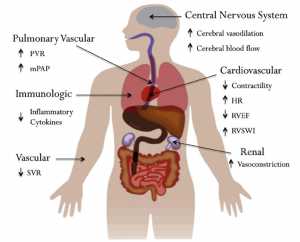
Sự hiểu biết thêm về thay đổi huyết động học phổi trong ARDS có thể thu được bằng các nghiên cứu kiểm tra sự liên kết giữa thất phải và tuần hoàn động mạch phổi. Các mạch máu phổi được đặc trưng bởi sự đàn hồi động mạch của hệ thống động mạch phổi đồng bộ với hậu tải thất phải (RV afterload = Ea), trong khi hệ thống thất phải (RV) được đặc trưng bởi sự đàn hồi RV (Ees).[49] Tỉ lệ Ees:Ea là tỷ số của độ đàn hồi RV chia cho độ đàn hồi động mạch phổi (PA) và phản ánh các khía cạnh năng lượng cơ của khớp nối RV/PA, xác định xác định thể tích nhát bóp RV. Khi Ees:Ea lớn hơn 1 (phạm vi bình thường 1 1⁄2 – 2), hệ thống được ghép nối, cung cấp cung lượng tim RV ở mức chi phí năng lượng tối thiểu.[50] Trong bối cảnh tăng CO2 máu, co mạch phổi và tăng hậu tải RV có thể dẫn đến tăng Ea, tách ra khỏi hệ thống RV/PA, và rối loạn chức năng RV tiếp theo.[50]
Các tác động tim phổi của thở máy trên bệnh nhân ARDS
Các nghiên cứu về thông khí cơ học ở bệnh nhân ARDS cách đây 40 năm đã xác định được tổn thương mao mạch phổi dẫn đến tăng áp phổi, rối loạn chức năng RV với chỉ số RV stroke work index cao và tăng gấp 3 lần ngưỡng PVR.[51-54] Tấm phế cấp (ACP, acute cor pulmonale) đại diện cho hình thức nghiêm trọng nhất của rối loạn chức năng RV và đã là chủ đề của nhiều cuộc điều tra trong quần thể ARDS. Nó được xác định khác nhau bằng cách sử dụng catheter tim phải, catheter động mạch phổi và siêu âm tim.
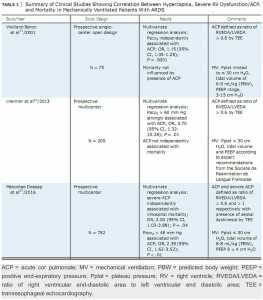
Trước khi có sự xuất hiện của thông khí bảo vệ phổi (LPV), ACP (được định nghĩa là rối loạn vận động vách tâm thất liên quan đến tỷ lệ diện tích vùng cuối tâm trương – end-diastolic area ratio – giữa thất phải và thất trái với [RVEDA/LVEDA] > 0,6) rất phổ biến và có thể thấy ở hơn một nửa số bệnh nhân được kiểm tra.[55] Không có gì đáng ngạc nhiên, nó tương quan dương với sự gia tăng áp lực cao nguyên (Pplat) trong quá trình thở máy.56 Trong một phân tích gộp lớn sử dụng các nghiên cứu siêu âm tim cho bệnh nhân ARDS, sự có mặt của ACP là 13%, 32% và 56% khi Pplat dao động từ 18 đến 26, 27 và 35, và> 35 cmH2O tương ứng. Tỷ lệ tử vong cao nhất đã được quan sát ở hai nhóm có giá trị Pplat cao nhất, trong đó ACP là phổ biến nhất.[56] Tuy nhiên, các nghiên cứu tương tự sử dụng LPV đã cho thấy tỷ lệ thấp hơn đáng kể.[57] Ví dụ, Osman et al58 ghi nhận suy RV (được định nghĩa là mPAP> 25 mm Hg, CVP lớn hơn áp lực động mạch phổi bít [Ppao], và chỉ số thể tích nhát bóp, stroke volume index < 30 mL/m2 ở khoảng 10% bệnh nhân ARDS,[58] trong khi Boissier et al[59] và Lheritier et al [60] ghi nhận tần suất của tâm phế cấp tương ứng là 22% và 22.5%. Áp lực đẩy (Pplat trừ cho PEEPtotal) là một đại diện của stress phổi có liên quan đến sự sống còn và nguy cơ ACP ở bệnh nhân ARDS, có thể cho thấy một “chiến lược áp lực thấp” có thể bảo vệ tâm thất phải.[61] Tỷ lệ thấp hơn của ACP trong những nghiên cứu gần đây có thể liên quan đến sự kết hợp của các chiến lược thông khí bảo vệ thất phải, không đồng nhất trong bản thân định nghĩa và các điều chỉnh máy thở điều trị dựa trên sự công nhận trước đó của nó.
Các tác động tim phổi của Permissive Hypercapnia trong ARDS
Mặc dù có những cải tiến này, rối loạn chức năng RV vẫn còn phổ biến và có liên quan đến kết cục tồi tệ hơn trong ARDS. Ví dụ, rối loạn chức năng RV nghiêm trọng được chứng minh là phổ biến hơn ở người không sống sót của rối loạn chức năng RV trong ARDS.[62] Rối loạn chức năng RV trong ARDS sớm, theo định nghĩa là tỷ lệ cao hơn áp lực nhĩ phải so với Ppao có liên quan một cách độc lập với tỷ lệ tử vong cao hơn.[63] Nghiên cứu này một phần có thể được giải thích bởi những ảnh hưởng của thông khí cơ học trong thời đại trước khi áp dụng LPV; tuy nhiên, các nghiên cứu của bệnh nhân ARDS trong thời đại sau khi thông qua LPV cũng cho thấy một mối tương quan giữa rối loạn chức năng RV và tử vong. Boissier et al[59] tìm thấy tỷ lệ tử vong 28 ngày cao hơn đáng kể ở những bệnh nhân với ARDS và rối loạn chức năng RV nghiêm trọng, và Osman et al [58] thấy rằng mPAP cao hoặc CVP lớn hơn Ppao, tương ứng, có liên quan một cách độc lập với tỷ lệ tử vong 90 ngày. Bên cạnh đó, phân tích thứ cấp của bệnh nhân ARDS từ nghiên cứu Fluid and Catheter Treatment Trial (FACTT) đã chứng minh rằng tăng gradient xuyên phổi (mPAP – Ppao) hoặc index PVR cao, là một nguy cơ cao tử vong trong 60 ngày.[64]
Mặc dù có LPV, permissive hypercapnia cùng với ARDS từ vừa đến nặng có thể gây ra hiệu ứng đồng vận có thể dẫn đến ACP. Sử dụng rộng rãi siêu âm tim hai chiều hiện đại không chỉ đã được cải thiện sự hiểu biết của chúng ta về những tác động của thông khí cơ học trên chức năng RV nhưng cũng đã tạo điều kiện hiểu rõ hơn về mối quan hệ giữa hệ thống thông khí cơ học, permissive hypercapnia, và sự phát triển của ACP (Bảng 1). Mekontso Dessap et al65 sử dụng siêu âm tim xuyên thực quản (TEE) ở bệnh nhân ARDS nghiêm trọng để chứng minh rằng sự bắt đầu của toan máu hypercapnic với thông khí thể tích khí lưu thông thấp và tăng PEEP ở áp lực cao nguyên hằng định trực tiếp gây suy giảm chức năng RV, độc lập với tác động của PEEP. Vieillard-Baron et al [57] đã thực hiện phân tích đa biến ở 75 bệnh nhân ARDS sử dụng TEE. Họ nhận thấy rằng PaCO2 tăng là dự báo cá nhân duy nhất của ACP. Mặc dù ACP không có ảnh hưởng đến tử vong, nhưng các tác giả đã xác định được chính xác về ACP trong nghiên cứu và thực hiện tư thế nằm sấp vào ngày thứ 3 ở những bệnh nhân có PaCO2/FIO2 <100 mm Hg. Những thay đổi này có thể làm giảm nhẹ tử vong liên quan đến ACP.[66] Lheritier và cộng sự đã sử dụng kết hợp siêu âm tim xuyên ngực và TEE để nghiên cứu 200 bệnh nhân ARDS ở mức độ trung bình và nặng sau 48 giờ nhập viện. PaCO2 tăng lên có liên quan đáng kể với ACP, và PaCO2 ≥ 60 mm Hg là yếu tố độc lập duy nhất gắn liền với ACP.[60] Nghiên cứu cũng cho thấy gradient áp lực tâm thu giữa tâm thất phải và tâm nhĩ phải (ΔPmax), một phép đo gián tiếp trương lực mạch máu phổi, có tương quan với PaCO2 và cao hơn đáng kể ở những bệnh nhân có PaCO2 > 60 mm Hg. Mặc dù kết quả nghiên cứu không có sự liên quan giữa ACP ở < 48 giờ sau khi nhập viện và 28 ngày tử vong.[60] Trong một nghiên cứu tiền cứu lớn gần đây (N = 752), Mekontso Dessap và al[67] đã xác định tăng CO2 máu (PaCO2 ≥ 48 mm Hg) như một biến thể hô hấp có tương quan có ý nghĩa thống kê với ACP (được đánh giá bởi TEE) ở bệnh nhân ARDS nhận LPV. ACP đã được tìm thấy ở 22% số người trong nhóm, và ACP nghiêm trọng (được định nghĩa là RVEDA/LVEDA> 1) được tìm thấy ở 7,2% số bệnh nhân và là một yếu tố tiên đoán độc lập về tử vong.
Phân tích thứ cấp của nghiên cứu ARDSnet do Kregenow và các cộng sự đã phát hiện thấy sự có mặt của chứng toan máu tăng CO2 máu ở ngẫu nhiên có liên quan đến tỷ lệ tử vong thấp hơn 28 ngày trong nhóm ngẫu nhiên có khối lượng khí lưu thông 12 mL/kg (nhưng không có sự khác biệt về tỷ lệ tử vong ở bệnh nhân được phân ngẫu nhiên 6 mL/kg) (Bảng 2). Nghiên cứu này có một số hạn chế, bao gồm cả việc phân tích hồi cứu thứ cấp, xác định tình trạng toan máu tăng CO2 máu dựa trên phép đo khí máu trong ngày 1 chứ không phải là toan máu tăng CO2 máu theo thời gian, cũng như có rất ít bệnh nhân trong nhóm toan máu tăng CO2 máu. Vì đây là một phân tích thứ yếu, không có sự kết hợp nhân quả nào được chứng minh.
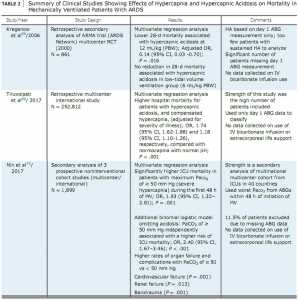
Trái ngược với nghiên cứu của Kregenow et al [68], hai nghiên cứu gần đây nhìn vào các bệnh nhân thở máy trong ICU đã đặt ra câu hỏi về sự an toàn của chứng toan máu tăng CO2 máu. Nghiên cứu đầu tiên đã được hồi cứu và bao gồm 252.812 bệnh nhân được nhận vào ICUs với suy hô hấp cần thông khí cơ học trong 24 giờ đầu tiên nhập viện ICU của họ. Nó phát hiện ra rằng toan máu tăng CO2 máu trong 24 giờ đầu tiên nhập viện vì ICU có liên quan đến tỷ lệ tử vong trong bệnh viện cao hơn so với tăng CO2 máu có bù trừ hoặc normocapnia[69] (Bảng 2). Thật thú vị, cả hai nhóm bệnh nhân tăng CO2 máu có bù trừ và những người có chứng toan máu tăng CO2 máu có tỷ lệ tử vong cao hơn. Hiệu quả này là nhất quán trên tất cả các loại nhập viện ICU. Điểm mạnh của nghiên cứu này là số lượng bệnh nhân đông đảo và tính chất theo chiều dọc của việc thu thập dữ liệu (dữ liệu trong một khoảng thời gian 14 năm từ 171 ICUs). Nghiên cứu này phân loại bệnh nhân dựa trên phép đo khí máu động mạch ngày 1 (ABG) và không tính đến những điều trị bổ trợ như truyền bicarbonate và hỗ trợ cuộc sống ngoài cơ thể (ECLS).
Nghiên cứu thứ hai là một phân tích thứ cấp của 1.899 bệnh nhân từ ba nghiên cứu ngẫu nhiên có triển vọng đối với bệnh nhân ARDS. Nó chứng minh rằng tăng CO2 máu nặng, theo PaCO2 ≥ 50 mm Hg, có liên quan đến tỷ lệ tử vong của ICU cao hơn ở một quần thể ARDS[70] vừa phải đến nặng (Bảng 2). Các tác giả đã sử dụng phương pháp thích ứng để tiến hành phân tích độ nhạy cảm để chứng minh rằng tăng CO2 máu độc lập với toan máu có liên quan đến tử vong tăng lên, trong khi cả hai đều có những tác động phụ độc lập lên sự gia tăng tỷ lệ tử vong. Nghiên cứu này bao gồm các bệnh nhân từ 927 ICUs ở 40 quốc gia. Các nhà điều tra đã sử dụng kết quả đo ABG tồi tệ nhất trong 48 giờ đầu tiên của thông khí cơ học để phân tầng bệnh nhân. Một số điểm yếu của nghiên cứu này bao gồm một số bệnh nhân bị loại trừ do ABG mất dữ liệu (11,5%) và không thu thập dữ liệu về sử dụng các liệu pháp bổ trợ như truyền bicarbonate và ECLS.
Hypercapnia và rối loạn chức năng cơ quan
Không có gì đáng ngạc nhiên, những ảnh hưởng có hại của tăng CO2 máu trầm trọng vượt ra ngoài hệ thống tim phổi. Trong nghiên cứu của Nin và cộng sự,[70] bệnh toan máu tăng CO2 máu có liên quan đến tỉ lệ biến chứng liên quan đến máy thở cao hơn (như barotrauma) và suy chức năng cơ quan, bao gồm rối loạn chức năng thận và tim mạch. Cần có thêm các nghiên cứu để xác nhận và làm rõ bên ngoài cơ sở sinh lý bệnh lý cho những phát hiện này và liệu chúng có giống nhau với những mô tả trong mô hình động vật.
Chiến lược LPV khi có Hypercapnia nặng
LPV, khoảng chết và Hypercapnia
Tăng CO2 máu ở bệnh nhân ARDS có thể là hậu quả ngoài ý muốn của LPV nhưng cũng có thể là kết quả của khoảng chết cao hơn do tăng mức độ nghiêm trọng của bệnh. Điều này rất quan trọng để xác định sớm tiến trình của bệnh, vì tỉ lệ khoảng chết cao hơn trong ARDS sớm kết hợp độc lập với tỷ lệ tử vong cao hơn.[71] Các chiến lược nhằm giảm khoảng chết của phế nang cùng với mức độ nặng của hypercapnia có thể được sử dụng nhưng mang theo rủi ro. Thứ nhất, việc huy động phổi phù hợp để tạo điều kiện cho việc thông khí trong ARDS thường đòi hỏi phải đạt được mức PEEP tối ưu, nhưng cần phải cẩn thận để tránh tình trạng căng phế nang quá mức, có thể ảnh hưởng xấu đến huyết động học phổi và chức năng RV.[67] Thứ hai, điều chỉnh PEEP và áp lực đẩy để đạt được thể tích khí lưu thông mong muốn và ngưỡng PaCO2 trong LPV là một quá trình phức tạp. Ví dụ, trong một post hoc analysis quan sát của 9 nghiên cứu ngẫu nhiên có đối chứng ở bệnh nhân ARDS, Amato và cộng sự đã chứng minh rằng giảm thể tích khí lưu thông hoặc tăng PEEP chỉ có lợi khi làm giảm áp lực đẩy. Cuối cùng, tần số thở cao hơn để điều chỉnh tăng CO2 máu không được dung nạp ở một số bệnh nhân ARDS do sự tăng căng phổi động (dynamic hyperinflation) và rối loạn chức năng RV đáng kể.[72] Nói tóm lại, các chiến lược giảm PaCO2 có thể gây ra những thiệt hại đáng kể và việc sử dụng chúng phải được cân nhắc những rủi ro liên quan đến permissive hypercapnia.
Tư thế nằm sấp
Việc đặt bệnh nhân ARDS nặng ở tư thế nằm sấp đã được chứng minh để cải thiện việc oxy hóa và độ giãn nở, và cải thiện tử vong.[73] Tuy nhiên, một số nghiên cứu cho thấy giảm PaCO2 có liên quan đến việc giảm khoảng chết của phế nang chứ không phải do tăng PaO2 có thể là phản ánh tốt nhất mức độ của phổi chức năng được huy động với tư thế nằm sấp.[74,75] Thật không may, chỉ có một thử nghiệm ngẫu nhiên có đối chứng để chứng minh lợi ích tử vong với việc tư thế nằm sấp (Proning Severed ARDS Patients [PROSEVA]) không trực tiếp đánh giá huy động phế nang với tư thế nằm sấp.[73] Ngoài ra, phân tích hồi cứu của PROSEVA bởi Albert et al,[76] chứng minh rằng tăng tỷ lệ sống sót với tư thế nằm sấp không được tiên đoán bởi sự cải thiện trong trao đổi khí được xác định bằng phân tích khí máu. Tuy nhiên, việc tư thế nằm sấp có thể làm giảm PaCO2 và giảm tải tâm thất trái ở nhóm bệnh nhân chọn lọc trong ICU và là một công cụ quan trọng để cải thiện kết cục bệnh nhân ARDS nặng.[77]
Extracorporeal Venovenous CO2 Removal
Cuộc tranh luận tiếp tục về vai trò của các thiết bị ngoài cơ thể trong việc quản lý ARDS. Cụ thể, đã có thêm mối quan tâm về việc loại bỏ CO2 ngoài cơ thể (ECCO2R), loại bỏ CO2 hiệu quả với tỷ lệ lưu lượng máu tương đối thấp. Một mô hình lợn thí nghiệm gần đây được sử dụng bởi Morimont và cộng sự đã tìm cách xác định ECCO2R trong quá trình LPV có thể cải thiện huyết động học phổi và chức năng RV trong ARDS sớm. ECCO2R đã điều chỉnh hiệu quả toan máu và tăng CO2 máu trong LPV. Ngoài ra, PVR và mPAP đã được giảm đáng kể và khớp nối RV-PA (Ees:Ea) đã được cải thiện. Sự thay đổi trong cả pH và PaCO2 có tương quan cao với sự thay đổi mPAP. Liệu những phát hiện từ nghiên cứu này có thể chuyển sang cho người bệnh với ARDS chưa được biết rõ. Tối thiểu, nó cung cấp cơ sở để bắt đầu các nghiên cứu tiền cứu ở bệnh nhân ARDS vừa đến nặng bằng cách sử dụng ECCO2R sớm để bình thường hóa pH và CO2 theo tiêu chuẩn hiện tại của LPV.
Thông khí VT siêu thấp và việc duy trì Normocapnia
Một số nghiên cứu gần đây đã kiểm tra thông khí VT siêu thấp (3-4 mL/kg) kết hợp với ECCO2R để xác định tính khả thi của nó và liệu có lợi ích bổ sung ngoài LPV hiện tại.[78,79,80] Về lý thuyết, thông khí VT xuống thấp làm giảm ACP hoặc suy RV, hoặc cả hai, và nó tạo điều kiện cho một cách tiếp cận thông khí “ít gây tổn hại nhất” (giảm đáng kể Pplat và các giá trị áp lực đẩy) mà có thể xảy ra bất chấp việc sử dụng LPV.[81] Mặc dù nghiên cứu của Bein et al[78] không cho thấy sự khác biệt tổng thể trong 28 ngày hoặc 60 ngày không có máy thở giữa các nhóm, một post hoc analysis đã chỉ ra rằng bệnh nhân bị giảm oxy máu nặng được phân ngẫu nhiên (PaO2/FiO2 < 150mmHg) có thời gian thông khí ngắn hơn đáng kể khi được đánh giá bởi ngày không thở máy 60 ngày cao hơn. Các nghiên cứu bổ sung về mặt này đang được tiến hành (A Strategy of Ultraprotective Lung Ventilation With Extracorporeal CO2 Removal for New-Onset Moderate to Severe ARDS [SUPERNOVA] và Protective Ventilation With Veno-venous Lung Assist in Respiratory Failure [REST]). Mặc dù các thử nghiệm này vẫn chưa rõ ràng liệu phương pháp thông khí có “ít gây tổn hại nhất” với thông khí thể tích khí lưu thông siêu thấp và duy trì normocapnia nên được áp dụng cho bệnh nhân ARDS vừa hoặc ARDS nặng và liệu nó có lợi hơn so với tiêu chuẩn LPV hiện nay với việc duy trì normocapnia ở một trong hai nhóm này.
Vai trò của các dung dịch đệm trong xử trí ARDS
Có sự không chắc chắn đáng kể về vai trò của dung dịch đệm trong việc xử trí toan hô hấp liên quan đến LPV. Mặc dù thử nghiệm ARMA đã cho phép truyền natri bicarbonate trong protocol thể tích khí lưu thông thấp khi pH giảm xuống <7.15,[1] nhưng việc sử dụng chúng cần cẩn trọng. Cách tiếp cận hợp lý là sử dụng một chiến lược tương tự như protocol được sử dụng trong nhóm thông khí khối lượng triều thấp của cuộc thử nghiệm ARMA.[1]
Kết luận
Các nghiên cứu tiền lâm sàng về ARDS đã cung cấp cái nhìn sâu hơn về các ảnh hưởng sinh lý của hypercapnic acidosis; tuy nhiên, đóng góp tương đối của tăng CO2 máu trên tử vong ở các mô hình động vật vẫn còn chưa chắc chắn, ngoại trừ trong bối cảnh nhiễm trùng phổi không được điều trị, trong đó có kết hợp với kết cục xấu hơn.
Các nghiên cứu lâm sàng ở bệnh nhân ARDS đã chỉ ra mối liên quan giữa tăng CO2 máu trầm trọng, ACP, và tử vong. Tăng CO2 máu nặng cũng có liên quan đến tỷ lệ cao hơn các rối loạn chức năng của cơ quan không phải tim mạch và tử vong ICU ở bệnh nhân ARDS mức độ trung bình và nặng.
Ultra-LPV với việc duy trì normocapnia, sử dụng loại bỏ CO2 ngoài cơ thể cung cấp những ưu điểm tiềm năng so với các tiêu chuẩn hiện tại của LPV. Tuy nhiên, vẫn còn chưa chắc chắn liệu chiến lược này có nên áp dụng cho bệnh nhân ARDS vừa hoặc nặng hay không. Hơn nữa, vẫn cần phải xác định liệu chiến lược này có mang lại lợi ích bổ sung cho nhóm bệnh nhân này so với LPV với việc duy trì normocapnia.
Suy nghĩ cuối cùng
Tăng CO2 máu nặng có những hậu quả có hại ở bệnh nhân có ARDS mức độ vừa phải đến nặng theo tiêu chuẩn Berlin. Đối với các nhà lâm sàng quản lý những bệnh nhân như vậy, chúng tôi khuyên kiểm soát tăng CO2 máu cao để PaCO2 giữ < 50 mm Hg phù hợp với các bằng chứng hiện tại.[83] Ngoài việc thử nghiệm thông khí với thể tích khí lưu thông siêu thấp cùng với ECCO2R, đã đến lúc đánh giá lại các chiến lược LPV hiện tại ở bệnh nhân ARDS trung bình đến nặng. Một nghiên cứu ngẫu nhiên được sử dụng đầy đủ hơn, sử dụng LPV so sánh việc duy trì normocapnia với ECCO2R và permissive hypercapnia được đảm bảo.





