Bài viết Làm ẩm trong thở máy ở bệnh nhân người lớn được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Humidification during Mechanical Ventilation in the Adult Patient
1. Tóm tắt
Làm ẩm và ấm khí hít vào là tiêu chuẩn trong chăm sóc bệnh nhân thông khí cơ học trong một thời gian dài. Hơn một thế kỷ trước, một loạt các báo cáo mô tả tổn thương đường thở quan trọng khi sử dụng khí khô trong quá trình thông khí nhân tạo.
Do đó, các nhà cung cấp dịch vụ chăm sóc hô hấp đã sử dụng các máy tạo độ ẩm bên ngoài để bù đắp cho việc thiếu các cơ chế làm ẩm tự nhiên khi đường hô hấp trên bị nối tắt. Đặc biệt, các thiết bị làm ẩm chủ động và thụ động đã phát triển nhanh chóng. Hệ thống tinh vi bao gồm các bình chứa, dây điện trở, thiết bị sưởi ấm và các yếu tố khác đã trở thành một phần của các thiết bị thông thường của chúng tôi trong đơn vị chăm sóc đặc biệt.
Do đó, kiến thức cơ bản về cơ chế hoạt động của từng thiết bị này, cũng như ưu điểm và nhược điểm của chúng, trở thành một điều cần thiết cho việc chăm sóc hô hấp và chuyên gia chăm sóc đặc biệt. Trong bài báo này, chúng tôi xem xét các phương pháp hiện tại để tạo độ ẩm đường thở trong quá trình thông khí cơ học xâm lấn của bệnh nhân người lớn. Chúng tôi mô tả một loạt các thiết bị và mô tả các ứng dụng theo điều kiện lâm sàng cụ thể.
2. Giới thiệu
Năm 1871, Friedrich Trendelenburg đã mô tả nội khí quản đầu tiên cho việc điều trị gây mê toàn thân [1]. Kể từ đó, ngày càng nhiều các y văn nghiên cứu về các tác động của khí khô trên đường hô hấp của bệnh nhân đặt nội khí quản. Trên thực tế, một nghiên cứu trên mười tám bệnh nhân được gây mê toàn thân đã chứng minh rằng sau ba giờ tiếp xúc với khí gây mê khô, tế bào biểu mô hô hấp có 39% tổn thương lông chuyển, 39% thay đổi tế bào chất và 48% thay đổi hạt nhân [2].
Sauđó, các tác giả khác đã xem xét tác động của khí khô lên niêm mạc ở chó gây mê cho các phẫu thuật nối tắt tim-phổi. Trong nhóm tiếp xúc với khí khô, lớp niêm mạc hô hấp đã giảm tốc độ thanh thải so với nhóm hít khí hoàn toàn làm ẩm [3]. Trong suốt những năm qua, một lượng lớn tài liệu đã cho thấy những tác động không thuận lợi của không đủ làm ẩm đường hô hấp [4–10].
Do đó, làm ẩm trong quá trình thông khí cơ học xâm lấn hiện là tiêu chuẩn chăm sóc được chấp nhận [11].
Trong tổng quan này, chúng tôi hướng đến việc mô tả các nguyên tắc cơ bản về làm ẩm đường hô hấp trên các bệnh nhân thở máy, các thiết bị tạo độ ẩm thường được sử dụng nhất và lựa chọn độ ẩm phù hợp theo điều kiện lâm sàng.
3. Kiểm soát sinh lý đường thở về nhiệt độ và độ ẩm
Độ ẩm là lượng nước trong trạng thái hơi chứa trong khí. Độ ẩm thường được phân loại thành độ ẩm tuyệt đối hoặc tương đối. Độ ẩm tuyệt đối (AH, Absolute humidity) là trọng lượng của nước có trong một thể tích khí nhất định và nó thường được biểu thị bằng mg/L.
Độ ẩm tương đối (RH, Relative humidity) là tỷ số giữa trọng lượng thực của hơi nước (AH) so với khả năng khí có thể giữ được lượng hơi nước tối đa ở một nhiệt độ cụ thể. Bất cứ khi nào lượng hơi nước chứa trong một mẫu chất khí bằng dung tích hơi nước tối đa của nó, thì RH là 100% và khí hoàn toàn bão hòa hơi nước.
Điều quan trọng là phải hiểu rằng dung tích hơi nước của mẫu khí sẽ tăng theo cấp số nhân với nhiệt độ [3]. Do đó, nếu độ ẩm tuyệt đối không đổi, RH sẽ giảm bất cứ khi nào nhiệt độ tăng (vì mẫu số tăng) và RH sẽ tăng khi nhiệt độ giảm (vì khả năng giữ hơi nước giảm). Trong tình huống sau, vì hàm lượng nước trong khí vượt quá khả năng giữ nước của nó, nước sẽ ngưng tụ thành những giọt chất lỏng.
Tình trạng này trở nên đặc biệt liên quan đến bệnh nhân thở máy, vì nước lỏng có khuynh hướng tích lũy ở điểm thấp hơn của ống, tăng sức đề kháng đối với việc phân phối khí. Ở mực nước biển, khả năng giữ nước ở nhiệt độ cơ thể và áp suất bão hòa (BTPS) là 43,9 mg nước trên mỗi lít khí.
Bảng 1 cho thấy các yêu cầu về độ ẩm cho việc phân phối khí tại các vị trí giải phẫu khác nhau trong đường hô hấp [12].
Bảng 1: Các yêu cầu về độ ẩm cho việc phân phối khí tại các vị trí giải phẫu khác nhau trong đường hô hấp.
| Vị trí | Mũi hoặc miệng | Hạ họng | Giữa khí quản |
| Độ ẩm cần thiết | RH là 50% với AH là 10 mg/L ở 22oC | RH là 95% với AH là 28- 34 mg/L ở 29-32oC | RH là 100% với AH là 36- 40 mg/L ở 31-35oC |
[Reference 12]
Trao đổi nhiệt và độ ẩm là một trong những chức năng quan trọng nhất của hệ hô hấp. Các mô liên kết của mũi được đặc trưng bởi một hệ thống mạch máu phong phú của nhiều tĩnh mạch và thành mỏng. Hệ thống này chịu trách nhiệm làm ấm không khí hít vào để tăng khả năng độ ẩm của nó. Khi không khí hít vào đi xuống đường hô hấp, nó đạt đến một điểm mà ở đó nhiệt độ của nó là 37°C và độ ẩm tương đối của nó là 100%.
Điểm này được gọi là ranh giới bão hòa đẳng nhiệt (ISB, isothermic saturation boundary), và nó thường nằm dưới carina 5 cm [5]. Niêm mạc đường hô hấp được lót bởi biểu mô trụ có lông chuyển phân tầng (pseudostratified columnar ciliated epithelium) và với nhiều tế bào trụ tiết chất nhày (goblet cells).
Những tế bào này, cũng như các tuyến dưới niêm mạc bên dưới biểu mô, chịu trách nhiệm duy trì lớp màng nhầy phục vụ như một cái bẫy cho các mầm bệnh và như một giao diện để trao đổi độ ẩm. Ở mức độ tiểu phế quản tận, biểu mô biến thành một tế bào dạng hình khối đơn giản với các tế bào goblet tối thiểu và ít có các tuyến dưới niêm mạc. Do đó, khả năng của các đường dẫn khí này đạt được cùng một mức độ ẩm được duy trì bởi đường hô hấp trên bị giới hạn [14].
Sau khi đặt nội khí quản, vì đường hô hấp trên mất khả năng làm ấm và ẩm khí hít vào, ISB bị dịch chuyển xuống đường hô hấp phía dưới. Điều này áp đặt một gánh nặng trên đường hô hấp dưới, vì nó không được chuẩn bị tốt cho quá trình làm ẩm. Do đó, việc cung cấp khí y tế lạnh và khô một phần mang lại những tổn thương tiềm ẩn cho biểu mô hô hấp, biểu hiện bằng cách tăng công thở, xẹp phổi, dịch tiết mất nước và cô đặc, ho và/hoặc co thắt phế quản [15].
Đáng chú ý, có những yếu tố khác có thể làm thay đổi ISB tạo ra các hiệu ứng tương tự, chẳng hạn như thở miệng, thở không khí lạnh và khô, và/hoặc thông khí phút tăng. Trong thực tế, hít phải một lượng lớn không khí lạnh trong khi tập thể dục được cho là yếu tố kích phát của hen suyễn do tập thể dục gây ra [16].
Trong quá trình thở ra, khí thở ra chuyển nhiệt trở lại niêm mạc đường hô hấp trên. Khi nhiệt độ đường khí giảm, khả năng giữ nước cũng giảm. Do đó, nước ngưng tụ được tái hấp thu bởi niêm mạc, phục hồi hydrat hóa của nó. Quan trọng hơn, trong thời tiết lạnh, lượng nước ngưng tụ có thể vượt quá khả năng niêm mạc để chấp nhận nước. Do đó, lượng nước còn lại tích lũy trong đường hô hấp trên với hậu quả là chảy nước mũi.
Để tránh những hậu quả nói trên liên quan đến việc thiếu độ ẩm ở bệnh nhân thở máy, một loạt các thiết bị (làm ẩm) đã được giới thiệu trong thực hành lâm sàng. Trong các đoạn dưới đây, chúng tôi mô tả các loại máy tạo độ ẩm hiện tại được sử dụng trong thông khí cơ học.
4. Các loại thiết bị làm ẩm
Máy làm ấm và ẩm (humidiiers) là các thiết bị bổ sung hơi nước vào khí. Chúng
được phân loại là chủ động hoặc thụ động dựa trên sự hiện diện của nguồn nhiệt và nước bên ngoài (làm ẩm chủ động), hoặc sử dụng nhiệt độ và độ ẩm của bệnh nhân để đạt được độ ẩm trong hơi thở tiếp theo (làm ẩm thụ động).
4.1 Làm ẩm chủ động (Active Humidifiers)
Làm ẩm chủ động hoạt động bằng cách cho phép không khí đi qua bên trong một buồng chứa nước nóng (heated water reservoir). Các thiết bịnày được đặt trong nhánh hít vào (inspiratory limb) của bộ dây máy thở, gần bên phía máy thở.
Sau khi không khí được nạp với hơi nước trong buồng chứa, nó di chuyển dọc theo nhánh hít vào đến đường hô hấp của bệnh nhân. Khi hơi nước ngưng tụ có thể tích tụ khi nhiệt độ xung quanh của nhánh hít vào giảm, các hệ thống này được bổ sung các bẫy nước, đòi hỏi phải đổ bỏ nước ngưng tụ thường xuyên để tránh nguy cơ gây nhiễm bẩn bộ dây thở. Hình 1 cho thấy một sơ đồ của một máy tạo độ ẩm nóng hoạt động ở 50°C để đạt được AH là 84 mg/L ở phía bên của máy tạo độ ẩm nhưng chỉ đạt được AH là 44 mg/L do sự ngưng tụ đáng kể trong ống [17].
Do thiếu sót nói trên, máy làm ẩm và ấm thường được bổ sung thêm dây điện trở nung nóng (HWH, heated wires) dọc theo nhánh hít vào để giảm thiểu vấn đề này. Những máy tạo độ ẩm này có 2 cảm biến (sensors) ở đầu ra của máy tạo độ ẩm và ở phần Y, gần bệnh nhân. Các cảm biến này hoạt động theo kiểu vòng kín, cung cấp phản hồi liên tục cho bộ điều chỉnh trung tâm để duy trì nhiệt độ mong muốn ở mức đầu xa (Y-piece). Khi nhiệt độ thực tế vượt quá hoặc giảm quá mức cực đoan nhất định, hệ thống báo động sẽ được kích hoạt.
Mặc dù hệ thống lý tưởng nên cho phép tự động khắc phục dựa trên mức độ ẩm, cảm biến thương mại có sẵn cung cấp phản hồi dựa trên những thay đổi về nhiệt độ [18]. Hình 2 cho thấy một máy tạo độ ẩm hoạt động với một sợi dây nóng trong nhánh hít vào; cả hai cảm biến nhiệt độ, một ở phía bên của bệnh nhân và một ở đầu ra của buồng chứa nước nóng, được hiển thị [17]. Cài đặt nhiệt độ thông thường cho các máy làm ẩm hiện tại là 37°C. Hiệu suất của máy tạo độ ẩm có thể bị ảnh hưởng bởi nhiệt độ phòng, cũng như thông khí phút của bệnh nhân.
Việc tăng thông khí phút, với cùng một nhiệt độ của buồng chứa nước nóng có thể không đủ để cung cấp AH phù hợp cho bệnh nhân. Do đó, một số máy tạo độ ẩm được bổ sung các hệ thống bù tự động, tính toán lượng năng lượng nhiệt cần thiết để làm ẩm lượng khí nhất định và thay đổi nhiệt độ của buồng chứa nước cho phù hợp. Lellouche et al. nghiên cứu hiệu suất của hai HWH và HH không có dây nóng, dưới các nhiệt độ phòng khác nhau (cao, 28–30°C; bình thường, 22-24°C).
Các tác giả cũng nghiên cứu hiệu suất thiết bị bằng cách thay đổi nhiệt độ khí trong máy thở và dưới hai mức thông khí phút (V E) khác nhau (thấp 10 L/phút và cao 21 L/phút). Sự hiện diện của thông khí và nhiệt độ phòng cao làm giảm hiệu suất làm ẩm, với độ ẩm tuyệt đối dưới 20 mg H 2O/L. Một trong những máy tạo độ ẩm được thử nghiệm có hệ thống bù tự động cho những thay đổi trong thông khí phút.
Mô hình này đạt được mức AH cao hơn so với những máy chỉ dựa vào cảm biến nhiệt độ [19]. Hơn nữa, các nghiên cứu khác cũng đã tăng cường ảnh hưởng của nhiệt độ phòng, sai lệch trong thông khí phút và nhiệt độ khí của máy thở ở các mức độ ẩm tuyệt đối được phân phối cho bệnh nhân [20–22]. Đáng chú ý, một số nghiên cứu chỉ ra rằng máy làm ẩm mà không có dây nung nóng đạt được độ ẩm cao hơn HWHs. Tuy nhiên, rõ ràng là chúng có liên quan đến sự ngưng tụ và bài tiết dịch đường hô hấp hơn [23].
Do đó, các loại máy làm ẩm này đang ngày càng trở nên không phổ biến trong các nhà cung cấp chăm sóc hô hấp. Như đã đề cập trước đây, dây dẫn nhiệt được làm nóng có thể giảm thiểu sự ngưng tụ. Tuy nhiên, không khí thở ra có thể tạo thành nước ngưng tụ ở nhánh thở ra. Điều này đã dẫn đến việc sử dụng các mạch dây nóng đôi (DHW, double heated wire).
Thực hành này đã thay thế việc sử dụng các mạch dây nóng đơn (SHW, single heated wires) tại một số quốc gia [24]. Một kỹ thuật được mô tả khác để hạn chế sự ngưng tụ trong nhánh thở ra là sử dụng bộ dây thở ra dạng xốp (porous) [25].
![Hình 1: Máy làm ẩm và ngưng tụ nóng, được điều chỉnh từ các nguyên tắc cơ bản về chăm sóc hô hấp của Egan’s Fundamentals of Respiratory Care, 10th edition, St. Louis:Mosby-Elsevier; 2012: 1424 [17].](https://www.healcentral.org/wp-content/uploads/2021/02/b11_anh_1.jpg)
![Hình 2: Máy tạo độ ẩm và ấm có dây nóng ở nhánh hít vào, được điều chỉnh từ các nguyên tắc cơ bản về chăm sóc hô hấp của Egan’s Fundamentals of Respiratory Care, 10th edition, St. Louis:Mosby-Elsevier; 2012: 1424 [17]](https://www.healcentral.org/wp-content/uploads/2021/02/b11_anh_2.jpg)
4.2 Làm ẩm sủi bọt (bubble).
Trong máy tạo độ ẩm sủi bọt, khí được đẩy xuống một ống vào đáy buồng chứa nước (Hình 3). Khí thoát ra từ đầu xa của ống dưới mặt nước tạo thành bong bóng, có độ ẩm khi chúng di chuyển lên mặt nước. Một số các máy tạo độ ẩm có bộ khuếch tán ở đầu xa của ống làm vỡ khí thành các bong bóng nhỏ hơn.
Các bong bóng nhỏ hơn, giao diện không khí – chất lỏng lớn hơn cho phép hàm lượng hơi nước cao hơn. Các yếu tố khác ảnh hưởng đến hàm lượng hơi nước của khí sinh ra là lượng nước trong bình chứa và tốc độ dòng khí. Đơn giản, cột nước trong thùng chứa càng cao, thì càng có nhiều giao diện không khí – chất lỏng hơn, do đó mực nước phải được kiểm tra thường xuyên. Xét về tốc độ dòng khí, khi dòng khí tốc độ chậm được phân phối, có nhiều thời gian hơn để làm ẩm khí.
Máy tạo ẩm sủi bọt có thể không làm nóng hoặc có làm nóng. Thông thường, các máy tạo độ ẩm sủi bọt không được làm nóng, được sử dụng với hệ thống phân phối oxy bằng đường mũi có lưu lượng thấp.
Máy làm ẩm sủi bọt có làm nóng cung cấp độ ẩm tuyệt đối cao hơn. Chúng được thiết kế để làm việc với tốc độ dòng chảy cao tới 100 L/phút. Những máy tạo ẩm này thường sử dụng bộ khuyếch tán để tăng giao diện không khí – chất lỏng. Một vấn đề với máy làm ẩm sủi bọt có làm nóng là biểu hiện sức đề kháng cao với luồng không khí, gây tăng công thở hơn so với loại mặt thoáng (passover) [26, 27]. Hơn nữa, chúng có thể tạo ra dạng hạt khí dung [28, 29]. Tuy nhiên, theo hướng dẫn của CDC về phòng ngừa viêm phổi liên quan đến thở máy báo cáo rằng lượng aerosol được tạo ra bởi các loại máy tạo độ ẩm này có thể không có ý nghĩa lâm sàng [30].
Mặc dù vậy, việc sử dụng máy tạo độ ẩm sủi bọt trong quá trình thông khí cơ học đã đánh mất lợi thế cho loại mặt thoáng.
![Hình 3: Máy tạo độ ẩm sủi bọt và mặt thoáng, được điều chỉnh từ Egan’s Fundamentals of Respiratory Care, 10th edition, St. Louis: Mosby-Elsevier; 2012: 1424 [17].](https://www.healcentral.org/wp-content/uploads/2021/02/b11_anh_3.jpg)
4.3 Làm ẩm mặt thoáng (passover).
Trong các máy tạo độ ẩm mặt thoáng (Hình 3), khí đi qua một buồng chứa nước nóng mang hơi nước đến bệnh nhân. Chúng thường được sử dụng cho mục đích thông khí cơ học xâm lấn và không xâm lấn. Một biến thể khác của làm ẩm mặt thoáng là một cái bấc (wick) (Hình 3).
Trong loại thiết bị này, khí đi vào một buồng chứa và đi qua một bấc hoạt động như một miếng bọt biển có đầu xa của nó ngâm trong nước. Các lỗ chân lông bấc cung cấp thêm giao diện không khí – chất lỏng, cho phép độ ẩm hơn so với máy làm ẩm đơn giản. Các buồng chứa nước được cho ăn thông qua một hệ thống khép kín. Hệ thống này có thể được cung cấp nước hoặc bằng tay thông qua một cổng hoặc hệ thống cấp nước qua phao nổi (float feed system) đảm bảo mực nước vẫn hằng định trong toàn bộ thời gian. Khi khí khô đi vào buồng và di chuyển qua bấc, nhiệt độ và độ ẩm tăng lên.
Do thực tế rằng khí không xuất hiện bên dưới mặt nước, không có bong bóng nào được tạo ra. Một loại máy tạo độ ẩm mặt thoàng thứ ba liên quan đến màng kỵ nước (hydrophobic membrane) (Hình 3). Như với thiết bị bấc, khí khô đi qua bề mặt màng. Tuy nhiên, đặc tính kỵ nước của nó chỉ cho phép hơi nước đi qua, ngăn cản nước lỏng đi qua nó. Tương tự như máy tạo độ ẩm dùng bấc, bong bóng và hạt khí dung không được tạo ra. Như đã đề cập trước đây, các loại máy làm ẩm này thường được sử dụng trong quá trình thông khí cơ học hơn so với các loại sủi bọt do khả năng tạo sức cản với dòng khí thấp hơn và không sinh các hạt khí dung.
Trong mọi trường hợp, đầu dò nhiệt độ được đặt gần đầu nối Y của bộ dây máy thở để đảm bảo cung cấp khí với nhiệt độ tối ưu. Như đã nói ở trên, sự có mặt của nước ngưng tụ trong ống có thể làm tăng trở kháng, có thể làm giảm thể tích cung cấp trong thông khí điều khiển áp suất, hoặc tăng áp suất đỉnh trong các chế độ thông khí điều khiển thể tích. Mặc dù nhu cầu của các dây làm nóng được đề cập ở trên để tránh ngưng tụ không mong muốn, cũng cần biết việc sử dụng các dây này có thể gây nguy cơ do nhiệt [31].
Do đó, các hướng dẫn thực hành lâm sàng của Hiệp hội Chăm sóc hô hấp Hoa Kỳ (AARC) của Mỹ khuyến cáo việc cung cấp khí với nhiệt độ tối đa là 37°C và 100% RH (44 mg H 2O/L) [11].
Về hệ thống làm nóng không khí, hiện tại có 6 loại thiết bị. Loại đĩa nóng (hot plate), định vị phía dưới của buồng tạo độ ẩm, là một trong những loại phổ biến nhất được sử dụng. Các thiết bị khác bao gồm loại bao quanh (wrap around), bao quanh buồng tạo độ ẩm; loại cổ (collar), nằm giữa buồng chứa và lổ thoát (outlet); thiết bị nóng nhúng vào chất lỏng (immersion heater), được đặt trực tiếp bên trong buồng chứa nước; và dây được làm nóng (heated wire), được đặt ở nhánh hít vào của máy thở.
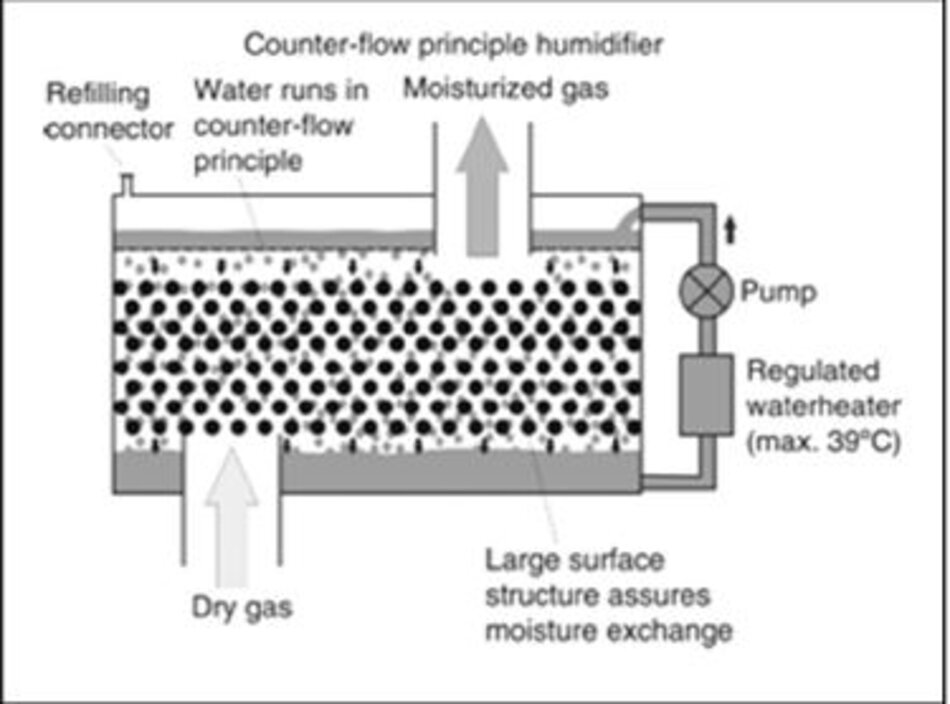
4.4 Làm ẩm ngược dòng (Counter Flow)
Trong bộ tạo độ ẩm ngược dòng được mô tả gần đây, nước được làm nóng bên ngoài bộ tạo hơi. Sau khi được đun nóng, nước được bơm lên đỉnh máy tạo độ ẩm, đi vào bên trong máy tạo ẩm thông qua lỗ chân lông có đường kính nhỏ và sau đó chạy xuống một khu vực bề mặt lớn. Khí chảy theo hướng ngược lại. Trong suốt quá trình đi qua buồng tạo độ ẩm, không khí được giữ ẩm và làm ấm đến nhiệt độ cơ thể.
Schumann et al. so sánh máy tạo độ ẩm ngược dòng, làm ẩm mặt thoáng có nung nóng (heated passover), và bộ trao đổi nhiệt và độ ẩm (HME) trong mô hình phổi nhân tạo. Các tác giả đã chứng minh rằng thiết bị dòng chảy ngược lại tạo ra ít công thở hơn so với các thiết bị khác. Ngoài ra, hiệu suất làm ẩm của mô hình dòng chảy ngược không phụ thuộc vào lưu lượng và tần số thở, ngược lại với làm ẩm mặt thoáng trong đó hiệu suất làm ẩm giảm với tần số máy thở [32]. Công nghệ này hứa hẹn nhưng cần nhiều nghiên cứu hơn trước khi nó được phổ biến rộng rãi.
4.5 Làm ẩm bốc hơi nội tuyến (Inline Vaporizer)
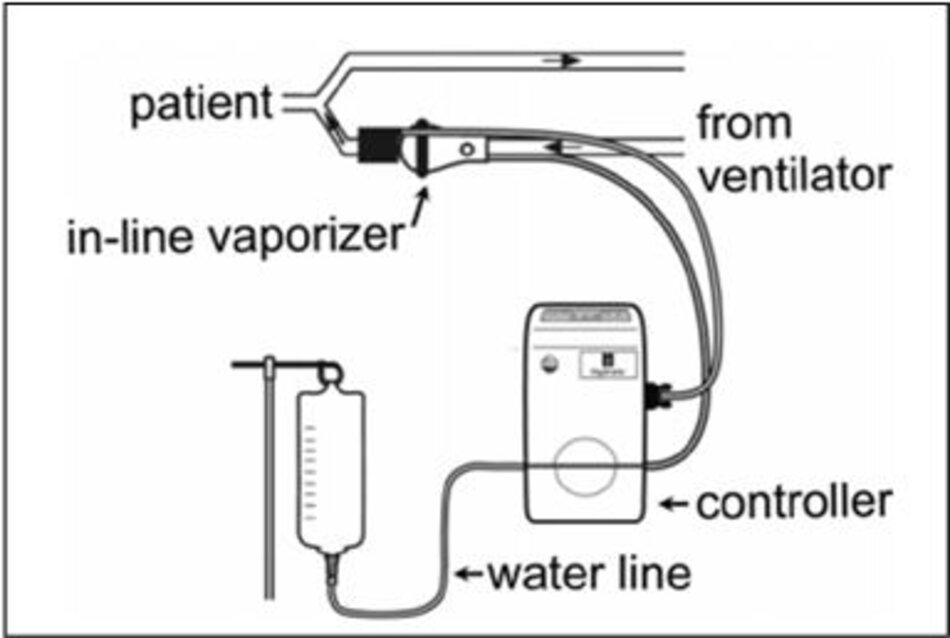
Bộ tạo ẩm bốc hơi nội tuyến mới sử dụng một capsule bằng nhựa, nơi hơi nước được bơm vào khí trong nhánh hít vào của bộ dây máy thở, gần với đầu nối với bệnh nhân. Ngoài hơi nước, hệ thống sưởi khí được bổ sung bằng một máy sưởi đĩa nhỏ trong capsule. Nước được đưa đến capsule bằng bơm nhu động nằm trong bộ điều khiển.
Lượng nước bơm đến capsule được thiết lập bởi các bác sĩ dựa trên thể tích phút thông qua bộ dây máy thở. Cả nhiệt độ và độ ẩm đều có thể điều chỉnh và hiển thị liên tục. Sự gần với kết nối wye làm giảm bớt yêu cầu đối với dây nóng và đầu dò nhiệt độ bên ngoài. Nhà sản xuất báo cáo cung lượng AH rất cao với hệ thống này. Tuy nhiên, hệ thống này chỉ được nghiên cứu trong quá trình thông khí bộ gõ tần số cao (high frequency percussive ventilation) [33, 34].
5. Làm ẩm thụ động (Passive Humidifiers)
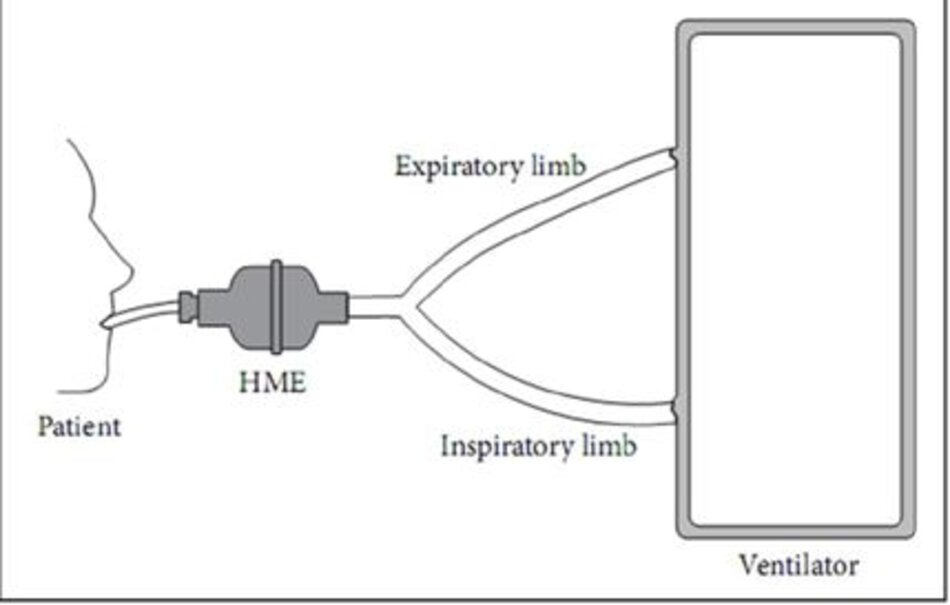
Bộ trao đổi nhiệt và độ ẩm (HME, Heat and Moisture Exchanger)
Bộ trao đổi nhiệt và độ ẩm cũng được gọi là mũi nhân tạo vì chúng bắt chước hoạt động của khoang mũi trong khí ẩm. Chúng hoạt động trên cùng một nguyên tắc vật lý, vì chúng chứa một phần tử ngưng tụ, giữ lại độ ẩm từ mọi hơi thở lúc thở ra và trả lại cho hơi thở hít vào tiếp theo. Không giống như các máy tạo độ ẩm và ấm, được đặt trong nhánh hít vào của bộ dây thở, các thiết bị HME được đặt giữa ống nối Y và bệnh nhân (Hình 4).
Điều này có thể làm tăng sức cản với luồng không khí không chỉ trong giai đoạn hít vào, mà còn trong giai đoạn thở ra. Trong những trường hợp cần sử dụng thuốc khí dung, HME cần phải được loại bỏ khỏi bộ dây máy thở để tránh lắng đọng hạt khí dung trong các bộ HME. Nếu không, các HME có khả năng thay đổi từ “chức năng HME” thành “chức năng khí dung” được sử dụng.
Thiết kế ban đầu của HMEs sử dụng chất gây ngưng tụ làm bằng các kim loại có tính dẫn nhiệt cao. Vì vậy, họ chỉ có thể lấy lại được 50% độ ẩm thở ra của bệnh nhân. Do đó, HME cung cấp độ ẩm từ 10-14 mg H 2O/L, với thể tích khí lưu thông (VT) dao động từ 500 mL đến 1000 mL.
Những thiết bị này được gọi là HME đơn giản. Chúng không được thải bỏ (sau một thời gian sử dụng) và tạo ra một sức đề kháng đáng kể trong quá trình thông khí cơ học [35, 36]. Các thiết kế mới hơn của HME bao gồm kỵ nước, kết hợp kỵ nước và hút ẩm, và HME hút ẩm thuần túy.
Trong các HMEs kỵ nước, buồng ngưng tụ được làm bằng một bộ phận chống thấm nước với độ dẫn nhiệt thấp duy trì độ dốc nhiệt độ cao hơn trong trường hợp HME đơn giản. Trong các HME hút ẩm kỵ nước kết hợp, một muối hút ẩm (canxi hoặc lithium chloride) được thêm vào trong HME kỵ nước. Các muối này có ái lực hóa học để thu hút các hạt nước và do đó làm tăng khả năng ẩm của HME. HME hút ẩm thuần túy chỉ có khoang hút ẩm. Trong quá trình thở ra, hơi nước ngưng tụ trong thành phần của HME cũng như trong các muối hút ẩm. Trong hít vào, hơi nước thu được từ các muối, có độ ẩm tuyệt đối dao động từ 22 đến 34 mg H2O/L. Hình 5 minh họa cấu trúc cơ bản và nguyên tắc làm việc của các HME.
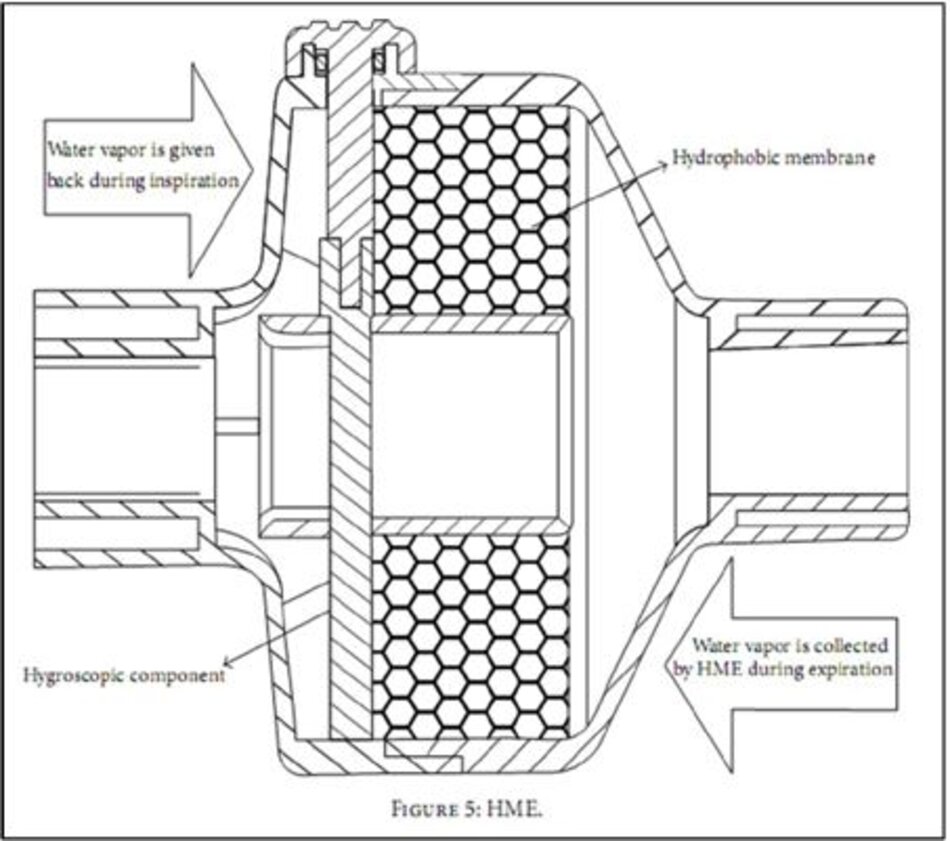
Hydrophobic HMEs là nguyên nhân gây hẹp đường kính NKQ hơn so với hygroscopic HME [37]. Do đó, các HME nói trên không thường xuyên được sử dụng. Các bộ lọc (filter) có thể được thêm vào các HME kỵ nước hoặc hút ẩm cho ra bộ lọc vừa trao đổi nhiệt và độ ẩm (HMEF). Các bộ lọc này hoạt động dựa trên lọc tĩnh điện hoặc cơ khí.
Cụ thể, dựa trên cơ chế chiếm ưu thế được áp dụng, các bộ lọc này có thể được phân loại thành các bộ lọc xếp li hoặc tĩnh điện. Các bộ lọc xếp li có nhiều xơ dày hơn và ít điện tích hơn, trong khi các bộ lọc tĩnh điện có nhiều điện tích hơn và ít xơ dày hơn. Các bộ lọc xếp li hoạt động tốt hơn như các rào cản đối với các tác nhân gây bệnh do vi khuẩn và virus hơn các bộ lọc tĩnh điện.
Tuy nhiên, chúng mang lại khả năng đề kháng với luồng khí cao hơn [38]. Bản chất xếp li của màng gây ra luồng không khí hỗn loạn, làm tăng sự lắng đọng của mầm bệnh vào bên trong bộ lọc. Các bộ lọc tĩnh điện phải chịu một điện trường. Vì vi khuẩn và vi rút mang điện tích, chúng bị mắc kẹt bên trong điện trường của các bộ lọc này. Những bộ lọc này thường có lỗ (pores) lớn hơn so với màng xếp li, và chúng chủ yếu dựa vào cơ chế tĩnh điện. Các bộ lọc được mô tả trước đây ít tạo độ ẩm và tăng sức đề kháng. Do đó, chúng được sử dụng chủ yếu làm rào cản đối với tác nhân gây bệnh [15].
Các tiêu chuẩn thiết kế và hiệu suất của HME được định nghĩa bởi Tổ chức tiêu chuẩn hóa quốc tế (ISO). Theo các tiêu chuẩn này, HME phù hợp phải có hiệu suất ít nhất 70%, cung cấp ít nhất 30 mg/L hơi nước. Trong một nghiên cứu gần đây, Lellouche và các đồng nghiệp đã độc lập đánh giá khả năng ẩm của 32 HME. Đáng chú ý, 36% số HME được thử nghiệm có AH thấp hơn 4 mg H2O/L so với những gì được liệt kê bởi nhà sản xuất. Trong thực tế, trong một số HME trong số đó, sự khác biệt là cao hơn 8 mg H2O/L [39].
Bằng trực giác, khi HME loại trừ vấn đề ngưng tụ nước trong bộ dây máy thở, nó có thể được coi là “yếu tố lựa chọn” để ngăn ngừa viêm phổi do máy thở (VAP). Tuy nhiên, cho dù sự hiện diện của ngưng tụ nước trong bộ dây máy thở đại diện cho một yếu tố quan trọng cho sự phát triển của VAP, tần suất mắc VAP trong các bộ dây máy thở được duy trì tốt vẫn còn gây tranh cãi. Hơn nữa, HME cũng có một số thiếu sót. Cụ thể, sự tồn tại của dịch tiết hoặc máu trong thiết bị có thể làm tăng khả năng cản trở dòng khí và tăng công thở. Trong trường hợp cực đoan, hoàn toàn tắc nghẽn đường thở đã được báo cáo [40]. Do đó, lựa chọn bệnh nhân trở thành một thành phần thiết yếu trong việc sử dụng HME. Bảng 2 cho thấy chống chỉ định đối với việc sử dụng HME [11].
![Bảng 2: Chống chỉ định đối với bộ trao đổi nhiệt và độ ẩm theo Hướng dẫn thực hành lâm sàng AARC 2012 [11].](https://www.healcentral.org/wp-content/uploads/2021/02/b11_anh_8.jpg)
Trong mô hình Booster, thiết bị sưởi ấm được kết hợp giữa HME và bệnh nhân. Trong thời gian hít vào, khí đi qua HME mang hơi nước dựa trên hoạt động thụ động của HME và sau đó thiết bị sưởi ấm thêm vào độ ẩm của khí trước khi nó đến bệnh nhân. Khi nước đi vào HME-Booster, nó làm bão hòa màng kỵ nước chứa trong nó. Độ ẩm trong màng bão hòa sau đó được tăng nhiệt độ bằng đơn vị điều khiển nhiệt độ dương kết nối với nó [41]. Người ta cho rằng việc sử dụng thiết bị này có thể làm tăng AH thêm 2-3 mg H2O/L so với HME thụ động [42].
![Hình 6: HME-Performer. Adapted from Critical Care, with permission [42].](https://www.healcentral.org/wp-content/uploads/2021/02/b11_anh_9.jpg)
Humid Heat là một HME hút ẩm có nguồn nhiệt bên ngoài với nước được thêm vào ở phía bệnh nhân [15]. Trong một nghiên cứu, nó đã cung cấp độ ẩm tuyệt đối 34,5 mg H2O/L [43]. Humid Heat có giá trị đặt trước cho nhiệt độ và độ ẩm. Thông số duy nhất cần được thiết lập là giá trị của thể tích phút của máy thở, làm cho việc sử dụng nó rất đơn giản.
Hygrovent Gold là một HME kỵ nước chủ động có một bộ chuyển đổi và một thiết bị làm nóng có thể được thêm vào và một nguồn cung cấp nước vào trong HME. Có một cảm biến nhiệt để tránh bị quá ẩm. Trong điều kiện bình thường, nó cung cấp AH 36,3 mg H2O/L. Tăng sức đề kháng dòng khí có khả năng liên quan đến sự tích tụ của nước ngưng tụ trong thành phần thụ động [44].
Cuối cùng, một mô hình HME hoạt động khác dựa trên các phản ứng hóa học. Trong các HME, khí carbon dioxide trong hơi thở thở ra được khai thác để tạo ra nhiệt thông qua phản ứng hóa học khi nó đi qua máy tạo độ ẩm. Broach và Durbin Jr. đã tiến hành một thử nghiệm lâm sàng ngẫu nhiên có đối chứng trên năm mươi bệnh nhân trải qua ghép động mạch vành và so sánh giữa HME được làm nóng bằng hóa học và những người thụ động thông thường. HME được làm nóng bằng hóa học dẫn đến việc làm ấm nhanh hơn các bệnh nhân bị giảm thân nhiệt nhẹ, không có sự khác biệt về kết cục lâm sàng [45]. Do kinh nghiệm hạn chế với thiết bị này, HME hoạt động về mặt hóa học hiện không được sử dụng trong thực hành lâm sàng.
6. Giám sát hệ thống ẩm
Khi thiết lập mức độ ẩm ở bệnh nhân thở máy, các nhà trị liệu hô hấp thường tuân theo khuyến nghị của Viện Tiêu chuẩn Quốc gia Hoa Kỳ (ANSI), liên quan đến mức hơi nước vượt quá 30 mg/L.
Trong thực tế, các hướng dẫn gần đây được công bố bởi Hiệp hội Chăm sóc hô hấp Hoa Kỳ (AARC) đề nghị nhiệt độ là 33 ± 2°C với RH là 100% và mức hơi nước là 44 mg/L. Mặc dù các hướng dẫn nói trên, các bác sĩ thường phải đối mặt với vấn đề dựa vào độ ẩm khác nhau mà không chắc chắn về độ chính xác của thiết bị. Đánh giá độc lập nêu lên mối quan tâm về tính hợp lệ của dữ liệu được nhà sản xuất đưa ra [39]. Phương tiện đo độ ẩm đáng tin cậy nhất là sử dụng hệ thống đo nhiệt độ – độ ẩm kế (hygrometer-thermometer system).
Tuy nhiên, các thiết bị này không phải lúc nào cũng có sẵn ở cạnh giường cho mọi bệnh nhân. Do đó, các dấu hiệu thay thế khác nhau đã được đề xuất để theo dõi mức độ ẩm. Các đại diện thay thế phổ biến nhất là các đặc tính chất tiết, quan sát trực quan của ngưng tụ trong hệ thống ống và nhu cầu phải nhỏ nước muối để làm loãng đàm. Nói chung, thể tích dịch tiết tỷ lệ thuận với mứcđộ ẩm. Độ ẩm quá mức sẽ làm tăng thểtích dịch bài tiết, và độ ẩm dưới mức tối ưu sẽ dẫn đến sự khô đàm, cảm giác dịch đặc và giảm thể tích của chúng [46]. Tuy nhiên, mối quan hệ này giả định rằng độ ẩm là yếu tố duy nhất ảnh hưởng đến thể tích dịch tiết.
Như một vấn đề của thực tế, thể tích dịch tiết có thể được thay đổi bằng cách sử dụng thuốc khí dung, tần số của hút đàm, và nhỏ nước muối [47]. Tần số của sự nhỏ nước muối đã được đề xuất bởi một số người như là một đại diện của độ ẩm khí. Tuy nhiên, thực hành này có thể khác nhau rất nhiều từ một học viên so với một học viên khác [48].
Ricard và các đồng nghiệp đã tiến hành một thử nghiệm lâm sàng ngẫu nhiên tiền cứu trên 45 bệnh nhân thở máy để đánh giá xem quan sát trực quan của ngưng tụ trong hệ thống ống có tương quan với các nghiên cứu độ ẩm của các HME và HHs không. Một người quan sát độc lập không biết về kết quả đo độ ẩm, quan sát sự ngưng tụ nước trong hệ thống dây máy thở như sau: khô, chỉ hơi ẩm, ẩm cộng với vài giọt nước, ẩm cộng với nhiều giọt nước, độ ẩm cộng với rất nhiều giọt nước và ướt nước.
Điều thú vị là có một mối tương quan đáng kể giữa phương pháp quan sát trực quan và phép đo hút ẩm [49]. Mặc dù các dữ liệu được mô tả trước đó, vẫn chưa có sự đồng thuận rõ ràng về một cách phổ quát để đánh giá độ ẩm đầy đủ ở bên cạnh giường.
7. Lựa chọn thiết bị làm ẩm phù hợp
7.1 Hiệu suất làm ẩm
Theo hướng dẫn AARC, các HHs nên cung cấp mức độ ẩm tuyệt đối từ 33 đến 44 mg H2O/L, trong khi HME phải cung cấp tối thiểu 30 mg H2O/L [11]. Các nghiên cứu ban đầu kiểm tra các HME đã giải quyết được hiệu suất của chúng trong các thiết lập gây mê, điều này đòi hỏi phải thử nghiệm chúng trong một thời gian ngắn.
Trong một nghiên cứu, sáu HME khác nhau đã được tìm thấy để cung cấp một AH thấp 14-26 mg H2O/L [50]. Khi các HME bắt đầu được thử nghiệm trong môi trường chăm sóc đặc biệt, các lo ngại liên quan đến việc tăng tần suất tắc nghẽn ống nội khí quản. Trong một loạt các trường hợp, Cohen et al. báo cáo 15 trường hợp tắc nghẽn NKQ khi sử dụng HMEF kỵ nước, trong khi chỉ có một trường hợp với độ ẩm tạo bọt đã được chứng minh.
Tuy nhiên, hầu hết bệnh nhân bị tắc nghẽn NKQ đều cần thông khí phút cao hơn 10 L/phút, làm giảm tính tổng quát của các kết quả này [51]. Trong một thử nghiệm đối chứng ngẫu nhiên tiền cứu, HMEF được so sánh với các HHs. HMEF được thay đổi hàng ngày. Dữ liệu được phân tích từ 31 bệnh nhân trong HMEF và 42 bệnh nhân trong nhóm HHs. Sáu bệnh nhân trong nhóm HMEF đã bị tắc nghẽn NKQ, trong khi không có sự tắc nghẽn nào được ghi nhận trong nhóm HHs [38].
Nghiên cứu đã sớm chấm dứt sau cái chết của một bệnh nhân với tắc nghẽn hoàn toàn của ống khí quản của mình. Ngoài ra, Roustan et al. tìm thấy tắc nghẽn NKQ nhiều hơn với HMEF, khi nó được so sánh với một hoại HHs [52]. Tuy nhiên, điều đáng chú ý là những nghiên cứu này được thực hiện với các HMEs kỵ nước, và hầu hết các trường hợp tắc nghẽn NKQ được báo cáo với thông khí phút cao. Dựa trên các thông tin nói trên, các HME hút ẩm kỵ nước kết hợp nên là lựa chọn đầu tiên nếu độ ẩm thụ động được chọn, vì chúng có khả năng làm ẩm tốt hơn so với các HME kỵ nước [53-55].
Trong thực tế, một thử nghiệm ngẫu nhiên có đối chứng so sánh HME hút ẩm kỵ nước (hydrophobic hygroscopic HME) so với HME kỵ nước (hydrophobic HME) so với HHs và với thông khí phút 10,8 L/phút, 11,6 L/phút và 10,2 L/phút cho thấy sau 72 giờ, đường kính trung bình của ETT giảm 6,5 mm với HME kỵ nước, 2,5 mm với HME kỵ nước hút ẩm và 1,5 mm với HHs [37]. Trong một thử nghiệm tiền cứu được kiểm soát ngẫu nhiên đa trung tâm, bệnh nhân dự kiến yêu cầu thông khí cơ học trong hơn 48 giờ được phân ngẫu nhiên vào một HMEF hút ẩm kỵ nước hoặc HWH. Sự tắc nghẽn ống nội khí quản xảy ra ở năm bệnh nhân trong HWH và chỉ có một bệnh nhân trong nhóm HMEF. Tuy nhiên, sự khác biệt này không có ý nghĩa thống kê.
Đáng chú ý, bệnh nhân có chống chỉ định đối với HME đã bị loại khỏi thử nghiệm này, chủ yếu là do sự hiện diện của chất tiết đặc [56].
Xét về độ dài sử dụng của HME, một số lo ngại về hiệu suất giảm với thời gian kéo dài của chúng đã được thể hiện. Do đó, hầu hết các nhà sản xuất khuyên bạn nên thay đổi HME mỗi 24 giờ. Vấn đề này đã là một lĩnh vực phát triển nghiên cứu. Djedaini et al. chứng minh rằng không có sự gia tăng sức đề kháng của HMEs kỵ nước hút ẩm nếu chúng được thay đổi sau 48 giờ so với mỗi 24 giờ [57].
Một nghiên cứu khác cho thấy HMEs hút ẩm kỵ nước đạt được độ ẩm tuyệt đối tương tự khi được sử dụng trong 24 hoặc 48 giờ, không tăng áp lực đường thở trung bình ở 48 giờ [58]. Kết quả tương tự đã được chứng minh trong các nghiên cứu tiếp theo sử dụng HME trong 48 giờ thay vì 24 giờ [59, 60].
Hơn nữa, một nghiên cứu cho thấy rằng HMEs có thể được sử dụng trong 96 giờ mà không có sự thay đổi đáng kể trong sản xuất độ ẩm tuyệt đối. Tuy nhiên, dữ liệu này thu được từ một nhóm chỉ có 13 bệnh nhân được thông khí cơ học vì lý do thần kinh, mà không có tiền sử của các vấn đề hô hấp mạn tính [61]. Trong một nghiên cứu ngẫu nhiên không được kiểm soát, Thomachot et al. kiểm tra việc sử dụng mở rộng các HMEs kỵ nước trong 7 ngày. Đáng chú ý là không có sự cố nào xảy ra với các trường hợp ETT, và sự đề kháng của HME không tăng lên so với việc trao đổi chúng mỗi 24 giờ [62].
Cuối cùng, Kapadia et al. tiến hành một nghiên cứu để ghi lại tai nạn đường hô hấp ở hơn 7900 bệnh nhân thở máy hơn 6 năm. Trong 3 năm đầu tiên của nghiên cứu, HMEF đã được thay đổi sau mỗi 24 giờ, và giai đoạn này không liên quan đến việc không có sự tắc nghẽn ống nội khí quản. Trong 3 năm cuối của nghiên cứu, HMEF đã được thay đổi sau 48 giờ, và điều này liên quan đến 13 lần tắc nghẽn ống nội khí quản trong số 2932 bệnh nhân [63]. Tỷ lệ hiện tượng tắc nghẽn ống nội khí quản vẫn còn rất thấp so với các nghiên cứu được thực hiện trên các HME kỵ nước kém hiệu quả [51-53].
Điều đáng nói là, vì HME là các thiết bị thụ động yêu cầu duy trì nhiệt để cung cấp chức năng hiệu quả, chúng được coi là chống chỉ định cho bệnh nhân giảm nhiệt với nhiệt độ thấp hơn 32°C [11]. Trong thực tế, Lellouche và các đồng nghiệp đã tiến hành một thử nghiệm chéo ngẫu nhiên tiền cứu để kiểm tra ảnh hưởng của HME ở 9 bệnh nhân bị hạ thân nhiệt vừa phải sau khi ngừng tim. HMEs dẫn đến làm ẩm thấp hơn so với các máy làm ẩm và ấm [64]. Để bù đắp cho bất lợi tiềm năng này, các HME chủ động được kết hợp với thực hành lâm sàng. Mặc dù đạt được lợi ích cuối cùng trong làm ẩm, HME chủ động có những bất lợi về việc đặt một nguồn nhiệt gần bệnh nhân, và sử dụng nó cũng đòi hỏi một khoảng chết cao hơn so với HME thụ động [65]. Ngoài ra, HME có liên quan đến tăng nguy cơ bị tắc NKQ so với máy làm ẩm và ấm. Vì vậy, nó được khuyến khích không được sử dụng ở những bệnh nhân có đàm đặc [66].
7.2 Ảnh hưởng đến cơ học thông khí
HME có tác động không thuận lợi trên các thông số thông khí. Chúng làm tăng khoảng chết, do đó làm giảm sự thông khí phế nang và dẫn đến gia tăng áp lực carbon dioxide động mạch. Do đó, để giữ cho cùng một mức độ thông khí phế nang, thể tích khí lưu thông phải được tăng lên, cho thấy bệnh nhân bị phơi nhiễm chấn thương phổi do thể tích. Ở những bệnh nhân thở tự nhiên, việc bổ sung khoảng chết gắn với HME có thể làm tăng công thở gây cản trở cho bệnh nhân cai thở máy [67].
Prat và các cộng sự đã chứng minh mức giảm trung bình là 17 mm Hg ở mức độ PaCO 2 ở bệnh nhân ARDS, khi sử dụng HHs thay cho HME. Điều này được cho là có liên quan đến sự khác biệt trong khoảng chết 95 mL giữa các thiết bị [68]. Tối ưu hóa PaCO 2 ở bệnh nhân ARDS bằng cách thay thế các HME bằng các HHs cũng được chứng minh trong các nghiên cứu khác [69–71]. Le Bourdellès et al. tiến hành một thử nghiệm chéo ngẫu nhiên so sánh HME với HHs trong khi cai máy cho 15 bệnh nhân.
Họ gợi ý rằng mặc dù khoảng chết do các HME có thể có thể là tầm thường, nhưng nó có thể ảnh hưởng xấu đến quá trình cai máy ở những bệnh nhân có dự trữ hô hấp hạn chế [72]. Phát hiện này sau đó được tăng cường bởi một nghiên cứu ngẫu nhiên có kiểm soát được thực hiện bởi Girault và các đồng nghiệp trên 11 bệnh nhân thở máy bị suy hô hấp mãn tính [73]. Hơn nữa, Iotti và các đồng nghiệp đã so sánh ảnh hưởng của một HHs, HME mà không có một bộ lọc, và HMEF trên mười bệnh nhân thông khí với chế độ PSV.
Sự gia tăng cao nhất trong khoảng chết và căng phế nang động đã được nhìn thấy với HMEF. Điều này đã được tiết lộ bởi sự gia tăng trong yêu cầu hỗ trợ áp lực, trong đó dao động từ các phương tiện: 12,8 cm H2O với HHs, 14,8 cm H2O với HMEs mà không có bộ lọc, và 17,6 cm H2O với HMEFs [74]. Ngoài hiệu ứng khoảng chết, HME tăng sức đề kháng hít vào và thở ra, góp phần vào sự phát triển của PEEP nội sinh [75].
7.3 Kết hợp với viêm phổi thở máy (VAP)
Năm 1998, Cook và cộng sự. tiến hành một phân tích gộp bao gồm năm nghiên cứu ngẫu nhiên có đối chứng được thực hiện từ năm 1990 đến năm 1997. Các tác giả tìm thấy tỷ lệ VAP thấp hơn với việc sử dụng HME so với HHs [76]. Tuy nhiên, tỷ lệ VAP thấp hơn này hầu hết chỉ được tìm thấy trong một trong năm nghiên cứu được đưa vào [77]. Trong một phân tích gộp tiếp theo, không có sự khác biệt về tỷ lệ VAP giữa HH và HME [78]. Phân tích gộp được xuất bản gần đây nhất bao gồm mười ba nghiên cứu ngẫu nhiên có đối chứng. Nó không tìm thấy sự khác biệt về tỷ lệ mắc VAP [79].
Sự khác biệt về kết quả giữa các phân tích gộp này có thể là do sự đa dạng của các nghiên cứu được đưa vào. Hơn nữa, các nghiên cứu này bao gồm các loại khác nhau và thiết kế của các HMEs và HHs. Sự không đồng nhất này được phản ánh trên các hướng dẫn được đề xuất bởi các hiệp hội khác nhau. Trong các hướng dẫn được xuất bản năm 2008 bởi Hiệp hội Hóa trị kháng sinh của Anh, nó khuyến cáo sử dụng các HME hơn các HHs để giảm tỷ lệ mắc VAP [80].
Tuy nhiên, hướng dẫn này không bao gồm các kết quả của phân tích gộp được thực hiện bởi Siempos và các đồng nghiệp trong năm 2007, trong đó bao gồm số lượng lớn nhất các thử nghiệm trong bốn phân tích gộp được thực hiện cho đến nay. Phân tích gộp này cho thấy không có sự khác biệt về tỷ lệ mắc VAP giữa các nhóm HME và HHs. Các khuyến cáo của CDC không ủng hộ các HME hơn với các HHs [81], và Hiệp hội Lồng ngực Mỹ nói rằng các HME không thể được coi là một công cụ phòng ngừa VAP [82].
Trong năm 2009, Hiệp hội hô hấp châu Âu (ERS), Hiệp hội vi sinh vật lâm sàng và bệnh truyền nhiễm châu Âu (ESCMID), và Hiệp hội chăm sóc chuyên sâu châu Âu (ESICM) đã ban hành một tuyên bố chung thích HME hơn HHs để phòng ngừa VAP. Tuy nhiên, điều này chỉ dựa trên công việc của Torres và cộng sự. mà không bao gồm các nghiên cứu tiếp theo và phân tích gộp [83]. Trong cùng năm đó, Ủy ban Hướng dẫn VAP và Nhóm thử nghiệm chăm sóc tích cực của Canada đã tuyên bố rằng không có sự khác biệt về tỷ lệ mắc VAP giữa các nhóm HME và HHs [84]. Độ nghiêng của các hướng dẫn của Châu Âu đối với HME trùng với xu hướng trong thực hành lâm sàng. Một cuộc khảo sát cắt ngang cho thấy HME thường được sử dụng ở Pháp hơn là ở Canada [85].
Tóm lại, dựa trên các dữ liệu được mô tả trước đây, lựa chọn loại làm ẩm nên
được thực hiện theo bối cảnh lâm sàng cụ thể. Nói chung, HME dễ sử dụng và nhẹ hơn so với máy làm ẩm và ấm. Do đó, chúng tạo thuận lợi cho việc vận chuyển các bệnh nhân thở máy, và chúng không mang các mối nguy hiểm nhiệt tương tự. Về mặt lý thuyết, HHs có độ ẩm tốt hơn so với HME. Chúng thường được ưu tiên ở những bệnh nhân có chất tiết đặc hoặc khi cần thông khí lâu dài.
Tuy nhiên, trong một tổng quan hệ thống Cochrane gần đây, không có sự khác biệt về kết cục lâm sàng. Trong cùng một đánh giá, PaCO2 và thông khí phút đã được tìm thấy là cao hơn với HMEs, cho thấy rằng HHs có thể là lựa chọn tốt hơn ở những bệnh nhân có dự trữ hô hấp hạn chế [86]. Một bất lợi đặc trưng của HHs là sự hình thành của ngưng tụ hơi nước trong bộ dây máy thở, được liên kết trong các nghiên cứu trước đó với tăng nguy cơ nhiễm trùng bệnh viện [77]. Mặc dù phát hiện được mô tả trước đây, không có sự khác biệt về tỷ lệ viêm phổi giữa các HHs và HME thụ động [86].
8. Tóm tắt
Độ ẩm của đường dẫn khí tượng trưng cho sự can thiệp chính ở bệnh nhân thở máy. Cài đặt độ ẩm không phù hợp hoặc lựa chọn thiết bị có thể tác động tiêu cực đến kết cục lâm sàng bằng cách làm hư hại niêm mạc đường thở, kéo dài thông khí cơ học, hoặc tăng công thở. Các thiết bị tạo độ ẩm có thể hoạt động thụ động hoặc chủ động, tùy thuộc vào nguồn nhiệt và độ ẩm. Tùy thuộc vào tình huống lâm sàng, lựa chọn độ ẩm có thể thay đổi theo thời gian. Vì vậy, kiến thức về những lợi thế và bất lợi của mỗi thiết bị này là điều cần thiết cho các học viên chăm sóc hô hấp.
9. References
1. J. Wawersik, “History of anesthesia in Germany,” Journal of Clinical Anesthesia, vol. 3, no. 3, pp. 235–244, 1991. View at Publisher • View at Google Scholar • View at Scopus
2. J. Chalon, D. A. Loew, and J. Malebranche, “Effects of dry anesthetic gases on tracheobronchial ciliated epithelium,” Anesthesiology, vol. 37, no. 3, pp. 338–343, 1972. View at Publisher • View at Google Scholar• View at Scopus
3. J. D. K. Burton, “Effects of dry anaesthetic gases on the respiratory mucous membrane,” The Lancet, vol. 279, no. 7223, pp. 235–238, 1962. View at Publisher • View at Google Scholar • View at Scopus
4. T. Tsuda, H. Noguchi, Y. Takumi, and O. Aochi, “Optimum humidification of air administered to a tracheostomy in dogs. Scanning electron microscopy and surfactant studies,” British Journal of Anaesthesia, vol. 49, no. 10, pp. 965–977, 1977. View at Publisher • View at Google Scholar • View at Scopus
5. J. C. van Oostdam, D. C. Walker, K. Knudson, P. Dirks, R. W. Dahlby, and J. C. Hogg, “Effect of breathing dry air on structure and function of airways,” Journal of Applied Physiology, vol. 61, no. 1, pp. 312–317, 1986. View at Google Scholar • View at Scopus
6. E. W. Fonkalsrud, M. Sanchez, I. Higashijima, and E. Arima, “A comparative study of the effects of dry vs. humidified ventilation on canine lungs,” Surgery, vol. 78, no. 3, pp. 373–380, 1975. View at Google Scholar • View at Scopus
7. L. R. Bryant, “A technique for adequate humidification with mechanical respirators,” The Journal of Thoracic and Cardiovascular Surgery, vol. 46, pp. 404–407, 1963. View at Google Scholar • View at Scopus
8. S. Marfatia, P. K. Donahoe, and W. H. Hendren, “Effect of dry and humidified gases on the respiratory epithelium in rabbits,” Journal of Pediatric Surgery, vol. 10, no. 5, pp. 583–592, 1975. View at Publisher •View at Google Scholar • View at Scopus
9. U. Mercke, “The influence of varying air humidity on mucociliary activity,” Acta Oto-Laryngologica, vol. 79, no. 1-2, pp. 133–139, 1975. View at Publisher • View at Google Scholar • View at Scopus
10. R. L. Chatburn and F. P. Primiano Jr., “A rational basis for humidity therapy,” Respiratory Care, vol. 32, no. 4, pp. 249–254, 1987. View at Google Scholar • View at Scopus
11. American Association for Respiratory Care, R. D. Restrepo, and B. K. Walsh, “Humidification during invasive and noninvasive mechanical ventilation: 2012,” Respiratory Care, vol. 57, no. 5, pp. 782– 788, 2012. View at Publisher • View at Google Scholar
12. J. M. Cairo, Mosby’s Respiratory Care Equipment, Mosby, Elsevier, St. Louis, Mo, USA, 9th edition, 2013.
13. S. T. Ballard and S. K. Inglis, “Liquid secretion properties of airway submucosal glands,” Journal of Physiology, vol. 556, no. 1, pp. 1–10, 2004. View at Publisher • View at Google Scholar • View at Scopus
14. M. P. Shelly, G. M. Lloyd, and G. R. Park, “A review of the mechanisms and methods of humidification of inspired gases,” Intensive Care Medicine, vol. 14, no. 1, pp. 1–9, 1988. View at Publisher • View at Google Scholar • View at Scopus
15. R. D. Branson, “Humidification for patients with artificial airways,” Respiratory Care, vol. 44, no. 6, pp. 630–641, 1999. View at Google Scholar • View at Scopus
16. S. D. Anderson and K. Holzer, “Exercise-induced asthma: is it the right diagnosis in elite athletes?” The Journal of Allergy and Clinical Immunology, vol. 106, no. 3, pp. 419–428, 2000. View at Publisher • View at Google Scholar • View at Scopus
17. R. M. Kacmarek, J. K. Stoller, and A. H. Heuer, Egan’s Fundamentals of Rrespiratory Care, Mosby- Elsevier, St.Louis, Miss, USA, 10th edition, 2012.
18. E. Schena, P. Saccomandi, S. Cappelli, and S. Silvestri, “Mechanical ventilation with heated humidifiers: measurements of condensed water mass within the breathing circuit according to ventilatory settings,” Physiological Measurement, vol. 34, no. 7, article 813, 2013. View at Publisher • View at Google Scholar •View at Scopus
19. F. Lellouche, S. Taillé, S. M. Maggiore et al., “Influence of ambient and ventilator output temperatures on performance of heated-wire humidifiers,” The American Journal of Respiratory and Critical Care Medicine, vol. 170, no. 10, pp. 1073–1079, 2004. View at Publisher • View at Google Scholar • View at Scopus
20. B. G. Carter, N. Whittington, M. Hochmann, and A. Osborne, “The effect of inlet gas temperatures on heated humidifier performance,” Journal of Aerosol Medicine, vol. 15, no. 1, pp. 7–13, 2002. View at Publisher • View at Google Scholar • View at Scopus
21. T. Nishida, M. Nishimura, Y. Fujino, and T. Mashimo, “Performance of heated humidifiers with a heated wire according to ventilatory settings,” Journal of Aerosol Medicine: Deposition, Clearance, and Effects in the Lung, vol. 14, no. 1, pp. 43–51, 2001. View at Publisher • View at Google Scholar • View at Scopus
22. M. Solomita, F. Daroowalla, D. S. LeBlanc, and G. C. Smaldone, “Y-piece temperature and humidification during mechanical ventilation,” Respiratory Care, vol. 54, no. 4, pp. 480–486, 2009. View at Google Scholar • View at Scopus
23. M. Solomita, L. B. Palmer, F. Daroowalla et al., “Humidification and secretion volume in mechanically ventilated patients,” Respiratory Care, vol. 54, no. 10, pp. 1329–1335, 2009. View at Google Scholar • View at Scopus
24. R. J. Boots, N. George, J. L. Faoagali, J. Druery, K. Dean, and R. F. Heller, “Double-heater-wire circuits and heat-and-moisture exchangers and the risk of ventilator-associated pneumonia,” Critical Care Medicine, vol. 34, no. 3, pp. 687–693, 2006. View at Publisher • View at Google Scholar • View at Scopus
25. F. Lellouche, A. Lyazidi, P. Rodriguez, and L. Brochard, “Condensation in inspiratory and expiratory circuits of heated wire humidifiers, evaluation of a new expiratory, “porous”, circuit and of new humidification compensation systems,” in Proceedings of the 100th International Conference of the American Thoracic Society, San Diego, Calif, USA, 2005.
26. T. E. Oh, E. S. Lin, and S. Bhatt, “Resistance of humidifiers, and inspiratory work imposed by a ventilator-humidifier circuit,” British Journal of Anaesthesia, vol. 66, no. 2, pp. 258–263, 1991. View at Publisher • View at Google Scholar • View at Scopus
27. J. Rathgeber, S. Kazmaier, O. Penack, and K. Züchner, “Evaluation of heated humidifiers for use on intubated patients: a comparative study of humidifying efficiency, flow resistance, and alarm functions using a lung model,” Intensive Care Medicine, vol. 28, no. 6, pp. 731–739, 2002. View at Publisher • View at Google Scholar • View at Scopus
28. F. S. Rhame, A. Streifel, C. McComb, and M. Boyle, “Bubbling humidifiers produce microaerosols which can carry bacteria,” Infection Control, vol. 7, no. 8, pp. 403–407, 1986. View at Google Scholar • View at Scopus
29. I. J. Gilmour, M. J. Boyle, A. Streifel, and R. C. McComb, “The effects of circuit and humidifier type on contamination potential during mechanical ventilation: a laboratory study,” The American Journal of Infection Control, vol. 23, no. 2, pp. 65–72, 1995. View at Publisher • View at Google Scholar • View at Scopus
30. http://www.cdc.gov/hicpac/pdf/guidelines/HApneu2003guidelines.pdf.
31. D. H. W. Wong, “Melted delivery hose—a complication of a heated humidifier,” Canadian Journal of Anaesthesia, vol. 35, no. 2, pp. 183–186, 1988. View at Publisher • View at Google Scholar • View at Scopus
32. S. Schumann, C. A. Stahl, K. Möller, H.-J. Priebe, and J. Guttmann, “Moisturizing and mechanical characteristics of a new counter-flow type heated humidifier,” British Journal of Anaesthesia, vol. 98, no. 4, pp. 531–538, 2007. View at Publisher • View at Google Scholar • View at Scopus
33. S. W. Jones, K. A. Short, M. Joseph, C. Sommer, and B. A. Cairns, “Use of a new novel humidification system with high frequency percussive ventilation in a patient with inhalation injury,” Journal of Burn Care and Research, vol. 31, no. 3, pp. 499–502, 2010. View at Publisher • View at Google Scholar • View at Scopus
34. N. H. Tiffin, K. A. Short, S. W. Jones, and B. A. Cairns, “Comparison of three humidifiers during high-frequency percussive ventilation using the VDR-4 fail-safe Breathing Circuit Hub,” Journal of Burn Care and Research, vol. 32, no. 3, pp. e45–e50, 2011. View at Publisher • View at Google Scholar • View at Scopus
35. W. W. Mapleson, J. G. Morgan, and E. K. Hillard, “Assessment of condenser-humidifiers with special reference to a multiplegauze model,” British Medical Journal, vol. 1, no. 5326, pp. 300–305, 1963. View at Publisher • View at Google Scholar • View at Scopus
36. B. K. Hingorani, “The resistance to airflow of tracheostomy tubes, connections, and heat and moisture exchangers,” British Journal of Anaesthesia, vol. 37, no. 6, pp. 454–463, 1965. View at Publisher • View at Google Scholar • View at Scopus
37. M. C. Villafane, G. Cinnella, F. Lofaso et al., “Gradual reduction of endotracheal tube diameter during mechanical ventilation via different humidification devices,” Anesthesiology, vol. 85, no. 6, pp. 1341–1349, 1996. View at Publisher • View at Google Scholar • View at Scopus
38. C. M. Vandenbroucke-Grauls, K. B. Teeuw, K. Ballemans, C. Lavooij, P. B. Cornelisse, and J. Verhoef, “Bacterial and viral removal efficiency, heat and moisture exchange properties of four filtration devices,” Journal of Hospital Infection, vol. 29, no. 1, pp. 45–56, 1995. View at Publisher • View at Google Scholar •View at Scopus
39. F. Lellouche, S. Taillé, F. Lefrançois et al., “Humidification performance of 48 passive airway humidifiers: comparison with manufacturer data,” Chest, vol. 135, no. 2, pp. 276–286, 2009. View at Publisher • View at Google Scholar • View at Scopus
40. C. Martin, G. Perrin, M. J. Gevaudan, P. Saux, and F. Gouin, “Heat and moisture exchangers and vaporizing humidifiers in the intensive care unit,” Chest, vol. 97, no. 1, pp. 144–149, 1990. View at Publisher • View at Google Scholar • View at Scopus
41. L. Thomachot, X. Viviand, I. Boyadjiev, R. Vialet, and C. Martin, “The combination of a heat and moisture exchanger and a BoosterTM: a clinical and bacteriological evaluation over 96 h,” Intensive Care Medicine, vol. 28, no. 2, pp. 147–153, 2002. View at Publisher • View at Google Scholar • View at Scopus
42. D. Chiumello, P. Pelosi, G. Park et al., “In vitro and in vivo evaluation of a new active heat moisture exchanger,” Critical Care, vol. 8, no. 5, pp. R281–R288, 2004. View at Publisher • View at Google Scholar •View at Scopus
43. F. Lellouche, S. Qader, S. Taille, A. Lyazidi, and L. Brochard, “Influence of ambient temperature and minute ventilation on passive and active heat and moisture exchangers,” Respiratory Care, vol. 59, no. 5, pp. 637–643, 2014. View at Google Scholar
44. P. Pelosi, P. Severgnini, G. Selmo et al., “In vitro evaluation of an active heat-and-moisture exchanger: the hygrovent gold,” Respiratory Care, vol. 55, no. 4, pp. 460–466, 2010. View at Google Scholar • View at Scopus
45. S. D. Broach and C. G. Durbin Jr., “A randomized, controlled, clinical trial of a chemically-reactive heated humidifier,” Respiratory Care, vol. 46, no. 1, pp. 37–42, 2001. View at Google Scholar • View at Scopus
46. T. M. Sottiaux, “Consequences of Under- and Over-humidification,” Respiratory Care Clinics of North America, vol. 12, no. 2, pp. 233–252, 2006. View at Publisher • View at Google Scholar • View at Scopus
47. P. Diot, L. Morra, and G. C. Smaldone, “Albuterol delivery in a model of mechanical ventilation: comparison of metered-dose inhaler and nebulizer efficiency,” American Journal of Respiratory and Critical Care Medicine, vol. 152, no. 4, part 1, pp. 1391–1394, 1995. View at Publisher • View at Google Scholar • View at Scopus
48. R. D. Branson, “Secretion management in the mechanically ventilated patient,” Respiratory Care, vol. 52, no. 10, pp. 1328–1347, 2007. View at Google Scholar • View at Scopus
49. J. Ricard, P. Markowicz, K. Djedaini, L. Mier, F. Coste, and D. Dreyfuss, “Bedside evaluation of efficient airway humidification during mechanical ventilation of the critically ill,” Chest, vol. 115, no. 6, pp. 1646–1652, 1999. View at Publisher • View at Google Scholar • View at Scopus
50. D. B. Weeks and F. M. Ramsey, “Laboratory investigation of six artificial noses for use during endotracheal anesthesia,” Anesthesia and Analgesia, vol. 62, no. 8, pp. 758–763, 1983. View at Google Scholar • View at Scopus
51. I. L. Cohen, P. F. Weinberg, I. A. Fein, and G. S. Rowinski, “Endotracheal tube occlusion associated with the use of heat and moisture exchangers in the intensive care unit,” Critical Care Medicine, vol. 16, no. 3, pp. 277–279, 1988. View at Publisher • View at Google Scholar • View at Scopus
52. J. P. Roustan, J. Kienlen, P. Aubas, and J. Du Cailar, “Comparison of hydrophogic heat and moisture exchangers with heated humidifier during prolonged mechanical ventilation,” Intensive Care Medicine, vol. 18, no. 2, pp. 97–100, 1992. View at Publisher • View at Google Scholar • View at Scopus
53. C. Mebius, “A comparative evaluaton of disposable humidifiers,” Acta Anaesthesiologica Scandinavica, vol. 27, no. 5, pp. 403–409, 1983. View at Publisher • View at Google Scholar • View at Scopus
54. J. Rathgeber, K. Zuchner, D. Kietzmann, and W. Weyland, “Heat and moisture exchangers for conditioning of inspired air of intubated patients in intensive care. The humidification properties of passive air exchangers under clinical conditions,” Anaesthesist, vol. 44, no. 4, pp. 274–283, 1995. View at Publisher • View at Google Scholar • View at Scopus
55. K. Davis Jr., S. L. Evans, R. S. Campbell et al., “Prolonged use of heat and moisture exchangers does not affect device efficiency or frequency rate of nosocomial pneumonia,” Critical Care Medicine, vol. 28, no. 5, pp. 1412–1418, 2000. View at Publisher • View at Google Scholar • View at Scopus
56. J. Lacherade, M. Auburtin, C. Cerf et al., “Impact of humidification systems on ventilator-associated pneumonia: a randomized multicenter trial,” American Journal of Respiratory and Critical Care Medicine, vol. 172, no. 10, pp. 1276–1282, 2005. View at Publisher • View at Google Scholar • View at Scopus
57. K. Djedaini, M. Billiard, L. Mier et al., “Changing heat and moisture exchangers every 48 hours rather than 24 hours does not affect their efficacy and the incidence of nosocomial pneumonia,” The American Journal of Respiratory and Critical Care Medicine, vol. 152, no. 5, pp. 1562–1569, 1995. View at Publisher •View at Google Scholar • View at Scopus
58. L. Thomachot, R. Vialet, J. Viguier, B. Sidier, P. Roulier, and C. Martin, “Efficacy of heat and moisture exchangers after changing every 48 hours rather than 24 hours,” Critical Care Medicine, vol. 26, no. 3, pp. 477–481, 1998. View at Publisher • View at Google Scholar • View at Scopus
59. C. Boisson, X. Viviand, S. Arnaud, L. Thomachot, Y. Miliani, and C. Martin, “Changing a hydrophobic heat and moisture exchanger after 48 hours rather than 24 hours: a clinical and microbiological evaluation,” Intensive Care Medicine, vol. 25, no. 11, pp. 1237–1243, 1999. View at Publisher • View at Google Scholar • View at Scopus
60. P. Markowicz, J. D. Ricard, D. Dreyfuss et al., “Safety, efficacy, and cost-effectiveness of mechanical ventilation with humidifying filters changed every 48 hours: a prospective, randomized study,” Critical Care Medicine, vol. 28, no. 3, pp. 665–671, 2000. View at Publisher • View at Google Scholar • View at Scopus
61. L. Thomachot, C. Boisson, S. Arnaud, P. Michelet, S. Cambon, and C. Martin, “Changing heat and moisture exchangers after 96 hours rather than after 24 hours: a clinical and microbiological evaluation,” Critical Care Medicine, vol. 28, no. 3, pp. 714–720, 2000. View at Publisher • View at Google Scholar •View at Scopus
62. L. Thomachot, M. Leone, K. Razzouk, F. Antonini, R. Vialet, and C. Martin, “Randomized clinical trial of extended use of a hydrophobic condenser humidifier: 1 vs. 7 days,” Critical Care Medicine, vol. 30, no. 1, pp. 232–237, 2002. View at Publisher • View at Google Scholar • View at Scopus
63. F. N. Kapadia, K. B. Bajan, S. Singh, B. Mathew, A. Nath, and S. Wadkar, “Changing patterns of airway accidents in intubated ICU patients,” Intensive Care Medicine, vol. 27, no. 1, pp. 296–300, 2001. View at Publisher • View at Google Scholar • View at Scopus
64. F. Lellouche, S. Qader, S. Taille, A. Lyazidi, and L. Brochard, “Under-humidification and over- humidification during moderate induced hypothermia with usual devices,” Intensive Care Medicine, vol. 32, no. 7, pp. 1014–1021, 2006. View at Publisher • View at Google Scholar • View at Scopus
65. R. D . Branson, R. S. Campbell, M. Ottaway, and J. A. Johannigman, “Comparison of conventional heated humidification to a new active heat and moisture exchanger in the ICU,” Critical Care, vol. 3, supplement 1, p. P017, 1999. View at Google Scholar
66. D. R. Hess, “And now for the rest of the story,” Respir Care, vol. 47, no. 6, pp. 696–699, 2002. View at Google Scholar
67. R. S. Campbell, K. Davis Jr., J. A. Johannigman, and R. D. Branson, “The effects of passive humidifier dead space on respiratory variables in paralyzed and spontaneously breathing patients,” Respiratory Care, vol. 45, no. 3, pp. 306–312, 2000. View at Google Scholar • View at Scopus
68. G. Prat, A. Renault, J. Tonnelier et al., “Influence of the humidification device during acute respiratory distress syndrome,” Intensive Care Medicine, vol. 29, no. 12, pp. 2211–2215, 2003. View at Publisher •View at Google Scholar • View at Scopus
69. J. Richecoeur, Q. Lu, S. R. R. Vieira et al., “Expiratory washout versus optimization of mechanical ventilation during permissive hypercapnia in patients with severe acute respiratory distress syndrome,” The American Journal of Respiratory and Critical Care Medicine, vol. 160, no. 1, pp. 77– 85, 1999. View at Publisher • View at Google Scholar • View at Scopus
70. S. Prin, K. Chergui, R. Augarde, B. Page, F. Jardin, and A. Vieillard-Baron, “Ability and safety of a heated humidifier to control hypercapnic acidosis in severe ARDS,” Intensive Care Medicine, vol. 28, no. 12, pp. 1756–1760, 2002. View at Publisher • View at Google Scholar • View at Scopus
71. J. Hurni, F. Feihl, R. Lazor, P. Leuenberger, and C. Perret, “Safety of combined heat and moisture exchanger filters in long-term mechanical ventilation,” Chest, vol. 111, no. 3, pp. 686–691, 1997. View at Publisher • View at Google Scholar • View at Scopus
72. G. Le Bourdellès, L. Mier, B. Fiquet et al., “Comparison of the effects of heat and moisture exchangers and heated humidifiers on ventilation and gas exchange during weaning trials from mechanical ventilation,” Chest, vol. 110, no. 5, pp. 1294–1298, 1996. View at Publisher • View at Google Scholar •View at Scopus
73. C. Girault, L. Breton, J. Richard et al., “Mechanical effects of airway humidification devices in difficult to wean patients,” Critical Care Medicine, vol. 31, no. 5, pp. 1306–1311, 2003. View at Publisher • View at Google Scholar • View at Scopus
74. G. A. Iotti, M. C. Olivei, A. Palo et al., “Unfavorable mechanical effects of heat and moisture exchangers in ventilated patients,” Intensive Care Medicine, vol. 23, no. 4, pp. 399–405, 1997. View at Publisher • View at Google Scholar • View at Scopus
75. G. A. Iotti, M. C. Olivei, and A. Braschi, “Mechanical effects of heat-moisture exchangers in ventilated patients,” Critical Care, vol. 3, no. 5, pp. R77–R82, 1999. View at Publisher • View at Google Scholar •View at Scopus
76. D. Cook, B. de Jonghe, L. Brochard, and C. Brun-Buisson, “Influence of airway management on ventilator-associated pneumonia: evidence from randomized trials,” The Journal of the American Medical Association, vol. 279, no. 10, pp. 781–787, 1998. View at Publisher • View at Google Scholar • View at Scopus
77. O. C. Kirton, B. DeHaven, J. Morgan, O. Morejon, and J. Civetta, “A prospective, randomized comparison of an in-line heat moisture exchange filter and heated wire humidifiers: rates of ventilator-associated early-onset (community-acquired) or late-onset (hospital-acquired) pneumonia and incidence of endotracheal tube occlusion,” Chest, vol. 112, no. 4, pp. 1055–1059, 1997. View at Publisher • View at Google Scholar • View at Scopus
78. D. R. Hess, T. J. Kallstrom, C. D. Mottram, T. R. Myers, H. M. Sorenson, and D. L. Vines, “Care of the ventilator circuit and its relation to ventilator-associated pneumonia,” Respiratory Care, vol. 48, no. 9, pp. 869–879, 2003. View at Google Scholar • View at Scopus
79. I. I. Siempos, K. Z. Vardakas, P. Kopterides, and M. E. Falagas, “Impact of passive humidification on clinical outcomes of mechanically ventilated patients: a meta-analysis of randomized controlled trials,” Critical Care Medicine, vol. 35, no. 12, pp. 2843–2851, 2007. View at Publisher • View at Google Scholar •View at Scopus
80. R. G. Masterton, A. Galloway, G. French et al., “Guidelines for the management of hospital-acquired pneumonia in the UK: report of the working party on hospital-acquired pneumonia of the british society for antimicrobial chemotherapy,” Journal of Antimicrobial Chemotherapy, vol. 62, no. 1, pp. 5–34, 2008.View at Publisher • View at Google Scholar • View at Scopus
81. O. C. Tablan, L. J. Anderson, R. Besser, C. Bridges, and R. Hajjeh, “Guidelines for preventing health-care—associated pneumonia, 2003: recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee,” Morbidity and Mortality Weekly Report: Recommendations and Reports, vol. 53, no. RR-3, pp. 1–36, 2004. View at Google Scholar • View at Scopus
82. American Thoracic Society and Infectious Diseases Society of America, “Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia,” American Journal of Respiratory and Critical Care Medicine, vol. 171, no. 4, pp. 388– 416, 2005. View at Publisher •View at Google Scholar
83. A. Torres, S. Ewig, H. Lode, and J. Carlet, “Defining, treating and preventing hospital acquired pneumonia: European perspective,” Intensive Care Medicine, vol. 35, no. 1, pp. 9–29, 2009. View at Publisher • View at Google Scholar • View at Scopus
84. J. Muscedere, P. Dodek, S. Keenan, R. Fowler, D. Cook, and D. Heyland, “Comprehensive evidence- based clinical practice guidelines for ventilator-associated pneumonia: prevention,” Journal of Critical Care, vol. 23, no. 1, pp. 126–137, 2008. View at Publisher • View at Google Scholar • View at Scopus
85. J. Ricard, D. Cook, L. Griffith, L. Brochard, and D. Dreyfuss, “Physicians’ attitude to use heat and moisture exchangers or heated humidifiers: a Franco-Canadian survey,” Intensive Care Medicine, vol. 28, no. 6, pp. 719–725, 2002. View at Publisher • View at Google Scholar • View at Scopus
86. M. Kelly, D. Gillies, D. A. Todd, and C. Lockwood, “Heated humidification versus heat and moisture exchangers for ventilated adults and children,” The Cochrane Database of Systematic Reviews, no. 4, Article ID CD004711, 2010. View at Publisher • View at Google Scholar • View at Scopus