Bài viết So sánh tỷ lệ SpO2/FiO2 và tỷ lệ PaO2/FiO2 trong bệnh nhân tổn thương phổi cấp và hội chứng suy hô hấp cấp tính được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Comparison of the Spo2/Fio2 Ratio and the Pao2/Fio2 Ratio in Patients With Acute Lung Injury or Acute Respiratory Distress Syndrome
1. Tóm tắt
Giới thiệu: Tiêu chí chẩn đoán tổn thương phổi cấp tính (ALI) và hội chứng suy hô hấp cấp tính (ARDS) bao gồm khởi phát cấp tính, X quang ngực thể hiện thâm nhiễm phổi hai bên, không có rối loạn chức năng thất trái và PaO2/FiO2 (PF) ≤ 300 cho ALI hoặc ≤ 200 cho ARDS. Tiêu chí này yêu cầu lấy mẫu khí máu động mạch xâm lấn. Tỷ lệ độ bão hòa pulse oximeter SpO2/FiO2 (SF) có thể là một thay thế không xâm lấn đáng tin cậy đối với tỷ lệ PF.
Phương pháp: Trong nghiên cứu cắt ngang này, chúng tôi ghi danh 70 bệnh nhân có ALI hoặc ARDS đã được nhận vào đơn vị chăm sóc chuyên sâu về nhi khoa của bệnh viện Tabriz (PICU). SpO2, FiO2, PaO2, được đo trong vòng 5 phút và tính toán SF và PF được ghi lại để xác định mối quan hệ giữa tỷ lệ SF và PF. Giá trị SF đã được kiểm tra như là một thay thế tỷ lệ PF cho chẩn đoán ARDS và ALI.
Kết quả: Mối quan hệ giữa tỷ số SF và PF được mô tả bằng phương trình hồi quy sau: SF = 57 + 0,61 PF (P <0,001). Tỷ số SF là 181 và 235 tương ứng với tỷ lệ PF 300 và
200. Điểm cắt SF là 235 có độ nhạy 57% và độ đặc hiệu 100% đối với chẩn đoán ALI.
Điểm cắt SF là 181 có độ nhạy 71% và độ đặc hiệu 82% đối với chẩn đoán ARDS.
Kết luận: Tỉ lệ SF là trị số thay thế không xâm lấn đáng tin cậy đối với tỷ lệ PF để xác định trẻ có ALI hoặc ARDS với lợi thế thay thế lấy mẫu máu động mạch xâm lấn bằng cách đo pulse oximeter không xâm lấn.
2. Giới thiệu
Tổn thương phổi cấp tính (ALI) và hội chứng suy hô hấp cấp tính (ARDS) là hội chứng nghiêm trọng liên quan đến tỷ lệ tử vong và bệnh suất cao. [1,2] Người ta ước tính rằng 30% đến 60% số bệnh nhân được nhập viện chăm sóc đặc biệt (PICU) yêu cầu cơ học thông khí, và những bệnh nhân này lên đến 25% bị ALI và 5% đến 10% có ARDS. Với việc thực hiện các chiến lược thông khí bảo vệ phổi, bệnh suất và tỷ lệ tử vong toàn diện đã được cải thiện đáng kể cho cả người lớn và trẻ em với ALI và ARDS. [3,4] Dựa trên Hội nghị đồng thuận châu Âu (AECC) vào năm 1994, tiêu chuẩn chẩn đoán cho ALI và ARDS yêu cầu khởi phát bệnh cấp tính, X quang ngực biểu hiện thâm nhiễm phổi hai bên, không rối loạn chức năng thất trái và PaO2/FiO2 ≤300 đối với ALI hoặc ≤200 đối với ARDS. [5] Ba thành phần đầu tiên có thể được thiết lập với bệnh sử lâm sàng hoặc các công cụ không xâm lấn như chụp X quang ngực hoặc siêu âm tim. Tuy nhiên, tiêu chuẩn PF cần thiết lấy mẫu máu động mạch. [6,7] Mối quan tâm về thiếu máu sau khi lấy mẫu máu lặp đi lặp lại và xu hướng thực hiện phương pháp tiếp cận ít xâm lấn hơn đã dẫnđến việcđo khí máu ít thường xuyên hơn ở những bệnh nhân bị bệnh nặng. [8,9] Hơn nữa giá trị ngưỡng SF có thể được sử dụng để chẩn đoán ARDS và ALI. [6-10]
Pulse oximetry là kỹ thuật được sử dụng phổ biến nhất để theo dõi quá trình oxy hóa không xâm lấn và an toàn. Trong phương pháp này độ bão hòa hemoglobin O 2 được đo bằng cách phân biệt oxy hemoglobin với deoxygenated hemoglobin bằng sử dụng hấp thụ ánh sáng tương ứng của nó ở độ dài sóng 660 nm (đỏ) và 940 nm (hồng ngoại). [11,12]
Pulse oximetry được sử dụng để phát hiện tình trạng thiếu oxy máu, phòng ngừa tăng oxy máu, cai máy từ thông khí cơ học, và để chuẩn độ FiO2. [9-13]
Trong hầu hết PICU lấy mẫu máu động mạch hàng ngày để tính tỷ lệ PF là không khả thi. Tính toán tỷ lệ SF như một đại diện cho tỷ lệ PF để chẩn đoán ARDS hoặc ALI, ít xâm lấn hơn, là mong muốn. [14] Tỉ lệ SF nhằm xác định mức độ thiếu oxy không xâm lấn mà không cần lấy mẫu máu động mạch. [7]
Trong nghiên cứu này, chúng tôi đã kiểm tra mối quan hệ giữa tỷlệ SF và PF ở những bệnh nhân bị bệnh nặng với ALI và ARDS. Người ta cho rằng việc đo lường tỷ lệ SF có sẵn và ít xâm lấn hơn có thể thay thế tỷ lệ PF trong chẩn đoán ALI và ARDS.
3. Vật liệu và phương pháp
Trong nghiên cứu cắt ngang này, 70 trẻ em bị ARDS hoặc ALI được nhập viện tại bệnh viện trẻ em Tabriz PICU, Iran từ năm 2012 đến năm 2013 đã được ghi danh. Ở những bệnh nhân ARDS hoặc ALI được đặt nội khí quản và thông khí cơ học với cùng FiO2; PaO2 được đo bằng lấy mẫu máu động mạch và SpO 2 được đo bằng đo pulse oximeter và biểu đồ trong vòng 5 phút. Tỷ lệ SF và PF sau đó được tính toán.
Tiêu chí đưa vào là trẻ bị ARDS hoặc ALI và khởi phát cấp tính của bệnh và X quang ngực biểu hiện thâm nhiễm phổi hai bên, phù hợp với phù phổi.
Tiêu chuẩn loại trừ là trẻ bị phù phổi do suy tim và bệnh tim bẩm sinh và dị thường giải phẫu của phổi hoặc đường dẫn khí và hạ huyết áp và mạch yếu.
Phân tích thống kê
Phân tích thống kê được thực hiện bằng cách sử dụng gói thống kê cho khoa học xã hội, phiên bản 17.0 (SPSS, Chicago, Illinois). Dữ liệu định lượng được trình bày dưới dạng trung bình ± độ lệch chuẩn (SD), trong khi dữ liệu định tính được trình bày dưới dạng tần số và phần trăm (%). Các tham số phân loại được so sánh bằng các phép thử χ2, và các biến liên tục được so sánh bằng phép thử t độc lập. P <0,05 được coi là có ý nghĩa thống kê. Mối quan hệ giữa SF và PF, được mô tả bằng phương trình hồi quy tuyến tính. Đường cong ROC được vẽ để xác định độ nhạy và độ đặc hiệu của giá trị ngưỡng SF tương quan với PF 200 (ARDS) và 300 (ALI).
4. Kết quả
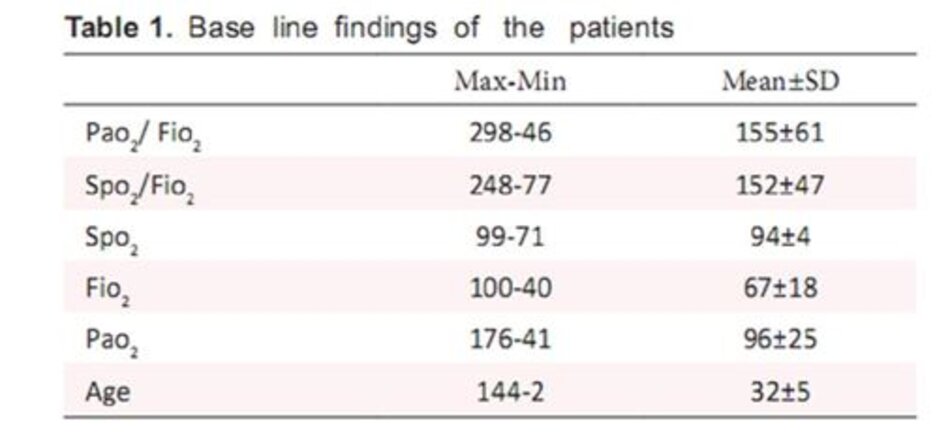
Trong số 70 trẻ em tham gia nghiên cứu này, 38 bệnh nhân là nữ (54,3%) và 32 bệnh nhân là nam (45,7%). Tuổi trung bình của dân số nghiên cứu là 32 + 5 tháng (tối thiểu 2 và tối đa 144 tháng).
Tổng cộng 70 cặp dữ liệu 56 (80%) đáp ứng các tiêu chuẩn tỷ lệ PF cho ARDS và 14 (20%) đáp ứng các tiêu chí PF cho ALI. Chênh lệch thời gian trung bình giữa các giá trị biểu đồ của cặp SpO2 và PaO2 là 5 phút.
Tuổi tác không có mối quan hệ đáng kể với tỷ lệ SF (P = 0,81) hoặc tỷ lệ PF (P = 0,99). Tương tự, giới tính không có mối quan hệ đáng kể với tỷ lệ SF (P = 0,77) hoặc tỷ lệ PF (P = 0,06).
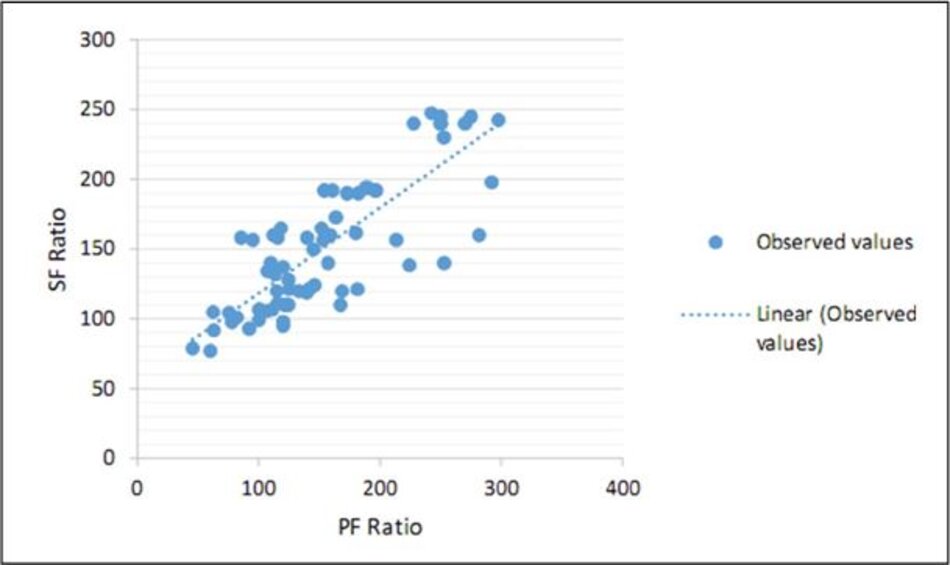
Nhìn chung, tỷ lệ SF có thể được dự đoán tốt từ tỷ lệ PF, được mô tả bằng phương trình hồi quy tuyến tính (SF = 57 + 0,61 PF). Dựa trên phương trình này, tỷ lệ PF là 300 tương ứng với tỷ số SF là 235 và tỷ lệ PF là 200 cho tỷ số SF là 181 [P<0,001 (Hình 1)]. Các giá trị điểm cắt SF (SF cut off) 235 có 57% độ nhạy và 100% đặc hiệu cho chẩnđoán ALI và điểm cắt 181 có 71% độ nhạy và 82% đặc hiệu cho chẩn đoán ARDS.
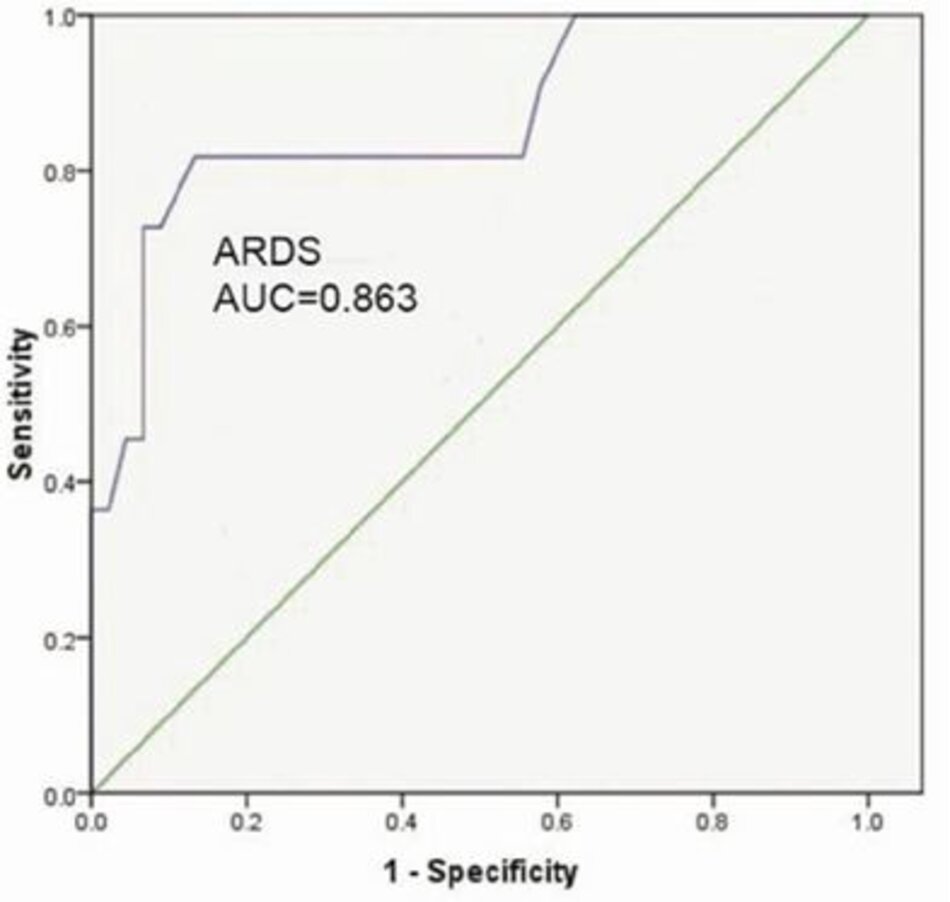
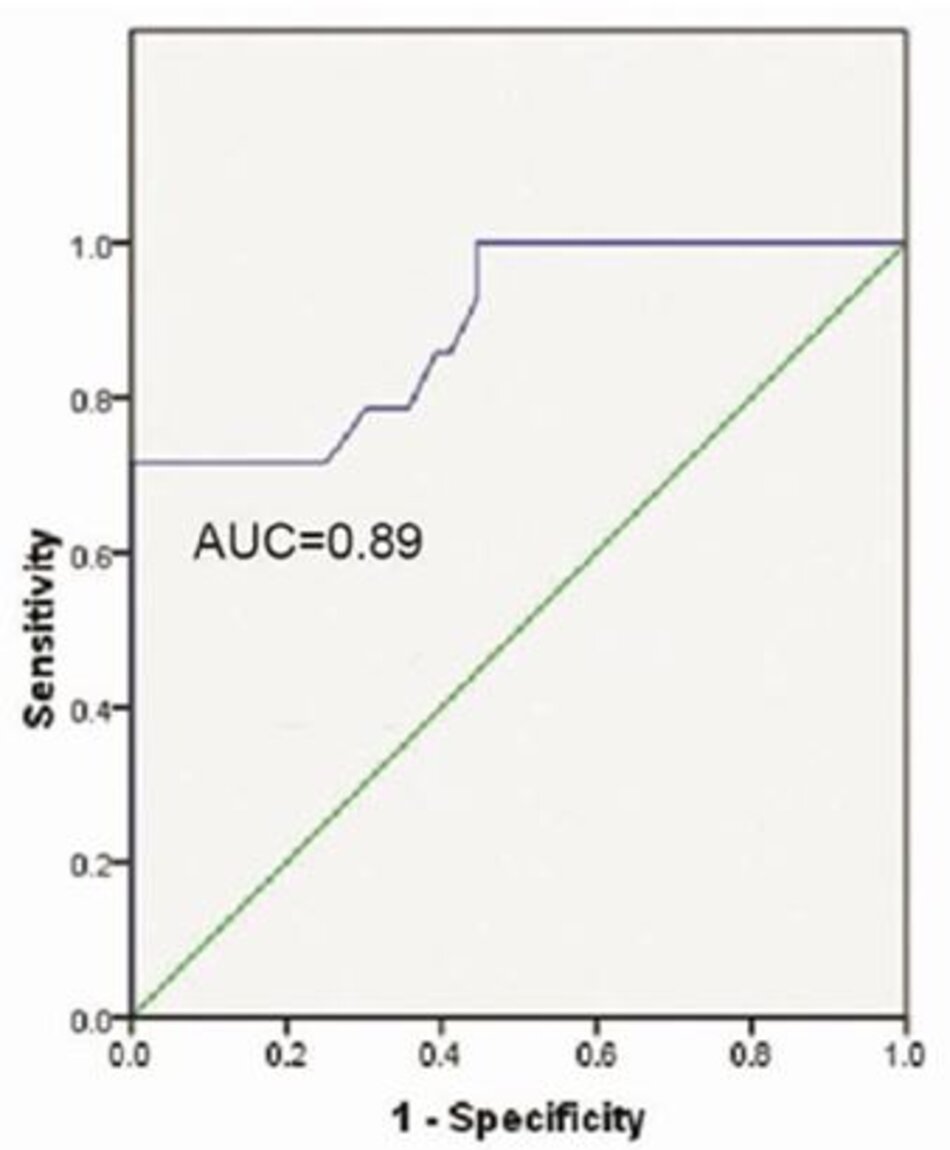
Tỷ lệ SF có khả năng phân biệt tuyệt vời đối với ARDS (AUC = 0,86) (Hình 2) và khả năng phân biệt tốt đối với ALI và ARDS (AUC = 0,89) (Hình 3).
5. Thảo luận
ALI và ARDS là những nguyên nhân đóng góp chính vào bệnh suất và tử vong cho bệnh nhân được nhận vào PICU. [15] Việc sử dụng thường xuyên pulse oximetry và capnographyđã dẫn đến việc lấy mẫu máu động mạch ít thường xuyên hơn. Trong hầu hết các PICU, đo pulse oximetry có sẵn và được sử dụng thường xuyên để theo dõi liên tục tình trạng oxy hóa. [16-18] Đo pulse oximetry loại bỏ các tác hại và chi phí lấy mẫu máu động mạch. [19] Sử dụng tỷ lệ SF để chẩn đoán ALI và ARDS dẫn đến việc xác định các trường hợp không được chẩn đoán hội chứng nói trên. [20]
Tỷ lệ SF có thể hữu ích trong đánh giá suy đa cơ quan, chẳng hạn như điểm số tổn thương phổi [21], điểm số rối loạn chức năng đa cơ quan [22], đánh giá suy cơ quan tuần tự [23], như là một thay thế cho tỷ lệ PF để ước tính mức độ thiếu oxy máu.
Trong nghiên cứu này, chúng tôi đăng ký 70 bệnh nhân với ALI hoặc ARDS. PaO2 và SpO2 được đo với cùng tỷ lệ FiO 2 và SF và PF được tính toán. Mối quan hệ giữa tỷ lệ SF và PF được mô tả với phương trình sau: SF = 57 + 0,61 PF. Giá trị ngưỡng tỷ lệ SF cho ALI là 235 và cho ARDS là 181 tương ứng với tỷ lệ PF 300 và 200.
Một nghiên cứu tương tự đã được thực hiện bởi Khemani và cộng sự về dân số trẻ em. Họ báo cáo rằng một điểm cắt là 201 cho SF có thể dự đoán PF cho ARDS với độ nhạy 84% và độ đặc hiệu 78% và điểm cắt 263 cho SF có thể dự đoán ALI với độ nhạy 93% và độ đặc hiệu 43%. Tuy nhiên, họ không có giới hạn độ tuổi. Ngoài ra khoảng thời gian giữa pulse oximetry và lấy mẫu máu động mạch là 15 phút, dài hơn trong nghiên cứu của chúng tôi. Họ không kiểm tra mối quan hệ giữa tỷ lệ SF và PF với giới tính.
Ở bệnh nhân người lớn, Rice et al. [25] báo cáo rằng một điểm cắt 235 cho SF có thể dự đoán ARDS với độ nhạy 85% và độ đặc hiệu 85% và ngưỡng 315 cho SF có thể dự đoán ALI với độ nhạy 91% và độ đặc hiệu 56%. Trong nghiên cứu này, chúng tôi đã kiểm tra mối quan hệ giữa tuổi và giới tính với tỷ lệ PF và SF. Chúng tôi đo PaO2 và SpO2 cách nhau tối đa 5 phút. Các ngưỡng tỷ lệ SF được xác định trong nghiên cứu này dựa trên tỷ lệ PF được đề xuất bởi AECC.
Có những hạn chế của nghiên cứu này. Đầu tiên, các phép đo pulse oximeter và ABG không đồng thời. Do những thay đổi trong SpO 2 và PaO2 có thể diễn ra nhanh chóng, điều này có thể ảnh hưởng đến kết quả của chúng tôi. Ngoài ra, chúng tôi không kiểm soát pH, hemoglobin, PaCO2, nhiệt độ cơ thể, cài đặt máy thở. Những yếu tố này cũng có thể ảnh hưởng đến mối quan hệ giữa SpO2 và PaO2.
6. Kết luận
Theo nghiên cứu này, tỷ lệ SF là một trị số không xâm lấn và có sẵn, đáng tin cậy thay cho tỷ lệ PF để chẩn đoán trẻ bị ALI hoặc ARDS, thay thế lấy mẫu khí máu động mạch bằng đo pulse oximetry. Xem xét các biến chứng của lấy mẫu máu động mạch như thiếu máu, và chảy máu ở bệnh nhân ICU, đo pulse oximetry là một sự thay thế mong muốn cho lấy mẫu máu động mạch.
7. References
1. Ware LB, Matthay MA. The acute respiratory distress syndrome. N Engl J Med. 2000;342:1334–1349. doi: 10.1056/NEJM200005043421806. [PubMed] [Cross Ref]
2. Rubenfeld GD, Caldwell E, Peabody E. Incidence and outcomes of acute lung injury. N Engl J Med. 2005;353:1685–1693. doi: 10.1089/jamp.2009.0775. [PubMed] [Cross Ref]
3. Bernard GR, Artigas A, Brigham KL. The American-European Consensus Conference on ARDS: definitions,mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994;149:818–824. doi: 10.1164/ajrccm.149.3.7509706. [PubMed] [Cross Ref]
4. Merlani P, Garnerin P, Diby M, Ferring M. Quality improvement report: linking guideline to regular feedback to increase appropriate requests for clinical test; blood gas analysis in intensive care. BMJ. 2001;323:620–62. doi: 10.1371/journal.pone.0078962. [PMC free article] [PubMed] [Cross Ref]
5. Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L. et al. Thoracic SoG-The American European Consensus Conference on ARDS efinitions, mechanisms. Am J Respir Crit Care Med. 1994;149:818–24. doi: 10.1164/ajrccm.149.3.7509706. [PubMed] [Cross Ref]
6. Pilon CS, Leathley DM, London R. Practice guideline for arterial blood gas measurement in the intensive care unit decreases numbers and increases appropriateness of tests. Crit Care Med. 1997;25:1308–1313. doi: 10.1016/j.jcrc.2007.11.013. [PubMed] [Cross Ref]
7. Jensen LA, Onyskiw JE, Prasad NG. Meta-analysis of arterial oxygen saturation monitoring by pulse oximetry in adults. Heart Lung. 1998;27:387–40. doi: 10.1016/S0147-9563(98)90086-3. [PubMed] [Cross Ref]
8. Ferguson ND, Frutos-Vivar F, Esteban A, Fernández-Segoviano P, Aramburu JA, Nájera L. et al. Acute respiratory distress syndrome: underrecognition by clinicians and diagnostic accuracy of three clinical definitions. Crit Care Med. 2005;33:2228–223. doi: 10.1007/978-3-319-03746-
2. [PubMed] [Cross Ref]
9. Roberts D, Ostryzniuk P, Loewen E, Shanks A, Wasyluk T, Pronger L. et al. Control of blood gas measurements in intensive-care units. Lancet. 1991;337:1580–1582. doi: 10.1016/0140- 6736(91)93271-A. [PubMed] [Cross Ref]
10. Perkins GD, McAuley DF, Giles S. Do changes in pulse oximeter oxygen saturation predict equivalent changes in arterial oxygen saturation? Crit Care. 2003;7:R67. doi: 10.1186/cc2339. [PMC free article] [PubMed] [Cross Ref]
11. Ms Mortz. US patent 714,803,2004 pulse oximeter probe off detection system.
12. Kliegman RM, Stanton BM, Geme JS, Schor N, Behrman RE. Nelson Textbook of Pediatrics.19 th ed. Elsevier; 2011. p.318.
13. Slutsky AS. Mechanical ventilation American College of Chest Physicians’ Consensus Conference. Chest. 1993;104(6):1833–59. doi: 10.1378/chest.104.6.1833. [PubMed] [Cross Ref]
14. Pandharipande PP1, Shintani AK, Hagerman HE, St Jacques PJ, Rice TW, Sanders NW. et al. Derivation and validation of Spo2/Fio2 ratio to impute for Pao2/Fio2 ratio in the respiratory component of the Sequential Organ Failure Assessment score. Crit Care Med. 2009;37(4):1317–21. doi: 10.1097/CCM.0b013e31819cefa9. [PMC free article] [PubMed] [Cross Ref]
15. Khemani RG, Markovitz BP, Curley MAQ. Epidemiologic factors of mechanically ventilated PICU patients in the United States [abstract] Pediatr Crit Care Med. 2007;8(suppl):A39. doi: 10.1001/jama.293.4.470. [Cross Ref]
16. Numa AH, Newth CJ. Assessment of lung function in the intensive care unit. Pediatr Pulmonol. 1995;19:118–128. doi: 10.1378/chest.09-0207. [PubMed] [Cross Ref]
17. Montgomery AB, Stager MA, Carrico CJ. Causes of mortality in patients with the adult respiratory distress syndrome. Am Rev Respir Dis. 1985;132:485–489. doi: 10.1001/jama.1995.03520280052. [PubMed] [Cross Ref]
18. Jubran A. Pulse oximetry. Intensive Care Med. 2004;30:2017–2020. doi: 10.1007/soo134- 004-2399-x. [PubMed] [Cross Ref]
19. Jubran A, Tobin MJ. Reliability of pulse oximetry in titrating supplemental oxygen therapy in ventilator-dependent patients. Chest. 1990;97:1420–1425. doi: 10.1378/chest.97.6.1420. [PubMed] [Cross Ref]
20. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome: the Acute Respiratory Distress Syndrome Network. N Engl J Med. 2000;342:1301–130. doi: 10.1056/NEJM200005043421801. [PubMed] [Cross Ref]
21. Murray JF, Matthay MA, Luce JM, Flick MR. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis. 1988;138:720–723. [PubMed]
22. Marshall JC, Cook DJ, Christou NV, Bernard GR, Sprung CL, Sibbald WJ. Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome. Crit Care Med. 1995;23:1638–1652. [PubMed]
23. Le Gall JR, Lemeshow S, Saulnier F. A new Simplified Acute Physiology Score (SAPS II) based on a European/North American multicenter study. JAMA. 1993;270:2957–2963. doi: 10.1001/jama.1993.03510240069035. [PubMed] [Cross Ref]
24. Khemani RG, Patel NR, Bart RD 3rd, Newth CJ. Comparison of the pulse oximetric saturation/fraction of inspired oxygen ratio and the PaO2/fraction of inspired oxygen ratio in children. Chest. 2008;135(3):662–8. doi: 10.1378/chest.08-2239. [PubMed] [Cross Ref]
25. Rice TW, Wheeler AP, Bernard GR, Hayden DL, Schoenfeld DA, Ware LB. Comparison of the SpO2/FIO2 ratio and the PaO2/FIO2 ratio in patients with acute lung injury or ARDS. Chest. 2007;132(2):410–7. doi: 10.1378/chest.07-0617. [PubMed] [Cross Ref]