Bài viết Hội chứng suy hô hấp cấp tính: Căn nguyên, bệnh sinh và tóm tắt về điều trị được dịch bởi bài gốc Acute Respiratory Distress Syndrome: Etiology, Pathogenesis, and Summary on Management bởi Thạc sĩ – Bác sĩ Hồ Hoàng Kim – ICU Bệnh viện NGUYỄN TRI PHƯƠNG.
Tóm tắt
Hội chứng suy hô hấp cấp tính (ARDS) có nhiều nguyên nhân và đặc trưng bởi hiện tượng viêm phổi cấp tính và tăng tính thấm thành mạch máu, dẫn đến suy hô hấp do thiếu oxy và mờ phổi hai bên. Hội chứng suy hô hấp cấp tính có tỷ lệ mắc bệnh và tử vong cao đáng kể, trong khi đó các chiến lược điều trị hiệu quả còn hạn chế. Tổng quan này chủ yếu nhìn lại các y văn hiện tại liên quan đến nguyên nhân, bệnh sinh và chiến lược quản lý ARDS.
Từ khóa hội chứng suy hô hấp cấp tính, nhiễm trùng huyết, hít sặc, thở máy, hồi sức tích cực.
Giới thiệu
Hội chứng suy hô hấp cấp tính (ARDS) được Ashbaugh và các cộng sự mô tả lần đầu tiên vào những năm 1960: đó là sự phát hiện của suy hô hấp thiếu oxy cấp tính ở người lớn do nhiều nguyên nhân (ví dụ, nhiễm trùng, chấn thương, viêm tụy), dẫn đến quá trình viêm trong nhu mô phổi và xuất hiện tình trạng phù phổi không do tăng áp lực thủy tĩnh.1 Ước tính trên toàn thế giới về tỷ lệ mắc ARDS dao động từ 7,2 đến 34 trường hợp trên 100 000 người-năm.[2-4] Theo ghi nhận của tiến trình lịch sử, tỷ lệ tử vong của ARDS được báo cáo là khoảng 60%. .[5-7] Trong 2 thập kỷ qua, đã có một sự cải thiện đáng kể về tỷ lệ sống còn của ARDS, với tỷ lệ tử vong hiện tại dao động từ 26% đến 35% .[5-7] Sự sống còn được cải thiện này là nhờ những tiến bộ trong quản lý chăm sóc tích cực nói chung và trong quản lý cụ thể bệnh nhân ARDS nói riêng, đặc biệt là sử dụng thông khí cơ học Vt thấp. Tuy nhiên, ARDS vẫn là một căn bệnh gây tử vong cao, gần 75 000 ca tử vong hàng năm ở Hoa Kỳ.[7] Trên toàn thế giới, ARDS ảnh hưởng đến gần 3 triệu người mỗi năm và chiếm 10% tổng số trường hợp nhập viện của đơn vị chăm sóc đặc biệt (ICU) và 23% ở nhóm bệnh nhân ICU có thở máy.[8]
Định nghĩa lâm sàng về ARDS lần đầu tiên được đưa ra vào năm 1994 bởi Hội nghị đồng thuận Mỹ-Âu (AECC), [9] và được thay thế vào năm 2012 bởi định nghĩa Berlin.[10,11] AECC định nghĩa các tiêu chuẩn cho ARDS và tổn thương phổi cấp tính (ALI), với ARDS là một phân loại nghiêm trọng hơn của ALI.[9] Định nghĩa Berlin cho ARDS loại bỏ phân loại ALI, và thay vào đó phân loại ARDS ở mức độ nhẹ (200 mm Hg <PaO2 / FiO2 300 mm Hg), trung bình (100 mm Hg <PaO2 / FiO2 200 mm Hg) và nặng (PaO2 / FiO2 100 mmHg) .[11] Định nghĩa Berlin vẫn giữ nguyên tiêu chuẩn định nghĩa chung về mức độ khởi phát cấp tính (1 tuần hoặc ít hơn), các hình mờ hai bên lan tỏa trên X quang phổi, không phải là do suy tim sung huyết hoặc quá tải thể tích nội mạch (IV). Ngoài ra, bệnh nhân phải nhận được áp lực dương cuối thì thở ra tối thiểu (PEEP) là 5 cm H2O, có thể thở xâm lấn hoặc không xâm lấn, tùy thuộc vào mức độ nghiêm trọng của bệnh. Định nghĩa Berlin có giá trị tiên đoán lớn đáng kể hơn đối với tỷ lệ tử vong do ARDS so với định nghĩa AECC.
Sinh bệnh học của hội chứng suy hô hấp cấp tính
Hội chứng suy hô hấp cấp tính được đặc trưng bởi tổn thương phế nang lan tỏa (DAD) và tăng tính thấm mao mạch.[12,13] Cả hai bề mặt biểu mô nội mô và phế nang đều bị ảnh hưởng, với sự phá vỡ màng phế nang- mao mạch. Tiếp theo là sự rò rỉ dịch giàu protein, thu hút tập trung bạch cầu trung tính và đại thực bào vào bên trong khoang phế nang, và sự hình thành màng hyaline.[13-16] Tổn thương phổi cũng như lan truyền quá trình viêm xảy ra do sự kích hoạt cytokine, giải phóng của các chất trung gian gây viêm như yếu tố hoại tử khối u và interleukin IL-1, IL- 6.[12,17] Bạch cầu trung tính hoạt hóa giải phóng các chất trung gian độc hại gây tổn thương oxy hóa tế bào [17]. Hư hại màng mao mạch – phế nang dẫn đến sự tích tụ dịch giàu protein trong các khoảng kẻ của nhu mô phổi, bất hoạt chất surfactan, xẹp phổi, và trao đổi khí bị suy giảm.[13,17] Về mặt lâm sàng, giai đoạn ARDS sớm hay còn gọi là giai đoạn xuất tiết này được đặc trưng bởi giảm oxy máu rõ rệt và giảm compliance phổi.[3] Giai đoạn cấp tính này có thể được giải quyết hoàn toàn, hoặc nó có thể tiến triển hoàn toàn sang giai đoạn tăng sinh nguyên bào sợi và tình trạng thiếu oxy sẽ kéo dài, tăng khoảng chết, compliance của phổi tiếp tục giảm đi, xơ hóa phổi và u hóa mạch máu phổi.[17]
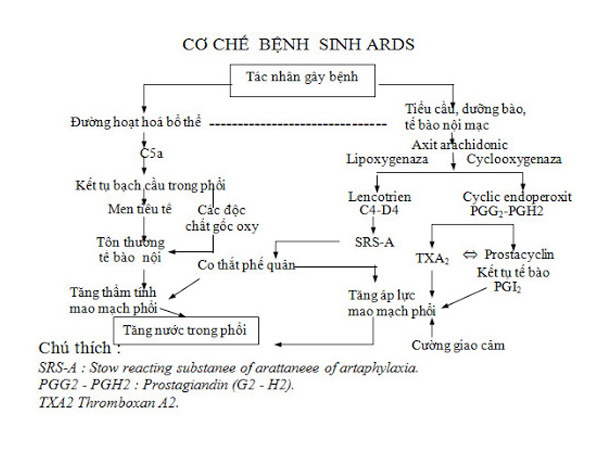
Tiêu chuẩn chẩn đoán cho ARDS không bao gồm chẩn đoán mô bệnh học của DAD và do đó mối tương quan giữa chẩn đoán lâm sàng của ARDS và kết quả giải phẫu bệnh lý của DAD có sự khác biệt. Các nghiên cứu so sánh bằng chứng tử thiết hoặc sinh thiết phổi mở của DAD với các tiêu chí lâm sàng đối với ARDS chỉ cho thấy mối tương quan 50% đến 88% khi sử dụng định nghĩa AECC,[18-21] và chỉ tương quan 45% đến 56% theo định nghĩa Berlin. Các nhà lâm sàng hãy chú ý đến mối tương hợp kém giữa ARDS được chẩn đoán theo các tiêu chí lâm sàng và dấu chứng DAD trên sinh thiết phổi hoặc khám nghiệm tử thi, cảnh báo các trường hợp chẩn đoán dương tính giả ARDS; tuy nhiên, ý nghĩa lâm sàng của quan sát này, trong hầu hết thực hành lâm sàng, còn nhiều giới hạn.[23]
Bệnh nguyên và các yếu tố nguy cơ Trong số hơn 50 bệnh lý liên quan đến sự xuất hiện ARDS, nhiễm trùng huyết, viêm phổi, hít sặc, chấn thương và truyền máu nhiều lần là nguyên nhân của phần lớn các trường hợp.[24,25] Gần 20% trường hợp ARDS không có yếu tố nguy cơ rõ ràng. Mặc dù khuynh hướng di truyền có thể có mối liên quan với sự xuất hiện và mức độ nghiêm trọng của ARDS, tuy vậy, vấn đề này đến nay vẫn chưa được rõ ràng.[27-30]
Nguyên nhân phổ biến nhất của ARDS là nhiễm trùng huyết, chiếm khoảng 40% các trường hợp.[24,25] Khoảng 6% đến 7% bệnh nhân nhiễm trùng huyết phát triển ARDS với tỷ lệ thấp hơn ghi hận ở những bệnh nhân có nguồn gốc nhiễm khuẩn ngoài phổi hoặc nhóm bệnh nhân nhiễm trùng huyết mức độ nhẹ hơn, nhưng ngược lại, có một tỷ lệ cao hơn và kết quả tồi tệ hơn xuất hiện ở những bệnh nhân bị sốc nhiễm trùng.[31-34] Nguồn nhiễm trùng tại phổi dường như có nguy cơ mắc ARDS cao hơn, do phải hứng chịu hai kiểu tác động trực tiếp (tức là viêm tại chỗ) và gián tiếp (tức là phản ứng viêm toàn thân) gây ARDS.[35,36]
Như đề cập phía trên, viêm phổi cũng là một nguyên nhân phổ biến của ARDS, đặc biệt ở những bệnh nhân viêm phổi nhập viện mà phân lập được tác nhân vi sinh trong các mẫu bệnh phẩm hô hấp.[37] Vi khuẩn gram dương và gram âm có tỷ lệ tương tự ARDS.[37] Mặc dù các tác nhân gây bệnh do virus và nấm thường ít gây ra viêm phổi, tuy nhiên, chúng có liên quan đến nguy cơ mắc ARDS cao hơn viêm phổi do vi khuẩn; điều này đặc biệt đúng với Pneumocystis jiroveci và Blastomyces.[37]
Hít sặc dịch dạ dày là nguyên nhân quan trọng của ARDS, chiếm tới 30% trường hợp trong một số nghiên cứu.[25,38] Hít sặc dẫn đến ARDS ngày càng thường xuyên hơn và nặng hơn ARDS so với các nguyên nhân khác, với tỷ lệ tử vong cao hơn (gấp 3 lần).[38] Các yếu tố nguy cơ để phát triển ARDS do viêm phổi hít bao gồm giới tính nam, tiền sử lạm dụng rượu, thang điểm hôn mê Glasgow thấp và nhập viện từ viện dưỡng lão.
Có tới 25% trường hợp ARDS do chấn thương nặng.[24] Tỷ lệ mắc ARDS ở bệnh nhân chấn thương nhập viện ICU là khoảng 12% .[39] Mặc dù bệnh nhân chấn thương có ARDS thường nằm ICU lâu hơn, nhưng nó không phải là yếu tố tiên đoán tỷ lệ tử vong cao hơn ở nhóm bệnh nhân này. Sau khi điều chỉnh tuổi, mức độ nặng của bệnh và tình trạng hôn mê, bệnh nhân chấn thương bị ARDS có tỷ lệ sống cao hơn so với các trường hợp ARDS do các nguyên nhân khác. Trong nghiên cứu của ARDS Network, bệnh nhân chấn thương có ARDS có nguy cơ thấp hơn về tiêu chí tỷ lệ tử vong sau 90 ngày (tỷ lệ chênh lệch [OR], 0,44; khoảng tin cậy 95% [CI], 0,24-0,82; P .01), so với bệnh nhân mắc ARDS do các nguyên nhân khác. [40] Sự khác biệt về kết quả này có thể được giải thích, một phần, do tổn thương biểu mô phổi và nội mô ít nghiêm trọng hơn trong ARDS [40,41] do chấn thương.
Truyền máu nhiều lần chiếm 25% đến 40% các trường hợp ARDS.[24-26] Tổn thương phổi cấp tính liên quan đến truyền máu (TRALI) được định nghĩa là ALI tiến triển trong vòng 6 giờ sau khi truyền hoàn toàn 1 hay nhiều huyết tương hoặc các chế phẩm có nguồn gốc từ huyết tương.[42] Các nghiên cứu đánh giá ban đầu truyền máu cho thấy truyền máu lớn hơn 22 đơn vị máu trong 12 giờ và hơn 15 đơn vị máu trong 24 giờ là yếu tố nguy cơ đáng kể cho sự phát triển ARDS xuất hiện sau đó.[24-26]
Có một mối liên quan về số lượng đơn vị hồng cầu được sử dụng với sự xuất hiện ARDS ở nhóm bệnh nhân nặng hồi sức có chỉ định truyền hồng cầu (PRBCs).[43] Hội chứng suy hô hấp cấp tính có nhiều khả năng xuất hơn ở những bệnh nhân được truyền huyết tương tươi đông lạnh và tiểu cầu so với những người chỉ truyền máu PRBC.[44]
Hệ thống điểm ARDS
Năm 2011, Nhóm thử nghiệm bệnh nặng và chấn thương nghiêm trọng của Hoa Kỳ đã xây dựng và xác nhận một mô hình nguy cơ xuất hiện ARDS, Điểm dự đoán tổn thương phổi (LIPS), để tìm xem bệnh nhân nào có nguy cơ cao mắc ALI và ARDS trước khi chúng xuất hiện. [32] Mô hình đã được xác nhận trong một nghiên cứu đoàn hệ tiến cứu, đa trung tâm, quan sát trên 5584 bệnh nhân có 1 hoặc nhiều yếu tố nguy cơ ALI / ARDS, trong đó có 377 (6,8%) đã phát triển ALI / ARDS. Những bệnh nhân này được đánh giá trong 6 giờ đầu sau khi nhập khoa cấp cứu, hoặc giai đoạn tiền phẫu tại thời điểm nhập viện để tiến hành các phẫu thuật chương trình có nguy cơ cao. Mục tiêu là xác định những bệnh nhân có nguy cơ mắc ALI / ARDS cao. Bằng cách xác định những bệnh nhân này càng sớm càng tốt, các can thiệp lâm sàng, chiến lược và điều chỉnh chế độ chăm sóc, theo dõi có thể được thực hiện để ngăn ngừa bệnh nhân phát triển ALI / ARDS sau đó. Tại điểm cắt LIPS > 4, được coi là điểm cắt tối ưu theo phân tích diện tích dưới đường cong, các giá trị tiên đoán âm và dương phát triển ALI / ARDS là 0,97 và 0,18, và độ nhạy và độ đặc hiệu lần lượt là 69% và 78% . Trong thực tế, LIPS có thể là một công cụ hữu ích để tiên đoán bệnh nhân có nguy cơ mắc ALI/ARDS thấp (nghĩa là những bệnh nhân có điểm LIPS nhỏ hơn hoặc bằng 4). Nhưng giá trị tiên đoán dương thấp và độ phức tạp của bảng tính LIPS làm giới hạn tính tiện ích của nó.
Levitt và các cộng sự đã thực hiện một nghiên cứu đoàn hệ tiến cứu để nhận dạng các biến số dự đoán nhu cầu phải thở máy áp lực dương ở bệnh nhân có dấu chứng ALI trên X quang (nghĩa là mờ đục phổi hai bên trong < 7 ngày) mà không có tăng áp nhĩ trái. Thở nhanh, ức chế miễn dịch, tăng nhu cầu oxy là các yếu tố tiên đoán độc lập tiến triển thành ALI / ARDS và được sử dụng để xây dựng thành điểm số tổn thương phổi cấp tính sớm (EALI). Điểm EALI có 3 thành phần (1 điểm cho yêu cầu O2 là 2-6 L / phút hoặc 2 điểm cho> 6 L / phút; 1 điểm cho nhịp thở từ 30 trở lên; 1 điểm cho ức chế miễn dịch) để xác định chính xác bệnh nhân tiến triển ALI có nhu cầu thông khí áp lực dương. Điểm số EALI 2 điểm xác nhận bệnh nhân mắc ARDS mức độ nhẹ sẽ cần thở máy áp lực dương với độ nhạy 89% và độ đặc hiệu 75%. Thời gian trung bình thông khí áp lực dương là 20 giờ. Giá trị tiên đoán dương và âm của điểm EALI lần lượt là 53% và 95%. Điểm EALI có thể là một công cụ xử lý hữu ích để xác định những bệnh nhân có nguy cơ phát triển ARDS và cần thở máy, mặc dù nó vẫn chưa được xác nhận nhóm bệnh nhân ngoài đoàn hệ.
Các dấu ấn sinh học chẩn đoán của hội chứng suy hô hấp cấp tính
Với những hạn chế của tiêu chuẩn chẩn đoán ARDS và hệ thống điểm tiên đoán, nên có mối quan tâm ngày càng tăng đối với dấu ấn sinh học ARDS. Các dấu ấn sinh học trong hơi thở của ARDS đặc biệt hấp dẫn bởi vì chúng có thể phản ánh chính xác hơn các biến cố xảy ra trong nhu mô phổi với độ trung thực cao hơn so với dấu ấn sinh học lưu hành trong máu. Các dấu ấn sinh học có trong hơi thở được nghiên cứu bao gồm các hợp chất hữu cơ dễ bay hơi, Cytokine, Hydro Peroxide, Oxit Nitric, axit, sản phẩm phụ do Peroxid hóa Lipid và cytokeratins. [46] Tuy nhiên, không có chất đánh dấu nào trong số này thật sự có tính thực tế để sử dụng lâm sàng.
Các dấu ấn sinh học ARDS khác từ các mẫu dịch rửa phế quản, phế nang và huyết thanh cũng đã được nghiên cứu. Nồng độ IL-8 trong dịch rửa phế quản, phế nang ở bệnh nhân có nguy cơ cao cao hơn đáng kể ở những bệnh nhân khác sau đó sẽ tiến triển vào ARDS.[47] Villar và các cộng sự đã tìm ra rằng protein gắn kết lipopolysacarit huyết thanh cao hơn ở bệnh nhân nhiễm trùng huyết có liên quan đến sự xuất hiện biến chứng ARDS do nhiễm trùng huyết và có tiên đoán kết quả lâm sàng xấu hơn. Nồng độ angiopoietin-2 trong huyết thanh tăng cao cũng đã được chứng minh là có liên quan đến sự phát triển của ALI ở bệnh nhân bị bệnh nhân hồi sức. Một tổng quan hệ thống và phân tích tổng hợp gần đây đã nhận diện được 20 dấu ấn sinh học huyết thanh được sử dụng để chẩn đoán ARDS ở những người có nguy cơ cao.[50]
Hạn chế của dấu ấn sinh học là không có dấu ấn sinh học đơn lẻ nào có thể dự đoán đầy đủ sự tiến triển hoặc kết quả của ARDS ở trên bệnh nhân. Các nghiên cứu gần đây đã chứng minh tính hữu ích của việc kết hợp nhiều dấu ấn sinh học với dữ liệu lâm sàng, chẳng hạn như Hệ thống tính điểm sinh lý cấp tính, Tuổi, Đánh giá sức khỏe mãn tính (APACHE) -III, để cải thiện tiên lượng nguy cơ.[51,52] Tương lai của dấu ấn sinh học ARDS có thể nằm ở tiện ích để cải thiện các hệ thống tính điểm dự đoán thay vì các xét nghiệm chẩn đoán biệt lập.
Ngăn ngừa và điều trị hội chứng suy hô hấp cấp tính
Tổn thương phổi đặc trưng của ARDS có thể được xem là phản ứng không thích hợp của vật chủ với tổn thương ban đầu, chẳng hạn như nhiễm trùng huyết, viêm phổi hoặc hít sặc. Nhưng chỉ có một nhóm nhỏ những bệnh nhân này sẽ tiếp tục phát triển ARDS. Điều này đã dẫn đến mối quan tâm ngày càng tăng trong việc nhận diện ngay từ ban đầu các biến cố sinh lý bệnh sớm dẫn đến ARDS và các can thiệp sớm hiệu quả để chặn đứng phản ứng gây tổn thương đó. Các chiến lược phòng ngừa hội chứng suy hô hấp cấp tính đã được thử nghiệm ở những bệnh nhân có nguy cơ cao bao gồm gói điều trị đạt mục tiêu sớm trong nhiễm trùng huyết, quản lý dịch truyền tĩnh mạch, chiến lược truyền máu, chiến lược thông khí bảo vệ phổi (LPV) và quản lý dinh dưỡng.
Điều trị nhiễm trùng huyết
Nhiễm trùng huyết chiếm gần 40% trong tất cả các trường hợp ARDS. Mặc dù không có phương thức cụ thể nào để ngăn ngừa sự phát triển của ARDS ở bệnh nhân nhiễm trùng huyết, nhưng việc trì hoãn điều trị nhiễm trùng huyết làm tăng nguy cơ mắc ARDS [53] lần lượt là 3,6 và 2,4 lần. Chẩn đoán sớm và điều trị sớm nhiễm trùng huyết có thể làm giảm nguy cơ ARDS ở bệnh nhân.
Quản lý dịch truyền
Một đặc điểm nổi bật của ARDS là tăng tính thấm mao mạch, rò rỉ dịch mao mạch và tăng thể tích nước ngoài mạch máu trong phổi. Có vẻ hợp lý khi một chiến lược quản lý dịch truyền tĩnh mạch cẩn trọng có thể ngăn ngừa ARDS ở những bệnh nhân có nguy cơ cao. Jia và các cộng sự đã chứng minh rằng sự cân bằng dịch dương ở những bệnh nhân thở máy trong hơn 48 giờ có OR 1,3 lần tiến triển ARDS, cho thấy vai trò của quản lý dịch cẩn trọng trong phòng ngừa ARDS [54] Các nghiên cứu ở nhóm bệnh nhân tiền phẫu trải qua cuộc phẫu thuật lớn cũng chỉ ra rằng cân bằng dịch dương là một yếu tố nguy cơ độc lập cho sự phát triển của ARDS. Ở những bệnh nhân phẫu thuật mở lồng ngực, cân bằng dịch dương vào ngày hậu phẫu 1 có liên quan đến việc tăng nguy cơ bệnh nhân mắc ARDS [55] Một phân tích tổng hợp gần đây cũng ở bệnh nhân phẫu thuật lồng ngực tiến hành cắt bỏ phổi cho thấy rằng chiến lược quản lý dịch phẫu thuật tự do, đạt mức trung bình 2,6 ml / kg / giờ trong và trong 24 giờ đầu sau phẫu thuật, có liên quan đến tỷ lệ mắc ARDS sau phẫu thuật cao hơn. Ở bệnh nhân hồi sức ngoại bị suy hô hấp giảm oxy máu cần thở máy hậu phẫu, những bệnh nhân nhận được > 20 mL/kg/h dịch IV trong phẫu thuật có nguy cơ phát triển ARDS cao gấp 4 lần so với những người nhận <10 mL/kg/h.[57] Trong khi dữ liệu xác định chiến lượt dịch truyền như thế nào là tối ưu cho việc ngăn ngừa nguy cơ xuất hiện ARDS còn chưa tõ ràng thì một chiến lượt sử dụng dịch truyền một cách cẩn thận tránh cân bằng dịch dương quá mức có thể là hợp lý nhằm giảm thiểu nguy cơ tiến triển ARDS ớ nhóm bệnh nhân có nguy cơ cao.

Ở những bệnh nhân đã tiến triển vào ARDS, Thử nghiệm Fluids and Catheters Treatment Trial (FACTT) cho thấy chiến lược quản lý dịch truyền cẩn trọng rút ngắn thời gian thở máy và thời gian nằm ICU (LoS) và cải thiện oxy hóa máu ở những bệnh nhân này.[58] Trong nghiên cứu, những bệnh nhân mắc ARDS ở nhóm truyền dịch cẩn trọng được truyền dịch để duy trì áp lực tĩnh mạch trung tâm và áp lực nêm mao mạch phổi thấp hơn so với nhóm truyền dịch tự do. Trong một phân tích thứ cấp của dữ liệu Thử nghiệm ARDSNet, nhóm cân bằng dịch âm tính tích lũy đến ngày thứ 4, nghiên cứu ghi nhận có liên quan đến tỷ lệ tử vong bệnh viện thấp hơn một cách độc lập (OR, 0,50; 95% CI, 0,28-0,89; P <0,001), số ngày thở máy ít hơn và ít ngày nằm viện hơn ở bệnh nhân mắc ARDS [59] Do đó, việc hạn chế dịch nhập và đạt được mức kiểm soát bằng lợi tiểu có thể có kết quả dương tính ở bệnh nhân mắc ARDS.[60]
Quản lý vấn đề truyền máu
Mối quan hệ đáp ứng – liều lượng giữa lượng sản phẩm máu được truyền ở bệnh nhân và nguy cơ phát triển ARDS cho thấy các chính sách truyền máu hạn chế có thể làm giảm tỷ lệ mắc ARDS ở những bệnh nhân này. [43,44,61] Trong một thử nghiệm ngẫu nhiên lớn được thực hiện bởi Critical Canada Care Trials Group, ở chiến lược hạn chế truyền máu hồng cầu (RBC) (hemoglobin mục tiêu 7-9 g / dL), có liên quan đến tỷ lệ mắc ARDS thấp hơn so với chiến lược truyền máu tự do (hemoglobin mục tiêu 10-12 g / dL; 7,7% so với 11,4%) [62] Cũng cần thận trọng hơn khi truyền tiểu cầu và huyết tương tươi đông lạnh, vì các sản phẩm máu này có nguy cơ mắc ARDS cao hơn so với truyền RBC [44]. Ngay cả trong chăm sóc tại chiến trường, một khi xuất huyết được kiểm soát, chiến lược truyền máu thận trọng hơn cho các sản phẩm máu được ủng hộ để giảm nguy cơ ARDS ở những bệnh nhân này.[63]
Các kháng thể đặc hiệu bạch cầu hạt hoặc HLA từ máu của người hiến cũng có thể đóng một vai trò trong sinh bệnh học của ARDS liên quan đến truyền máu, thông qua hoạt hóa bổ thể và sau đó là tổn thương phổi. [64,65] Việc sàng lọc người cho máu để tìm các kháng thể đặc hiệu đã được đề nghi như là một biện pháp hữu ích để giảm tỷ lệ mắc TRALI [66]. Nhưng điểm cắt chính xác nồng độ kháng thể và cũng như lợi ích về mặt chi phí của xét nghiệm kháng thể thông thường ở người hiến máu chưa được biết rõ.[66] Mối liên quan giữa tiền căn sinh nhiều con và sự hình thành kháng thể kháng bạch cầu của người (HLA) cũng làm tăng lên mối lo lắng về sự an toàn của máu được hiến từ người nữ. Một số nghiên cứu đã cho thấy tăng nguy cơ mắc TRALI và kết quả lâm sàng tồi tệ hơn ở những bệnh nhân được truyền máu toàn phần hoặc huyết tương từ máu mà người cho là nữ [67,68]. Để giảm nguy cơ TRALI, Hiệp hội Ngân hàng máu Hoa Kỳ khuyến cáo rằng các thành phần máu có thể tích huyết tương cao (như là huyết tương, tiểu cầu hoặc máu toàn phần) nên được lấy từ nam, nữ chưa bao giờ mang thai hoặc nữ đã thử nghiệm âm tính với kháng thể HLA [66,69]. Các khuyến nghị tương tự áp dụng trên phạm vi quốc tế, giúp giảm 2/3 trong số các trường hợp TRALI được báo cáo. [70]
Có một số bằng chứng cho thấy mối liên quan giữa thời gian lưu trữ máu và nguy cơ TRALI. Khi PRBCs được lưu trữ, việc kích hoạt các chất chuyển hóa độc tính bạch cầu trung tính xảy ra, góp phần vào sự xuất hiện của TRALI, do đó làm tăng mối lo ngại về sự an toàn của các sản phẩm máu cũ.[71] Một mô hình in vivo trên bò cũng gia tăng mối lo lắng này.[72] Nhưng nhiều nghiên cứu về Truyền máu ở người không cho thấy mối liên quan giữa truyền máu các sản phẩm máu cũ và TRALI. [67,68,73-75] Hiện tại, không có đủ dữ liệu để khuyến cáo cho việc sử dụng các sản phẩm máu mới ở nhóm bệnh nhân nguy cơ cao.
Thở máy trong điều trị ARDS
Các chiến lược thông khí bảo vệ phổi đại diện cho sự tiến bộ lớn nhất trong việc quản lý ARDS trong 50 năm qua. Các chiến lược giảm chấn thương thể tích và chấn thương do xẹp phổi với việc sử dụng Vt thấp, áp lực hít vô và bình nguyên thấp, và thông khí nằm sấp đã được chứng minh là cải thiện kết quả ở bệnh nhân mắc ARDS và được các hiệp hội hồi sức lớn khuyến cáo sử dụng.[76-78] Những hướng dẫn này khuyến khích sử dụng chiến lược LPV cho tất cả bệnh nhân mắc ARDS, với các mục tiêu: (1) thể tích thông khí 4 đến 8 mL / kg (dựa trên trọng lượng cơ thể dự đoán) và (2) áp suất bình nguyên < 30 cmH2O, sử dụng áp lực hít vào thấp hơn. Các hướng dẫn không khuyến cáo sử dụng thông khí dao động tần số cao (HFOV) thường xuyên ở bệnh nhân mắc ARDS.[77] Thử nghiệm OSCILLATE cho thấy nguy cơ tử vong tăng ngày 28 với HFOV (nguy cơ tương đối, 1,41; 95% CI, 1,12- 1,79), [79] và các thử nghiệm HFOV khác đã không tìm thấy lợi ích ở bệnh nhân mắc ARDS [80,81]. Cần thêm các nghiên cứu bổ sung để xác định tính an toàn và hiệu quả của việc sử dụng oxy hóa màng ngoài cơ thể (ECMO) ở những bệnh nhân ARDS [77].Trong một thử nghiệm ngẫu nhiên có đối chứng gần đây, những bệnh nhân mắc ARDS nặng (PaO2 / FiO2 <80 mm Hg trong hơn 6 giờ) đã nhận được ECMO tĩnh mạch ngay lập tức không có sự thay đổi đáng kể về tỷ lệ tử vong so với những người được thở máy thông thường (35% so với 46%) [82]. Tuy nhiên, 28% bệnh nhân được thở máy thông thường đã chuyển qua ECMO, gây khó khăn cho việc đưa ra kết luận về tiện ích của ECMO trong ARDS.
Những hướng dẫn này cũng đưa ra 2 khuyến cáo có điều kiện để sử dụng PEEP cao và thủ thuật huy động phế nang ở những bệnh nhân mắc ARDS trung bình đến nặng. Các chiến lược điều trị được đề xuất này dựa trên quan niệm rằng PEEP cao và huy động phế nang có thể có hiệu quả trong việc mở phế nang bị xẹp và cải thiện Compliance của phổi cũng như trao đổi khí. Nhưng một thử nghiệm ngẫu nhiên lớn gần đây đã phát hiện ra rằng chiến lược huy động phế nang và PEEP cao hơn (so với tiêu chuẩn, PEEP thấp hơn) ở những bệnh nhân mắc ARDS làm tăng tỷ lệ tử vong trong 28 ngày ở những bệnh nhân này (tỷ lệ nguy hiểm 1,20; CI 95%, 1,01 -1,42). [83] Trong phân tích 3562 bệnh nhân mắc ARDS từ 9 thử nghiệm trước đó, giảm áp lực đẩy (driving pressure), được tính bằng Vt chia cho compliance hô hấp hoặc áp lực bình nguyên trừ PEEP ở bệnh nhân không nỗ lực hít vào, có liên quan đến khả năng sống còn tăng lên. [84] Phát hiện này có thể giải thích tại sao PEEP có lợi ích hơn ở những bệnh nhân còn khả năng huy động phế nang [85] và tác hại có thể xảy ra khi PEEP gây ra tình trạng căng quá mức. [86,87]
Các chế độ thở máy khác nhau đã được nghiên cứu ở bệnh nhân mắc ARDS. Thông khí giải phóng áp lực đường thở (APRV) là chế độ thông khí cơ học chuyển đổi giữa 2 mức áp suất đường thở dương liên tục, đồng thời cho phép thở tự nhiên trong bất kỳ giai đoạn nào của chu kỳ thở máy. Các nghiên cứu nhỏ về APRV ở bệnh nhân ARDS cho thấy sự cải thiện về cung lượng tim, trao đổi khí, Compliance phổi, nhu cầu an thần và thời gian thở máy so với thở máy thông thường (không bao gồm các chiến lược bảo vệ phổi về Vt thấp và áp lực hô hấp) [88,89]. Các nghiên cứu trên động vật cũng cho thấy APRV có thể ngăn ngừa ARDS ở cả hai mô hình nguy cơ cao và ở phổi bình thường [90,91]. Trong các mô hình động vật có nguy cơ cao, APRV có liên quan đến việc giảm phù phổi và bảo tồn protein E-cadherin, và các protein surfactant, cho thấy nó làm giảm tính thấm của phổi, phù nề và thoái hóa surfactant so với động vật được thông khí Vt thấp.[90] Trong quần thể phổi bình thường, APRV ngăn cản sự phát triển của ALI và có tỷ lệ PaO2 / FiO2 cao hơn (478 so với 242, tương ứng với P <0,55), so với động vật được thở máy liên tục với Vt 10 cc/kg [91]. Trong tổng quan hệ thống dữ liệu quan sát từ nhóm bệnh nhân chấn thương, áp dụng sớm APRV ở bệnh nhân chấn thương có nguy cơ cao đã giảm tỷ lệ mắc ARDS; tuy nhiên, các tác giả không thể xác định liệu nhóm so sánh có sử dụng chiến lược thông khí Vt thấp hay không.[92] Những nghiên cứu gần đây so sánh APRV với chiến lược thông khí nhắm vào thể tích Vt 8 đến 10 mL / kg đã không chứng minh được lợi ích rõ ràng của việc sử dụng APRV ở bệnh nhân với ARDS.[93-95] Tuy nhiên, một thử nghiệm ngẫu nhiên có đối chứng ở một trung tâm gần đây so sánh APRV sớm (bắt đầu < 48 giờ sau khi bắt đầu thở máy) với thông khí thể tích Vt thấp ở 138 bệnh nhân mắc ARDS với PaO2 / FiO2 < 250 cho thấy có lợi ích về số ngày không thở máy, rút ống nội khí quản, mở khí quản và tử vong ICU.[96] Những bệnh nhân này được điều trị APRV cũng ít phải thông khí nằm sấp hơn, ít sử dụng thuốc ức chế thần kinh cơ (NMB) và ít phải sử dụng thủ thuật huy động phế nang hơn. Điều quan trọng cần lưu ý là APRV được sử dụng trong nghiên cứu này tránh áp suất cao và Vt cao, có thể mang lại mức độ bảo vệ phổi cao hơn trong nhóm APRV. Với dữ liệu mâu thuẫn, không có bằng chứng rõ ràng để ủng hộ cho khuyến cáo sử dụng APRV ở bệnh nhân mắc ARDS.
Thông khí tỷ lệ đảo ngược (IRV) là một chế độ thông khí cơ học khác đã được thử nghiệm ở bệnh nhân mắc ARDS. Thông khí tỷ lệ đảo nghịch nhằm mục đích đảo ngược tỷ lệ hô hấp hít vào và thở ra bình thường, làm cho thời gian hít vào dài hơn thời gian thở ra khi thở máy. Về mặt lý thuyết, điều này làm tăng áp lực đường thở và giúp huy động các phế nang bị xẹp. Thông khí tỷ lệ đảo ngược có thể được thực hiện trong cả hai chế độ kiểm soát bằng áp suất hoặc thể tích. Nhược điểm của IRV là nó có thể xuất hiệp bẫy khí đáng kể và hình thành PEEP nội sinh trong phổi, đặc biệt là ở những bệnh nhân mắc bệnh phổi tắc nghẽn. Vài thử nghiệm được tiến hành xem xét vai trò của IRV trong ARDS. Các nghiên cứu này đã chỉ ra rằng IRV ít có tác dụng đối với oxy, cung lượng tim hoặc thải CO2 so với thông khí thông thường và có thể làm xấu đi trao đổi khí, chấn thương thể tích và huyết động học.[97-100].
Do chức năng phổi kém, bệnh nhân mắc ARDS đặc biệt dễ bị mắc bẫy khí và PEEP nội sinh, bất kể chế độ thở máy nào được sử dụng. Đo áp lực thực quản được đề xuất như một cách để phát hiện PEEP nội sinh và giúp hướng dẫn các bác sĩ lâm sàng tối ưu hóa cài đặt máy thở để giảm thiểu áp lực xuyên phổi và cải thiện trao đổi khí ở bệnh nhân mắc ARDS [101-104] Trong một thử nghiệm ngẫu nhiên có đối chứng 61 bệnh nhân mắc ARDS [101-104] , Talmor và các cộng sự đã ghi nhận các tác động lâm sàng của việc điều chỉnh PEEP dựa trên áp lực màng phổi đo được từ áp lực của thực quản [105]. Trong nhóm đo áp lực thực quản, mức PEEP được thiết lập để đạt được áp lực xuyên phổi từ 0 đến 10 cm H2O cuối thì thở ra, thì bệnh nhân có sự cải thiện tốt về mức bão hòa oxy máu và compliance. Soroksy và các cộng sự đã sử dụng phương pháp đo áp lực thực quản để điều chỉnh Vt ở bệnh nhân mắc ARDS và cũng nhận thấy rằng tình trạng tăng thán khí nặng có thể được điều trị thành công bằng phương thức này.106 Tuy nhiên, Chiumello và các đồng sự lại nhận ra rằng phương pháp điều chỉnh PEEP bằng phương pháp đo áp lực thực quản không thể dự đoán được khả năng huy động phổi trong ARDS khi được đánh giá bằng chụp cắt lớp vi tính [107]. Một nghiên cứu gần đây không tìm thấy sự khác biệt đáng kể về tử vong, số ngày không thở máy ở những bệnh nhân mắc ARDS được chọn ngẫu nhiên để điều chỉnh PEEP bằng phương pháp đo áp lực thực quản, so với chiến lược PEEP/FiO2 cao theo kinh nghiệm [108]. Cần có nhiều nghiên cứu chặt chẽ hơn trước khi đo áp lực thực quản trở thành một chăm sóc chẩn cho bệnh nhân mắc ARDS. Một thử nghiệm lớn, ngẫu nhiên (the Esophageal Pressure-Guided Ventilation 2 study) hiện đang được tiến hành để đánh giá hiệu quả của việc sử dụng áp lực thực quản ở bệnh nhân mắc ARDS tác động lên các kết quả lâm sàng liên quan (ví dụ: tử vong, ngày không thở máy).
Thông khí nằm sấp
Đối với những bệnh nhân bị ARDS nặng (nghĩa là tỷ lệ PaO2 / FiO2 <100), những bệnh nhân này nên được thông khí nằm sấp ít nhất 12 h /ngày [77]. Dựa trên kết quả thử nghiệm (PROSEVA), thông khí nằm sấp ở những bệnh nhân mắc ARDS nặng làm giảm tỷ lệ tử vong trong 28 ngày xuống hơn 50% [110]. Nằm sấp làm thay đổi thực hành lâm sàng ở nhiều trung tâm ICU và các bác sĩ và có thể làm thay đổi cả hệ thống phía sau. Bên cạnh đó, chú ý thông khí nằm sấp mang lại nhiều nguy cơ cho bệnh nhân, chẳng hạn như mằn sai vị trí hoặc ống nội khí quản bị tụt hay lệch, cần tăng an thần, ít cơ hội vận động sớm và nguy cơ loét tỳ đè cao hơn.
Quản lý vấn đề dinh dưỡng Bệnh nhân mắc ARDS có quá trình dị hóa mạnh và cần có sự hỗ trợ dinh dưỡng đầy đủ để bù đắp lượng calo và protein bị mất trong khi đảm bảo lượng dịch nhập không gây ra tình trạng quá tải [111]. Thử nghiệm dinh dưỡng hạn chế giai đoạn đầu với dinh dưỡng tiêu hóa hoàn toàn ở bệnh nhân bị tổn thương phổi cấp tính (EDEN) nhằm đưa ra một lượng dinh dưỡng cần thiết cho bệnh nhân mắc ARDS, bằng cách so sánh hiệu quả lâm sàng giữa bệnh nhân được cho ăn dinh dưỡng hạn chế qua đường tiêu hóa (20 kcal / giờ) so với đầy đủ (ví dụ, 25-30 kcal /kg/ngày calo không protein, cộng với 1,2-1,6 g/kg/ngày protein) trong 6 ngày đầu tiên thở máy, sau đó dinh dưỡng tiêu hóa đầy đủ ở cả hai nhóm [112]. Họ không tìm thấy sự khác biệt nào giữa 2 nhóm về số ngày không thở máy, tử vong ngắn hay dài hạn, chức năng thể lực về sau, hoặc các biến chứng thứ phát [113, 114]. Tuy nhiên, trong nhóm dinh dưỡng đầy đủ, bệnh nhân có tỷ lệ nôn mửa, tồn lưu dạ dày, tăng đường huyết và táo bón cao hơn so với nhóm ăn hạn chế.[112].
Đường dinh dưỡng nào là tối ưu cho bệnh nhân mắc ARDS vẫn chưa rõ ràng. Có một mối lo ngại rằng dinh dưỡng đường tĩnh mạch có chứa một lượng lớn chất béo nhũ tương có thể làm nặng thêm tình trạng viêm biểu mô phế nang. Lekka và các cộng sự đã so sánh hiệu quả của việc sử dụng lipid trong dinh dưỡng tĩnh mạch toàn phần so với giả dược với bệnh nhân mắc ARDS [115]. Bệnh nhân dùng ARDS sử dụng lipid có mức độ bão hòa oxy máu xấu hơn, giảm compliance phổi và tăng sức cản mạch máu phổi so với những người được dùng giả dược. Tương tự, Suchner và cộng sự đánh giá các tác động lâm sàng của tốc độ truyền lipid ở bệnh nhân mắc ARDS và lưu ý rằng việc truyền nhanh các nhũ tương chất béo (tức là hơn 6 giờ) có liên quan đến việc oxy hóa máu xấu hơn so với truyền chậm hơn 24 giờ [116]. Do đó, lipid truyền tĩnh mạch có thể có hại ở bệnh nhân mắc ARDS. Tuy nhiên, một thử nghiệm lâm sàng ngẫu nhiên có đối chứng (Thử nghiệm CALORIES) của Harvey và cộng sự tiến hành trên 2400 bệnh nhân hồi sức (bao gồm cả bệnh nhân mắc ARDS), được chỉ định ngẫu nhiên dinh dưỡng tĩnh mạch toàn phần so với dinh dưỡng tiêu hóa cho thấy không có sự khác biệt đáng kể về tỷ lệ tử vong 30 và 90 ngày, tỷ lệ nhiễm trùng [117]. Các nghiên cứu tiếp theo là cần thiết để chỉ ra đường dinh dưỡng tối ưu ở bệnh nhân mắc bệnh nhân nặng có ARDS.
Về thành phần của các chế phẩm dinh dưỡng, có nhiều thông tin trái chiều liên quan đến hiệu quả lâm sàng của việc bổ sung chất chống oxy hóa đường dinh dưỡng để giảm thiếu quá trình viêm trong nhu mô phổi ở bệnh nhân mắc ARDS. Hai nghiên cứu riêng biệt (N lần lượt là 146 và 100) đã đánh giá tác dụng của axit eicosapentaenoic, axit gamma-linolenic và chất chống oxy hóa (là các thành phần của chế độ ăn uống điều chỉnh miễn dịch) ở bệnh nhân mắc ARDS; cả hai nghiên cứu đều cho thấy cải thiện mức oxy hóa máu và có thời gian thở máy ít hơn ở những bệnh nhân được chế động dinh dưỡng bổ sung điều hòa miễn dịch [118,119]. Tuy nhiên, một nghiên cứu gần đây của Rice và các cộng sự về việc sử dụng axit béo omega-3, axit g-linolenic và chất chống oxy hóa cho bệnh nhân mắc ARDS đã bị ngừng sớm do không có hiệu quả lâm sàng [120]. Ngoài ra, Stapleton và các đồng nghiệp đánh giá việc sử dụng dầu cá so với giả dược ở 90 bệnh nhân mắc ARDS và không tìm thấy sự khác biệt về dấu ấn sinh học của phổi hoặc kết quả lâm sàng ở những bệnh nhân này [12]. Do cở mẫu nhỏ và kết quả mâu thuẫn của những nghiên cứu trên, nên cần có những nghiên cứu thêm là cần thiết để xác định hiệu quả của chế độ ăn uống điều chỉnh miễn dịch ở bệnh nhân mắc ARDS.
Thuốc điều trị suy hô hấp cấp tính
Thuốc an thần
Thuốc an thần là một thành phần chính trong quản lý bệnh nhân thở máy có ARDS. Các nghiên cứu đánh giá cụ thể các chiến lược an thần ở bệnh nhân mắc ARDS còn hạn chế, nhưng việc quản lý an thần ở những bệnh nhân này có thể được suy luận từ các dữ liệu ICU nói chung. Hướng dẫn thực hành lâm sàng về an thần và giảm đau cho bệnh nhân ICU người lớn có thể áp dụng cho bệnh nhân ARDS [122]. Thuốc an thần và giảm đau giúp giảm tiêu thụ năng lượng, cải thiện compliance và sự đồng bộ máy thở ở bệnh nhân ARDS [123.124]. Tuy nhiên, quá liều an thần mất đi sự thức tỉnh có thể kéo dài thời gian thở máy và thời gian nằm ICU và thời gian nằm viện, làm tăng nguy cơ bệnh nhân xuất hiện sảng ICU và suy giảm chức năng nặng kéo dài [125-129]. Điều này có thể dẫn đến tỷ lệ tử vong cao hơn, rối loạn chức năng nhận thức và thể chất lâu dài [130-133]. Giảm thiểu tối đa thuốc an thần có thể tạo điều kiện cho cai máy thở và vận động sớm, do đó đẩy nhanh quá trình phục hồi và cải thiện kết quả lâm sàng của họ [126,128,134,135]. Chiến lược bảo vệ phổi cho thở máy có thể được sử dụng ở bệnh nhân mắc ARDS mà không cần sử dụng thuốc an thần sâu [136-141] Nhưng cần phải dùng thuốc an thần và giảm đau sâu ở nhữngbệnh nhân mắc ARDS, đó là những bệnh nhân cần NMB kéo dài để cải thiện trao đổi khí và dung nạp máy thở, để loại bỏ nhận thức, khó chịu và ký ức ở những bệnh nhân này [128] Nhìn chung nên tránh sử dụng thuốc an thần nhóm Benzodiazepin cho bệnh nhân ICU vì chúng có liên quan đến xuất hiện trạng thái sảng ICU, thời gian nằm ICU, thời gian nằm viện, thở máy và tỷ lệ tử vong [142-146]. Các nghiên cứu bổ sung về chiến lược an thần ở bệnh nhân mắc ARDS là cần thiết, đặc biệt là trong quá trình thông khí nằm sấp của bệnh nhân. Ở những bệnh nhân mắc ARDS cần dùng thuốc an thần, nên sử dụng chiến lược giảm đau trước tiên (nghĩa là điều trị đau trước khi bắt đầu hoặc tăng thuốc an thần), sử dụng thuốc an thần Nonbenzodiazepine (ví dụ Propofol, Dexmedetomidine) để tối ưu hóa bệnh nhân [122.126.128.143.147-149].
Ức chế thần kinh cơ
Ức chế thần kinh cơ được sử dụng ở những bệnh nhân mắc ARDS nặng (nghĩa là tỷ lệ PaO2 / FiO2 <150) để cải thiện trao đổi khí và tạo điều kiện cho đồng bộ với máy thở. Ức chế thần kinh cơ được sử dụng đến 48 giờ đầu trong quá trình điều trị ARDS đã được chứng minh là cải thiện oxy hóa và giảm tỷ lệ tử vong ở bệnh nhân mắc ARDS. Gainnier và các cộng sự đã chỉ ra rằng so với trị liệu thông thường, việc kết hợp NMB trong 48 giờ đầu ở bệnh nhân nặng mắc ARDS nặng làm tăng tỷ lệ PaO2 / FiO2 cao hơn đến 120 giờ sau đó [150]. Forel và các đồng nghiệp đã chứng minh giảm phản ứng viêm nhiễm với việc sử dụng sớm NMB [151]. Trong thử nghiệm ACCURASYS, Papazian và các cộng tác đã phát hiện ra rằng việc điều trị NMB trong 48 giờ có liên quan đến việc cải thiện oxy hóa và giảm tỷ lệ tử vong trong 90 ngày so với giả dược ở bệnh nhân mắc ARDS có an thần sâu [152]. Một phân tích gộp gàn đây đã chứng minh rằng truyền cisatracurium trong 48 giờ ở những bệnh nhân mắc ARDS nặng có liên quan đến tỷ lệ tử vong ở bệnh viện thấp hơn và nguy cơ mắc bệnh barotrauma thấp hơn [153]. Tuy nhiên, thử nghiệm Reevaluation of Systemic Early Neuromuscular Blockade (ROSE) được công bố gần đây không tìm thấy sự khác biệt về tỷ lệ tử vong trong 90 ngày ở những bệnh nhân mắc ARDS mức trung bình đến nặng được truyền NMB liên tục trong 48 giờ với an thần sâu (nhóm can thiệp) với phương pháp chăm sóc thông thường với thuốc an thần nhẹ và không có NMB (nhóm đối chứng) thường xuyên [154]. NMB kéo dài ở bệnh nhân mắc ARDS cũng liên quan đến việc mất chức năng nặng, bệnh cơ và hội chứng yếu mắc phải ở những bệnh nhân này [155]. Dựa trên bằng chứng này, NMB không nên được sử dụng thường xuyên ở những bệnh nhân mắc ARDS mức độ trung bình- nặng và khi NMB được sử dụng bởi các bác sĩ lâm sàng, nó nên được sử dụng sớm, nhưng giới hạn không quá 48 giờ điều trị.
Thuốc dãn động mạch phổi
Nitric Oxide dạng hít (iNO) là thuốc giãn động mạch phổi có khả năng cải thiện khả năng kết hợp V/Q và oxy hóa máu ở bệnh nhân mắc ARDS. Một loạt ca bệnh và các thử nghiệm lâm sàng ngẫu nhiên về iNO ở bệnh nhân ARDS đã cho thấy lợi ích của nó trong việc cải thiện tỷ lệ PaO2 / FiO2 so với điều trị thông thường, nhưng sự cải thiện này thường thoáng qua và không tác động đến kết quả lâm sàng sẽ cải thiện (ví dụ, sống sót, thời gian nằm viện, thời gian thở máy) [156- 161].
Hai nghiên cứu đánh giá tác dụng lâu dài của iNO cho thấy kết quả mâu thuẫn. Theo dõi thử nghiệm lâm sàng ngẫu nhiên 385 bệnh nhân mắc ARDS, Angus và các cộng sự ghi nhận iNO không liên quan đến sự cải thiện về khả năng sống còn sau 1 năm, thời gian nằm viện, chất lượng cuộc sống hoặc chức năng tâm thần [162]. Dellinger và các đồng sự phát hiện ra rằng bệnh nhân được điều trị với iNO có một số biện pháp cải thiện chức năng phổi sau 6 tháng [163]. Một tổng quan hệ thống gần đây đã kết luận rằng iNO không làm giảm tỷ lệ tử vong ở người lớn hoặc trẻ em mắc ARDS, bất kể mức độ giảm oxy máu [164]. Mặc dù iNO có thể cải thiện oxy hóa tạm thời, nhưng thiếu hiệu quả duy trì kéo dài và chi phí của nó nên việc sử dụng thường xuyên trong điều trị ARDS còn nhiều hạn chế.
Thuốc đồng vận Prostacyclin dạng hít (ví dụ epoprostenol, iloprost) là thuốc giãn động mạch phổi cải thiện kết hợp V / Q giống như cơ chế của iNO. Ở những bệnh nhân ARDS, các thuốc prostacyclin dạng hít chứng minh là cải thiện tỷ lệ oxy hóa máu và tỷ lệ PaO2 / FiO2 [165-167]. So sánh trực tiếp giữa iNO và Epoprostenol hít ở bệnh nhân mắc ARDS đã cho thấy sự tương đương về tác dụng của chúng đối với độ bão hòa oxy và huyết động học [168]. Nhưng những nghiên cứu này chưa đánh giá tác dụng của chúng đối với kết quả có ý nghĩa như thế nào đối với bệnh nhân mắc ARDS, chẳng hạn như sống còn và thời gian thở máy. Cần nghiên cứu thêm trước khi xác định vai trò của Prostacyclin trong điều trị ARDS.
Sildenafil là thuốc có tác dụng giãn mạch máu phổi dùng trong điều trị tăng huyết áp phổi không thuộc nhóm II. Trong một nghiên cứu đoàn hệ tiến cứu trên bệnh nhân mắc ARDS, sử dụng sildenafil làm giảm áp lực động mạch phổi trung bình, nhưng không cải thiện áp suất riêng phần oxy động mạch phổi [170]. Thuốc cũng làm giảm đáng kể áp lực động mạch trung bình toàn thân. Do thiếu dữ liệu có ý nghĩa về kết cuộc và ảnh hưởng của nó đối với huyết áp, sildenafil không được khuyến cáo để điều trị ARDS thường quy.
Corticosteroid
Corticosteroid đã được nghiên cứu rộng rãi ở bệnh nhân mắc ARDS. Cả liệu pháp steroid toàn thân liều cao và liều thấp cùng với thời gian tối ưu đã được đánh giá. Bệnh nhân được điều trị bằng steroid liều cao cho thấy không có sự cải thiện về thời gian thở máy, mức độ PEEP hoặc FiO2 nhưng lại có tỷ lệ nhiễm trùng cao hơn và tỷ lệ tử vong cao hơn [171-173]. Trong khi đó, điều trị steroid liều vừa phải trong ARDS có liên quan đến việc cải thiện oxy hóa và giảm số ngày không thở máy hơn, nhưng không có tác dụng đối với tỷ lệ tử vong ARDS sớm, nhưng làm tăng tỷ lệ tử vong ở bệnh nhân mắc ARDS lâu hơn 2 tuần [173]. Năm 2008, một phân tích gộp và tổng quan hệ thống đã không chứng minh được lợi ích của steroid toàn thân trong bệnh nhân mắc ARDS [174,175].
Một nghiên cứu tiếp theo về corticosteroid liều thấp (methylprednisolone) đã bắt đầu trong vòng 72 giờ kể từ khi bắt đầu điều trị ARDS và tiếp tục trong 28 ngày (sử dụng kéo dài) cho thấy giảm thời gian thở máy, thời gian nằm ICU cũng như nằm viện và tử vong [176]. Hai phân tích sau đó cũng đã chứng minh rằng steroid toàn thân liều thấp có liên quan đến việc giảm tỷ lệ mắc bệnh và tử vong trong ARDS [177,178]. Nhưng vẫn cần các nghiên cứu đầy đủ để xác định tính an toàn và hiệu quả của steroid toàn thân trong ARDS. Một phân tích gần đây của đoàn hệ LIPS cho thấy việc sử dụng Corticosteroid dạng hít ở bệnh nhân có ít nhất 1 yếu tố nguy cơ ARDS có liên quan đến việc giảm nguy cơ xuất hiện ARDS [179]. Nhưng 69% bệnh nhân trong thử nghiệm này đang sử dụng corticosteroid dạng hít cũng đang sử dụng đồng vận Beta dạng khí dung, so với chỉ 8% trong đoàn hệ đối chứng. Khi điều chỉnh sử dụng thuốc đồng vận beta hít, không còn tác dụng bảo vệ đáng kể với Corticosteroid dạng hít ở những bệnh nhân này.
Các thuốc khác
Vai trò của chất Surfactant để ngăn chặn xẹp các phế nang và đặc tính chống viêm của nó làm cho nó trở thành một liệu pháp tiềm năng cho ARDS. Nhưng dữ liệu về việc sử dụng surfactant ở bệnh nhân ARDS có sự trái ngược. Các nghiên cứu nhỏ cho thấy sự cải thiện khả năng oxy hóa máu mà không có bất kỳ lợi ích nào về mặt cải thiện tử vong, [180-182] và thông qua phân tích tổng hợp cũng xác nhận những kết quả này [183]. Nhưng trong một nghiên cứu lớn hơn trên 418 bệnh nhân trưởng thành mắc ARDS cho thấy bệnh nhân điều trị bằng surfactant của heo đã chứng minh xu hướng tăng tỷ lệ tử vong và các tác dụng phụ, [184] trong khi một nghiên cứu khác của Wilson và các đồng nghiệp sử dụng chất surfactant ở trẻ sơ sinh, trẻ em và thanh thiếu niên mắc ALI cho thấy sự cải thiện về oxy máu và giảm tỷ lệ tử vong [185]. Những sự không nhất quán này có thể là do sự khác biệt về loại và liều lượng chất surfactant được sử dụng, dân số được nghiên cứu và nguyên nhân của ARDS [186-188]. Do đó, cần nhiều nghiên cứu hơn để xác định loại và liều Surfactant, và nhóm bệnh nhân cụ thể mắc ARDS có thể đáp ứng với việc bổ sung chất Surfactant.
Một số thuốc khác đã được nghiên cứu để điều trị ARDS, bao gồm Lisofylline (chất chống oxy hóa),189 Nacetylcystein (chất chống oxy hóa), kháng sinh Macrolid [190-194] (chất chống viêm và kháng khuẩn),195 Ketoconazole (chất chống viêm và kháng khuẩn), thuốc chẹn thụ thể Angiotensin và thuốc ức chế men chuyển (đặc tính chống viêm) [199-202]. Các nghiên cứu lớn, được thiết kế tốt đều thiếu hoặc đã không chứng minh được bất kỳ lợi ích nào về kết quả ở bệnh nhân mắc ARDS.
Lĩnh vực nghiên cứu mới nhất trong điều trị ARDS là liệu pháp tế bào gốc trung mô (MSC) [33]. Dựa trên các nghiên cứu trên động vật và in vitro, MSC đã được chứng minh là có đặc tính chống viêm và cũng để bảo tồn chức năng hàng rào biểu mô và phế nang – mao mạch [204 -207]. Những tác dụng này đã được nghiên cứu và cấy ghép trong mô hình phổi người được tưới máu được phân lập tronh ex vivo [208]. Zheng và các đồng sự đã chọn ngẫu nhiên 12 bệnh nhân trưởng thành mắc ARDS để nhận một liều MSC hoặc giả dược. Nhóm điều trị có nồng độ IL-8 trong máu lưu thông thấp hơn đáng kể và IL-6 (dấu ấn sinh học của ALI) cũng có xu hướng thấp hơn đáng kể so với nhóm đối chứng [209]. Nhưng không có sự khác biệt về số ngày không có máy thở hoặc ngày nằm ICU giữa 2 nhóm. Wilson và các đồng nghiệp đã công bố kết quả của một thử nghiệm lâm sàng giai đoạn 1 với 9 bệnh nhân mắc ARDS đã nhận được cấy tế bào gốc trung mô, chứng minh không có tác dụng phụ nghiêm trọng nào [210]. Hiện họ đang chuyển sang thử nghiệm giai đoạn 2 ở những bệnh nhân mắc ARDS từ trung bình đến nặng. Liệu pháp tế bào gốc vẫn là một lĩnh vực nghiên cứu đầy hứa hẹn trong điều trị bệnh nhân mắc ARDS.
Tóm lại
Hội chứng suy hô hấp cấp tính vẫn là gánh nặng y tế công cộng đáng kể trên toàn thế giới với tỷ lệ mắc và tử vong cao, mặc dù đã có những cải thiện đáng kể trong lĩnh vực hồi sức và trong điều trị đặc hiệu của ARDS. Nghiên cứu trong những thập kỷ gần đây đã giúp chẩn đoán xác định rõ ràng hơn và làm sáng tỏ sinh lý bệnh tiềm ẩn của nó. Do đó, việc xác định bệnh nhân có nguy cơ và tỷ lệ phát hiện ARDS đã được cải thiện. Tuy nhiên, việc ngăn chặn ARDS vẫn là một thách thức. Phát hiện và điều trị sớm nhiễm trùng huyết, truyền dịch IV cẩn trọng và truyền sản phẩm máu, và sử dụng các chiến lược LPV và thông khí nằm sấp sớm cho thấy sự hứa hẹn nhất trong việc ngăn ngừa và làm chậm tiến triển của ARDS. Giảm thiểu thuốc an thần, trừ trường hợp buộc sử dụng NMB, là điều cần thiết để tránh các biến chứng ngắn và dài hạn do quá liều và bất động kéo ở những bệnh nhân này. Sử dụng NMB không được sử dụng thường qui ở tất cả các bệnh nhân. Nhưng các thử nghiệm lớn, được thiết kế tốt hoặc thiếu cho thấy không có lợi ích cho hầu hết các phương pháp điều trị hay thuốc được cho là có tiềm năng. Các nghiên cứu bổ sung chất lượng cao là cần thiết để xác định tốt hơn các chiến lược dinh dưỡng nào là tối ưu ở bệnh nhân mắc ARDS. Liệu pháp tế bào gốc có thể là hướng mới tiếp theo trong cuộc chiến để cải thiện kết quả ở bệnh nhân mắc ARDS.
Authors’ Note Shawn Kaku, MD, Christopher D. Nguyen, MD, and Natalie N. Htet, MD, contributed equally to this work. Declaration of Conflicting Interests The author(s) declared no potential conflicts of interest with respect to the research, authorship, and/or publication of this article. Funding The author(s) received no financial support for the research, authorship, and/or publication of this article. ORCID iD Natalie N. Htet, MD, MS https://orcid.org/0000-0001-7813-8905.





