Bài viết Kích hoạt máy thở trong tương tác bệnh nhân – máy thở được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Triggering of the Ventilator in Patient-Ventilator Interactions
Tóm tắt
Với thiết kế kích hoạt máy thở (ventilator triggering design) hiện tại, khi khởi động máy thở, nỗ lực của bệnh nhân chỉ là một phần nhỏ trong tổng nỗ lực chi tiêu để vượt qua tải hít vào (inspiratory load). Tương tự như vậy, những tiến bộ trong áp lực máy thở hoặc cung cấp lưu lượng và kết thúc lưu lượng hít vào cải thiện nỗ lực của bệnh nhân hoặc công của cơ hô hấp trong quá trình thông khí cơ học. Tuy nhiên, các tinh chỉnh trong thiết kế máy thở không nhất thiết cho phép tương tác bệnh nhân – máy thở (patient-ventilator interactions) tối ưu, vì bác sĩ lâm sàng là chìa khóa trong việc quản lý các yếu tố bệnh nhân và lựa chọn các yếu tố thông khí thích hợp để duy trì sự đồng bộ của máy thở. Trong tương tác bệnh nhân – máy thở, nhu cầu lưu lượng bệnh nhân chưa phù hợp với lưu lượng cung cấp của máy thở dẫn đến sự không đồng bộ lưu lượng, trong khi không khớp giữa thời gian hít vào cơ học (Ti cơ học) và thời gian Ti thần kinh (neural Ti) gây ra không đồng bộ thời gian. Nỗ lực bị lãng phí (wasted efforts) là một ví dụ về không đồng bộ thời gian. Trong giai đoạn kích hoạt, ngưỡng kích hoạt được đặt quá cao hoặc loại phương pháp kích hoạt gây ra nỗ lực bị lãng phí. Nỗ lực bị lãng phí có thể trầm trọng hơn do suy yếu cơ hô hấp hoặc các tình trạng khác làm giảm kiểm soát hô hấp (respiratory drive). Trong giai đoạn sau kích hoạt, các yếu tố máy thở đóng một vai trò quan trọng trong sự tương tác của máy thở bệnh nhân; vai trò này bao gồm mức độ hỗ trợ, cài đặt tốc độ lưu lượng hít vào, Ti, tốc độ điều áp (pressurization rate) và ngưỡng chấm dứt chu kỳ (cycling-off threshold), và ở một mức độ nào đó, PEEP áp dụng. Bài báo này đề xuất một thuật toán mà các bác sĩ lâm sàng có thể sử dụng để điều chỉnh cài đặt máy thở với mục tiêu loại bỏ hoặc giảm nỗ lực lãng phí của bệnh nhân.
Mở đầu
Gần một phần tư thế kỷ trước, việc kích hoạt lưu lượng dựa trên bộ vi xử lý được kết hợp trong các máy thở chuyên sâu (ICU) với mục tiêu giảm nỗ lực kích hoạt bệnh nhân. [1,2] Thiết kế kích hoạt máy thở đã phát triển sao cho tỷ lệ nỗ lực của bệnh nhân cần kích hoạt máy thở chỉ là một phần nhỏ trong tổng nỗ lực để vượt qua tải cơ hô hấp. [3] Gần đây, một phương pháp kích hoạt thông khí khác, được gọi là kích hoạt tín hiệu hình dạng (shape-signal triggering), được giới thiệu để giảm thiểu nỗ lực kích hoạt của bệnh nhân (patient-triggered effort). [3] Tuy đã có nhiều tiến bộ trong thiết kế kích hoạt máy thở, bất kỳ sự không phù hợp nào giữa sự kích hoạt của bệnh nhân với máy thở và các cài đặt máy thở sẽ gây ra sự không đồng bộ của bệnh nhân – máy thở vẫn còn là vấn đề trong quản lý máy thở. [4] Không đồng bộ của bệnh nhân – máy thở (sử dụng giá trị ngưỡng không đồng bộ từ 10% trở lên) là tương đối phổ biến, xảy ra trong khoảng 25% bệnh nhân nhận thông khí cơ học với bộ bệnh nhân kích hoạt cổ điển và có liên quan đến thời gian thở máy kéo dài. [4,5] Lưu ý, một số mức độ không đồng bộ của máy thở bệnh nhân có mặt rất nhiều.
Các yếu tố quyết định quan trọng của sự không đồng bộ của máy thở bệnh nhân bao gồm cả yếu tố bệnh nhân và yếu tố máy thở; tuy nhiên, vai trò của bác sĩ không thể không nhấn mạnh (Hình 1). Các bác sĩ có thể cải thiện hoặc làm trầm trọng thêm các tương tác này. Ví dụ, giảm mức hỗ trợ áp lực khi nó đã được cài đặt quá cao [6] hoặc tăng mức độ an thần lên [7] có thể cải thiện hoặc làm trầm trọng thêm sự không đồng bộ của máy thở bệnh nhân, tương ứng. Vì vậy, các bác sĩ lâm sàng là chìa khóa trong việc tối ưu hóa tương tác bệnh nhân – máy thở, và phải hiểu sinh lý bệnh học hoặc yếu tố quyết định và các loại bệnh nhân không đồng bộ thở máy. Kiến thức cơ bản này là quan trọng để thực hiện các bước trong việc cải thiện sự tương tác của bệnh nhân – máy thở. Sự tương tác giữa bệnh nhân và máy thở mà không cần đầu vào lâm sàng về cơ bản là tự động hóa (ví dụ, SmartCare, Dräger Medical, Lübeck, Đức), một chế độ hỗ trợ áp lực sử dụng trí tuệ nhân tạo để cai máy thở. [8,9]
Bài báo này sẽ xem xét ảnh hưởng của các yếu tố của máy thở lên nỗ lực của bệnh nhân hoặc công của cơ hít vào trong giai đoạn kích hoạt và sau kích hoạt, các yếu tố quyết định tương tác của bệnh nhân – máy thở và tác động của việc kiểm soát các yếu tố máy thở lên sự tương tác của bệnh nhân – máy thở, và các lưu đồ để cải thiện sự tương tác của bệnh nhân – máy thở ở những bệnh nhân được thông khí cơ học thông thường.
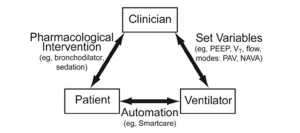
”Tương tác giữa các bác sĩ, bệnh nhân và máy thở. Các bác sĩ lâm sàng là chìa khóa trong sự tương tác. Các bác sĩ có thể cải thiện tương tác bệnh nhân – máy thở, ví dụ, bằng cách dùng thuốc giãn phế quản để giảm PEEP nội sinh, hoặc bằng cách áp dụng các cài đặt thông khí thích hợp (ví dụ, PEEP, VT, lưu lượng) hoặc các chế độ thông khí cụ thể (ví dụ, thông khí hỗ trợ tỷ lệ [PAV] hoặc trợ giúp thông khí được điều chỉnh theo thần kinh [NAVA]). Mặt khác, bác sĩ có thể làm trầm trọng thêm sự tương tác, ví dụ, bằng cách dùng thuốc an thần nặng. Một tương tác hai chiều giữa bệnh nhân và máy thở xảy ra với tự động hóa (ví dụ, với SmartCare, một chế độ hỗ trợ áp lực sử dụng trí thông minh nhân tạo để cai máy thở).”
Ảnh hưởng của yếu tố máy thở đến nỗ lực của bệnh nhân hoặc công thở
Giai đoạn kích hoạt (triggering phase) – tức là, từ khi bắt đầu nỗ lực của bệnh nhân đến khi bắt đầu cung cấp lưu lượng – bao gồm biến kích hoạt của nhịp thở cơ học. Giai đoạn sau kích hoạt (post-triggering phase) – tức là, từ khi bắt đầu cung cấp lưu lượng đến kết thúc lưu lượng hít vào — cấu thành các biến kiểm soát áp lực hoặc cung cấp lưu lượng và biến chu kỳ (cycling-off variable), còn được gọi là biến kích hoạt thở ra (expiratory triggering variable) (Hình 2).
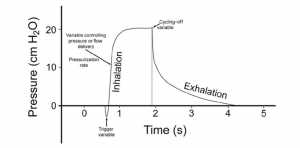
”Các thành phần của nhịp thở cơ học do bệnh nhân kích hoạt. Giai đoạn kích hoạt bao gồm biến kích hoạt. Giai đoạn sau kích hoạt bao gồm biến kiểm soát áp lực hoặc cung cấp lưu lượng và biến chu kỳ. Trong thông khí kiểm soát áp lực, tốc độ điều áp xác định tốc độ cung cấp lưu lượng, ngược lại trong khi thông khí kiểm soát áp lực chu kỳ lưu lượng, biến chu kỳ xác định thời gian hít vào cơ học.”
Giai đoạn kích hoạt
Biến kích hoạt.
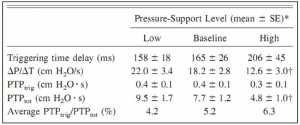
Thiết kế mới đã cải thiện đáng kể hiệu suất của máy thở. Trong thử nghiệm của máy thở ICU được phát hành vào năm 2000 hoặc sau đó, trong đó biến kích hoạt được đặt ở độ nhạy đủ nhưng không gây kích hoạt tự động (auto-triggering), tất cả 3 thiết bị thông khí có thời gian trễ kích hoạt (triggering time delay) hơn 60 ms (Hình 3). [10] Ngược lại, trong số máy thở trước năm 2000, chỉ có 2 máy thở có thời gian trễ kích hoạt nhỏ hơn 60 ms. [11] Thời gian trễ kích hoạt là thời gian từ khi khởi động nỗ lực kích hoạt đến khi bắt đầu cung cấp lưu lượng. Nỗ lực của bệnh nhân để kích hoạt, thể hiện là tích số áp lực – thời gian của các cơ hít vào trong quá trình kích hoạt (PTPtrig, pressure-time product), tương đối hằng định với sự hỗ trợ thông khí tăng lên. [3,12] PTPtrig hằng định được gây ra bởi sự giảm tốc độ phát triển của áp lực (pressure- development rate) khi đối tượng kích hoạt máy thở và sự gia tăng đồng thời thời gian trễ kích hoạt khi hỗ trợ máy thở tăng lên (Bảng 1). Để đáp ứng với 3 mức thông khí hỗ trợ áp lực (PSV) — mức cơ bản là 18 cm H2O, mức thấp và cao (5 cm H2O ít hơn hoặc lớn hơn mức cơ bản tương ứng) — PTPtrig nhỏ: 5.2%, 4.2% và 6,3%, tương ứng, trong tổng số nỗ lực hít vào hoặc tổng PTP của các cơ hít vào (PTPtot) [3] (Bảng 1).

”Thời gian trễ kích hoạt của các máy thở ICU khác nhau, dựa trên thử nghiệm. Các thanh màu trắng thể hiện các máy thở được phát hành trước năm 2000. Chỉ có 2 máy thở (*) có thời gian trễ kích hoạt nhỏ hơn 60 ms. Ngược lại, trong số các máy thở được phát hành sau năm 2000 (các thanh màu xám đen và tối), tất cả trừ 3 máy thở (†) có thời gian trễ kích hoạt nhỏ hơn 60 ms. (Từ dữ liệu trong Tài liệu tham khảo 10 và 11.)”
Giai đoạn sau kích hoạt
Biến áp lực kiểm soát hoặc cung cấp lưu lượng
Đối với hầu hết các máy thở của ICU được phát hành từ năm 2000, hiệu suất của tốc độ điều áp cho lưu lượng trong chế độ PSV là đủ, chỉ với một vài ngoại lệ (ví dụ: Avea, Viasys, Yorba Linda, California và Centiva, GE Healthcare, Madison, Wisconsin). [10] Tuy nhiên, tăng mức hỗ trợ áp lực sẽ cải thiện hiệu suất. [10]
Với PSV, việc cài đặt tốc độ điều áp (pressurization rate) cho phép thay đổi đường dốc áp lực (pressure ramp) ban đầu và tốc độ dòng đỉnh (peak flow rate) ban đầu. Tăng tốc độ điều áp kết hợp với giảm thời gian để đạt được mức hỗ trợ áp lực và với tốc độ lưu lượng cao nhất. Ảnh hưởng của tốc độ điều áp lên công của cơ hít vào (đơn vị là Joules/min) và cảm giác khó thở đã được nghiên cứu ở những bệnh nhân bị tổn thương phổi cấp tính, sử dụng mức hỗ trợ áp lực 5 hoặc 15 cm H2O. [13] Tốc độ điều áp — chuẩn hóa từ mức −9 (thấp nhất) đến +9 (cao nhất) — thay đổi ở 5 mức: mức cơ bản (baseline) hoặc mức mặc định và 2 mức bên dưới và 2 mức phía trên nó. Tỷ lệ công chung (overall work rate) thấp hơn với mức PS cao. Với mức PS thấp hoặc cao, mức cao nhất của tỷ lệ công đạt được ở tốc độ điều áp thấp nhất (Hình 4). [13] So với tốc độ điều áp ban đầu, cài đặt cao nhất không làm giảm thêm tỷ lệ công.
Ảnh hưởng của tốc độ điều áp lên nhận thức của khó thở, được đo bằng cách sử dụng thang đo cảm nhận khó thở của Borg, dao động từ 0 đến 10 cm, với 0 cm là không có nhịp thở ngắn (shortness of breath) và 10 cm là mức độ nhịp thở ngắn cực kỳ nghiêm trọng. Như hình 4, nhận thức của khó thở theo mô hình hình chữ U, với khó thở tồi tệ nhất ở tốc độ điều áp thấp nhất và cao nhất. [13] Ở tốc độ điều áp thấp nhất, cảm giác khó thở được coi là “cơn đói không khí” – “air hunger” với tín hiệu hướng tâm phát sinh từ ngực. Ở tốc độ áp lực cao nhất, cảm giác khó thở được coi là “khó chịu đường hô hấp” – “airway discomfort”, với tín hiệu hướng tâm phát sinh từ đường thở trên. Như vậy, trong tổn thương phổi cấp tính, tăng tốc độ điều áp hoặc tốc độ lưu lượng cung cấp trên mức đáp ứng nhu cầu lưu lượng của bệnh nhân không cung cấp thêm lợi ích trong việc dỡ bỏ công cơ hít vào, và thực tế, gây khó chịu cho việc thở.
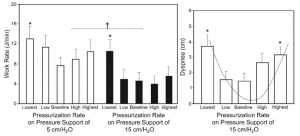
”Ảnh hưởng của tốc độ điều áp (pressurization rate) lên công cơ hít vào (inspiratory muscle work), được biểu thị bằng tốc độ công (work rate), và cảm giác khó thở ở những bệnh nhân bị tổn thương phổi cấp tính. Bảng bên trái cho thấy tốc độ công với hỗ trợ áp lực của 5 cm H2O và 15 cm H2O ở các mức áp lực thấp nhất, thấp, mức cơ bản, cao và cao nhất với thiết bị thông khí Bear 1000 (Allied Healthcare, Riverside, California). Tốc độ điều áp tương ứng với thang điểm tùy ý là −9 (thấp nhất) đến +9 (cao nhất), với 0 là giá trị cơ bản mặc định. Tốc độ điều áp thấp và cao được đặt giữa 0 và −9 hoặc +9, tương ứng. Bảng bên phải thể hiện nhận thức của khó thở theo thang đo cảm nhận khó thở của Borg ở các tốc độ điều áp khác nhau, với 0 cm là không khó thở và 10 cm là khó thở cực kỳ nghiêm trọng. Tốc độ lưu lượng đỉnh (Peak flow rates) tương ứng với tốc độ điều áp thấp nhất, thấp, cơ bản, cao và cao nhất lần lượt là 0,48, 0,67, 0,86, 0,97 và 1,12 L/s. Cảm giác khó thở biểu hiện theo dạng hình chữ U. Thanh là trung bình ± sai số chuẩn, n = 10. * P <0,05 cho tốc độ điều áp thấp nhất so với các mức áp lực khác cho tốc độ công (bảng bên trái); so với tốc độ điều áp thấp và mức cơ bản cho cảm giác khó thở (bảng bên phải). † P <0,05 cho hỗ trợ áp lực 5 cm H2O so với hỗ trợ áp lực 15 cm H2O cho tốc độ công ở tất cả các tốc độ điều áp. (Từ dữ liệu trong Tài liệu tham khảo 13.)”
Biến chu kỳ
Ảnh hưởng của việc thay đổi biến chu kỳ đến công cơ hô hấp được xác định bởi bệnh phổi nền hoặc hằng số thời gian thở ra (expiratory time constant). Ở những bệnh nhân bị tổn thương phổi cấp tính, trong đó hằng số thời gian thở ra ngắn, khi cả hai tốc độ điều áp và ngưỡng chu kỳ thay đổi, với tốc độ điều áp nhất định, chu kỳ máy thở ở tốc độ lưu lượng đỉnh thấp nhất hoặc cao nhất không ảnh hưởng đến tốc độ công (Joules/min, Hình 5A). [15] Tốc độ điều áp là yếu tố quyết định duy nhất của tốc độ công. Việc dỡ bỏ công cơ hít vào đã đạt được với tốc độ điều áp cao, không phụ thuộc vào mức PS (xem Hình 5A). Ngược lại, ở những bệnh nhân COPD, hằng số thời gian thở ra kéo dài, ngưỡng chu kỳ có tác động đáng kể đến tốc độ công. [16] Khi áp dụng PSV 5 và 15 cm H2O, có và không có PEEP, với chu kỳ giảm đi ngưỡng cài đặt ở mức 5% hoặc 40% tốc độ lưu lượng đỉnh, tốc độ công giảm đáng kể ở ngưỡng chu kỳ cao (xem Hình 5 B). Ngưỡng chu kỳ cao dẫn đến kết thúc nhịp thở sớm hơn so với ngưỡng chu kỳ thấp, dẫn đến giảm thời gian Ti và thể tích khí lưu thông (VT), và do đó, giảm PEEP nội sinh (PEEPi) và thời gian trễ kích hoạt. [16] Ở PS của 15 cm H2O, thay đổi ngưỡng chu kỳ không có bất kỳ tác động nào đến tốc độ công. Một mức độ PS cao giảm tải công của cơ hít vào đáng kể, như vậy mà ngưỡng chu kỳ cao không có tác động hơn nữa vào công thở (xem hình 5 B).
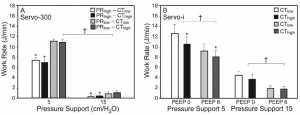
”Tốc độ công (work rate) tùy thuộc tốc độ điều áp (pressurization rate) và ngưỡng chu kỳ (cycling-off threshold), trong quá trình thông khí hỗ trợ áp lực của (A) bệnh nhân bị chấn thương phổi cấp tính (ALI) và (B) bệnh nhân COPD. Ở bệnh nhân ALI, máy Servo-300 (Siemens Elema, Solna, Thụy Điển) đã được sử dụng, và tốc độ công cơ hít vào được xác định chủ yếu bởi tốc độ điều áp và mức hỗ trợ áp lực. Ở những bệnh nhân COPD, máy Servo-I (Maquet, Solna, Thụy Điển) được sử dụng và tốc độ công của cơ hít vào được xác định bởi ngưỡng chu kỳ và mức hỗ trợ áp lực và áp lực dương cuối kỳ thở ra (PEEP). Thanh là mean ± SE. ALI, n = 10. COPD, n = 13. * P <.05 cho tốc độ áp lực cao (PRhigh) so với thấp (PRlow) và ngưỡng chu kỳ cao (CThigh) so với thấp (CTlow). † P <0,05 cho hỗ trợ áp lực 5 cm H2O so với hỗ trợ áp lực 15 cm H2O, và cho PEEP 0 cm H2O so với 6 cm H2O. (Chuyển thể từ Tài liệu tham khảo 15 và 16.)”
Yếu tố máy thở xác định tương tác của bệnh nhân – máy thở
Hình 6 cho thấy một khái niệm đơn giản về tương tác bệnh nhân – máy thở trong quá trình thông khí do bệnh nhân kích hoạt. Các yếu tố bệnh nhân bao gồm cường độ thần kinh của bệnh nhân theo mỗi nhịp thở và tần số thở, trong khi các yếu tố máy thở bao gồm áp lực đẩy (driving pressure) của máy thở và tần số thở. [17] Cả hai tần số thần kinh và máy thở bao gồm các thành phần: thời gian hít vào (Ti thần kinh và Ti cơ học) và thời gian thở ra (Te thần kinh và Te cơ học). Cường độ thần kinh mỗi nhịp thở của bệnh nhân được chuyển thành áp lực được tạo ra bởi các cơ hô hấp (Pmus). Máy thở cung cấp áp lực đẩy (Paw) để cung cấp dòng khí. Cả Pmus và Paw đều tạo áp lực để chống lại sự đàn hồi và sức cản đường thở của hệ hô hấp, bao gồm cả PEEPi (xem Hình 6). Khi áp lực đẩy của máy thở là không đủ, lưu lượng cung cấp không thể đáp ứng nhu cầu lưu lượng của bệnh nhân, và sự mất đồng bộ lưu lượng xảy ra.
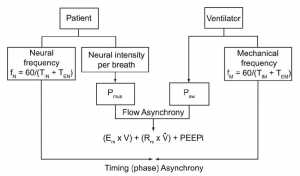
”Yếu tố quyết định tương tác của bệnh nhân – máy thở. Cường độ thần kinh của bệnh nhân mỗi nhịp thở được chuyển thành áp lực được tạo ra bởi các cơ hô hấp (Pmus). Cả áp lực đường thở của máy thở (Paw) và Pmus là áp lực được áp dụng để chống lại sự đàn hồi của hệ thống hô hấp (ERS), sức cản đường thở (RRS) và PEEP nội sinh (PEEPi). Kết quả Paw không đủ đáp ứng nhu cầu lưu lượng của bệnh nhân sẽ gây ra sự bất đồng bộ lưu lượng. Tần số thở thần kinh của bệnh nhân (fN) bao gồm thời gian hít vào (TiM) và thở ra (TeN) thần kinh. Tương tự như vậy, tần số cơ học (fM) bao gồm thời gian hít vào (TiM) hoặc thời gian thở ra (TeM) cơ học. Sự không khớp giữa các thành phần thời gian dẫn đến sự không đồng bộ thời gian hoặc pha. (Chuyển thể từ Tài liệu tham khảo 17.)”
Trong tương tác bệnh nhân – máy thở, cơ chế phản hồi (feedback mechanisms) có thể có ít ảnh hưởng đến bộ điều khiển thần kinh (hô hấp) của bệnh nhân. Ví dụ, trong khi thông khí kiểm soát thể tích được kích hoạt bởi bệnh nhân (ví dụ, thông khí bắt buộc liên tục kiểm soát thể tích VC-CMV) nếu tăng gấp đôi VT máy thở và tăng lưu lượng khí thở để duy trì Ti cơ học hằng định, thì tần số hô hấp giảm ít, khoảng 12%. [18,19] Tương tự như vậy, trong một nghiên cứu có thông khí hỗ trợ tỷ lệ (PAV, proportional assist ventilation) trong đó VT tăng theo đáp ứng với thách thức CO2, Pmus chỉ giảm nhẹ (14%). [20] Những quan sát này chứng minh rằng ức chế thần kinh cơ (neuromechanical inhibition), thông qua tăng VT, tác động trên tần số thở và Pmus thì yếu. Khi VT tăng, tần số hô hấp giảm gây ra rút ngắn TE, căng phế nang động (dynamic hyperinflation), sự chậm trễ trong kích hoạt máy thở, và cuối cùng, kích hoạt không hiệu quả (ineffective triggering) hoặc nỗ lực hít vào bị lãng phí (wasted inspiratory effort), một dạng không đồng bộ thời gian hoặc pha (timing or phase asynchrony).
Không đồng bộ thời gian xảy ra khi các thành phần thời gian của máy thở và bệnh nhân không khớp. Không đồng bộ thời gian có thể tồn tại dưới dạng:
- Kích hoạt không hiệu quả (ineffective triggering) hoặc nỗ lực lãng phí (wasted effort), có thể xảy ra trong khi hít vào hoặc thở ra.
- Tự động kích hoạt (Auto-triggering): xảy ra khi thở máy mà không cần nỗ lực hít vào của bệnh nhân, và kết hợp với kiểm soát trung tâm hô hấp thấp, thời gian thở ra kéo dài khi không có PEEPi, dao động tim mạch, nấc cục, ngưỡng kích hoạt thấp, nước trong bộ dây thở hoặc rò rỉ qua bộ dây thở hoặc nội khí quản không bóng chèn.
- Kích hoạt kép (Double-triggering): xảy ra khi 2 chu kỳ thở liên tục do bệnh nhân kích hoạt xảy ra với một khoảng thời gian ít hơn 1⁄2 của Ti trung bình, và được kết hợp với Ti cơ học ngắn so với Ti thần kinh của bệnh nhân.
- Chu kỳ ngắn (Short cycling), xảy ra khi chu kỳ thở của máy thở ngừng đột ngột và được kết hợp với trung tâm kiểm soát hô hấp cao.
- Chu kỳ dài (Prolonged cycling), xảy ra khi chu kỳ thở của máy thở dài hơn bệnh nhân Ti (Ti cơ học > Ti thần kinh).
Dạng không đồng bộ thời gian hoặc pha phổ biến nhất là kích hoạt không hiệu quả hoặc nỗ lực lãng phí [5]; từ nay trở đi, các thuật ngữ kích hoạt không hiệu quả và nỗ lực không hiệu quả hoặc lãng phí sẽ được sử dụng thay thế cho nhau. Việc đóng góp các yếu tố thông khí có trách nhiệm kích hoạt không hiệu quả có thể được phân tích trong các giai đoạn kích hoạt và sau kích hoạt.
Giai đoạn kích hoạt
Ngưỡng kích hoạt.
Trong giai đoạn kích hoạt, kích hoạt không hiệu quả được kết hợp với một ngưỡng kích hoạt cài đặt hoặc với phương pháp kích hoạt máy thở không nhạy cảm. Ngưỡng kích hoạt cài đặt không nhạy cảm gây ra nỗ lực lãng phí, có thể trầm trọng hơn do suy yếu cơ hô hấp, trung tâm kiểm soát hô hấp thấp, [12] hoặc các tình trạng ức chế trung tâm hô hấp (ví dụ, kiềm chuyển hóa hoặc kiềm hô hấp, an thần nặng), hoặc căng phế nang động. [21]
Phương pháp kích hoạt.
Hiện nay, thông khí do bệnh nhân kích hoạt có thể xảy ra bằng 4 phương pháp: kích hoạt áp lực (pressure triggering), kích hoạt lưu lượng (flow triggering), kích hoạt thể tích (volume triggering) hoặc kích hoạt tín hiệu hình dạng (shape-signal triggering). Thay thế kích hoạt áp lực bằng kích hoạt lưu lượng không làm giảm nỗ lực lãng phí. [22] Gần đây, Prinianakis và cộng sự [3] cho thấy rằng kích hoạt tín hiệu hình dạng tạo ra ít nỗ lực lãng phí hơn kích hoạt lưu lượng. Tuy nhiên, do phương thức tín hiệu hình dạng có kích hoạt nhạy cảm cao, việc kích hoạt tự động diễn ra thường xuyên hơn so với kích hoạt lưu lượng. Kích hoạt tín hiệu hình dạng có sẵn trên máy thở Vision (Philips Respironics, Andover, Massachusetts), [3] kết hợp các phương pháp tín hiệu thể tích và tín hiệu hình dạng, tùy theo điều kiện nào xảy ra trước. Kích hoạt tín hiệu hình dạng được kích hoạt khi máy thở tạo ra một lưu lượng tín hiệu hình dạng mới (bằng cách bù trừ tín hiệu từ lưu lượng thực tế đến 0,25 L/s và trì hoãn 300 ms), sau đó cắt giảm đột ngột lưu lượng khí thực tế khi bệnh nhân tạo ra một nỗ lực hít vào (Hình 7). Tương tự như vậy, lưu lượng tín hiệu hình dạng có thể được sử dụng để ngưng chu kỳ hít vào. Nếu tín hiệu hình dạng không vượt quá lưu lượng thở ra thực tế của bệnh nhân — ví dụ, do chậm nỗ lực hít vào — kích hoạt thể tích được kích hoạt khi 6 mL thể tích được tích lũy trên lưu lượng cơ bản. [3] Vai trò của kích hoạt thể tích trong giảm nỗ lực lãng phí, so với kích hoạt áp lực hoặc lưu lượng, chưa được đánh giá.
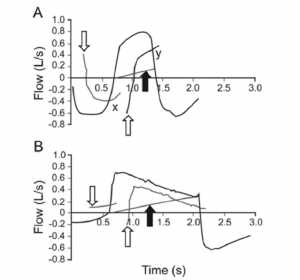
”Phương thức kích hoạt tín hiệu hình dạng: kết hợp kích hoạt tín hiệu hình dạng (A) và kích hoạt thể tích (B). A: Phương pháp kích hoạt tín hiệu hình dạng (Vision, Philips Respironics, Andover, Massachusetts). Máy thở tạo ra một lưu lượng tín hiệu hình dạng mới (bằng cách bù trừ tín hiệu từ lưu lượng thực tế bằng 0,25 L/s và trì hoãn nó trong 300 ms, đường màu xám mỏng) và khi tín hiệu hình dạng (mũi tên mở đầu tiên xuống) và lưu lượng thực tế (đường màu đen dày) cắt ngang tại điểm X (tức là, trước khi bắt đầu hít vào), máy thở được kích hoạt để cung cấp khí. Tương tự như vậy, hít vào ngưng chu kỳ chuyển sang thở ra khi lưu lượng tín hiệu hình dạng (mũi tên hướng lên trên thứ hai) đi qua lưu lượng thực tại điểm Y. Mũi tên khép kín: tín hiệu điện tử, tăng tỷ lệ với lưu lượng khí thực tế trong từng nhịp thở, được kích hoạt khi kích hoạt tín hiệu hình dạng không xảy ra. B: Phương pháp kích hoạt thể tích được kích hoạt khi lưu lượng thực tế không vượt qua lưu lượng tín hiệu hình dạng được tạo ra cho đến sau khi bắt đầu hít vào; do đó, lưu lượng tín hiệu hình dạng bị trì hoãn. Trong quá trình thở ra, ngưỡng chu kỳ được đặt trước (tín hiệu điện tử) cũng được kích hoạt để ngưng chu kỳ hít vào khi tạo ra lưu lượng tín hiệu hình dạng để chấm dứt hít vào bị trễ. (Được phép của Philips Healthcare.)”
Giai đoạn sau kích hoạt
Trong giai đoạn sau kích hoạt, các yếu tố thông khí góp phần vào nỗ lực lãng phí bao gồm các biến ảnh hưởng đến sự phù hợp của Ti cơ học và Ti thần kinh. Chúng bao gồm mức hỗ trợ thông khí, biến số chu kỳ trong PSV, tốc độ dòng khí hít vào, và ở mức độ nhất định, PEEP được áp dụng.
Mức độ hỗ trợ thông khí
Leung và cộng sự [12] đã chứng minh rằng với PSV số lượng các nỗ lực lãng phí tăng lên tương ứng với mức hỗ trợ thông khí. Phân tích VT cho thấy một VT cao hơn trong nhịp thở trước gây ra những nỗ lực lãng phí hơn ở những nhịp thở được kích hoạt. Hơn nữa, nhịp thở trước với những nỗ lực lãng phí có một TE cơ học ngắn và PEEPi cao hơn so với những nhịp thở được kích hoạt. Ở những bệnh nhân phụ thuộc vào máy thở mãn tính, giảm mức hỗ trợ áp lực xuống mức trung bình là 11 cm H2O đồng thời loại bỏ được các nỗ lực lãng phí. [22] Mức PS giảm liên quan đến giảm VT và tăng Pmus, nhưng có thể gây ra kiểu thở nhanh nông và suy hô hấp. [22]
Gần đây, Thille và cộng sự [6] đã chứng minh rằng ở những bệnh nhân khó cai máy thở, trong khi duy trì PEEP hằng định được áp dụng, giảm PS từ mức cơ bản (trung bình 20 cm H2O) sang mức tối ưu (được xác định là mức PS loại bỏ được những nỗ lực lãng phí nhưng không gây ra sự không dung nạp đường hô hấp) đã cải thiện chỉ số không đồng bộ từ trung bình 45% đến 0% (Hình 8A). Chỉ số không đồng bộ là tỷ lệ nỗ lực lãng phí cho tổng số nỗ lực lãng phí cộng với nhịp thở cơ học được kích hoạt thu được trong 2 phút, [22] và được biểu thị bằng tỷ lệ phần trăm. [4] Các nỗ lực lãng phí đã được loại bỏ hoàn toàn ở 2/3 số bệnh nhân. Mức PS tối ưu (trung bình 13 cm H2O) được kết hợp với VT trung bình là 6,0 mL/kg, so với 10,2 mL/kg ở mức PS ban đầu, Ti cơ học là 0,8 giây so với 1,3 giây và PEEPi động 1.1 cm H2O so với 1,8 cm H2O, tương ứng.
Ngưỡng chu kỳ
Để giảm thiểu những nỗ lực lãng phí, Thille et al [6] cũng sử dụng một phương pháp khác: bằng cách điều chỉnh biến số chu kỳ từ mức cơ bản 25% lưu lượng đỉnh đến giá trị cực đại là 45%, Ti cơ học đã giảm cho đến khi đạt được Ti cơ học tối ưu. Nếu những nỗ lực lãng phí tiếp tục tồn tại, thời gian bơm phồng phổi sẽ giảm thêm 0,2 giây mỗi bậc cho đến khi những nỗ lực lãng phí bị loại bỏ hoặc không dung nạp đường hô hấp xảy ra sau đó. Ở Ti cơ học tối ưu, chỉ số không đồng bộ giảm 38% (xem hình 8B). VT giảm xuống mức trung bình 7 mL/ g, Ti cơ học giảm xuống 0,8 giây và PEEPi động giảm xuống còn 1,5 cm H2O. Do đó, giảm mức PS hoặc giảm Ti cơ học bằng cách điều chỉnh ngưỡng chu kỳ là một phương pháp hiệu quả để giảm các nỗ lực lãng phí, và kết hợp với giảm VT, Ti cơ học và PEEPi, và do đó phù hợp hơn giữa Ti bệnh nhân và Ti máy thở.
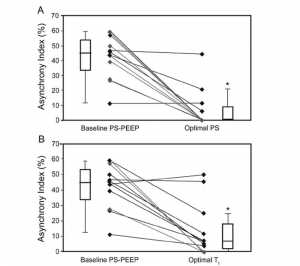
”Chỉ số không đồng bộ (Asynchrony index) tại mức cơ bản và sau khi tối ưu hóa mức hỗ trợ áp lực (PS) (A), và sau tối ưu hóa thời gian hít vào cơ học (Ti cơ học) (B). Chỉ số không đồng bộ là tỷ lệ nỗ lực lãng phí chia cho tổng số nỗ lực lãng phí cộng với nhịp thở cơ học được kích hoạt được thu thập trong 2 phút, được biểu thị bằng phần trăm. Tối ưu hóa mức PS (Avea, Viasys Healthcare, Conshohocken, Pennsylvania) (bảng A) hoặc Ti cơ học (bảng B) cải thiện chỉ số không đồng bộ. Mức PS tối ưu được định nghĩa là PS mà tại đó các nỗ lực lãng phí được loại bỏ khi PS được giảm theo mức 2 cm H2O mỗi bước, hoặc khi bệnh nhân cho thấy khả năng dung nạp kém, tùy theo điều kiện nào xảy ra trước. Áp lực dương cuối thì thở ra (PEEP) 5 cm H2O được duy trì ở mức cơ sở và PS tối ưu. Ở 8 trong số 12 bệnh nhân, tối ưu hóa PS làm giảm chỉ số không đồng bộ thành 0% (A). Trong bảng B, Ti cơ học được điều chỉnh cho đến khi đạt được Ti cơ học tối ưu. Độ Ti cơ học tối ưu thu được bằng cách tăng ngưỡng chu kỳ theo các bước tăng 10% tốc độ lưu lượng đỉnh. Nếu đạt tới ngưỡng chu kỳ tối đa (45% lưu lượng đỉnh) và nỗ lực lãng phí, thời gian bơm phồng giảm 0,2 giây so với thời gian bơm phồng trung bình (bằng cách tăng tốc độ điều áp) cho đến khi các nỗ lực lãng phí bị loại bỏ hoặc bệnh nhân biểu hiện không dung nạp đường hô hấp, như được định nghĩa ở trên. Giá trị là phạm vi trung vị và khoảng cách giữa các vùng. * P <0,01 so với đường chuẩn PS và PEEP. (Tài liệu tham khảo 6.)”
Khi chọn ngưỡng chu kỳ, điều quan trọng là phải tính đến hằng số thời gian của hệ hô hấp — tức là thời gian cần thiết để làm trống khoảng hai phần ba thể tích thở ra — là tích số của sức cản đường thở và độ giãn nở hệ hô hấp. Ở những bệnh nhân COPD, hằng số thời gian kéo dài, và cài đặt ngưỡng chu kỳ cao (như tỷ lệ phần trăm của lưu lượng đỉnh), cải thiện sự phù hợp của Ti cơ học và Ti thần kinh, và giảm các nỗ lực lãng phí (Hình 9A). [23,24] VT, Ti thần kinh, thời gian kích hoạt trễ, và PEEPi giảm đáng kể với ngưỡng chu kỳ đặt cao, so với ngưỡng chu kỳ thấp. [23] Ngược lại, ở những bệnh nhân bị tổn thương phổi cấp tính, hằng số thời gian ngắn; một ngưỡng chu kỳ cao dẫn đến kết thúc nhịp thở sớm và gây tái kích hoạt (kích hoạt kép) hoặc mở sớm van thở ra (xem hình 9B). [24]
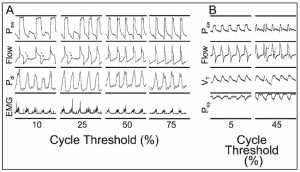
”Ảnh hưởng của việc tăng ngưỡng chu kỳ theo hằng số thời gian kéo dài (A) hoặc ngắn (B) của hệ hô hấp. Tăng ngưỡng chu kỳ (CT) (Galileo Gold, Hamilton Medical, Rhäzuns, Thụy Sĩ) từ 10% đến 50–75% ở bệnh nhân có hằng số thời gian kéo dài (COPD) loại bỏ những nỗ lực lãng phí. Ngược lại, bảng B cho thấy việc tăng ngưỡng chu kỳ (Puritan-Bennett 840, Mallinckrodt, Pleasanton, California) từ 5% đến 45% ở bệnh nhân có hằng số thời gian ngắn (tổn thương phổi cấp tính hoặc hội chứng suy hô hấp cấp tính) – kích hoạt hoặc mở sớm van thở ra. Mũi tên (A) cho thấy những nỗ lực lãng phí. Mũi tên đầu tiên (B) cho thấy kích hoạt kép. Mũi tên thứ hai (B) cho thấy việc mở van thở ra sớm. Paw = áp lực đường thở. PTD = áp lực xuyên cơ hoành. EMG = tín hiệu điện cơ của hoạt động điện cơ hoành. VT = thể tích khí lưu thông. Pes = áp lực thực quản. (Chuyển thể từ Tài liệu tham khảo 23 và 24, với sự cho phép.)”
Tốc độ lưu lượng hít vào
Với thông khí kiểm soát thể tích do bệnh nhân kích hoạt, tốc độ dòng khí thở thấp hơn nhu cầu thông khí của bệnh nhân không chỉ gây ra sự không đồng bộ (xem Hình 6) mà còn không phù hợp giữa Ti cơ học và Ti thần kinh. Ti cơ học kéo dài liên quan đến Ti thần kinh, lấn vào TE của bệnh nhân để nhịp thở tiếp theo xảy ra ở thể tích phổi cao, cao hơn thể tích phổi nghỉ cuối thì thở ra và kết quả là nhịp thở kích hoạt không hiệu quả. Đây là loại nỗ lực lãng phí có thể được sửa chữa bằng cách tăng tốc độ dòng khí thở, hoặc, khi sử dụng hệ thống thông khí kiểm soát áp lực chu kỳ thời gian bằng cách rút ngắn Ti. [25]
PEEP áp dụng
Thille et al [6] không tìm thấy cách áp dụng PEEP hữu ích trong việc giảm các nỗ lực lãng phí, bởi vì PEEPi nhỏ hơn PEEP được áp dụng. Kết quả của nghiên cứu này [6] tương phản với Nava và cộng sự, [21] trong đó các nỗ lực lãng phí giảm đáng kể, từ 19 ± 5.7% không PEEP giảm xuống còn 4 ± 2.5% khi PEEP tương đương 75% PEEPi tĩnh đo được. PEEPi dao động từ 3 đến 20 cm H2O. Áp dụng PEEP để cải thiện những nỗ lực lãng phí sẽ phải được tùy chỉnh theo mức độ PEEPi tĩnh. Tuy nhiên, việc đo lường PEEPi thường không khả thi nếu không dùng thuốc an thần nặng hoặc thuốc liệt cơ.
Các chế độ thông khí để cải thiện tương tác của bệnh nhân – máy thở
Hiện nay, chỉ có 2 chế độ thông khí — thông khí hỗ trợ tỷ lệ (PAV) [26] và hỗ trợ thông khí được điều chỉnh theo thần kinh (NAVA) [27] — có khả năng làm giảm sự không đồng bộ của bệnh nhân – máy thở, và sẽ chỉ được đề cập một đoạn ngắn trong tổng quan này. Biến kích hoạt khác nhau giữa hai chế độ này. PAV sử dụng kích hoạt khí nén, với áp lực hoặc lưu lượng để bắt đầu nhịp thở. Ngược lại, kích hoạt với NAVA sử dụng hoạt động điện cơ hoành, một tín hiệu gần với bộ kiểm soát hô hấp, và do đó, tránh gây ra sự chậm trễ, như xảy ra với căng phồng phế nang động hoặc rò rỉ qua bộ dây máy thở. [28] Tín hiệu hoạt động điện cơ được sử dụng không chỉ để khởi tạo mà còn để hỗ trợ và giảm bớt hít vào. Kích hoạt của máy thở xảy ra khi tín hiệu điện cơ hoành được phát hiện trên ngưỡng kích hoạt cài đặt thủ công. Đặt ngưỡng kích hoạt phía trên mức độ hoạt động điện cơ bản tránh được tự động kích hoạt. [27,29]
Hiệu quả của PAV và NAVA trong việc cải thiện đồng bộ bệnh nhân – máy thở được so sánh với PSV. [26,27] Ở bệnh nhân đang dùng PAV hoặc PSV trong 48 giờ, nỗ lực lãng phí với chỉ số không đồng bộ lớn hơn 10%, được quan sát thấy ở 1,3% (10/744 phép đo) của bệnh nhân đang dùng PAV, so với 9,6% (67/696 phép đo) của bệnh nhân đang dùng PSV.
Trong một thử nghiệm ngắn hạn với 14 bệnh nhân có 2 mức NAVA và PSV, trong đó áp lực đường hô hấp với NAVA phù hợp với PSV (trung bình là 10,6 cm H2O và 17,4 cm H2O cho mức hỗ trợ thấp và cao), những nỗ lực lãng phí đã được quan sát thấy ở 6 trong số 14 bệnh nhân. Ở những bệnh nhân có những nỗ lực lãng phí, các nỗ lực lãng phí ± SD trung bình với PSV thấp và cao lần lượt là 5 ± 4% và 31 ± 26%, trong khi đồng bộ bệnh nhân – máy thở hoàn toàn đã đạt được với NAVA.
Đề xuất thuật toán để cải thiện đồng bộ bệnh nhân – máy thở
Hình 10 cho thấy một thuật toán được đề xuất có thể được áp dụng tại giường để cải thiện hoặc loại bỏ các nỗ lực lãng phí, dựa trên các nghiên cứu được thảo luận ở trên. Thông thường, mức PEEP thấp (5 cm H2O) được áp dụng khi bắt đầu thở máy. Trong trường hợp này, PEEP có thể được duy trì trong khi thực hiện các bước được trình bày trong thuật toán. Khi người ta có thể đo PEEPi tĩnh – nên nhớ trong nhịp thở do bệnh nhân kích hoạt, điều này có thể không khả thi – đối với PEEPi lớn hơn 5 cm H2O, áp dụng PEEP 75-80% PEEPi tĩnh. [21] Đối với PEEPi nhỏ hơn 5 cm H2O hoặc không thể đo được, duy trì PEEP 5 cm H2O. Nếu những nỗ lực lãng phí với chỉ số không đồng bộ lớn hơn 10% tồn tại, ta có thể tăng PEEP áp dụng lên 1 cm H2O với tối đa 8 cm H2O. Sau thao tác này, nếu những nỗ lực lãng phí vẫn tồn tại, mức hỗ trợ, dù ở dạng hỗ trợ áp lực hay thể tích, được điều chỉnh để đạt được VT từ 6–8 mL/kg. [6] Sau đó, người ta có thể tăng tốc độ dòng khí hít vào được cài đặt với thông khí bắt buộc kiểm soát thể tích [25] hoặc tăng tốc độ điều áp khi đang thông khí bằng kiểm soát áp suất. [15] Ngoài ra, với thông khí kiểm soát áp lực chu kỳ thời gian, Ti có thể giảm trong khi vẫn duy trì sự thoải mái của bệnh nhân. Với PSV, người ta có thể điều chỉnh ngưỡng chu kỳ, có tính đến hằng số thời gian của hệ hô hấp. [23,24] Ở những bệnh nhân có hằng số thời gian kéo dài (tức là COPD), ngưỡng điều chỉnh lưu lượng được điều chỉnh lên theo phần trăm tốc độ lưu lượng đỉnh, [23] trong khi ở những bệnh nhân có hằng số thời gian ngắn (tức là tổn thương phổi cấp tính hoặc hội chứng suy hô hấp cấp) ngưỡng chu kỳ được điều chỉnh xuống. [24] Với ngưỡng chu kỳ đặt cao, Ti cơ học và VT có thể giảm bớt. Nó có thể là cần thiết để tinh chỉnh ngưỡng chu kỳ hoặc điều chỉnh Ti cơ học và VT để tránh suy hô hấp. Bệnh nhân cần được đánh giá lại và bước có thể bị dừng ở bất kỳ cấp nào trong thuật toán được đề xuất khi chỉ số không đồng bộ đã được giảm thành công xuống dưới 10%. Tuy nhiên, thuật toán này vẫn được kiểm tra một cách tương lai về hiệu quả của nó.
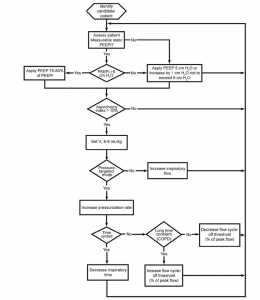
”Một thuật toán cho thấy các bước để thực hiện tại giường để loại bỏ hoặc cải thiện những nỗ lực lãng phí. Bệnh nhân có nỗ lực lãng phí sẽ được xác định và đánh giá. Nếu PEEP nội sinh tĩnh (PEEPi) có thể đo lường và lớn hơn 5 cm H2O, áp dụng PEEP 75-80% PEEPi tĩnh – trong nhịp thở do bệnh nhân kích hoạt, điều này có thể không khả thi. Nếu PEEPi là không đo được hoặc ≤ 5 cm H2O, áp dụng PEEP 5 cm H2O. Nếu những nỗ lực lãng phí vẫn tồn tại, tăng PEEP áp dụng lên 1 cm H2O với tối đa là 8 cm H2O. Khi các nỗ lực lãng phí tồn tại và chỉ số không đồng bộ là ≥ 10%, hãy điều chỉnh mức hỗ trợ để đạt được VT từ 6-8 ml/kg. Tiếp theo, bệnh nhân có ở chế độ nhắm mục tiêu áp lực không? Nếu không (trên thông khí bắt buộc liên tục kiểm soát thể tích, tăng tốc độ lưu lượng được cài đặt). Nếu bệnh nhân đang thông khí mục tiêu áp lực, hãy tăng tốc độ điều áp. Nếu thông khí mục tiêu áp lực chu kỳ thời gian, giảm thời gian hít vào được cài đặt. Nếu thông khí mục tiêu áp lực chu kỳ lưu lượng (thông khí hỗ trợ áp lực) và nỗ lực lãng phí vẫn tồn tại, hãy điều chỉnh ngưỡng lưu lượng thở ra (phần trăm lưu lượng đỉnh hít vào), có tính đến hằng số thời gian của hệ hô hấp. Ở những bệnh nhân có hằng số thời gian kéo dài (ví dụ, COPD), làm tăng ngưỡng lưu lượng kết thúc hít vào; và ở những bệnh nhân có hằng số thời gian ngắn (ví dụ, tổn thương phổi cấp tính hoặc hội chứng suy hô hấp cấp tính), giảm ngưỡng kết thúc hít vào. Có thể cần phải tinh chỉnh ngưỡng chu kỳ, thời gian hít vào cơ học (Ti) và thể tích khí lưu thông (VT), khi điều chỉnh ngưỡng chu kỳ có thể dẫn đến giảm đồng thời VT và/hoặc Ti cơ học. Bệnh nhân cần được đánh giá lại và các bước có thể bị dừng ở bất kỳ mức nào khi chỉ số không đồng bộ đã được giảm thành công xuống dưới 10%.”





