Bài viết Các tác dụng của Khoảng chết thiết bị trên PaCO2 ở bệnh nhân nhận thông khí bảo vệ phổi được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: The Effects of Apparatus Dead Sapace on PaCO2 in Patients Receiving Lung-Protective Ventilation
BỐI CẢNH: Thông khí bảo vệ phổi bằng cách sử dụng thể tích khí lưu thông (VT) 4 – 6mL/kg (trọng lượng cơ thể dự đoán) làm giảm tử vong (so với V T truyền thống) ở những bệnh nhân bị hội chứng suy hô hấp cấp tính (ARDS) và tổn thương phổi cấp tính (ALI). Việc sử dụng VT tiêu chuẩn thấp có thể dẫn đến nhiễm toan hô hấp và đã nêu lên những lo ngại mới về cấu hình thích hợp của bộ dây máy thở, đặc biệt là đối với khoảng chết (VD) của thiết bị, Chúng tôi giả thuyết rằng ở bệnh nhân nhận thông khí bảo vệ phổi, việc loại bỏ tất cả các thiết bị khoảng chết từ bộ dây sẽ làm giảm PaCO2 và cho phép giảm thông khí phút.
PHƯƠNG PHÁP: Tất cả các bệnh nhân được nghiên cứu đều đáp ứng các tiêu chí về ARDS/ALI, đã nhận được chiến lược thông khí bảo vệ phổi, > 18 tuổi và ổn định về huyết động. Chúng tôi đã thử nghiệm liên tiếp 3 cấu hình bộ dây máy thở khác nhau, theo trình tự ngẫu nhiên, trong 15 phút mỗi: (1) thiết bị trao đổi nhiệt và ẩm (HME) loại hygroscopic tiêu chuẩn với ống nối mềm (flexible tubing) 15 cm, (2) ống nối mềm 15 cm, (3) không có HME hoặc ống nối mềm. VT, tần số thở, áp lực dương cuối thì thở ra và nồng độ oxy khí hít vào được duy trì liên tục trong suốt nghiên cứu, và lượng CO 2 khí thở ra được đo liên tục. Khoảng chết sinh lý (V D/VT) được tính toán bằng cách sử dụng sửa đổi Enghoff của phương trình Bohr.
KẾT QUẢ: Bảy bệnh nhân được nghiên cứu. Loại bỏ HME khỏi bộ dây giảm đáng kể VD/VT (khoảng 6%) và PaCO2 (khoảng 5 mm Hg). Loại bỏ cả HME và ống nối mềm khỏi bộ dây giảm VD/VT thêm 5% và PaCO2 thêm 6 mm Hg. Với cả hai thay đổi cấu hình bộ dây, thông khí phút giảm từ mức trung bình 11,51 L/phút xuống 10,35 L/phút và pH tăng từ 7,30 lên 7,38. Sản xuất carbon dioxide không thay đổi đáng kể.
KẾT LUẬN: Ở những bệnh nhân nhận được thông khí V T thấp, loại bỏ tất cả các V D thiết bị từ bộ dây máy thở làm giảm PaCO2 và làm tăng pH, ở thông khí phút thấp hơn. Thông tin này sẽ giúp hướng dẫn cấu hình bộ dây máy thở cho bệnh nhân được thông khí bảo vệ phổi.
1. Giới thiệu
Được mô tả lần đầu tiên vào năm 1967, hội chứng suy hô hấp cấp tính (ARDS) là một căn bệnh khó quản lý và có liên quan đến tỷ lệ tử vong cao. [1] Hơn nữa, nghiên cứu lâm sàng và lâm sàng cho thấy việc sử dụng thể tích khí lưu thông thông thường (VT) (10-12 ml/kg) có thể dẫn đến tổn thương phổi do máy thở gây ra, dẫn đến kết quả kém. [2] Một nghiên cứu ngẫu nhiên lớn gần đây cho thấy việc sử dụng VT thấp hơn (6 ml/kg trọng lượng cơ thể dự đoán so với VT thông thường là 12 ml/kg) làm giảm tỷ lệ tử vong từ 39,8% xuống còn 31%. [3] Phương pháp VT thấp hơn này được gọi là thông khí bảo vệ phổi.
Với sự gia tăng sử dụng thông khí bảo vệ phổi ở bệnh nhân người lớn bị ARDS/ ALI, mối quan tâm mới đã phát sinh trên cấu hình hiệu quả nhất cho bộ dây máy thở. Quan tâm đặc biệt là câu hỏi liệu khoảng chết (VD) của thiết bị trong bộ dây máy thở tiêu chuẩn (như ống mềm và bộ trao đổi nhiệt và độ ẩm [HME]) có ảnh hưởng đáng kể đến tổng số VD và yêu cầu thông khí ở bệnh nhân ARDS/ALI.
Khi VT nằm trong khoảng 8-12 ml/kg, VD thiết bị có thể không phải là yếu tố quan trọng trong việc xác định yêu cầu thông khí toàn phần, nhưng điều này có thể là vấn đề trong quá trình thông khí V T thấp. Ngoài ra, bệnh nhân bị ARDS có suy giảm trao đổi khí nghiêm trọng, bao gồm cả loại bỏ CO2 bị tổn hại, điều này làm cho việc chuẩn hóa PCO2 trở nên khó khăn hoặc không thể trong nhiều trường hợp.
[4] Chúng tôi đưa ra giả thuyết rằng việc loại bỏ tất cả các VD thiết bị từ bộ dây máy thở trong quá trình thông khí bảo vệ phổi sẽ làm giảm PaCO2, tăng pH và cho phép giảm thông khí phút (VE).
2. Phương pháp
Nghiên cứu được tiến hành từ ngày 28 tháng 9 năm 2004 đến ngày 18 tháng 1 năm 2005, tại Harborview Medical Center, một bệnh viện chấn thương cấp, bỏng và bệnh cấp tính ở Seattle, Washington.
Những bệnh nhân đáp ứng được các tiêu chuẩn nghiên cứu đã được xác định của các tác giả nghiên cứu. Bệnh nhân được lựa chọn đáp ứng tiêu chí hội nghị-đồng thuận Mỹ-châu Âu [5] cho ARDS/ALI, > 18 tuổi, đã được áp dụng giao thức thông khí bảo vệ phổi (VT 4-6 ml/kg trọng lượng cơ thể dự đoán), và đã được huyết động ổn định.
Các bệnh nhân được quản lý theo một giao thức tại chổ dựa trên giao thức ARDS Network để thông khí bảo vệ phổi. [3] Hội đồng xét duyệt nghiên cứu của Đại học Washington đã phê duyệt nghiên cứu và nhận được sự đồng ý có được từ luật pháp của từng bệnh nhân bên cạnh thân nhân trước khi thu thập dữ liệu.
Bệnh nhân được nghiên cứu không liên tục.Tại thời điểm nghiên cứu, bệnh nhân không trải qua bất kỳ quy trình nào và được yên tĩnh và đồng bộ hợp lý với máy thở (Servo 300, Siemens/Maquet, Bridgewater, New Jersey). Theo dõi hô hấp (CO2SMO Plus 8100, Novametrix, Wallingford, Connecticut) được kết nối tại đoạn Y bộ dây để đo lượng khí CO 2 thở ra (volumetric capnography). [6] Thiết bị được làm ấm và hiệu chuẩn. Ba cấu hình bộ dây máy thở đã được kiểm tra:
1. Hygroscopic HME tiêu chuẩn (Humid-Vent Filter Light, Hudson RCI, Triangle Park, North Carolina) với một ống nối mềm 15 cm (Tube-Flex, Puritan Bennett, Pleasanton, California)
2. Ống nối mềm 15 cm
3. Không có HME hoặc ống nối mềm
Thứ tự cấu hình được phân ngẫu nhiên cho từng bệnh nhân và cấu hình cơ sở là thiết lập mà bệnh nhân đã có tại thời điểm nghiên cứu.
Sau 15 phút trên một trong các cấu hình bộ dây, một mẫu máu động mạch được lấy từ một catheter động mạch đặt sẳn, và, từ khí thở ra của bệnh nhân, chúng tôi đo carbon dioxide end-tidal, carbon dioxide khí thở ra hỗn hợp và sản xuất carbon dioxide. Huyết áp, nhịp tim và nhịp thở được theo dõi. V T, tần số thở cài đặt, PEEP và FiO 2 được duy trì liên tục trong suốt thời gian nghiên cứu. Sau đó bộ dây được thay đổi thành cấu hình tiếp theo và sau 15 phút trôi qua, việc thu thập dữ liệu được lặp lại với cấu hình bộ dây đó.
Dữ liệu được phân tích bằng phần mềm bảng tính (Excel, Microsoft, Redmond, Washington) và phần mềm vẽ đồ thị (Prism, Phần mềm GraphPad, San Diego, California). VD sinh lý (VD/VT) được tính toán bằng cách sử dụng Enghoff sửa đổi của phương trình Bohr: [7]
VD/VT = (PaCO2 – PeCO2)/PaCO2
trong đó PeCO2 là áp suất của carbon dioxide khí thở ra hỗn hợp.
Dữ liệu được trình bày là trung bình độ lệch chuẩn. Sự khác biệt giữa các điều kiện được so sánh bằng cách sử dụng paired t test với hiệu chỉnh Bonferoni cho nhiều so sánh.
Các giá trị được coi là đáng kể khi p< 0,05. Hồi quy tuyến tính được thực hiện để xác định hệ số tương quan giữa phần của VD thiết bị (được chuẩn hóa thành [HME+ Ống nối mềm] cực đại) và giá trị trung bình của các biến đo được, với độ tuyến tính được xác nhận với runs test.
3. Kết quả
Bảy bệnh nhân được ghi danh vào nghiên cứu (Bảng 1). Thể tích của HME là 60 mL, và thể tích của ống nối mềm là 55 mL, cho VD của tổng thiết bị tối đa 115 mL. Loại bỏ HME khỏi bộ dây giảm VD/VT khoảng 6% (p = 0,01) và giảm PaCO2 xuống 5 mm Hg (p = 0,007) (Hình 1). Loại bỏ cả HME và ống nối mềm giảm VD/VT thêm 5% (p = 0,007) và giảm PaCO2 thêm 6 mm Hg (p = 0,03).
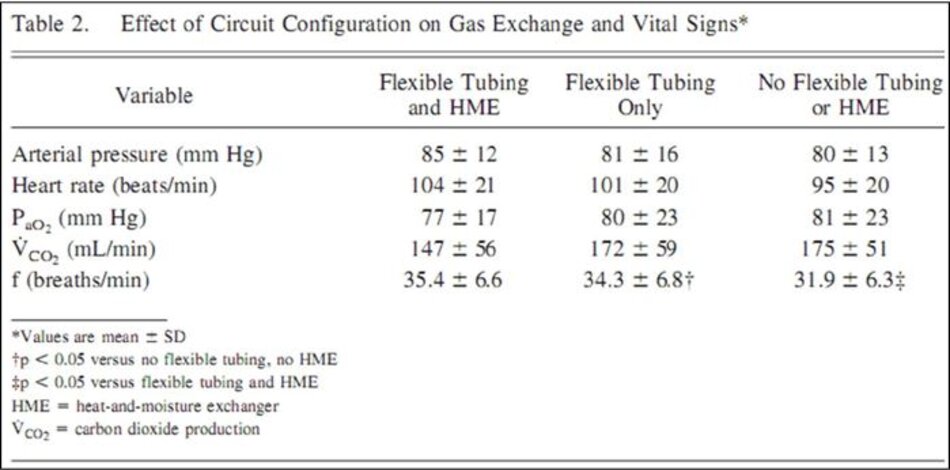
Loại bỏ cả HME và ống nối mềm được phép giảm VE, từ trung bình 11,51 L/phút xuống 10,35 L/phút (p = 0,02) và pH tăng từ 7,30 đến 7,38 (p = 0,005) (Hình 2). Mối quan hệ giữa VD thiết bị và VD/VT và VE là tuyến tính, với hệ số tương quan là 0,99 và 0,94, tương ứng. Với việc loại bỏ V D thiết bị có xu hướng tăng sản xuất carbon dioxide, nhưng không có thay đổi đáng kể nào về áp suất động mạch trung bình, PaO2 hoặc nhịp tim (Bảng 2).

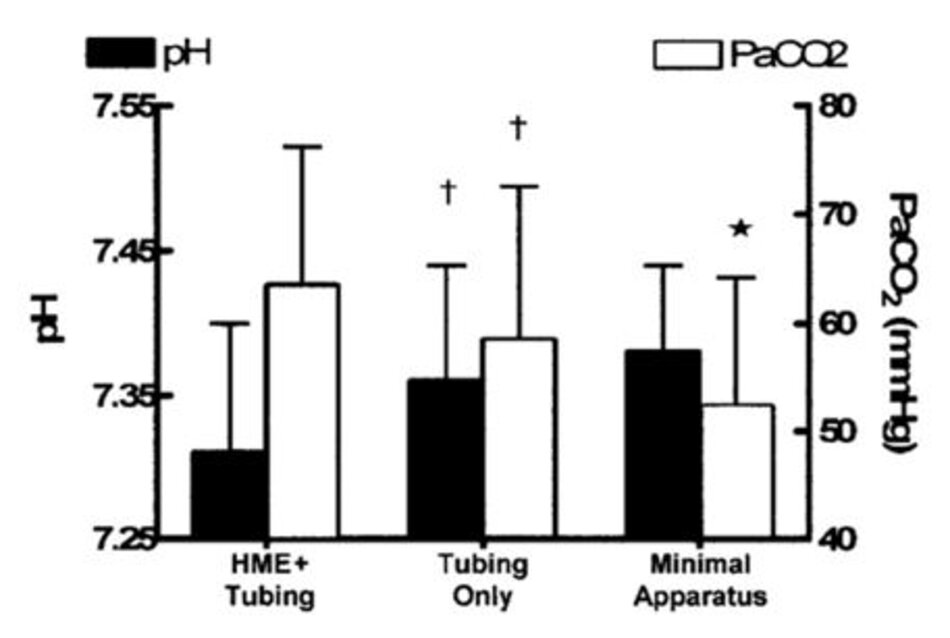
![Hình 2. Thay đổi khoảng chết sinh lý (là khoảng chết chia cho thể tích khí lưu thông [VD/VT]) và thể tích phút (VE) với 3 cấu hình bộ dây máy thở: (1) với ống nối mềm và thiết bị trao đổi nhiệt và độ ẩm (HME), (2) chỉ có ống nối mềm, và (3) không có HME hoặc ống nối mềm. * Không có HME hoặc ống nối mềm, cả V D/VT và VE đều tốt hơn đáng kể (p < 0,05) so với chỉ ống nối mềm. † Với chỉ ống nối mềm, VD/VT tốt hơn đáng kể (p < 0,05) so với HME + ống nối mềm.](https://www.healcentral.org/wp-content/uploads/2021/02/b8_anh_3.jpg)
4. Thảo luận
ARDS/ALI được đặc trưng bởi sự không tương hợp về thông khí-tưới máu nghiêm trọng, do tăng tính thấm mạch máu và tổn thương phế nang, dẫn đến ngập lụt phế nang, làm gián đoạn đáp ứng co mạch thiếu oxy và shunting do các đơn vị phế nang bị xẹp. [4] Kết quả là sự xấu đi nghiêm trọng của trao đổi khí phổi, dẫn đến thiếu oxy máu và tăng CO2 máu, thường xuyên kháng với liệu pháp oxy thông thường và hỗ trợ thông khí cơ học. Bất thường trao đổi khí có thể được chứng minh thêm bằng sự gia tăng sự thay đổi của V D tính theo sửa đổi Enghoff của phương trình Bohr (VD sinh lý, VD/VT). [8,9] VD/VT tăng được cho là chủ yếu đến các vùng shunt và thông khí phế nang thấp hơn là các vùng thông khí phế nang cao, nhưng kết quả thực vẫn là giảm thải CO2, với tăng CO2 máu và nhiễm toan hô hấp, mặc dù tăng cường hỗ trợ thông khí. [10]
Ở những bệnh nhân nhận VT thấp như là một phần của chiến lược bảo vệ phổi, VD thiết bị của bộ dây máy thở cũng có thể góp phần vào việc giảm thanh thải CO2 và tăng CO2 máu. Ví dụ, HME được sử dụng trong nghiên cứu của chúng tôi đã có một VD 60 ml và ống nối mềm có một VD là 55 mL. VD thiết bị cơ sở là 15 mL cho theo dõi CO2 và ống hút đàm kín, trong khi VT dao động từ 270 mL đến 465 mL, với giá trị trung bình là 337 80 mL. VD thiết bị với cả HME và ống nối mềm chiếm 40,3 8,5% V T, và VD thiết bị của ống nối mềm chỉ chiếm 21,7 4,6% của V T. VD thiết bị cơ sở chiếm 4,6% 1,0%. Thật vậy, chúng tôi thấy rằng việc loại bỏ ống HME và ống nối mềm khỏi bộ dây máy thở giảm VD/VT, làm giảm đáng kể PaCO 2 ở V E toàn phần thấp hơn. Loại bỏ VD thiết bị cũng liên quan đến sự gia tăng về mặt lâm sàng của pH máu động mạch.
Bệnh nhân nhận thông khí bảo vệ phổi với việc loại bỏ CO2 bị suy giảm có thể được hưởng lợi từ việc loại bỏ tất cả các VD thiết bị có thể, vì 3 lý do. Đầu tiên, loại bỏ VD thiết bị làm giảm chứng tăng CO2 máu và tăng pH máu động mạch. Thứ hai, giảm nhu cầu thông khí, với sự giảm liên quan đến V E, có thể làm giảm bẫy khí và PEEP nội sinh, với giảm áp lực trong lồng ngực, huyết động được cải thiện và áp lực nội sọ thấp hơn. Giảm áp lực nội sọ được quan sát ảnh hưởng của HME trên cơ học thở máy ở bệnh nhân thở tự phát. [11–13] Thứ ba, việc loại bỏ CO2 được cải thiện có thể cho phép giảm VT hoặc tần số thở, có thể làm giảm bẫy khí và tổn thương phổi do máy thở gây ra.

Hiện đang có các cuộc tranh luận liên quan đến tác hại hoặc lợi ích của tăng CO2 máu trên trao đổi khí và chấn thương phổi. Các mô hình thực nghiệm cho thấy rằng hít phải CO2 để gây ra nhiễm toan tăng CO 2 máu cải thiện PaO2 ở động vật có phổi bình thường. [14,15] Hít CO2 làm giảm tổn thương phổi ở các mô hình thực nghiệm. [16,17] Ngược lại, gây tăng CO2 máu bằng cách giảm VE làm tăng tổn thương phổi ở thỏ được điều trị bằng lipopolysaccharide.
[18] Ngoài ra, lợi ích của tăng CO2 máu điều trị hoặc thụ động về trao đổi khí hoặc chấn thương phổi chưa được tái tạo ở những bệnh nhân bị tổn thương phổi nặng. Một phân tích hồi cứu gần đây của dữ liệu từ thử nghiệm thông khí bảo vệ phổi của ARDS Net ban đầu cho thấy tăng CO 2 máu không ảnh hưởng đến tử vong ở bệnh nhân thở với V T thấp (6 ml/kg) nhưng có liên quan đến giảm tử vong ở nhóm V T cao.
[19] Tương tự như các nhà nghiên cứu khác, chúng tôi thấy không có hiệu ứng PaO2 từ thao tác của VD thiết bị và các thay đổi liên quan trong PaCO2. [20,21] Vì vậy, sẽ rất sớm để đề nghị nhiễm toan tăng CO2 máu như là một chiến lược bảo vệ hoặc điều trị ở những bệnh nhân ARDS và ALI, đặc biệt khi bị giảm bởi VE.
Hai nghiên cứu khác đã kiểm tra ảnh hưởng của V D thiết bị vềthông khí trong ARDS. Prin và cộng sự đã nghiên cứu 11 bệnh nhân ARDS. [20] Trong nghiên cứu đó,
HME, có VD là 100 mL, được loại bỏ khi PaCO2 vượt quá 55 mm Hg. Nghiên cứu đó đã tìm thấy sự gia tăng pH, từ 7,20 0,08 lên 7,26 0,06 (p < 0,005) và PaCO 2 giảm từ 67
9 mmHg xuống 56 6 mmHg (p < 0,003). [20] Trong một nghiên cứu khác, Prat và cộng sự [21] đã nghiên cứu ảnh hưởng của các V D thiết bị kích thước khác nhau, dao động từ 120 mL đến 0 mL.
Họ tìm thấy một sự gia tăng pH, từ 7,18 0,08 lên 7,28 0,08 (p < 0,05), và giảm PaCO2, từ 80,3 20 mm Hg xuống 63,6 13 mm Hg (p < 0,05). Nghiên cứu của chúng tôi khác với 2 nghiên cứu sau đây theo một vài cách.
Đầu tiên, chúng tôi không sửa đổi khả năng kiểm soát thông khí của bệnh nhân. Prin etal[20] dùng cisatracurium trong quá trình nghiên cứu, và Prat et al [21] duy trì mức độ an thần của bệnh nhân để đạt được số điểm Ramsey là 6, dẫn đến một V E cố định trong cả hai nghiên cứu. Trong nghiên cứu của chúng tôi bệnh nhân đã có thể điều chỉnh V E với những thay đổi trong VD thiết bị, và loại bỏ VD giảm đáng kể VE, có thể làm giảm bẫy khí và cho phép giảm cường độ thông khí. Chúng tôi đã tìm thấy các cải thiện về pH và PaCO2 so với các nghiên cứu trước đây, mặc dù thực tế là chúng tôi đã giảm V E. Thứ hai, VT trong nghiên cứu của chúng tôi (5,3 1 ml/kg) thấp hơn so với các nghiên cứu của Prinetal (7,6 0,6 ml/kg) và Prat et al (6,9 1,8 ml/kg).
Việc loại bỏ thường xuyên VD thiết bị từ bộ dây máy thở trong quá trình thông khí bảo vệ phổi có một số nhược điểm về mặt lý thuyết. Sự vắng mặt của ống nối mềm có thể làm tăng sức căng trên bộ dây máy thở và có khả năng làm tăng nguy cơ tuột ống vô ý. Loại bỏ HME khỏi bộ dây đòi hỏi phải sử dụng thiết bị làm ẩm có độ ẩm cao hơn. Tuy nhiên, đối với những bệnh nhân có các bất thường trao đổi khí nghiêm trọng và tăng CO2 máu liên quan và nhiễm toan hô hấp, loại bỏ VD thiết bị cung cấp một lợi ích lâm sàng quan trọng và cần được xem xét thường xuyên.
5. Kết luận
Ở bệnh nhân ARDS hoặc ALI nhận được thông khí bảo vệ phổi, loại bỏ tất cả các VD thiết bị có thể làm giảm PaCO2 và tăng pH, ở mức VE thấp hơn. Chúng tôi đề nghị một bộ dây với bộ VD tối thiểu có thể cho người lớn, và hướng dẫn thực hành kích hoạt loại bỏ VD khỏi bộ dây.
6. References
1. Ware LB, Matthay MA. The acute respiratory distress syndrome. N Engl J Med 2000;342(18):1334–1349.
2. Frank JA, Matthay MA. Science review: mechanisms of ventilator-induced injury. Crit Care 2003;7(3):233–241.
3. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med 2000;342(18):1301–1308.
4. Gunther A, Walmrath D, Grimminger F, Seeger W. Pathophysiology of acute lung injury. Semin Respir Crit Care Med 2001;22(3):247–258.
5. Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L, et al. Report of the American-European consensus conference on ARDS: definitions, mechanisms, relevant outcomes and clinical trial coordination. The Consensus Committee. Intensive Care Med 1994; 20(3):225–232.
6. Kallet RH, Daniel BM, Garcia O, Matthay MA. Accuracy of physiologic dead space measurements in patients with acute respiratory distress syndrome using volumetric capnography: comparison with the metabolic monitor method. Respir Care 2005;50(4):462–467.
7. Enghoff H. Volumen inefficax: bemerkungen zur frage des schadlichen raumes. Upsala Lakareforen Forh 1938;44:191–218. article in German
8. Kallet RH, Alonso JA, Pittet JF, Matthay MA. Prognostic value of the pulmonary dead-space fraction during the first 6 days of acute respiratory distress syndrome. Respir Care 2004;49(9):1008–1014.
9. Nuckton TJ, Alonso JA, Kallet RH, Daniel BM, Pittet JF, Eisner MD, Matthay MA. Pulmonary dead-space fraction as a risk factor for death in the acute respiratory distress syndrome. N Engl J Med 2002;346(17):1281–1286.
10. Robertson HT, Swenson ER. What do dead-space measurements tell us about the lung with acute respiratory distress syndrome? (edito- rial) Respir Care 2004;49(9):1006–1007.
11. Iotti GA, Olivei MC, Palo A, Galbusera C, Veronesi R, Comelli A, et al. Unfavorable mechanical effects of heat and moisture exchangers in ventilated patients. Intensive Care Med 1997;23(4):399–405.
12. Le Bourdelles G, Mier L, Fiquet B, Djedaini K, Saumon G, Coste F, Dreyfuss D. Comparison of the effects of heat and moisture exchangers and heated humidifiers on ventilation and gas exchange during weaning trials frommechanical ventilation. Chest 1996;110(5):1294– 1298.
13. Pelosi P, Solca M, Ravagnan I, Tubiolo D, Ferrario L, Gattinoni L. Effects of heat and moisture exchangers on minute ventilation, ventilatory drive, and work of breathing during pressure-support venti- lation in acute respiratory failure. Crit Care Med 1996;24(7):1184–1188.
14. Swenson ER, Robertson HT, Hlastala MP. Effects of inspired carbon dioxide on ventilation- perfusion matching in normoxia, hypoxia, and hyperoxia. Am J Respir Crit Care Med 1994;149(6):1563–1569.
15. Swenson ER, Robertson HT, Hlastala MP. Effects of carbonic an- hydrase inhibition on ventilation-perfusion matching in the dog lung. J Clin Invest 1993;92(2):702–709.
16. Shibata K, Cregg N, Engelberts D, Takeuchi A, Fedorko L, Kavanagh BP. Hypercapnic acidosis may attenuate acute lung injury by inhibition of endogenous xanthine oxidase. Am J Respir Crit Care Med 1998;158(5 Pt 1):1578–1584.
17. Laffey JG, Honan D, Hopkins N, Hyvelin JM, Boylan JF, McLoughlin P. Hypercapnic acidosis attenuates endotoxin-induced acute lung injury. Am J Respir Crit Care Med 2004;169(1):46–56.
18. Lang JD, Figueroa M, Sanders KD, Aslan M, Liu Y, Chumley P, Freeman BA. Hypercapnia via reduced rate and tidal volume contributes to lipopolysaccharide-induced lung injury. Am J Respir Crit Care Med 2005;171(2):147–157.
19. Kregenow DA, Rubenfeld GD, Hudson LD, Swenson ER. Hypercapnic acidosis and mortality in acute lung injury. Crit Care Med 2006;34(1):1–7.
20. Prin S, Chergui K, Augarde R, Page B, Jardin F, Vieillard-Baron A. Ability and safety of a heated humidifier to control hypercapnic acidosis in severe ARDS. Intensive Care Med 2002;28(12):1756–1760.
21. Prat G, Renault A, Tonnelier JM, Goetghebeur D, Oger E, Boles JM, L’Her E. Influence of the humidification device during acute respiratory distress syndrome. Intensive Care Med 2003;29(12):2211–2215.
Tham khảo thêm một số bài viết cùng chủ đề: