Bài viết Cai máy thở ở trẻ em được dịch bởi Bác sĩ Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Weaning Infants from Mechanical Ventilation
ĐIỂM CHÍNH:
- Việc cai máy thở và rút ống khỏi thở máy (MV) vẫn là một khoa học chưa chính xác. Các bằng chứng sẵn có cho thấy rõ ràng rằng việc rút nội khí quản sớm là mong muốn, nhưng khả năng của chúng tôi để dự đoán thời thực hiện một cách an toàn ở trẻ sơ sinh cực kỳ non tháng vẫn còn hạn chế.
- Thông khí mục tiêu thể tích có thể làm tăng tốc độ cai máy thở từ MV. Có bằng chứng mạnh cho việc sử dụng caffein và CPAP sau khi rút ống.
- Rút nội khí quản thất bại thường gặp và có thể mang lại hậu quả đáng kể ngắn và dài hạn; đạt được tỷ lệ rút nội khí quản thất bại thấp mà không cần tăng thời gian thông khí vẫn là một mục tiêu khó nắm bắt.
- Các biện pháp hỗ trợ khác cho cai máy thở và rút nội khí quản ít được thiết lập tốt hơn. Các công cụ cải tiến để tiên đoán rút nội khí quản thành công trong dân số dễ bị tổn thương này hiện đang được khám phá với hy vọng giảm thất bại rút nội khí quản và rủi ro liên quan đến việc tái đặt lại nội khí quản và thở máy kéo dài.
GIỚI THIỆU
Thông khí cơ học (MV) được coi là một trong những tiến bộ lớn của y học sơ sinh và là phương pháp điều trị được sử dụng một cách thường xuyên, đặc biệt là ở quần thể cực kỳ non. Trong một nghiên cứu đoàn hệ lớn cho trẻ sơ sinh cực kỳ nhẹ cân (ELBW), 89% trẻ được điều trị với thở máy trong ngày đầu tiên của cuộc đời, và gần 95% số người sống sót được thông khí trong suốt thời gian nằm viện. [1]
Gần đây, một thử nghiệm ngẫu nhiên có đối chứng đa trung tâm (RCT) so sánh việc sử dụng hỗ trợ hô hấp không xâm lấn và xâm lấn ngay sau khi sinh và cho thấy có đến 83% trẻ ELBW ban đầu được chỉ định hỗ trợ không xâm lấn phải cần đặt nội khí quản và thở máy trong thời gian nằm viện. [2] Trong một nhóm lớn các trẻ sinh ra ở tuổi thai dưới 28 tuần (GA), 74% đã đặt nội khí quản và tiếp nhận liệu pháp surfactant trong thời gian nằm viện. [3]
Thử nghiệm Continuous Positive Airway Pressure or Intubation (COIN) nhận vào những trẻ sơ sinh từ 25 đến 28 tuần GA với các nỗ lực hô hấp đầy đủ sau khi sinh. Tuy nhiên, 46% trẻ sơ sinh ban đầu được chỉ định hỗ trợ không xâm lấn cần đặt nội khí quản và thở máy. [4]
Vì vậy, thở máy là một liệu pháp thông thường trong các đơn vị chăm sóc tích cực sơ sinh (NICUs), ngay cả trong thời đại hỗ trợ hô hấp không xâm lấn. Mặc dù thở máy cung cấp hỗ trợ cần thiết trong khi hệ hô hấp hồi phục sau khi bị suy giảm cấp tính và là điều cần thiết cho sự sống còn, liệu pháp này có liên quan đến nguy cơ và biến chứng, bao gồm tử vong và suy giảm phát triển thần kinh. [1,5]
Vì vậy, khi chăm sóc cho trẻ sơ sinh vô cùng non tháng, bác sĩ lâm sàng nên tập trung vào cai máy thở và loại bỏ thở máy càng khẩn trương càng tốt. Thành công của việc rút nội khí quản chỉ là 60% đến 73% ở trẻ sơ sinh ELBW [6,7]. Tỷ lệ thành công cao hơn (80% -86%) đã được báo cáo trong một số chuỗi gồm tất cả các trẻ sơ sinh [8,9].
Trẻ sơ sinh thất bại và cần phải đặt nội khí quản lại, với những nguy cơ liên quan, có thể bị suy giảm tình trạng hô hấp do xẹp phổi. Các đợt giảm thiếu oxy máu hoặc tăng CO2 máu trước khi tái đặt nội khí quản có thể khiến trẻ gặp nguy cơ thêm. Tái đặt nội khí quản tự nó gây khó chịu và có thể gây chấn thương và đi kèm với nhịp tim chậm, tăng CO2 máu, và những thay đổi của lưu lượng máu và sự oxy hóa máu não. [10,11]
Mặt khác, nhiều trẻ sơ sinh tự rút nội khí quản và vẫn còn chậm rút nội khí quản. [12] Những trẻ sơ sinh này tiếp xúc với thở máy lâu hơn cần thiết và gây ra tổn thương phổi do thở máy. Thở máy kéo dài không phải là điều tốt; ở những con khỉ sanh non, thở máy 5 ngày sau gây ra một mức độ tổn thương não lớn hơn khi so với chỉ 1 ngày [13].
Sử dụng dữ liệu của “National Institute of Child Health & Human Development Neonatal Research Network”, Walsh và các cộng sự [1] cho thấy mỗi tuần thở máy thêm có liên quan đến sự gia tăng đáng kể khả năng phát triển thần kinh suy giảm. Thêm vào đó, ống nội khí quản (ETT) hoạt động như một vật lạ, nhanh chóng trở thành con đường lây nhiễm các mầm bệnh, làm tăng nguy cơ viêm phổi liên quan đến thở máy và nhiễm trùng huyết muộn. [14] Rõ ràng, việc rút nội khí quản sớm và thở máy kéo dài không cần thiết là không điều mong muốn.
Có một sự thiếu sót đáng chú ý của dữ liệu tốt để hướng dẫn bác sĩ lâm sàng về những cách tối ưu để cai hỗ trợ hô hấp cũng như đánh giá sự sẵn sàng cho việc rút nội khí quản của trẻ sơ sinh. Trong bài này, các tài liệu sẵn có được tóm tắt và các khuyến cáo dựa trên bằng chứng hợp lý cho việc cai máy thở nhanh và rút nội khí quản được thiết lập.
GIẢM HỖ TRỢ HÔ HẤP
Việc cai máy thở thường đạt được bằng việc giảm dần sự hỗ trợ thở máy cho đến khi các cài đặt được đánh giá là đủ thấp để loại bỏ sự hỗ trợ hô hấp. Tranh cãi đáng kể vẫn tồn tại liên quan đến những cách tốt nhất để hoàn thành mục tiêu này, nhưng có thể xây dựng một số nguyên tắc dựa trên bằng chứng chung.
Thông khí giới hạn áp lực
Một tổng quan hệ thống Cochrane [15] so sánh thông khí bắt buộc ngắt quãng (IMV) với thông khí đồng bộ (sync) đã kết luận rằng sự thông khí đồng bộ làm giảm thời gian thở máy. Phương pháp đồng bộ hóa nào là thích hợp nhất vẫn là vấn đề tranh luận, và không có sự đồng thuận rõ ràng về kết quả thành công của hỗ trợ/kiểm soát (AC) và thở máy đồng bộ (SIMV). Dữ liệu sẵn có không rõ ràng tính ưu việt của chế độ thở nào đối với ảnh hưởng của chúng đối với thương tích phổi, nhưng có bằng chứng tốt, cũng như lý do sinh lý học mạnh để sử dụng các phương thức hỗ trợ mọi nhịp thở tự phát ở trẻ sơ sinh ELBW. Các nghiên cứu ngắn hạn cho thấy thể tích khí lưu thông biến đổi nhỏ hơn và ít biến đổi hơn, ít thở nhanh hơn, sự biến động huyết áp nhỏ hơn và cai máy thở nhanh hơn từ thở máy với AC, so với SIMV. [16,17]
Có những lý do sinh lý quan trọng tại sao SIMV không cung cấp sự hỗ trợ tối ưu ở trẻ sơ sinh non tháng. Ví dụ, với SIMV, các nhịp tự thở cao hơn tần số IMV đã được cài đặt thì không được hỗ trợ, kết quả là thể tích khí lưu thông không đồng đều và gây tăng công thở. Tình trạng này đặc biệt đúng trong thời kỳ cai máy, khi số lượng nhịp thở không được hỗ trợ tăng lên. Vấn đề này quan trọng nhất ở trẻ sơ sinh cực nhỏ có ETT tương đối hẹp, bởi vì sức cản với lưu lượng khí di chuyển sẽ tỉ lệ nghịch với lũy thừa bậc 4 của bán kính đường thở.
(Định luật Poiseuille: R = f x η/r^4 , với R = sức cản đường thở, L = chiều dài của ống, η = độ nhớt và r = bán kính).
Tác động đối với trẻ sơ sinh ELBW có thể là đáng kể; 1 nghiên cứu cho thấy sự gia tăng gấp 4 lần trong công việc hít thở trong suốt quá trình SIMV, so với AC. [17] Kháng lực đường thở cao của ETT hẹp, sức cơ có giới hạn và bất lợi cơ học do thành ngực đàn hồi quá mức của trẻ sơ sinh thường dẫn đến VT nhỏ, không hiệu quả. Các thể tích khí lưu thông nhỏ này gần với thể tích khoảng chết và góp phần làm thông khí phế nang không hiệu quả.
Thông khí phế nang = thông khí phút – thông khí khoảng chết
Do đó, để đạt được thông khí đầy đủ, cần phải có một VT lớn tương đối với tần số thở giới hạn được cung cấp bởi máy thở.
Mặc dù những cân nhắc này, nhiều bác sĩ lâm sàng vẫn thích cai máy thở từ SIMV, chủ yếu dựa vào truyền thống và niềm tin rằng ít nhịp thở cơ học hơn sẽ ít gây chấn thương phổi hơn. Tuy nhiên, hiện tại cho thấy rằng VT quá mức trực tiếp gây ra thương tích phổi, bất kể áp lực cần thiết để tạo ra VT đó. Do đó, mặc dù tần số nhịp thở cơ học của AC lớn hơn, nhưng các nhịp thở này sẽ ít gây tổn thương hơn, bởi vì VT nhỏ hơn khoảng 33%. [16] Tần số 60 lần/phút so với 20-40 lần/phút dẫn đến ít rò rỉ khí ở IMV không đồng bộ, [15] cho thấy sự thuận lợi của AC so với SIMV với VT nhỏ hơn và tần số thở máy cao hơn.
Một quan niệm sai lầm khác là hỗ trợ tất cả các nhịp thở sẽ không cung cấp cho trẻ sơ sinh cơ hội huấn luyện cơ hô hấp. Sự lo lắng này không giải thích được sự tương tác giữa bệnh nhân và máy thở trong quá trình thông khí đồng bộ. Với sự thông khí đồng bộ, VT là kết quả của nỗ lực thở của bệnh nhân (áp suất âm trong thì hít vào) và áp suất dương được tạo ra bởi máy thở. Nỗ lực kết hợp này (áp lực kéo vào của trẻ và đầy vào của máy thở) dẫn đến áp lực xuyên phổi, cùng với độ giãn nở của hệ thống hô hấp, xác định VT.
Trong quá trình cai máy, khi áp lực hít vào của máy thở đã giảm, trẻ sơ sinh dần dần tăng công thở và trong quá trình này huấn luyện các cơ hô hấp. Áp lực của máy thở được giảm cho đến khi nó chỉ vượt qua được sức cản của ETT và bộ dây máy thở, tại thời điểm đó trẻ sơ sinh đã sẵn sàng cho việc rút nội khí quản. Những bất lợi chính của SIMV có thể được giảm nhẹ bằng cách sử dụng áp lực hỗ trợ (PS) cho nhịp thở tự phát. Sự kết hợp này hiện có trên tất cả các máy thở hiện đại được sử dụng trong các NICU Bắc Mỹ và nên được sử dụng cho trẻ nhỏ nếu chọn chế độ SIMV. Sự kết hợp của SIMV + PS đã cho thấy sự cai máy thở nhanh hơn từ hỗ trợ hô hấp cơ học so với SIMV đơn thuần ở trẻ sơ sinh ELBW [18] và làm giảm đáng kể công thở. [19]
Tuy nhiên, chế độ kết hợp tạo ra sự phức tạp thêm và có rất nhiều thông tin liên quan đến cách sử dụng tối ưu kết hợp này. Việc sử dụng AC hoặc PS đơn lẻ ít phức tạp hơn và có thể có hiệu quả tương đương, nếu áp dụng đủ PEEP trong suốt quá trình PS để duy trì thể tích phổi. Tuy nhiên, khi sử dụng đúng cách, một trong hai cách tiếp cận này sẽ tránh được sự cạn kiệt của nguồn dự trữ hô hấp hạn chế của trẻ sơ sinh ELBW và tránh việc cài đặt thở máy lại cho một thử nghiệm rút ống thất bại. Cài đặt thông khí khi chuẩn bị rút nội khí quản có thể được xem xét ở trẻ sơ sinh từ 2 tuần tuổi trở xuống được cung cấp trong Hộp 1. Trẻ lớn hơn có thể được rút nội khí quản ở áp lực cao hơn.

Thông khí mục tiêu thể tích
Khi thể tích khí lưu thông, chứ không phải áp lực, là biến số điều khiển chính, giảm áp lực hít vào xảy ra tự động để đáp ứng sự cải thiện của phổi hoặc tăng nỗ lực hô hấp của trẻ sơ sinh. Việc giảm hỗ trợ này xảy ra liên tục và trong thời gian thực, thay vì phải liên tục để đáp ứng các phép đo khí máu, và do đó sẽ đẩy nhanh quá trình cai máy. Một phân tích gộp Cochrane gần đây, [20], bao gồm bảo đảm thể tích và thông khí kiểm soát thể tích, kết luận rằng thông khí mục tiêu thể tích giảm đáng kể thời gian của thở máy khi so sánh với thông khí giới hạn áp lực.
Các giá trị VT cụ thể tối ưu cho việc cai máy thở không được thiết lập tốt. Tuy nhiên, việc giảm hỗ trợ xảy ra một cách tự động và các yêu cầu về thông khí phút/thể tích khí lưu thông của trẻ sơ sinh không giảm đáng kể do cải thiện bệnh phổi; thay vào đó, áp lực cần thiết để đạt được VT sẽ giảm. Do đó, giảm VT mục tiêu dưới giá trị sinh lý bình thường là phản tác dụng và làm tăng công thở không thích hợp. [19]
Trẻ sơ sinh vẫn duy trì máy thở kéo dài đã làm tăng nhu cầu VT theo thời gian, [21] do kết quả của (1) tăng khoảng chết giải phẫu, do khí quản to (tracheomegaly) mắc phải [22] và (2) tăng khoảng chết sinh lý với sự phát triển bệnh phổi mãn tính và thông khí phổi không đồng nhất. Nói chung, VT không nên giảm dưới 4 ml/kg và ở một số trẻ không dưới 5 mL/kg trong suốt quá trình cai máy thở để tránh thở quá mức (xem Hộp 1). Mục tiêu là để có một trẻ sơ sinh có kiểm soát hô hấp đầy đủ, có độ pH dưới 7,35, bất kể PaCO2. Cần tránh các loại thuốc có thể gây ức chế hô hấp.
Thông khí tần số cao
Mặc dù nhiều bác sĩ lâm sàng cảm thấy thoải mái hơn khi thay đổi từ thông khí tần số cao sang các phương thức thông thường để cai máy, nhưng việc rút nội khí quản trực tiếp từ cả thở HFJV và HFOV đều có thể và thậm chí đạt mong muốn. Một nghiên cứu về HFOV so sánh 2 chiến lược của HFOV với thông khí thông thường. Các nhà điều tra phát hiện ra rằng chỉ có những trẻ sơ sinh ở lại HFOV cho đến khi rút nội khí quản có tỉ lệ thấp hơn về chứng loạn sản phế quản phổi (BPD); trẻ sơ sinh đã được đổi sang SIMV sau 72 giờ dường như không được hưởng lợi như nhau. [23] Tương tự, thử nghiệm Neonatal Ventilation Study Group, đòi hỏi trẻ ở lại HFOV trong 2 tuần đầu hoặc cho đến khi rút nội khí quản, báo cáo nguy cơ BPD thấp hơn và thời gian thở ngắn hơn, so với thông khí thông thường, [24] trong khi nghiên cứu của Johnson, cho phép chéo sớm để thông khí thông thường không cho thấy những lợi ích tương tự. [25]
Cách HFOV giảm hỗ trợ là phần lớn dựa trên kinh nghiệm, chứ không phải là thử nghiệm, dữ liệu. Nhìn chung, biên độ áp lực và áp lực đường thở trung bình (Paw) được giảm dần theo mức dung nạp. Thậm chí còn ít thông tin về những gì cấu thành các cài đặt có thể cài đặt trong HFOV và HFJV hơn là có sẵn cho thông khí thông thường. Nhìn chung, việc rút ống được xem xét khi Paw trung bình khoảng 8 cm H2O (cao hơn một chút so với thông khí thông thường) với FiO2 dưới 0,30. Tình huống này là do với thời gian hít vào thông thường 33% của chu kỳ thở (tỷ lệ I:E là 1: 2), Paw trung bình trong đường dây máy thở vượt quá áp lực khí quản từ 1 đến 2 cm H2O (xem Hộp 1). Tần số không được giảm như một phương tiện để giảm hỗ trợ. Với nhiều thiết bị HFOV, VT tăng khi tần số giảm, do đó làm giảm tần số của máy thở có ảnh hưởng ngược lại so với thông khí thông thường.
Một số bác sĩ lâm sàng làm tăng tần số HFOV như một phương tiện để giảm biên độ áp suất và VT, tuy nhiên cách tiếp cận này tỏ ra không hiệu quả. Cai máy với HFJV gần với cai máy trong thông khí thông thường, từng bước giảm dần áp lực trung bình và áp lực đỉnh. Tần số thở có thể giảm nhẹ vì VT trong HFJV không bị ảnh hưởng bởi sự thay đổi tần số, nhưng phương tiện chủ yếu để giảm hỗ trợ là giảm biên độ áp lực.
Với cả hai phương thức này, nếu hỗ trợ giảm xuống đủ để làm nhiễm toan hô hấp nhẹ, thì hít thở tự nhiên trở nên rõ ràng. Khi biên độ áp lực tiếp tục giảm, trẻ sơ sinh cần tiếp tục gắng sức nhiều hơn về hô hấp, với VT tự thở thấy rõ ràng, và khi các thiết lập được đánh giá là đủ thấp, nên rút ống nội khí quản. Không có nghiên cứu về sự sẵn sàng rút ống cho trẻ sơ sinh khi thở máy có tần số cao. Các thiết lập thông khí để xem xét sự sẵn sàng rút ống nội khí quản ở trẻ 2 tuần tuổi hoặc nhỏ hơn được thông khí tần số cao cũng được cung cấp trong Hộp 1.
CÁC ĐIỀU TRỊ HỖ TRỢ CHO CAI MÁY THỞ
Tăng CO2 máu cho phép (Permissive Hypercapnia)
Chấp nhận mức PaCO2 cao hơn trong quá trình cai máy thở để tạo điều kiện cho việc rút nội khí quản sớm hơn đã được điều tra rộng rãi và được xem xét chi tiết ở những nơi khác trong số này. Các thử nghiệm lâm sàng ngẫu nhiên ở trẻ non tháng cho thấy rằng tăng CO2 máu cho phép nhẹ là an toàn, nhưng lợi ích lâm sàng còn khiêm tốn. [26] Các giới hạn an toàn của tăng CO2 máu trong cả hai ngày đầu khi nguy cơ xuất huyết trong não thất cao nhất và sau đó là trong giai đoạn mãn tính của BPD chưa được xác định rõ ràng.
Giảm oxygen máu cho phép (Permissive Hypoxemia)
Bổ sung oxy cho trẻ non tháng là một can thiệp chung. Các kiến thức hiện tại về độ bão hòa oxy (SpO2) ở các thời kỳ bào thai và sau sinh khác nhau vẫn còn hạn chế và các phạm vi mục tiêu được sử dụng rất rộng, khoảng 70% cho giới hạn thấp và 98% cho giới hạn cao. Các thông tin sẵn có hiện nay cho thấy các mục tiêu SpO2 thấp hơn làm giảm tỷ lệ và mức độ nặng của bệnh võng mạc do non tháng (ROP) và dẫn đến các yêu cầu ngắn hơn về hỗ trợ hô hấp và oxy bổ sung. Tuy nhiên, có thể có một sự gia tăng đáng kể về tỉ lệ tử vong với các mục tiêu SpO2 thấp hơn. Trong thử nghiệm BOOST (Benefit Of Oxygen Saturation Targeting), trẻ sơ sinh được phân bổ cho nhóm độ bão hòa cao (95%-98%) nhận oxy trong thời gian dài hơn (median, 40 days vs 18 days; P<.001) tỷ lệ phụ thuộc vào oxy ở tuổi 36 tuần tuổi thai và tỷ lệ điều trị oxy ở nhà cao hơn, không cải thiện về tăng trưởng và phát triển thần kinh, so với trẻ sơ sinh được phân bố dưới mức SpO2 thấp hơn từ 91% đến 94%. [27]
Các thử nghiệm STOP-ROP (Supplemental Therapeutic Oxygen for Prethreshold Retinopathy of Prematurity) đã bị gián đoạn sớm và báo cáo một xu hướng có lợi trên ROP của một mục tiêu SpO2 (96% -99%) cao hơn (odds ratio 0.72: 95% CI 0.52,1.01). [28] Tuy nhiên, trẻ sơ sinh trong nhóm mục tiêu có độ ôxy cao hơn đã kéo dài thời gian thở oxy và sự phụ thuộc máy thở và kéo dài thời gian nằm viện. Thử nghiệm này chỉ bao gồm các trẻ non tháng có prethreshold ROP. Nghiên cứu thử nghiệm Neonatal Research Network SUPPORT (Surfactant, Positive Pressure, and Pulse Oximetry Randomized Trial) báo cáo rằng một khoảng SpO2 thấp hơn (85% -89%) dẫn đến giảm đáng kể bệnh võng mạc nặng ở những người sống sót, nhưng làm tăng tỷ lệ tử vong chung, gây lo ngại nghiêm trọng về sự an toàn của phạm vi mục tiêu thấp này, mặc dù SpO2 trung bình ở nhóm mục tiêu thấp gần với phạm vi đích cao hơn (xem bài báo ở nơi khác trong số này để biết thêm thông tin về kiểm soát ôxy). Tương tự, thử nghiệm Benefits Of Oxygen Saturation Targeting (BOOST II) ở Úc và New Zealand đã ngừng nhận ca nghiên cứu sau khi phân tích an toàn cho thấy tỉ lệ sống sót cao hơn ở tuổi điều chỉnh GA 36 tuần ở trẻ sơ sinh được phân ngẫu nhiên đến các mục tiêu SpO2 từ 91% đến 95% thay vì 85 % đến 89% trong khi tiếp nhận oxy bổ sung. [29]
Các RCT lớn khác đang đánh giá hiệu quả của các mục tiêu SpO2 (91% -95%) so với thấp hơn (85% -90%) từ khi sinh ở trẻ sinh cực non tháng. The Neonatal Oxygenation Prospective Meta-analysis (NeOProM) đã được hình thành và sẽ tiến hành phân tích meta theo từng thời điểm, sử dụng dữ liệu cá nhân bệnh nhân, khi tất cả các thử nghiệm đều hoàn thành. [30] Kích cỡ của bộ dữ liệu kết hợp sẽ cho phép đáng tin cậy xác định hiệu quả của các can thiệp. Kết quả chính được đánh giá là kết cục của tử vong hoặc khuyết tật nặng ở tuổi thai sau 18-24 tháng. [30] Trong khi đó, những bằng chứng sẵn có chỉ ra để tránh các phạm vi SpO2 rất thấp (83% -87%) và SpO2 rất cao (95% -98%); giữ SpO2 giữa 88% và 93% có thể là cách tiếp cận tốt nhất cho đến khi có nhiều dữ liệu hơn.
Caffeine
Việc sử dụng caffeine ở trẻ non tháng đã được điều tra trong một số nghiên cứu nhỏ và một RCT lớn cho chứng ngưng thở ở trẻ non tháng (thử nghiệm CAP). [31] Trong thử nghiệm đa quốc gia này, trẻ sơ sinh có trọng lượng từ 500 đến 1250g ngẫu nhiên cho caffeine được điều trị bằng caffeine theo ý của bác sĩ chịu trách nhiệm trong 10 ngày đầu tiên của cuộc đời. Có hơn một nửa số bệnh nhân trong nhóm caffeine được điều trị bằng thở máy, 33% để tạo điều kiện cho việc rút NKQ và 20% để ngăn ngừa ngưng thở sau rút NKQ. Một phân tích thứ cấp của dữ liệu thử nghiệm cho thấy trẻ sơ sinh trong nhóm cho caffeine được thông khí trong thời gian ngắn hơn, nhận được CPAP và bổ sung oxy ít hơn, và ít bị BPD. [31]
Trong một phân tích tiếp theo, người ta đã quan sát thấy rằng việc sử dụng caffein trước đây có liên quan đến cai máy thở nhanh hơn. [32] Mặc dù việc sử dụng caffein cho trẻ sơ sinh dưới 1250g có vẻ an toàn và hiệu quả trong cai máy thở, tất cả những phát hiện này là những phân tích thứ phát và do đó cần được giải thích cẩn thận. Trong thử nghiệm lớn, caffeine được dùng vào lúc 3 ngày tuổi trung bình, khi trẻ sơ sinh chuẩn bị ngưng thở máy theo đánh giá của bác sĩ. [31] Do đó, các ngoại suy cho việc bắt đầu caffein ngay sau khi sinh hoặc trong vòng vài giờ sau sinh với mục đích cải thiện kết quả ngắn hạn hoặc dài hạn không được chứng minh dựa trên bằng chứng sẵn có.
Corticosteroids sau sinh
Việc sử dụng steroid sau sinh, dexamethasone hoặc hydrocortisone, đã được chủ đề của một số đánh giá có hệ thống. [33-35] Việc sử dụng corticosteroid toàn thân để điều trị BPD đã giảm mạnh kể từ khi nhận thức được sự nguy hiểm của việc sử dụng tự do các loại thuốc này. Tuy nhiên, corticosteroid có thể có hiệu quả và hoạt động tốt ngay cả ở liều thấp hơn so với trước đây được sử dụng, có lẽ với độc tính ít hơn. Giống như tất cả các loại thuốc, cần phải đánh giá rủi ro-lợi ích cẩn thận và việc sử dụng chúng nên hạn chế trong các tình huống nguy cơ gây hậu quả xấu do sự phụ thuộc thở máy kéo dài.
Một tuyên bố chính sách của “American Academy of Pediatrics Committee on Fetus and Newborn” được đưa ra trong năm 2010 và bao gồm các khuyến cáo sau:
1) liều dexamethason cao mỗi ngày (khoảng 0,5 mg/kg/ngày) đã được chứng minh là làm giảm tỷ lệ mắc BPD nhưng có liên quan đến nhiều kết quả bất lợi ngắn và dài hạn, bao gồm sự suy giảm phát triển thần kinh, và không có cơ sở để cho rằng liều cao hàng ngày mang lại lợi ích điều trị bổ sung cho liệu pháp liều thấp hơn;
2) dùng dexamethason liều thấp (< 0,2 mg/kg/ngày) có thể tạo điều kiện cho việc rút nội khí quản và có thể làm giảm tỉ lệ tác dụng phụ ngắn hạn và dài hạn so với liều dexamethasone cao hơn. Các RCT bổ sung được cung cấp đầy đủ để đánh giá hiệu quả của liệu pháp này đối với tỷ lệ sống sót mà không có BPD, cũng như các kết cục ngắn và dài hạn khác được đảm bảo;
3) liệu pháp hydrocortisone liều thấp (1 mg/kg/ngày) trong 2 tuần đầu đời có thể làm tăng tỷ lệ sống sót mà không có BPD, đặc biệt đối với trẻ sơ sinh bị viêm trước khi sinh (prenatal inflammation) mà không ảnh hưởng xấu đến kết cục phát triển thần kinh. Các bác sĩ lâm sàng nên nhận thức được nguy cơ bị thủng ruột tăng có liên quan đến việc điều trị đồng thời sớm với thuốc ức chế prostaglandin;
4) dữ liệu hiện có không đủ để đưa ra khuyến cáo về điều trị với liều cao hydrocortisone. Do dữ liệu sẵn có xung đột và không kết luận nên bác sỹ lâm sàng phải sử dụng đánh giá lâm sàng riêng của họ để cân bằng các tác dụng bất lợi của BPD với các tác dụng bất lợi có thể có của điều trị cho từng bệnh nhân.
Một phân tích hồi quy sử dụng dữ liệu thử nghiệm đã công bố cho thấy tỷ lệ nguy cơ/lợi ích là không thuận lợi ở trẻ sơ sinh bị bệnh nhẹ nhưng lại thích sử dụng corticosteroid ở trẻ non tháng hơn và bệnh nặng hơn. Trẻ sơ sinh rất nhẹ cân (VLBW) vẫn còn trên thở máy sau 1 đến 2 tuần tuổi có nguy cơ phát triển BPD cao. [35] Nếu sử dụng liệu pháp corticosteroid, tốt hơn là nên dùng một đợt ngắn. [33,34] Quyết định này nên được thảo luận cùng với cha mẹ của trẻ sơ sinh.
Thuốc lợi tiểu
Thuốc lợi tiểu đã được chứng minh là không có hiệu quả trong điều trị hội chứng suy hô hấp cấp (RDS). Tuy nhiên, furosemide, thiazides và spironolactone được sử dụng rộng rãi trong thực hành lâm sàng cho trẻ sơ sinh bị BPD, chủ yếu dựa trên các nghiên cứu ngắn hạn cho thấy cải thiện cơ học phổi và kinh nghiệm. Các tác động về thời gian hỗ trợ hô hấp và oxy, thời gian nằm viện, biến chứng tiềm ẩn, tỷ lệ sống sót và kết cục lâu dài chưa được nghiên cứu trong các nghiên cứu ngẫu nhiên thiết kế thích hợp và cỡ mẫu đủ lớn. [38-40]
Một số trẻ có BPD dường như dễ bị phù phổi kẽ với ứ dịch và cho thấy lợi ích ngắn hạn của thuốc lợi tiểu. Những lợi ích rõ ràng của thuốc lợi tiểu phải được cân bằng với những tác dụng phụ đã biết của những loại thuốc này, đặc biệt là do thiếu dữ liệu thuyết phục để hỗ trợ việc sử dụng thuốc lợi tiểu lâu dài.
Vật lý trị liệu ngực để tạo điều kiện cho cai máy thở
Liệu pháp vật lý trị liệu ngực thường quy (CPT, chest physiotherapy) ở trẻ sơ sinh VLBW có RDS không được chỉ định và có liên quan đến tăng nguy cơ xuất huyết trong não thất (IVH). [41] Có thể có vai trò của CPT trong việc ngăn ngừa xẹp phổi sau rút NKQ, nhưng dữ liệu không thuyết phục, như thảo luận ở phần sau.
Hỗ trợ dinh dưỡng tối ưu
Cần quan tâm đến tầm quan trọng của việc hỗ trợ dinh dưỡng trong việc tạo điều kiện thành công sau rút ống NKQ. Khái niệm này được thiết lập tốt trong y văn người lớn và dựa trên nguyên lý sinh lý học. [42,43] Duy trì trẻ sơ sinh trong thở máy để tăng cân là một thực tế cần phải bỏ qua, nhưng cần được theo dõi cân nặng trong khi trẻ sơ sinh bị đặt nội khí quản thở máy, như một phương tiện tối ưu hóa sức mạnh và độ bền của cơ sau khi rút nội khí quản.
Quy trình thở máy
Cách đây hơn 10 năm, một nhóm trong American College of Chest Physicians đã tạo ra một loạt các khuyến cáo về cai máy thở ở người lớn và đề nghị nên xây dựng và thực hiện các đề cương thiết kế cho các BS không chuyên nghiệp. [44] Khuyến nghị này dựa trên các bằng chứng từ RCTs báo cáo kết quả cải thiện ở bệnh nhân điều trị bằng các quy trình thở máy. Mặc dù các bằng chứng sẵn có từ các tài liệu dành cho người lớn là thuyết phục và biện minh cho việc sử dụng các quy trình hướng tới các nhân viên y tế ở nhiều cơ sở, cần phải nghiên cứu thêm để đánh giá hiệu quả của cách tiếp cận như vậy ở trẻ sơ sinh. Chỉ có 3 RCT ở trẻ em đã được xuất bản; những nghiên cứu này cho thấy những kết quả trái ngược nhau và chỉ thu thập bệnh nhân một vài tuần lễ. [45-47]
Việc củng cố dữ liệu từ người lớn hoặc trẻ em đến trẻ sơ sinh sinh non là không phù hợp, vì các khía cạnh độc đáo của sinh lý phổi, cơ học hô hấp và dịch tễ học về tổn thương phổi. Trong năm 2009, một nghiên cứu quan sát từ Canada cho thấy việc áp dụng một quy trình cai máy thở cho trẻ sơ sinh có BW 1250g trở xuống, sử dụng các tiêu chuẩn khách quan cho việc cai máy, rút nội khí quản, và tái đặt lại NKQ, đã làm cải thiện đáng kể các kết quả hô hấp ngắn hạn. Sau khi thực hiện dự án, trẻ sơ sinh đã được rút nội khí quản sớm hơn và giảm sự thất bại rút NKQ và thời gian thở máy. Các nghiên cứu này ủng hộ việc áp dụng các quy trình thông khí cho chăm sóc tích cực sơ sinh, tuy nhiên các thử nghiệm lâm sàng được thiết kế tốt bao gồm cả quần thể sinh non sẽ được hưởng lợi từ việc thực hành sơ sinh.
TIÊU CHUẨN SẰN SÀNG RÚT NỘI KHÍ QUẢN
Thất bại sau rút nội khí quản là một vấn đề phổ biến ở trẻ sơ sinh cực non tháng. Mặc dù các nhà sơ sinh học đã có những tiến bộ quan trọng trong việc hỗ trợ hô hấp cho trẻ sau rút NKQ, việc xác định một cách khoa học xem bệnh nhân đã sẵn sàng cho việc rút nội khí quản hay không, là chưa rõ ràng. Hầu hết trẻ non tháng được rút NKQ một cách dễ dàng sau một thời gian ngắn thở máy nhưng ở một vài bệnh nhân, vì các nguyên nhân như suy cơ hô hấp, bất thường đường thở, rối loạn huyết động đáng kể do còn ống động mạch (PDA), kiểm soát hô hấp chưa trưởng thành, di chứng tổn thương phổi, viêm phổi nhiễm trùng bệnh viện và cần thông khí kéo dài hoặc thất bại 1 hoặc nhiều lần rút NKQ. Sự liên quan giữa thất bại rút nội khí quản và những kết cục tồi tệ hơn đã được nghiên cứu rộng rãi ở người lớn và bệnh nhân nhi khoa, những trẻ bị thất bại rút nội khí quản đã kéo dài thời gian chung của thở máy và thời gian nằm viện và làm tăng nguy cơ viêm phổi và tử vong do bệnh viện. [49,50]
Ở quần thể thiếu tháng, thở máy kéo dài liên quan chặt chẽ đến tình trạng bệnh tật và tử vong gia tăng và là lý do chính cho các nhà sơ sinh học chủ động trong việc cai máy thở trẻ sơ sinh. [1,5,51] Tuy nhiên, ngưng thở máy sớm sau 1 hoặc nhiều đợt thất bại rút nội khí quản và tái đặt lại NKQ trực tiếp góp phần vào các kết cục ngắn hạn và dài hạn tồi tệ hơn hoặc chỉ đơn giản là một bằng chứng cho biết đó là trẻ sơ sinh non tháng hơn và bệnh nặng hơn. Tuy nhiên, việc tìm thấy một yếu tố để dự đoán khi trẻ sơ sinh non tháng có thể được xem xét để rút nội khí quản thành công cao nhất là điều rất mong muốn.
Nếu không có bằng chứng mạnh mẽ, quyết định rút ống tay thường được dựa trên sự đánh giá lâm sàng của bác sĩ có trách nhiệm. Quá trình này có tính đến kinh nghiệm cá nhân và quan sát tại giường của 1 hoặc nhiều thông số, thường là khí máu, nhu cầu oxy, và các cài đặt máy thở. Có thể dự đoán, chiến lược này dẫn đến sự khác biệt đáng kể trong thực tiễn rút nội khí quản. Các nghiên cứu về hô hấp liên quan đến trẻ non tháng đã mô tả các tiêu chuẩn khác nhau về thở máy ở trẻ sơ sinh có các chế độ thông khí khác nhau, bao gồm SIMV, SIMV/PS, PSV, AC, đảm bảo thể tích hoặc HFOV. Như vậy, rõ ràng là không có sự nhất trí về những gì cấu thành nên tiêu chuẩn rút NKQ.
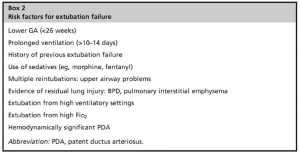
Ở trẻ sơ sinh non tháng, tỷ lệ thất bại rút nội khí quản có thể dao động từ 10% đến 80% và có liên quan đến sự khác biệt về dân số được nghiên cứu, tuổi rút NKQ, thời gian thở máy trước khi rút ống, cách xử trí sau khi rút NKQ và khung thời gian sử dụng cho định nghĩa. Thất bại xảy ra vì một vài lý do, chẳng hạn như kiểm soát hô hấp không ổn định, bơm hô hấp còn yếu, nhuyễn hóa đường thở trên, xẹp phổi, sự bất ổn định về huyết động, phù thanh môn hoặc dưới thanh môn, hoặc tổn thương phổi di chứng (Hộp 2). Các dấu hiệu thường gặp nhất để tái đặt lại NKQ là ngưng thở và nhịp tim chậm (tăng số lượng hoặc mức độ trầm trọng của các cơn), nhiễm toan hô hấp, giảm oxy máu trầm trọng, và tăng công thở (co lõm ngực khoảng gian sườn và dưới sườn, phập phồng cánh mũi, thở rên) (Hộp 3). Thông thường, những trẻ sơ sinh này được đặt lại NKQ khi có bất kỳ điều kiện nào sau đây: PaCO2 > 60 – 65 với pH < 7,20 – 7,25, FiO2 > 0,5 – 0,6 để duy trì SpO2 từ 88% – 92%, nhiều cơn ngưng thở (> 3-8 lần mỗi giờ), hoặc ngưng thở nặng cần thông khí áp lực dương (Hộp 4).

Tái đặt NKQ không phải là một thủ thuật lành tính và có thể liên quan đến một loạt các rối loạn sinh lý. Đặt NKQ khó cũng là một vấn đề, bởi vì có ít trẻ được đặt lại nội khí quản hơn. Một nghiên cứu gần đây được thực hiện ở một NICU ở cấp độ 3 ở Canađa đã báo cáo rằng khả năng của BS nội trú sơ sinh ở khoa NICU thực hiện đặt nội khí quản thành công đã không đạt được các tiêu chuẩn của chương trình hồi sức sơ sinh (NRP – non-resalcitation program). [52]

Mặc dù theo đặt nội khí quản sơ sinh không nên kéo dài quá 20 giây để tránh tình trạng giảm oxy máu và chậm nhịp tim, thời gian trung bình tổng cộng cho đặt nội khí quản thành công là 51 ± 28 giây, và ở trẻ sinh non thì thời gian này còn lâu hơn. Hơn nữa, 60% ETTs không ở vị trí tối ưu trong đường thở trên X-quang ngực. Các thử nghiệm tiền cứu được thực hiện để đánh giá việc sử dụng cho đặt NKQ chọn lọc và bán chọn lọc đã báo cáo, thời gian có thể dài hơn và trung bình gần 2 lần đặt cho mỗi bệnh nhân. [53,54]
Do đó, việc đặt lại NKQ ở trẻ non tháng có nguy cơ kéo dài, không thành công nhiều lần và các biến chứng liên quan đến thủ thuật. Tái đặt lại NKQ có thể gây ra ống sai vị trí, chấn thương mũi, hầu, thanh quản hoặc khí quản, xẹp phổi hoặc đường thở, và nhiễm trùng. [52,55] Những biến chứng này có thể gây ra hoặc làm trầm trọng thêm các rối loạn về tim mạch hoặc thần kinh, và có thể dẫn đến di chứng lâu dài về hô hấp hoặc thần kinh. Sự chậm nhịp nghiêm trọng, biến động lớn về huyết áp, SpO2, áp lực nội sọ, và oxy hóa đã được quan sát thấy trong nỗ lực đặt nội khí quản, và chỉ khắc phục một phần bằng phương pháp dùng thuốc trước đặt NKQ. [11] Một nghiên cứu gần đây đã sử dụng quá trình giám sát điện cực ba kênh trong quá trình đặt nội khí quản và mô tả những thay đổi đáng kể trong chức năng não. [56] Tất cả những phát hiện trên nhằm nhấn mạnh tầm quan trọng của việc đạt được tỷ lệ thất bại sau rút nội khí quản ở mức thấp hơn mà không cần tăng thời lượng thở máy một cách không cần thiết.
DỰ ĐOÁN SỰ SẲN SÀNG RÚT NỘI KHÓ QUẢN
Trong những thập kỷ qua, một số nghiên cứu đã điều tra các công cụ dự đoán có thể giúp các nhà sơ sinh xác định sự sẵn sàng rút NKQ ở trẻ sơ sinh có cơ hội thành công cao nhất. Một số nghiên cứu đã được thực hiện trước khi sử dụng thường quy hoặc sử dụng rộng rãi steroid trước khi sinh và Surfactant. Ngoài ra, xử trí sau rút NKQ khác với thực tế hiện nay, với trẻ sơ sinh sau rút NKQ cho thở oxy ẩm với head box hoặc khí phòng. [8,57-59] Gần đây hơn, các yếu tố dự báo khác đã được kiểm tra ở trẻ nhỏ dùng steroid trước khi sinh và điều trị surfactant, và được hỗ trợ thở NIV trong giai đoạn sau rút NKQ.
Các phép đo Sinh lý học
Szymankiewicz và cộng sự điều tra sự khác biệt trong cơ học phổi ở trẻ non tháng phụ thuộc vào máy thở đã được rút nội khí quản thành công hoặc không thành công. [60] Chỉ hơn một nửa số em bé được tiếp xúc với steroid trước khi sinh, và surfactant được dùng ở bệnh nhân thông khí chỉ khi FiO2 > 0,4 và tỷ lệ PO2 động mạch/phế nang < 0,22. Đã áp dụng các tiêu chuẩn cụ thể cho việc rút ống NKQ và tái đặt lại NKQ, và 31% trẻ sơ sinh thất bại trong việc rút nội khí quản. Sự khác biệt đáng kể giữa nhóm bệnh nhân thành công và thất bại là độ giãn nở động, sự đề kháng hô hấp, công thở, VT, và thông khí phút được đo bằng 10 nhịp thở cơ học với độ rò rỉ < 10%. Tuy nhiên, trong nghiên cứu này, tất cả trẻ được dùng dexamethasone liều cao trong suốt thời kỳ rút NKQ (tổng liều 5,5 mg/kg) và chỉ được điều trị bằng CPAP mũi 10 cm H2O trong vòng 2 đến 3 giờ sau khi rút NKQ. Sau đó, trẻ sơ sinh được đặt trong oxygen hood. Hầu hết các thất bại là do các cơn ngưng thở; chỉ có 3 bệnh nhân thất bại vì nhiễm toan hô hấp. Không có giá trị tiên đoán đặc hiệu nào được tính toán và xác nhận các kết quả. Việc áp dụng một chỉ số áp lực-thời gian (pressure-time index) đánh giá sức mạnh của cơ hô hấp đã có thể dự đoán sự rút kinh nghiệm thành công với độ nhạy và độ đặc hiệu cao, cho thấy giảm hiệu quả của cơ hoành ở trẻ sơ sinh thất bại với rút nội khí quản. Tuy nhiên, nghiên cứu này là trẻ > tuần thứ 36 của GA và BW lớn hơn 3 kg. Vì vậy việc sử dụng cho trẻ sơ sinh nhỏ nhất và chưa trưởng thành nhất, những trẻ có nguy cơ bị thất bại lớn nhất vẫn chưa được biết.
Thử nghiệm tự thở (SBT, Spontaneous Breathing Trials)
Ở người lớn, việc sử dụng một thử nghiệm tự thở 30 phút đến 120 phút để đánh giá sự sẵn sàng rút nội khí quản được thiết lập dựa trên bằng chứng. Ở trẻ sanh non, chỉ có một vài nghiên cứu đã khảo sát cách tiếp cận tương tự của một thử nghiệm thở CPAP qua NKQ (ETT-CPAP) trước khi rút NKQ và một phân tích gộp kết luận rằng trẻ sơ sinh non tháng nên được rút NKQ trực tiếp từ cài đặt thông số thở máy thấp mà không cần dùng thử ETT-CPAP. [61] Phân tích gộp cập nhật này thất bại trong việc xác định các thử nghiệm gần đây, và 3 nghiên cứu được đưa vào phân tích đã được thực hiện cách đây hơn 20 năm, khi số lượng sinh non và chiến lược thông khí khác biệt đáng kể. Hơn nữa, các thử nghiệm ETT-CPAP của những nghiên cứu đó dao động từ 6 giờ đến 24 giờ. Trong 2 thập kỷ vừa qua, chỉ có 1 RCT đơn trung tâm nhỏ so sánh sự khác biệt về kết quả cai máy thở giữa việc ra quyết định rút NKQ từ lâm sàng riêng lẻ và thông khí phút, so với nhóm cho thở ETT-CPAP 10 phút từ 3 đến 4 cm H2O. [62] Trẻ sơ sinh có GA trung vị trong 30 tuần được rút nội khí quản nếu tỷ lệ giữa thông khí phút của thở máy và thở tự phát là 50% và không có tác dụng phụ như cơn ngưng thở, nhịp tim chậm hoặc tăng nhu cầu oxy. Mặc dù không có ý nghĩa, tỷ lệ bệnh nhân cần phải đặt lại NKQ trong 24 giờ hoặc lâu hơn ở nhóm kiểm tra thông khí phút (24% so với 9%). Mức CPAP thấp có thể gây ra xẹp phổi và có thể đã góp phần làm thất bại.
Hai nghiên cứu quan sát nhỏ đã khảo sát việc sử dụng một thử nghiệm của ETT-CPAP trước khi rút nội khí quản ở trẻ sơ sinh. Vento và các đồng nghiệp [7] đã đánh giá tỷ lệ phần trăm thời gian thông khí phút thở ra tự thở < 125 mL/phút/kg trong một thử nghiệm ETT-CPAP 2 giờ ở 4 cm H2O, được thực hiện sau khi cai máy thở với tần số IMV là 6 nhịp/phút. Sự thất bại rút NKQ được định nghĩa là cần phải đặt lại trong vòng 72 giờ sau khi rút nội khí quản. Có 40 trẻ được rút khỏi CPAP mũi từ 4 đến 5 cmH2O; 11 bệnh nhân cần phải đặt lại (26,8%). Sử dụng một cutoff value trên 8,1% thời gian tiêu tốn cho thông khí phút thở ra tự thở < 125 mL/phút/kg, các nhà nghiên cứu có được độ nhạy 100% và độ đặc hiệu 90%. Thử nghiệm chưa bao giờ được xác nhận trong một nghiên cứu tiền cứu và có thể là trẻ sơ sinh ở những cutoff value cao hơn có thể đã được rút nội khí quản thành công.
Năm 2006, Kamlin và các cộng sự đã thực hiện một thử nghiệm ETT-CPAP 3 phút ở trẻ non tháng trước khi rút ống khi các thông số cài đặt thông khí cao hơn Vento và các đồng nghiệp sử dụng. Thử nghiệm đơn giản và bao gồm việc quan sát phản ứng lâm sàng bằng cách thay đổi SpO2 và nhịp tim trong 3 phút. SBT cho thấy giá trị tiên đoán tích cực cao, giá trị tiên đoán âm tính, độ nhạy và độ đặc hiệu và đã được thông qua theo chuẩn về chăm sóc tại cơ sở của các nhà điều tra. Một đánh giá tiền cứu của công cụ dự đoán này tại cùng một NICU cho thấy trẻ sơ sinh được rút nội khí quản sớm hơn và từ các thiết lập thông khí máy cao hơn mà không có bất kỳ sự gia tăng tỷ lệ rút nội khí quản thất bại, so với thời kỳ trước khi sử dụng SBT. [64]
Chức năng Hệ thần kinh tự trị (Autonomic Nervous System Function)
Biết rằng ở trạng thái khỏe mạnh, các hệ thống thể hiện một mức độ thay đổi trong các chức năng sinh lý, chẳng hạn như nhịp tim và hô hấp. Sự biến thiên này được tạo ra bởi hoạt động của hệ thống thần kinh tự trị (ANS, autonomic nervous system) và tính phức tạp, nó là trách nhiệm cho khả năng thích ứng và tính năng của các hệ thống này. Ở trẻ non tháng, sự mất đi tính thay đổi nhịp tim (HRV, heart rate variability) đã được chứng minh là trước khởi phát của nhiễm trùng huyết [65-68] và có liên quan đến kết cục lâm sàng tồi tệ hơn. [69-71]
Quá trình cai máy thở cho thấy một giai đoạn chuyển tiếp từ thở máy sang thở tự nhiên và có liên quan đến sự thay đổi hoạt động tự trị. [72] Vì vậy, đánh giá chức năng ANS trong thời kỳ cai máy thở có thể cung cấp thông tin về sự mất cân bằng sinh lý. [73] Ở người lớn, sự suy giảm HRV và mất kiểm soát hoạt động ANS là những thay đổi cơ bản ở những bệnh nhân thất bại cai máy. [74] Tương tự như vậy, một số nghiên cứu đã đánh giá khả năng thay đổi chỉ số hô hấp (ability of respiratory variability indes) là yếu tố dự đoán của rút NKQ; giảm RV được báo cáo ở những bệnh nhân thất bại. [73,75,76] Việc kết hợp cả hai chỉ số (HRV và RV) đã được nghiên cứu trong quá trình cai máy cho người lớn. [77,78] Chỉ có 1 nghiên cứu đã đánh giá RV ở trẻ non tháng trước khi rút nội khí quản. Trong nghiên cứu này, các thông số về hô hấp thu được sử dụng cảm biến lưu lượng trong SBT 3 phút được sử dụng để tính RV. Sự kết hợp của RV và đáp ứng lâm sàng với SBT có độ chính xác cao hơn trong việc tiên đoán sự rút nội khí quản thành công so với cả hai chỉ số dự báo riêng lẻ. Các nghiên cứu thêm về các chỉ số biến thiên sử dụng các phân tích phức tạp hơn theo thời gian là cần thiết và có thể cung cấp thông tin quan trọng cho bác sĩ lâm sàng về quá trình ra quyết định trong khi cai máy thở và rút nội khí quản.
XỬ TRÍ SAU RÚT NỘI KHÍ QUẢN
CPAP so với Oxyhood hoặc Cannula mũi
Việc sử dụng CPAP sau khi rút nội khí quản ở trẻ non tháng tốt hơn việc cho thở oxy qua head box hoặc oxyhood sau rút nội khí quản cho trẻ sơ sinh non tháng. [80] Cơ sở sinh lý cho phát hiện này là khung lồng ngực của trẻ ELBW đàn hồi quá nhiều/không đủ độ cứng để duy trì dung tích cặn chức năng. Thêm vào đó, sau khi được đặt nội khí quản trong một thời gian, dây thanh quản của trẻ sơ sinh bị phù nề, ngăn cản việc tạo grunting hiệu quả; một cơ chế mà trẻ sơ sinh non tháng thường sử dụng để duy trì áp lực căng phế nang bên trong. Do đó, một số hình thức giữ áp lực căng đường thở (distending airway pressure) nên luôn được sử dụng trong ít nhất 24 giờ sau khi rút nội khí quản.
Không có đủ bằng chứng để cho thấy có thể sử dụng oxy lưu lượng cao qua cannula mũi (HHHFNC, heated humidified high-flow nasal cannula) với bộ phận làm ấm & ẩm để cung cấp áp lực căng đường thở. [81] Các bằng chứng hiện có cho thấy áp lực hầu họng khi dùng HHHFNC là không đều và thấp. [82,83]
Một nghiên cứu đặc biệt giải quyết sự rút nội khí quản thành công cho thấy sự thất bại rút ống NKQ nhiều hơn ở nhóm nasal cannula so với CPAP. Mười hai trong số 20 trẻ sơ sinh được phân ngẫu nhiên vào nhóm HHHFNC được đặt lại NKQ so với 3 trong số 20 trẻ dùng Infant Flow CPAP ở trẻ sơ sinh (P = .003). Nhóm HHHFN đã tăng sử dụng oxy và số cơn ngưng thở và nhịp tim chậm nhiều hơn sau khi rút nội khí quản so với CPAP. [84]
Hai RCTs đánh giá việc sử dụng HHHFNC trong phòng ngừa thất bại rút NKQ ở trẻ non tháng (NCT 00609882 và ACTRN 12610000166077). Với các nghiên cứu này, hơn 700 bệnh nhân sẽ được đánh giá. Kết quả của các thử nghiệm này sẽ giúp làm sáng tỏ vai trò của liệu pháp này trong hướng dẫn cụ thể này.
CPAP so với NIV qua mũi (Nasal Intermittent Positive Pressure Ventilation)
Bốn thử nghiệm lâm sàng nhỏ và đơn trung tâm đã cho thấy những ảnh hưởng có lợi của việc thông khí NIPPV đồng bộ qua cannula mũi để hỗ trợ những trẻ cực non trong giai đoạn ngay sau rút NKQ. [85-87] Ba trong số những nghiên cứu này đã được thực hiện gần 20 năm trước đây và sử dụng các giao diện và định nghĩa thất bại rút NKQ khác nhau. Tuy nhiên, việc sử dụng NIPPV không đồng bộ (nonsync) trở nên phổ biến gần đây. [88-90]
Cơ chế chính xác mà NIPPV hoạt động không được hiểu rõ và đã là chủ đề của các nghiên cứu gần đây được thực hiện ở trẻ ổn định, vài ngày sau khi rút nội khí quản. Chang và cộng sự [91] cho biết không có lợi ích ngắn hạn về thông khí và trao đổi khí khi so sánh thở NIPPV qua mũi với CPAP mũi. Chỉ NIPPV đồng bộ có liên quan đến việc giảm công thở hít vào. Tuy nhiên, nỗ lực thở ra tích cực và thời gian thở ra tăng lên trong cả hai chế độ NIPPV.
Owen và các đồng nghiệp đã khẳng định những phát hiện này bằng cách báo cáo ít ảnh hưởng lên VT trong khi sử dụng NIPPV không đồng bộ ngay cả khi áp lực dương được cung cấp đồng bộ với nhịp thở tự phát của bệnh nhân. Các điều tra viên này cũng báo cáo những thay đổi đáng kể giữa áp lực thiết lập và áp lực cung cấp (được đo ở mũi); ở hầu hết bệnh nhân, áp lực đạt được thấp hơn đáng kể so với áp lực cài đặt. Trong giai đoạn ngưng thở, sự bơm phồng ngực chỉ xảy ra trong 5% thời gian, dẫn đến thể tích khí lưu thông nhỏ (26,7% thể tích nhịp thở tự nhiên), tuy nhiên số lượng mất độ bão hòa oxy giảm. Nhiều giai đoạn ngưng thở đi kèm với tắc nghẽn đường thở, [93] và dựa trên những phát hiện này, có vẻ như áp lực cung cấp qua mũi có thể không vượt qua được trở ngại này. Tăng mức áp lực dương có thể không hiệu quả do rò rỉ nhưng cũng vì áp lực dương ở mũi cao làm tăng hoạt động điện của cơ co thắt thanh môn (thyroarytenoid), như đã được trình bày trong một loạt các thí nghiệm ở những con cừu non. [94-96] Phát hiện này cho thấy rằng đóng đường thở như vậy có thể làm hạn chế thông khí phổi khi tăng mức áp lực dương của NIPPV.
Một RCT đa quốc gia lớn về việc sử dụng NIPPV không đồng bộ ở trẻ non tháng (NCT00433212) vừa được báo cáo ở dạng tóm tắt và không có sự khác biệt trong bất kỳ kết cục chính nào, kể cả thời gian thông khí hoặc thất bại rút ống. [Kirpalani, và cộng sự PAS 2012: E-PAS2012: 1675.1].
Caffeine
Một đánh giá có hệ thống của Cochrane [97] cho thấy nguy cơ tương đối (relative risk) của thất bại rút NKQ là 0,48 đối với trẻ sơ sinh tiếp xúc với methylxanthines trước khi rút NKQ, và trên cơ sở đó, caffeine hầu như luôn được dùng trước khi rút NKQ ở trẻ nhỏ ELBW, nếu nó chưa được sử dụng trước. Liều tối ưu để rút NKQ có thể cao hơn liều đã được sử dụng theo truyền thống.
Một nghiên cứu đa trung tâm của Steer và các cộng sự cho thấy có giảm đáng kể việc thất bại trong việc rút NKQ cho trẻ sơ sinh dùng liều > 20 mg/kg/ngày (15,0% so với 29,8% ở trẻ sơ sinh dùng liều 5 mg/kg/ngày, nguy cơ tương đối [RR] = 0,51, 95% CI 0,31-0,85, number needed to treat = 7). Một sự khác biệt đáng kể về thời gian thở máy được thấy ở trẻ nhỏ dưới 28 tuần tuổi nhận được lượng caffein cao (14,4 ± 11,1 so với 22,1 ± 17,1 ngày, P = 0,01).
Corticosteroid sau sinh trong dự phòng và điều trị thở rít sau rút NKQ
Ở trẻ sơ sinh, 2 nghiên cứu đã kiểm tra việc sử dụng steroid để phòng ngừa thở rít sau rút NKQ. Một phân tích gộp cho thấy kết quả không đồng nhất, không có sự giảm đáng kể về mặt thống kê trong thở rít sau rút NKQ (RR 0,42; KTC 95% 0,07-2,32). [99] Nghiên cứu được thực hiện ở những trẻ sơ sinh có nguy cơ cao được điều trị bằng nhiều liều steroid trong thời gian rút nội khí quản thấy giảm stridor đáng kể. [100] Như vậy, sự can thiệp này cần được nghiên cứu thêm. Mặc dù dữ liệu không tương quan, việc sử dụng một đợt corticosteroid liều thấp đã trở nên phổ biến, chủ yếu dựa vào kinh nghiệm. Có thể thận trọng khi dự trữ liệu pháp này cho trẻ sơ sinh bị đặt nội khí quản trong thời gian dài, có tiền sử chấn thương hoặc đặt nội khí quản nhiều lần, hoặc những trẻ trước đây đã thất bại rút nội khí quản do phù nề dưới thanh môn.
Epinephrine và Dexamethasone
Khí dung racemic epinephrine được sử dụng rộng rãi để điều trị phù nề đường thở cấp tính ở trẻ bị croup và thở rít sau rút NKQ ở trẻ sơ sinh. Mặc dù kinh nghiệm và các nghiên cứu ngắn hạn hỗ trợ việc sử dụng nó, [101] một phân tích gộp của Cochrane [102] đã thất bại khi tìm kiếm kết cục lâm sàng có hiệu quả của sử dụng khí dung racemic epinephrine. Cũng thiếu các bằng chứng rõ ràng để hỗ trợ dùng dexamethasone cho thở rít sau rút NKQ.
CPT để ngăn ngừa xẹp phổi sau rút NKQ và Tái đặt lại NKQ
CPT (liệu pháp vật lý trị liệu ngực) đã được sử dụng trên khắp thế giới để cải thiện việc loại bỏ các chất bài tiết đường hô hấp và điều trị xẹp phổi, nhưng bằng chứng để hỗ trợ việc sử dụng nó ở trẻ sơ sinh là không rõ ràng. Trong một phân tích gộp, [41] CPT chủ động được thực hiện mỗi 1 đến 2 giờ kết hợp với việc giảm nhu cầu đặt lại NKQ trong vòng 24 giờ đầu sau khi rút nội khí quản.
Tuy nhiên, cần thận trọng khi giải thích bất kỳ tác động tích cực nào của liệu pháp này vì các nghiên cứu này đã cũ và ghi nhận một số lượng nhỏ trẻ có GA lớn hơn, trưởng thành hơn và kết quả không đồng nhất giữa các thử nghiệm. Do đó, dữ liệu về sự an toàn không đầy đủ và áp dụng vào thực tiễn hiện tại có thể bị hạn chế.
TÓM LƯỢC
Việc cai máy thở và rút nội khí quản từ thở máy vẫn là một khoa học chưa chính xác. Các bằng chứng sẵn có cho thấy rõ ràng rằng việc rút nội khí quản sớm là mong muốn, nhưng khả năng của chúng tôi để dự đoán điểm mà tại đó việc này có thể được thực hiện an toàn ở trẻ sơ sinh ELBW còn hạn chế. Thông khí theo mục tiêu thể tích có thể làm tăng tốc độ cai máy thở từ MV. Có bằng chứng mạnh mẽ cho việc sử dụng caffein và áp lực căng đường thở sau khi rút ống NKQ. Các điều trị hỗ trợ khác cho cai máy thở và rút nội khí quản ít được thiết lập tốt hơn. Các công cụ cải tiến để dự đoán sự rút nội khí quản thành công trong quần thể dễ bị tổn thương này hiện đang được nghiên cứu, với hy vọng giảm thất bại rút ống và rủi ro liên quan đến việc tái đặt lại nội khí quản và thở máy kéo dài.





