Tác giả: Bác sĩ Đặng Thanh Tuấn
Mở đầu
Thông khí cơ học đã được cải thiện đến mức có rất ít trẻ sơ sinh chết do suy hô hấp cấp tính. Tỷ lệ tử vong sớm hiện nay chủ yếu từ các biến chứng khác của sự cực non sớm, chẳng hạn như nhiễm trùng và xuất huyết. Sự phát triển này đã làm thay đổi trọng tâm của việc giảm tỷ lệ tử vong bây giờ nhằm giảm tỷ lệ mắc bệnh phổi mãn tính không thể chấp nhận. Mặc dù hệ thống thông khí tần số cao đã thể hiện sự quan tâm về mặt này, nhưng nó gây ra tăng thông khí không phù hợp đã hạn chế chấp nhận nó như một điều trị đầu tiên ở trẻ sơ sinh bị suy hô hấp không biến chứng (RDS).[1] Đồng thời, với công nghệ cải tiến, hệ thống thông khí đồng bộ (còn được gọi là bệnh nhân kích hoạt) đã trở nên phổ biến rộng rãi. Thậm chí còn hứa hẹn hơn là sự ra đời của các phương thức thông khí được nhắm mục tiêu theo thể tích của thông khí thông thường, lần đầu tiên, cho phép kiểm soát hiệu quả thể tích khí lưu thông được phân phối để thông khí sơ sinh. Chương này xem xét ngắn gọn các chế độ thông khí đồng bộ cơ bản, mô tả khái niệm về thông khí nhắm mục tiêu theo thể tích và thảo luận về ứng dụng lâm sàng của cả hai.
Đồng bộ hóa thông khí
Loại thông khí cơ học tiêu chuẩn được sử dụng ở trẻ sơ sinh trước khi có các chế độ đồng bộ được gọi là thông khí bắt buộc gián đoạn (IMV, intermittent mandatory ventilation). IMV là chế độ thông khí có giới hạn áp lực, chu kỳ thời gian, cung cấp một số lượng nhịp thở cơ học “bắt buộc” được cài đặt. Bệnh nhân có thể thở một cách ngẫu nhiên bất cứ lúc nào, sử dụng dòng khí tươi có sẵn trong bộ dây máy thở, đồng thời cung cấp áp lực dương cuối kỳ thở ra (PEEP). Thật không may, tần số thở ngẫu nhiên của trẻ sơ sinh thường dẫn đến sự không đồng bộ giữa trẻ sơ sinh và máy thở.
Áp lực đường thở cao, oxy hóa kém và dao động lớn của áp lực nội sọ là kết quả khi trẻ sơ sinh thở ra trong chu trình thở máy. An thần mạnh và liệt cơ thường được sử dụng để ngăn chặn nỗ lực hô hấp tự phát của trẻ và ngăn chặn bé “chống máy thở.” Các can thiệp này dẫn đến sự phụ thuộc lớn hơn vào hỗ trợ hô hấp, thiếu huấn luyện cơ hô hấp, phù toàn thân, và không có khả năng đánh giá trạng thái thần kinh trẻ sơ sinh.
Những lợi thế của việc đồng bộ hóa nỗ lực của trẻ sơ sinh với chu trình máy thở, thay vì sử dụng thuốc giãn cơ, có vẻ là một lợi ích hiển nhiên (Bảng 1-1). Tuy nhiên, sự ra đời của thông khí đồng bộ áp dụng vào thực hành lâm sàng ở trẻ sơ sinh tụt hậu so với việc sử dụng ở người lớn vì những thách thức công nghệ được áp đặt bởi thể tích nhỏ và tần số thở nhanh của trẻ sơ sinh non tháng.
| BẢNG 1-1: Lợi ích của thông khí cơ học đồng bộ |
|
Các loại thiết bị kích hoạt
Thiết bị kích hoạt lý tưởng phải đủ nhạy để được kích hoạt bởi trẻ sinh non, nhưng tương đối tránh được kích hoạt tự động. Nó cũng phải có thời gian đáp ứng nhanh chóng để phù hợp với thời gian hít vào ngắn và tần số thở nhanh được thấy ở trẻ sơ sinh non tháng nhỏ. Sự rò rỉ khí thay đổi xung quanh các ống nội khí quản không bóng chèn (ETTs) tạo thêm một vấn đề quan trọng khác. Bảng 1-2 liệt kê các loại thiết bị kích hoạt được sử dụng trong chăm sóc lâm sàng và ưu điểm và nhược điểm tương đối của chúng. Kinh nghiệm lâm sàng và phòng thí nghiệm đã chỉ ra rằng kích hoạt bằng cách sử dụng cảm biến lưu lượng (flow sensor) khi đường dẫn khí mở (tại bộ chuyển đổi ETT) là có độ nhạy tốt nhất.[2,3] Tại thời điểm này, tất cả các máy thở trẻ sơ sinh đều sử dụng chế độ kích hoạt này. Một khái niệm hấp dẫn mới là sử dụng hoạt động điện của cơ hoành (NAVA) để kích hoạt máy thở. Kỹ thuật này đòi hỏi phải đặt một đầu dò thực quản để cảm nhận sự co cơ thực và điều chỉnh áp lực hô hấp của máy thở. Nó không bị ảnh hưởng bởi rò rỉ xung quanh các ống nội khí quản và có thời gian phản ứng rất nhanh. Tuy nhiên, hiện tại tính khả dụng của nó chỉ giới hạn ở một thiết bị duy nhất, và chức năng kích hoạt không thể tách rời khỏi thành phần hỗ trợ tỷ lệ, có thể không hoạt động tối ưu ở trẻ non tháng có kiểm soát hô hấp chưa trưởng thành (xem bên dưới).
| BẢNG 1-2 So sánh các phương pháp kích hoạt | ||
| Phương pháp | Ưu điểm | Nhược điểm |
| Áp lực | Không thêm khoảng chết | Nhạy cảm kém
Trễ kích hoạt dài Công thở cao |
| Lưu lượng | Nhạy cảm nhất | Thêm khoảng chết |
| Pneumaticcapsule | Hồi đáp nhanh
Không có thêm khoảng chết |
Vị trí là rất quan trọng |
| Trở kháng | Không có thêm khoảng chết | Độ nhạy kém
Nhiễu |
Cạm bẫy tiềm ẩn của kích hoạt lưu lượng
Mặc dù kích hoạt lưu lượng là phương pháp được sử dụng rộng rãi nhất, nhưng vẫn có những vấn đề tiềm ẩn với chế độ kích hoạt này. Gắn thêm cảm biến lưu lượng tạo thêm khoảng 0,5–1 mL khoảng chết vào bộ dây máy thở, có thể trở nên nhiều hơn với trẻ rất nhỏ. Claure và các đồng nghiệp giới thiệu phương pháp tạo một rò rỉ nhỏ, cố định vào bộ dây thở, để có thể rửa sạch khoảng chết của cảm biến lưu lượng.[4] Nếu phương pháp này chứng minh là thực tế trong môi trường lâm sàng, nó sẽ loại bỏ một nhược điểm của kích hoạt lưu lượng.
Vấn đề thứ hai là tính nhạy cảm với sự tự động kích hoạt (auto-triggering) khi có sự rò rỉ đáng kể xung quanh ETT. Bất kỳ sự rò rỉ đáng kể nào của lưu lượng trong giai đoạn thở ra sẽ được thiết bị diễn giải sai như là một nỗ lực hít vào, kích hoạt máy thở với tốc độ cực nhanh. Khi được nhận diện, vấn đề có thể được khắc phục bằng cách giảm độ nhạy của kích hoạt. Thật không may, mức rò rỉ thường thay đổi khá nhanh, đòi hỏi phải điều chỉnh thường xuyên. Hơn nữa, làm cho kích hoạt ít nhạy cảm hơn có nghĩa là làm tăng nỗ lực cần thiết để kích hoạt thiết bị và làm tăng độ trễ kích hoạt; cả hai đều không mong muốn. Một thiết bị, Dräger Babylog 8000 plus (Dräger Medical, Inc., Lübeck, Đức), cung cấp một giải pháp tối ưu cho vấn đề này. Babylog 8000 plus sử dụng công nghệ bù rò rỉ độc quyền cho phép thiết bị lấy ngay luồng rò rỉ trong suốt chu kỳ máy thở và tính toán lưu lượng này từ giá trị đo được. Điều này có hiệu quả loại bỏ vấn đề liên quan đến rò rỉ của tự động kích hoạt và cho phép độ nhạy kích hoạt ở lại với giá trị nhạy cảm nhất, duy trì thời gian đáp ứng nhanh và công việc tối thiểu để kích hoạt thiết bị.
Phương thức thông khí đồng bộ
Sự nhầm lẫn đáng kể tồn tại trong thuật ngữ được sử dụng để mô tả các phương thức khác nhau của hỗ trợ hô hấp. Các nhà sản xuất thiết bị thường sử dụng các thuật ngữ khác nhau để mô tả các chế độ cơ bản giống hệt nhau. Theo thuật ngữ cơ bản, nhịp thở của máy thở có thể là chu kỳ thời gian hoặc lưu lượng (bắt đầu hít vào và thở ra) và áp lực hoặc thể tích bị giới hạn. Kích hoạt có thể xảy ra ở một tần số cố định được cài đặt bởi người sử dụng hoặc ở một tần số thay đổi được xác định bởi bệnh nhân.[5] Các phần sau đây xác định ngắn gọn thuật ngữ cho các chế độ được sử dụng chủ yếu ở trẻ sơ sinh.
Thông khí bắt buộc ngắt quãng đồng bộ
Chế độ thông khí bắt buộc đồng bộ (SIMV, synchronized intermittent mandatory ventilation) cung cấp một số lượng nhịp thở cơ học định sẵn như trong IMV tiêu chuẩn, nhưng nhịp thở được đồng bộ hóa với nỗ lực hô hấp tự phát của trẻ, nếu có. Nhịp thở tự phát vượt quá số lượng đặt trước không được hỗ trợ, dẫn đến thể tích khí lưu thông (VT) không đồng đều và công thở cao (WOB), đặc biệt là khi cai máy. Đặc biệt là ở trẻ cực kỳ nhỏ và non tháng với ETTs hẹp tương ứng. Sức đề kháng đường hô hấp cao của ETT hẹp, sức mạnh cơ hô hấp giới hạn của trẻ sinh non, và nhược điểm cơ học do thành ngực đàn hồi quá mức của trẻ sơ sinh thường dẫn đến VT nhỏ, không hiệu quả. Vì khoảng chết giải phẫu là cố định, một VT rất nhỏ mà phần lớn là khí khoảng chết góp phần làm cho thông khí phế nang kém hiệu quả (thông khí phế nang = thông khí phút – thông khí khoảng chết). Để duy trì thông khí tối đa đầy đủ với số nhịp thở cơ học hạn chế được cung cấp bởi máy thở ở chế độ SIMV, VT tương đối lớn là bắt buộc.
Hỗ trợ/Kiểm soát
Giống như SIMV, Hỗ trợ/Kiểm soát (A/C, assist/control) là chế độ giới hạn áp lực, chu kỳ thời gian, nhưng không giống như SIMV, trong A/C, mọi nhịp thở tự phát vượt quá ngưỡng kích hoạt được hỗ trợ bởi máy thở. Cách tiếp cận này cung cấp VT thống nhất hơn và làm giảm WOB. Các bác sĩ vẫn đặt một tần số thở cho nhịp thở bắt buộc, cung cấp một tần số tối thiểu trong trường hợp ngưng thở. Tần số này thường không được đặt hơi thấp hơn tần số tự phát của trẻ sơ sinh để không tránh được nhịp thở tự phát. Bởi vì trẻ sơ sinh kiểm soát tần số thở máy hiệu quả, cai máy được thực hiện bằng cách hạ thấp áp lực hít vào đỉnh, chứ không phải là giảm tần số thở máy. Cách tiếp cận này làm giảm lượng hỗ trợ cung cấp cho mỗi nhịp thở, cho phép trẻ sơ sinh dần dần chiếm lấy WOB. Một lý do cho sự miễn cưỡng rõ ràng để áp dụng chế độ này dường như là chiến lược cai máy ít trực quan hơn.
Thông khí hỗ trợ áp lực
Thông khí hỗ trợ áp lực (PSV, pressure support ventilation) là một chế độ với chu kỳ lưu lượng, chứ không phải là chế độ chu kỳ thời gian, giới hạn áp lực, hỗ trợ mọi nhịp thở tự phát (giống như A/C). Tuy nhiên, PSV cũng chấm dứt mỗi nhịp thở khi lưu lượng cảm ứng giảm xuống ngưỡng đặt trước, thường là 10- 20% lưu lượng hít vào đỉnh. Tính năng này giúp loại bỏ tình trạng ngưng cuối thì hít vào (thời gian hít vào kéo dài, giữ cho phổi ở mức bơm phồng cao nhất) và do đó có lẽ cung cấp đồng bộ tối ưu hơn. Trong một số thiết bị, PSV có thể được sử dụng để hỗ trợ nhịp thở tự phát giữa các tần số SIMV thấp để khắc phục các vấn đề liên quan đến nỗ lực hô hấp tự phát không đầy đủ của bệnh nhân và sức đề kháng ETT cao. Tuy nhiên, với một số thiết bị, PSV được sử dụng như một kỹ thuật độc lập, giống như A/C.
Thông khí hỗ trợ tỷ lệ
Thông khí hỗ trợ theo tỷ lệ (PAV, proportional assist ventilation) là kỹ thuật quan tâm hiện không có sẵn ở Hoa Kỳ. Dựa trên tải trọng đàn hồi và trở kháng (elastic and resistive unloading) của hệ thống hô hấp, PAV nhằm khắc phục khối lượng công việc bổ sung do độ giãn nở phổi kém và sức cản đường thở và ETT/bộ dây máy thở cao.[6] Máy thở tạo áp lực hít vào tương ứng với nỗ lực của bệnh nhân — về bản chất, nó là một hệ thống phản hồi tích cực. Khái niệm này giả định một cơ chế kiểm soát hô hấp trưởng thành và một hệ thống khép kín. Thật không may, cả hai giả định này đều không hợp lệ ở trẻ sinh non với ETT không bóng chèn. Ví dụ, các vấn đề thường gặp của thở chu kỳ (periodic breathing) sẽ được làm rõ hơn bởi máy thở, với sự hỗ trợ ít hơn được tạo ra khi trẻ thở chậm hơn và một mức độ hỗ trợ quá cao được cung cấp khi trẻ sơ sinh thở mạnh hơn. Ngoài ra, vì hệ thống phản ứng với lưu lượng và thể tích hít thở, một sự rò rỉ lớn xung quanh ETT sẽ được hiểu là thể tích hít vào lớn và bé phải chịu áp lực hô hấp cao, có khả năng dẫn đến VT nguy hiểm. Dữ liệu lâm sàng còn hạn chế về việc sử dụng PAV ở trẻ non tháng.
Hỗ trợ thông khí điều chỉnh theo thần kinh
Hỗ trợ thông khí được điều chỉnh theo thần kinh (NAVA, Neurally adjusted ventilatory assist) sử dụng hoạt động điện của cơ hoành để kích hoạt và điều chỉnh lưu lượng khí thở. Tương tự như PAV, nó giả định bệnh nhân phải có một trung tâm kiểm soát hô hấp trưởng thành. Giống như PAV, nó là một cơ chế kiểm soát phản hồi tích cực, cung cấp áp lực cao hơn khi trẻ sơ sinh thở mạnh và ít hoặc không có hỗ trợ khi trẻ sơ sinh giảm trương lực hoặc trở nên ngưng thở. Do đó, nó có thể không phù hợp cho trẻ sinh non, thường có nhịp thở chu kỳ. Mặc dù tỷ lệ dự phòng có sẵn sẽ giải quyết được vấn đề ngưng thở, nhưng việc áp dạng là một vấn đề đòi hỏi phải đánh giá cẩn thận.
Chọn loại đồng bộ hóa
Mặc dù nhiều năm sử dụng thường xuyên, không có sự liên quan rõ ràng về các ưu điểm tương đối của A/C và SIMV, hai phương thức được sử dụng rộng rãi nhất của thông khí đồng bộ hóa. Thông tin ghi lại sự vượt trội của một chế độ trên một chế độ khác bị hạn chế. Không có thử nghiệm chuyên sâu lớn với các kết quả lâm sàng quan trọng, chẳng hạn như tỷ lệ rò rỉ khí, bệnh phổi mãn tính hoặc thời gian thở máy. Tuy nhiên, các thử nghiệm lâm sàng ngắn hạn đã chứng minh VT nhỏ hơn và ít biến đổi hơn, ít thở nhanh, cai máy nhanh hơn từ thở máy, và biến động huyết áp nhỏ hơn với A/C so với SIMV.[7–10] Có những cân nhắc sinh lý quan trọng, như đã nêu ở trên, tại sao SIMV có thể không cung cấp hỗ trợ tối ưu ở trẻ rất non tháng. Tuy nhiên, nhiều người sử dụng vẫn thích SIMV, đặc biệt là để cai máy từ thông khí cơ học. Tùy chọn này dựa trên giả định, không được hỗ trợ bởi dữ liệu, ít nhịp thở cơ học ít gây tổn hại hơn và với niềm tin rằng tần số thông khí cần thiết phải giảm dần trước khi rút ống. Người ta đã chứng minh rằng chấn thương phổi là trực tiếp nhất gây ra bởi VT quá mức, bất kể áp lực cần thiết để tạo ra VT. [11–13] Tần số 60 nhịp thở mỗi phút, so với tỷ lệ 20-40 nhịp mỗi phút, được hiển thị kết quả là rò rỉ khí ít hơn với IMV không đồng bộ. Kết quả này cho thấy sự hỗ trợ thêm cho lợi thế giả định của việc nên sử dụng A/C, với VT nhỏ hơn và tần số nhịp thở cơ học cao hơn, so với SIMV.
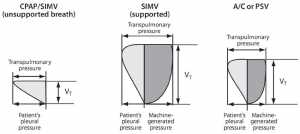
”Tương tác của áp lực máy thở và bệnh nhân để tạo VT được cung cấp ở các chế độ thông khí đồng bộ khác nhau. VT là kết quả của nỗ lực hô hấp của bệnh nhân (áp lực màng phổi âm tính trên thì hít vào) kết hợp với áp lực dương do máy thở tạo ra. Nỗ lực kết hợp này (em bé kéo kéo và máy thở đẩy) dẫn đến áp lực xuyên phổi, cùng với độ giãn nở của hệ thống hô hấp, xác định VT.”
Một số bác sĩ cũng tin rằng việc hỗ trợ mỗi nhịp thở không cung cấp cho trẻ sơ sinh cơ hội huấn luyện cơ hô hấp. Mối quan tâm này cũng vô căn cứ và làm nổi bật hiểu biết hạn chế của một số bác sĩ về sự tương tác của máy thở – bệnh nhân trong khi thở máy đồng bộ. Như Hình 1-1 minh họa, với sự thông khí đồng bộ, VT là kết quả của nỗ lực hít vào của bệnh nhân (áp lực màng phổi âm trên thì hít vào) kết hợp với áp lực dương tạo ra bởi máy thở. Nỗ lực kết hợp này (em bé “kéo” và máy thở “đẩy” khí) dẫn đến áp lực xuyên phổi, cùng với độ giãn nở của hệ thống hô hấp, xác định VT. Vì vậy, như là áp lực hít vào của máy thở chắc chắn là giảm dần trong khi cai máy, và trẻ sơ sinh giả định dần dần sẽ chiếm một tỷ lệ lớn hơn của công thở; trong quá trình này, các cơ hô hấp được huấn luyện. Cuối cùng, áp lực của máy thở được giảm xuống đến mức nó chỉ khắc phục được sức cản của ETT và bộ dây thở. Tại thời điểm đó, trẻ sơ sinh đã sẵn sàng rút ống.
Cuối cùng, kinh nghiệm rộng rãi với thông khí tần số cao (HFV) làm cho nó rõ ràng rằng biên độ áp lực giảm và để tỷ lệ không thay đổi là một cách hiệu quả để giảm sự hỗ trợ của máy thở đến thời điểm rút ống. Mặc dù chúng ta không thể tạo ra một song song trực tiếp giữa A/C và HFV, nhưng nó là hợp lý để chấp nhận rằng một số lượng lớn các nhịp thở với VT nhỏ hơn ở chế độ A/C không phải gây bất lợi. Nhưng một nghiên cứu lớn dứt khoát so sánh các giá trị tương đối của SIMV và A/C là còn thiếu.
Thử nghiệm lâm sàng thông khí đồng bộ hóa
Mặc dù có sự chấp nhận rộng rãi về thông khí cơ học đồng bộ trong chăm sóc tích cực ở trẻ sơ sinh, nhưng có rất nhiều thông tin về ảnh hưởng của phương thức này đối với các kết quả chính như tử vong, bệnh phổi mãn và thời gian nằm viện. Một số nghiên cứu nhỏ đã cho thấy sự cải thiện trong các kết quả sinh lý ngắn hạn (Bảng 1-3), nhưng việc giải thích kết quả dài hạn “lợi nhuận” đã khó nắm bắt.[15] Thật không may, các nghiên cứu có sẵn chỉ quan trọng về thiết kế và hạn chế thiết bị, để lại các bác sĩ lâm sàng với tình trạng rối rắm.
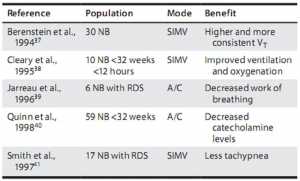
Trong thử nghiệm lâm sàng lớn đầu tiên, Bernstein và các cộng tác so sánh SIMV và IMV trong một nghiên cứu đa trung tâm ngẫu nhiên tiền cứu của 327 trẻ sơ sinh thở máy Infant Star ventilator với Star Sync module (cảm biến chuyển động bụng bằng nang Grasby).[16] So với IMV, thời gian thở máy ngắn hơn ở trẻ sơ sinh > 2.000 g trên SIMV, ít cần thiết an thần hơn cho trẻ nhỏ 1.000–1,499 g trên SIMV, áp lực đường thở trung bình thấp hơn trong tất cả các nhóm tuổi trên SIMV, cũng như thời gian ngắn hơn để lấy lại cân nặng lúc sinh khi được thở trong > 14 ngày trên SIMV. Các nhà nghiên cứu tiếp tục cho thấy ít cần oxy hơn ở tuổi thai dưới 36 tuần tuổi thai hiệu chỉnh (CGA) ở trẻ cân nặng < 1,000 g và ít cần oxy ở 36 tuần CGA cho tất cả trẻ sơ sinh < 2.000 g trong quá trình điều trị SIMV. Không có sự khác biệt giữa SIMV và IMV ở các điểm cuối chính – tỷ lệ sống, tỷ lệ rò rỉ khí và tổng thời gian của thông khí cơ học – trong nhóm không đồng nhất này. Nếu các nhà nghiên cứu chọn loạn sản phế quản phổi (BPD) sau 36 tuần CGA là kết quả chính, họ có thể báo cáo một cải thiện đáng kể trong toàn bộ dân số nghiên cứu của họ (giảm từ 42% đến 28%, p <0,05) (kết quả được phân tích lại dựa trên dữ liệu đã xuất bản).
Một thử nghiệm ngẫu nhiên đơn lẻ nhỏ hơn nhiều do Chen và các đồng nghiệp sử dụng cùng một thiết bị đã ghi nhận 77 trẻ sơ sinh có RDS và hội chứng hít phân su (MAS) cần thở máy. Trẻ sinh non có RDS trên SIMV có thời gian thông khí ngắn hơn đáng kể, ít cần tái đặt lại nội khí quản, tỷ lệ xuất huyết não thất nặng (IVH) (độ 3 và 4) thấp hơn và tỷ lệ thấp hơn BPD so với IMV. Không có sự khác biệt trong số lượng nhỏ MAS.[17]
Baumer và cộng sự, trong một thử nghiệm ngẫu nhiên lớn, so sánh A/C với IMV ở 924 trẻ sinh non có RDS. A/C được cung cấp sử dụng SLE 2000 (kích hoạt áp lực đường thở) ở một phần lớn bệnh nhân và Draeger Babylog 8000 (kích hoạt lưu lượng) trong phần còn lại. Một số trung tâm thiếu kinh nghiệm trước đây với thông khí được kích hoạt. Thử nghiệm này cho thấy không có sự khác biệt về bệnh phổi mãn tính, tràn khí màng phổi, thời gian thở máy, hoặc nguy cơ IVH giữa hai nhóm. Tác giả và cộng sự đã kết luận rằng không có lợi ích từ việc sử dụng A/C, đặc biệt ở trẻ < 28 tuần tuổi thai.[18] Điều quan trọng là phải giải thích kết quả bằng thiết bị được sử dụng ở phần lớn bệnh nhân. SLE 2000 sử dụng áp lực đường thở để cảm nhận nỗ lực của bệnh nhân. Kích hoạt áp lực đã được chứng minh là không kích hoạt ở một tỷ lệ lớn trẻ < 1,000 g.[3] Có một xu hướng với tỷ lệ rò rỉ khí cao hơn ở trẻ sơ sinh < 1.000 g trong nhóm được kích hoạt. Do sự chậm trễ kích hoạt dài của máy thở áp lực, có thể suy đoán rằng sự gia tăng rò rỉ khí là do ở cuối chu kỳ của máy thở tại thời điểm trẻ sơ sinh đã bắt đầu thở ra. Tác giả và các đồng nghiệp đã đưa ra một cách thích hợp trong cuộc thảo luận của họ rằng các kết quả này áp dụng cho thiết bị SLE 2000 và cho dân số được nghiên cứu và có thể không được khái quát hóa với các tình huống khác.[18]
Beresford và cộng sự đã đăng ký 386 trẻ sinh non có trọng lượng sơ sinh từ 1–2 kg trong một thử nghiệm ngẫu nhiên IMV hoặc kích hoạt thông khí bằng máy thở SLE 2000 (kích hoạt áp lực). Trẻ sơ sinh trong nhóm kích hoạt được thông khí bằng cách sử dụng A/C, sau đó cai máy bằng SIMV, trong khi nhóm điều trị có tỷ lệ thông khí được điều chỉnh theo cách thủ công để phù hợp với nhịp thở của từng trẻ sơ sinh ban đầu và sau đó được cai máy. Bệnh phổi mãn tính, tử vong, tràn khí màng phổi, IVH, số ngày thở máy, và sự phụ thuộc oxy kéo dài là tương đương với hai nhóm. Có thể kết luận rằng việc đồng bộ hóa thủ công cẩn thận làm đồng bộ tần số cài đặt máy thở với nhịp thở của trẻ sơ sinh có hiệu quả như việc đồng bộ hóa tự động bởi máy thở khi sử dụng kích hoạt áp lực.[19] Làm thế nào để đồng bộ hóa thủ công thực tế nằm ngoài giao thức nghiên cứu vẫn là một câu hỏi mở. Tuy nhiên, một lần nữa, vấn đề về tính không hiệu quả tương đối của thiết bị kích hoạt áp lực làm tăng thêm sự không chắc chắn về việc giải thích dữ liệu.
Rõ ràng, hai nghiên cứu sử dụng một thiết bị kích hoạt bề mặt tác động nhanh (rapidly acting surface trigger device, từ máy Infant Star) có kết quả tốt hơn so với hai thử nghiệm đã sử dụng thiết bị kích hoạt áp lực, từ máy SLE 2000. Các nghiên cứu thông khí nên thận trọng và kết luận rút ra từ chúng cần được xem xét cụ thể cho các thiết bị và chiến lược được sử dụng. Những kết quả mâu thuẫn này làm nổi bật khó khăn liên quan đến việc tiến hành các nghiên cứu máy thở nơi nhiều thiết bị khác nhau được sử dụng và trải nghiệm với việc sử dụng chúng khác nhau giữa các trung tâm tham gia.
Các đặc điểm của thiết bị cảm biến và kích hoạt là rất quan trọng đối với hiệu suất của nó trong việc đồng bộ hóa nhịp thở của trẻ sơ sinh và máy thở, đặc biệt là ở trẻ rất nhỏ. Phân tích gộp là một công cụ quan trọng để sử dụng trong việc đánh giá nghiên cứu để thực hành dựa trên bằng chứng, nhưng gộp lại các nghiên cứu sử dụng các thiết bị thông khí khác nhau và cách tiếp cận thông khí có thể che khuất sự khác biệt và gây nhầm lẫn, thay vì làm rõ, các vấn đề.
Thông khí nhắm mục tiêu theo thể tích
Gần đây nhất – và theo nhiều cách nhất, sự tiên tiến nhất trong việc thông khí sơ sinh là sự ra đời của các chế độ thông khí nhắm mục tiêu theo thể tích. Sự thừa nhận rằng thể tích, chứ không phải là áp lực, là yếu tố quyết định của tổn thương phổi do máy thở gây ra,[12,13] cùng với bằng chứng gắn kết rằng hạ CO2 máu liên quan đến tổn thương não sơ sinh,[20–22] đã thu hút sự quan tâm trực tiếp đến VT. Thông khí điều khiển thể tích truyền thống là vấn đề khó khăn ở trẻ sơ sinh nhỏ do sự mất mát không thể đoán trước của VT để nén khí trong bộ dây máy thở, kéo căng ống và thay đổi rò rỉ xung quanh các ETT không bị hạn chế. Tuy nhiên, một ấn phẩm đã chứng minh tính khả thi của thông khí kiểm soát thể tích ở trẻ <1.500 g, ít nhất là trong điều kiện nghiên cứu được kiểm soát cẩn thận. Nghiên cứu cho rằng, khi cảm biến lưu lượng gần được sử dụng để đo chính xác thể tích khí lưu thông thở ra và bộ VT được điều chỉnh thủ công theo các khoảng thời gian thường xuyên để duy trì VT thở ra mong muốn, có thể đạt được điều khiển thể tích hiệu quả. Các bệnh nhân được chọn ngẫu nhiên vào chế độ điều khiển thể tích đạt đến điểm cuối chính hoặc là áp lực đường thở trung bình < 8 cmH2O hoặc là sự khác biệt oxy phế nang – động mạch (AaDO2) <100, mặc dù thời gian thở máy và bổ sung oxy-gen không khác nhau.[23] Tuy nhiên, việc tính toán thể tích khí lưu thông gần và thường xuyên điều chỉnh thể tích khí lưu thông cài đặt không thường xuyên được thực hiện với thông khí điều khiển thể tích. Vì lý do này, một số thay đổi về thông khí giới hạn áp lực chu kỳ thời gian được thiết kế để nhắm mục tiêu một thể tích khí lưu thông được cài đặt bằng cách sử dụng các điều chỉnh của vi xử lý về áp lực đỉnh hoặc thời gian hít vào đã được phát triển gần đây. Mỗi chế độ có sẵn đều có ưu điểm và nhược điểm. Các chế độ thông khí được nhắm mục tiêu theo thể tích phổ biến nhất được thảo luận dưới đây.
Các phương thức thở theo mục tiêu thể tích
Kiểm soát thể tích điều chỉnh áp lực
Kiểm soát thể tích điều chỉnh áp lực (PRVC, Pressure-regulated volume control) là chế độ thông khí giới hạn áp lực, chu kỳ thời gian, có thể điều chỉnh áp lực hít vào để nhắm mục tiêu một thể tích khí lưu thông cài đặt, dựa trên VT của nhịp thở trước đó. Vấn đề chính với chế độ PRVC của Maquet Servo 300 và ở một mức độ thấp hơn Servo-i (Maquet, Inc., Bridgewater, New Jersey, trước đây là Siemens, Solna, Thụy Điển) là sự thiếu chính xác của phép đo VT được thực hiện tại đầu thông khí của bộ dây máy thở, thay vì ở đường dẫn khí mở.[24,25] Giới hạn này có thể được khắc phục ở một mức độ nào đó bằng cách sử dụng tính năng độ giãn nở mạch và sử dụng cảm biến lưu lượng gần. Bạn có thể tìm thêm thông tin về các nhà cung cấp này tại www.maquet.com/criticalcare.
Hỗ trợ áp lực đảm bảo thể tích
Chế độ hỗ trợ áp lực đảm bảo thể tích (VAPS, volume-assured pressure support) trên Bird VIP Gold (CareFusion, San Diego, California) là một chế độ lai, hoạt động để đảm bảo rằng VT đạt được. Mỗi nhịp thở bắt đầu như nhịp thở có giới hạn áp lực, nhưng nếu không đạt được thể tích khí lưu thông đã đặt, thiết bị sẽ chuyển sang chế độ dòng (thể tích). Nhịp thở điều khiển thể tích dẫn đến sự tăng thời gian hít vào và tăng thụ động áp lực đỉnh. Thời gian hít vào dài hơn này có thể dẫn đến tình trạng không đồng bộ thở ra. Nhắm mục tiêu khí lưu thông dựa trên VT hít vào này dễ bị lỗi khi có sự rò rỉ ETT đáng kể. Trọng tâm là đảm bảo VT đủ lớn. Không có điều khoản để giảm áp lực hít vào một cách tự động khi độ giãn nở phổi cải thiện, cũng không có điều khoản nào được thực hiện để tránh tình trạng tăng thông khí vô ý và cho phép cai máy tự động.
Máy thở AVEA mới hơn của CareFusion (San Diego, California) chia sẻ các tính năng cơ bản của VAPS, mặc dù với một thuật toán vi xử lý tinh vi hơn tránh thời gian thở dài quá mức, và thêm chức năng giới hạn thể tích để chấm dứt thì hít vào nếu vượt quá giới hạn VT trên. Chức năng được thêm vào này sẽ làm giảm nguy cơ volutrauma và tăng thông khí, nhưng nó vẫn không dẫn đến việc cai áp lực hít vào tự động và có thể dẫn đến thời gian hít vào rất ngắn. Bạn có thể tìm thêm thông tin về các máy thở này tại www.carefusion.com. Một sửa đổi phần mềm mới bắt chước chế độ đảm bảo thể tích (VG) được mô tả bên dưới gần đây đã được triển khai trong thiết bị này.
Đảm bảo thể tích
Các Dräger Babylog 8000 plus và Babylog VN500 mới cung cấp một tùy chọn VG có thể được kết hợp với bất kỳ chế độ thông khí tiêu chuẩn (A/C, SIMV, PSV). Chế độ VG là một hình thức được nhắm mục tiêu theo thể tích, chu kỳ thời gian,giới hạn áp lực. Người vận hành chọn VT mục tiêu và chọn giới hạn áp lực mà áp lực vận hành của máy thở (áp lực làm việc) có thể được điều chỉnh. Bộ vi xử lý so sánh VT của nhịp thở trước, sử dụng VT thở ra để giảm thiểu nhiễu có thể do rò rỉ khí, và điều chỉnh áp lực làm việc lên hoặc xuống để cố đạt được VT đã đặt. Thuật toán giới hạn lượng áp lực tăng từ nhịp thở này sang nhịp thở khác để tránh quá mức có thể dẫn đến VT quá mức. Điều này, và thực tế là VT thở ra của nhịp thở trước được sử dụng, có nghĩa là, với những thay đổi rất nhanh chóng trong việc độ giãn nở hoặc nỗ lực hô hấp của bệnh nhân, cần có một số nhịp thở là cần thiết để đạt được VT mục tiêu. Để giảm thiểu nguy cơ VT quá lớn, bộ vi xử lý mở van thở ra, hạn chế bất kỳ sự phân phối áp lực bổ sung nào nếu VT đã cung cấp vượt quá 130% nhịp thở trước đó. Theo thiết kế, thuật toán được hướng tới điều chỉnh chậm hơn cho VT thấp và điều chỉnh nhanh hơn cho quá trình phân phối thể tích quá mức, nguy hiểm. Việc tự điều chỉnh áp lực hô hấp khiến VG trở thành chế độ tự cai máy. Bởi vì cai máy xảy ra trong thời gian thực, thay vì liên tục theo đáp ứng với khí máu, VG có tiềm năng để đạt được cai máy nhanh hơn từ thông khí cơ học.
Các nghiên cứu lâm sàng của phương thức thở theo mục tiêu thể tích
Một số nghiên cứu ban đầu đã chứng minh tính khả thi và tính hiệu quả của VG và cho thấy áp lực đỉnh tương đương hoặc thấp hơn là cần thiết để đạt được trao đổi khí tương tự với sự dịch chuyển công thở từ máy thở dần dần chuyển sang cho trẻ sơ sinh.[26,27]
Một nghiên cứu chéo chéo ngắn hạn cho thấy VG được kết hợp với A/C, SIMV, hoặc PSV dẫn đến sự biến thiên thấp hơn đáng kể của VT so với chỉ có A/C, PSV hoặc SIMV và áp lực thở đỉnh là tương đương.[28]
Thử nghiệm lâm sàng ngẫu nhiên đầu tiên của VG sau đó đã chứng minh rằng, khi kết hợp với chế độ A/C, VG kết hợp PaCO2 và VT trong phạm vi đích nhiều hơn so với chỉ dùng A/C trong 72 giờ đầu tiên ở trẻ non tháng với RDS không biến chứng. Tỷ lệ mắc giảm PaCO2 máu, được xác định là PaCO2 <35 mmHg, giảm khoảng 45 phần trăm.[29] Nghiên cứu chéo đã ghi nhận rằng thiết bị VG hoạt động như dự định trong môi trường lâm sàng, với sự giảm biến thiên VT như dự đoán.[28] Thử nghiệm ngẫu nhiên đã chứng minh rằng VT quá mức và giảm PaCO2 máu có thể giảm, mặc dù không được loại bỏ, với việc sử dụng VG.[29] Điều này đã làm tăng tiềm năng của VG để giảm nhiều tác động bất lợi quan trọng của thông khí cơ học.
Một thử nghiệm chéo ngắn hạn năm 2005 đã nghiên cứu 12 trẻ sơ sinh cực kỳ nhẹ cân (679 ± 138 g) để xác định xem VG có hiệu quả hơn khi kết hợp với A/C hoặc SIMV hay không. Đúng như dự đoán, VT ổn định hơn khi VG được kết hợp với A/C vì khoảng cách giữa các nhịp thở được hỗ trợ dài hơn trong quá trình SIMV, dẫn đến điều chỉnh áp lực làm việc chậm hơn. Một phát hiện bất ngờ là, trong thời gian SIMV, trẻ nhỏ có SpO2 thấp hơn và biến thiên nhiều hơn đáng kể, và đặc biệt là nhịp tim nhanh hơn và thở nhanh. Theo thiết kế, VT là giống hệt nhau, nhưng áp lực hít vào (PIP) được yêu cầu cao hơn đáng kể trong quá trình SIMV để đạt được cùng một VT. Nhịp thở nhanh, nhịp tim nhanh, độ bão hòa oxy thay đổi nhiều hơn và thấp hơn cho thấy rằng trẻ sơ sinh mệt mỏi trong thời kỳ SIMV và đóng góp ít nỗ lực tự phát vào cuối giai đoạn hai giờ khi các số đo thu được.[30] Điều này là bởi vì, trong quá trình thông khí đồng bộ, VT được cung cấp là kết quả của nỗ lực kết hợp hít vào của em bé và thông khí áp lực dương. Khi em bé mệt mõi và đóng góp ít hơn, máy thở cần phải tạo ra PIP cao hơn để cung cấp cùng một VT.
Cuối cùng, trong một thử nghiệm ngẫu nhiên 53 trẻ bị RDS, Lista và các đồng nghiệp đã chứng minh mức độ giảm các cytokine gây viêm và thời gian thở máy ngắn hơn bằng cách sử dụng VG kết hợp với PSV hơn là chỉ PSV. Độ dài thông khí cơ học là 8,8 ± 3 ngày ở nhóm VG so với 12,3 ± 3 ngày ở nhóm PSV.[31] Ngược lại, một nghiên cứu tương tự tiếp theo của cùng tác giả, lần này sử dụng thể tích khí lưu thông mục tiêu là 3 mL/kg, cho thấy sự gia tăng của các cytokine tiền viêm.32 Đây có thể là kết quả của xẹp phổi do kết hợp của VT thấp và PEEP thấp ở mức 3–4 cmH2O đã được sử dụng.[33]
Một phân tích gộp gần đây bao gồm cả nghiên cứu VG, PRVC và VCV báo cáo rằng thông khí nhắm mục tiêu theo thể tích, so với thông khí giới hạn áp lực, giảm kết cục kết hợp tử vong hoặc BPD, giảm nguy cơ tràn khí màng phổi và rút ngắn thời gian thông khí cơ học. Tuy nhiên, các nghiên cứu được thu nhận có cỡ mẫu khá nhỏ và quan trọng hơn, nhiều kết quả chính được báo cáo trong phân tích gộp không được thu thập hoặc xác định một cách chuyên nghiệp. Trong một số nghiên cứu, các biến khác ngoài thể tích so với áp lực nhắm mục tiêu cũng khác nhau. Tất cả các nghiên cứu được đưa vào đều tập trung vào các kết cục sinh lý ngắn hạn và không bao gồm BPD là kết cục chính.[34]
Tầm quan trọng của chiến lược phổi mở
Những phát hiện của nghiên cứu Lista thứ hai đưa ra tầm quan trọng của việc phân phối thể tích khí lưu thông đồng đều vào phổi tối ưu. Khái niệm then chốt này đã không được đánh giá rộng rãi và đòi hỏi sự nhấn mạnh đặc biệt. Phổi của trẻ non tháng rất dễ bị xẹp do thiếu chất hoạt động bề mặt và thành ngực đàn hồi quá mức. Xẹp phổi không đồng đều, nhưng có xu hướng xảy ra ở vùng phụ thuộc phổi. Ngay cả một VT sinh lý bình thường chỉ cung cấp vào quần thể phế nang mở chắc chắn sẽ dẫn đến việc căng phế nang quá mức với tổn thương phổi sau đó. Vì vậy, điều quan trọng là phải cố gắng tối ưu hóa thể tích phổi bằng cách sử dụng áp lực căng đường thở đầy đủ. Trong thực tế, khái niệm “khái niệm phổi mở” này đạt được bằng cách áp dụng PEEP hiệu quả để cải thiện oxy hóa và cai dần FiO2 xuống < 0,35. Những lợi ích của thông khí nhắm mục tiêu theo thể tích không thể được thực hiện mà không đảm bảo rằng thể tích khí lưu thông này được phân bố đều trong phổi.
Những lợi ích ngắn hạn đã chứng minh của VG làm giảm đáng kể trong tần suất rò rỉ khí, bệnh phổi mãn tính, bất thường hình ảnh thần kinh, và thời gian nhập viện.
Ứng dụng lâm sàng của thông khí
Mặc dù thiếu bằng chứng dứt khoát về tính ưu việt của hệ thống thông khí đồng bộ với IMV tiêu chuẩn, nhưng các lợi ích của việc thông khí đồng bộ thường được chấp nhận. Rất ít nếu bất kỳ NICU nào không áp dụng các kỹ thuật này. Sự lựa chọn của SIMV hoặc A/C, ở một mức độ nào đó, là một vấn đề ưu tiên và thực tế. Trong thực tế, có rất ít sự khác biệt giữa hai phương thức trong giai đoạn cấp tính của suy hô hấp, đặc biệt là ở những trẻ cực kỳ non hoặc bị bệnh nặng, những người có ít hoặc không có nỗ lực hô hấp của chính họ hoặc ở những trẻ bị an thần nặng hoặc thậm chí bị liệt cơ. Trong những trường hợp này, chúng tôi thực sự cung cấp IMV đơn giản, bất kể lựa chọn chế độ thông khí. Tuy nhiên, sự khác biệt giữa SIMV và AC/PSV trở nên rõ rệt hơn trong khi cai máy và đặc biệt quan trọng ở trẻ nhỏ nhất có ETT hẹp. Thông khí kéo dài với tỷ lệ SIMV thấp nên tránh ở những trẻ này vì nó áp đặt một công việc thở không mong muốn cao. Reyes và các cộng sự đã chứng minh rằng việc bổ sung PSV để hỗ trợ nhịp thở tự phát trong quá trình SIMV có hiệu quả bù trừ đối với VT không hiệu quả trong quá trình SIMV.[35]
Phương thức thở đồng bộ tiêu chuẩn
Như với tất cả các máy thở có chu kỳ thời gian, giới hạn áp lực, người vận hành phải chọn PIP, PEEP, TI, tần số thở (trực tiếp hoặc bằng cách điều chỉnh riêng thời gian hít vào và thở ra) và FiO2. Các bước ban đầu là phù hợp với tất cả các hình thức thông khí đồng bộ hóa.
Cài đặt ban đầu
PIP
Việc lựa chọn PIP bắt đầu dựa trên ước tính mức độ nghiêm trọng của bệnh và mức độ nâng lên của ngực. Cài đặt này sau đó được điều chỉnh để đạt được VT thích hợp, thường là 4–7 mL/kg, được đo tại đường thở mở. Trái với ý kiến phổ biến, yêu cầu PIP không liên quan đến kích thước của bé, mà là do bệnh tật. Quan niệm sai lầm về PIP xuất phát từ thực tế là những đứa trẻ lớn hơn đối phó với phổi kém độ giãn nở hiệu quả hơn những trẻ nhỏ hơn vì sức mạnh và sức chịu đựng của chúng lớn hơn. Do đó, sự thất bại hô hấp xảy ra ở mức độ thấp hơn mức độ nghiêm trọng của bệnh ở trẻ nhỏ hơn. Tuy nhiên, ngay cả trẻ non tháng nhỏ có thể có phổi rất cứng và đôi khi, đòi hỏi áp lực khá cao. Mặt khác, trẻ đủ tháng có phổi bình thường, mục tiêu thông khí cho các bệnh nhân không thở, chỉ cần PIP ở thấp để đạt được VT bình thường. Cải thiện nhanh chóng độ giãn nở có thể diễn ra sau khi dùng surfactant.
PEEP
PEEP nên được cài đặt tương ứng với yêu cầu oxy hiện tại vì hầu như tất cả các bệnh phổi sơ sinh, thiếu oxy máu là sự phản ánh của sự không phù hợp về thông khí – tưới máu và shunting phổi từ phải sang trái. Điều này, lần lượt, phản ánh sự xẹp phổi và thể tích phổi thấp. Vì vậy, một nhu cầu oxy cao thường có thể được quy cho thể tích phổi thấp. Nó có thể được sửa chữa bởi PIP đầy đủ để mở phế nang bị xẹp và áp dụng PEEP đầy đủ để duy trì phổi mở. Ngoại lệ đối với quy tắc này là trẻ sơ sinh bị tăng áp động mạch phổi với tình trạng thiếu oxy máu liên quan đến shunting ngoài phổi. Một PEEP 5 cmH2O thường đủ nếu FiO2 là 0,25-0,35, PEEP nên khoảng 6 cmH2O với yêu cầu oxy giữa 0,35 và 0,5, và nó phải là 7–10 cmH2O nếu FiO2 vẫn > 0,6. Việc mở rộng phổi trên x-quang ngực cũng có thể hướng dẫn lựa chọn mức PEEP.
Thời gian hít vào
Việc lựa chọn thời gian hít vào (TI) nên phản ánh qua hằng số thời gian của trẻ sơ sinh (một thước đo khí có thể vào và ra khỏi phổi) như thế nào. Trẻ non tháng có RDS có hằng số thời gian rất ngắn và cần được thông khí với TI là 0,3 giây hoặc ít hơn. Những trẻ lớn hoặc những người có sức cản đường thở tăng lên (ví dụ, những bé bị bệnh phổi mãn hoặc hít phân xu) có hằng số thời gian dài hơn và đòi hỏi TI dài hơn, có khi đến 0,5 giây.
Tần số thở
Tần số thở máy nên phản ánh mức độ nghiêm trọng của bệnh tật và trẻ có nỗ lực hô hấp tự phát không. Trẻ bị bệnh phổi nặng và ít hoặc không có nỗ lực hô hấp nên được hỗ trợ với tần số khá nhanh 50-60 lần/phút. Trẻ em có thở tự nhiên với bệnh ít nghiêm trọng hơn có thể được hỗ trợ với tần số khoảng 40 nhịp/ phút, cho phép chúng kích hoạt hít vào. Vì tần số thở xác định thời gian hít vào (và ngược lại), điều quan trọng là phải cho phép thời gian thở ra đủ để tránh bẫy khí do thở ra không đủ. Vì lý do này, điều quan trọng là phải tránh mức tần số > 60 lần/phút ở trẻ lớn hơn hoặc những trẻ có sức đề kháng đường hô hấp tăng và > 80 lần/phút ở trẻ non tháng nhỏ. Sự phù hợp của thời gian hít vào và thở ra có thể được xác minh bằng cách quan sát dạng sóng của máy thở và đảm bảo lưu lượng thở ra trở về không (đường cơ sở) trước mỗi lần cuối thì thở ra và thì hít vào bắt đầu.
Điều chỉnh tiếp theo
Khi trẻ sơ sinh bắt đầu cải thiện và tạo ra nỗ lực hô hấp tự phát, tần số thở nên được hạ dần dần để cho phép bé tiếp nhận một số công thở. Điều này là quan trọng bởi vì một tần số quá nhanh sẽ ghi đè nỗ lực của chính trẻ sơ sinh và đánh bại mục đích của thông khí đồng bộ – cụ thể là, cho trẻ sơ sinh và máy thở làm việc cùng nhau. Một PaCO2 thấp là không mong muốn bởi vì nó sẽ ngăn chặn trung tâm hô hấp của trẻ sơ sinh.
Điều quan trọng là phải hiểu rõ cách các biến thông khí khác nhau ảnh hưởng đến trao đổi khí và cách chúng tương tác với sinh lý học cơ bản. Thảo luận chi tiết về các khái niệm này nằm ngoài phạm vi của chương này, nhưng các yếu tố cần thiết được xem xét một thời gian ngắn.
Oxygen hóa được kiểm soát bằng cách điều chỉnh FiO2 và áp lực đường thở trung bình, như đã thảo luận ở trên. Mục tiêu là để tối ưu hóa thể tích phổi và phù hợp thông khí- tưới máu và giảm FiO2 xuống < 0,35. PEEP là yếu tố quyết định quan trọng nhất của đường thở trung bình (Paw). PIP, thời gian hít vào và độ dốc (đạt được áp lực cao nguyên nhanh như thế nào) là các yếu tố khác.
Thông khí (loại bỏ CO2) được kiểm soát bởi các điều chỉnh tần số thở và VT. Trong thông khí giới hạn áp lực tiêu chuẩn, VT được xác định bởi biên độ độ giãn nở và áp lực phổi (sự khác biệt giữa PIP và PEEP). Vì vậy, tăng PIP cải thiện thông khí cũng như oxy hóa thông qua hiệu ứng của nó trên VT và Paw.
Tăng PEEP và/hoặc giảm PIP sẽ giảm VT nếu tất cả các yếu tố khác vẫn không đổi. Tuy nhiên, nếu tăng PEEP làm huy động phế nang (bình thường hóa) thể tích phổi, độ giãn nở phổi sẽ cải thiện, điều này có thể cải thiện sự thông khí, đôi khi khá đáng kể. Cải tiến này trong thông khí có thể dẫn đến tình trạng tăng thông khí vô ý — việc sử dụng thông khí nhắm mục tiêu theo thể tích có thể tránh được điều này. PEEP cao quá mức sẽ gây ra căng phổi quá mức, kết hợp với chèn ép huyết động học và thở ra không hoàn toàn (VT thấp), dẫn đến tăng CO2 máu.
Khi bệnh phổi của bệnh nhân tổn thương, dấu hiệu những thay đổi về độ giãn nở và sức cản đường thở sẽ xảy ra. Vì vậy, sự phù hợp của tất cả các cài đặt cần phải được đánh giá lại thường xuyên. Ví dụ, một PEEP 6 hoặc 7 cmH2O, sẽ thích hợp sớm trong quá trình RDS khi phổi cứng, trở nên quá cao khi độ giãn nở cải thiện và tăng thể tích phổi. Yêu cầu oxy là công cụ đầu giường tốt nhất để đánh giá mức độ phù hợp của thể tích phổi.
Cai máy
Với SIMV, việc cai máy được thực hiện bằng cách giảm PIP cũng như tần số thở. Nói chung, tần số không nên giảm nhiều cho đến khi PIP được giảm xuống các giá trị tương đối thấp (<16–18 cmH2O) cho thấy sự cải thiện đáng kể khả năng độ giãn nở phổi. Cai tần số thở máy trong khi phổi vẫn còn khá cứng có khả năng áp đặt một công thở cao. Nó có thể yêu cầu VT quá lớn cho nhịp thở của máy để bù đắp cho nhịp thở tự phát không hiệu quả do thông khí khoảng chết giải phẫu. Tần số không nên giảm xuống < 10 nhịp/phút, đặc biệt là ở trẻ nhỏ, vì công thở cao liên quan đến các ETT nhỏ. Một lần nữa, việc bổ sung PSV vào SIMV có thể bù đắp cho những vấn đề này và được khuyến khích nếu máy thở có khả năng. Theo quy định, trẻ sơ sinh có khả năng tạo đủ VT và trao đổi khí với PIP 15–18 cmH2O và tỷ lệ mười nhịp thở mỗi phút đã sẵn sàng để rút ống.
Với A/C và PSV, trẻ sơ sinh điều khiển tốc độ thở máy; do đó, giảm tốc độ cài đặt, chỉ hoạt động như một bản sao lưu trong trường hợp ngưng thở, có ít tác động. Việc cai máy được thực hiện bằng cách giảm PIP, giúp giảm lượng hỗ trợ cho mỗi nhịp thở. Điều này dần dần chuyển giao WOB cho trẻ sơ sinh. Khi PIP giảm xuống còn 10–14 cmH2O ở trẻ non tháng và 15–20 cmH2O ở trẻ lớn hơn, những trẻ này thường sẵn sàng rút ống. Ở trẻ nhỏ, những áp lực thấp này chỉ phục vụ cho việc vượt qua sức đề kháng gia tăng của ETT. Ở những trẻ rất non tháng, thích hợp để giảm tần số dự phòng xuống 15-20 nhịp mỗi phút trong vài giờ trước khi rút ống để phát hiện ra không có nỗ lực hô hấp, không thở/thở định kỳ mà tần số dự phòng cao hơn có thể che mất hiệu quả.
Thông khí theo mục tiêu thể tích
Bởi vì VG là phương thức được sử dụng rộng rãi nhất và được nghiên cứu tốt nhất về thông khí nhắm mục tiêu theo thể tích và vì đó là kỹ thuật mà tôi có kinh nghiệm lâm sàng sâu rộng, các hướng dẫn lâm sàng được cung cấp cụ thể cho phương thức này. Mặc dù các chế độ thông khí nhắm mục tiêu theo thể tích có một số đặc điểm nhất định, nhưng mỗi thiết bị sẽ khác nhau và có thể phản ứng với những nhiễu loạn theo một cách khác. Tham khảo tài liệu sản phẩm của từng nhà sản xuất để có hướng dẫn lâm sàng cụ thể cho máy thở tương ứng của họ.
Bắt đầu
- Cần thực hiện càng sớm càng tốt sau khi bắt đầu thở máy bởi vì đây là thời điểm những thay đổi nhanh nhất trong cơ học phổi có thể xảy ra.
- VT mục tiêu bắt đầu thông thường cho hầu hết trẻ sơ sinh là 4–5 mL/kg trong giai đoạn cấp tính của bệnh. Trẻ sơ sinh có MAS có thể cần VT lớn hơn một chút (5-6 ml/kg) do khoảng chết phế nang lớn hơn.
- Khoảng chết thêm của cảm biến lưu lượng trở nên có ý nghĩa hơn ở trẻ nhỏ nhất. Vì lý do này, trẻ sơ sinh rất nhẹ cân < 700 g cần VT từ 5,5-6 ml/kg. Tuy nhiên, hiệu quả không đủ lớn để loại trừ việc sử dụng thông khí được đồng bộ hóa hoặc được nhắm mục tiêu theo thể tích.[36]
- Cần thể tích khí lưu thông lớn hơn (6-8 mL /kg) ở trẻ lớn hơn bị bệnh phổi mãn do tăng khoảng chết giải phẫu và sinh lý (đường hô hấp lớn bị giãn ra và thông khí lãng phí do không phù hợp thông khí – tưới máu kém).
- PIP nên được đặt cao hơn khoảng 20 phần trăm so với áp lực làm việc (PIP hiện tại cần để cung cấp VT mục tiêu) để cung cấp cho máy thở đủ khoảng rộng để điều chỉnh PIP.
- Không chỉ ghi lại giới hạn PIP, mà còn là áp lực làm việc, đó là sự phản ánh thực sự về mức độ hỗ trợ mà trẻ sơ sinh đang nhận được.
Điều chỉnh tiếp theo
- Điều chỉnh tiếp theo đối với VT mục tiêu có thể được thực hiện dựa trên PaCO2, mặc dù điều chỉnh hiếm khi cần thiết. Mức tăng thông thường là 0,5 mL/kg.
- Giới hạn PIP cần phải được điều chỉnh theo thời gian (mức tăng thông thường là 2-4 cmH2O) để giữ giới hạn PIP đủ gần với áp lực làm việc để tránh VT cao nguy hiểm và đồng thời đủ cao để tránh báo động thường xuyên. Ở hầu hết trẻ sơ sinh, giữ áp lực giới hạn áp lực làm việc trung bình trên 4–6 cmH2O là thích hợp.
- Lưu ý: Áp lực làm việc sẽ mặc định giới hạn PIP nếu cảm biến lưu lượng được tạm thời loại bỏ (chẳng hạn như khoảng thời gian dùng surfactant hoặc phân phối thuốc khí dung), nếu chức năng của nó bị ảnh hưởng bởi đàm nhớt hoặc chất hoạt động bề mặt, hoặc nếu nó bị trục trặc vì lý do nào. Thì hít vào bằng tay (manual inspiration) cũng sử dụng giới hạn PIP đã đặt. Lý tưởng nhất là khi loại bỏ cảm biến lưu lượng trong một khoảng thời gian quan trọng, chẳng hạn như khi sử dụng thuốc khí dung, điều chỉnh giới hạn PIP gần với áp lực làm việc trung bình hoặc gần đây. Để tránh volutrauma, giữ giới hạn PIP gần với PIP thực tế (~ 5–10 cmH2O).
- Nếu trẻ có vẻ bị kích thích, với các đợt tăng thông khí tự phát, hãy xem xét sự an thần nhẹ. (Tuy nhiên, tránh quá mức an thần, với sự ức chế hoàn toàn của nỗ lực hô hấp)
- Trẻ sơ sinh thở nhanh hoặc thở trên mức VT đã đặt liên tục, bé sẽ tốn công thở quá mức. Xem xét tăng mục tiêu VT ngay cả khi PaCO2 và pH là bình thường. (Tuy nhiên, nếu PaCO2 thấp và tần số thở cao, có thể chỉ định thuốc an thần.)
- Nếu báo động VT thấp nhiều lần, hãy tăng giới hạn áp lực để cho phép thiết bị đạt được VT mong muốn. Báo động lặp đi lặp lại cho thấy đã có sự thay đổi về cơ học phổi hoặc nỗ lực hô hấp của bệnh nhân (ví dụ, xẹp phổi, tràn khí màng phổi, phù phổi, ETT đi sâu vào phế quản chính bên phải). Hệ thống cảnh báo sớm này là một lợi ích quan trọng của chế độ VG và không nên bỏ qua.
- Nếu giới hạn áp lực cần phải tăng lên đáng kể và/hoặc nhiều lần, hãy xác minh rằng phép đo VT là chính xác (đánh giá mức nâng ngực lên, kết quả khí máu). Nếu có, tìm nguyên nhân của sự thay đổi trong cơ học phổi (kiểm tra bệnh nhân, xác minh vị trí ETT, chụp x-quang ngực).
Cai máy
- Khi VT mục tiêu được đặt ở mức thấp nhất của dải bình thường (thường là 4 mL/kg trong giai đoạn cấp tính, 1-2 mL/kg cao hơn ở trẻ BPD) và PaCO2 được phép tăng lên mức thấp đến trung bình nằm trong khoảng 40s, cai máy tự động diễn ra (“tự cai máy”).
- Nếu VT được đặt quá cao và/hoặc PaCO2 quá thấp, em bé sẽ không điều khiển trung tâm hô hấp và sẽ không tự cai máy. Thay vào đó, việc thiếu huấn luyện cơ hô hấp sẽ khiến bé trở nên lệ thuộc vào máy thở.
- Tránh quá mức an thần trong giai đoạn cai máy.
- Nếu trẻ sơ sinh dường như không cai máy như mong đợi, mặc dù cải thiện bệnh phổi, hãy thử giảm VT xuống 3,5 mL/kg, miễn là khí máu của trẻ sơ sinh đầy đủ và WOB không xuất hiện quá mức. Tuy nhiên, hãy nhớ rằng trẻ sơ sinh mắc bệnh phổi mãn cần VT tương đối lớn hơn. Giảm VT bên dưới nhu cầu sinh lý của trẻ sẽ dẫn đến tăng công thở quá mức vì trẻ sơ sinh sẽ phải thở qua ETT với ít hoặc không có hỗ trợ từ máy thở.
- Nếu một yêu cầu oxy đáng kể vẫn tồn tại, có thể cần phải tăng PEEP để duy trì áp lực đường thở trung bình khi PIP tự động hạ xuống.
- Hầu hết trẻ sơ sinh có thể được rút ống khi chúng duy trì VT ở mức trên hoặc cao hơn giá trị đích với PIP < 10–12 cmH2O (< 12– 15 cmH2O ở trẻ > 1 kg) với FiO2 < 0,35 và nỗ lực hô hấp tốt.
- Quan sát hiển thị đồ họa của áp lực làm việc là hữu ích trong việc đánh giá cho kiểu thở chu kỳ (nỗ lực hô hấp dao động) có thể yêu cầu dùng thêm methylxanthine để tạo điều kiện rút ống.
Tóm lược
Nhiều phương thức và kỹ thuật mới có sẵn để điều trị suy hô hấp. Hiểu biết của chúng tôi về cách sử dụng các thiết bị này để có hiệu quả tốt nhất, trong khi ứng dụng vẫn còn chậm hơn tốc độ đổi mới công nghệ. Những cải thiện về kết quả, chẳng hạn như BPD, đang ngày càng trở thành khó khăn vì mỗi cải tiến thêm lại gây gia tăng tần suất bệnh hơn nhiều. Khi kết hợp với các chiến lược bảo vệ phổi khác nhằm tối ưu hóa thể tích phổi và đảm bảo phân phối thể tích khí lưu thông, thông khí nhắm mục tiêu thể tích dường như hy vọng sẽ tạo ra một tác động đáng kể đến việc giảm tổn thương phổi do máy thở gây ra. Tuy nhiên, tránh thông khí cơ học thông qua việc sử dụng sớm CPAP có hoặc không có sử dụng surfactant vẫn có thể là cách hiệu quả nhất để giảm nguy cơ mắc bệnh phổi mãn.