Nhiễm nấm xâm lấn là bệnh lý nhiễm trùng có tiên lượng nặng và tỷ lệ tử vong cao. Dự phòng và điều trị sớm bằng thuốc kháng nấm toàn thân có thể giúp cải thiện hiệu quả điều trị và giảm thiểu tỷ lệ tử vong. Quá trình phát triển các thuốc kháng nấm toàn thân bắt đầu từ những năm 1950, với sự ra đời của amphotericin B deoxycholat (Hình 1).[1] Trải qua 60 năm, việc phát triển thuốc kháng nấm toàn thân có những tiến bộ đáng kể nhưng số lượng thuốc được sử dụng trong điều trị vẫn tương đối hạn chế, với chỉ 10 hoạt chất thuộc 4 nhóm thuốc, bao gồm nhóm azol (fluconazol, itraconazol, voriconazol, posaconazol và isavuconazol), nhóm polyen (amphotericin B), nhóm echinocandin (caspofungin, anidulafungin và micafungin) và nhóm ức chế tổng hợp thymidylat (flucytosin). Mỗi loại thuốc đều có cơ chế, phổ tác dụng, tính hiệu quả và độ an toàn khác nhau. Vì vậy, việc nắm vững về các đặc điểm quan trọng về dược lý lâm sàng của các thuốc này sẽ giúp các bác sĩ và dược sĩ cân nhắc lựa chọn và sử dụng phù hợp các thuốc kháng nấm trong thực hành lâm sàng. Bài viết này tập trung làm rõ các thông tin về cơ chế tác dụng, phổ kháng nấm, tình hình đề kháng, đặc điểm dược động học cũng như độc tính và tương tác của các thuốc điều trị nhiễm nấm xâm lấn phổ biến hiện nay.
CƠ CHẾ TÁC DỤNG VÀ PHỔ KHÁNG NẤM
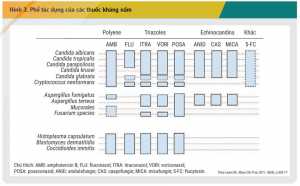
Các thuốc điều trị nhiễm nấm xâm lấn, nhìn chung, có thể phân biệt với nhau dựa trên vị trí tác dụng trên tế bào vi nấm gây bệnh. Vị trí tác dụng của các thuốc kháng nấm được mô tả khái quát trong Hình 2. [1] Cơ chế của các nhóm thuốc kháng nấm khác nhau dẫn đến phổ tác dụng cũng khác nhau trên các chủng nấm. Sơ đồ biểu diễn phổ tác dụng của các thuốc kháng nấm được thể hiện trong Hình 3. [2] Cụ thể, các azol có hoạt tính kháng nấm bằng cách ức chế ức chế CYP450 14α-demethylase của nấm, dẫn đến giảm tổng hợp ergosterol, ngăn chặn tổng hợp màng tế bào nấm và có tác dụng kìm nấm. Các azol chỉ có ái lực cao với CYP450 của nấm và ít ảnh hưởng lên CYP450 ở người. Tuy nhiên, tác dụng chọn lọc này không hoàn toàn, dẫn đến các tương tác dược động học của nhóm azol thường có nguyên nhân do sự ức chế CYP450 ở người. Khác biệt về ái lực của các azol với đích 14α-demethylase của tế bào nấm dẫn đến phổ kháng nấm của các thuốc trong nhóm khác nhau.[2] Fluconazol là đại diện đầu tiên trong nhóm azol với phổ tác dụng hẹp, chủ yếu trên một số chủng Candida và Cryptococcus và không có tác dụng trên các chủng nấm sợi. Vì vậy, chỉ định của fluconazol chỉ giới hạn trong điều trị và dự phòng nhiễm nấm Candida xâm lấn. Trong khi đó, itraconazol, voriconazol và posaconazol là các azol phổ rộng với khả năng tác dụng trên hầu hết các chủng nấm.[11] Do đó, bên cạnh vai trò trong điều trị Candida xâm lấn, chỉ định của các thuốc này còn được mở rộng sang nhiễm nấm Aspergilus. Trong đó, voriconazol được khuyến cáo là liệu pháp ưu tiên, còn posaconazol và itraconazol là liệu pháp thay thế trong điều trị nhiễm nấm Aspergilus xâm lấn.[3]

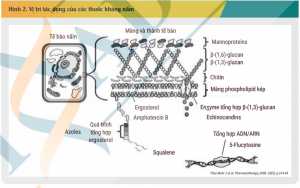
Ngoài nhóm azol, amphotericin B cũng có đích tác dụng trên màng tế bào nấm. Trong đó, amphotericin B gắn vào ergosterol ở màng tế bào nấm, làm rò rỉ các thành phần tế bào nấm và có tác dụng diệt nấm hoặc kìm nấm phụ thuộc số lượng nấm và nồng độ thuốc.22 Amphotericin B là một trong những thuốc kháng nấm có phổ tác dụng rộng nhất hiện nay, thể hiện hoạt tính chống lại phần lớn các loại nấm men, nấm sợi và lưỡng tính. Vì vậy, mặc dù ra đời từ năm 1958, đến nay, amphotericin B vẫn được khuyến cáo trong điều trị nhiễm nấm Candida và Aspergillus xâm lấn nặng. Tuy nhiên, do nguy cơ gặp độc tính nghiêm trọng của thuốc và sự ra đời của nhiều thuốc kháng nấm mới an toàn hơn, việc sử dụng amphotericin B dạng quy ước bị giới hạn chỉ ở những bệnh nhân không dùng được các thuốc kháng nấm khác.[3,4]
Trong các thuốc kháng nấm hiện nay, nhóm echinocandin là các thuốc duy nhất tác dụng trên vách tế bào vi nấm bằng cách ức chế tổng hợp β (1,3)-D-glucan – thành phần thiết yếu trong vách tế bào của một số loài nấm. Sự khác nhau trong thành phần glucan trong thành tế bào của các loại nấm ảnh hưởng đến phổ kháng nấm của nhóm này, trong đó, các echinocandin có tác dụng diệt nấm đối với Candida spp. nhưng lại chỉ có tác dụng kìm nấm với Aspergilus spp.[2] Do đó, nhóm echinocandin hiện đang được khuyến cáo là liệu pháp ưu tiên trong điều trị nhiễm nấm Candida máu.[4] Với nhiễm nấm Aspergilus, nhóm thuốc này chỉ là liệu pháp điều trị thay thế.[3]
Khác với các thuốc chống nấm khác, flucytosin có đích tác dụng nằm trong tế bào nấm. Flucytosin gắn chọn lọc với hai enzym đặc hiệu ở nấm là cytosine permease và cytosine deaminase và được chuyển hóa thành 5- fluorouracil, chất này ức chế tổng hợp thymidylate synthase, từ đó, gây ức chế quá trình tổng hợp RNA. Flucytosin có phổ kháng nấm hẹp nhất trong các thuốc kháng nấm toàn thân, chỉ tác dụng trên các chủng nấm men và cần sử dụng phối hợp với các thuốc khác để phòng tránh đề kháng.[2]
CƠ CHẾ VÀ TÌNH HÌNH ĐỀ KHÁNG
Việc sử dụng rộng rãi các thuốc kháng nấm toàn thân làm gia tăng đề kháng kháng nấm trong khi số lượng loại thuốc hiện có rất hạn chế. Các nghiên cứu dịch tễ cho thấy, tỷ lệ đáng kể các chủng Candida và Aspergilus đề kháng với azol nhưng ít gặp đề kháng với các chủng Cyprotococcus. Candida và Aspergilus spp. đề kháng azol theo nhiều cơ chế khác nhau nhưng phần lớn liên quan đến thay đổi biểu hiện gen tại đích tác dụng, bao gồm gen mã hóa bơm tống thuốc hoặc gen mã hóa cho enzym lanosterol C14α-demethylase.[5] Trên thế giới, tỷ lệ đề kháng azol của các chủng Candida xâm lấn thường gặp hiện còn thấp (1,0 – 2,1% với C. albicans, 0,4 – 4,2% với C. parasilosis, 1,4 – 6,6% với C. tropicalis), ngoại trừ C. glabrata với tỷ lệ 7 – 12%.[6] Đáng lưu ý, hiện nay có sự gia tăng đề kháng fluconazol ở các chủng Candida non-albicans. Chương trình giám sát thuốc kháng nấm toàn cầu SENTRY tổng kết dữ liệu trong 20 năm cho thấy, tỷ lệ C. albicans đề kháng fluconazol chỉ là 0,3% và ít có thay đổi trong suốt thời gian trên. Trong khi đó, tỷ lệ đề kháng của C. glabrata (8,6 – 10,1%) và C. tropicalis (2,5 – 4,9%) tăng đáng kể trong giai đoạn 1997 – 2014 và chỉ giảm nhẹ vào năm 2015 – 2016 khi nhóm echinocandin được sử dụng rộng rãi hơn so với fluconazol.[7]
Do khác nhau về cơ chế tác dụng, nhóm echinocandin vẫn phát huy được tác dụng trên nhiều chủng Candida đề kháng với fluconazol hoặc các azol khác. Tuy nhiên, đề kháng echinocandin vẫn có thể xảy ra mặc dù tỷ lệ còn thấp. Đề kháng echinocandin thường liên quan đến đột biến gen mã hóa cho tiểu đơn vị xúc tác glucan synthase. Đáng lưu ý, có khoảng 11% nhiễm nấm máu do C. glabrata đề kháng với fluconazol cũng kháng lại cả thuốc nhóm echinocandin. Ngoài C. glabrata, C. auris cũng là một tác nhân đáng quan ngại do khả năng đề kháng được nhiều loại thuốc kháng nấm.[8] Rõ ràng, tình hình đề kháng của Candida spp. và Aspergilus spp. với nhóm azol cũng như sự xuất hiện các chủng Candida kháng đa thuốc đang là thách thức lớn trong điều trị nhiễm nấm xâm lấn. Điều này cũng cho thấy tầm quan trọng của việc xác định dịch tễ đề kháng, từ đó, giúp bác sĩ lựa chọn thuốc phù hợp, giảm thiểu hậu quả bất lợi trên lâm sàng hoặc thất bại điều trị.
Đề kháng của các chủng Candida với amphotericin B rất hiếm gặp, trong khi đó, có khoảng 11,5% các chủng A. fumigatus được đề kháng với thuốc này được xác định theo điểm gãy nhạy cảm của EUCAST (≤ 1 μg/mL).[6] Đề kháng với amphotericin B của Candida thường liên quan đến đột biến các gen tham gia tổng hợp ergosterol ở màng tế bào nấm.[5] Nhìn chung, hiện nay, tỷ lệ đề kháng của amphotericin B cũng như nhóm echinocandin còn thấp. Tuy nhiên, không loại trừ được khả năng việc gia tăng áp lực sử dụng các thuốc kháng nấm dự trữ này có thể tiềm tàng nguy cơ xuất hiện kháng thuốc trong tương lai.
ĐẶC ĐIỂM DƯỢC ĐỘNG HỌC
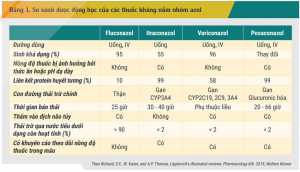
Bên cạnh phổ tác dụng và nguy cơ đề kháng, các đặc điểm dược động học cũng là yếu tố quan trọng cần cân nhắc trong lựa chọn thuốc kháng nấm do suy giảm chức năng gan, thận hoặc thay đổi pH dạ dày đều ảnh hưởng đáng kể đến hiệu quả và an toàn của các thuốc kháng nấm. Nhóm azol hấp thu được qua đường tiêu hóa nên có thể dùng đường uống, tuy nhiên, khả năng hấp thu giữa các thuốc rất khác nhau. Itraconazol (dạng viên nang) và posaconazol (dạng hỗn dịch) cần thời gian để hòa tan trong dịch vị dạ dày, do đó, nên được sử dụng trong bữa ăn.[2] Hấp thu của các thuốc này còn bị thay đổi bởi pH dạ dày nên cần quan tâm đến tương tác với các thuốc ức chế bài tiết acid hoặc trung hòa acid dịch vị như antacid, kháng H2 hay thuốc ức chế bơm proton.[2,19] Ở chuyển hóa và thải trừ, cũng có sự khác biệt giữa các dẫn chất azol trong nhóm. Itraconazol chuyển hóa mạnh qua CYP3A4 trong khi voriconazol chuyển hóa mạnh qua CYP2C19 nên có nguy cơ tương tác với rất nhiều thuốc ức chế và cảm ứng enzym này.[2] Fluconazol chuyển hóa ít ở gan và thải trừ chủ yếu qua nước tiểu nên thuốc được lựa chọn ưu tiên trong điều trị nhiễm nấm Candida tiết niệu nhưng cần lưu ý hiệu chỉnh liều thuốc phù hợp ở bệnh nhân suy thận.[4] Trong khi đó, hầu hết các thuốc kháng nấm azol phổ rộng không hoặc ít thải trừ ở dạng còn hoạt tính qua thận nên không có vai trò trong điều trị Candida đường tiết niệu.[4] Bảng 1 so sánh đặc điểm dược động học quan trọng giữa các thuốc kháng nấm nhóm azol.[9]
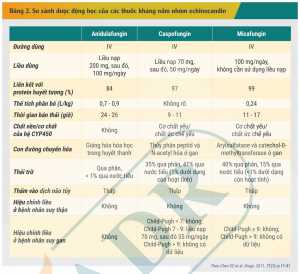
Khác với nhóm azol, đặc tính dược động học giữa các thuốc trong nhóm echinocandin khá tương tự nhau. Các dẫn chất echinocandin hấp thu kém qua đường tiêu hóa nên phải dùng đường truyền tĩnh mạch. Các thuốc này đều có thời gian bán thải kéo dài nên chỉ cần sử dụng thuốc 1 lần trong ngày. Sự khác biệt chủ yếu giữa các thuốc trong nhóm là sự khác nhau về con đường chuyển hóa, chế độ liều nạp và yêu cầu hiệu chỉnh liều ở bệnh nhân suy gan. Micafungin không cần sử dụng liều nạp, trong khi đó, anidulafungin và caspofungin cần sử dụng chế độ liều nạp để nhanh chóng đạt nồng độ ổn định trong huyết thanh vượt qua nồng độ đích cần đạt.[10,11,12] Các dẫn chất echinocandin ít chuyển hóa qua hệ enzym gan CYP450. Tuy nhiên, caspofungin và micafungin vẫn được chuyển hóa qua gan bằng những con đường khác nhau, vì vậy, cần lưu ý hiệu chỉnh liều của caspofungin cho bệnh nhân rối loạn chức năng gan và tránh dùng micafungin ở bệnh nhân suy gan nặng do chưa có đầy đủ dữ liệu ở đối tượng bệnh nhân này[11,19]. Bảng 2 so sánh đặc điểm dược động học quan trọng giữa các thuốc kháng nấm nhóm echinocandin.[12]
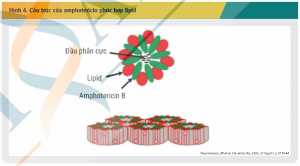
Amphotericin B là đại diện duy nhất trong nhóm polyen, tuy nhiên, amphotericin B lại có nhiều dạng bào chế khác nhau, với đặc điểm dược động học khác biệt. Bên cạnh amphotericin B deoxycholat (dạng bào chế quy ước), có ba dạng bào chế lipid của hoạt chất này, bao gồm: amphotericin B deoxycholat hệ phân tán keo (ABCD); amphotericin B liposom (L-AMB) và amphotericin B phức hợp lipid (ABLC), trong đó, chỉ có amphotericin B phức hợp lipid là dạng bào chế lipid duy nhất của amphotericin B có mặt tại Việt Nam. Amphotericin B phức hợp lipid là phức hợp 1:1 của amphotericin B và hai phospholipid (dimyristoylphosphatidylcholine và dimyristoylphosphatidyl-glycerol theo tỷ lệ 7:3) có cấu trúc hình dải (Hình 4). [13]
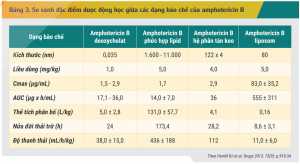
Đặc điểm dược động học của các dạng bào chế lipid của amphotericin B khác nhau và khác biệt đáng kể so với dạng quy ước (Bảng 3).[14] Đáng lưu ý, amphotericin B deoxycholat được thải trừ chậm qua thận, với 2 – 5% ở dạng còn hoạt tính nên có thể sử dụng trong điều trị nhiễm nấm Candida tiết niệu.[4] Ngược lại, các dạng bào chế lipid của amphotericin B đều không thải trừ qua con đường này dẫn đến không có vai trò trong điều trị nấm Candida tiết niệu.[2] Tuy nhiên, đây cũng là ưu điểm nổi bật của các dạng bào chế lipid của amphotericin B. Nhờ giảm phân bố amphotericin B đến thận, độc tính trên thận điển hình của amphotericin B dạng quy ước giảm đáng kể khi chuyển sang dạng bào chế lipid.[11] Mặt khác, nhờ có kích thước phân tử lớn, amphotericin B phức hợp lipid bị hấp thu nhanh chóng vào hệ thống lưới nội mô dẫn đến nồng độ thuốc trong mô cao nhưng nồng độ trong huyết thanh lại thấp, làm tăng thời gian bán thải kéo dài và thể tích phân bố so với amphotericin B dạng quy ước.[14]
Tương tự các thuốc kháng sinh, dựa trên đặc điểm dược động học và dược lực học (PK/PD), các thuốc kháng nấm được chia thành ba nhóm phụ thuộc thời gian (thông số PK/PD đặc trưng là T>MIC), phụ thuộc nồng độ (thông số PK/PD đặc trưng là Cpeak/MIC) và phụ thuộc vào tổng lượng thuốc vào cơ thể (thông số PK/PD đặc trưng là AUC/MIC). Với nhóm echinocandin và nhóm polyen, do thời gian hậu kháng nấm dài nên thông số đặc trưng là Cpeak/MIC và chỉ cần sử dụng 1 lần/ngày. Nhóm azol cũng thể hiện tác dụng hậu kháng nấm kéo dài nhưng các nghiên cứu PK/PD không cho thấy vai trò rõ rệt về nồng độ thuốc đối với hiệu lực tác dụng. Thông số PK/PD đặc trưng của nhóm azol là AUC/MIC. Với thời gian hậu kháng nấm ngắn, flucytosin đòi hỏi duy trì nồng độ trên MIC để đạt hiệu quả, do đó, thuốc có đặc tính phụ thuộc thời gian và thông số đặc trưng là T>MIC.[2]
ĐỘC TÍNH
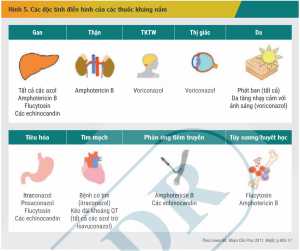
Độ an toàn trước đây là yếu tố quan trọng làm giới hạn việc sử dụng các thuốc kháng nấm toàn thân. Gần đây, độ an toàn của các thuốc kháng nấm mới được cải thiện đáng kể nhưng độc tính khi sử dụng thuốc kéo dài vẫn là một vấn đề cần lưu ý trên lâm sàng. Độc tính của các nhóm thuốc kháng nấm ảnh hưởng đến các hệ cơ quan khác nhau trên cơ thể đươc mô phỏng trong Hình 5.[2]
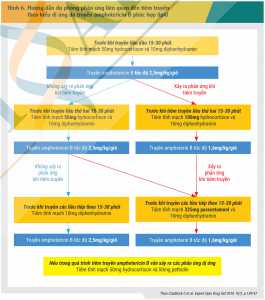
Amphotericin B là thuốc kháng nấm có hoạt tính mạnh nhưng việc sử dụng amphotericin B deoxycholat bị hạn chế do tác dụng không mong muốn của thuốc, điển hình là phản ứng liên quan đến tiêm truyền theo kiểu dị ứng và độc tính trên thận. Nguy cơ độc độc tính trên thận phụ thuộc liều và tăng lên theo tổng liều tích lũy. Truyền tĩnh mạch NaCl 0,9% được cho là biện pháp giúp giảm độc tính này. Độc tính trên thận do amphotericin B thường dẫn đến rối loạn điện giải xảy ra trong hoặc sau vài tuần.[15] Một tổng quan hệ thống gồm 23 thử nghiệm lâm sàng ngẫu nhiên có đối chứng, với tổng số 2677 bệnh nhân được đưa vào phân tích, cho thấy, tỷ lệ xuất hiện độc tính trên thận khi sử dụng amphotericin dạng quy ước trong khoảng 12 – 50% và giảm đi gần một nửa khi chuyển sang dạng bào chế lipid (9 – 25%).[16] Phản ứng liên quan đến tiêm truyền (sốt, rét run, đau đầu, đau khớp, nôn, buồn nôn và tụt huyết áp) vẫn có thể xảy ra với dạng bào chế lipid nhưng có tỷ lệ thấp hơn đáng kể so với dạng quy ước.[15] Phản ứng này có thể dự phòng bằng cách sử dụng paracetamol/NSAIDs, các thuốc kháng histamin hoặc corticosteroid. Hình 6 mô tả hướng dẫn dự phòng phản ứng dị ứng do tiêm truyền amphotericin B phức hợp lipid.[17] Trong khi không có sự khác biệt về hiệu quả lâm sàng giữa các dạng bào chế của amphotericin B, rõ ràng, việc sử dụng dạng bào chế lipid là giải pháp an toàn hơn cho bệnh nhân, đặc biệt trong một số tình trạng lâm sàng được liệt kê trong Bảng 4 [2].
| Bảng 4. Các tình trạng lâm sàng cần cân nhắc ưu tiên sử dụng amphotericin B dạng phức hợp lipid |
|
| Bảng 5. Các thuốc có độc tính trực tiếp trên thận |
|
TƯƠNG TÁC THUỐC
Trong các thuốc kháng nấm, tương tác liên quan đến các dẫn chất azol cần chú ý nhất. Các azol đều là cơ chất hoặc chất ức chế nhiều enzym CYP450 ở gan và tiềm tàng nguy cơ cao xuất hiện tương tác. Ái lực của các thuốc với các isozym (CYP3A4, CYP2C9, CYP2C19) khác nhau dẫn đến khác biệt về khả năng tương tác giữa các thuốc trong nhóm.[11] Như đã đề cập ở trên, sự hấp thu của viên nang itraconazol và hỗn dịch posaconazol tối ưu trong môi trường acid, vì vậy, nên tránh sử dụng các thuốc ức chế acid (antacid, thuốc ức chế bơm proton hoặc thuốc kháng H2) đồng thời với các thuốc này. Các dẫn chất azol, ngoại trừ isavuconazol, có thể gây kéo dài khoảng QT do đó cần lưu ý tương tác dược lực học hiệp đồng với các thuốc khác cùng nguy cơ này để tránh hậu quả loạn nhịp thất và xoắn đỉnh. Các thuốc chống chỉ định phối hợp với thuốc kháng nấm nhóm azol được trình bày trong Bảng 6. [19,20].
| Bảng 6. Các tương tác chống chỉ định của các thuốc kháng nấm nhóm azol | |||
| Fluconazol | Itraconazol | Voriconazol | Posaconazol |
|
|
|
|
TÓM LẠI
Nhiễm nấm xâm lấn có xu hướng gia tăng trong thời gian gần đây nhưng sự phát triển của các thuốc kháng nấm mới đã giúp cải thiện đáng kể tình hình điều trị bệnh lý này. Mỗi thuốc kháng nấm đều có đặc điểm dược động học, cơ chế và phổ tác dụng khác biệt đem lại những lựa chọn điều trị khác nhau cho bác sĩ. Tuy nhiên, số lượng thuốc kháng nấm toàn thân tương đối hạn chế, sự xuất hiện đề kháng kháng nấm, độc tính và tương tác thuốc là những vấn đề khác cần lưu ý để nâng cao hiệu quả điều trị và đảm bảo an toàn cho bệnh nhân. Bài viết trên đã tổng kết những đặc điểm dược lý lâm sàng quan trọng nhất của các thuốc kháng nấm toàn thân, giúp các bác sĩ và dược sĩ cân nhắc lựa chọn và sử dụng phù hợp các thuốc này trong thực hành lâm sàng.