Bài viết Hình ảnh trong hội chứng suy hô hấp cấp tính được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Imaging in acute respiratory distress syndrome
Tóm tắt
Mục đích: Hình ảnh ngày càng trở nên quan trọng trên các chuyên khoa y khoa với mục đích chẩn đoán, theo dõi và điều trị trong hội chứng suy hô hấp cấp tính (ARDS).
Phương pháp: Tổng quan này đề cập đến việc sử dụng các kỹ thuật hình ảnh để chẩn đoán và quản lý ARDS cũng như có được kiến thức về sinh bệnh học và sinh lý bệnh của nó. Các kỹ thuật được mô tả trong bài viết này là chụp cắt lớp vi tính, chụp cắt lớp phát xạ positron và hai kỹ thuật hình ảnh có thể truy cập dễ dàng có sẵn tại tại giường là siêu âm và chụp cắt lớp trở kháng điện (EIT).
Kết quả: Việc sử dụng chụp cắt lớp điện toán đã cung cấp những hiểu biết mới về sinh lý bệnh ARDS, chứng minh rằng ARDS không ảnh hưởng đồng nhất đến nhu mô phổi và mức độ nặng của tổn thương phổi được phân bố rộng trong dân số ARDS. Chụp cắt lớp phát xạ Positron là một kỹ thuật hình ảnh chức năng có giá trị nằm trong việc bổ sung những hiểu biết gia tăng cho hình ảnh hình thái. Nó có thể định lượng tưới máu khu vực, thông khí, sục khí, tính thấm của mạch máu phổi, phù và viêm. Siêu âm phổi và EIT là các công cụ không xâm lấn, không có bức xạ có sẵn tại giường. Siêu âm phổi có thể cung cấp thông tin hữu ích về chẩn đoán ARDS khi chụp X-quang hoặc CT scan không có sẵn. EIT là một công cụ hữu ích để theo dõi thông khí phổi và đánh giá sự phân phối tưới máu khu vực.
Kết luận: Tương lai của hình ảnh trong chăm sóc tích cực có thể sẽ phát triển theo hai hướng chính: kỹ thuật hình ảnh dễ tiếp cận có thể được sử dụng tại giường và phương pháp hình ảnh tinh vi sẽ được sử dụng để hỗ trợ trong các trường hợp chẩn đoán khó khăn hoặc nâng cao hiểu biết của chúng tôi về sinh bệnh học và sinh lý bệnh của một loạt các bệnh hiểm nghèo.
Giới thiệu
Hội chứng suy hô hấp cấp tính (ARDS) đã được giới thiệu lần đầu tiên cách đây 50 năm và nhiều định nghĩa đã được đề xuất theo thời gian, cho đến khi có định nghĩa Berlin. Tuy nhiên, các thông tin mặc dù hạn chế nhưng có sẵn về dịch tễ học, nhận biết, quản lý và kết cục của bệnh nhân. Các phát hiện gần đây cho thấy ARDS đại diện cho 10,4% bệnh nhân nhập khoa ICU và 60,2% tất cả bệnh nhân mắc ARDS được bác sĩ lâm sàng nhận biết, cho thấy tiềm năng cải thiện chẩn đoán và quản lý [1]. Trong bối cảnh này, kỹ thuật hình ảnh có thể là công cụ hữu ích. Trên thực tế, hình ảnh trong chăm sóc tích cực ngày càng trở nên quan trọng: một số kỹ thuật như siêu âm và chụp cắt lớp trở kháng điện được sử dụng tại giường, trong khi các phương pháp chẩn đoán hình ảnh khác hữu ích trong các trường hợp chẩn đoán khó khăn hoặc giúp chúng ta hiểu hơn về một mảng bệnh hiểm nghèo. Bài viết đánh giá này đề cập đến cả hai lĩnh vực này liên quan đến ARDS.
CT scan trong ARDS
Lịch sử
Việc sử dụng chụp cắt lớp vi tính (CT) trong ARDS lần đầu tiên được báo cáo bởi Rommelsheim vào năm 1983 [2]. Bài viết này mô tả sự phân bố từ lưng – đến trung tâm (dorso-central distribution) của mật độ phổi được quan sát đặc biệt là trong giai đoạn phù nề của hội chứng này. Thật không may, bài báo cáo này (bằng tiếng Đức) đã bị cộng đồng khoa học bỏ qua. Hai bài báo sau [3, 4], được xuất bản độc lập vào tháng 4 năm 1986, đã thay đổi tầm nhìn của chúng tôi về ARDS. Họ đã chỉ ra rằng mật độ ARDS không phải đồng nhất lan tỏa giống như phim X ngực đã gợi ý, mà chủ yếu phân bố ở các vùng phổi phụ thuộc. Hơn nữa, nghiên cứu từ Milan đã cho thấy ứng dụng của CT trong cài đặt PEEP, nó cho thấy mật độ phổi giảm đáng kể ở một số bệnh nhân và không có thay đổi ở những người khác.
Phân tích CT scan định lượng
Hình ảnh do CT scan tạo ra bao gồm một ma trận pixel, mỗi pixel đại diện cho một yếu tố thể tích của mô (voxel). CT scan đo hệ số suy giảm (μ), tức là giảm cường độ bức xạ khi đi qua vật chất. Giá trị được gán cho mỗi voxel (μvoxel), tỷ lệ xấp xỉ với mật độ của nó và được biểu thị dưới dạng số CT được chuẩn hóa với nước (μwater):
CT = 1000 x [(μvoxel – μwater)] /μwater
Ví dụ, một voxel có số CT là −700 HU bao gồm 30% mô (giả sử mật độ mô là 1 g/cm3 ) và 70% khí. Từ mật độ, chúng tôi tính toán cả khí và thể tích mô của một vùng nhất định hoặc của toàn bộ phổi, xác định trạng thái sục khí (aeration) của nó, thay đổi từ mức xẹp (collapse) cho đến bơm phồng quá mức (hyperinflation).
Vì mật độ mô được coi là bằng với nước (tức là, 1 g/cm3 ) nên thể tích mô bằng trọng lượng mô.
Các khoang phổi ở các mức độ sục khí khác nhau, từ mô hoàn toàn không được sục khí (totally non- aerated) đến mô bơm phồng quá mức [5], có thể được xác định bằng cách phân tích phân phối tần số CT của tất cả các voxels có trong hình chụp phổi.
Sức mạnh phân biệt của CT scan là đáng chú ý. Máy quét CT hiện đại có thể thu được toàn bộ thể tích của ngực trong ít hơn một lần nín thở, cho ra kết quả một thể tích hình ảnh bao gồm các voxels là 1 khối với thể tích 0,216-0.343 mm³ . Thể tích của một acinus bình thường, bao gồm khoảng 2000 phế nang, là khoảng 16-22 mm³ ở mức dung tích cặn chức năng (FRC). Điều này ngụ ý rằng thể tích voxel gần bằng 1/100 thể tích acinus tại FRC, tức là, thể tích khoảng 20 phế nang.
Giao thức quét CT truyền thống hơn được giới thiệu đã sử dụng một đến ba trục hình ảnh để suy ra toàn bộ hành vi của phổi. Tuy nhiên, giao thức này đã bị nghi ngờ bởi vì nó ít đại diện cho toàn bộ phổi và không thể quét chính xác cấu trúc giải phẫu khi phổi “di chuyển” trên các cài đặt khác nhau [6]. Sự sẵn có của máy quét CT nhanh hơn cho phép quét CT liên tục toàn bộ phổi nhưng rất khó để quét lại toàn bộ bệnh nhân trong nhiều điều kiện xét nghiệm vì sự tiếp xúc với tia X. Một sự thỏa hiệp tốt đã được tìm thấy với phép ngoại suy từ mười phần CT ngực (ten thoracic CT sections), một phương pháp có thể làm giảm phơi nhiễm phóng xạ và rút ngắn thời gian cần thiết cho phân tích [7].
CT scan và cơ học phổi
CT scan liên tục cho thấy rằng thể tích khí của phổi ARDS giảm xuống chịu trách nhiệm chính cho các đặc tính cơ học của nó và độ giãn nở của phổi tỷ lệ thuận với phần phổi có thể thông khí còn lại [5]. Phần phổi mở càng nhỏ thì độ giãn nở càng thấp. Do đó, phổi nhỏ, thay vì cứng, như mô tả của nguyên bản [8]. Quan sát này đã dẫn đến khái niệm về “phổi em bé” (“baby lung”), góp phần giải thích tác hại có thể của thở máy trong ARDS. Trong những năm qua, khái niệm về “phổi em bé” đã phát triển [9], nhưng khái niệm chính vẫn còn hiệu lực: một thể tích khí lưu thông bình thường của một em bé nhỏ được cài đặt cho bệnh nhân ARDS người lớn có thể gây ra các biến dạng mô trên mức sinh lý và gây ra tổn thương. Hơn nữa, bơm phồng quá mức (được định nghĩa là sự hiện diện của voxels với mật độ từ − 1000 đến −900 HU) có ở những bệnh nhân ARDS nặng được đặc trưng bởi các khoang không có sục khí lớn (large non-aerated compartments) ngay cả khi đang thông khí 6 ml/kg [10].
CT scan và huy động
Sự sụp đổ khoang khí (airspace) trong ARDS chủ yếu là kết quả của sự gia tăng áp lực chồng lên (superimposed pressure) do sự xuất hiện của phù [11]. Việc đánh giá khả năng huy động của phổi bị sụp đổ có liên quan để chọn mức PEEP phù hợp. Trên thực tế, cả nghiên cứu sinh lý [12, 13] và phân tích tổng hợp trên bệnh nhân từ các thử nghiệm PEEP lớn [14] đều cho rằng những bệnh nhân mắc ARDS nặng có thể được hưởng lợi từ mức PEEP cao hơn. Một số phương pháp đã được sử dụng để ước tính việc huy động: cải thiện trao đổi khí [15], thay đổi cơ học phổi [16], thay đổi trên siêu âm [17] và biến thiên về trở kháng điện [18]. Điều đáng chú ý là các phương thức này, đo lường các thực thể khác nhau, không nhất thiết phải thay thế cho nhau. Để đánh giá khả năng huy động, hai lần chụp CT được thực hiện ở các áp lực đường thở khác nhau (5 và 45 cmH2O) để đo số lượng phổi không được sục khí (+100 HU và HU 100 HU) quay lại được bơm phồng ở áp lực cao (khả năng cho phổi huy động). Với phương pháp này, Gattinoni et al. thấy rằng khả năng huy động phần lớn thay đổi ở bệnh nhân ARDS và nó tăng theo mức độ nghiêm trọng của ARDS [13] (Hình 1).
Cách tiếp cận thứ hai, mặc dù sử dụng cùng một thuật ngữ và ngưỡng HU của phân tích voxel -by- voxel, dựa trên phân tích cả hình thái và mật độ [6]. Trong một khu vực phổi nhất định, được xác định rõ thông qua các dấu hiệu giải phẫu, các voxels tiếp giáp với bơm phồng lên tới -500 HU (không được sục khí hoặc được sục khí kém) được xác định bằng mã màu và được tô viền thủ công. Phân định thủ công được thực hiện trên CT thu được ở áp lực thở ra cuối không (ZEEP) sau đó CT scan được thực hiện tại PEEP khác, bằng cách sử dụng các mốc giải phẫu như mạch máu phổi hoặc nhánh phế quản, và sự huy động được tính là sự khác biệt của thể tích khí CT được đo trong các khu vực phổi bị thay đổi. Rõ ràng, hai phương pháp cho kết quả khác nhau [19]. Phân tích voxel-by-voxel cho thấy số lượng mô có khả năng trải qua hình thái xẹp và hết xẹp trong 1 chu kỳ thờ (intratidal collapse and decollapse), một loại biến đơn có liên quan đến tỷ lệ tử vong; trong khi phương pháp giải phẫu đo cả mô lấy lại tình trạng bơm phồng và mô dịch chuyển từ mô kém sục khí đến trạng thái thông thường, mà không phân biệt hai loại này ra. Ngoài ra, cách tiếp cận hình thái đã dẫn đến định nghĩa về ARDS là thùy, lốm đốm và lan tỏa. Thật hấp dẫn khi suy đoán rằng viêm phổi thùy thường gặp hơn ở ARDS nhẹ, lốm đốm ở ARDS trung gian, trong khi viêm phổi lan tỏa thường gặp hơn ở ARDS nặng. Một mối quan hệ nhất quán giữa hình thái và chức năng, cho đến nay, vẫn còn thiếu.
CT scan, stress, strain và đồng nhất
Strain là biến dạng của mô phổi (tỷ lệ thể tích khí lưu thông so với FRC) khi áp lực xuyên phổi được áp dụng. Các lực phản ứng ngược tăng lên trong mô được gọi là stress. Tổng số biến dạng phổi có thể được ước tính thông qua việc đo FRC bằng cách pha loãng helium hoặc các công nghệ khác [20]. Tuy nhiên, điều làm cho CT scan trở nên độc đáo là phép đo vùng phổi. Sự khác biệt về strain giữa các cấu trúc tiếp giáp là phép đo chính để ước tính độ đồng nhất của phổi [21].
![Hình 1. Hình a Phân phối tần số của 68 bệnh nhân ARDS theo mức độ huy động phổi, được biểu thị bằng tỷ lệ phần trăm của tổng trọng lượng phổi. ALI mà không có ARDS được xác định bằng PaO2/FiO2 nhỏ hơn 300 nhưng không dưới 200 và ARDS được xác định bằng PaO2/FiO2 dưới 200. Lượng phổi có thể huy động được xác định là tỷ lệ mô phổi trong đó sục khí được phục hồi ở áp lực đường thở trong khoảng từ 5 đến 45 cmH2O. Hình b Các lát cắt CT đại diện của phổi thu được 2 cm trên vòm hoành ở áp lực đường thở là 5 cmH2O (trái) và 45 cmH2O (phải) từ một bệnh nhân có tỷ lệ phổi có thể huy động thấp hơn (bằng hoặc thấp hơn giá trị trung bình là 9% tổng trọng lượng phổi). Hình c Các lát cắt CT đại diện của phổi thu được 2 cm trên vòm hoành ở áp lực đường thở là 5 cmH2O (trái) và 45 cmH2O (phải) từ một bệnh nhân trong nhóm có tỷ lệ phổi có thể huy động cao hơn (Tái tạo từ Gattinoni et al. [13])](https://www.healcentral.org/wp-content/uploads/2020/09/hinh_anh_trong_hoi_chung_suy_ho_hap_cap_tinh_1-300x125.jpg)
CT scan trong thực hành lâm sàng
Ở những bệnh nhân ARDS, chụp CT, thậm chí sử dụng phơi nhiễm tia X thấp hơn [22], có thể được thực hiện trong điều kiện tiêu chuẩn ở PEEP 5 cmH2O [23] sẽ cho phép người ta chẩn đoán các phát hiện không được khám và có thể hướng dẫn lựa chọn điều trị hô hấp thích hợp. Ngay cả việc kiểm tra bằng mắt của CT scan tiêu chuẩn cũng cho phép đánh giá số lượng và sự phân bố mật độ cũng như phát hiện tràn dịch màng phổi [24] hoặc tràn khí màng phổi có áp lực cục bộ, không phát hiện được bằng phim chụp X quang tiêu chuẩn. Việc chụp lại CT scan thứ hai ở áp lực đường thở 45 cmH2O cho phép người ta đánh giá khả năng huy động phổi. Do đó, ngay cả việc kiểm tra trực quan cũng cung cấp những hiểu biết sâu sắc về lượng phù và khả năng huy động phổi, là cơ sở giải phẫu và sinh lý để lựa chọn PEEP. Tuy nhiên, phân tích CT scan định lượng (quantitative CT scan analysis) cho phép người ta đo trọng lượng phổi, tỷ lệ các phần của mô mở và mô đóng đối với thông khí, có thể huy động được bao nhiêu mô phổi và mức độ lan rộng của “stress risers” phân bố. Thông tin này có thể cho phép sử dụng hợp lý các giá trị PEEP và tư thế nằm sấp.
Hình ảnh PET của ARDS
Chụp cắt lớp phát xạ Positron (PET, Positron emission tomography) đã được sử dụng ngày càng nhiều để nghiên cứu sinh lý bệnh học của ARDS và tổn thương phổi do máy thở (VILI) cả trong nghiên cứu lâm sàng và thực nghiệm. PET rất linh hoạt và nó có thể định lượng tưới máu khu vực, thông khí, sục khí, tính thấm của mạch phổi, phù, hoạt động trao đổi chất của các tế bào viêm, hoạt động của enzyme và biểu hiện gen phổi [25].
Hình ảnh PET của chức năng phổi khu vực trong ARDS và VILI
Các chất đánh dấu (tracers) được sử dụng thường xuyên nhất là [15O] oxygen-labeled water (H2 15O) để đo tưới máu khu vực và nước phổi; [13N] nitơ ( 13N2), được hòa tan trong dung dịch muối và tiêm tĩnh mạch, để đo mức tưới máu khu vực, shunt, thông khí của phế nang được tưới máu và bẫy khí, hoặc bằng cách hít vào để đo mức sục khí khu vực và thông khí (bao gồm thông khí khoãng chết); 11C, dưới dạng carbon monoxide (11CO), để đo đạc nước phổi ngoài mạch máu phổi (EVLW) từ các phép đo H2 15O của nước phổi, hoặc như 11C-methylalbumin để đo độ thấm của mạch máu. 68Ga-transferrin cũng có thể được sử dụng để đo độ thấm và các tập hợp 68Ga-albumin đã được sử dụng để đo sự phân bố khu vực của tưới máu phổi trong các nghiên cứu thực nghiệm [26].
Giá trị của PET làm tăng hiểu biết thêm vào hình ảnh hình thái. Một ví dụ, CT scan đã chỉ ra rằng ở những bệnh nhân mắc ARDS, phổi được sục khí bình thường cùng tồn tại với phổi mất huy động, chiếm ưu thế ở các vùng phụ thuộc. Tuy nhiên, PET đã tiết lộ rằng sự gia tăng tính thấm của mạch máu phổi là đồng nhất trong toàn bộ phổi ARDS, không có sự chênh lệch từ trên xuống dưới (ventro- dorsal gradient) [27], cho thấy ngay cả các vùng được thông khí tốt cũng bị ảnh hưởng bởi quá trình bệnh lý. Hơn nữa, các phép đo PET của tưới máu khu vực đã cho thấy mối quan hệ nghịch đảo giữa tỷ lệ lưu lượng máu phổi đến các vùng phổi phụ thuộc và tỷ lệ PaO2/FiO2 của đối tượng [28]. Điều này ngụ ý rằng các đối tượng có cùng số lượng và sự phân bố của hình ảnh cản quang phổi (nghĩa là với cùng một CT lâm sàng hoặc chụp X-quang phổi) có thể có PaO2 khác nhau rõ rệt, và do đó, khác nhau về độ nặng của ARDS, điều này phụ thuộc vào hiệu quả của tái phân bố tưới máu từ các khu vực không có sục khí.
Các phép đo PET kết hợp của tưới máu và shunt cũng đã xác định sự phân phối lại của tưới máu đối với các vùng bị mất huy động là cơ chế làm xấu đi quá trình oxy hóa, đôi khi được quan sát trong các thủ thuật huy động [29] hoặc cài đặt PEEP [30]. Kết hợp lại với nhau, những phát hiện này chỉ ra rằng bác sĩ lâm sàng phải thận trọng khi sử dụng PaO2 như một chỉ số về mức độ nghiêm trọng của ARDS hoặc lấy nó để đánh giá đáp ứng với các chiến lược huy động nếu không biết mức độ phân bố tưới máu.
Khả năng thực hiện quét PET nối tiếp đã cho phép hiểu biết sâu sắc về sự thay đổi theo thời gian của các quá trình bệnh liên quan đến ARDS. Các nghiên cứu thực nghiệm sử dụng PET với 68Ga- albumin đã cho thấy phản ứng hai pha với hít axit, một nguyên nhân thường gặp của ARDS. Trong vòng 10 phút và trong giờ đầu tiên sau khi hít, lưu lượng máu đến các vùng bị ảnh hưởng tăng lên, cho thấy phản ứng sung huyết được kích hoạt bởi tổn thương ban đầu. Tuy nhiên, sớm nhất là 2 giờ, tưới máu ở vùng tổn thương hít sặc thấp hơn so với vùng khác [31], có khả năng là kết quả của việc co mạch phổi do thiếu oxy hoặc chèn ép mạch máu trực tiếp bởi dịch tiết.
Hình ảnh PET của hoạt động tế bào viêm
Các tế bào viêm được kích hoạt, đặc biệt là bạch cầu trung tính, phụ thuộc rất nhiều vào quá trình glycolysis kỵ khí. PET với 2- [18F] fluoro-2-deoxy- d-glucose ([18F] FDG) đã được sử dụng để đo kích hoạt chuyển hóa bạch cầu trung tính khu vực trong viêm phổi [32, 33] và VILI [34]. Do báo cáo trường hợp ban đầu về sự gia tăng hấp thu [18F]FDG của phổi trong ARDS [35], các nghiên cứu tiếp theo đã xác nhận rằng hoạt động trao đổi chất của phổi ARDS tăng so với các biện pháp kiểm soát bình thường [25]. Sự gia tăng này không chỉ liên quan đến các khu vực quét CT tổng hợp mà còn cả nhu mô với mật độ bình thường (Hình 3 của Tham khảo [9]). Trên thực tế, trong khi ở một số bệnh nhân, sự hấp thu [18F] FDG cao nhất xảy ra ở những khu vực có mật độ cao nhất, còn những bệnh nhân khác lại xảy ra ở những vùng phổi có mật độ bình thường được sục khí (Hình 2). Quan sát này cho thấy rằng hoạt động trao đổi chất của các tế bào viêm trong phổi được sục khí thông thường, ít nhất là một phần, do ảnh hưởng của thông khí cơ học, một tác động chủ yếu trên phổi không đông đặc. Phù hợp với giả thuyết này là phát hiện rằng sự hấp thu của [ 18F]FDG của khoang khí bình thường tỷ lệ thuận với thể tích khí lưu thông khu vực của nó, được bình thường hóa bởi thể tích phổi cuối thì thở ra và tăng mạnh đối với áp lực đường thở cao nguyên cao hơn 27 cmH2O [25] rằng phần này của phổi ARDS có thể bị viêm do thở máy.
Các nghiên cứu thử nghiệm sau đó [36] đã thực sự cho thấy mối quan hệ tuyến tính trực tiếp giữa strain thể tích phổi khu vực, được đo bằng cách quét PET 13N2 khí hít vào, và tốc độ phosphoryl hóa [ 18F] FDG, được chứng minh là có tương quan với biểu hiện của các cytokine viêm nhiễm IL-1β, IL-8 và IL-10 trong tổn thương phổi cấp tính thực nghiệm [37]. Hơn nữa, nội độc tố, một đại diện cho nhiễm trùng huyết thường đi kèm với ARDS, làm tăng tính nhạy cảm của phổi với strain cho sẳn, chỉ ra một sự hiệp đồng khó hiểu giữa một tổn thương và VILI như vậy. Sự hiệp đồng này ngụ ý rằng những lợi ích của thở máy bảo vệ sẽ được tăng cường trong tình trạng nhiễm độc nội độc tố ngay cả khi nó nhẹ và không đủ để tạo ra phù phổi [38] (Hình 3).
Mặc dù vai trò của thể tích khí lưu thông lớn và tình trạng quá căng phổi cuối thì hít vào trong sinh bệnh học của VILI đã được thiết lập rõ ràng, nhưng vai trò của huy động/mất huy động phế nang cuối thở ra là ít dứt khoát hơn, ít nhất là in vivo [25, 39, 40].
![Hình 2 Phân phối sự hấp thu [18F] FDG (KiD) là một hàm của mật độ phổi khu vực (CTD) ở mười bệnh nhân mắc ARDS (đường chấm) so với bốn kiểm soát (đường liên tục, trung bình độ lệch chuẩn). Ở một số bệnh nhân, KiD tăng tuyến tính với CTD (hình tròn trắng); điều này không đúng trong các bệnh nhân khác (hình tròn đen). Lưu ý rằng, ở tất cả các bệnh nhân, tốc độ trao đổi chất đã tăng lên một cách có hệ thống trên toàn bộ phổ suy giảm ở phổi bình thường (Chỉnh sửa từ Bellani và cộng sự [84])](https://www.healcentral.org/wp-content/uploads/2020/09/hinh_anh_trong_hoi_chung_suy_ho_hap_cap_tinh_2-300x212.jpg)
![Hình 3 Hình ảnh tham số của phổi Tốc độ hấp thu [ 18F] FDG (KiP) ở hai con cừu được truyền 2 giờ với liều endotoxin nhỏ (10 ng/kg/phút) trong khi chịu thông khí cơ học bị tổn thương (trái) hoặc bảo vệ (phải). Lưu ý hoạt động trao đổi chất thấp hơn nhiều ở cừu được thông khí bảo vệ (Chỉnh sửa từ de Prost và cộng sự [38])](https://www.healcentral.org/wp-content/uploads/2020/09/hinh_anh_trong_hoi_chung_suy_ho_hap_cap_tinh_3-300x166.jpg)
Định hướng tương lai
Mặc dù quét PET thường quy cho bệnh nhân ARDS là không khả thi, nhưng PET có thể hữu ích trong các trường hợp được chọn. Các nghiên cứu gần đây [41] và lâm sàng [42] cho thấy rằng sự gia tăng lan tỏa của sự hấp thu [18F] FDG ở phổi trước sự phát triển của ARDS biểu hiện lâm sàng. Do đó, PET với [18F] FDG có thể gợi ý trị liệu sớm trong trường hợp có nguy cơ cao mắc ARDS. Một ứng dụng lâm sàng khác của PET với [18F] FDG là để theo dõi hiệu quả của điều trị chống viêm [43].
Gần đây, các kỹ thuật và công cụ mới của PET đã được phát triển để có các khía cạnh hình ảnh khác với viêm phổi, chẳng hạn như biểu hiện tổng hợp oxit nitric cảm ứng [44], cũng như biểu hiện gen phổi [45]. Tính khả dụng hiện tại của PET-CT kết hợp và, trong tương lai gần, máy quét PET-MR [46] làm cho hình ảnh đa phương thức trở thành một công cụ có giá trị để chúng ta hiểu hơn về ARDS.
Siêu âm trong ARDS
Cơ sở siêu âm phổi
Việc sử dụng siêu âm như một công cụ chẩn đoán phổi có từ những năm 1960 nhưng chỉ gần đây việc sử dụng nó mới lan rộng trong môi trường chăm sóc tích cực. Các cấu trúc giải phẫu chứa đầy khí không truyền sóng siêu âm, thường ngăn cản hình ảnh phổi. Do đó, hình ảnh thực chỉ xuất hiện trong trường hợp tràn dịch màng phổi và đông đặc phổi. Tuy nhiên, không khí tạo ra các hình ảnh nhiễu và siêu âm phổi có những ưu điểm của các đặc điểm hình ảnh nhiễu cụ thể. Thông thường phổi được sục khí hoặc bơm phồng quá mức (hoặc tràn khí màng phổi) tạo ra các nhiễu nằm ngang song song với đường màng phổi (A lines, Hình 4 và video 1) trong khi mất sục khí tạo ra các nhiễu giống như tia laser dọc (B lines, Hình 4; video 2). Số lượng B lines và phân bố không gian của chúng (cách đều đặn hoặc không đều, kết hợp) có thể được sử dụng để đánh giá mức độ nghiêm trọng của mất thông khí và gợi ý chẩn đoán. Siêu âm phổi là động: trượt phổi, tức là, sự lướt qua lẫn nhau của màng phổi tạng và màng phổi thành đồng bộ với nhịp thở, là một dấu hiệu của thông khí phổi. Không nên nhầm lẫn trượt phổi với cái gọi là xung phổi (lung pulse), một loại tiếng ồn của tim (“heart noise”) là một chuyển động màng phổi ngắn và tốc độ cao đồng bộ với nhịp tim (video 2). Sự kết hợp của thông tin tĩnh và động cho phép đánh giá độc lập thông khí phổi và thông khí khu vực. Ký hiệu học phổi (lung semiotics) được phác thảo trong các khuyến nghị quốc tế [47] và sách giáo khoa [48].
Siêu âm phổi để chẩn đoán ARDS
Kết quả siêu âm phổi có thể tạo thuận lợi cho chẩn đoán ở bệnh nhân suy hô hấp cấp tính (ARF) [49]. Trong một phần đó, ARDS trình bày nhiều B lines, điển hình là phân bố không theo trọng lực, không đồng nhất, dày màng phổi, đông đặc dưới màng phổi, trượt phổi bị giảm hoặc bị mất, đặc biệt là ở các vùng trước và trong giai đoạn đầu của bệnh, và đông đặc phổi ở các vùng phổi phụ thuộc (Hình 4; video 2, 3). Siêu âm phổi tại giường trong giao thức khẩn cấp (BLUE) là một cây quyết định được đề xuất để chuyển những phát hiện này vào thực hành lâm sàng [50]. Nó dựa trên đánh giá (1) sự hiện diện của A lines hoặc B lines, (2) sự hiện diện hay không có sự trượt của phổi, (3) sự hiện diện hay không có đông đặc phổi và/hoặc tràn dịch màng phổi khi đánh giá siêu âm phổi của các khu vực trước (mục 1 và 2) và khu vực sau bên (mục 3). Các mục này được nhóm thuận tiện để xác định kiểu hình siêu âm phổi có liên quan đến các nguyên nhân khác nhau của ARF (Bảng 1). Viêm phổi và ARDS được liên kết với B profile (B lines trước mà không trượt phổi), A/B profile (B lines tiền thân ở một bên và A lines chiếm ưu thế ở bên kia), C profile (đông đặc phía trước) và A[V]-PLAPS profile (A lines phía trước và đông đặc phế nang/tràn dịch màng phổi không có huyết khối tĩnh mạch sâu) [50].
Một trong những tác giả của tổng quan hiện tại (D.L.) đã áp dụng giao thức BLUE ở 100 bệnh nhân mắc ARDS sớm: trượt phổi phía trước không có mặt rộng rãi hoặc theo vùng trong 45%, PLAPS hầu như luôn có mặt và profile phù hợp với ARDS được phân bổ cho 74 % bệnh nhân (dữ liệu không được công bố). Siêu âm phổi có thể là một sự thay thế hợp lệ cho X quang phổi hoặc CT scan trong hầu hết các trường hợp. Gần đây, một định nghĩa ARDS được sửa đổi của Berlin dựa trên siêu âm phổi – cản quang phổi hai bên (lung ultrasound- detected bilateral lung opacities) đã được sử dụng để đánh giá tỷ lệ mắc và kết quả của bệnh nhân ARDS trong môi trường hạn chế về tài nguyên [51]. Siêu âm phổi cũng giúp phân biệt bệnh nhân với phổi trắng lâm sàng khi chụp X quang phổi tiêu chuẩn: nó dễ dàng phát hiện và/hoặc loại trừ các tình trạng như tràn dịch màng phổi hoặc phù phổi do tim [47-50, 52, 53]. Siêu âm phổi có thể dự đoán ARDS trong các khung cảnh cụ thể: siêu âm định lượng của dập phổi xác định bệnh nhân chấn thương có nguy cơ phát triển ARDS [54].
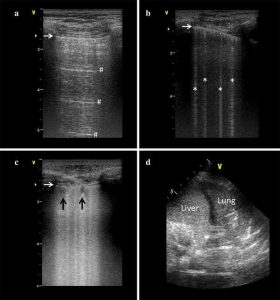
”a: một mẫu siêu âm phổi bình thường (score = 0). b: Các B lines cách đều nhau (mất sục khí vừa phải; score = 1). c: B lines kết hợp (mất sục khí nghiêm trọng; score = 2). d: Phổi đông đặc (mất hoàn toàn sục khí; score = 3). Mũi tên ngang đề cập đến đường màng phổi giữa bóng hai xương sườn. Trong a và b, các ký hiệu đánh dấu A lines (*) và B line (#). Trong c, mũi tên màu đen đánh dấu hai vùng đông đặc tăng âm dưới màng phổi. Trong d, nhiều đường khí phế quản đồ tăng âm, arborescent có thể phát hiện rõ ràng trong đông đặc phổi. Để tính điểm siêu âm phổi, sáu khu vực tiêu chuẩn được xem xét trong mỗi nữa ngực: vùng trước, bên và sau, mỗi khu vực được chia thành các trường trên và dưới. Điểm siêu âm phổi tương ứng với tổng của từng khu vực Điểm số, do đó từ 0 (tất cả các khu vực được sục khí) đến 36 (tất cả các khu vực đông đặc).”
Siêu âm phổi hướng dẫn quản lý bệnh nhân ARDS
Ở bệnh nhân ARDS đánh giá siêu âm phổi về sục khí phổi toàn diện và khu vực có thể giúp đánh giá mức độ nghiêm trọng của bệnh, hướng dẫn các biện pháp can thiệp điều trị và theo dõi đáp ứng của bệnh nhân [55]. Một mô hình con người về mất sục khí phổi có kiểm soát đã xác định bốn mô hình mất sục khí tiến triển [56]. A lines tương ứng với phổi được sục khí thông thường hoặc bơm phồng quá mức, các B lines cách đều nhau gặp trong mất sục khí vừa phải, các B lines hợp nhất gặp trong mất thông khí nghiêm trọng và mô hình giống như mô để mất sục khí hoàn toàn (Hình 4). Một đánh giá siêu âm phổi định tính đơn giản có thể dự đoán đáp ứng với các thủ thuật huy động: bệnh nhân ARDS bị mất sục khí lan tỏa có mức độ huy động phổi do PEEP cao hơn nếu so với bệnh nhân mất sục khí khu trú [17].
Một số điểm sục khí dựa trên siêu âm phổi (xem hình 4 để biết chi tiết) cũng có thể được lấy tại giường, cho phép bán định lượng thông khí phổi [55, 57]. Điểm siêu âm phổi cho thấy mối tương quan tốt với kết quả của cả CT định lượng và đo EVLW bằng phương pháp pha loãng nhiệt xuyên phổi [58, 59]. Hơn nữa, trong giai đoạn đầu của ARDS liên quan đến sốc nhiễm trùng, điểm siêu âm phổi cho thấy tình trạng suy giảm thông khí phổi do quá tải dịch: do đó, nó được đề xuất như là một biện pháp bảo vệ an toàn đối với hồi sức dịch truyền quá mức [60]. Điểm tái sục khí trên siêu âm phổi đánh giá chính xác kết quả điều trị sau 7 ngày điều trị bằng kháng sinh ở bệnh nhân viêm phổi liên quan đến máy thở (VAP) [61] và cho phép phát hiện huy động phổi do PEEP gây ra ở bệnh nhân ARDS [17]. Điều này cho thấy bất kỳ can thiệp nào nhằm cải thiện sục khí (thủ thuật huy động, tư thế nằm sấp, nội soi phế quản; xem video 4A, B) có thể được theo dõi bằng siêu âm phổi [55, 57]. Siêu âm phổi cũng giúp phát hiện sớm và điều trị trước các biến chứng phổi ở bệnh nhân thở máy. Siêu âm phổi có độ chính xác chẩn đoán rất cao đối với cả tràn khí màng phổi (video 1) và tràn dịch màng phổi và cải thiện sự an toàn và hiệu quả của phẫu thuật lồng ngực [52]. Điểm siêu âm viêm phổi do thở máy (VAP) dựa trên các dấu hiệu siêu âm phổi cụ thể (Hình 4, video 3, 5) giúp chẩn đoán sớm bệnh VAP ở bệnh nhân ICU [62]. Cuối cùng, đánh giá dựa trên siêu âm về tương tác tim phổi có thể hướng dẫn các can thiệp điều trị ở bệnh nhân ARDS phát triển tâm phế cấp tính và/hoặc shunting qua lỗ bầu dục [63, 64].
Kỹ thuật siêu âm phổi có một số hạn chế. Siêu âm phổi không thể phát hiện quá căng phổi, ngay cả khi thiếu dấu hiệu phổi trượt ở các vùng phổi không phụ thuộc có thể gợi ý nó. Khí phế thũng dưới da và sự hiện diện của băng ngực lớn có thể ngăn cản sự lan truyền của chùm siêu âm đến bề mặt phổi. Hơn nữa, trong trường hợp chấn thương ngực nghiêm trọng hoặc bỏng, siêu âm phổi có thể bị giới hạn bởi bệnh nhân đau và khó chịu. Cần thận trọng để tránh lây các tác nhân truyền nhiễm bằng đầu dò siêu âm. Đào tạo là cần thiết để thực hiện chính xác kiểm tra siêu âm phổi và giải thích các phát hiện. Cuối cùng, ngay cả khi siêu âm phổi là một kỹ thuật có khả năng lặp lại cao, nó không phải là một công cụ theo dõi liên tục.
Chụp cắt lớp trở kháng điện (EIT) trong ARDS
Trở kháng điện đo lường sự đối lập mà một mạch thể hiện với dòng điện xoay chiều và có thể được sử dụng trong nhiều lĩnh vực, từ địa chất đến hình ảnh y tế [65]. Các phép đo của nó đòi hỏi ứng dụng xung quanh thể tích quan tâm bằng nhiều cặp điện cực truyền dòng điện xoay chiều cường độ thấp:điện áp cắt ngang được đo trên các ranh giới và trở kháng của vùng được tái tạo để thu được hình ảnh hai hoặc ba chiều. Thông thường EIT ngực có được bằng cách đặt một đai điện cực xung quanh ngực, giữa khoảng liên sườn thứ ba và thứ sáu [66]. Hình ảnh thu được đại diện cho những thay đổi trở kháng xảy ra trong một mặt cắt ngang của ngực, thường dày tới 5-10 cm [67].
Tín hiệu EIT thông khí phổi
EIT đã được nghiên cứu rộng rãi để theo dõi thông khí phổi khu vực [65]. Phổi là một mục tiêu tốt cho EIT vì trở kháng của phổi có liên quan mật thiết đến mức độ bơm phồng nhu mô [67]. Các hệ thống EIT tạo ra các hình ảnh không hiển thị cấu trúc giải phẫu, nhưng các vùng phổi biểu hiện các biến đổi theo chu kỳ trong trở kháng phổi. Các khu vực không được thông khí (và không được tưới máu) vẫn im lặng (không nhìn thấy) trong các hình ảnh EIT.
Nhiều nghiên cứu đã xác nhận EIT, với độ chính xác tốt để ước tính sự phân bố thể tích khí trong quá trình thở tự nhiên [67, 68] hoặc trong khi thở máy và theo dõi những thay đổi trong cài đặt thông khí [69, 70]. Độ phân giải của hình ảnh thường bằng một phần năm đường kính ngực.
Các nghiên cứu gần đây đã xác nhận EIT để đo thể tích phổi cuối kỳ thở ra (EELV) so với xét nghiệm rửa nitơ (nitrogen washout test) và phép đo thể tích cơ thể (plethysmography) [67, 68] hoặc để đo phân bố thể tích phổi theo vùng so với CT scan [71, 72], Chụp cắt lớp phát xạ-photon đơn (SPECT, single- photon emission computed tomography) [73] và PET [74]. EIT được xem là máy theo dõi liên tục không xâm lấn, không phát tia xạ đo đạc thể tích phổi trong quá trình thông khí [75] và có thể là hướng dẫn về chăm sóc thông khí tối ưu [69, 70] (Hình 5).
![Bảng 1 Siêu âm phổi tại giường trong cấp cứu (BLUE) (được điều chỉnh từ [50])](https://www.healcentral.org/wp-content/uploads/2020/09/hinh_anh_trong_hoi_chung_suy_ho_hap_cap_tinh_5-300x96.jpg)
Tín hiệu EIT tưới máu phổi
Đặc tính trở kháng rất nhạy cảm với sự khác biệt giữa máu và không khí, do đó, EIT cũng đã được nghiên cứu để đánh giá sự phân bố tưới máu khu vực và mối quan hệ của nó với thông khí. Việc tưới máu phổi đã được nghiên cứu bởi EIT bằng cách sử dụng hai phương pháp thay đổi trở kháng đo lường, gây ra bởi sự dao động của dòng máu chảy qua phổi hoặc do bơm trực tiếp (bolus) natri clorua hypertonic vào tâm nhĩ phải . Phương pháp [76] tương phản đầu tiên được xác định dựa trên SCAN tưới máu tham chiếu (SPECT và CT động). Xét nghiệm này đã xác nhận EIT để cung cấp thông tin tại giường đáng tin cậy về tưới máu phổi . Các [76] nghiên cứu đang thực hiện ở những bệnh nhân bị thuyên tắc phổi đang được tiến hành. Phương pháp tạo nhịp phổi cho đến nay đã được chứng minh là cung cấp thông tin định tính về tưới máu phổi, ví dụ, sau khi kích hoạt tình trạng co thắt phổi do thiếu oxy hoặc ở những bệnh nhân mãn tính phát triển khí phế thũng hoặc tăng áp phổi . Ngược [66] lại, việc sử dụng epoprostenol ở bệnh nhân tăng áp phổi gây ra sự gia tăng rõ rệt và cấp tính trong xung động EIT . [77]
Ứng dụng EIT ở bệnh nhân ARDS
EIT phát hiện sự khác biệt trong thông khí khu vực với (a) sự không đồng nhất của phổi do bệnh gây ra, (b) ảnh hưởng của các thao tác thở máy (ví dụ, đánh giá khả năng huy động phổi) và (c) để đo lường tác động sinh lý của PEEP và thể tích khí lưu thông . [69, 70, 72, 73, 78]
Trong ARDS phù nề kẽ tăng cường các hiệu ứng trọng lực trên phổi. Thông thường, theo dõi EIT trong quá trình hình thành phù nề cho thấy giảm thông khí phổi ở vùng lưng, liên quan đến giảm thông khí khu vực. Liên quan đến những thay đổi như vậy, EIT thường tăng bù trong thông khí khu vực của các vùng trước ngực . Sự [70-72, 78, 79] thay đổi trong phân bố thông khí phù hợp và tăng cường bởi trọng lượng phổi, gần đây, Trepte et al. [80] đã có thể định lượng EVLW trong tổn thương phổi cấp tính thực nghiệm bằng cách đo sự thay đổi này trong thông khí EIT khi thông khí ở các vị trí cơ thể khác nhau.
Trong tự nhiên thở đối tượng bình thường, sự thông khí cao hơn ở phổi lưng. Điều này được gây ra bởi tư thế lớn hơn của cơ hoành, cũng như do trọng lực, đưa phổi phụ thuộc đến một phần tốt hơn của đường cong P/V, với độ giãn nở khu vực tốt hơn [79]. Tuy nhiên, trong trường hợp tăng trọng lượng phổi, hoặc trong khi mất trương lực cơ, tuy nhiên, đóng kín đường thở và tăng áp lực màng phổi ở các vùng phụ thuộc có xu hướng đảo ngược mô hình này, và thông khí chiếm ưu thế ở phổi không phụ thuộc. Sự thay đổi bất thường này có thể được phát hiện bởi EIT, cũng như những thay đổi về mức độ ổn định của các đơn vị phổi lưng do ảnh hưởng của thể tích khí lưu thông , PEEP và thủ thuật [69] [75] huy động (RM) . Các thao tác tăng cường thông [70] khí vùng lưng (thở dài, huy động hoặc PEEP cao hơn kết hợp với VT thấp hơn) bao gồm cải thiện oxy hóa , thông khí lưng và bảo vệ phổi [69] [70] trong các nghiên cứu thực nghiệm . Ngược [67, 80] lại, mức hỗ trợ áp lực cao hoặc thể tích khí lưu thông có liên quan đến tăng thông khí và tín hiệu của tình trạng quá căng phổi ở vùng không phụ thuộc. Độ giãn nở khu vực có nguồn gốc từ EIT (được tính bằng thay đổi trở kháng pixel theo nhịp thở chia cho áp lực đẩy đường thở ), khi được [71] đo nhiều lần trong quá trình chuẩn độ PEEP, đã được sử dụng để tính tỷ lệ phần trăm đơn vị phổi bị sụp đổ ước tính bởi CT hoặc để phân biệt giữa [79] các vùng phổi có thể huy động hoặc không thể huy động . Trong các thử nghiệm PEEP tăng dần và [71] giảm dần, các chỉ số mới như “phân phối khí trong chuu kỳ thở” có nguồn gốc từ EIT và quá căng phổi có nguồn gốc EIT đã được tính toán và cho thấy là các chỉ số đầy hứa hẹn để phát hiện strain phổi quá mức . Cuối cùng, bệnh nhân ARDS có thể [81, 82] được phân biệt rõ ràng với bệnh nhân có phổi khỏe mạnh bằng cách tính hằng số thời gian khu vực có nguồn gốc EIT Không chỉ các hằng số thời [70, 71]. gian mà cả các chỉ số bơm phồng phổi động khác cũng hứa hẹn trong việc phát hiện các tình trạng bệnh lý như huy động khí lưu thông và Pendelluft, cái sau này thường gây ra bởi những nỗ lực quá mức của bệnh nhân. Khi Pendelluft xảy ra, khả năng quá căng của phổi phụ thuộc được đề xuất mạnh mẽ bởi EIT, ngay cả ở những bệnh nhân được đưa vào thông khí thể tích khí lưu thông thấp . [82]
Hạn chế EIT và sự phát triển tương lai
Nghiên cứu hiện tại nhằm mục đích mở rộng lĩnh vực ứng dụng của EIT bằng cách cải thiện các thuật toán tái tạo hình ảnh, tạo ra các thuật toán chuyên dụng cho các ứng dụng lâm sàng cụ thể, cải thiện giao tiếp với máy thở, sửa chữa các nhiễu gây ra bởi sự thay đổi hình dạng lồng ngực và cung cấp tuyệt đối ba chiều/hình ảnh tương đối với độ phân giải tốt hơn. Nghiên cứu về độ bão hòa của phổi sẽ sớm yêu cầu các hệ thống hình ảnh EIT nhanh hơn và các quy trình lọc tạm thời tiên tiến [67].
Kết luận
Hình ảnh trong ARDS có thể là thủ tục phù hợp nhất cho phép hiểu rõ hơn về hội chứng này, dẫn đến một định nghĩa định lượng về các khái niệm như bình thường, bơm phồng quá mức hoặc không bơm phồng, huy động và không đồng nhất phổi. Cho đến nay, nó vẫn đại diện cho cách tiếp cận tốt nhất để mô tả ARDS ở từng bệnh nhân. Một ghi chú ngắn gọn nên được viết về việc sử dụng các kỹ thuật khác như chụp cộng hưởng từ (MRI) trong đánh giá hình ảnh phổi; trên thực tế, mặc dù việc sử dụng nó bị hạn chế chủ yếu trong nghiên cứu, MRI khi kết hợp với các biện pháp tưới máu khu vực cung cấp một phương pháp mới để đo lường sự phân bố khu vực của thông khí/tưới máu . Cuối [83] cùng, nếu trong tương lai gần, công nghệ quét CT cho phép thu nhận tại giường khi tiếp xúc với tia X thấp, việc sử dụng nó sẽ mở rộng đáng kể, cho phép, chúng tôi tin rằng, một cách tiếp cận hợp lý hơn trong điều trị ARDS.





