Bài viết Chụp cắt lớp điện toán đã nói gì với chúng ta về Hội chứng suy hô hấp cấp tính? được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: What Has Computed Tomography Taught Us about the Acute Respiratory Distress Syndrome?
Mặc dù chụp cắt lớp vi tính cơ thể (CT, computed body tomography) lần đầu tiên có vào giữa những năm 1970, các báo cáo đầu tiên về hình ảnh CT của suy hô hấp cấp tính (hiện được phân loại là tổn thương phổi cấp tính [ALI, acute lung injury] hoặc hội chứng suy hô hấp cấp tính [ARDS, acute respiratory distress syndrome]) đã không xuất hiện cho đến khi gần như một thập kỷ sau (1-3). Tại sao phải mất quá nhiều thời gian để áp dụng CT cho ALI/ARDS ở người? Máy quét CT ban đầu rất chậm (8-18 giây/hình trục), máy quét CT rất ít và thường được chỉ định quá nhiều so với khả năng có thể chụp, và việc vận chuyển bệnh nhân nguy kịch được coi là khó khăn. Quan trọng hơn, ARDS được cho là ảnh hưởng đến cả hai phổi đồng nhất và CT, trong những trường hợp như vậy, không được coi là có lợi. Động lực để nghiên cứu bệnh nhân ALI/ARDS bằng CT đã đi theo các nghiên cứu tiên phong về CT của Brismar và đồng nghiệp cho các đối tượng bình thường trong quá trình gây mê và liệt cơ (4). Họ luôn tìm thấy, ở những người được gây mê bình thường, có tăng mật độ phổi CT (CT lung density) ở vùng phổi phụ thuộc vào trọng lực (gravity-dependent lung regions). Mật độ phổi tăng lên này được cho là do mất trương lực cơ do gây mê và được gọi là xẹp phổi do nén (“compression atelectasis”). Vì nhiều bệnh nhân ALI/ARDS cũng bị cho thuốc an thần và/hoặc liệt cơ, chúng tôi cần biết xẹp phổi do nén biểu hiện ở mức độ lớn hơn hoặc ít hơn so với ở bệnh nhân suy hô hấp. Các bài báo CT đầu tiên của ALI/ARDS cho thấy bệnh phổi ở ALI/ARDS không đồng nhất hơn so với thông tin ban đầu (Hình 1). CT làm thay đổi đáng kể sự hiểu biết về hội chứng này (2, 3). Chụp CT, trong nhiều năm qua, đã được chứng minh là một công cụ đặc biệt để hiểu về sinh lý học của ALI/ARDS, và hiện nay nó ngày càng được sử dụng nhiều trong thực hành.
Trong báo cáo này, chúng tôi sẽ xem xét cách CT đã làm tăng hiểu biết của chúng tôi về sinh lý học và quản lý lâm sàng của ALI/ARDS như thế nào.
PHÂN TÍCH HÌNH THÁI CỦA HÌNH ẢNH CT
Trong 15 năm qua, nhiều báo cáo, cả thực nghiệm và lâm sàng, đã mô tả các kiểu hình thái CT khác nhau được tìm thấy trong ALI/ARDS. Thật không may, hầu hết là báo cáo hàng loạt ca, đã bị giới hạn về cỡ mẫu, sử dụng các phương pháp khác nhau và các thế hệ thiết bị CT khác nhau, và rất khác nhau về thuật ngữ để mô tả các thay đổi hình thái. Tuy nhiên, bất chấp những khác biệt này, các phát hiện CT đã cùng nhau bác bỏ một cách dứt khoát niềm tin thường thấy, dựa trên chụp X quang lồng ngực, nói rằng ALI/ARDS là một tiến trình bệnh lý nhu mô đồng nhất. Thật vậy, CT scan đã kết luận một cách thuyết phục rằng ALI/ARDS là một tiến trình không đồng nhất, hình thái ALI/ARDS thay đổi theo nguyên nhân và hình thái ALI/ARDS thay đổi theo thời gian, thở máy và tư thế bệnh nhân.
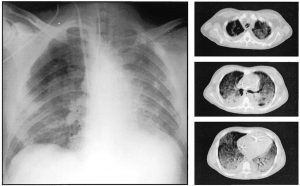
”Hình ảnh được chụp ở áp lực cuối thì thở ra 5 cm H2O. X- quang ngực cho thấy hình cản quang kính mờ lan tỏa (diffuse ground glass opacification), trừ phổi trên bên phải. Kết quả chụp CT cho thấy đây là bệnh phổi không đồng nhất và có sự chênh lệch tổn thương từ đỉnh phổi đến đáy phổi và từ phổi vùng xương ức đến vùng cột sống.”
Vì các mô tả giải phẫu đã thay đổi rất nhiều, nên đáng để xác định chính xác thuật ngữ CT. Chúng tôi đã thông qua các mô tả được đề xuất bởi Ủy ban Danh pháp Xã hội Fleischner (Fleischner Society Nomenclature Committee) (5).
- Theo đó: cản quang kính mờ (ground-glass opacification): tăng không rõ ràng trong suy giảm phổi (lung attenuation), còn thấy được các bờ phế quản và mạch máu;
- đông đặc (consolidation): sự gia tăng đồng nhất về suy giảm phổi làm che khuất các bờ phế quản – mạch máu trong đó có thể có hình ảnh khí phế quản đồ (air-bronchogram);
- kiểu lưới (reticular pattern): vô số bóng đường xen kẽ có thể là mịn, trung gian hoặc thô.
Những thay đổi hình thái này đều được tìm thấy trong CT scan của bệnh nhân ALI/ARDS. Mặc dù ý nghĩa sinh lý bệnh học của các kiểu hình thái được mô tả ở trên có thể khác nhau đối với các bệnh phổi khác nhau, nhưng trong ALI/ARDS, cản quang kính mờ được cho là phản ánh quá trình viêm hoạt động liên quan đến cả mô kẽ phổi, với sự dày lên bất thường của thành phế nang, và lấp đầy khoảng phế nang với các tế bào viêm, mảnh vụn tế bào và phù (6). Đông đặc, còn được gọi là cản quang nhu mô đậm đặc, cho dù lốm đốm hoặc lan tỏa, thường đề cập đến nhu mô phổi, hoàn toàn hoặc gần như hoàn toàn không có không khí. Điều này có thể là do lấp đầy hoàn toàn các khoảng phế nang với chất lỏng và tế bào hoặc do sự sụp đổ hoàn toàn của các đơn vị phổi có khả năng huy động (xẹp phổi) hoặc kết hợp cả hai (6). Kiểu lưới thường đề cập đến sự dày lên, thẳng, rời rạc, dễ nhận biết của mô kẽ phổi. Đây có thể là cấp tính (phù hoặc viêm mô kẽ) hoặc mãn tính (xơ hóa) (5, 6).
Giai đoạn sớm [Tuần đầu tiên]
Phát hiện CT nổi bật nhất trong ALI/ARDS sớm là bản chất không đồng nhất của tổn thương ở phổi. Người ta có thể khái niệm hóa phổi theo ba thành phần: (1) vùng phổi bình thường hoặc gần bình thường, thường xuyên nhất nằm ở phổi không phụ thuộc (vùng bụng ở vị trí nằm ngửa); (2) cản quang kính mờ trong phổi vùng giữa; và (3) đông đặc ở vùng phổi phụ thuộc nhiều nhất (mặt lưng ở vị trí nằm ngửa) (2, 3). Thật vậy, có một gradient mật độ dọc theo trục bụng-lưng (ventral–dorsal), như Pistolesi và đồng nghiệp đã đề xuất trước đây trên X quang ngực (7) và được mô tả trước đây trong ALI/ARDS thực nghiệm (8-10). Ngoài gradient mật độ theo trục dọc bụng lưng, còn có một gradient theo trục đầu-chân (cephalocaudal), với mật độ tăng dần từ đỉnh phổi đến đáy phổi (2, 11).
Giai đoạn muộn [Tuần thứ hai và sau đó]
ALI/ARDS là một tiến trình động theo một bệnh cảnh thay đổi, với sự hồi phục trong vòng một tuần hoặc kéo dài hơn. Chưa đầy một tuần sau tổn thương ban đầu, giai đoạn xuất tiết chuyển sang giai đoạn tổ chức trong đó chất lỏng được tái hấp thu từ phổi. Mật độ X quang và CT tổng thể của phổi giảm và kiến trúc phổi trải qua sửa đổi mở rộng (Hình 2). Đặc biệt, với thời gian, xơ hóa nhu mô gây ra sự biến dạng của các dấu hiệu mô kẽ và phế quản-mạch máu. Đáng chú ý, ngoài một hoặc hai tuần đầu tiên, có sự gia tăng mạnh mẽ của nang dưới màng phổi (subpleural cysts) hoặc bullae (12). Những u nang khí phế thũng hoặc pneumatocele thay đổi từ vài mm đến vài cm (13). Những tổn thương này, thường tương quan với thông khí kéo dài, đã được báo cáo cả ở vùng phổi phụ thuộc (14) và ở phổi không phụ thuộc (13, 15).
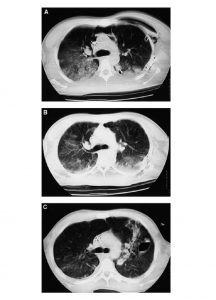
”(A) CT scan qua carina 5 ngày sau khi chấn thương nặng cho thấy hình kính mờ lan tỏa, bên phải nhiều hơn bên trái. Có một gradient từ vùng không phụ thuộc đến vùng phụ thuộc. Ngẫu nhiên lưu ý là có tràn khí trung thất và một ống ngực dẫn lưu tràn khí màng phổi. (B) Bảy ngày sau, cải thiện một phần của hình kính mờ lan tỏa và xẹp phổi phụ thuộc vào trọng lực. Tràn khí trung thất gần như được giải quyết hoàn toàn. (C) Năm ngày sau, cản quang kính mờ có kiểu lưới hơn. Bây giờ có một pneumatocele ở giữa phổi trái và tăng sự xẹp phổi bên cạnh nó.”
Bullae có thể bắt nguồn từ sự hóa hang (cavitation) của áp xe hoặc từ volutrauma/barotrauma. Trong trường hợp đầu tiên, bullae phải tuân theo sự phân bố của nhiễm trùng trong nhu mô. Tuy nhiên, sự hình thành của chúng cũng có thể được gây ra bởi tổn thương phổi do máy thở bất kể vị trí của phổi (16). Nếu được tìm thấy ở các vùng phổi không phụ thuộc (nondependent lung regions), người ta có thể cho rằng chúng là thứ yếu do quá căng (overdistention). Nếu được tìm thấy ở các vùng phổi phụ thuộc giữa (mid-dependent lung regions), chúng có thể là do lực cắt (shearing forces) từ mở và đóng khoảng khí (air-space) trong khu vực mà phổi có thể được huy động trong khi hít vào, nhưng áp lực dương cuối thì thở ra (PEEP) không đủ để giữ cho chúng liên tục mở.
Theo dõi lâu dài
Ở những bệnh nhân sống sót sau ALI/ARDS, một kiểu lưới đã được mô tả ở vùng phổi bình thường nhất không phụ thuộc. Nó đã được tìm thấy tương quan với thời gian thông khí cơ học và với việc sử dụng thông khí tỷ lệ đảo nghịch (inverse ratio ventilation) (17). Chúng tôi tin rằng cũng như với bullae, vị trí của xơ hóa có thể phụ thuộc vào việc tiếp xúc với thở máy. Vùng bị cản quang đậm đặc (phụ thuộc nhiều nhất) có thể không được thông khí, và do đó không tiếp xúc với chấn thương của thở máy (phần lớn do FiO2 và áp lực). Theo đó, một mối tương quan âm tính đã được ghi nhận giữa mức độ của kiểu lưới trên CT theo dõi và mức độ mờ đục nhiều trên CT scan ban đầu. Điều này cho thấy rằng xơ hóa chủ yếu xảy ra ở các khu vực tiếp xúc nhiều hơn với thở máy.
Sinh bệnh học của tổn thương hình thái
Gần đây, người ta đã chứng minh rằng ALI/ARDS do bị tổn thương trực tiếp qua đường thở (hít, viêm phổi) có cơ học hô hấp khác nhau và khả năng huy động thấp hơn ALI/ARDS có nguồn gốc từ các ổ ngoài phổi qua đường máu (chủ yếu là bệnh lý ở bụng, nhiễm trùng huyết) (18). Với tổn thương trực tiếp, người ta thấy sự tổn thương đa ổ của nhu mô phổi, trong khi với sự tổn thương gián tiếp, người ta sẽ thấy một sự tổn thương nhu mô lan tỏa và đồng nhất hơn do các hóa chất trung gian có nguồn gốc từ máu. Nó đã được chứng minh bằng thực nghiệm rằng với tổn thương gián tiếp, sự thay đổi chủ yếu là mô kẽ (19). Hơn nữa, vì sự tổn thương phổi gián tiếp thường là do các bệnh ở bụng, sự xẹp phổi ở đáy phổi tăng lên do áp lực ổ bụng tăng lên từ sự di chuyển lên phía trên của cơ hoành. Thật vậy, các kiểu hình thái CT trong ALI/ARDS phổi và ngoài phổi có phần khác nhau.
Trên thực tế, so sánh tiền cứu 22 bệnh nhân mắc ARDS tại phổi (ARDSp) sớm với 11 bệnh nhân mắc ARDS ngoài phổi (ARDSexp) sớm, Goodman và đồng nghiệp (20) phát hiện ra rằng ARDSexp có hình ảnh kính mờ đối xứng, với sự đông đặc (xẹp phổi) ở vùng lưng, trong khi ARDSp có xu hướng không đối xứng, với sự pha trộn giữa cản quang nhu mô dày đặc và cản quang kính mờ. Desai và đồng nghiệp (17), Winer-Muram và đồng nghiệp (21), và Rouby và đồng nghiệp (22) đã đưa ra kết luận tương tự nhưng không giống nhau. Thật không may, các nghiên cứu có sẵn còn hạn chế. Tất cả báo cáo đều có ít bệnh nhân. Thời gian bắt đầu chụp CT không đồng nhất và cài đặt máy thở khác nhau từng nghiên cứu. Hơn nữa, nhóm ARDSexp thường bao gồm các bệnh nhân bị bệnh ở bụng và sau phẫu thuật tim, trong đó sự xẹp thùy dưới bên trái là một phát hiện thường xuyên. Ngoài ra, những tổn thương trực tiếp và gián tiếp có thể cùng tồn tại (nghĩa là, một hoặc nhiều thùy với sự tổn thương trực tiếp và cả hai phổi với sự tổn thương gián tiếp) (20, 23), làm cho kiểu hình thái khó diễn giải.
PHÂN TÍCH ĐỊNH LƯỢNG CỦA HÌNH ẢNH CT SCAN
Thông tin liên quan nhất về sinh lý bệnh ALI/ARDS được lấy từ phân tích định lượng mật độ tia X của mô phổi được mô tả trên CT scan. Mặc dù có một số nguồn lỗi tiềm ẩn (24), phân tích dựa trên mối tương quan chặt chẽ giữa sự suy giảm tia X trong một thể tích mô hoặc voxel nhất định (đơn vị thể tích CT) và mật độ vật lý của thể tích phổi đó (nghĩa là tỷ lệ khối so với thể tích) (25). Độ suy giảm tia X của mô được biểu thị bằng số CT, hoặc đơn vị Hounsfield (HUs) (26). Số CT này thu được, trong bất kỳ voxel nào, bằng cách xác định tỷ lệ phần trăm bức xạ được hấp thụ bởi thể tích phổi đó. Như với bất kỳ kỹ thuật X-quang nào, độ hấp thụ càng lớn, bức xạ chiếu vào phim X-quang hoặc máy dò CT càng ít. Thang đo suy giảm tùy ý gán cho xương một giá trị +1.000 HU (hấp thụ hoàn toàn), tạo ra giá trị −1.000 HU (không hấp thụ) và nước có giá trị 0 HU. Máu và mô là 20-40 HU. Thật vậy, mối quan hệ giữa mật độ vật lý, trong bất kỳ vùng phổi quan tâm nào, giả sử trọng lượng riêng của mô bằng 1, có thể được biểu thị bằng:
volumegas/(volumegas+volumetissue)=meanCTnumberobserved/(CTnumbergas−CTnumberwater) (1)
Sắp xếp lại phương trình 1, có thể tính toán cho bất kỳ vùng phổi quan tâm nào (voxels tiếp giáp) trong đó tổng thể tích đã biết, thể tích của khí, thể tích (và trọng lượng) của mô và tỷ lệ khí/mô (27 , 28).
Ví dụ, một voxel −1.000 HU chỉ bao gồm khí, một voxel với 0 HU chỉ bao gồm nước (hoặc mô) và một voxel với −500 HU bao gồm khoảng 50% khí và 50% nước (hoặc mô).
Một số thành phần góp phần vào mật độ CT của phổi bình thường: lượng khí phế nang (1.000 HU), lượng mô phổi và máu (20-40 HU) và lượng nước (0 HU). Bởi vì mật độ vật lý là một tỷ lệ, cùng một sự gia tăng mật độ có thể xuất phát từ ít khí hoặc nhiều mô hơn. Trong giai đoạn đầu của ALI/ARDS, hàm lượng khí phế nang bị giảm, và “mô” thì tăng lên do phù mô kẽ và phế nang. Thật không may, voxel là một hộp đen, trong đó không thể phân biệt thành phần nào chịu trách nhiệm về mật độ CT.
Bởi vì đơn vị thể tích CT là voxel, được đặc trưng bởi số CT, nên xem xét những gì một voxel có thể bao gồm về mặt giải phẫu. Điều này phụ thuộc vào kích thước voxel và kích thước của phổi hình ảnh. Trong hình ảnh trục 10 mm tiêu chuẩn (kích thước ma trận 256 × 256), thể tích của một voxel 1,5 × 1,5 × 10 mm là 22,5 mm3 , xấp xỉ bằng một thể tích bình thường ở dung tích cặn chức năng (khoảng 16-22 mm3 , bao gồm ∼ 2.000 phế nang) (29). Do đó, một voxel, được coi là một đơn vị phổi CT cố định, có thể bao gồm, ở dung tích cặn chức năng trong phổi bình thường, cùng một lượng cấu trúc cơ bản của một acinus bình thường (ví dụ 2.000 phế nang, với khoảng 29% khí trong ống phế nang – alveolar ducts, 61% khí trong túi phế nang – alveolar sacs và 10% trong hàng rào mô – mạch máu – “tissue” barrier-capillaries). Tuy nhiên, các cấu trúc cơ bản có trong một voxel xuất phát từ nhiều hơn một acinus do hình dạng khác nhau của voxel (hình hộp) và của acinus (hình cầu gần đúng) và thực tế là một voxel không có khả năng xếp hàng hoàn hảo với một acinus. Các voxels khác có thể bao gồm các cấu trúc dày đặc hơn, chẳng hạn như động mạch, tĩnh mạch, tiểu động mạch, tĩnh mạch, thành phế quản và mạch bạch huyết. Tổng cộng, ở dung tích cặn chức năng, xem xét tất cả các cấu trúc phổi, khí là 70% và mô tế bào là ∼ 30%. Bằng cách tăng bơm phồng lên, voxel bao gồm ít cấu trúc hơn vì ở mức 75% tổng dung tích phổi, thể tích acinus tăng lên 30 -40 mm3 (1,5-2 lần so với thể tích voxel) (29). Mặt khác, khi acinus bình thường hoàn toàn xẹp, mất hết khí, thể tích của chúng chỉ bao gồm hàng rào mao mạch phế nang và máu, và lên đến 15-20 không có không khí nhưng nếu không thì acini bình thường có thể được đưa vào một voxel. Trong trường hợp phù nề, khi chất lỏng thay thế hoàn toàn khí, kích thước của acanus vẫn bình thường và một voxel phải bao gồm số lượng acini tương đương như trong điều kiện bình thường. Kiểu này được kiểu hóa trong Hình 3. Máy quét CT hiện tại có khả năng hình ảnh trục mỏng 0,5 mm (so với 10 mm, ma trận lớn hơn 512 × 512 hoặc 1.024 × 1.024) và voxels sẽ nhỏ hơn tương ứng. Các voxels nhỏ hơn làm tăng độ phân giải khoảng, giảm trung bình thể tích và cải thiện độ tin cậy của chỉ số mật độ CT.
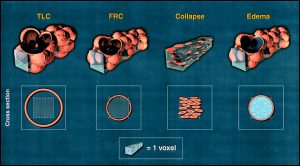
Phân phối tần số CT
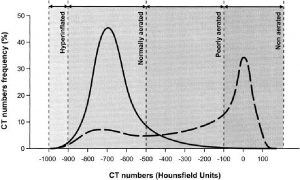
Phân tích này cho thấy các đơn vị phổi của CT (tức là, voxels) được phân phối như một hàm của mật độ vật lý của chúng (số CT – CT number). Phân phối tần số số CT thường được thực hiện trên 11 ngăn CT (từ -1.000 HU đến + 100 HU, mỗi bước là 100 HU) và số lượng voxels có trong mỗi ngăn được biểu thị bằng phần trăm của tổng số voxels được xem xét (27, 30). Như được hiển thị trong Hình 4, ở các đối tượng bình thường ở mức dung tích cặn chức năng, khoảng 50% đơn vị phổi CT được đặt trong khoang −600 HU đến −800 HU (nghĩa là trung bình, 70% khí và 30% mô). Với mức tổng dung tích phổi, ở những người bình thường, 20% đơn vị phổi CT chuyển sang khoang giữa −800 HU và −900 HU (tức là, 85% khí và 15% mô) (31). Khoang 0 HU, trong các đối tượng bình thường, không đáng kể, và có khả năng biểu thị cho các voxels chỉ hình ảnh cấu trúc phổi rắn hoặc lỏng, như thành phế quản, động mạch phổi và tĩnh mạch có kích thước lớn hơn một voxel.
Biết phân phối tần số số CT của một vùng quan tâm nhất định và tổng thể tích của nó (tức là mô + khí), có thể tính toán, sắp xếp lại phương trình 1, lượng mô của mỗi ngăn. Điều đáng nhấn mạnh là mô tế bào không chỉ bao gồm mô phổi mà còn cả máu, nước ngoại bào, mảnh vụn tế bào, v.v. (tức là tất cả các vật liệu có mật độ khoảng 0 HU).
Khoang phổi
Để định lượng các vùng phổi với sục khí khác nhau, có hai cách tiếp cận cơ bản. Đầu tiên, diện tích mật độ, như được thấy về mặt hình thái (tức là, đông đặc hoặc hình kính mờ), được ước tính (trực quan hoặc điện tử) theo tỷ lệ phần trăm của tổng diện tích phổi được nghiên cứu (4). Thứ hai là dựa trên phân bố tần số số CT của phổi, trong đó (Hình 4) một voxel được sục khí bình thường có thể được phân biệt với một voxel kém hoặc không được sục khí (30). Về mặt số lượng, hầu hết các tác giả định nghĩa bốn loại khoang phổi: bơm phồng quá mức (hyperinflated), sục khí bình thường (normally aerated), sục khí kém (poorly aerated) và không được sục khí (nonaerated). Giới hạn HU của các ngăn này thay đổi một chút từ điều tra viên này sang điều tra viên khác (2, 30-35) (Bảng 1).
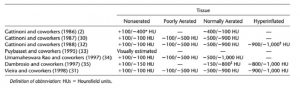
Thật vậy, khoang bơm phồng quá mức thích hợp với việc nạp đầy acini bằng không khí. Khoang “sục khí kém” (có giá trị định lượng tương đương của hình kính mờ) có tỷ lệ khí/mô cũng như các đối tượng bình thường, ít nhất là khi cuối thì thở ra, nhưng khoang này lan rộng hơn trong bệnh cảnh ALI/ARDS. Khoang không được sục khí, trong hầu hết các trường hợp, bao gồm các voxels trong khoảng −100 HU đến 0 HU, nghĩa là, với tỷ lệ khí/mô từ 1/10 giảm xuống bằng 0. Điều này có thể do sụp đổ đường thở nhỏ, một phần khí còn lại trong phế nang bị sụp đổ.
Khi so sánh kết quả của các tác giả khác nhau, họ thường sử dụng cùng một thuật ngữ (như bơm phồng quá mức, sục khí bình thường, sục khí kém và không sục khí), nhưng điều quan trọng là so sánh các điểm cắt CT mà họ sử dụng trong định nghĩa của họ. Ví dụ, khoang “bơm phồng quá mức” được định nghĩa là -1.000 HU đến −900 HU (32) khá khác biệt với khoang “bơm phồng quá mức” được định nghĩa là -1.000 HU đến −800 HU (35). Các biến thiên như vậy có thể giải thích kết luận khác nhau hoặc tương phản nhau.
GIAO THỨC CT SCAN VÀ PHÂN TÍCH ẢNH HƯỞNG KẾT QUẢ
Để so sánh các nghiên cứu khác nhau và để giải thích lý do cho một số kết quả trái ngược nhau, điều quan trọng là phải hiểu giới hạn của các giao thức và phân tích khác nhau được sử dụng bởi các tác giả khác nhau.
Một đến ba lát so với CT scan toàn bộ phổi
Hai giao thức quét CT cơ bản được mô tả trong tài liệu. Truyền thống hơn sử dụng một đến ba hình ảnh trục để suy ra toàn bộ hành vi của phổi. Với sự sẵn có của máy quét CT nhanh hơn, hiện tại có thể tái tạo toàn bộ phổi (31) và giá trị của phương pháp từ một đến ba hình ảnh đã được đặt câu hỏi (36). Cả hai phương pháp đều có ưu điểm và nhược điểm (37). Cách tiếp cận một đến ba hình ảnh cho phép thử nghiệm nhiều lần trong khi hạn chế phơi nhiễm tia X. Thử nghiệm có thể được thực hiện ở nhiều mức áp lực đường thở áp dụng, hít vào và thở ra, các tư thế khác nhau, v.v … Các giới hạn của lấy mẫu đại diện là 2 lần: đầu tiên, nếu suy giảm phổi là không đồng nhất, càng ít lát cắt có thể càng ít đại diện hơn; thứ hai, cách tiếp cận này không thể quét chính xác cấu trúc giải phẫu giống nhau vì phổi “di chuyển” trên các cài đặt khác nhau.
Quét CT liên tục của toàn bộ phổi là một công cụ nghiên cứu lý tưởng, vì nó cho phép hình dung toàn bộ phổi và nghiên cứu mức độ phổi bằng cách sử dụng các dấu hiệu giải phẫu xác định. Tuy nhiên, rất khó để quét lại toàn bộ bệnh nhân trong nhiều điều kiện thử nghiệm vì khả năng tiếp xúc với tia X. Trên thực tế, các nghiên cứu hiện có về toàn bộ phổi chỉ khám phá hai điều kiện (PEEP 0 và 10 hoặc 15 cm H2O). Thật vậy, sự lựa chọn giữa hai phương pháp là sự đánh đổi giữa mức độ thông tin chính xác hơn nhưng ít về một số tình trạng hô hấp và thông tin kém chính xác hơn nhưng phạm vi điều kiện thử nghiệm rộng hơn nhiều.
Huy động
Chụp CT là một công cụ độc đáo để phân biệt giữa huy động (sục khí của các vùng phổi không sục khí trước đây) và bơm phồng (sục khí thêm các vùng phổi đã bị bơm phồng sẳn). Từ năm 1987, chúng tôi đã định nghĩa huy động là sự khác biệt trong mô không được sục khí, tính bằng gam, trong các điều kiện thông khí khác nhau (30). Mặc dù giới hạn của kỹ thuật cắt một đến ba CT, cách tiếp cận này đã cải thiện sự hiểu biết của chúng ta về các cơ chế PEEP, sự xẹp và mở trong chu kỳ hô hấp, và sự tương tác giữa xẹp cuối thì hít vào/cuối thì thở ra.
Gần đây, Malbouisson và đồng nghiệp (36) đã đề xuất một phương pháp mới để tính toán huy động, trong đó không chỉ tính đến mô không được sục khí mà còn cả mô được sục khí kém, xác định huy động là lượng khí đi vào vùng sục khí kém và không được sục khí, khi tăng áp lực đường thở.
Hai cách tiếp cận tạo ra kết quả khác nhau vì bản chất chúng khác nhau. Cách đầu tiên phân biệt rõ ràng giữa huy động (giảm mô không sục khí) và bơm phồng, và cách thứ hai xác định lượng khí được đưa vào phổi bị bệnh (thay đổi tổng thể sục khí ở mô không được sục khí và kém sục khí) (37). Chúng tôi tin rằng vấn đề không phải là tốt hơn, mà đơn giản là họ chỉ mô tả hai hiện tượng khác nhau và do đó, không thể so sánh được.
Bơm phồng quá mức và quá căng
Vào năm 1984, Hayhurst và đồng nghiệp đã báo cáo rằng trong khí phế thũng có sự thay đổi rõ ràng về phân bố tần số số CT về phạm vi từ −900 HU đến -1.000 HU, trong ngăn bơm phồng quá mức (hyperinflated compartment) (38). Thật vậy, có rất ít nghi ngờ rằng CT scan là một công cụ hữu ích để phát hiện bơm phồng quá mức. Ở bệnh nhân ALI/ARDS, Dambrosio và đồng nghiệp (35) nhận thấy rằng trên điểm uốn trên của đường cong áp lực thể tích, số lượng voxels trong khoảng từ -1.000 HU và −800 HU tăng ∼ 10%. (Lưu ý: Mức cắt −800 HU cao hơn mức cắt thường được sử dụng là − 900 HU.) Vieira và đồng nghiệp (31) nhận thấy rằng trong sáu bệnh nhân mắc ALI/ARDS, tăng áp lực gây ra sự gia tăng của khoang bơm phồng quá mức. Kết luận là trong ALI/ARDS, CT scan là một công cụ hữu ích để phát hiện tình trạng quá căng phổi (overdistention) do thông khí cơ học. Trong một nghiên cứu trước đây (32), chúng tôi đã phát hiện ra rằng trong ALI/ARDS, ở PEEP là 15 cm H2O, ngăn từ −1.000 HU đến −900 HU chỉ là 4% (nghĩa là trong phạm vi quan sát được ở các đối tượng bình thường ở FRC) và chúng tôi đã kết luận rằng bơm phồng quá mức không được tìm thấy trong ALI/ARDS. Theo quan điểm của chúng tôi, những kết quả trái ngược nhau này xuất phát từ việc sử dụng không phù hợp các từ bơm phồng quá mức (hyperinflation) và căng phổi quá mức (over- distention) hoặc quá căng phổi (overstretching), một cách thường được sử dụng không chính xác như từ đồng nghĩa. Trên thực tế, bơm phồng quá mức nên đề cập đến việc nạp đầy khí (nghĩa là tỷ lệ khí/mô lớn hơn 9/1), trong khi căng phổi quá mức và quá căng phổi nên đề cập đến sức căng của thành phế nang (áp lực). Trong ARDS nghiêm trọng, trong đó toàn bộ phổi có thể tích tăng lên, áp lực tăng có thể dẫn đến căng phổi quá mức, nhưng không đạt được con số tới hạn − 900 HU. Thật vậy, điều quan trọng là phải nhận ra rằng phổi có thể bị overdistended và không bị hyperinflated (trong ARDS nặng) và ngược lại (trong khí phế thũng).
CẤU TRÚC – CHỨC NĂNG LIÊN QUAN TRONG TOÀN BỘ PHỔI
Trao đổi khí
Trong hầu hết các nghiên cứu, lượng mô không sục khí được nhìn thấy trên CT (0 đến -100 HU) và sự biến thiên của nó có mối tương quan tốt với giảm oxy máu và tỷ lệ shunt (20, 32, 39-41). Những kết quả này cũng được quan sát thấy ở những đối tượng bình thường trong quá trình liệt cơ và gây mê (42). Mặc dù mối quan hệ giữa giảm oxy máu và mô không được sục khí nhìn thấy trên CT rất đơn giản, nhưng vai trò của mô được sục khí kém (−500 đến -100 HU) trong sự phát triển của thiếu oxy máu là không rõ . Mô sục khí kém hoặc cản quang kính mờ không tương quan với giảm oxy máu (14, 20, 30), trong khi đó, kết hợp với nhau, cả hai hình kính mờ và đông đặc (20, 35) và mô kém và không sục khí (36) có tương quan với thiếu oxy.
Theo chúng tôi, một sự hiểu biết dứt khoát về mối quan hệ cấu trúc phổi – trao đổi khí sẽ chỉ có thể xảy ra khi đo tưới máu khu vực. Trên thực tế, với CT scan, có thể đo được sục khí của chỉ một vùng nhất định. Có rất ít nghi ngờ rằng khoang không sục khí là một khu vực shunt. Tuy nhiên, chúng tôi không biết nó được tưới máu ở mức độ nào. Mặt khác, khoang chứa mô sục khí kém (có tỷ lệ khí/mô giữa 1/10 và 5/5) cũng có khả năng oxy hóa máu. Ở mức FiO2 cao, sự đóng góp của nó đối với tình trạng thiếu oxy sẽ giảm. Thật không may, chúng tôi không biết tưới máu của từng ngăn. Tương tự, chúng ta không biết động lực của thông khí trong một vùng phổi nhất định. Trên thực tế, CT scan chỉ cung cấp thông tin về bơm phồng tĩnh; nó không trực tiếp đo thông khí khu vực. Ví dụ, khoang được sục khí bình thường, nếu được tưới máu và căng phổi quá mức, thông thường có trao đổi oxy, thông qua một loại oxygen hóa ngưng thở (apneic oxygenation), nhưng không thể trao đổi carbon dioxide thông thường, do thông khí giảm.
Mặc dù chúng ta thiếu kiến thức về sự phân bố giải phẫu của thông khí và tưới máu khu vực trong ALI/ARDS, nhưng có bằng chứng mạnh mẽ rằng, ít nhất, khoang không được sục khí là khu vực của shunt, và tái mở nó ra (reexpansion) thường liên quan đến tăng oxygen hóa máu (32).
Cơ học phổi
Thông tin quan trọng nhất từ phân tích CT của ALI/ARDS được lấy từ nghiên cứu về mối quan hệ giữa dữ liệu CT và cơ học phổi. Cho đến năm 1986, trên thực tế, có một niềm tin phổ biến, với một số ngoại lệ (43), rằng phổi ALI/ARDS là cứng vì độ giãn nở thấp của hệ hô hấp.
Thật bất ngờ, người ta phát hiện ra rằng độ giãn nở hô hấp không liên quan đến lượng mô không được sục khí hoặc được sục khí kém, nhưng nó có liên quan chặt chẽ với lượng mô được sục khí thông thường, nhận phần lớn khí được bơm vào. Do đó, độ giãn nở hô hấp trong ALI/ARDS sớm dường như là thước đo trực tiếp của mô được sục khí thông thường (30), cho thấy rằng trong ALI/ARDS, phổi được sục khí không phải là cứng, hay mà là nhỏ (the “baby lung”).
PHÂN TÍCH CT KHU VỰC
Thông tin phù hợp nhất về sinh lý ALI/ARDS xuất phát từ phân tích phổi khu vực, được thực hiện bằng cách chia mỗi hình ảnh trục CT thành 10 khoảng cách đều nhau, từ xương ức đến đốt sống. Ở mỗi khoảng phổi, phân tích tương tự được mô tả cho toàn bộ phổi được áp dụng. Trong thực tế, biết thể tích của từng cấp độ và mật độ vật lý của nó (tính bằng HU), có thể tính toán mô phổi và thể tích khí khu vực và tỷ lệ khí/mô (44, 45). Hơn nữa, giả sử rằng áp lực (trọng lượng) được truyền đến nhu mô phổi phụ thuộc như trong một chất lỏng, có thể tính toán, tại mỗi khoảng phổi dọc theo trục xương ức, áp lực do mô bên trên gây ra. Áp lực chồng lên (superimposed pressure) sau đó được ước tính bằng cách nhân mật độ với chiều cao (46).
Theo đó: SPlevel=[1−(CT/−1,000)]×Ht+SPabove levels (2)
Trong đó CT là số CT trung bình của cấp đã cho và Ht là chiều cao của cấp đó.
Phân bố phù và thể tích phổi
Như được hiển thị trong Hình 5, chúng tôi thấy rằng khối mô, được đo ở mỗi trong số 10 mức phổi dọc theo trục xương ức, gần gấp đôi thể tích bình thường ở mức đó (46). Điều này cho thấy phù nề (nghĩa là khối mô quá mức (excess tissue mass) so với các đối tượng bình thường) phân bố đều khắp nhu mô phổi, như được tìm thấy trong môi trường thí nghiệm (47, 48) và trong ALI/ARDS, sử dụng phương pháp chụp cắt lớp phát xạ positron (PET) (49). Kích thước phổi, theo trục trước sau, tương tự ở bệnh nhân ALI/ARDS và ở những người bình thường, cho thấy rằng, ít nhất là trong phép chiếu này, phù thay thế một lượng khoảng khí bằng nhau, duy trì thể tích phổi (thể tích khí + thể tích mô). Puybasset và các đồng nghiệp (11), sử dụng hình ảnh CT xoắn ốc liền kề từ đỉnh đến đáy phổi và tái tạo đa nhân, đã tìm thấy, như chúng tôi đã làm, thể tích phổi theo chiều trước sau (antero- posterior) không thay đổi, nhưng họ đã quan sát thấy giảm 15% kích thước theo chiều từ đỉnh đến đáy (cephalocaudal) của phổi trong ALI/ARDS (xem bên dưới).
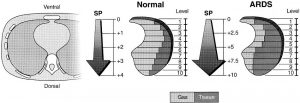
”Tuy nhiên, thể tích tăng lên gây ra áp lực chồng chất (SP) tăng lên, do đó, dẫn đến khí bị nén ép từ vùng phổi phụ thuộc nhiều nhất. Áp lực chồng chất được biểu thị bằng cm H2O. Các giá trị được chỉ ra trong các số liệu được lấy từ Pelosi và đồng nghiệp (46).”
Áp lực chồng chất và PEEP
Phân tích khu vực CT, cho thấy sự phân bố không theo trọng lực của phù, là mâu thuẫn rõ ràng với phân bố theo trọng lực bằng nhau của mật độ. Vì thể tích mô quá mức không lớn hơn ở các vùng phụ thuộc, nên lời giải thích duy nhất cho sự tăng mật độ theo trọng lực là sự giảm hàm lượng khí dọc theo trục xương ức (46, 50). Điều này không phụ thuộc vào giảm vùng phụ thuộc trong bơm phồng khu vực và mật độ CT tăng cũng được tìm thấy ở các đối tượng bình thường (51). Nó đã được quy cho một số yếu tố: hình dạng lồng ngực, trọng lượng phổi và phân phối trọng lực của máu trong mao mạch phổi (24). Tất cả các yếu tố này làm tăng áp lực màng phổi dọc theo trục dọc, làm giảm áp lực xuyên phổi (áp lực đường thở – áp lực màng phổi) là lực cản của phổi. Độ dốc áp lực màng phổi dọc bình thường ở vị trí nằm ngửa (bằng với độ dốc áp lực xuyên phổi) có thứ tự là 2-3 cm H2O (52), cùng độ dốc với áp lực chồng chất. Trong ALI/ARDS, hình dạng lồng ngực ở kích thước trước của nó tương tự như bình thường (11, 46). Cũng không có bằng chứng cho thấy máu tích lũy quá mức ở các vùng phổi phụ thuộc. Trên thực tế, thể tích mô quá mức trong đó “máu thừa quá mức” không cao hơn ở vùng phổi không phụ thuộc. Thật vậy, mặc dù hình dạng lồng ngực và phân phối máu khá ổn định, nhưng điều thay đổi trong ALI/ARDS là áp lực chồng chất (trọng lượng của phổi), tăng gấp đôi hoặc gấp ba so với bình thường (Hình 5). Nghiên cứu gần đây đã chỉ ra rằng những thay đổi áp lực chồng chất, được đo bằng CT scan, có mối tương quan chặt chẽ với thay đổi áp lực màng phổi, được đo trực tiếp ở các mức phổi khác nhau trong khoang màng phổi (40).
Sự gia tăng áp lực chồng chất là yếu tố chủ yếu của sự tái phân bố lại mật độ phổi ở tư thế nằm sấp (Hình 6), khi các lực hấp dẫn bị đảo ngược (44). Điều này giải thích, ít nhất là một phần, cơ chế của PEEP (45). Trên thực tế, chúng tôi đã có thể chỉ ra rằng PEEP chống lại áp lực chồng chất một cách hiệu quả. Để tiếp tục mở các vùng phổi phụ thuộc nhất, phải áp dụng PEEP bằng hoặc lớn hơn áp lực chồng lên vùng đó. Ở phổi giữa, nơi giảm áp lực chồng chất, cần ít PEEP hơn để giữ cho phổi mở và không cần PEEP để mở các vùng phổi không phụ thuộc, vì không có lực nén nào xuất hiện trong phần nhu mô phổi này.
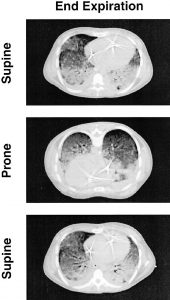
Những phát hiện này đã dẫn đến khái niệm về kiểu bọt biển: phổi ALI/ARDS làm tăng tính thấm của chính nó ở từng vùng với sự phân bố phù nề và thể tích phổi tăng lên gây ra xẹp phổi dưới trọng lượng của chính nó (53) (Hình 5) . Tuy nhiên, kiểu bọt biển không giải thích toàn bộ hành vi phổi ALI/ARDS, vì lực nén này không phải là trường hợp duy nhất gây xẹp phổi. Trong kiểu bọt biển lý tưởng, trên thực tế, tổng thể tích phổi (khí + mô) không được thay đổi, với sự thay thế khí bằng phù nề. Từ công việc của Puybasset và đồng nghiệp (11), chúng ta biết rằng trong ALI/ARDS, sự mất thể tích phổi tối đa là vùng đáy, gần với cơ hoành. Có một gradient từ đỉnh đến đáy phổi (craniocaudal) cũng như một gradient theo trục thẳng đứng từ ngực-bụng đến lưng (ventrodorsal). Điều này cho thấy rằng việc giảm áp lực xuyên phổi ở đáy phổi không chỉ là do áp lực chồng chất. Có khả năng là trọng lượng của tim (quan trọng hơn ở tư thế nằm ngửa so với nằm sấp) (54, 55) và tăng áp lực ổ bụng, như thường thấy trong ALI/ARDS có nguồn gốc ngoài phổi (18), cũng góp phần vào việc xẹp phổi vùng đáy.
Giả thuyết kiểu bọt biển phổi, nghĩa là tăng phù kẽ và khử khí tiến triển dọc theo trục bụng-lưng do áp lực chồng chất, gần đây đã được thử thách. Wilson và đồng nghiệp (56), trên cơ sở các công trình thí nghiệm trước đó (57) trong đó thể tích khu vực được đo bằng các điểm đánh dấu, đã đề xuất kiểu sau: trong phổi phù nề, áp lực đầu tiên khiến giao diện dịch-khí xâm nhập vào miệng của phế nang (áp lực đường thở khoảng 20 cm H2O), sau đó giao diện dịch- khí nằm trong phế nang và phổi trở nên co giãn tốt hơn. Sự khác biệt cơ bản giữa hai quan điểm là trong kiểu bọt biển, phù nề được cho là chủ yếu ở mô kẽ (gây ra sự sụp đổ phế nang do nén), trong khi đó trong kiểu giao diện dịch-khí, phù nề chủ yếu ở phế nang. Trong cả hai kiểu, tổng thể tích phổi là gần như bình thường.
CT SCAN VÀ CÀI ĐẶT MÁY THỞ
Mở phổi
Một trong những nền tảng của chiến lược bảo vệ phổi là mở phổi. Người ta đã nghĩ rằng việc mở phổi chủ yếu xảy ra xung quanh điểm uốn thấp hơn của đường cong áp lực thể tích (58). Tuy nhiên, từ lâu người ta đã biết rằng oxy hóa và độ giãn nở cải thiện khi thể tích thủy triều cao (và áp lực) được áp dụng (59). Gần đây, đầu tiên trên cơ sở lý thuyết và kiểu toán học (60, 61) và sau đó trong môi trường lâm sàng (62, 63), người ta đã đề xuất rằng việc huy động có thể xảy ra dọc theo toàn bộ đường cong áp lực. Đây là cao hơn điểm uốn dưới, như được đề xuất bởi sinh lý học cổ điển của phổi khỏe mạnh (64).
Chụp CT cung cấp bằng chứng trực tiếp rằng huy động là một hiện tượng hô hấp (Hình 7). Trên thực tế, công việc gần đây đã giúp giải thích việc huy động dọc theo đường cong áp lực thể tích, cả trong môi trường thí nghiệm (chó oleic acid) (40) và ở bệnh nhân mắc ALI/ARDS (41). Việc huy động diễn ra dọc theo toàn bộ đường cong áp lực của điểm số cao hơn điểm uốn dưới và thậm chí trên điểm uốn trên, với sự phân bố khoảng xác định (từ bụng đến lưng và đỉnh đến đáy) (11, 40, 41). Hình dạng sigmoid của đường cong áp lực huy động ngụ ý một phân phối gaussian của áp lực mở. Nói cách khác, như đã đề xuất trước đây về lập luận lý thuyết (60) và suy luận lâm sàng (65), có vẻ như trong phổi ALI/ARDS có các vùng có áp lực mở khác nhau, dao động từ vài cm H2O đến 45-70 cm H2O (40, 41). Phạm vi này có thể là do các loại xẹp phổi khác nhau. Trong thực tế, áp lực mở cho sự sụp đổ đường thở nhỏ (điển hình của sự xẹp phổi do nén) là ở mức 20 cm H2O (xẹp phổi lỏng lẻo – loose atelectasis), trong khi đó áp lực mở cần thiết để mở xẹp phế nang là theo thứ tự 30-40 cm H2O (xẹp phổi dính – sticky atelectasis) (66). Trong phổi bình thường, Rothen và đồng nghiệp (67) nhận thấy rằng áp lực cần thiết để xóa sự chèn ép phát triển trong quá trình gây mê và liệt cơ là khoảng 40 cm H2O.
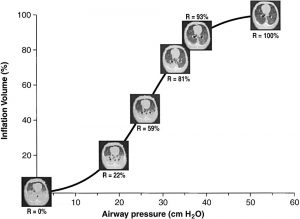
”Huy động xảy ra dọc theo toàn bộ đường cong áp lực thể tích, ngay cả sau điểm uốn trên. “R” chỉ ra tỷ lệ huy động xảy ra ở áp lực đường thở tương ứng. Dữ liệu được liên kết với đường cong sigmoid, theo Venegas và đồng nghiệp (60). Sắp xếp lại từ Pelosi và đồng nghiệp (40). Kết quả tương tự cũng thu được ở bệnh nhân (41).”
Tuy nhiên, điều quan trọng cần nhấn mạnh là áp lực mở thực sự là áp lực xuyên phổi (tức là áp lực đường thở được áp dụng trừ đi áp lực màng phổi). Với độ đàn hồi cao của thành ngực và áp lực màng phổi cao (như béo phì hoặc, ALI/ARDS có nguồn gốc từ bệnh ở bụng), áp lực đường thở cần thiết để đạt được áp lực xuyên phổi đủ có thể cao hơn 40 – 45 cm H2O. Tuy nhiên, thông điệp chính từ các nghiên cứu này là trong ALI/ARDS, một loạt các áp lực mở được phân phối khắp phổi.
Tương tác giữa cuối thở ra và cuối hít vào
Như đã thảo luận trước đây, áp lực chồng chất tăng làm giảm áp lực xuyên phổi, gây ra sự khử khí tiến triển dọc theo gradient bụng-lưng. PEEP chống lại các lực nén, giữ cho phổi mở. Điều này có nghĩa là trong một phổi nhất định và tại một PEEP nhất định, một lượng phổi cố định vẫn mở, không phụ thuộc vào lịch sử phổi trước đó. Tuy nhiên, sự sụp đổ cuối thì thở ra, ở một PEEP nhất định, phụ thuộc vào thì hít vào trước đó, cho thấy rằng sự sụp đổ cuối thì thở ra và cuối thì hít vào không phải là hiện tượng độc lập (40, 41). CT scan cung cấp bằng chứng rằng chúng có liên quan chặt chẽ. Trên thực tế, sự sụp đổ cuối thì thở ra lớn hơn khi áp lực cao nguyên hít vào trước đó thấp hơn, ở cả hai chó thực nghiệm (axit oleic) và ở bệnh nhân mắc ALI/ARDS. Điều này chỉ ra rằng những gì vẫn mở với PEEP chỉ là những gì đã được mở bởi áp lực hít vào trước đó. Ngoài ra, phổi chỉ mở nếu áp lực chồng chất thấp hơn PEEP áp dụng. Nếu áp lực chồng chất lớn hơn PEEP, bất cứ điều gì đã được mở ra bởi áp lực cao nguyên hít vào sẽ sụp đổ khi thở ra.
Những phát hiện này nhấn mạnh khái niệm rằng PEEP là một thủ thuật cuối thì thở ra, giữ cho phổi mở ở một mức độ nhất định, tùy thuộc vào độ mở của hít vào trước đó và áp lực chồng chất. Thật vậy, việc chọn mức PEEP dựa trên nhánh hít vào của đường cong áp lực – thể tích dường như không có cơ sở sinh lý vững chắc.
Phân phối khí trong thông khí cơ học
Chụp CT được lấy ở cuối hít vào khác biệt đáng kể so với khi thở ra. Một lần nữa, phân tích định lượng cung cấp thông tin phù hợp nhất. Trên thực tế, với cùng một thể tích thủy triều 10 ml/kg, người ta thấy rằng tăng PEEP từ 0 đến 20 cm H2O (và áp lực cao nguyên từ 21 đến 46 cm H2O) gây ra sự phân bố thông khí đồng nhất dần dần (68). Điều này dường như có liên quan đến hai hiện tượng. Đầu tiên, các vùng phổi không phụ thuộc trở nên ít giãn nở hơn, có thể là do sự kéo căng của các đơn vị phổi đã mở. Thứ hai, các vùng phổi phụ thuộc trở nên phù hợp hơn. Ở PEEP là 15 cm H2O và 20 cm H2O, hầu hết các đơn vị phổi, trước đó đã bị sụp đổ, vẫn mở và có thể chấp nhận thể tích khí cung cấp. Thông khí đồng nhất hơn thường liên quan đến quá trình oxy hóa tốt hơn, và các hiệu ứng PEEP gián tiếp này (tức là, những thay đổi trong độ giãn nở khu vực) có thể là một cơ chế khác qua đó PEEP cải thiện quá trình oxy hóa. Hiệu ứng thứ cấp này có thể quan trọng trong ARDS muộn, khi việc xẹp phổi nén ít có khả năng và tác dụng chính của PEEP (tức là, chống lại áp lực chồng chất) có thể giảm hoặc không có.
Sự sụp đổ của trong chu kỳ và khử xẹp
Người ta đã nhận ra rằng trong cả thí nghiệm (69- 71) và lâm sàng (72), việc mở và đóng cơ học của các đơn vị phổi thông qua chu kỳ hô hấp có thể gây ra barotrauma/volutrauma/biotrauma phổi, phóng thích các chất trung gian gây viêm có khả năng gây hại cho phổi. Chụp CT đã cung cấp bằng chứng trực tiếp về việc mở và đóng. Chúng tôi thấy rằng ở áp lực cao nguyên từ 21 đến 46 cm H2O, hầu hết việc huy động đã hoàn thành (68). Tuy nhiên, những gì vẫn mở sau đó phụ thuộc vào mức độ PEEP. Trong loạt bệnh nhân này, chỉ có PEEP 15 và 20 cm H2O là đủ để giữ cho acini mở mà chúng đã được huy động ở áp lực cao nguyên cao hơn. Do đó, CT scan xác nhận rằng sau khi thực hiện thủ thuật huy động tạo ra sự mở phế nang hoàn toàn, áp lực cao nguyên rất cao là không cần thiết. Thay vào đó, PEEP chỉ cần được giữ đủ cao để ngăn chặn sự sụp đổ cuối thì thở ra.
TÁC ĐỘNG CỦA CT SCAN TRÊN THỰC HÀNH LÂM SÀNG
Khi máy quét CT đã trở nên nhanh hơn và thường có sẵn hơn, chúng đang đóng vai trò ngày càng tăng trong chẩn đoán và quản lý bệnh nhân mắc bệnh hô hấp cấp tính (12). Hình ảnh cắt ngang cung cấp sự phân biệt mô tốt hơn và loại bỏ sự chồng chất của các cấu trúc, vốn có trong chụp X quang thông thường. Trong một nghiên cứu hồi cứu trên 74 bệnh nhân mắc ALI/ARDS, Tagliabue và đồng nghiệp (73) cho thấy tràn dịch màng phổi, xẹp phổi thùy phổi, áp xe phổi, tràn khí màng phổi cấp tính, barotrauma và không được chẩn đoán là thường xuyên hơn trên X-quang ngực. CT mang lại thông tin bổ sung trong 66% và ảnh hưởng đến điều trị trong 22%. Desai và Hansell (74) chỉ ra rằng CT được sử dụng tốt nhất để phát hiện các biến chứng ở những bệnh nhân đang xấu đi, hoặc không cải thiện với tốc độ dự kiến.
Những lợi thế của CT phải được cân bằng trước những rủi ro tiềm tàng khi vận chuyển bệnh nhân bị bệnh nặng, chi phí bổ sung và liều phóng xạ bổ sung. Theo thỏa thuận với Desai và Hansell (74), chúng tôi tin rằng CT được dành riêng để giải quyết các vấn đề nan giải lâm sàng hơn là cho hình ảnh thông thường.
Việc sử dụng CT gây tranh cãi hơn kết hợp với việc bắt đầu thở máy. Trong giai đoạn đầu của ALI/ARDS, CT rất hữu ích trong việc đánh giá bản chất và mức độ rộng của hình ảnh thâm nhiễm trên phổi của bệnh nhân và các đáp ứng của họ khi thở máy. Để hạn chế phóng xạ, phổi thường được chụp ảnh ở hai hoặc ba cấp độ, lặp lại cùng một mức độ ở các cài đặt máy thở khác nhau (ví dụ: cuối thì hít vào và ở các mức PEEP khác nhau). Việc sử dụng các áp lực khác nhau giúp phân biệt giữa các khu vực sụp đổ phế nang và đông đặc, cung cấp thông tin hữu ích về các thông số thông khí cơ học.
PHÁT TRIỂN MỚI VÀ NGHIÊN CỨU TƯƠNG LAI
Giờ đây, CT điện tử và máy quét xoắn ốc đa hướng mới có thể thu được hình ảnh trục ở tốc độ thứ hai (50, 500 ms) và giảm bức xạ, khắc phục một số hạn chế kỹ thuật và mối lo ngại về bức xạ của máy quét CT truyền thống. Tốc độ tăng này có thể được sử dụng để quét liên tục trên một khu vực cố định của phổi hoặc hình ảnh toàn bộ phổi, đỉnh đến đáy, trong chưa đầy 5 giây và giảm liều bệnh nhân.
Nếu bảng CT được giữ ở một vị trí cố định, có thể quét phổi nhanh liên tục trong chu kỳ hô hấp. Bởi vì phổi phồng lên và xì hơi ở các tốc độ khác nhau, và bệnh lý địa phương làm thay đổi bơm phồng và giảm phát, nên việc xem ciné hoặc phân tích máy tính tinh vi sẽ là cần thiết để cung cấp hiểu biết thứ hai về động lực học thông khí (75). Hình ảnh có thể được tiền cứu, hoặc hồi cứu, phân tích các giai đoạn cụ thể của chu kỳ hô hấp (76).
Quét nhanh cũng sẽ khắc phục vấn đề của sự sai lệch phổi từ vùng đỉnh đến đáy phổi trong quá trình hô hấp. Nếu một máy quét dò duy nhất được giữ ở một vị trí cố định, CT sẽ ghi lại hình ảnh các mức phổi khác nhau trong chu kỳ hô hấp, không thể so sánh định lượng chính xác. Máy chụp cắt lớp đa năng và chùm tia điện tử (EBCT) có thể quét nhanh qua các lát cắt liền kề (một thể tích mô), giúp có thể khớp hoàn hảo các vùng giải phẫu trong suốt chu kỳ hô hấp.
Mặc dù CT rất hữu ích trong việc tìm hiểu động lực học thông khí, nhưng nó đã không được sử dụng để phân tích tưới máu phổi trong ALI/ARDS. Không phân tích thích hợp tưới máu phổi khu vực và làm thế nào nó liên quan đến thông khí khu vực và các bất thường về hình thái, quét CT cung cấp một sự hiểu biết không đầy đủ về ALI/ARDS. Mặt khác, quét PET và chụp cộng hưởng từ (MRI) đã được sử dụng để đánh giá cả nước nội mô, tính thấm mao mạch và lưu lượng máu mao mạch (77, 78). Các máy vừa được bán trên thị trường kết hợp quét CT và PET thành một đơn vị, cung cấp mối tương quan giải phẫu chính xác giữa dữ liệu sinh lý của PET và dữ liệu giải phẫu của CT. Dữ liệu ba chiều, thay vì hai chiều sẽ có sẵn. Gần đây, CT tia điện tử (electron beam CT) đã được sử dụng để đánh giá tưới máu phổi và tương quan với hình thái phổi (79, 80). Hy vọng rằng, những cuộc hôn nhân kỹ thuật này sẽ tạo điều kiện cho một cuộc hôn nhân hiểu biết của chúng tôi về thông khí và tưới máu khu vực.





