Bài viết Phân tầng nguy cơ sử dụng SpO2/FiO2 và PEEP lúc chẩn đoán ARDS ban đầu và sau 24 giờ ở bệnh nhân ARDS vừa hoặc nặng được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Risk stratification using SpO2/FiO2 and PEEP at initial ARDS diagnosis and after 24 h in patients with moderate or severe ARDS
1. Tóm tắt
1.1 Bối cảnh
Chúng tôi đánh giá khả năng phân tầng nguy cơ của bệnh nhân ARDS sử dụng SpO2/FiO2 và áp lực dương cuối kỳ thở ra (PEEP) lúc khởi phát ARDS và sau 24 giờ.
1.2 Phương pháp
Chúng tôi đã sử dụng dữ liệu từ một nghiên cứu quan sát tiền cứu ở những bệnh nhân được nhận vào một đơn vị chăm sóc y tế chuyên sâu hỗn hợp phẫu thuật của một bệnh viện đại học ở Hà Lan. Phân tầng nguy cơ bởi điểm cắt (cut-off) SpO 2/FiO2 và PEEP. Kết quả chính là tử vong trong bệnh viện. Bệnh nhân có ARDS trung bình hoặc nặng với thời gian lưu trú > 24 giờ được đưa vào trong nghiên cứu này. Bệnh nhân được phân vào 4 nhóm nguy cơ được xác định trước: nhóm I (SpO 2/FiO2 ≥ 190 và PEEP < 10 cm H2O), nhóm II (SpO2/FiO2 ≥ 190 và PEEP ≥ 10 cm H 2O), nhóm III (SpO2/FiO2 < 190 và PEEP < 10 cm H2O) và nhóm IV (SpO2/FiO2 < 190 và PEEP ≥ 10 cm H2O).
1.3 Các kết quả
Phân tích bao gồm 456 bệnh nhân. SpO2/FiO2 và PaO2/FiO2 có mối tương quan mạnh mẽ (P <0,001, R2 = 0,676) có thể được mô tả trong một phương trình hồi quy tuyến tính (SpO2/FiO2 = 42,6 + 1,0 * PaO2/FiO2). Phân tầng nguy cơ tại chẩn đoán ARDS ban đầu đã dẫn đến các nhóm không có sự khác biệt về tỷ lệ tử vong tại bệnh viện. Phân tầng nguy cơ lúc 24 giờ đã dẫn đến các nhóm có tỷ lệ tử vong gia tăng. Mối liên hệ giữa việc phân nhóm theo 24 giờ và kết cục đã bị làm nhiễu bởi một số yếu tố, bao gồm điểm APACHE IV, pH động mạch và nồng độ lactate trong huyết tương, và liệu pháp vận mạch.
1.4 Kết luận
Trong nhóm thuần tập bệnh nhân ARDS vừa hoặc nặng, SpO2/FiO2 và PaO2/FiO2 có mối tương quan tuyến tính mạnh. Ngược lại với phân tầng nguy cơ khi chẩn đoán ARDS ban đầu, phân tầng nguy cơ sử dụng SpO 2/FiO2 và PEEP sau 24 giờ dẫn đến các nhóm có kết quả xấu đi. Phân tầng nguy cơ bằng cách sử dụng SpO 2/FiO2 và PEEP có thể thực tế, đặc biệt là trong các thiết lập giới hạn tài nguyên.
2. Giới thiệu
Ở định nghĩa Berlin về hội chứng suy hô hấp cấp (ARDS), phân tầng nguy cơ được đề xuất bằng cách phân loại bệnh nhân có ARDS ‘nhẹ’, ‘vừa phải’ hoặc ‘nghiêm trọng’ dựa trên PaO2/FiO2 lúc chẩn đoán ban đầu [1.] Cách tiếp cận này có một sốthách thức. Đầu tiên, nó đòi hỏi lấy mẫu và phân tích khí máu động mạch, tốn kém và thường xuyên không có sẵn, đặc biệt là trong các bệnh viện giới hạn tài nguyên. Thứ hai, cách phân loại bệnh nhân này không được khẳng định bằng các xác nhận bên ngoài [2]. Tuy nhiên, điều quan trọng nhất là mức áp lực dương cuối kỳ thở ra (PEEP) có thể ảnh hưởng đến PaO 2/FiO2 [3] và PaO2/FiO2 và PEEP được thu thập tại các thời điểm sau này, ví dụ 24 giờ sau chẩn đoán ARDS ban đầu, phần lớn cải thiện sự phân tầng nguy cơ [4, 5].
Do tính chất sigmoidal của đường cong phân ly oxyhemoglobin, độ bão hòa pulse oximetry (SpO2) có thể phục vụ như là một thay thế đáng tin cậy cho PaO 2 ở những bệnh nhân có SpO2 thấp hơn 97% [6]. Thật vậy, bệnh nhân có ARDS được chẩn đoán bằng phương tiện SpO2/FiO2 có các đặc điểm và kết quả tương tự như bệnh nhân được chẩn đoán ARDS bằng cách sử dụng PaO 2/FiO2 [7], và chỉ số độ bão hòa oxy (oxygen saturation index) cao trong 24 giờ kéo dài kết hợp với kết quả tồi tệ hơn trong trường hợp ARDS trẻ em [8]. Như pulse oximetry là không xâm lấn, rẻ tiền và có sẵn rộng rãi, SpO2/FiO2 có thể phục vụ như là một thay thế hấp dẫn cho PaO2/FiO2 trong phân tầng nguy cơ bệnh nhân ARDS.
Mục tiêu bao quát của cuộc điều tra hiện nay là xác định xem phân loại bệnh nhân sử dụng SpO2/FiO2 và PEEP khi chẩn đoán ARDS ban đầu và sau 24 giờ có thể được sử dụng để phân tầng cho nguy cơ tử vong. Cụ thể, chúng tôi đưa ra giả thuyết rằng SpO2/FiO2 có thể phục vụ như là một thay thế cho PaO2/FiO2 trong phân loại nguy cơ và phân loại lại bằng SpO2/FiO2 và PEEP sau 24 giờ cải thiện phân tầng nguy cơ trong một nhóm bệnh nhân người lớn ARDS trong một đơn vị chăm sóc đặc biệt (ICU) ở Hà Lan.
3. Phương pháp
3.1Thiết kế nghiên cứu
Chúng tôi đã sử dụng dữ liệu từ một nhóm quan sát tiền cứu ở bệnh nhân được chẩn đoán rõ ràng được nhận vào đơn vị chăm sóc chuyên sâu phẫu thuật – y tế hỗn
hợp của một bệnh viện đại học ở Hà Lan [9]. Những dữ liệu này đã được kết hợp với
dữ liệu oxy hóa được xác nhận bởi y tá tại thời điểm bắt đầu và sau 24 giờ được thu thập lại từ hệ thống quản lý dữ liệu bệnh nhân (Metavision®, iMDSoft, Tel Aviv, Israel). Hội đồng đánh giá thể chế của Trung tâm y tế học thuật đã phê duyệt giao thức nghiên cứu phụ huynh và sử dụng phương thức chấp thuận ‘không tham gia’ (IRB số 10- 056C).
3.2 Tiêu chí bao gồm và loại trừ
Một nhóm các nhà nghiên cứu ICU được đào tạo đã ghi nhận bệnh nhân về sự có hoặc không có ARDS theo các tiêu chuẩn được đưa ra bởi Hội nghị đồng thuận Mỹ- châu Âu về ARDS [10]. Mặc dù nghiên cứu này bắt đầu vào năm 2011 (tức là, trước khi công bố định nghĩa của Berlin về ARDS [1]), tất cả bệnh nhân được chẩn đoán mắc ARDS đều đáp ứng các tiêu chí về định nghĩa ARDS mới nhất. Bệnh nhân ARDS nhẹ đã được loại trừ như là bệnh nhân xuất viện hoặc chuyển sang một ICU khác trước 24 giờ sau khi chẩn đoán ARDS ban đầu.
3.3 Kết quả
Kết cục chính là nguyên nhân gây tử vong tại bệnh viện. Kết quả thứ cấp bao gồm tử vong ICU, tử vong 30 và 90 ngày và 1 năm, và số ngày không thở máy và sống ở ngày 28 (VFD-28), được định nghĩa là số ngày từ ngày 1 đến ngày 28 bệnh nhân còn sống và thở mà không cần sự trợ giúp xâm lấn của máy thở cơ học trong ít nhất 24 giờ liên tiếp.
3.4 Thu thập dữ liệu
Khi chẩn đoán ARDS ban đầu và sau 24 giờ, kết quả đo độ bão hòa oxy bằng pulse oximeter được thu thập hồi cứu, và SpO2/FiO2 tương ứng được tính toán. Đối với điều này, đầu tiên chúng tôi thu thập mười giá trị SpO2 và FiO2 đã được xác nhận y tá liên tiếp trong vòng 10 phút ngay trước đó, và tại thời điểm đó, một mẫu máu động mạch được lấy để phân tích khí máu. Giá trị trung bình của mười giá trị SpO 2 và FiO2 này được sử dụng để tính toán SpO 2/FiO2 để giảm giá trị SpO2 giả tạo tiền cứu. Ở tất cả các bệnh nhân, đo pulse oximetry được đo bằng dầu dò ngón tay hai bước sóng thông thường. Giao thức cục bộ quyết định thay đổi vị trí ngón tay cứ 3–4 giờ để tránh tổn thương chèn ép và sử dụng đầu dò thay thế, chẳng hạn như mũi và trán, chỉ ở những bệnh nhân không có tín hiệu thích hợp khi đo bằng đầu dò ngón tay. Thêm vào đó, nồng độ PaO2 và PaCO2, nồng độ pH và nhiệt độ cơ thể đã được thu thập, và bệnh nhân có được điều trị bằng thuốc co mạch ở cả hai thời điểm hay không.
Dữ liệu cơ bản được thu thập từ cơ sở dữ liệu gốc bao gồm dữ liệu nhân khẩu học và máy thở, các loại bệnh đi kèm, loại nhập viện, loại bệnh nhân và nguyên nhângây ra ARDS. Điểm APACHE IV [11] , điểm dự đoán tổn thương phổi [12] và điểm số bệnh kết hợp của Charlson đ[1ư3ợ] c tính toán.
3.5 Kế hoạch phân tích
Sự tương quan giữa SpO2/FiO2 và PaO2/FiO2 được nghiên cứu chỉ sử dụng SpO2/FiO2 và PaO2/FiO2 lúc chẩn đoán ARDS ban đầu. Giá trị SpO 2 > 97% được loại trừ khỏi phân tích tương quan vì đường phân ly oxyhemoglobin phẳng trên mức này và những thay đổi lớn trong PaO 2 có thể dẫn đến ít hoặc không có thay đổi trong SpO2, phù hợp với các nghiên cứu trước đây phân tích mối quan hệ này [6,14,15]. Phương trình phi tuyến (‘công thức Ellis’) cũng được sử dụng để ước tính PaO2/FiO2 từ các giá trị SpO2 và FiO2 [16,17].
Tiếp theo, chúng tôi phân loại tất cả các bệnh nhân lúc chẩn đoán ARDS ban đầu và tái phân loại bệnh nhân sau 24 giờ, thành bốn nhóm nguy cơ dựa trên việc xác định trước SpO2/FiO2 và PEEP. Như hai nghiên cứu gần đây về phân tầng nguy cơ bệnh nhân ARDS đã sử dụng một ngưỡng cho PaO 2/FiO2 là 150 mmHg [4,5], tương ứng với một SpO2/FiO2 là 190 [6], chúng tôi sử dụng giá trị này như một ngưỡng cho SpO2/FiO2 trong phân tích hiện tại. Chúng tôi đã sử dụng cùng một ngưỡng cho PEEP như trong hai nghiên cứu trước đây [4,5]. Theo đó, chúng tôi đã tạo ra bốn nhóm: SpO2/FiO2 ≥ 190 và PEEP < 10 cm H2O (nhóm I); SpO2/FiO2 ≥ 190 và PEEP ≥ 10 cm H2O (nhóm II); SpO2/FiO2 < 190 và PEEP < 10 cm H2O (nhóm III); và SpO2/FiO2 < 190 và PEEP ≥ 10 cm H2O (nhóm IV). So sánh giữa các nhóm bao gồm tất cả so sánh từng cặp trong bốn nhóm nguy cơ.
3.6 Phân tích thống kê
Dữ liệu được biểu diễn dưới dạng ± độ lệch chuẩn (SD) trung bình, với dải phân cách giữa (IQR) hoặc số có phần trăm, nếu thích hợp.
Một phân tích hai chiều và phân tích tương quan Pearson được sử dụng để mô tả mối quan hệ giữa SpO2/FiO2 (ước lượng tuyến tính và phi tuyến) và PaO2/FiO2. Hồi quy tuyến tính cho phép định lượng đường hồi qui tốt nhất và lấy được một phương trình dự đoán cho mối quan hệ. Do đó, dựa trên phương trình hồi quy có nguồn gốc, chúng tôi thu được các giá trị SpO 2/FiO2 tương ứng với các giá trị tỷ lệ PaO 2/FiO2 là 100, 150 và 200 mmHg. PaCO2, pH động mạch, nhiệt độ cơ thể, PEEP và sử dụng các thuốc co mạch đã được thử nghiệm dưới dạng các điều kiện tương tác trong mô hình để đánh giá sự kiểm duyệt của mối liên hệ giữa SpO2/FiO2 và PaO2/FiO2. Khu vực dưới đường cong đặc tính vận hành của người nhận (ROC, receiver operating characteristic) đánh giá khả năng ứng dụng của SpO2/FiO2 trong phân biệt ARDS vừa phải với nặng.
Sự khác biệt giữa các nhóm nguy cơ đã được thử nghiệm với Pearson Chi- square hoặc Fisher kiểm tra chính xác cho các biến phân loại và với một chiều ANOVA hoặc Kruskal-Wallis thử nghiệm cho các biến liên tục. Tỷ lệ tử vong tại bệnh viện và các điểm cuối tử vong khác được tính cho mỗi nhóm, và giá trị P cho xu hướng được tính từ một thử nghiệm bình phương cho xu hướng theo tỷ lệ (thí nghiệm Cochrane – Armitage), kiểm tra giả thuyết không tỷ lệ trong một số nhóm là như nhau. So sánh cặp đôi tại chẩn đoán ARDS và sau 24 h được thực hiện bằng cách sử dụng phương pháp dự đoán ma trận tương phản trong đó các tỷ số chênh (OR, odd ratio) và khoảng tin cậy 95% được tạo cho mỗi so sánh lẫn nhau giữa các nhóm.
3.7 Phân tích sau nghiên cứu (Post hoc analyses)
Một số phân tích hậu kỳ đã được thực hiện. Đầu tiên, chúng tôi đánh giá liệu việc chuyển đổi dữ liệu thành phân số (1/(PaO2/FiO2) và 1/(SpO2/FiO2)) đã cải thiện sự phù hợp giữa SpO2/FiO2 và PaO2/FiO2, như đã báo cáo trước đây [18].
Thứ hai, phân loại nguy cơ sử dụng ngưỡng xác định Berlin cho ARDS nặng (tức là 100 mm Hg) [đ6ã] được thực hiện.
Thứ ba, trong phân tích cuối cùng, chúng tôi đã phân tích liệu mối liên hệ giữa phân tầng nguy cơ và tử vong trong bệnh viện có bị ảnh hưởng bởi các yếu tố như mức độ nghiêm trọng của bệnh và các thông số sẵn có khác trong cơ sở dữ liệu hay không, như pH động mạch và nồng độ plasma lactate, mức huyết áp và liệu pháp thuốc vận mạch. Đối với phân tích này, mô hình hồi quy logistic đa biến được xây dựng để đánh giá tác động gây nhiễu của các biến này trên mối liên hệ giữa các nhóm nguy cơ và kết quả chính.
Tất cả các phân tích được thực hiện trong R thông qua giao diện R-studio (R phiên bản 3.0, www.r-project.org). Giá trị P dưới 0,05 được coi là đáng kể.
4. Các kết quả
4.1 Bệnh nhân
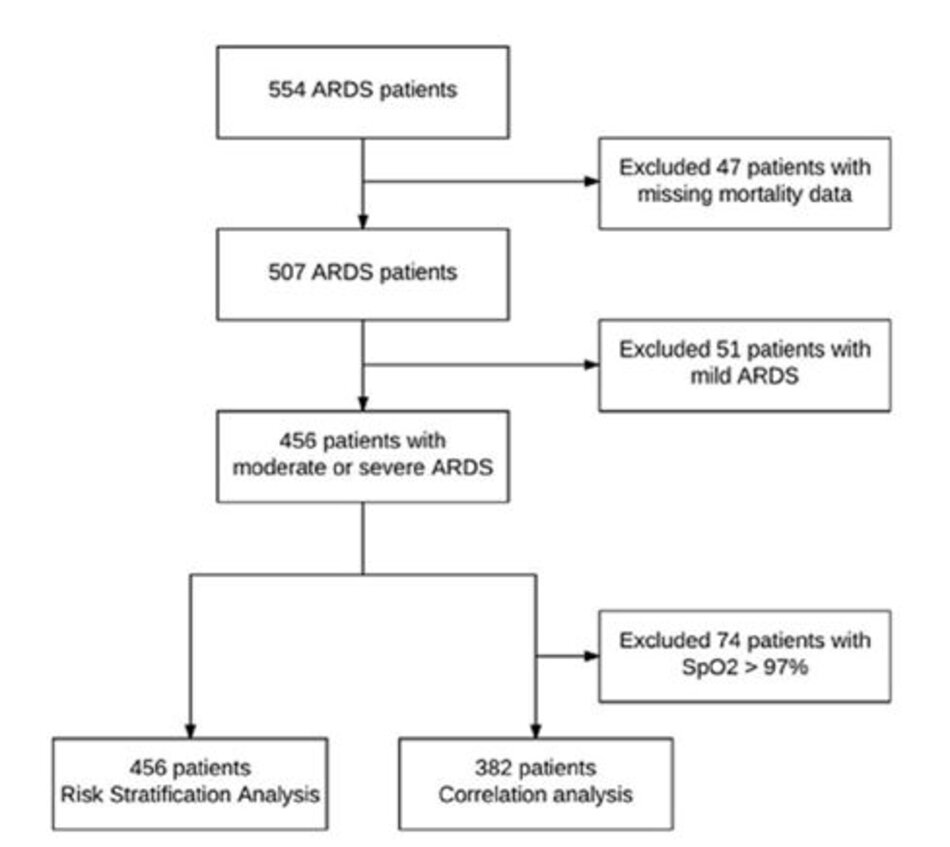
Trong số 554 bệnh nhân có ARDS, 456 bệnh nhân được phân loại là ARDS trung bình hoặc nặng theo định nghĩa của Berlin và có các bộ dữ liệu hoàn chỉnh. Trong số đó, 382 có thể được sử dụng cho các phân tích tương quan và tất cả các bệnh nhân để phân tích phân loại và phân loại lại (Hình 1). Viêm phổi, nhiễm trùng huyết, phẫu thuật lớn và chấn thương là nguyên nhân phổ biến nhất của ARDS (Bảng 1). Tại thời điểm ban đầu, không có sự khác biệt giữa những người sống sót và những người không sống sót về các thông số oxy hóa, kích thước thể tích khí lưu thông, Điểm dự đoán tổn thương phổi và nguyên nhân của ARDS. Ngoài ra, không có sự khác biệt về điểm số bệnh kết hợp. Tỷ lệ tử vong bệnh viện trong tổng thể là 39,7%. Những người không sống sót lớn tuổi hơn, có nồng độ pH động mạch thấp hơn khi chẩn đoán ARDS, được thở ở tần số thở cao hơn và có điểm số mức độ nghiêm trọng của bệnh cao hơn. Phân loại theo định nghĩa của Berlin không khác biệt giữa những người sống sót và những người không sống sót.
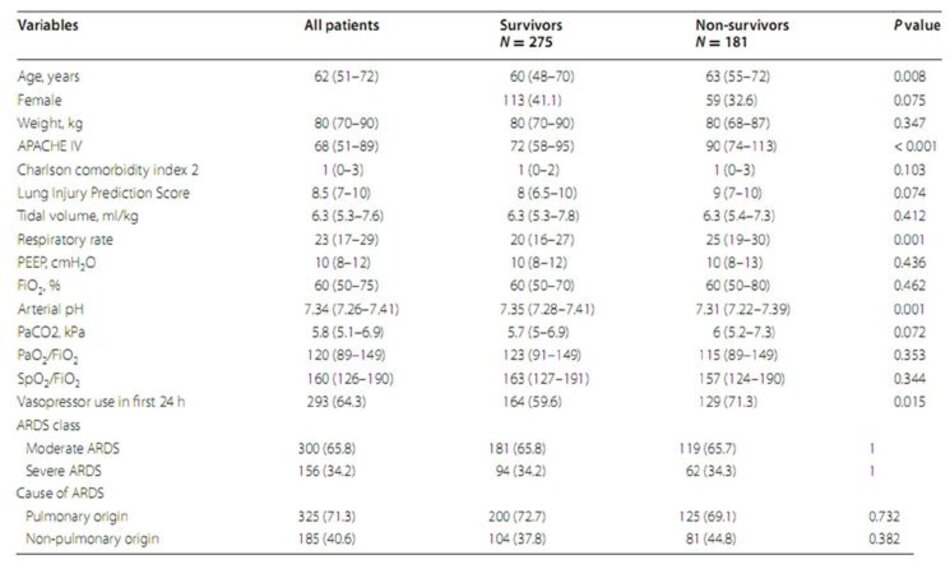
4.2 Mối quan hệ giữa SpO2/FiO2 và PaO2/FiO2
Sự tương quan giữa SpO2/FiO2 và PaO2/FiO2 rất mạnh (P <0,001, R2 = 0,676; Hình 2) và có thể được mô tả trong một phương trình hồi quy tuyến tính: SpO2/FiO2 = 42,6 + 1,00 ∗ PaO2/FiO2
![Hình 2: Phân tán SpO2/FiO2 so với PaO2/FiO2 tại chẩn đoán ARDS banđầu. Dòng đại diện cho mối quan hệ tuyến tính phù hợp nhất: SpO2/FiO2 = 42.6 + 1.0 * PaO2/FiO2 [P <0,001, R2 = 0,676] lúc chẩn đoán ARDS ban đầu](https://www.healcentral.org/wp-content/uploads/2021/02/b20_anh_3.jpg)
Dựa trên phương trình tìm thấy, một PaO2/FiO2 200 mm Hg tương ứng với một SpO2/FiO2 là 243 [95% CI 220–265], một PaO2/FiO2 150 mm Hg tương ứng một SpO2/FiO2 là 193 [95% CI 174–211] và một PaO2/FiO2 100 mm Hg tương ứng với SpO2/FiO2 là 143 [95% CI 127–158].
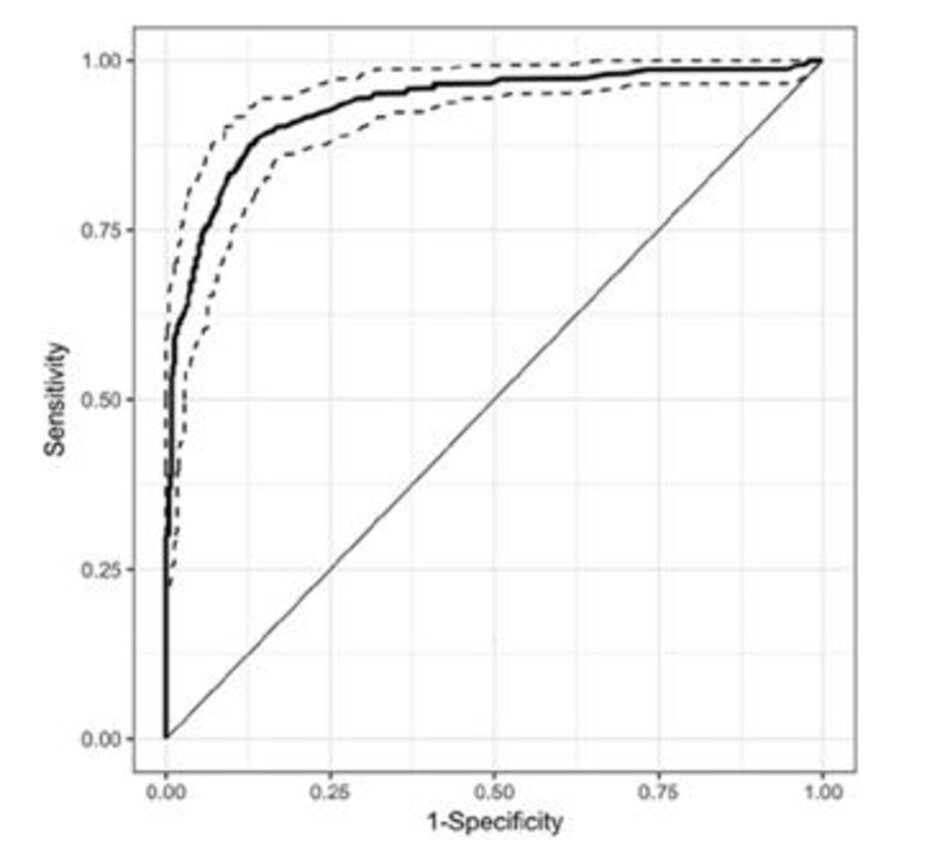
Các SpO2/FiO2 có khả năng tuyệt vời để phân biệt ARDS vừa phải với ARDS nghiêm trọng, với một khu vực ROC dưới đường cong là 0,928 (Hình 3). Công thức phi tuyến (công thức Ellis) để ước tính PaO 2/FiO2 từ SpO2 và FiO2 không vượt trội so với mô hình tuyến tính khi SpO2 ≤ 97% (N = 382, R2 = 0,656).
Việc sử dụng các phân số (1/SpO2/FiO2 và 1/PaO2/FiO2) không dẫn đến mối quan hệ tuyến tính mạnh hơn (R2 = 0,629). Tuy nhiên, phương trình hồi quy rất giống với phương trình được báo cáo trước đây ở bệnh nhi (1/SpO 2/FiO2 = 0,00424 + 0,46/ PaO2/FiO2) [18].
4.3 Phân cấp nguy cơ
Dữ liệu phân phối và kết quả cho bốn nhóm nguy cơ được trình bày trong Bảng 2. Không có xu hướng tăng tỷ lệ tử vong tại bệnh viện trong bốn nhóm nguy cơ lúc ban đầu (giá trị P cho xu hướng = 0,90). So sánh cặp đôi cũng cho thấy không có sự khác biệt đáng kểvề tỷ lệ tử vong tại bệnh viện giữa các nhóm tại lúc chẩn đoán ARDS. Ngược lại, phân loại tương tự sau 24 giờ đã dẫn đến các nhóm nguy cơ với tỷ lệ tử vong trong bệnh viện gia tăng (giá trị P cho xu hướng < 0,001). So sánh cặp đôi cho thấy sự khác biệt về tỷ lệ tử vong trong bệnh viện giữa nhóm IV và nhóm II (OR 2,40 [1,15–4,82]; P value = 0,012), và giữa nhóm IV và nhóm I là đáng kể (OR 2,47 [1,26– 4,85] ; P giá trị = 0,003) (Bảng 3).
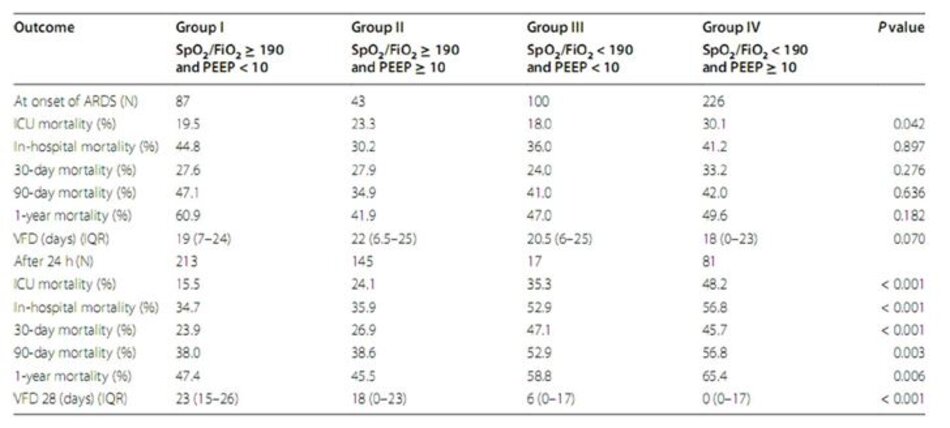
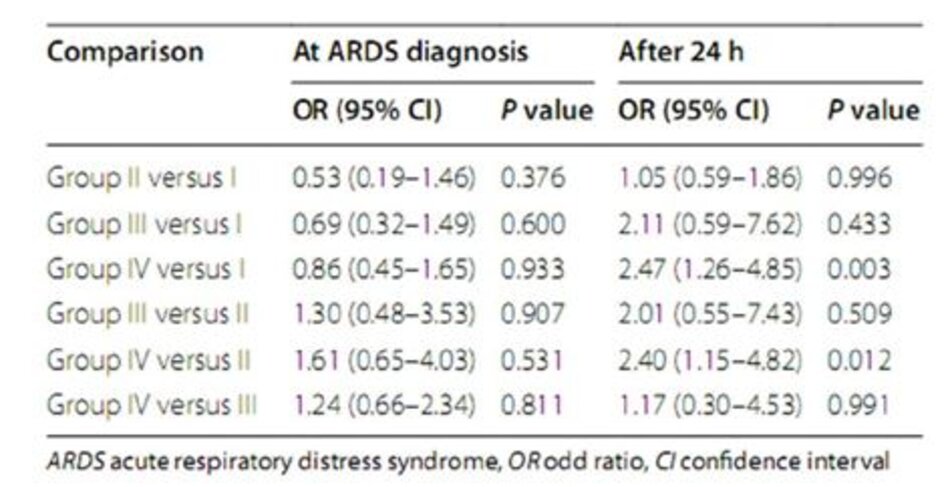
Các kết quả có thể so sánh được với các kết cục thứ cấp. Trong khi phân loại bằng cách sử dụng các điểm cắt cho SpO2/FiO2 và PEEP khi chẩn đoán ARDS ban đầu không liên quan đến bất kỳ kết cục nào, phân tầng nguy cơ ở 24 h dẫn đến xu hướng tích cực đáng kể giữa các nhóm và kết quả thứ yếu kém hơn ở nhóm IV so với nhóm I và nhóm II (Tệp bổ sung 1: Bảng E1).
Phân bố bệnh nhân ở mỗi nhóm nhỏ thay đổi đáng kể ở 24 giờ. Ít hơn một phần tư bệnh nhân duy trì có SpO2/FiO2 < 190; tỷ lệ tử vong tại bệnh viện của họ cao hơn nhiều so với bệnh nhân có SpO2/FiO2 ≥ 190 (56,1 so với 35,2%, P = 0,001). Một nửa số bệnh nhân được thông khí ở PEEP < 10 cm H 2O; tỷ lệ tử vong tại bệnh viện của họ tương tự như bệnh nhân được giữ ở PEEP ≥ 10 cm H 2O (36.1 so với 43.4 P = 0.107). Khi xem xét đặc điểm của bốn nhóm nguy cơ trong 24 giờ, chúng tôi nhận thấy sự khác biệt về mặt thống kê ở điểm APACHE IV, pH động mạch và FiO 2 ở 24 giờ, mức lactate huyết tương tối đa và sử dụng thuốc vận mạch, có thể giải thích sự khác biệt đáng kể về kết quả (Bảng 3).
4.4 Phân tích sau nghiên cứu (Post hoc analyses)
Phân tích post hoc với điểm cắt SpO 2/FiO2 tương ứng là 150, phù hợp với điểm cắt trong định nghĩa Berlin của PaO 2/FiO2 là 100 mm Hg, cho kết quả tương tự với phân tích chính, mặc dù kích thước nhóm đã thay đổi. Không có xu hướng nguy cơ nào khác ngoài tỷ lệ tử vong do ICU khi sử dụng ngưỡng này khi bắt đầu ARDS, trong khi một xu hướng đáng kể trong bốn nhóm nguy cơ được ghi nhận bằng điểm cắt sau 24 giờ (Tệp bổ sung 1: Bảng E2). So sánh giữa các nhóm cũng phản ánh phân tích ban đầu, không có sự tương phản rõ rệt với chẩn đoán ARDS, nhưng độ tương phản rõ ràng sau 24 giờ (nhóm IV so với nhóm I và II) (Tệp bổ sung 1: Bảng E3).
Mô hình đa biến cho thấy rằng điểm APACHE IV, nồng độ lactate trong huyết tương và pH động mạch làm nhiễu đáng kể mối quan hệ giữa sự phân tầng nhóm và tỷ lệ tử vong trong bệnh viện (tệp bổ sung 1: Bảng E4). Cũng áp dụng như vậy khi hạn chế phân tích này đối với các nhóm nguy cơ cao (tức là, nhóm I và IV), trong đó ngay cả liệu pháp vận mạch là một yếu tố gây nhiễu đáng kể (tệp bổ sung 1: Bảng E5).
5. Thảo luận
Theo hiểu biết tốt nhất của chúng tôi, đây là nghiên cứu đầu tiên trong đó bệnh nhân ARDS được phân loại bằng cách sử dụng các giá trị điểm cắt được xác định trước cho SpO2/FiO2 và PEEP. Những phát hiện có liên quan nhất của nghiên cứu này là: (1) SpO2/FiO2 xác nhận là một thay thế hợp lệ cho PaO2/FiO2 ở bệnh nhân ARDS vừa hoặc nặng; (2) phân loại lại sau 24 giờ sử dụng các ngưỡng cắt được xác định trước cho SpO2/FiO2 và PEEP cải thiện sự phân tầng nguy cơ so với các ngưỡng tương tự tại đường cơ sở; và (3) mối liên hệ giữa nhóm nguy cơ và kết cục, tuy nhiên, bị làm giảm đi bởi mức độ nghiêm trọng của bệnh, độ pH động mạch và mức lactate, và liệu pháp vận mạch. Chúng tôi tin rằng cách tiếp cận sử dụng SpO 2/FiO2 và PEEP để phân loại bệnh nhân có thể hữu ích cho việc thực hiện phương pháp tiếp cận cá nhân để chẩn đoán và điều trị thích hợp ở bệnh nhân ARDS, đặc biệt là ở những nơi khó khăn, nếu không nói là không thể, phân tích khí máu lặp lại (Bảng 4).
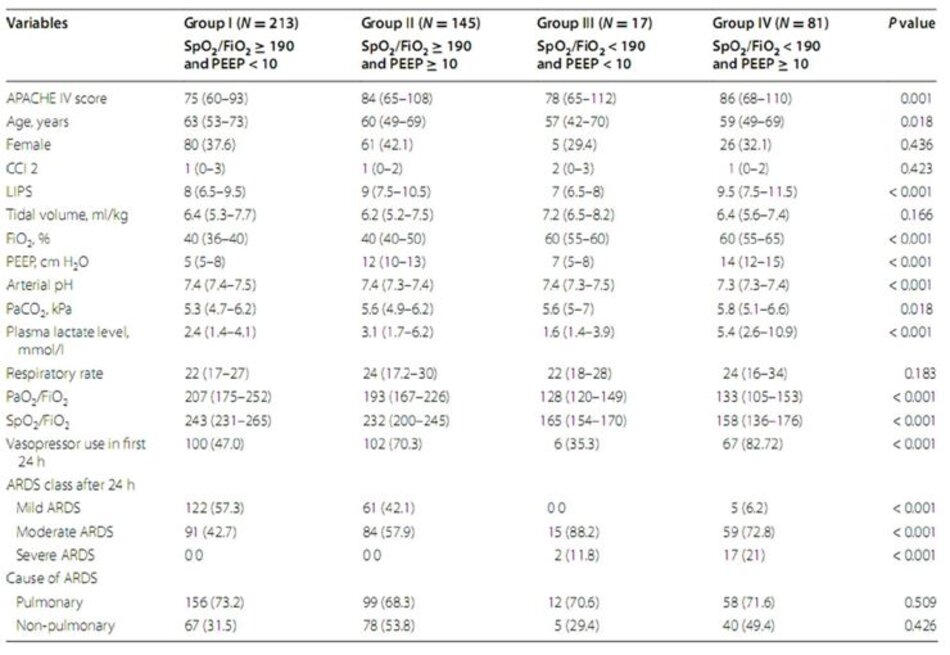
đầu dựa trên ngưỡng cắt SpO2/FiO2 190 và ngưỡng PEEP 10 cm H2O
Nghiên cứu của chúng tôi có một số điểm mạnh. Thiết kế tiền cứu của việc thu thập dữ liệu, tính đầy đủ của việc theo dõi và thực tế là chẩn đoán ARDS được ghi nhận bởi một nhóm các nhà nghiên cứu ICU được đào tạo đã ngăn chặn sự nhiễu.
Ngoài ra, chúng tôi có thể phân loại lại bệnh nhân theo các tiêu chuẩn được Hội nghị đồng thuận Mỹ-châu Âu về ARDS đ[1ư0a] ra cho định nghĩa Berlin mới hơn về ARDS
[1], sau khi chúng tôi có thể chọn bệnh nhân ARDS vừa hoặc nặng. Cuối cùng, số lượng người tham gia lớn, bệnh nhân đồng nhất về đặc điểm lâm sàng cũng như loại ARDS và tỷ lệ tử vong trong bệnh viện tổng thể của nhóm thuần tập so sánh với tỷ lệ tử vong gộp chung cho bệnh nhân ARDS vừa và nặng trong Nghiên cứu LUNG SAFE được công bố gần đây [19].
SpO2/FiO2 là một tham số ngày càng được đánh giá cao trong chẩn đoán và quản lý bệnh nhân ARDS [6,15,17,20,21]. Định nghĩa ARDS trẻ em hiện tại bao gồmcác biện pháp dựa trên đo pulse oximeter được ưa thích hơn là PaO 2/FiO2, như là chỉ số bão hòa oxy hóa (oxygenation saturation index) [22]. Thật không may, áp lực đường thở trung bình, cần thiết để tính chỉ số bão hòa oxy hóa trên, không được ghi nhận đáng tin cậy trong nhóm thuần tập của chúng tôi, không cho chúng ta so sánh kết quả của chúng với những nghiên cứu trước đây ở trẻ em [8,18,23]. Chúng tôi đã sử dụng phương trình được báo cáo trước đây (SpO 2/FiO2 = 64 + (0,84*PaO2/FiO2) [6] để chuyển đổi ngưỡng cắt đã sử dụng trước đó cho PaO 2/FiO2 (tức là 150 mm Hg) thành ngưỡng cắt cho SpO2/FiO2 190. Sử dụng phương trình xuất phát từ dữ liệu riêng của chúng tôi, việc lựa chọn SpO2/FiO2 rất giống nhau, do tính khả thi của nó, SpO2/FiO2 thực sự được xem xét để đưa vào quy trình định nghĩa tiêu chí của Berlin [24]loại trừ đối với khả năng nó có thể phân loại sai bệnh nhân ARDS nhẹ thành bệnh nặng. Một ngưỡng cắt cho PaO2/FiO2 150 mm Hg thường xuyên được chứng minh là phân tầng chính xác cho tử vong tại bệnh viện [4,5,25] và cũng được sử dụng trong hai các thử nghiệm đối chứng ngẫu nhiên, lớn nhất và cuối cùng dương tính ở bệnh nhân ARDS [26,27].
Những phát hiện hiện tại về mối quan hệ giữa kết quả SpO2/FiO2 và PaO2/FiO2 soi gương từ các nghiên cứu trước đây ở người lớn [6,15] và bệnh nhi [14,18,23,28], mặc dù đã tìm thấy phương trình hồi quy khác nhau. Một nghiên cứu không tìm thấy mối quan hệ chặt chẽ giữa SpO2/FiO2 và PaO2/FiO2, nhưng trong nghiên cứu này, dữ liệu được thu thập từ hệ thống thông tin của gây mê tự động với một phần rất nhiều dữ liệu bị loại trừ do giá trị SpO2 cao [29]. Gần đây, mối quan hệ tuyến tính giữa SpO2/FiO2 và PaO2/FiO2 đã được thử thách lại và cả một phép biến đổi phân đoạn (fractional transformation) [14] và phương pháp imputation phi tuyến (nonlinear imputation method) [17,30] được đề xuất để cải thiện mô hình phù hợp hoặc tốt hơn đại diện cho hình dạng sigmoidal của đường cong phân ly oxyhemoglobin. Mặc dù lý do sinh lý rõ ràng, những cách tiếp cận này không cải thiện mối quan hệ trong tập dữ liệu hiện tại.
FiO2 ở mức > 70% làm thay đổi PaO 2/FiO2: sự gia tăng trong FiO2 > 70% dần dần làm tăng PaO2/FiO2 [31], đặc biệt là ở mức thấp của phần shunt [32]. Tuy nhiên, hiệu ứng của FiO2 trên SpO2/FiO2 có thể ngược lại với pulse oximetry có giới hạn trên bên trong chặt chẽ hơn nhiều so với PaO2. Sự gia tăng FiO2 sẽ giảm dần SpO2/FiO2. Giới hạn toán học nội tại của SpO2/FiO2 có thể dẫn đến phân loại sai các trường hợp ARDS riêng lẻ. Lưu ý, FiO2 > 70% được sử dụng ở 25% bệnh nhân chẩn đoán ARDS, và chỉ trong 3% sau 24 giờ.
Mức PEEP được biết là có liên quan đặc biệt khi sự tiến triển và tiên lượng ARDS có liên quan đến những thay đổi trong PaO2/FiO2 theo phản ứng với những thay đổi trong PEEP lớn hơn hoặc bằng 10 cm H2O [3,33,34]. Trong khi PEEP không ảnh hưởng đến đường oxyhemoglobin và có thể không làm thay đổi đáng kể mối quan hệ giữa SpO2 và PaO2 [15], nó có thể ảnh hưởng đến tỷ lệ SpO 2/FiO2 bằng cách cải thiện kết hợp thông khí – tưới máu và do đó được xem xét trong phân tích của chúng tôi. Lưu ý, cách tiếp cận sử dụng PaO2/FiO2, hoặc SpO2/FiO2 và PEEP không phải là mới. Thật vậy, phân loại nguy cơ ở định nghĩa Berlin sử dụng mức độ PaO 2/FiO2 và PEEP [1], mặc dù chỉ bắt đầu từ ARDS và không áp dụng sau 24 giờ chăm sóc tiêu chuẩn. Mục đích thấu đáo của cuộc điều tra hiện nay là xem liệu hai thông số thu thập và hầu như luôn luôn có sẵn, ngay cả trong các cài đặt giới hạn tài nguyên, ví dụ, SpO 2/FiO2 và PEEP, sẽ thay đổi các nhóm nguy cơ.
Mặc dù có một số hệ thống phân loại và dự đoán cho bệnh nhân ARDS [1,3,25, 33,35–37], chúng tôi vẫn thiếu hệ thống phân loại thích hợp cho mục đích nghiên cứu và quản lý lâm sàng. Một số nghiên cứu đã chỉ ra rằng PaO 2/FiO2 đo lúc khởi phát ARDS không thể được sử dụng để phân tầng nguy cơ ở bệnh nhân ARDS vừa hoặc nặng [35,38–41]. Gần đây, người ta đã chứng minh rằng tiêu chuẩn hóa cài đặt máy thở tại thời điểm thu thập dữ liệu PaO 2/FiO2 [33] cũng như phân loại lại dựa trên cả mức cắt PaO2/FiO2 và PEEP, đo 24 giờ sau chẩn đoán ARDS ban đầu, phần lớn được cải thiện phân tầng nguy cơ tử vong trong bệnh viện [4,5]. Những phát hiện của nghiên cứu này đã đồng ý và mở rộng những phát hiện cho thấy lần đầu tiên đo pulse oximetry sau 24 giờ hoạt động tốt hơn khi chẩn đoán ARDS ban đầu trong phân tầng kết quả ngắn hạn và dài hạn ở bệnh nhân người lớn ARDS vừa hoặc nặng. Kết quả tương tự phát sinh từ dân số nhi, nơi các chỉ số oximetry sau 24 h kết quả phân tầng đáng tin cậy trong khi các giá trị ban đầu không hữu ích trong tiên lượng [8].
Trong nghiên cứu thuần tập của bệnh nhân có ARDS vừa hoặc nặng, cải thiện hoặc xấu đi của SpO 2/FiO2 trong 24 giờ đầu tiên đã liên quan chặt chẽ với kết quả. Nhóm I đại diện cho những bệnh nhân ít phức tạp hơn với ARDS và một phần lớn bệnh nhân của chúng tôi ở nhóm này sau 24 giờ (46,7 so với 19,1% lúc ban đầu), nhấn mạnh sự thay đổi lâm sàng đặc trưng cho những giờ chăm sóc tích cực ban đầu. Rất ít bệnh nhân (17, 3,7%) được phân loại sau 24 giờ khi có SpO2/FiO2 < 190 và PEEP < 10 cm H2O (nhóm III), theo các quan sát trước đó, trong đó chỉ có một số ít bệnh nhân bị oxy hóa kém hơn mức PEEP [4]. Việc sử dụng điểm cắt SpO 2/FiO2 khác nhau (150, tương ứng với 100 mm Hg như được sử dụng trong định nghĩa Berlin cho ARDS để phân loại ARDS nghiêm trọng) về cơ bản không thay đổi kết quả. Điều này nhấn mạnh lý do cần phân loại lại sau 24 giờ.
Sự so sánh giữa các nhóm nguy cơ nhấn mạnh sự cải thiện trong phân tầng nguy cơ sau 24 giờ nhưng cũng cho thấy phân loại được đề xuất bởi SpO 2/FiO2 và PEEP trong bốn nhóm nguy cơ phụ thuộc vào các yếu tố khác. Sự khác biệt giữa nhóm III và các nhóm khác không đạt được ý nghĩa có thể được giải thích một phần bởi số lượng nhỏ bệnh nhân trong nhóm này sau 24 giờ. Điều thú vị là, sự khác biệt về kết quả giữa các nhóm được phân tách bởi PEEP không đáng kể (nhóm I so với nhóm II và nhóm III so với IV). Điều này không làm suy yếu sự cải thiện trong phân tầng nguy cơ sau 24 giờ, nhưng có thể gợi ý rằng những phát hiện của chúng tôi được thúc đẩy nhiều hơn bởi SpO2/FiO2 so với PEEP. Do đó, mặc dù PEEP là một công cụ phân tầng hấp dẫn do tính phổ biến của nó, các biến thay thế có thể dẫn đến phân loại tốt hơn khi kết hợp với tỷ lệ SpO2/FiO2.
Tỷ lệ tử vong cao, đặc biệt là ở các nhóm nguy cơ thấp, lại có từ vong cao, nhưng xác nhận lại các cuộc điều tra trước đó [4, 5]. Phân loại lại sau 24 giờ dẫn đến tỷ lệ tử vong thấp hơn ở nhóm nguy cơ thấp nhất, nhưng vẫn tỷ lệ bệnh nhân tử vong vẫn cao. Điều này cũng phù hợp với những phát hiện từ các nghiên cứu trước đó [4, 5].
Sự khác biệt đáng chú ý được thấy ở APACHE IV, pH động mạch, nồng độ lactate trong 24 giờ đầu và sử dụng thuốc vận mạch giữa các nhóm nguy cơ, và tất cả có thể, ít nhất một phần có liên quan đến sự khác biệt đáng kể về tỷ lệ tử vong. Trong thực tế, phân tích đa biến post hoc cho thấy phân tầng dựa trên SpO 2/FiO2 và PEEP làm mất khả năng dự đoán khi được kiểm soát cho điểm APACHE IV, nồng độ lactate huyết tương, pH động mạch, mức huyết áp và liệu pháp vận mạch. Điều này ít nhất cho thấy rằng sự tồn tại của tình trạng thiếu oxy máu sau 24 giờ có thể là một đại diện, ví dụ, mức độ nghiêm trọng của bệnh tổng thể nhưng cũng nhấn mạnh sự yếu kém của một hệ thống phân loại đơn giản. Tuy nhiên, chúng tôi cho rằng phân tầng nguy cơ được đề xuất vẫn có thể hữu ích trong các thiết lập mà chỉ có đo pulse oximetry để theo dõi và nơi mà các xét nghiệm để tính toán mức độ nghiêm trọng của bệnh đang thiếu.
Kết quả của nghiên cứu này cho thấy rằng SpO2/FiO2 có thể thay thế chính xác PaO2/FiO2 trong phân tầng cho tỷ lệ tử vong của bệnh nhân người lớn với ARDS đã được thiết lập trong các đơn vị giàu tài nguyên. Cách tiếp cận đơn giản này có thể đặc biệt hữu ích trong các đơn vị mà các phép phân tích khí máu lặp lại khó có được hoặc không có, chẳng hạn như ở bệnh nhi [23] và các đơn vị giới hạn tài nguyên [42].
Tuy nhiên, phải thừa nhận rằng oximetry có thể không bao giờ hoàn toàn thay thế phân tích khí máu động mạch hoàn toàn. Thật vậy, tình trạng acid-base và mức độ PaCO 2 là quan trọng về mặt lâm sàng. Tuy nhiên, chúng tôi nhấn mạnh rằng pulse oximetry luôn có mặt trong các đơn vị tài nguyên thấp trong khi các máy phân tích khí máu khan hiếm, nếu không nói hoàn toàn vắng mặt.
Hơn nữa, một số thiết bị chăm sóc điểm cho phép đo tình trạng toan kiềm bằng máu mao mạch hoặc tĩnh mạch, có khả năng làm giảm nhu cầu về mẫu máu động mạch và các thiết bị phân tích khí máu đắt tiền.
SpO2/FiO2 cũng có thể hữu ích trong việc xác định bệnh nhân có nguy cơ bị ARDS. Nó đã được chứng minh là một chỉ số độc lập hữu ích của ARDS trong tiêu chuẩn Kigali cho ARDS, trong đó SpO 2/FiO2 và siêu âm phổi được sử dụng thay cho PaO2/FiO2 và chụp X quang ngực [42]. Các nghiên cứu sâu hơn về các đơn vị giàu tài nguyên và nghèo tài nguyên vẫn cần thiết để đánh giá tiện ích của các tiêu chí thích nghi này ở những bệnh nhân có nguy cơ bị ARDS.
Hạn chế của phân tích của chúng tôi bao gồm thiết kế đơn trung tâm và thiếu tiêu chuẩn hóa các phép đo SpO 2, do tính hồi cứu. Thật vậy, tiêu chuẩn hóa các thiết lập thông khí cơ bản và sau 24 h, và tính toán PaO2/FiO2, có thể rất quan trọng cho sự phân tầng thích hợp và giảm thiểu nhiễu do lựa chọn bệnh nhân [43] , và điều tương tự cũng có thể áp dụng cho kết quả dựa trên SpO2.
Trong khi chúng tôi cố gắng giảm thiểu các lỗi tiền cứu bằng cách tăng số lượng giá trị SpO2 thu thập được, chúng tôi nhận thấy rằng các giá trị SpO2 giả tạo tiền cứu hoặc những kết quả từ các sự kiện cấp tính không liên quan đến quá trình bệnh có thể được đưa vào (chẳng hạn như không đồng bộ của máy thở bệnh nhân, tắc nghẽn nội khí quản, hút đàm và huyết động không ổn định).
Chúng tôi cũng không thu thập thông tin về sắc tố da, nhiễu do chuyển động, tưới máu da, ánh sáng môi trường xung quanh, mức độ methemoglobinemia và mức carboxyhemoglobinemia — các yếu tố có thể liên quan đến độ chính xác của phép đo SpO2. Thiết kế hồi cứu cho phép chúng tôi không xác định loại máy pulse oximeter được sử dụng và cũng như vị trí của đầu dò được sử dụng ở từng bệnh nhân. Mặc dù nhỏ nhưng nó thể hiện một điểm yếu về phương pháp luận, nhưng chúng tôi không tin chúng ảnh hưởng đến kết quả hoặc phân tích tương quan một cách quan trọng. Chúng tôi chỉ tập trung vào hai điểm thời gian, tức là thời gian chẩn đoán ARDS ban đầu và sau 24 giờ.
Có thể là SpO2/FiO2 và PEEP tại các điểm thời gian khác thêm vào sự phân tầng nguy cơ. Cuối cùng, phân loại lại sau 24 giờ đồng nghĩa với việc các bệnh nhân tử vong trong 24 giờ đầu bị bỏ qua. Điều tương tự cũng xảy ra với tỷ lệ nhỏ bệnh nhân được rút ống hoặc chuyển đi trước 24 giờ. Chúng tôi cũng loại trừ bệnh nhân với một PaO2/FiO2 > 200 mm Hg; tuy nhiên, chúng tôi không tin điều này làm suy yếu kết quả của chúng tôi. Chúng tôi đã làm điều này vì hai lý do sau.
Bệnh nhân được phân loại là ARDS nhẹ [1] rất ‘không đồng nhất’ đối với kết cục. Hơn nữa, mức độ suy giảm oxy hóa nhẹ hơn ở những bệnh nhân này làm tăng số bệnh nhân có giá trị SpO 2 > 97%, trên đó mối quan hệ giữa PaO2 và SpO2 trở nên yếu.
6. Kết luận
SpO2/FiO2 và PaO2/FiO2 có mối quan hệ tuyến tính mạnh. Ngược lại với phân tầng nguy cơ khi chẩn đoán ARDS ban đầu, phân tầng nguy cơ sử dụng SpO 2/FiO2 và PEEP ở 24 giờ dẫn đến các nhóm nguy cơ có kết quả xấu đi. Mặc dù sự kết hợp giữa phân công và kết quả của nhóm nguy cơ bị nhiều yếu tố gây ra, sự phân tầng nguy cơ bằng cách sử dụng SpO2/FiO2 và PEEP có thể hữu ích và thiết thực, đặc biệt là ở những nơi khó phân tích khí máu lặp lại.
7.References
1. The ARDS Definition Task Force*. Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307:1. [PubMed]
2. Hernu R, Wallet F, Thiollière F, et al. An attempt to validate the modification of the American-European consensus definition of acute lung injury/acute respiratory distress syndrome by the Berlin definition in a university hospital. Intensive Care Med. 2013;39:2161– 2170. doi: 10.1007/s00134-013-3122-6. [PubMed] [Cross Ref]
3. Villar J, Pérez-Méndez L, López J, et al. An early PEEP/FIO trial identifies different degrees of lung injury in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2007;176:795–804. doi: 10.1164/rccm.200610-1534OC. [PubMed] [Cross Ref]
4. Villar J, Fernandez RL, Ambros A, et al. A clinical classification of the acute respiratory distress syndrome for predicting outcome and guiding medical therapy*. Crit Care Med. 2015;43:346–353. doi: 10.1097/CCM.0000000000000703. [PubMed] [Cross Ref]
5. Bos LD, Cremer OL, Ong DSY, et al. External validation confirms the legitimacy of a new clinical classification of ARDS for predicting outcome. Intensive Care Med. 2015;41:2004– 2005. doi: 10.1007/s00134-015-3992-x. [PubMed] [Cross Ref]
6. Rice TW, Wheeler AP, Bernard GR, et al. Comparison of the SpO/FIO ratio and the PaO/FIO ratio in patients with acute lung injury or ARDS. Chest. 2007;132:410–417. doi: 10.1378/chest.07-0617. [PubMed] [Cross Ref]
7. Chen W, Janz DR, Shaver CM, et al. Clinical characteristics and outcomes are similar in ARDS diagnosed by oxygen saturation/FiO2 ratio compared with PaO2/FiO2 ratio. Chest J. 2015;148:1477. doi: 10.1378/chest.15-0169. [PMC free article] [PubMed] [Cross Ref]
8. Parvathaneni K, Belani S, Leung D, et al. Evaluating the performance of the pediatric acute lung injury consensus conference definition of acute respiratory distress syndrome. Pediatr Crit Care Med. 2017;18:17–25. doi: 10.1097/PCC.0000000000000945. [PubMed] [Cross Ref]
9. Klouwenberg PMCK, Ong DSY, Bos LDJ, et al. Interobserver agreement of centers for disease control and prevention criteria for classifying infections in critically Ill patients*. Crit Care Med. 2013;41:2373–2378. doi: 10.1097/CCM.0b013e3182923712. [PubMed] [Cross Ref]
10. Bernard GR, Artigas A, Brigham KL, et al. Report of the American-European consensus conference on ARDS: definitions, mechanisms, relevant outcomes and clinical trial coordination. Intensive Care Med. 1994;20:225–232. doi: 10.1007/BF01704707. [PubMed] [Cross Ref]
11. Zimmerman JE, Kramer AA, McNair DS, Malila FM. Acute Physiology and Chronic Health Evaluation (APACHE) IV: hospital mortality assessment for today’s critically ill patients. Crit Care Med. 2006;34:1297–1310. doi: 10.1097/01.CCM.0000215112.84523.F0. [PubMed] [Cross Ref]
12. Gajic O, Dabbagh O, Park PK, et al. Early identification of patients at risk of acute lung injury: evaluation of lung injury prediction score in a multicenter cohort study. Am J Respir Crit Care Med. 2010 [PMC free article] [PubMed]
13. Quan H, Li B, Couris CM, et al. Updating and validating the Charlson comorbidity index and score for risk adjustment in hospital discharge abstracts using data from 6 countries. Am J Epidemiol. 2011;173:676–682. doi: 10.1093/aje/kwq433. [PubMed] [Cross Ref]
14. Khemani RG, Patel NR, Bart RD, Newth CJL. Comparison of the pulse oximetric saturation/fraction of inspired oxygen ratio and the PaO2/fraction of inspired oxygen ratio in children. Chest. 2009;135:662–668. doi: 10.1378/chest.08-2239. [PubMed] [Cross Ref]
15. Pandharipande PP, Shintani AK, Hagerman HE, et al. Derivation and validation of SpO2/FiO2 ratio to impute for PaO2/FiO2 ratio in the respiratory component of the Sequential Organ Failure Assessment score. Crit Care Med. 2009;37:1317–1321. doi: 10.1097/CCM.0b013e31819cefa9. [PMC free article] [PubMed] [Cross Ref]
16. Ellis RK. Determination of PO from saturation. J Appl Physiol. 1989;67:902. [PubMed]
17. Brown SM, Grissom CK, Moss M, et al. Non-linear imputation of PaO2/FiO2 from SpO2/FiO2 among patients with acute respiratory distress syndrome. Chest. 2016 [PMC free article] [PubMed]
18. Khemani RG, Thomas NJ, Venkatachalam V, et al. Comparison of SpO2 to PaO2 based markers of lung disease severity for children with acute lung injury. Crit Care Med. 2012;40:1309–1316. doi: 10.1097/CCM.0b013e31823bc61b. [PubMed] [Cross Ref]
19. Bellani G, Gattinoni L, Van Haren F, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:2526–2533. doi: 10.1001/jama.2016.0291. [PubMed] [Cross Ref]
20. Serpa Neto A, Schultz MJ, Festic E. Ventilatory support of patients with sepsis or septic shock in resource-limited settings. Intensive Care Med. 2016;42:100–103. doi: 10.1007/s00134- 015-4070-0. [PMC free article] [PubMed] [Cross Ref]
21. Festic E, Bansal V, Kor DJ, Gajic O. SpO2/FiO2 ratio on hospital admission is an indicator of early acute respiratory distress syndrome development among patients at risk. J Intensive Care Med. 2015;30:209–216. doi: 10.1177/0885066613516411. [PubMed] [Cross Ref]
22. Group TPALICC Pediatric acute respiratory distress syndrome: consensus recommendations from the pediatric acute lung injury consensus conference. Pediatr Crit Care Med. 2015;16:428–
439. doi: 10.1097/PCC.0000000000000350. [PMC free article] [PubMed] [Cross Ref]
23. Khemani RG, Rubin S, Belani S, et al. Pulse oximetry vs. PaO2 metrics in mechanically ventilated children: Berlin definition of ARDS and mortality risk. Intensive Care Med. 2015;41:94–102. doi: 10.1007/s00134-014-3486-2. [PubMed] [Cross Ref]
24. Ferguson ND, Fan E, Camporota L, et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Med. 2012;38:1573–1582. doi: 10.1007/s00134-012-2682-1. [PubMed] [Cross Ref]
25. Villar J, Pérez-Méndez L, Kacmarek RM. Current definitions of acute lung injury and the acute respiratory distress syndrome do not reflect their true severity and outcome. Intensive Care Med. 1999;25:930–935. doi: 10.1007/s001340050984. [PubMed] [Cross Ref]
26. Papazian L, Forel J-M, Gacouin A, et al. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med. 2010;363:1107–1116. doi: 10.1056/NEJMoa1005372. [PubMed] [Cross Ref]
27. Guérin C, Reignier J, Richard J-C, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368:2159–2168. doi: 10.1056/NEJMoa1214103. [PubMed] [Cross Ref]
28. Mayordomo-Colunga J, Pons M, López Y, et al. Predicting non-invasive ventilation failure in children from the SpO2/FiO2 (SF) ratio. Intensive Care Med. 2013;39:1095–1103. doi: 10.1007/s00134-013-2880-5. [PubMed] [Cross Ref]
29. Tripathi RS, Blum JM, Rosenberg AL, Tremper KK. Pulse oximetry saturation to fraction inspired oxygen ratio as a measure of hypoxia under general anesthesia and the influence of positive end-expiratory pressure. J Crit Care. 2010;25:542.e9–542.e13. doi: 10.1016/j.jcrc.2010.04.009. [PubMed] [Cross Ref]
30. Sanz F, Dean N, Dickerson J, et al. Accuracy of PaO2/FiO2 calculated from SpO2 for severity assessment in ED patients with pneumonia. Respirology. 2015;20:813–818. doi: 10.1111/resp.12560. [PubMed] [Cross Ref]
31. Allardet-Servent J, Forel J-M, Roch A, et al. FiO2 and acute respiratory distress syndrome definition during lung protective ventilation*. Crit Care Med. 2009;37:202-e6. doi: 10.1097/CCM.0b013e31819261db. [PubMed] [Cross Ref]
32. Feiner JR, Weiskopf RB. Evaluating pulmonary function: an assessment of PaO2/FiO2. Crit Care Med. 2017;45:e40–e48. doi: 10.1097/CCM.0000000000002017. [PubMed] [Cross Ref]
33. Villar J, Pérez-Méndez L, Blanco J, et al. A universal definition of ARDS: the PaO2/FiO2 ratio under a standard ventilatory setting-a prospective, multicenter validation study. Intensive Care Med. 2013;39:583–592. doi: 10.1007/s00134-012-2803-x. [PubMed] [Cross Ref]
34. López-Fernández Y, Azagra AM, de la Oliva P, et al. Pediatric acute lung injury epidemiology and natural history study: incidence and outcome of the acute respiratory distress syndrome in children. Crit Care Med. 2012;40:3238–3245. doi: 10.1097/CCM.0b013e318260caa3. [PubMed] [Cross Ref]
35. Bone RC, Maunder R, Slotman G, et al. An early test of survival in patients with the adult respiratory distress syndrome. The PaO2/FiO2 ratio and its differential response to conventional therapy. Prostaglandin E1 Study Group. Chest. 1989;96:849–851. doi: 10.1378/chest.96.4.849. [PubMed] [Cross Ref]
36. Cooke CR, Shah CV, Gallop R, et al. A simple clinical predictive index for objective estimates of mortality in acute lung injury. Crit Care Med. 2009;37:1913–1920. doi: 10.1097/CCM.0b013e3181a009b4. [PMC free article] [PubMed] [Cross Ref]
37. Villar J, Pérez-Méndez L, Basaldúa S, et al. A risk tertiles model for predicting mortality in patients with acute respiratory distress syndrome: age, plateau pressure, and PaO2/FiO2 at ARDS onset can predict mortality. Respir Care. 2011;56:420–428. doi: 10.4187/respcare.00811. [PubMed] [Cross Ref]
38. Bersten AD, Edibam C, Hunt T, Moran J. Incidence and mortality of acute lung injury and the acute respiratory distress syndrome in three Australian States. Am J Respir Crit Care Med. 2002;165:443–448. doi: 10.1164/ajrccm.165.4.2101124. [PubMed] [Cross Ref]
39. Luhr OR, Karlsson M, Thorsteinsson A, et al. The impact of respiratory variables on mortality in non-ARDS and ARDS patients requiring mechanical ventilation. Intensive Care Med. 2000;26:508–517. doi: 10.1007/s001340051197. [PubMed] [Cross Ref]
40. Knaus WA, Sun X, Hakim RB, Wagner DP. Evaluation of definitions for adult respiratory distress syndrome. Am J Respir Crit Care Med. 1994;150:311–317. doi: 10.1164/ajrccm.150.2.8049808. [PubMed] [Cross Ref]
41. Sloane PJ, Gee MH, Gottlieb JE, et al. A multicenter registry of patients with acute respiratory distress syndrome. Physiology and outcome. Am Rev Respir Dis. 1992;146:419–426. doi: 10.1164/ajrccm/146.2.419. [PubMed] [Cross Ref]
42. Riviello ED, Kiviri W, Twagirumugabe T, et al. Hospital incidence and outcomes of the acute respiratory distress syndrome using the Kigali modification of the Berlin definition. Am J Respir Crit Care Med. 2016;193:52–59. doi: 10.1164/rccm.201503-0584OC. [PubMed] [Cross Ref]
43. Villar J, Blanco J, del Campo R, et al. Assessment of PaO2/FiO2 for stratification of patients with moderate and severe acute respiratory distress syndrome. BMJ Open. 2015;5:e006812. doi: 10.1136/bmjopen-2014-006812. [PMC free article] [PubMed] [Cross Ref]