Mục đích của bài viết này là xem xét cơ sở sinh lý của việc sản xuất và thanh thải Lactate, các yếu tố quyết định chính của nó trong các trạng thái sốc và cung cấp một số manh mối để hỗ trợ cho việc giải thích nồng độ lactate trong thiết lập chăm sóc đặc biệt (ICU).
Bài viết được biên soạn bởi Thạc sĩ – Bác sĩ Hồ Hoàng Kim – ICU bệnh viện NGUYỄN TRI PHƯƠNG.
Lactate là gì?
Lactate là một thông số trao đổi chất quan trọng có truyền thống liên quan đến giảm tưới máu mô và thiếu oxy trong rối loạn chức năng tuần hoàn cấp tính [1- 4]. Trên thực tế, tăng lactate máu dai dẳng là yếu tố tiên lượng bất lợi một cách mạnh mẽ trong các trạng thái sốc, và ngược lại, việc giảm nồng độ lactate trong quá trình hồi sức được cho là có liên quan đến sự thay đổi của phục hồi và được coi là một dấu hiệu của tái tưới máu [5-9]. Vì những lý do này, đánh giá mức độ lactate máu được khuyến nghị là một phần cơ bản trong việc theo dõi bệnh nhân bị bệnh nghiêm trọng. Hơn nữa, tăng lactate máu đã được đưa vào định nghĩa sốc nhiễm trùng mới nhất [10] và được đề xuất như một mục tiêu hồi sức của Chiến dịch sống còn trong Nhiễm trùng huyết (SSC) [11].
Trong bài viết này, chúng ta sẽ xem xét cơ sở sinh lý của việc tạo và thanh thải lactate, các yếu tố quyết định chính của nó trong các trạng thái sốc và cung cấp một số manh mối để hỗ trợ cho việc giải thích mức độ lactate ở bệnh nhân bị bệnh nặng.
Lactate được sản xuất trong tất cả các tế bào của con người như là một phần của việc xử lý glucose nội bào [12 .14]. Sự chuyển hóa glucose thành hai phân tử pyruvate tạo ra hai phân tử adenosine triphosphate (ATP) ròng và không cần oxy (O2), do đó được gọi là ly giải đường kỵ khí. Pyruvate có thể được chuyển hóa qua các con đường khác nhau, sự chuyển hóa có liên quan nhất của nó là thành lactate bởi lactate dehydrogenase (LDH) hoặc chu trình Krebs của ty thể tùy thuộc vào hoạt động của phức hợp pyruvate dehydrogenase (PDH) và tính sẵn có của O2. Việc chuyển đổi pyruvate thành lactate tái tạo nicotinamide adenine dinucleotide (NAD), một đồng yếu tố chính để duy trì sự ly giải đường[12].
Ly giải đường kỵ khí là cơ chế mà các tế bào bị giảm tưới máu có thể tạo ra ATP, và tốc độ của nó có thể tăng lên nhiều lần bù cho đến một lúc nào đó sự suy giảm thực sự của chức năng ty thể (Hình 1). Trong quá trình giảm tưới máu quá mức hoặc tiềm ẩn, tăng lactate được tạo ra theo con đường yếm khí được đưa vào tuần hoàn và có thể cảnh báo các bác sĩ về sự hiện diện của các mô được hồi sức dưới mức. Dữ liệu thực nghiệm kinh điển cho thấy việc sản xuất lactate kỵ khí tăng lên khi việc cung cấp O2 giảm xuống dưới ngưỡng tới hạn mà mức tiêu thụ O2 trở nên phụ thuộc vào nguồn cung [3, 15]. Trong bối cảnh này, khi dòng chảy hệ thống và khu vực và oxy hóa mô được phục hồi, có thể loại bỏ lactate thông qua các chất vận chuyển monocarboxylate (MCT) chuyên biệt bằng chính các tế bào nơi nó được giải phóng và chuyển thành pyruvate và đi vào chu trình Krebs, báo hiệu hồi sức thành công [12 ]. Tuy nhiên, những bất thường vi tuần hoàn nghiêm trọng có thể ngăn cản sự phục hồi oxy hóa mô, và một số nghiên cứu đã tìm thấy mối tương quan tốt giữa những bất thường này và tình trạng tăng lactate máu tiến triển [16, 17, 18].
Hai biến số có thể đo được trên lâm sàng đã được đề xuất là đại diện gần đúng cho tình trạng thiếu oxy mô là tỷ lệ chênh lệch hàm lượng CO2 trong tĩnh mạch-động mạch và mức chênh O2 động mạch-tĩnh mạch (Cv-aCO2 / Da-vO2) [19] và tỷ lệ lactate / pyruvate (L / P) [20]. Cả hai tỷ lệ có thể là đại diện của một biểu hiện của chuyển hóa yếm khí ở cấp độ tế bào và do đó có thể được cho là gắn liền với tình trạng thiếu oxy. Vì vậy, chúng có thể hỗ trợ trong việc cho thấy thiếu oxi mô là một nguyên nhân gây tăng lactate.
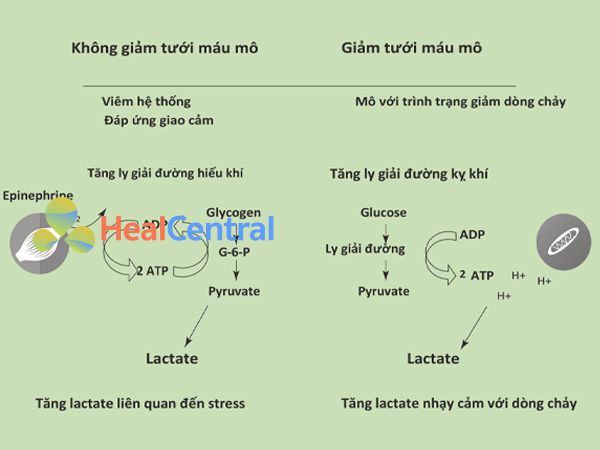
Hình 1. Hình minh họa cho thấy hai cơ chế chính liên quan đến việc tạo ra lactate: glycolysis kỵ khí trong các mô bị giảm tưới máy và glycolysis hiếu khí do adrenergic ở cấp độ cơ.
Tỷ lệ Cv-aCO2 / Da-vO2 này có thể hữu ích như là chất thay thế cho chỉ số hô hấp [19,21,22]. Tỷ lệ > 1.4 có thể xác định việc tạo CO2 yếm khí [19,21,22]. Tỷ lệ Cv-aCO2 / Da-vO2 cao trong bệnh cảnh tăng lactate máu có thể ủng hộ cho một nhận định là quá trình chuyển hóa yếm khí là nguồn gây tăng lactate có thể có, trong khi tỷ lệ Cv-aCO2 / Da-vO2 bình thường có thể cho thấy sự tích lũy Lactate do các nguyên nhân không liên quan đến tình trạng giảm tưới máu mô [19, 21, 22]. Trong một nghiên cứu gần đây, người ta đã quan sát thấy tình trạng tăng lactate máu kéo dài kết hợp với tỷ lệ Cv-aCO2 / Da-vO2 cao có liên quan đến rối loạn chức năng cơ quan và tử vong nghiêm trọng, trong khi bình thường hóa tỷ lệ Lactate và Cv-aCO2 / Da-vO2 có kết cuộc tốt nhất [19].
Một số tác giả đã đề xuất rằng nên đo pyruvate cùng với lactate để phân biệt tình trạng tăng lactate mà do thiếu oxy hay không do thiếu oxy [20, 23]. Trong điều kiện yếm khí, pyruvate được chuyển thành lactate, và do đó tỷ lệ L / P tăng lên ≥18 [23]. Tỷ lệ L / P có thể là một trong những chỉ số cho tình trạng thiếu oxy đáng tin cậy nhất ở những bệnh nhân nguy kịch, nhưng nó chưa bao giờ được sử dụng rộng rãi vì những khó khăn về mặt kỹ thuật khi đo pyruvate.
Hình thành Lactate hiếu khí
Trong quá trình viêm toàn thân, nhiễm trùng huyết và các trạng thái sốc, hoạt hóa các cớ chế bù trừ phức hợp thần kinh-thể dịch adrenergic dẫn đến sự gia tăng nồng độ epinephrine tỷ lệ thuận với cường độ của tổn thương. Epinephrine kích thích thụ thể adrenergic beta-2 cơ xương làm tăng hoạt động AMP vòng, do đó thúc đẩy glycogenolysis và glycolysis hiếu khí với hoạt hóa đồng thời của bơm Na+ / K+ -ATPase [12,14] (Hình 1). Pyruvate được tạo ra cuối cùng vượt quá khả năng PDH trong thời gian có stress và viêm nặng, do đó làm tăng chuyển đổi thành lactate. Lactate được phóng thích và có thể được sử dụng làm nhiên liệu trao đổi chất bởi các nhóm tế bào cơ hoặc các cơ quan từ xa khác như não và tim trong điều kiện stress và sốc [12].
Sản xuất Lactate liên quan đến Adrenergic là một quá trình hiếu khí, vì nó xảy ra trong sự hiện diện của oxy cơ đầy đủ và tạo thành một con thoi trao đổi chất cơ bản. Nó có thể được điều biến trong các thiết lập thực nghiệm và lâm sàng bằng cách ngăn chặn bơm Na+/K+ -ATPase hoạt động hoặc bằng cách giảm trương lực hệ adrenergic [24, 25] (Hình.1). Ngoài ra, nhiều nguyên nhân khác như sự hiện diện của mô hoại tử hoặc mô bị nhiễm trùng và ức chế PDH bởi các chất trung gian gây viêm, có thể góp phần tăng cường sản xuất lactate trong quá trình viêm toàn thân [12].
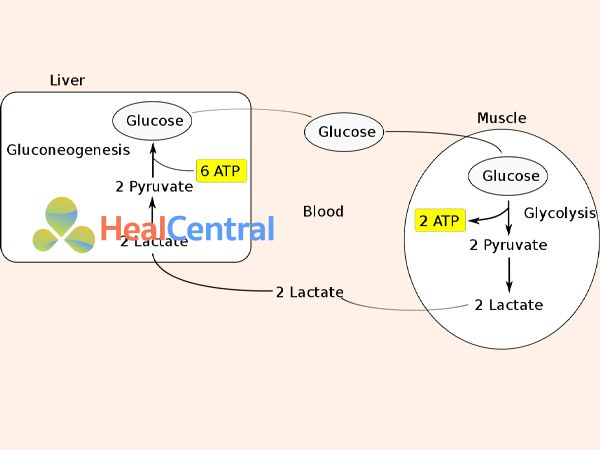
Hình thành Lactate trong suy tuần hoàn cấp
Sự phân biệt về sự hình thành lactate kỵ khí và hiếu khí bằng cách nào đó đã được thực hiện qua mô hình nhân tạo và mô phạm. Sản xuất lactate gia tắng luôn luôn là đa yếu tố trong các trạng thái sốc. Trên thực tế, khi quá trình giảm tưới máu mô phát triển, các tế bào chuyển hình thành ATP thành ly giải đường kỵ khí như một cơ chế sinh tồn cơ bản, và đồng thời phản ứng thần kinh thể dịch bừ trừ kích hoạt ly giải đường hiếu khí ở cấp độ cơ. Ở những bệnh nhân được hồi sức thành công, việc sản xuất lactate giảm liên quan đến cả tái tưới máu và ngừng hoạt động của phản ứng hệ adrenergic [1]. Ngược lại, tăng lactate máu dai dẳng và tiến triển là một dấu hiệu đặc trưng của sốc kháng trị có thể đại diện cho tổng lượng thiếu oxy, “nhiễm độc” của hệ adrenergic tăng hoạt động và các cơ chế khác [1].
Động học và thanh thải Lactate
Khoảng 1500 mmol Lactate được sản xuất hàng ngày trong điều kiện sinh lý, và các cơ quan chuyển hóa có liên quan nhất là gan và thận. Các cơ quan này cùng nhau chiếm hơn 90% độ thanh thải lactate toàn thân, bằng cách oxy hóa hoặc tân tạo đường thông qua chu trình Cori [12-14].
Độ thanh thải của Lactate đã được xác định bằng sự thay đổi nồng độ Lactate giữa hai thời điểm và được biểu thị bằng mức giảm 10 – 20% mỗi giờ hoặc giảm ít nhất 10% trong 6 giờ khi hồi sức sớm [12-14]. Tuy nhiên, mức thanh thải nghiêm ngặt hơn là một thuật ngữ dược động học được sử dụng để mô tả loại bỏ thuốc hoặc chất nội sinh từ sinh vật. Theo nghĩa này, thuật ngữ “độ thanh thải lactate” đã được sử dụng không chính xác trong các tài liệu y khoa vì việc giảm nồng độ lactate có thể được gây ra do giảm sự hình thành hiếu khí hoặc kỵ khí hoặc tăng độ thanh thải lactate [1, 26]. Do đó, tốt hơn là sử dụng thuật ngữ “động học Lactate” hay “khoảng thời gian” [26].
Một đánh giá có hệ thống gần đây về động học Lactate đã tìm thấy một mô hình tiến hóa không đồng nhất về mức độ Lactate ở những bệnh nhân bị bệnh nghiêm trọng, trong đó một số bệnh nhân giảm, những người khác tăng lên và những người khác biểu hiện một quá trình ổn định theo thời gian trong đáp ứng với điều trị [26]. Dựa trên những quan sát này, có vẻ như việc đánh giá lại lactate cứ sau 1 hoặc 2 giờ là đủ trong hầu hết các điều kiện lâm sàng.
Gan chịu trách nhiệm cho 60% thanh thải lactate toàn thân là một cơ quan dễ bị tổn thương trong rối loạn chức năng tuần hoàn cấp tính liên quan đến nhiễm trùng huyết. Rối loạn chức năng gan trong bối cảnh nhiễm trùng huyết không kiểm soát được hoặc giảm tưới máu gan trong sốc nhiễm trùng có thể ảnh hưởng đến việc chuyển hóa lactate ở gan [12, 27-29]. Tuy nhiên, điều đáng chú ý là tình trạng tăng lactate kéo dài chỉ liên quan đến rối loạn chức năng gan trong tình trạng sốc nặng với thiếu máu cục bộ rõ rệt như biểu hiện bằng sự gia tăng men gan hoặc hạ đường huyết hoặc trong bệnh xơ gan tiến triển [27, 28]. Thật vậy, thiếu các nghiên cứu sinh lý toàn diện liên quan đến vai trò của gan trong tăng lactate máu dai dẳng và các nghiên cứu thực nghiệm và lâm sàng cho đến nay đã cho kết quả mâu thuẫn.
Trong một nghiên cứu sinh lý gần đây, chúng tôi đã đề cập đến vai trò của tưới máu gan-lách đối với động học lactate trong quá trình hồi sức [27]. Một nhóm gồm 15 bệnh nhân sốc nhiễm trùng huyết tăng cường hồi sức tích cực đã được theo dõi đặc biệt bao gồm đánh giá lactate nối tiếp nhau, cùng với đo niêm mạc dạ dày và tỷ lệ biến mất trong huyết tương của chất chỉ thị indocyanine màu xanh lá cây (ICG- PDR (LiMON, Pulsion Medical Systems, Munich, Đức)). ICG-PDR phụ thuộc vào lưu lượng và chức năng của gan, nhưng do chức năng không thay đổi trong thời gian ngắn, nên việc giảm PDR từ phạm vi bình thường là 20-30% / phút được cho là phản ánh quá trình giảm tưới máu. Bệnh nhân giảm so với không bị suy giảm lactate lúc 6 giờ biểu hiện giảm tưới máu gan do cả hai kỹ thuật (ICG-PDR (9,7 so với 19,6% / phút, p <0,05) và khoảng cách pCO2 (33 so với 7,7 mmHg, p <0,05)). Huyết động học hệ thống có thể so sánh giữa các nhóm, một lần nữa nhấn mạnh một thực tế là các thông số huyết động học vĩ mô bình thường không loại trừ sự hiện diện của tình trạng giảm tưới máu gan-lách. Tuy nhiên, khía cạnh thú vị nhất là các men gan bao gồm transaminase không phân biệt được bệnh nhân giảm hoặc không giảm lactate [27]. Điều này có thể có nghĩa là một vai trò tiềm năng đối với rối loạn chức năng gan trong động học lactate bất thường có thể không được loại trừ chỉ bằng cách xem xét các thông số hệ thống của bất kỳ loại nào.
Một sự suy yếu vừa phải của sự thanh thải lactate toàn cơ thể đã được chứng minh bởi Levraut et al. trong một đoàn hệ bệnh nhân nhiễm trùng huyết ổn định với mức độ tăng nhẹ của lactate nhưng không có thuốc vận mạch [30]. Để đánh giá độ thanh thải thực sự, một liều 1 mmol/kg natri lactate đã được truyền qua ống thông tĩnh mạch trung tâm trong hơn 15 phút. Các mẫu máu động mạch nối tiếp để đánh giá lactate được lấy tại mức nền, trong quá trình truyền, và sau đó, tuần tự trong 40 phút sau khi tiêm lactate. Thanh thải sau đó đã được phân tích bằng phương pháp bình phương phương pháp toán học [30]. Nghiên cứu này đã chứng minh rằng độ thanh thải của lactate có thể bị suy yếu ở bệnh nhân nhiễm trùng huyết theo cách dưới lâm sàng ngay cả khi không có rối loạn chức năng tuần hoàn rõ ràng, cho thấy có tồn tại rối loạn chức năng trao đổi chất.
Để khám phá chủ đề này sâu sắc hơn, các nhà nghiên cứu đã thực hiện một loạt các nghiên cứu thực nghiệm [31, 32]. Mục tiêu của họ là thiết lập động lực học và mức độ nghiêm trọng của suy giảm thanh thải lactate ngoại sinh trong sốc nội độc tố (LPS) và khám phá vai trò tiềm năng của giảm tưới máu gan trong giai đoạn đầu của sốc [31]. Sau khi gây mê, 12 con cừu đã được theo dõi huyết động/tưới máu bao gồm một catheter được đặt tĩnh mạch gan và tĩnh mạch cửa, và một đầu dò siêu âm gan, sau đó được chọn ngẫu nhiên để LPS hoặc giả dược. Sau 60 phút sốc, các con cừu LPS đã được hồi sức bằng dịch truyền và thuốc vận mạch. Đánh giá nối tiếp của tất cả các thông số bao gồm cả độ thanh thải lactate ngoại sinh và sorbitol lặp đi lặp lại được thực hiện đến 2 giờ sau khi hồi sức sốc. Tăng lactate máu tiến triển đã được quan sát thấy ở động vật LPS đạt mức 10,2 mmol/L sau 2 giờ. Song song, độ thanh thải lactate ngoại sinh giảm xuống 10% giá trị của động vật không LPS khi kết thúc thí nghiệm. Suy giảm nghiêm trọng này không liên quan đến giảm tưới máu gan do vận chuyển, tiêu thụ và trích xuất oxy ở gan, tổng lưu lượng máu của gan, hô hấp của ty lạp thể, transaminase và độ thanh thải sorbitol (một thông số liên quan đến dòng chảy) có thể so sánh giữa LPS và không LPS [31]. Trong một nghiên cứu tiếp theo sử dụng cùng một mô hình như vậy, các nhà nghiên cứu đã chứng minh rằng những bất thường trong thanh thải lactate ngoại sinh và thanh thải lactate của gan có thể bị suy giảm khi sử dụng các chất điều chỉnh hệ adrenergic như dexmedetomidine và esmolol [32]. Trong nghiên cứu sau này, các mẫu song song của tĩnh mạch gan và tĩnh mạch cửa và catheter động mạch đã được thực hiện để đánh giá một loạt mẫu lactate nối tiếp nhau sau khi sử dụng natri lactate bolus, phát hiện ra rằng không có độ chênh giữa nồng độ lactate tĩnh mạch gan và tĩnh mạch cửa, cho thấy trích xuất gan không đáng kể (không được công bố quan sát nghiên cứu [31]).
Tóm lại, có vẻ như sự đóng góp của gan đối với tình trạng tăng lactate kéo dài có thể cao hơn nhiều so với suy nghĩ trước đây và các cơ chế có thể là đa yếu tố. Không nghi ngờ gì nữa, thiếu máu cục bộ gan có thể đóng góp trong một số trường hợp đặc biệt là, nhưng không giới hạn, sốc nhiễm trùng nghiêm trọng và có hoặc không có thay đổi trong men gan kinh điển.
Mặt khác, sự suy yếu nghiêm trọng của thanh thải lactate ngoại sinh không liên quan đến giảm tưới máu gan đã được thể hiện trong điều kiện thí nghiệm. Nếu đây là thích nghi hoặc kém thích nghi, rối loạn chức năng trao đổi chất hoặc cuối cùng là do bất thường vi tuần hoàn gan là vấn đề cần nghiên cứu thêm.
Sự chuyển đổi tình trạng tăng Lactate
Sự cân bằng giữa sản xuất và thanh thải duy trì mức độ lactate bình thường ngay cả trong điều kiện tăng sản xuất lactate như trong viêm hệ thống hoặc rối loạn chức năng tuần hoàn nhẹ. Sự chuyển đổi từ mức độ lactate bình thường sang tăng lactate phản ánh sự chuyển đổi từ trạng thái cân bằng sinh lý sang trạng thái mất bù sinh lý bệnh ảnh hưởng đến một hoặc nhiều cơ chế liên quan đến chuyển hóa lactate bình thường [1].
Do đó, và không có gì đáng ngạc nhiên, tình trạng tăng lactate tiến triển có liên quan đến tiên lượng xấu ở các bệnh cảnh lâm sàng khác nhau [2, 4, 6, 7, 33]. Thật vậy, kể từ báo cáo của Scherer năm 1843, một lượng bằng chứng đáng kể được tích lũy trong tài liệu chứng minh rằng tăng lactate tiến triển có liên quan đến tỷ lệ mắc bệnh và tử vong đáng kể [33 – 35]. Nhiều nghiên cứu đã nhấn mạnh sự liên quan tiên lượng của một mức tăng lactate đơn độc hoặc giảm lactate bị suy giảm trong quá trình hồi sức. Đáng chú ý, giá trị tiên lượng của mức độ lactate dường như không phụ thuộc vào bệnh hiểm nghèo tiềm ẩn và sự hiện diện của sốc và vượt trội hơn so với các thông số huyết động vĩ mô trong việc dự đoán kết quả ở các bệnh nhân nguy kịch khác, bao gồm cả bệnh nhân nhiễm trùng huyết. Gần đây, một phân tích của một bộ dữ liệu SSC lớn đã xác nhận rằng tăng lactate kéo dài là một yếu tố dự báo hữu ích về kết quả ở bệnh nhân nhiễm trùng huyết nặng và bệnh nhân sốc nhiễm trùng [33].
Ý nghĩa thực hành
1. Cả Đồng thuận Sepsis-3 gần đây [10] và các khuyến nghị về huyết động học thứ tư của SSC [11] không giải quyết được một vấn đề chính: sự không đồng nhất của các cơ chế có thể dẫn đến tăng lactate máu tiến triển ở bệnh nhân rối loạn tuần hoàn cấp tính liên quan đến nhiễm trùng huyết [36, 37]. Nguy cơ tử vong rõ ràng đồng nhất ở những bệnh nhân sốc nhiễm trùng do định nghĩa Sepsis-3 đưa ra và đề xuất bình thường hóa lactate là mục tiêu hồi sức chính theo hướng dẫn của SSC là những vấn đề gây tranh cãi cao, thiếu nền tảng sinh lý mạnh [35, 37].
Trên thực tế, tăng lactate kéo dài đặc biệt khó diễn giải trong bối cảnh lâm sàng. Như đã nêu ở trên, ít nhất có ba cơ chế gây bệnh có thể có liên quan: ly giải đường kỵ khí ở các vùng bị giảm tưới máu, đặc biệt là khi có bất thường vi tuần hoàn nghiêm trọng [1, 17, 18, 38], ly giải đường hiếu khí do adrenergic gây ra [12], và khả năng thanh thải gan bị suy yếu [30-32]. Thách thức quan trọng nhất là cố gắng xác định cơ chế chiếm ưu thế cho mỗi bệnh nhân. Đây là một khía cạnh quan trọng vì chỉ một số trong các cơ chế này như giảm tưới máu mô dai dẳng có thể đáp ứng với việc tối ưu hóa dòng chảy hệ thống, một điều kiện mà chúng ta gọi là “nhạy với dòng chảy”, và các cơ chế khác rõ ràng là không.
Để nhận ra một mô hình lâm sàng của tăng lactate liên quan đến giảm tưới máu mô là khả năng cao vì việc tối ưu hóa lưu lượng máu toàn thân trong bối cảnh này có thể cải thiện quá trình giảm tưới máu đang diễn ra và cải thiện tiên lượng. Ngược lại, theo đuổi hồi sức bổ sung trong các trường hợp không liên quan đến giảm tưới máu mô có thể dẫn đến “độc tính” của quá tải dịch truyền và dùng thuốc vận mạch quá mức, cuối cùng làm tăng tỷ lệ mắc bệnh hoặc tử vong [1].
2. Tốc độ giảm hoặc bình thường hóa lactate có liên quan đến sự sống còn và được thử nghiệm như một mục tiêu trong hai nghiên cứu quan trọng với kết quả mâu thuẫn [9, 39]. Gần đây hơn, Shapiro et al. báo cáo rằng bình thường hóa Lactate là yếu tố dự báo sinh còn mạnh nhất (đã điều chỉnh OR, 5,2; 95% CI, 1,7 – 15.8), sau đó là giảm lactate > 50% trong 6 giờ (OR, 4.0; 95% CI, 1.6-10.0) trong một đoàn hệ của 187 bệnh nhân sốc nhiễm trùng được hồi sức sớm [40].
Tuy nhiên, có một số khía cạnh chưa được giải quyết và mối quan tâm về vai trò của Lactate như là một mục tiêu hồi sức thích hợp. Đầu tiên, không rõ liệu lựa chọn giảm lactate so với bình thường hóa lactate như là mục tiêu hồi sức là tương đương hay không, nhưng quan trọng hơn, nếu quyết định này dẫn đến giải quyết kịp thời tương tự nhau tình trạng giảm tưới máu mô hoặc thiếu oxy. Cuối cùng, chỉ có bình thường hóa lactate có thể đảm bảo không có tình trạng thiếu oxy, mặc dù điều này còn gây tranh cãi [40]. Thứ hai, vì các nguyên nhân gây tăng lactate không liên quan đến giảm tưới máu có thể chiếm ưu thế ở một số bệnh nhân là chưa biết, điều này có thể dẫn đến hồi sức quá mức ở ít nhất một số trong số họ như đã nêu ở trên. Thứ ba, động học của sự phục hồi của Lactate có thể biểu hiện một mô hình hai pha, và do đó, đáp ứng thời gian thực của Lactate đối với các thách thức dịch có thể không đơn giản tùy thuộc vào bối cảnh giảm tưới máu [41]. Một số người sống sót thậm chí có thể bình thường hóa lactate chỉ sau 24 giờ đánh giá [41].
3. Gần đây người ta đã đề xuất rằng một phân tích đồng thời về độ bão hòa O2 tĩnh mạch trung tâm (ScvO2), độ chênh pCO2 tĩnh mạch trung tâm-động mạch (P (cv-a) CO2) và tưới máu ngoại vi được đánh giá theo thời gian đổ đầy mao mạch (CRT) có thể hữu ích trong gợi ý bối cảnh giảm tưới máu cho bệnh nhân có hoặc không có tăng lactate [1] (Hình 2). Sự hiện diện của ScvO2 thấp cho thấy rõ sự mất cân bằng trong mối quan hệ tiêu thụ/vận chuyển O2 [1]. Trong trường hợp P(cv- a)CO2, mối quan hệ đường cong nghịch đảo giữa Pcv-aCO2 và cung lượng tim tồn tại, làm nổi bật tầm quan trọng của lưu lượng máu đối với tích lũy CO2 tĩnh mạch [1, 42]. Hơn nữa, P(cv-a)CO2 cao có khả năng xác định bệnh nhân nhiễm trùng huyết được hồi sức không đầy đủ mặc dù đã đạt được các mục tiêu chuyển hóa oxy, củng cố khái niệm P(cv-a)CO2 như một dấu hiệu tốt hơn của tưới máu toàn thân [42]. Việc đánh giá tưới máu ngoại vi có thể cung cấp thêm thông tin sinh lý. Một tưới máu ngoại vi bất thường có thể được gây ra bởi sự co mạch da do adrenergic gây ra thứ phát do lưu lượng máu toàn thân thấp và nên nhắc nhở ít nhất là đánh giá lại tình trạng tiền tải [43].
Trong một nghiên cứu hồi cứu ở 90 bệnh nhân sốc nhiễm trùng huyết tăng lactate, chúng tôi đã thử nghiệm nếu các tiêu chí này có thể xác định hiệu quả một nhóm phụ có nguy cơ cao hơn [44]. Bệnh nhân biểu hiện ScvO2 < 70%, P(cv-a)CO2 > 6 mmHg hoặc CRT > 4 giây khi nhập viện ICU được phân loại là bệnh nhân có bệnh cảnh giảm tưới máu. Bảy mươi bệnh nhân đã đáp ứng phân loại này và cần thêm thuốc vận mạch và thuốc điều trị. Họ cũng có xu hướng có thời gian nằm viện và ICU cao hơn, ngày thở máy, cân bằng dịch dương tính và đòi hỏi sử dung các biện pháp cứu vãn nhiều hơn. Chỉ có 1 trong số 20 bệnh nhân tăng lactate máu không có bệnh cảnh giảm tưới máu đã chết (5%) so với 11 trong số 70 bệnh nhân có tăng lactate máu liên quan đến giảm tưới máu (16%), mặc dù sự khác biệt này không còn ý nghĩa [44].
4. Từ góc độ lý thuyết, ba biến số liên quan đến tưới máu dễ dàng đánh giá này cung cấp một lợi thế quan trọng so với Lactate là mục tiêu hồi sức dịch truyền ở bệnh nhân sốc nhiễm trùng: chúng rõ ràng nhạy cảm với dòng chảy và có tốc độ phục hồi nhanh hơn sau khi dòng chảy toàn thân tối ưu hóa. Nói cách khác, các thông số này có thể rõ ràng trong vài phút ở những bệnh nhân đáp ứng với dịch so với lactate đôi khi phải mất hàng giờ để phục hồi. Các nhà nghiên cứu đã chứng minh điểm này bằng cách phân tích động học của sự phục hồi của các thông số này trong một nhóm các bệnh nhân sốc nhiễm trùng sống sót chung cuộc. ScvO2, P(cv-a)CO2 và CRT đã bình thường ở gần 70% bệnh nhân sau 2 giờ hồi sức truyền dịch, so với chỉ 15% trong trường hợp lactate [41].
Tuy nhiên, cũng có một số nhược điểm đối với một số tham số nhạy cảm với dòng chảy liên quan đến tưới máu này. ScvO2 là một biến số sinh lý phức tạp. Nó được sử dụng rộng rãi cho đến gần đây như là mục tiêu hồi sức ở những bệnh nhân bị bệnh nặng [1], mặc dù một số hạn chế có thể ngăn cản sự giải thích đơn giản về những thay đổi của nó [1]. Ví dụ, các giá trị ScvO2 bình thường hoặc thậm chí siêu thường không loại trừ tình trạng thiếu oxy mô toàn thân hoặc khu vực vì một số lý do đã được nên bật trong chương khác, nhưng bao gồm các rối loạn vi tuần hoàn nghiêm trọng làm suy giảm khả năng trích xuất mô của mô [1]. Vallee et al. tìm thấy giá trị P(cv-a)CO2 bất thường kéo dài ở 50% bệnh nhân sốc nhiễm trùng đã đạt được giá trị ScvO2 bình thường sau khi hồi sức ban đầu [42]. Tuy nhiên, ở một số trạng thái huyết động tăng động, lưu lượng máu tĩnh mạch cao có thể đủ để rửa sạch CO2 toàn thân được sản xuất từ các mô được sử dụng, và do đó, P(cv-a)CO2 có thể bình thường mặc dù có tình trạng thiếu oxy mô [1]. Một vấn đề khác đối với hai biến này là chúng nhất thiết phải được đánh giá thông qua tĩnh mạch trung tâm, một nhiệm vụ có thể phức tạp để thực hiện trong hoàn cảnh nguồn lực bị giới hạn hoặc tại khoa cấp cứu (ED).
Kết luận
Tăng lactate kéo dài sau khi hồi sức sốc có liên quan đến tăng tỷ lệ mắc bệnh và tử vong nhưng đặc biệt khó diễn giải trong bối cảnh lâm sàng. Ít nhất có ba cơ chế gây bệnh có thể có liên quan: ly giải đường kỵ khí ở vùng bị giảm tưới máu, ly giải đường hiếu khí liên quan đến stress, và khả năng thanh thải đường bị suy yếu. Đánh giá tưới máu mô đa phương thức có thể hỗ trợ trong việc gợi ý bối cảnh giảm tưới máu ở bệnh nhân tăng lactate để tập trung hồi sức trong những trường hợp này và tránh nguy cơ hồi sức quá mức khi các nguyên nhân không liên quan đến tưới máu khác có thể xảy ra.
Hình 2. Một lượt đồ đơn giản để tiếp cận chứng tăng lactate kéo dài dựa trên sự hiện diện của bối cảnh giảm tưới máu.
Thông tin cốt lõi
Lactate là một thông số trao đổi chất quan trọng truyền thống liên quan đến giảm tưới máu và thiếu oxy trong rối loạn chức năng tuần hoàn cấp tính. Đánh giá Lactate được khuyến nghị là một phần cơ bản trong việc theo dõi bệnh nhân bị bệnh nặng. Tăng lactate kéo dài sau khi hồi sức sốc có liên quan đến tăng tỷ lệ mắc bệnh và tử vong. Tăng lactate dai dẳng đặc biệt khó diễn giải trong bối cảnh lâm sàng. Ít nhất có ba cơ chế gây bệnh có thể có liên quan: ly giải đường kỵ khí ở vùng bị giảm tưới máu, ly giải đường hiếu khí liên quan đến stress và suy giảm chức năng thanh thải lactate ở gan. Một đánh giá tưới máu đa phương thức có thể hỗ trợ trong việc gợi ý bối cảnh giảm tưới máu ở những bệnh nhân bị tăng lactate kéo dài.
Tài liệu tham khảo
1. Hernandez G, Bruhn A, Castro R, Regueira T. The holistic view on perfusion monitoring in septic shock. Curr Opin Crit Care. 2012;18:280–6.
2. Bakker J, Nijsten MW, Jansen TC. Clinical use of lactate monitoring in critically ill patients. Ann Intensive Care. 2013;3:12.
3. Bakker J, Vincent JL. The oxygen-supply dependency phenomenon is associated with increased blood lactate levels. J Crit Care. 1991;6:152–9.
4. Bakker J, Coffernils M, Leon M, Gris P, Vincent JL. Blood lactate levels are superior to oxygen-derived variables in predicting outcome in human septic shock. Chest. 1991;99:956–62.
5. Nguyen HB, Rivers EP, Knoblich BP, Jacobsen G, Muzzin A, Ressler JA, et al. Early lactate clearance is associated with improved outcome in severe sepsis and septic shock. Crit Care Med. 2004;32:1637–42.
6. Arnold RC, Shapiro NI, Jones AE, Schorr C, Pope J, Casner E, et al. Multicenter study of early lactate clearance as a determinant of survival in patients with presumed sepsis. Shock. 2009;32:35–9.
7. Mikkelsen ME, Miltiades AN, Gaieski DF, Goyal M, Fuchs BD, Shah CV, et al. Serum lactate is associated with mortality in severe sepsis independent of organ failure and shock. Crit Care Med. 2009;37:1670–7.
8. Gu WJ, Wang F, Bakker J, Tang L, Liu JC. The effect of goal-directed therapy on mortality in patients with sepsis – earlier is better: a meta-analysis of randomized controlled trials. Crit Care. 2014;18:570.
9. Jansen TC, van Bommel J, Schoonderbeek FJ, Visser SJS, van der Klooster JM, Lima AP, et al. Early lactate-guided therapy in intensive care unit patients: a multicenter, open- label, randomized controlled trial. Am J Respir Crit Care Med. 2010;182:752–61.
10. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315:801–10.
11. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign:
12. international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43:304–77.
13. Garcia-Alvarez M, Marik P, Bellomo R. Sepsis-associated hyperlactatemia. Crit Care. 2014;18:503.
14. Cori CF. Mammalian carbohydrate metabolism. Physiol Rev. 1931;11:143–275.
15. Levy B. Lactate and shock state: the metabolic view. Curr Opin Crit Care. 2006;12:315– 21.
16. Friedman G, De Backer D, Shahla M, Vincent JL. Oxygen supply dependency can characterize septic shock. Intensive Care Med. 1998;24:118–23.
17. De Backer D, Donadello K, Sakr Y, Ospina-Tascon G, Salgado D, Scolletta S, et al. Microcirculatory alterations in patients with severe sepsis: impact of time of assessment and relationship with outcome. Crit Care Med. 2013;41:791–9.
18. Hernandez G, Boerma EC, Dubin A, Bruhn A, Koopmans M, Edul VK, et al. Severe abnormalities in microvascular perfused vessel density are associated to organ dysfunctions and mortality and can be predicted by hyperlactatemia and norepinephrine requirements in septic shock patients. J Crit Care. 2013;28:538.e9–14.
19. Hernandez G, Bruhn A, Ince C. Microcirculation in sepsis: new perspectives. Curr Vasc Pharmacol. 2013;11:161–9.
20. Ospina-Tascón GA, Umaña M, Bermúdez W, Bautista-Rincón DF, Hernandez G, Bruhn A, et al. Combination of arterial lactate levels and venous-arterial CO2 to arterial- venous O2 content difference ratio as markers of resuscitation in patients with septic shock. Intensive Care Med. 2015;41:796–805.
21. Rimachi R, Bruzzi de Carvahlo F, Orellano-Jimenez C, Cotton F, Vincent JL, De Backer D. Lactate/pyruvate ratio as a marker of tissue hypoxia in circulatory and septic shock. Anaesth Intensive Care. 2012;40:427–32.
22. Ospina-Tascón GA, Hernández G, Cecconi M. Understanding the venous-arterial CO2 to arterial- venous O2 content difference ratio. Intensive Care Med. 2016;42:1801–4.
23. Monnet X, Julien F, Ait-Hamou N, Lequoy M, Gosset C, Jozwiak M, et al. Lactate and venoarterial carbon dioxide difference/arterial-venous oxygen difference ratio, but not central venous oxygen saturation, predict increase in oxygen consumption in fluid responders. Crit Care Med. 2013;41:1412–20.
24. Minton J, Sidebotham DA. Hyperlactatemia and cardiac surgery. J Extra Corpor Technol. 2017;49:7–15.
25. Levy B, Desebbe O, Montemont C, Gibot S. Increased aerobic glycolysis through beta2 stimulation is a common mechanism involved in lactate formation during shock states. Shock. 2008;30:417–21.
26. Levy B, Gibot S, Franck P, Cravoisy A, Bollaert PE. Relation between muscle Na+K+ ATPase activity and raised lactate concentrations in septic shock: a prospective study. Lancet. 2005;365:871–5.
27. Vincent JL, Quintairos E, Silva A, Couto L Jr, Taccone FS. The value of blood lactate kinetics in critically ill patients: a systematic review. Crit Care. 2016;20:257.
28. Hernandez G, Regueira T, Bruhn A, Castro R, Rovegno M, Fuentealba A, et al. Relationship of systemic, hepatosplanchnic, and microcirculatory perfusion parameters with 6-hour lactate clearance in hyperdynamic septic shock patients: an acute, clinical-physiological, pilot study. Ann Intensive Care. 2012;2:44.
29. Mizock B. The hepatosplanchnic area and hyperlactatemia: a tale of two lactates. Crit Care Med. 2001;29:447–9.
30 . De Backer D, Creteur J, Silva E, Vincent JL. The hepatosplanchnic area is not a common source of lactate in patients with severe sepsis. Crit Care Med. 2001;29:256– 61.
31. Levraut J, Ciebiera JP, Chave S, Rabary O, Jambou P, Carles M, et al. Mild hyperlactatemia in stable septic patients is due to impaired lactate clearance rather than overproduction. Am J Respir Crit Care Med. 1998;157:1021–6.
32. Tapia P, Soto D, Bruhn A, Alegría L, Jarufe N, Luengo C, et al. Impairment of exogenous lactate clearance in experimental hyperdynamic septic shock is not related to total liver hypoperfusion. Crit Care. 2015;19:188.
33. Hernández G, Tapia P, Alegría L, Soto D, Luengo C, Gomez J, et al. Effects of dexmedetomidine and esmolol on systemic hemodynamics and exogenous lactate clearance in early experimental septic shock. Crit Care. 2016;20:234.
34. Casserly B, Phillips GS, Schorr C, Dellinger RP, Townsend SR, Osborn TM, et al. Lactate measurements in sepsis-induced tissue hypoperfusion: results from the Surviving Sepsis Campaign database. Crit Care Med. 2015;43:567–73.
35. Kompanje EJO, Jansen TC, van der Hoven B, Bakker J. The first demonstration of lactic acid in human blood in shock by Johann Joseph Scherer (1814–1869) in January 1843. Intensive Care Med. 2007;33:1967–71.
36. Bakker J. Lost in translation: on lactate, hypotension, sepsis-induced tissue hypoperfusion, quantitative resuscitation and Surviving Sepsis Campaign bundles. Crit Care Med. 2015;43:705–6.
37. Bakker J, de Backer D, Hernandez G. Lactate-guided resuscitation saves lives: we are not sure. Intensive Care Med. 2016;42:472–4.
38. Hernández G, Teboul JL. Fourth Surviving Sepsis Campaign’s hemodynamic recommendations: a step forward or a return to chaos? Crit Care. 2017;21:133.
39. Vellinga NAR, Boerma EC, Koopmans M, Donati A, Dubin A, Shapiro NI, et al. Mildly elevated lactate levels are associated with microcirculatory flow abnormalities and increased mortality: a microSOAP post hoc analysis. Crit Care. 2017;21:255.
40. Jones AE, Shapiro NI, Trzeciak S, Arnold RC, Claremont HA, Kline JA, et al. Lactate clearance vs central venous oxygen saturation as goals of early sepsis therapy: a randomized clinical trial. JAMA. 2010;303:739–46.
41. Puskarich MA, Trzeciak S, Shapiro NI, Albers AB, Heffner AC, Kline JA, et al. Whole blood lactate kinetics in patients undergoing quantitative resuscitation for severe sepsis and septic shock. Chest. 2013;143:1548–53.
42. Hernandez G, Luengo C, Bruhn A, Kattan E, Friedman G, Ospina-Tascon GA, et al. When to stop septic shock resuscitation: clues from a dynamic perfusion monitoring. Ann Intensive Care. 2014;4:30.
43. Vallée F, Vallet B, Mathe O, Parraguette J, Mari A, Silva S, et al. Central venous-to- arterial carbon dioxide difference: an additional target for goal-directed therapy in septic shock? Intensive Care Med. 2008;34:2218–25.
44. Lara B, Enberg L, Ortega M, Leon P, Kripper C, Aguilera P, et al. Capillary refill time during fluid resuscitation in patients with sepsis-related hyperlactatemia at the emergency department is related to mortality. PLoS One. 2017;12:e0188548.
45. Alegría L, Vera M, Dreyse J, Castro R, Carpio D, Henriquez C. A hypoperfusion context may aid to interpret hyperlactatemia in sepsis-3 septic shock patients: a proof-of- concept study. Ann Intensive Care. 2017;7:29.