Bài viết Sinh lý bệnh của tình trạng giảm oxy máu ‘hạnh phúc’ trong COVID-19 được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: The pathophysiology of ‘happy’ hypoxemia in COVID-19
Tóm tắt
Đại dịch coronavirus mới 2019 (COVID- 19) là một cuộc khủng hoảng toàn cầu, thách thức các hệ thống chăm sóc sức khỏe trên toàn thế giới. Nhiều bệnh nhân có biểu hiện những khoảng nghỉ đáng kể giữa tình trạng giảm oxy máu sâu nhưng không có dấu hiệu suy hô hấp tương ứng (tức là giảm oxy máu “hạnh phúc”) và tình trạng suy sụp nhanh chóng có thể xảy ra. Biểu hiện lâm sàng đặc biệt này ở bệnh nhân COVID-19 trái ngược với kinh nghiệm của các bác sĩ thường điều trị bệnh nhân nặng suy hô hấp và việc đảm bảo chuyển tuyến kịp thời đến đơn vị chăm sóc đặc biệt có thể là một thách thức. Sự hiểu biết thấu đáo về các yếu tố quyết định sinh lý bệnh của trung khu điều hòa hô hấp và giảm oxy máu có thể thúc đẩy sự hiểu biết đầy đủ hơn về biểu hiện và xử trí lâm sàng của bệnh nhân. Tình trạng độ bão hòa oxy được bảo toàn mặc dù áp suất riêng phần thấp của oxy trong mẫu máu động mạch xảy ra, do sự dịch chuyển sang trái của đường cong phân ly oxyhemoglobin gây ra bởi tăng thông khí do giảm oxy máu, cũng như có thể có tương tác trực tiếp của virus với hemoglobin. Sự không phù hợp về thông khí-tưới máu, từ shunt đến thông khí khoảng chết phế nang, là dấu hiệu trung tâm và cung cấp các mục tiêu điều trị khác nhau.
Điều cần nhớ
Tổng quan này mô tả các bất thường sinh lý bệnh trong COVID-19 có thể giải thích sự khác biệt giữa mức độ nghiêm trọng của tình trạng giảm oxy máu và tình trạng khó chịu về hô hấp tương đối nhẹ mà bệnh nhân đã báo cáo.
Bối cảnh
Vào đầu tháng 12 năm 2019, những trường hợp đầu tiên bị viêm phổi không rõ nguyên nhân đã được xác định ở Vũ Hán, thủ phủ tỉnh Hồ Bắc, Trung Quốc. Tác nhân gây bệnh do coronavirus 2019 (COVID-19) đã được xác định là một thành viên mới của họ betacoronavirus RNA có võ bao và được đặt tên là coronavirus hội chứng hô hấp cấp tính nghiêm trọng 2 (SARS- CoV-2), do những điểm tương đồng với SARS- CoV và Hội chứng Hô hấp Trung Đông (MERS). Mặc dù người ta biết nhiều về dịch tễ học và các đặc điểm lâm sàng của COVID-19, nhưng ít người biết về tác động của nó đối với sinh lý bệnh phổi. COVID-19 có mức độ nghiêm trọng lâm sàng rộng, dữ liệu phân loại các trường hợp là nhẹ (81%), nặng (14%), hoặc nguy kịch (5%). Nhiều bệnh nhân có biểu hiện giảm oxy máu động mạch rõ rệt nhưng không có dấu hiệu suy hô hấp tương ứng, thậm chí họ không nói họ có cảm giác khó thở . Hiện tượng này được gọi là giảm oxy máu im lặng hoặc “hạnh phúc”. Tobin và cộng sự gần đây đã trình bày ba trường hợp giảm oxy máu “hạnh phúc” với PaO2 trong khoảng từ 36 đến 45 mmHg trong trường hợp không tăng thông khí phế nang (PaCO2 dao động trong khoảng 34 đến 41 mmHg) [5]. Ở bệnh nhân COVID-19, mức độ nghiêm trọng của tình trạng giảm oxy máu có liên quan độc lập với tử vong khi nhập viện và có thể là một yếu tố dự báo quan trọng rằng bệnh nhân có nguy cơ phải nhập viện chăm sóc đặc biệt (ICU). Do việc nhận biết chính xác tình trạng giảm oxy máu có tác động đến tiên lượng và quyết định điều trị kịp thời, ở đây chúng tôi xin cung cấp tổng quan về các bất thường sinh lý bệnh trong COVID-19 có thể giải thích mối liên hệ giữa giảm oxy máu và cảm giác khó thở của bệnh nhân.
Khó thở như một cảm giác
Sự thở được kiểm soát tập trung bởi trung tâm hô hấp ở vùng hành tủy (medulla oblongata) và vùng cầu não (pons) của thân não (xem Hình 1), nơi “trung tâm điều hòa hô hấp” (respiratory drive) để hô hấp phù hợp với nhu cầu trao đổi chất của cơ thể . Đầu vào chính ảnh hưởng đến quá trình hô hấp bắt nguồn từ phản hồi hóa học giữa các thụ thể hóa học ngoại vi và trung tâm. Tuy nhiên, trung tâm này cũng bị ảnh hưởng bởi vỏ não cao hơn, quá trình nhận thức tích hợp vùng dưới đồi, phản hồi từ các thụ thể cơ học trong cơ và phổi, và tốc độ trao đổi chất. Đầu ra của trung tâm hô hấp có thể được chia thành các tín hiệu nhịp – (ví dụ: nhịp thở) và tạo kiểu (ví dụ độ sâu của nỗ lực thở), và các đầu ra này có thể được kiểm soát độc lập . Khó thở thường được định nghĩa là cảm giác thở “khó chịu, khó khăn hoặc gắng sức” và nói chung xảy ra khi nhu cầu thông khí không tương ứng với khả năng đáp ứng của bệnh nhân. Cần phân biệt với thở nhanh (tachypnea) (tăng số nhịp thở) hoặc tăng thở (hyperpnea) (tăng thông khí). Phân loại khó thở liên quan đến việc cảm giác này xảy ra khi nghỉ ngơi hay khi tập thể dục. Phương pháp chấm điểm bán định lượng này được minh chứng rõ nhất bởi thang đo khó thở được sửa đổi của Hội đồng Nghiên cứu Y khoa (MRC) được sử dụng thường xuyên, phân loại khó thở từ cấp độ 0 (khó thở chỉ khi vận động gắng sức) đến cấp độ 4 (khó thở khi rời khỏi nhà hoặc khó thở khi mặc quần áo) trong mối quan hệ với các đối tượng cùng độ tuổi.
Các kích thích cảm giác, đau và cảm xúc khác nhau ảnh hưởng đến cảm giác thở qua vỏ não và vùng dưới đồi (hypothalamus). Cảm giác bất thường về nỗ lực của cơ là một nguyên nhân khác gây ra chứng khó thở. Không có nhận thức có ý thức về hoạt động của các cơ hô hấp trong quá trình thở khỏe mạnh. Tuy nhiên, khi các cơ hô hấp mệt mỏi hoặc suy yếu do cơ học phổi bị thay đổi (ví dụ: giảm độ giãn nở của lồng ngực), thì việc thở có thể được coi là một nỗ lực đáng kể. Khó thở cũng có thể do đầu vào từ các cơ quan thụ cảm cơ học trong đường hô hấp và thành ngực.
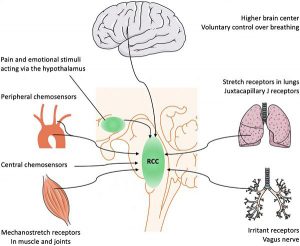
Kích thích các thụ thể gây kích thích phế vị (ví dụ như co thắt phế quản, thở bằng sức cản bên ngoài) dường như làm tăng khó thở. Sự đóng góp của tốc độ trao đổi chất trong việc điều chỉnh cảm giác khó thở ở bệnh nhân nặng vẫn chưa rõ ràng, mặc dù vai trò của nó đã được thiết lập rõ ràng khi tập thể dục. Các yếu tố quyết định được biết đến nhiều nhất của trung khu điều hòa hô hấp là các cơ quan thụ cảm hóa học trung tâm và ngoại vi. Sự thay đổi áp suất khí một phần của carbon dioxide hòa tan trong máu (PaCO2) dường như là thành phần quan trọng nhất, gây ra sự thay đổi pH ở mức độ của cả cơ quan thụ cảm hóa học ngoại vi và trung tâm. Ở trạng thái ổn định, PaCO2 của động mạch được xác định theo công thức sau:
PaCO2 = K.VCO2 / [Ve.(1- (Vd/Vt)]
Đáp ứng bình thường đối với tăng CO2 máu (do tăng VD, giảm thông khí hoặc tăng VCO2) là tăng hoạt hóa trung khu điều hòa hô hấp và tăng thông khí phút. Bản thân tình trạng giảm oxy máu đóng một vai trò hạn chế trong cảm giác khó thở của bệnh nhân bệnh tim phổi, ngược lại với tăng CO2 máu gây ra khó thở. Ở những đối tượng khỏe mạnh, hệ thống hô hấp thay đổi tối thiểu trong tình trạng giảm oxy máu nhẹ (PaO2 60–65 mmHg), chẳng hạn như do ở trên cao hoặc các buồng giảm oxy thực nghiệm. Nhiều bệnh nhân khó thở không phải do giảm oxy máu, trong khi những bệnh nhân này thường chỉ cải thiện một chút triệu chứng sau khi tình trạng giảm oxy máu được điều chỉnh bằng liệu pháp oxy bổ sung. Khi PaO2 động mạch giảm xuống dưới 40 mmHg, khó thở thường xảy ra. Cần lưu ý, phản ứng bình thường đối với giảm oxy máu là tăng thông khí phút, chủ yếu bằng cách tăng thể tích khí lưu thông và nhịp thở. Tần số thở tăng (thở nhanh) và thể tích khí lưu thông tăng (tăng thở) – chứ không phải khó thở – do đó là những dấu hiệu lâm sàng quan trọng nhất của suy hô hấp giảm oxy máu sắp xảy ra. Hơn nữa, PaCO2 đóng vai trò là một trong những yếu tố điều hòa cơ bản của lưu lượng máu não. Tăng thông khí làm giảm PaCO2, sau đó dẫn đến co mạch động mạch do đó làm giảm lưu lượng máu não và áp lực nội sọ. Ngược lại, tăng PaCO2 dẫn đến tăng áp lực nội sọ, cuối cùng dẫn đến suy giảm mức độ ý thức, thay đổi phản xạ thân não, thay đổi tư thế và phản ứng vận động. Tại giường bệnh, sự hiểu biết sâu sắc về các yếu tố quyết định sinh lý bệnh của quá trình hô hấp và giảm oxy máu có thể thúc đẩy sự hiểu biết đầy đủ hơn về COVID- 19 trongbiểu hiện lâm sàng của bệnh nhân và xử trí kịp thời.
Giảm oxy máu “hạnh phúc” trong COVID-19
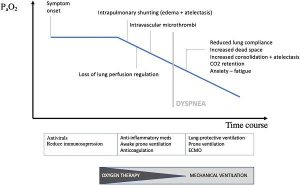
Sự khác biệt giữa mức độ nghiêm trọng của tình trạng giảm oxy máu và tình trạng khó chịu ở đường hô hấp tương đối nhẹ được báo cáo bởi bệnh nhân COVID-19 trái ngược với kinh nghiệm của các bác sĩ thường điều trị cho những bệnh nhân suy hô hấp nặng. Guan báo cáo khó thở chỉ ở 18,7% trong số 1099 bệnh nhân COVID-19 nhập viện, mặc dù tỷ lệ PaO2/FiO2 thấp, chụp CT bất thường (86%) và nhu cầu thông thường về oxy bổ sung (41%). Giảm oxy máu hạnh phúc hoặc thầm lặng không chỉ gặp ở COVID-19, mà còn có thể xảy ra ở bệnh nhân xẹp phổi, shunt trong phổi (tức là dị dạng động mạch-tĩnh mạch) hoặc shunt trong tim từ phải sang trái. Sự đầy đủ của trao đổi khí chủ yếu được xác định bởi sự cân bằng giữa thông khí phổi và lưu lượng máu mao mạch, được gọi là sự phù hợp thông khí/tưới máu (V/Q). Trong giai đoạn đầu của COVID-19, một số cơ chế góp phần vào sự phát triển của giảm oxy máu động mạch (xem Hình 2), mà không làm tăng nhịp thở đồng thời. Có thể xảy ra tình trạng xấu đi nhanh chóng về mặt lâm sàng.
Thay đổi đường cong phân ly oxyhemoglobin
Độ bão hòa oxy được đo bằng phương pháp đo độ bão hòa oxy qua mạch ngoại biên (SpO2) thường được sử dụng để phát hiện tình trạng giảm oxy máu. Tuy nhiên, SpO2 nên được diễn giải một cách thận trọng trong COVID-19. Đường cong phân ly oxyhemoglobin hình sigmoid dường như dịch chuyển sang trái, do kiềm hô hấp gây ra (giảm PaCO2) vì thở nhanh và tăng thở do giảm oxy máu. Trong giai đoạn giảm CO2 máu, ái lực của hemoglobin đối với ôxy tăng và do đó độ bão hòa ôxy tăng lên đối với một mức độ PaO2 nhất định, giải thích tại sao SpO2 có thể được bảo tồn tốt khi PaO2 thấp sâu. Phát hiện này cũng được thấy trong tình trạng giảm oxy máu độ cao, trong đó tình trạng giảm oxy máu làm thay đổi đáng kể đường cong phân ly oxy-hemoglobin và cải thiện độ bão hòa oxy trong máu. Phương trình khí phế nang cũng dự đoán rằng tăng thông khí và kết quả là giảm áp suất riêng phần phế nang của carbon dioxide dẫn đến tăng áp suất riêng phần phế nang của oxy và cuối cùng dẫn đến tăng SpO2.
Cũng có thể có một lời giải thích sinh học cho sự dịch chuyển sang trái của đường cong trong COVID-19. Liu và cộng sự đưa ra giả thuyết về sự tương tác trực tiếp của virus với nhóm heme của hemoglobin. Theo lý thuyết này, nồng độ huyết thanh heme đang tăng lên trong COVID- 19 cùng với các ion sắt có hại (Fe3+) gây viêm và chết tế bào (ferroptosis). Điều này dẫn đến việc sản xuất một lượng lớn ferritin huyết thanh để liên kết các chất sắt tự do này nhằm giảm tổn thương mô. Kết luận, SpO2 có tương tác với tăng thông khí (thở nhanh, PaCO2 thấp) và nếu có thể, PaO2 qua lấy máu động mạch. Đo sự khác biệt oxy giữa phế nang với động mạch [P(A-a)O2 = 150 mmHg – PaCO2/0.8 – PaO2) ở mực nước biển] và liên hệ giá trị này với tuổi và lượng oxy bổ sung (tuổi/4 + 4 + 50 (FiO2–0,21) tính bằng mmHg). Điều này có thể được thực hiện nhanh chóng trên ứng dụng điện thoại thông minh. Gradient P(A-a)O2 tăng lên do V/Q không phù hợp hoặc do shunt trong phổi. Giảm oxy máu do không phù hợp V/Q có thể dễ dàng điều chỉnh bằng liệu pháp oxy bổ sung trong khi shunt trong phổi đáp ứng kém với liệu pháp oxy.
Nguyên nhân gây giảm oxy máu ở COVID-19
Shunt trong phổi
Giảm oxy máu động mạch sớm trong nhiễm trùng SARS-CoV-2 chủ yếu là do V/Q không phù hợp và do đó tồn tại kéo dài việc lưu lượng máu động mạch phổi đến các phế nang không thông khí, phản ánh bằng sự gia tăng rõ rệt độ chênh lệch P(A-a)O2. Nhiễm trùng dẫn đến phù nề mô kẽ cục bộ, đặc biệt nằm ở mặt tiếp giáp giữa các cấu trúc phổi với các đặc tính đàn hồi khác nhau, nơi tập trung stress và strain. Do phù phổi tăng lên (dẫn đến hình kính mờ và động đặc trên phim X quang ngực), mất chất hoạt động bề mặt và áp lực chồng chất, xẹp phế nang xảy ra sau đó và một phần đáng kể cung lượng tim đang tưới máu cho mô phổi không được thông khí, dẫn đến shunt trong phổi. Như đã thảo luận trước đây, thể tích khí lưu thông tăng lên trong suốt quá trình bệnh dẫn đến tăng áp lực âm tính trong lồng ngực. Khi tăng áp lực âm trong lồng ngực, kết hợp với tăng tính thấm của phổi do viêm, cuối cùng sẽ dẫn đến phù nề tiến triển, tràn ngập phế nang và bệnh nhân tự gây tổn thương phổi (P-SILI), như được mô tả lần đầu tiên bởi Barach năm 1938. Theo thời gian, tình trạng phù nề tăng lên sẽ làm tăng thêm trọng lượng phổi, xẹp phế nang và xẹp phổi phụ thuộc, dẫn đến tỷ lệ shunt tăng dần và suy giảm thêm oxy máu mà không thể điều chỉnh hoàn toàn bằng cách tăng FiO2.
Mất điều hòa tưới máu phổi
Sự tồn tại của lưu lượng máu cao từ phổi đến các phế nang phổi không được thông khí dường như là do sự thất bại tương đối của cơ chế co mạch phổi do thiếu oxy (co thắt các động mạch phổi nhỏ để đáp ứng với tình trạng thiếu oxy phế nang) trong quá trình nhiễm SARS-CoV- 2, như được minh họa gần đây bởi Lang và cộng sự khi sử dụng CT năng lượng kép. Liệu cơ chế thứ hai chỉ được kích hoạt bởi sự giải phóng các prostaglandin giãn mạch nội sinh, bradykinin, và các cytokine liên quan đến quá trình viêm hay do các cơ chế chưa được xác định khác vẫn còn được nghiên cứu. Liệt mạch máu dường như cũng ảnh hưởng đến việc mất điều hòa tưới máu phổi, có thể gây ra bởi lực cắt (shear stress) trên các mặt phân cách giữa các cấu trúc phổi, như một phần của phổ P-SILI. Hơn nữa, rối loạn điều hòa hệ thống renin-angiotensin (RAS) góp phần vào sinh lý bệnh của COVID-19. Enzyme chuyển 2 (ACE2) là thụ thể chức năng chính được sử dụng bởi SARS-CoV-2 để xâm nhập tế bào, ngụ ý sự nội hóa (internalization) của ACE2. ACE2 chuyển đổi angiotensin II (Ang II) thành angiotensin 1–7 (Ang 1–7) và cũng rất quan trọng để phân hủy bradykinin. Do đó, nồng độ ACE2 giảm dẫn đến tăng Ang II, làm trung gian co mạch phổi thông qua đồng vận tại thụ thể Ang II, trong khi Ang 1-7 đối kháng các hoạt động của Ang II. Gần đây, Liu và cộng sự cho thấy rằng nồng độ Ang II trong huyết thanh có liên quan tuyến tính với tải lượng virus và tổn thương phổi ở COVID-19.
Vi huyết khối nội mạch
Tổn thương nội mô đang nổi lên như một dấu hiệu trung tâm của cơ chế bệnh sinh COVID- 19, và vi rút tế bào có thể lây nhiễm trực tiếp vào các tế bào nội mô mao mạch phổi biểu hiện ACE2. Vi huyết khối nội mạch là kết quả thực sự của sự mất cân bằng giữa hoạt động đông máu và tiêu sợi huyết khi có viêm cấp tính và tổn thương nội mô. Hoạt động tiền đông máu có thể là kết quả của việc kích hoạt đông máu qua trung gian bổ thể, tương tự như một số dạng bệnh vi mạch huyết khối (TMA, thrombotic microangiopathy), hoặc có thể do ức chế hoạt hóa plasminogen và tiêu sợi huyết thông qua tăng hoạt tính của chất ức chế hoạt hóa plasminogen (PAI-1 và -2) được tạo ra dưới dạng protein pha cấp tính dưới ảnh hưởng của IL-6. Đông máu nội mạch lan tỏa (DIC, diffuse intravascular coagulation) cũng được thấy ở những bệnh nhân bị COVID-19 nặng, qua trung gian nội mô giải phóng yếu tố mô và hoạt hóa yếu tố đông máu VII và XI. Nhiều bệnh nhân với COVID-19 phát triển D-dimers cao cho thấy sự hình thành các cục máu đông. Mức độ D-dimer khi nhập viện được sử dụng để dự đoán tỷ lệ tử vong khi nhập viện ở COVID-19, và DIC hiện diện thường xuyên hơn nhiều (71%) ở bệnh nhân COVID-19 với tiên lượng xấu, so với chỉ 0,6% những người sống sót. Khám nghiệm tử thi phổi sau khi bệnh nặng cho thấy lắng đọng fibrin, tổn thương phế nang lan tỏa, dày thành mạch và thường xuyên xảy ra vi khuẩn giàu bổ thể làm tắc các mao mạch phổi và huyết khối lớn hơn gây ra huyết khối và thuyên tắc động mạch phổi. Tình trạng tăng đông dẫn đến suy giảm thêm về sự không phù hợp V/Q và tổn thương mô phổi. Hơn nữa, đông máu cũng được điều chỉnh bằng cách kích hoạt protein phản ứng C và tiếp theo là hoạt hóa bổ thể và tổng hợp fibrinogen ở gan như một protein giai đoạn cấp tính trong COVID-19.
Khả năng khuếch tán suy giảm
Khả năng khuếch tán của phổi (DLCO, lung diffusion capacity) có thể bị suy giảm, mặc dù khiếm khuyết khuếch tán đơn thuần hiếm khi là nguyên nhân làm tăng gradient P(A-a)O2 lúc nghỉ. SARS-CoV-2 lan truyền trong các tế bào loại II phế nang, nơi một số lượng lớn các hạt virus sẽ được sản xuất và giải phóng, sau đó là phản ứng miễn dịch phá hủy các tế bào bị nhiễm (bệnh pyroptosis liên kết với virus). Mất tế bào biểu mô phế nang và trạng thái đông máu làm cho màng đáy bị bào mòn được bao phủ bởi các mảnh vụn, bao gồm fibrin, tế bào chết và các sản phẩm hoạt hóa bổ thể, được gọi chung là màng hyalin. Khi các hoạt động tăng dần và đối mặt với tình trạng co mạch thiếu oxy trong COVID-19, tuần hoàn phổi tăng động có thể không cho phép đủ thời gian để các tế bào hồng cầu cân bằng sự hấp thu oxy của chúng. Do đó, hạn chế khuếch tán có thể xảy ra trong COVID-19 dẫn đến tăng gradient P(A-a)O2 và giảm oxy máu động mạch do gắng sức (EIAH, exercise-induced arterial hypoxemia). Gần đây, Xiaoneng Mo và cộng sự xác nhận sự giảm DLCO ở bệnh nhân COVID-19 tại thời điểm xuất viện. Tỷ lệ suy giảm khả năng khuếch tán có liên quan đến mức độ nghiêm trọng của bệnh, lần lượt là 30,4% ở bệnh nhẹ, 42,4% ở bệnh viêm phổi và 84,2% ở bệnh viêm phổi nặng [70]. Các nghiên cứu dài hạn là cần thiết để giải quyết liệu những khiếm khuyết này có tồn tại dai dẳng như đã thấy ở MERS hay không khi 37% số người sống sót sau MERS vẫn bị suy giảm DLCO.
Bảo tồn cơ học phổi
Dàn ý được trình bày trong các đoạn trước phần lớn làm rõ sự phân biệt giữa mức độ nghiêm trọng của giảm oxy máu trong COVID-19 và cơ học phổi được bảo tồn tương đối tốt. Bất thường trao đổi khí ở một số bệnh nhân COVID- 19 xảy ra sớm hơn so với tăng tải cơ học. Trong những ngày đầu tiên của nhiễm trùng, không có sức cản đường thở tăng lên và có lẽ không có tăng thông khí khoảng chết giải phẫu hoặc sinh lý. Nỗ lực thở cũng khá thấp vì độ giãn nở của phổi là bình thường ở nhiều bệnh nhân không có bệnh phổi từ trước. Như được chỉ ra gần đây bởi Gattinoni và cộng sự trong một nhóm thuần tập gồm 16 bệnh nhân nặng, các giá trị tương đối bình thường về độ giãn nở hệ thống hô hấp (50,2 ± 14,3 ml/cmH2O) đi đôi với tỷ lệ shunt tăng đột ngột là 0,50 ± 0,11. Sự khác biệt lớn như vậy là rất bất thường đối với hầu hết các dạng rối loạn dẫn đến tổn thương phổi cấp tính và ARDS. Mức độ độ giãn nở tương đối cao cho thấy thể tích khí phổi được bảo tồn tốt và giải thích phần nào việc không có khó thở sớm trong quá trình bệnh. Ngược lại, Ziehr và cộng sự đã mô tả mức độ độ giãn nở thấp và trình bày thống nhất phù hợp với định nghĩa của Berlin về ARDS trong một nhóm thuần tập gồm bệnh nhân COVID-19. Đáng lưu ý, bệnh nhân thở máy có mức độ COVID-19 nghiêm trọng nhất và do đó có lẽ mức độ độ giãn nở hệ thống hô hấp thấp nhất. Bản thân khó thở có thể thúc đẩy đưa đến thở máy, và thở máy có thể là dấu hiệu đại diện cho mức độ độ giãn nở thấp trong COVID-19. Sự hiểu biết về cơ chế hô hấp được tìm thấy trong COVID-19 sẽ tiếp tục phát triển khi các nghiên cứu sâu hơn được báo cáo.
Diễn tiến xấu nhanh chóng
Nhịp thở nhanh do thiếu oxy máu, tăng thở và thay đổi oxygen hóa dự báo tình trạng xấu đi trên lâm sàng do mức độ bệnh và/hoặc đáp ứng của vật chủ và/hoặc xử trí dưới mức tối ưu. Khi bệnh tiến triển, các khoảng không khí được đông đặc nhiều hơn sẽ không dễ dàng bị phồng lên ở áp suất xuyên phổi cao hơn. Sự mất thể tích lớn hơn tương ứng với thể tích phổi cao hơn. Sự mất thể tích này làm giảm khả năng độ giãn nở tổng thể của phổi và làm tăng công thở. Cũng có bằng chứng cho thấy khả năng độ giãn nở động của phổi còn lại được thông khí bị giảm trong bệnh viêm phổi do SARS-CoV-2 (như đã thấy ở bệnh viêm phổi do phế cầu khuẩn) hầu hết có thể do giảm hoạt động bề mặt, làm tăng thêm công việc thở. Khoảng chết sinh lý cũng ngày càng tăng do lưu lượng máu phổi giảm do huyết khối nội mạch. Quan trọng là, sự lo lắng của bệnh nhân COVID-19 cũng ảnh hưởng đến phản hồi của vỏ não đối với các trung tâm hô hấp. Hậu quả là khi bệnh tiến triển, tình trạng khó thở ngày càng rõ rệt.
Suy nghĩ về cách xử trí
Ở giai đoạn bệnh nhân COVID-19 nhập viện với tình trạng giảm oxy máu, sự nhân lên của virus đang xảy ra mạnh mẽ và ngoài việc cho dùng thuốc kháng virus, việc tối ưu hóa sự không phù hợp V/Q và giảm cơn bão cytokine vẫn là mục tiêu điều trị chính. Chú ý đến tưới máu, tránh vi thuyên tắc và lắng đọng fibrin đang diễn ra là một trong những chiến lược điều trị. Có vẻ như thận trọng khi sử dụng dự phòng huyết khối ở tất cả bệnh nhân COVID-19, đặc biệt ở những bệnh nhân có chỉ số D-dimers cao khi nhập viện. Moore và cộng sự gần đây đã đề xuất sử dụng chất hoạt hóa plasminogen mô (tPA) để điều trị ARDS trong COVID-19. Ngoài ra, việc giải quyết biến chứng tạo huyết khối toàn thân bằng cách sử dụng thuốc chống viêm (như tocilizumab kháng IL6R hoặc sarilumab, hoặc siltuximab kháng thể kháng IL6 hoặc các chiến lược ức chế bổ thể) để ngăn ngừa thuyên tắc vi mô và vĩ mô thể hiện một cách tiếp cận tiềm năng khác và một số thử nghiệm hiện đang được kiểm chứng giả thuyết này. Sự co thắt mạch phổi do giảm oxy hiệu quả có thể là một mục tiêu khác để cải thiện sự phù hợp của tưới máu vùng và thông khí trong phổi. Có sự giải phóng quá mức các chất trung gian gây viêm làm rối loạn sự cân bằng giữa nitric oxide (NO), endothelin và prostanoid trong các mao mạch phổi, mặc dù NO hít liên tục không cho thấy sự cải thiện tỷ lệ tử vong trong ARDS. Điều hòa RAS (ví dụ như thuốc chẹn thụ thể angiotensin, ACE2 hòa tan tái tổ hợp và ức chế hệ thống bradykinin) có thể có vai trò tiềm năng trong việc khôi phục điều hòa tưới máu phổi, và các thử nghiệm đang được tiến hành.
Về thông khí, bổ sung oxy là bước đầu tiên để tạo điều kiện cho quá trình oxy hóa. Ở những bệnh nhân suy hô hấp giảm oxy máu (tăng tỷ lệ shunt), đặt nội khí quản kịp thời nhưng không sớm và hỗ trợ thông khí xâm lấn có thể ưu việt hơn thông khí không xâm nhập trong việc tăng áp lực trong phổi, mở các phế nang xẹp, cải thiện oxy, giảm nợ oxy, tránh P-SILI và tạo cơ hội tốt hơn cho phổi được chữa lành. Xem xét các trường hợp nguy kịch, hầu hết bệnh nhân đáp ứng các tiêu chí Berlin của ARDS, trong đó thông khí bảo vệ phổi, thông khí nằm sấp, an thần và giảm đau hiệu quả, và áp lực dương cuối thì thở ra (PEEP) cao là chìa khóa. Bệnh nhân COVID-19 nhạy cảm với PEEP. Sự dung nạp đối với tình trạng tăng CO2 cho phép ở mức độ vừa phải giúp giảm thiểu tổn thương phổi do máy thở (VILI, ventilator- induced lung injury). Vì tư thế nằm sấp huy động các vùng phổi ở lưng và chuyển hướng dòng máu đến các vùng này, nó có thể có tầm quan trọng đặc biệt trong COVID-19 khi được sử dụng sớm và trong các phiên điều trị tương đối dài. Mặc dù cần có các thử nghiệm sâu hơn để đánh giá tác động đến mức độ nghiêm trọng của bệnh và tỷ lệ tử vong, một số tác giả đã xác nhận rằng nằm sấp thức tỉnh có thể cải thiện quá trình oxygen hóa trong COVID-19.
Kết luận
Sự phân biệt đáng chú ý giữa suy hô hấp giảm oxy máu sâu và một bệnh nhân “hạnh phúc” trên lâm sàng thường thấy và cần nhắc nhở các bác sĩ và nhân viên y tế không chỉ dựa vào tình trạng sức khỏe rõ ràng của bệnh nhân mà theo dõi chặt chẽ nhịp thở, dấu hiệu tăng thông khí, độ bão hòa oxy và các phép đo xâm lấn giảm oxy máu/giảm CO2 máu trong khoảng thời gian đều đặn. Phép đo độ bão hòa oxy mạch ngoại biên nên được diễn giải một cách thận trọng, vì sự dịch chuyển sang trái của đường cong phân ly oxyhemoglobin. Tình trạng giảm oxy máu động mạch được gây ra bởi sự tắt nghẽn trong phổi, rối loạn điều hòa co mạch phổi do thiếu oxy, suy giảm khuếch tán phổi và hình thành vi thuyên tắc trong lòng mạch. Như những ngày đầu của bệnh, cơ học phổi được bảo tồn tốt và không có hiện tượng tăng sức cản đường thở hoặc thông khí khoảng chết. Do đó, trung tâm hô hấp không có cảm giác thở khó chịu. Tuy nhiên, tình trạng mất bù hô hấp đột ngột và nhanh chóng có thể xảy ra, và thở nhanh và tăng thở có thể là những dấu hiệu cảnh báo lâm sàng quan trọng nhất về suy hô hấp sắp xảy ra ở bệnh nhân COVID-19.





