Bài viết Nhắm mục tiêu oxy máu bình thường trong hội chứng suy hô hấp cấp tính có thể gây ra kết quả ngắn hạn xấu hơn do độc tính oxy được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Targeting Normoxemia in Acute Respiratory Distress Syndrome May Cause Worse Short-Term Outcomes because of Oxygen Toxicity
1. Tóm tắt
Người ta đã đề xuất rằng nhắm mục tiêu oxy máu bình thường – normoxemia (PaO2 85–110 mm Hg) ở những bệnh nhân có hội chứng suy hô hấp cấp tính (ARDS) có thể ngăn ngừa rối loạn chức năng thần kinh nhận thức ở những người sống sót.
Tuy nhiên, nhắm mục tiêu normoxemia có thể gây ra những tác động bất lợi cho phổi do độc tính oxy. Một số người đã gợi ý rằng oxy không gây hại cho phổi ở nồng độ FiO 2 (nồng độ oxy khí hít vào) dưới 0,6-0,7, nhưng bằng chứng tương phản ở người bình thường cho thấy rằng có thể có tác dụng không mong muốn của nồng độ FiO2 mức vừa phải. Hơn nữa, trong các mô hình thí nghiệm của hội chứng suy hô hấp cấp tính, viêm phổi cùng tồn tại làm tăng tính nhạy cảm với độc tính oxy.
Viêm phổi hiện tại có thể làm giảm ngưỡng độc tính oxy ở bệnh nhân ARDS hoặc các bệnh cấp tính khác trong phổi. Hơn nữa, các bác sĩ thường cho y lệnh nồng độ FiO 2 cao hơn mức cần thiết để đạt được mục tiêu oxy hóa động mạch, làm tăng thêm nguy cơ độc tính oxy. Tiêu chuẩn normoxemia ở bệnh nhân ARDS có thể ngăn ngừa một số thâm hụt nhận thức thần kinh lâu dài ở những người sống sót, nhưng nó có thể làm tăng viêm phổi và gây ra kết cục lâm sàng ngắn hạn tồi tệ hơn. Chúng tôi ủng hộ một thử nghiệm lâm sàng ở bệnh nhân ARDS để xác định các mục tiêu thích hợp hơn cho sự oxy hóa động mạch.
Trong bài viết của họ, Mikkelsen và các đồng nghiệp cho rằng tiêu chuẩn normoxemia (PaO2 85–110 mm Hg) ở những bệnh nhân bị hội chứng suy hô hấp cấp tính (ARDS) có thể ngăn ngừa rối loạn chức năng thần kinh ở những người sống sót (1).
Normoxemia có thể tốt cho nhận thức thần kinh trong thời gian dài, nhưng có thể không thuận lợi cho sự sống còn ARDS trong thời gian ngắn vì độc tính oxy. Chúng tôi phỏng đoán rằng Mikkelsen và các đồng nghiệp có thể hiểu rõ nguy cơ ngắn hạn tiềm ẩn của FiO2 cao ở bệnh nhân ARDS. Người ta cố gắng bình thường hóa các trị số như PaO2, nhưng giống như tất cả mọi thứ chúng ta làm trong y học, có những rủi ro.
Mục tiêu chính của quan điểm này là cung cấp bằng chứng rằng trong việc nhắm mục tiêu normoxemia, bệnh nhân có thể tiếp xúc với nồng độ FiO 2 cao không cần thiết làm trầm trọng thêm chấn thương phổi.
Để hỗ trợ cho ý tưởng này, chúng tôi nhấn mạnh sự không chắc chắn trong sự hiểu biết về độc tính oxy của con người, như bằng chứng cho thấy oxy có thể gây độc cho phổi của người bình thường ngay cả ở nồng độ vừa phải (FiO2 0,5–0,6) (2). Hơn nữa, các mô hình thử nghiệm chứng minh rằng tình trạng viêm phổi cùng tồn tại như nhiễm trùng làm tăng tính nhạy cảm với độc tính oxy (3, 4).
Các nghiên cứu cũng cho thấy rằng hyperoxia có thể dẫn đến kết quả tồi tệ hơn trong các tình trạng cấp tính khác bao gồm ngừng tim (5) và bệnh phổi tắc nghẽn mạn tính (COPD) đợt cấp (6).
Ngoài ra, tập trung vào phòng ngừa và điều trị sớm chấn thương phổi cấp tính, hiểu sự liên quan của độc tính oxy trong những quần thể nhạy cảm này sẽ rất quan trọng trong việc thiết kế các nghiên cứu trong tương lai. Chúng tôi nhấn mạnh sự cần thiết cho một nghiên cứu tiền cứu để thiết lập các mục tiêu thích hợp hơn cho sự oxy hóa động mạch ở bệnh nhân ARDS.
2. FiO2 an toàn là gì ?
Mức độ “an toàn” và thời gian tiếp xúc với oxy chưa được thiết lập ngay cả ở người bình thường. Các nghiên cứu trên động vật cho thấy một phổ nhạy cảm với oxy khác nhau trong các loài. Yếu tố quyết định chấn thương mô do oxy gây ra bao gồm tuổi tác cũng như nồng độ oxy và thời gian tiếp xúc với oxy (7).
Con người và các loài linh trưởng khác được cho là có tính nhạy cảm tương tự với độc tính oxy. Tuy nhiên, các nghiên cứu ở loài linh trưởng cho thấy sự khác biệt về sự giao nhau của tính nhạy cảm. Trong một nghiên cứu, khỉ rhesus cần nhiều hơn 5 ngày tiếp xúc với oxy lớn hơn 90% trước khi chúng phát triển các triệu chứng, và thời gian phơi nhiễm trung bình đến chết là 10 ngày (8).
Trong một nghiên cứu trong đó linh trưởng được tiếp xúc với một FiO2 là 1,0, tỷ lệ tử vong của ngày 6 là 57% ở khỉ đầu chó so với 33% ở khỉ rhesus (9).
Nhiều bác sĩ tin rằng nồng độ FiO2 thấp hơn 0,6–0,7 là an toàn. Kết luận này có thể dựa chủ yếu vào nghiên cứu, ở người bình thường, với những điểm kết thúc chủ quan thiếu đánh giá nghiêm ngặt về tình trạng viêm phổi và chức năng rào cản (barrier function), và nghiên cứu ở những bệnh nhân có bệnh hô hấp có thể tồn tại hoặc phơi nhiễm đồng thời có hại.
Trong một nghiên cứu của Comroe và các đồng nghiệp, những người tình nguyện khỏe mạnh phàn nàn về sự khó chịu ở ngực và ho khi tiếp xúc với nồng độ FiO 2 lớn hơn 0,75 chỉ trong 24 giờ (10). Tiếp xúc với nồng độ oxy vừa phải (0,5 < FiO2 < 0,75) thường được sử dụng ở những bệnh nhân ARDS không được thử nghiệm trong nghiên cứu này. Hơn nữa, tình trạng viêm phổi, tính thấm mạch máu và chức năng rào cản không được đánh giá.
Nghiên cứu của Sevitt (11) và Nash và cộng sự (12) chứng minh bằng chứng hỗ trợ tác hại tiềm tàng của nồng độ FiO 2 dưới 0,6, nhưng rất khó để kết luận rằng tác hại chỉ xảy ra do oxy dư thừa do bệnh lý đường hô hấp hoặc tiếp xúc với thông khí cơ học. Gần đây hơn, Griffith và các đồng nghiệp đã trình bày các đối tượng bình thường với một FiO2 là 0,50 trong một thời gian 44 giờ. Họ đã chứng minh tình trạng viêm phổi tăng và chức năng rào cản nội mô và biểu mô bị suy giảm so với những người phơi nhiễm không khí trong phòng (2). Chúng tôi vẫn không biết nồng độ oxy tối thiểu và thời gian phơi nhiễm đủ để gây tổn thương phổi ở người bình thường là bao nhiêu.
3. Bệnh nhân thường xuyên nhận được nhiều oxy hơn là cần thiết để đạt được mục tiêu oxy hóa máu động mạch
Bằng chứng cho thấy nhiều bệnh nhân bị suy hô hấp cấp tính được tiếp xúc với oxy dư thừa. Trong ARDSnet, việc vi phạm thường xuyên các giao thức quản lý máy thở là do thiếu phản ứng với PaO 2 trên phạm vi mục tiêu (13).
Các BS thường phản ứng nhanh khi độ bão hòa PaO 2 hoặc oxyhemoglobin giảm xuống dưới phạm vi mục tiêu, nhưng họ phản ứng chậm khi quá trình oxy hóa động mạch vượt quá phạm vi mục tiêu. Điều này có vẻ liên quan đến hành vi của bác sĩ, và cũng có thể dựa trên sự thiếu hiểu biết về độc tính oxy ở người (14, 15). Một số yếu tố có thể góp phần vào việc thực hành cho phép các giá trị PaO2 quá cao, bao gồm cả việc tập trung vào việc tránh tình trạng thiếu oxy máu và một nền văn hóa không nhấn mạnh tầm quan trọng của kiểm soát chính xác (14–16).
Các nghiên cứu khác ở những bệnh nhân suy hô hấp cấp tính cũng cho thấy một xu hướng sai lệch về mặt tiếp xúc với oxy quá mức. de Graaff và các đồng nghiệp đã đánh giá đáp ứng của các bác sĩ ICU để tăng oxy máu, được xác định trong nghiên cứu của họ như là một PaO2 lớn hơn 120 mm Hg (> 16 kPa), trong số những bệnh nhân thở máy nhận oxy bổ sung.
Trong dân số này, FiO2 đã giảm chỉ trong 25% các trường hợp trong khoảng thời gian 24 giờ (17). Bởi vì khí máu động mạch đã thực hiện trung bình chín lần trong 24 giờ, các bác sĩ đã có nhiều cơ hội để giảm FiO2, nhưng họ đã hành động tối thiểu để đáp ứng với mức độ PaO 2 vượt quá normoxemia. Suzuki và các đồng nghiệp đã đánh giá các phản ứng của bác sĩ đối với các bão hòa oxyhemoglobin lớn hơn hoặc bằng 99% ở bệnh nhân suy hô hấp cấp tính. Khi FiO 2 khởi động lớn hơn hoặc bằng 0,6, nó đã được giảm trong hơn 95% các trường hợp.
Tuy nhiên, khi khởiđộng FiO 2 là 0,5, không có thay đổi nào được thực hiện trong 57% thời gian. Khi FiO2 khởi đầu là 0,4, nó không thay đổi trong 76% thời gian và thực sự tăng trong 5% thời gian (18). Nghiên cứu này cho thấy rằng các bác sĩ chấp nhận nồng độ FiO2 dưới 0,6 là an toàn ngay cả ở những bệnh nhân bị suy hô hấp cấp tính.
Ngay cả sau khi ICU đã thông qua một “liệu pháp oxy bảo thủ” (độ bão hòa oxy được xác định bằng phương pháp đo oxy xung [SpO2] 90-92%) để tránh tiếp xúc với oxy không cần thiết, gần một nửa mức SpO2 vượt quá giới hạn trên của mục tiêu phạm vi (19). Mặc dù không tuân thủ đáng kể, hai phần ba oxy ít được sử dụng trong nhóm bảo thủ mà không có tác dụng phụ. Do đó, nhiều bệnh nhân tiếp xúc với nồng độ FiO2 cao hơn mức cần thiết để đạt được một phạm vi ôxy hóa động mạch mục tiêu.
Các bác sĩ có thể bỏ lỡ các cơ hội để tránh tiếp xúc không cần thiết với nồng độ FiO2 cao bởi vì họ thường xuyên dựa vào đo oxy xung để theo dõi quá trình oxy hóa động mạch. Trong thực tế, chúng tôi giả định normoxemia khi SpO2 là cao bình thường (> 95%), nhưng thực tế PaO2 có thể vượt quá normoxemia (80-100 mm Hg) và mở rộng thành hyperoxemia (> 120 mm Hg). Trong một nghiên cứu của Rice và các đồng nghiệp ở bệnh nhân ARDS, đối với một SpO 2/FiO2 đã cho, phạm vi tỷ lệ PaO 2/FiO2 tương ứng là rộng (20). Ví dụ, tại một SpO2/FiO2 khoảng 180, PaO2/FiO2 thay đổi từ dưới 100 đến hơn 300, cho thấy nhiều trường hợp PaO2 cao không cần thiết.
Điều chỉnh FiO2 hoặc PEEP có thể là một chiến lược hiệu quả để tăng PaO2. Tuy nhiên, trong một nghiên cứu của bệnh nhân ARDS, Rachmale và các đồng nghiệp chứng minh rằng các bác sĩ lâm sàng thường chọn để tăng FiO 2 trước khi tăng PEEP (21). Họ xác định sử dụng oxy quá mức như một FiO 2 lớn hơn 0,50 khi giá trị SpO2 vượt quá 92%. Trong 48 giờ sau khi đặt nội khí quản, sử dụng oxy quá mức xảy ra ở 74% bệnh nhân thông khí trong khoảng 17 giờ. Bệnh nhân dùng FiO2 cao có nồng độ PEEP thấp hơn đáng kể so với những người được điều trị FiO 2 không cao (5 so với 8 mm Hg). Sự khác biệt giữa nồng độ FiO2 quá mức và PEEP thấp hơn cho thấy rằng các bác sĩ lâm sàng có thể điều chỉnh PEEP và FiO 2 dựa trên nhận thức của họ về những rủi ro và lợi ích tiền cứu của cả hai thông số này và xem xét khả năng gây hại của PEEP cao hơn.
4. Mức độ không cần thiết của FiO 2 có an toàn trong suy hô hấp cấp tính không?
Bằng cách sai lệch về mặt “an toàn” cao của một dải PaO 2, bệnh nhân bị suy hô hấp cấp tính tiếp xúc với nồng độ oxy cao và có khả năng gây hại một cách không cần thiết. Trong nghiên cứu của Rachmale và các đồng nghiệp, việc tăng thời gian tiếp xúc với oxy quá mức có liên quan đến các chỉ số oxy hóa xấu đi.
Tiếp xúc với oxy quá mức cũng có liên quan đến thời gian thở máy lâu hơn, và thời gian sử dụng ICU và thời gian nằm viện dài hơn (21). Một nghiên cứu của de Jonge và các đồng nghiệp đã đề xuất một mối liên hệ trực tiếp giữa tử suất bệnh viện và các giá trị FiO2 cao hơn trong 24 giờ đầu tiên sau khi bắt đầu thở máy.
Điều này đã được dự kiến ở những bệnh nhân có giá trị PaO2 tương ứng thấp (tỷ lệ PaO2/FiO2 thấp). Tuy nhiên, một FiO2 cao hơn cũng liên quan đến tỷ lệ tử vong gia tăng ở bệnh nhân có giá trị PaO 2 cao (cao PaO2/FiO2), cho thấy độc tính oxy góp phần vào tử vong tại bệnh viện (22). Trái ngược với các nghiên cứu của Rachmale và de Jonge, một nghiên cứu của Eastwood và các đồng nghiệp đã không chứng minh mối liên hệ giữa việc sử dụng oxy quá mức trong 24 giờ đầu và tử vong do bệnh viện gia tăng (23). Cho đến nay, các nghiên cứu đánh giá ảnh hưởng của hyperoxia ở bệnh nhân ARDS đã được quan sát là chủ yếu, gây khó khăn khi rút ra bất kỳ kết luận cụ thể nào về tác động của oxy dư thừa.
5. Tiếp xúc với nồng độ vừa phải của FiO 2 có thể làm trầm trọng thêm viêm phổi (Lung Inflammation)
Để đáp ứng với mức độ tiếp xúc oxy cao hoặc các nguồn oxy hóa khác, sự thích nghi của động vật có vú bao gồm sản sinh ra nhiều enzym chống oxy hóa như superoxide dismutase, catalase, và glutathione peroxidase, làm giảm các loại phản ứng oxy hóa khử (ROS, reactive oxygen species) với nước. Tuy nhiên, bệnh nhân ARDS có thể dễ bị ảnh hưởng bởi oxy hơn vì phản ứng thích ứng của họ bị suy yếu do viêm phổi và tổn thương. Bằng cách định lượng các sản phẩm huỳnh quang (fluorescent products) của quá trình oxy hóa lipid trong dung dịch phế nang, Griffith và các cộng sự cho rằng có sự gia tăng đáng kể về stress oxy hóa sau khi tiếp xúc với một FiO 2 0,5 trong 44 giờ ở người khỏe mạnh (2).
Ti thể trong các tế bào tiếp xúc với hyperoxia là một nguồn quan trọng của ROS. Mặc dù mối quan hệ tuyến tính giữa nồng độ oxy và tỷ lệ sản xuất anion superoxide ty thể (O2- -), sự giải phóng hydrogen peroxide (H2O2) từ ti thể phổi xảy ra với tốc độ nhanh hơn khi FiO 2 vượt quá 0,6 (24–26). Các tác giả cho rằng FiO2 lớn hơn 0,6 vượt quá ngưỡng phòng thủ chống oxy hóa ty lạp thể.
Độc lập với FiO2, ROS được tạo ra bởi các quá trình viêm phổi. Cùng với việc giảm sản xuất từ các tế bào phổi bị tổn thương, các nơi dự trữ enzyme chống oxy hóa của phổi có thể bị cạn kiệt trong tình trạng viêm phổi. Do đó, bệnh nhân ARDS có thể dễ bị nhiễm độc oxy hơn so với bệnh nhân bình thường. Turrens và đồng nghiệp đã chứng minh rằng việc phân phối sớm catalaza và lipidome chứa superoxide dismutase kéo dài sự sống sót ở chuột khi tiếp xúc với oxy 100% (27). Xử trí chậm, tức là sau khi bắt đầu viêm phổi và tiếp xúc với nồng độ oxy độc, có thể giải thích kết quả âm tính của các nghiên cứu lâm sàng đã thử nghiệm hiệu quả điều trị của liệu pháp chống oxy hóa trong ARDS (28-30).
Hiện nay có một sự dịch chuyển về phòng ngừa và điều trị sớm ARDS (PETAL; http://grants.nih.gov/grants/guide/rfa-files/RFA-HL-14-014.html). Thay đổi phần nào trên cơ sở dân số bệnh nhân, một tỷ lệ đáng kể (20–80%) bệnh nhân phát triển ARDS hơn 24 giờ sau khi nhập viện (31-35).
Kết quả là, có sự quan tâm ngày càng tăng trong việc nhận biết và giảm bớt những cú đấm “thứ hai”, như thông khí cơ học với thể tích khí lưu thông cao hơn và truyền máu không cần thiết, có thể làm tăng tỷ lệ ARDS tại bệnh viện ở những bệnh nhân có nguy cơ cao. Hyperoxia, thậm chí ở mức FiO2 vừa phải, có thể là một cú đấm thứ hai. Sinclair và các đồng nghiệp đã cho thỏ thở máy trong 4 tiếng, sử dụng thể tích khí lưu thông 25 ml/kg với không khí trong phòng hoặc 50% oxy. Có sự giảm đáng kể trong PaO 2/FiO2 và tăng đáng kể tổn thương phổi mô học, bạch cầu trung tính ở phế nang và tính thấm mao mạch – phế nang ở thỏ nhận được 50% oxy (4).
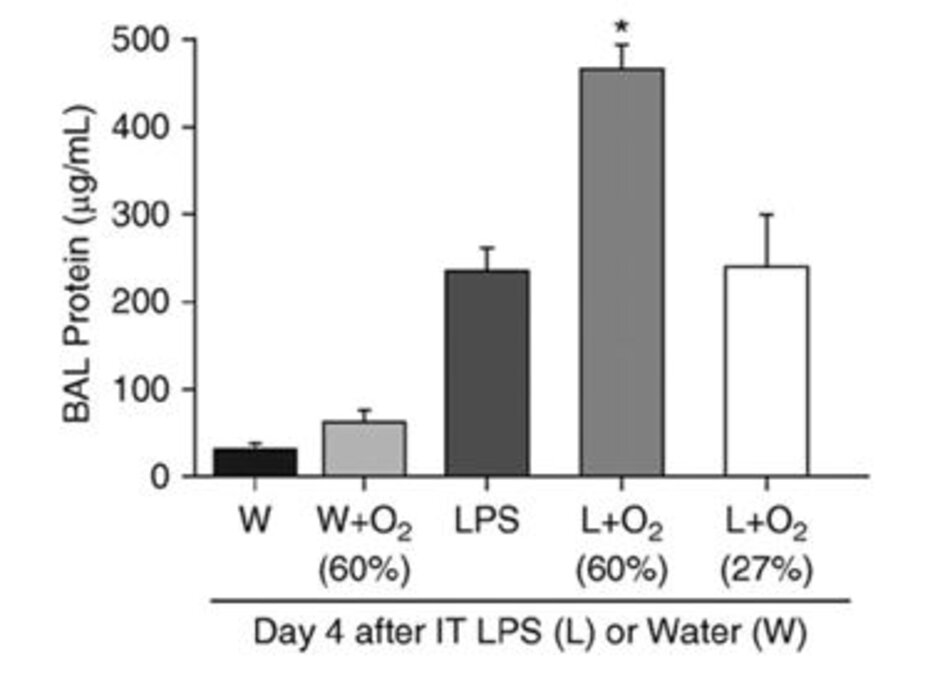
Sử dụng một mô hình thử nghiệm khác trong đó tổn thương phổi cấp tính phát triển chậm hơn, chúng tôi cho chuột tiếp xúc với LPS liều thấp qua nội khí quản, 12 giờ sau đó với cho thở oxy 60% hoặc 27% trong 1 đến 3 ngày. Đã có sự tăng cường hiệp đồng của tổn thương phổi, được chứng minh bằng tăng bạch cầu trung tính và protein phế nang (Hình 1) ở chuột tiếp xúc với LPS qua ống nội khí quản cộng với 60% oxy so với những con chuột tiếp xúc với khí LPS cộng với không khí trong phòng, LPS qua ống nội khí quản cộng với oxy 27% hoặc H2O qua ống nội khí quản cộng với 60% oxy (3).
Các đại thực bào phế nang thu được từ những con chuột tiếp xúc với LPS qua ống nội khí quản cộng với 60% oxy tạo ra các mức cao hơn của ROS và các cytokine tiền viêm so với những con chuột tiếp xúc với LPS qua ống nội khí quản hoặc 60% oxy một mình. Do đó, 60% oxy, nhưng không phải 27% oxy, là đủ để gây ra độc tính oxy và làm tăng tổn thương phổi khi kết hợp với viêm phổi nhẹ.
6. Mục tiêu oxy máu động mạch thấp hơn: Khó đạt được, nhưng nên được đánh giá
Các bác sĩ đào tạo để duy trì normoxemia với chuẩn độ oxy nghiêm ngặt hơn là có thể, nhưng điều này có thể sẽ là một quá trình chậm ngay cả trong giao thức của một thử nghiệm lâm sàng.
Trong một nghiên cứu so sánh liệu pháp oxy chuẩn độ so với liệu pháp oxy thông thường cho bệnh nhân COPD, Austin và các đồng nghiệp đã chứng minh sự tuân thủ giảm của nhân viên y tế trong nhóm oxy được chuẩn độ với mục tiêu bão hòa oxyhemoglobin là 88–92% (6).
Tuy nhiên, trong khoảng thời gian 8 năm, Li và các đồng nghiệp đã thành công trong việc thực hiện các thay đổi trên toàn bệnh viện trong quản lý bác sĩ, và chứng minh giảm đáng kể 50% tỷ lệ ARDS tại bệnh viện bằng cách sử dụng can thiệp dựa vào giao thức, không xâm nhập (36). Những thay đổi trong hành vi của bác sĩ bao gồm thông khí bảo vệ phổi ở những bệnh nhân không có ARDS, liệu pháp dịch truyền hướng mục tiêu (goal-directed fluid therapy) và quản lý kháng sinh sớm.
Thay đổi hành vi của bác sĩ để hạn chế oxy quá mức bằng cách sử dụng các giao thức để đạt được và duy trì một mục tiêu PaO 2 hoặc SpO2 có thể ảnh hưởng tích cực đến kết quả của bệnh nhân, nhưng có thể gặp khó khăn do mức độ nghiêm trọng của bệnh trong ARDS. Tuy nhiên, trong một thử nghiệm tiền cứu, Suzuki và các đồng nghiệp đã chứng minh tính an toàn và tính khả thi trong việc áp dụng mục tiêu bão hòa oxy động mạch thấp hơn ở bệnh nhân ARDS (19).
Chúng tôi đưa ra giả thuyết rằng việc thực hiện một giao thức để theo dõi thường xuyên oxy hóa và nhắm vào tình trạng thiếu oxy máu nhẹ (PaO2 55–80, SpO2 88–92%) có thể dẫn đến kết quả tốt hơn ở bệnh nhân ARDS và những người có nguy cơ ARDS. Chúng tôi đề xuất phạm vi sửa đổi cho SpO2 so với sử dụng bởi ARDSnet một phần vì SpO 2 93-95% có thể không cần thiết để duy trì PaO2 lớn hơn 60 mmHg ở đa số bệnh nhân và bởi vì các bác sĩ thường xuyên cho phép mức độ bão hòa oxy cao hơn hơn phạm vi mục tiêu. Hơn nữa, giảm thiểu oxy quá mức có thể làm giảm sự tiến triển thành ARDS ở những bệnh nhân bị chấn thương phổi cấp tính sớm (EALI) được xác định là có yếu tố nguy cơ ARDS, thâm nhiễm 2 phế trường và nhận oxy ở mức hơn 2 L/phút (37).
7. Oxy quá mức là bất lợi trong các điều kiện cấp tính khác
Oxy quá mức có thể làm tăng tỷ lệ tử vong trong một số tình trạng cấp tính khác. Trong 24 giờ đầu tiên sau khi ngừng tim, mức độ PaO 2 tối đa cao hơn (254 mm Hg, khoảng tứ phân vị 172-363) có liên quan đến tỷ lệ tử vong tại bệnh viện tăng và tình trạng thần kinh tồi tệ hơn so với PaO2 tối đa thấp hơn (198 mm Hg, khoảng cách từ phân vị 152,5–282) (38).
Austin và các đồng nghiệp đã chứng minh rằng ở những bệnh nhân có đợt COPD cấp tính, so sánh bệnh nhân được điều trị theo kinh nghiệm với O 2 8-10 L/phút, so với nhóm bệnh nhân chuẩn độ oxy đến mức bão hòa oxyhemoglobin là 88–92%, cho thấy giảm tỉ lệ tử vong toàn phần là 58%, và giảm 78% trong số những người được xác nhận COPD (6).
Trong một nghiên cứu thuần tập hồi cứu ở những bệnh nhân bị đột quỵ nhận được thông khí cơ học, hyperoxia (PaO2 ≥ 300 mm Hg) có liên quan đến tỷ lệ tử vong cao hơn (39).
Các nghiên cứu quan sát nhỏ hơn ở bệnh nhân nhồi máu cơ tim cho thấy có tác dụng bất lợi của hyperoxia ở kích thước nhồi máu (40) và tình trạng huyết động (41). Một phân tích gộp cho thấy tỷ lệ tử vong gộp tăng lên ở những bệnh nhân được điều trị bằng oxy (4–6 L/phút) trong vòng 24 giờ đầu tiên sau khi được xác định hoặc nghi ngờ nhồi máu cơ tim cấp tính khi so sánh với những người được chỉ được thở không khí trong phòng (42). Do đó, dữ liệu từ các bệnh viêm cấp tính khác tăng cường sự cần thiết phải kiểm tra tác động của việc tiếp xúc với oxy dư thừa ở bệnh nhân EALI hoặc ARDS.
8. Bình thường hóa các thông số sinh lý: Một đề xuất nguy hiểm
Trong việc quản lý bệnh nhân bị bệnh nặng, nhiều nghiên cứu cho rằng việc bình thường hóa các thông số có liên quan đến kết quả tồi tệ hơn. ARDSnet đã chứng minh rằng thông khí thể tích khí lưu thông thấp làm giảm đáng kể tỷ lệ tử vong ở bệnh nhân ARDS mặc dù nó gây ra tăng CO2 máu cao hơn và toan hô hấp (43). Hébert và cộng sự đã chứng minh rằng một chiến lược truyền máu hồng tự do với mục tiêu Hb 10-12 g/dl làm tăng tỷ lệ tử vong của bệnh viện so với chiến lược truyền máu hạn chế với mục tiêu Hb là 7-9 g/dl ở những bệnh nhân có điểm APACHE dưới 20 (44). Các kết quả tương tự về các chiến lược truyền máu tự do đã được chứng minh bởi Lacroix ở trẻ em bị bệnh nặng (45). Phần lớn những gì chúng ta làm trong y học có liên quan đến nguy cơ. Nhiều bác sĩ có một yêu cầu không thể cưỡng lại để bình thường hóa các thông số sinh lý, tin rằng việc điều chỉnh các biến bất thường sẽ cải thiện kết quả. Nhưng đôi khi, chúng ta có thể làm hại nhiều hơn là tốt. Chúng ta không nên giả định rằng bình thường hóa độ bão hòa oxyhemoglobin động mạch sẽ có lợi cho các kết cục lâm sàng.
9. Kết luận
Tỷ lệ tử vong ngắn hạn và rối loạn chức năng thần kinh lâu dài có thể là rủi ro cạnh tranh. Chúng tôi đồng ý với Mikkelsen và các đồng nghiệp về những ưu điểm và nhược điểm tiền cứu của các mục tiêu oxy hóa động mạch thấp hơn và cao hơn (1). Tuy nhiên, trước tiên chúng ta cần xác định xem liệu nhắm mục tiêu normoxemia có dẫn đến oxy dư thừa và tử vong cao hơn trước khi chúng ta đánh giá điều gì là tốt nhất cho chức năng nhận thức thần kinh lâu dài ở những người sống sót hay không. Mức độ an toàn và thời gian phơi nhiễm FiO2 chưa được xác định ở người bình thường, những người bị viêm phổi cấp tính có nguy cơ bị ARDS hoặc những người bị ARDS. Các nghiên cứu về bệnh nhân suy hô hấp cấp tính chứng minh rằng bệnh nhân thường xuyên nhận được nồng độ FiO2 lớn hơn mức cần thiết để đạt được mục tiêu PaO2 hoặc SpO2. Các báo cáo quan sát khác nhau cho đến nay đã không phù hợp liên quan đến tác động của tiếp xúc oxy quá mức ở bệnh nhân suy hô hấp. Chúng tôi cần nghiên cứu nghiêm ngặt hơn, tiền cứu hơn để xác định chiến lược oxy hóa tối ưu. Chúng tôi đồng ý rằng một thử nghiệm lâm sàng là cần thiết để đánh giá liệu nỗ lực phối hợp với giao thức để duy trì bệnh nhân có EALI hoặc ARDS trong phạm vi giảm oxy máu nhẹ hay thậm chí normoxemia có thể giảm thiểu nguy cơ oxy thừa trên độc tính phổi và ảnh hưởng tích cực đến sự sống còn của bệnh nặng.
10. References
1. Mikkelsen ME, Anderson B, Christie JD, Hopkins RO, Lanken PN. Can we optimize long- term outcomes in acute respiratory distress syndrome by targeting normoxemia? Ann Am Thorac Soc 2014;11:613–618.
2. Griffith DE, Garcia JG, James HL, Callahan KS, Iriana S, Holiday D. Hyperoxic exposure in humans: effects of 50 percent oxygen on alveolar macrophage leukotriene B4 synthesis. Chest 1992;101:392–397.
3. Aggarwal NR, D’Alessio FR, Tsushima K, Files DC, Damarla M, Sidhaye VK, Fraig MM, Polotsky VY, King LS. Moderate oxygen augments lipopolysaccharide-induced lung injury in mice. Am J Physiol Lung Cell Mol Physiol 2010;298:L371–L381.
4. Sinclair SE, Altemeier WA, Matute-Bello G, Chi EY. Augmented lung injury due to interaction between hyperoxia and mechanical ventilation. Crit Care Med 2004;32:2496– 2501.
5. Kilgannon JH, Jones AE, Shapiro NI, Angelos MG, Milcarek B, Hunter K, Parrillo JE, Trzeciak S; Emergency Medicine Shock Research Network (EMShockNet) Investigators. Association between arterial hyperoxia following resuscitation from cardiac arrest and in- hospital mortality. JAMA 2010;303:2165–2171.
6. Austin MA, Wills KE, Blizzard L, Walters EH, Wood-Baker R. Effect of high flow oxygen on mortality in chronic obstructive pulmonary disease patients in prehospital setting: randomised controlled trial. BMJ 2010;341:c5462.
7. Frank L, Bucher JR, Roberts RJ. Oxygen toxicity in neonatal and adult animals of various species. J Appl Physiol 1978;45:699–704.
8. Friedrich M, Grayzel DM. High resistance of rhesus monkeys to 90 plus per cent oxygen. Proc Soc Exp Biol Med 1944;56:204–205.
9. Robinson FR, Sopher RL, Witchett CE, Carter VL Jr. Pathology of normobaric oxygen toxicity in primates. Aerosp Med 1969;40:879–884.
10. Comroe JH, Dripps RD, Dumke PR, Deming M. Oxygen toxicity—the effect of inhalation of high concentrations of oxygen for 24 hours on normal men at sea level and at a simulated altitude of 18,000 feet. JAMA 1945;128:710–717.
11. Sevitt S. Diffuse and focal oxygen pneumonitis: a preliminary report on the threshold of pulmonary oxygen toxicity in man. J Clin Pathol 1974;27:21–30.
12. Nash G, Blennerhassett JB, Pontoppidan H. Pulmonary lesions associated with oxygen therapy and artificial ventilation. N Engl J Med 1967;276:368–374.
13. Brower R. Assessment of protocol conduct in a trial of ventilator management of acute lung injury (ALI) and ARDS [abstract]. Am J Respir Crit Care 1999;159:A716.
14. Eastwood GM, Reade MC, Peck L, Jones D, Bellomo R. Intensivists’ opinion and self- reported practice of oxygen therapy. Anaesth Intensive Care 2011;39:122–126.
15. Mao C, Wong DT, Slutsky AS, Kavanagh BP. A quantitative assessment of how Canadian intensivists believe they utilize oxygen in the intensive care unit. Crit Care Med 1999;27:2806–2811.
16. Martin DS, Grocott MP. Oxygen therapy in critical illness: precise control of arterial oxygenation and permissive hypoxemia. Crit Care Med 2013;41:423–432.
17. de Graaff AE, Dongelmans DA, Binnekade JM, de Jonge E. Clinicians’ response to hyperoxia in ventilated patients in a Dutch ICU depends on the level of FiO2. Intensive Care Med 2011;37:46–51.
18. Suzuki S, Eastwood GM, Peck L, Glassford NJ, Bellomo R. Current oxygen management in mechanically ventilated patients: a prospective observational cohort study. J Crit Care 2013;28:647–654.
19. Suzuki S, Eastwood GM, Glassford NJ, Peck L, Young H, Garcia-Alvarez M, Schneider AG, Bellomo R. Conservative oxygen therapy in mechanically ventilated patients: a pilot before- and-after trial. Crit Care Med 2014;42:1414–1422.
20. Rice TW, Wheeler AP, Bernard GR, Hayden DL, Schoenfeld DA, Ware LB; National Institutes of Health, National Heart, Lung, and Blood Institute ARDS Network. Comparison of the SpO2/FiO2 ratio and the PaO2/FiO2 ratio in patients with acute lung injury or ARDS. Chest 2007;132:410–417.
21. Rachmale S, Li G, Wilson G, Malinchoc M, Gajic O. Practice of excessive FiO2 and effect on pulmonary outcomes in mechanically ventilated patients with acute lung injury. Respir Care 2012;57:1887–1893.
22. de Jonge E, Peelen L, Keijzers PJ, Joore H, de Lange D, van der Voort PH, Bosman RJ, de Waal RA, Wesselink R, de Keizer NF. Association between administered oxygen, arterial partial oxygen pressure and mortality in mechanically ventilated intensive care unit patients. Crit Care 2008;12:R156.
23. Eastwood G, Bellomo R, Bailey M, Taori G, Pilcher D, Young P, Beasley R. Arterial oxygen tension and mortality in mechanically ventilated patients. Intensive Care Med 2012;38:91– 98.
24. Turrens JF. Mitochondrial formation of reactive oxygen species. J Physiol 2003;552:335– 344.
25. Turrens JF, Freeman BA, Crapo JD. Hyperoxia increases H2O2 release by lung mitochondria and microsomes. Arch Biochem Biophys 1982;217:411–421.
26. Turrens JF, Freeman BA, Levitt JG, Crapo JD. The effect of hyperoxia on superoxide production by lung submitochondrial particles. Arch Biochem Biophys 1982;217:401–410.
27. Turrens JF, Crapo JD, Freeman BA. Protection against oxygen toxicity by intravenous injection of liposome-entrapped catalase and superoxide dismutase. J Clin Invest 1984;73:87–95.
28. Rice TW, Wheeler AP, Thompson BT, deBoisblanc BP, Steingrub J, Rock P; NIH NHLBI Acute Respiratory Distress Syndrome Network of Investigators. Enteral omega-3 fatty acid, γ-linolenic acid, and antioxidant supplementation in acute lung injury. JAMA 2011;306:1574–1581.
29. Bernard GR, Wheeler AP, Arons MM, Morris PE, Paz HL, Russell JA, Wright PE; Antioxidant in ARDS Study Group. A trial of antioxidants N-acetylcysteine and procysteine in ARDS. Chest 1997;112:164–172.
30. Jepsen S, Herlevsen P, Knudsen P, Bud MI, Klausen NO. Antioxidant treatment with N- acetylcysteine during adult respiratory distress syndrome: a prospective, randomized, placebo-controlled study. Crit Care Med 1992;20:918–923.
31. Craig T, McAuley DF. What is the score with mortality predictions in acute lung injury? Crit Care Med 2008;36:1644–1646.
32. Levitt JE, Bedi H, Calfee CS, Gould MK, Matthay MA. Identification of early acute lung injury at initial evaluation in an acute care setting prior to the onset of respiratory failure. Chest 2009;135:936–943.
33. Pepe PE, Potkin RT, Reus DH, Hudson LD, Carrico CJ. Clinical predictors of the adult respiratory distress syndrome. Am J Surg 1982;144:124–130.
34. Shari G, Kojicic M, Li G, Cartin-Ceba R, Alvarez CT, Kashyap R, Dong Y, Poulose JT, Herasevich V, Garza JA, et al. Timing of the onset of acute respiratory distress syndrome: a population-based study. Respir Care 2011;56:576–582.
35. Agrawal A, Matthay MA, Kangelaris KN, Stein J, Chu JC, Imp BM, Cortez A, Abbott J, Liu KD, Calfee CS. Plasma angiopoietin-2 predicts the onset of acute lung injury in critically ill patients. Am J Respir Crit Care Med 2013;187:736–742.
36. Li G, Malinchoc M, Cartin-Ceba R, Venkata CV, Kor DJ, Peters SG, Hubmayr RD, Gajic O. Eight-year trend of acute respiratory distress syndrome: a population-based study in Olmsted County, Minnesota. Am J Respir Crit Care Med 2011;183:59–66.
37. Levitt JE, Matthay MA. Clinical review: Early treatment of acute lung injury—paradigm shift toward prevention and treatment prior to respiratory failure. Crit Care 2012;16:223.
38. Janz DR, Hollenbeck RD, Pollock JS, McPherson JA, Rice TW. Hyperoxia is associated with increased mortality in patients treated with mild therapeutic hypothermia after sudden cardiac arrest. Crit Care Med 2012;40:3135–3139.
39. Rincon F, Kang J, Maltenfort M, Vibbert M, Urtecho J, Athar MK, Jallo J, Pineda CC, Tzeng D, McBride W, et al. Association between hyperoxia and mortality after stroke: a multicenter cohort study. Crit Care Med 2014;42:387–396.
40. Madias JE, Madias NE, Hood WB Jr. Precordial ST-segment mapping. 2. Effects of oxygen inhalation on ischemic injury in patients with acute myocardial infarction. Circulation 1976;53:411–417.
41. Kenmure AC, Murdoch WR, Beattie AD, Marshall JC, Cameron AJ. Circulatory and metabolic effects of oxygen in myocardial infarction. BMJ 1968;4:360–364.
42. Cabello JB, Burls A, Emparanza JI, Bayliss S, Quinn T. Oxygen therapy for acute myocardial infarction. Cochrane Database Syst Rev [serial on the Internet]. 2010 [accessed 2014 Oct];6:CD007160. Available from: http://summaries.cochrane.org/
43. Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000;342:1301–1308.
44. Hébert PC, Wells G, Blajchman MA, Marshall J, Martin C, Pagliarello G, Tweeddale M, Schweitzer I, Yetisir E; Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. N Engl J Med 1999;340:409–417.
45. Lacroix J, Hébert PC, Hutchison JS, Hume HA, Tucci M, Ducruet T, Gauvin F, Collet JP, Toledano BJ, Robillard P, et al.; TRIPICU Investigators; Canadian Critical Care Trials Group; Pediatric Acute Lung Injury and Sepsis Investigators Network. Transfusion strategies for patients in pediatric intensive care units. N Engl J Med 2007;356:1609–1619.