Bài viết Sử dụng lâm sàng các xét nghiệm đông máu (Uptodate) của tác giả James L Zehnder, MD; được biên dịch bởi Bác sĩ Nguyễn Duyên, Bác sĩ tại Bệnh Viện Nhi Trung Ương Việt Nam.
1. Giới thiệu
Chủ đề này xem xét các nguyên tắc và cách giải thích kết quả của các xét nghiệm
đông máu thường được sử dụng trong lâm sàng.
2. Đảm bảo kết quả xét nghiệm chính xác
2.1 Thu thập và xử lý mẫu
Các xét nghiệm đông máu phải được thực hiện trên huyết tương chứ không phải huyết thanh, vì các yếu tố đông máu bị loại bỏ trong quá trình ly tâm lấy huyết thanh cùng với các thành phần đông máu tế bào.
Xét nghiệm đông máu chính xác đòi hỏi mẫu máu phải được thu thập và xử lý thích hợp. Các thông số sau rất quan trọng để đảm bảo độ chính xác:
Ống thu thập – Mẫu xét nghiệm đông máu phải được lấy vào một ống có chứa chất chống đông mà chất đó có thể dễ dàng được loại bỏ khi tiến hành xét nghiệm. Dung dịch natri citrat (3,2% natri citrat) trong ống có nắp màu xanh lam nhạt được sử dụng phổ biến nhất. Lượng dung dịch citrat trong ống cố định để có tỷ lệ thích hợp giữa một phần dung dịch citrat với chín phần máu toàn phần khi ống được lấy đúng thể tích mục tiêu. Bệnh nhân bị đa hồng cầu cần bỏ bớt lượng citrat do thể tích huyết tương giảm.
Thể tích máu – Ống phải chứa đủ máu để cho tỷ lệ citrate thích hợp với máu toàn phần. Các ống lấy không đủ thể tích có thể kéo dài thời gian đông máu giả tạo. Thể tích máu không được ít hơn 90% thể tích mục tiêu [2].
Trộn mẫu – Vì các ống chứa dung dịch natri citrat lỏng, cần đảo nhẹ chúng vài lần càng sớm càng tốt sau khi máu ra khỏi tĩnh mạch để trộn dung dịch citrat với máu. Không nên lắc ống mạnh vì điều này có thể gây tán huyết và dẫn đến kết quả không chính xác.
Bảo quản mẫu – Mẫu phải được xét nghiệm kịp thời để tránh làm giảm chất lượng của các yếu tố đông máu không bền (đặc biệt là yếu tố V, VIII và protein S); Sự suy giảm đáng kể của các yếu tố đông máu có thể dẫn đến việc kéo dài thời gian đông máu một cách giả tạo [3]. Tổng thời gian từ khi lấy mẫu và xét nghiệm không được quá 24 giờ. Các ống máu toàn phần không được làm đông lạnh trước khi tách huyết tương khỏi tế bào.
2.2 Nguồn gây nhiễu
Kết quả không chính xác có thể xảy ra nếu có những điều sau:
Lấy mẫu từ đường tiêm/truyền tĩnh mạch – Tốt nhất, nên lấy bệnh phẩm đông máu bằng phương pháp trích máu tĩnh mạch. Không cần thiết phải loại bỏ ống máu ban đầu khi trích máu tĩnh mạch [4,5]. Tuy nhiên, trong các cơ sở chăm sóc đặc biệt, xét nghiệm đông máu thường được lấy từ các đường truyền tĩnh mạch có sẵn. Mẫu phải không bị lẫn dung dịch đang được truyền, vì có thể làm loãng mẫu và / hoặc đưa heparin vào. Điều này đặc biệt quan trọngđối với máu lấy từ các đường truyền trung tâm, thường được tráng bằng heparin hoặc citrat, có thể dẫn đến kéo dài thời gian đông máu một cách giả tạo [6-9]. Khi lấy mẫu từ các đường truyền này, một vài ml máu đầu tiên được rút ra sẽ phải loại bỏ, và mẫu cần thiết được lấy từ bơm tiêm thứ hai hoặc ống thứ hai để tránh bị nhiễm dung dịch trong đường truyền.
Thuốc chốngđông máu -Thực hành y tế tốt yêu cầu phòng xét nghiệmđược biết về liệu pháp chống đông máu bệnh nhân đang sử dụng vì điều này có thể ảnh hưởng lớn đến việc giải thích kết quả xét nghiệm. Có thểlà bác sĩ lâm sàng cần ghi rõ liệu pháp chống đông đang sử dụng trong chỉ định xét nghiệm hoặc nhân viên phòng xét nghiệm kiểm tra thuốc bệnh nhân đang sử dụng trong bệnh án điện tử hoặc bằng cách liên hệ trực tiếp với bác sĩ chỉ định.
Các chất và điều kiện ảnh hưởng khác – Các chất khác có trong mẫu như lipid hoặc bilirubin do tăng lipid máu, tăng bilirubin máu và tán huyết có thể cản trở việc xác định thời gian đông máu. Nếu không thể tránh được các yếu tố gây nhiễunhư vậy, thì việc pha loãng mẫu có thể cho phép ước tính thời gian đông máu. Phòng xét nghiệm có thể đánh giá yêu cầu pha loãng mẫu tại thời điểm thử nghiệm. Đa hồng cầu (ví dụ: hematocrit > 55%) gây ra giảm thể tích huyết tương trong ống lấy máu. Do đó, những bệnh nhân bị đa hồng cầu cần phải loại bỏ một lượng dung dịch citrat trong ống xét nghiệm để duy trì tỷ lệ chính xác của citrat trong máu toàn phần và để ngăn chặn việc kéo dài thời gian đông máu một cách giả tạo [10]. Không có khuyến cáo tương ứng cho bệnh thiếu máu nặng. Cách tiếp cận tốt nhất đối với những tình huống như vậy là nhận thức được khả năng gây nhiễu và liên hệ với phòng xét nghiệm đông máu để được hướng dẫn thu thập mẫu thích hợp nếu cần thời gian đông máu chính xác để chăm sóc bệnh nhân.
3. Các loại xét nghiệm
3.1 Thời gian đông máu
Thời gian đông máu đo thời gian hình thành cục đông khi thêm các chất khác nhau vào. Citrat trong ống thu thập nắp màu xanh lam lấy mất canxi trong mẫu máu để quá trình hình thành cục đông không thể diễn ra, vì canxi cần thiết cho các phức hợp yếu tố đông máu trên bề mặt tế bào hoạt hóa hoặc phospholipid.
Khi xét nghiệm, canxi được thêm trở lại mẫu tại thời điểm bắt đầu thử nghiệm, cùng với nguồn phospholipid và chất khởi động (yếu tố mô đối với thời gian prothrombin [PT]; silica hoặc các chất khác cho thời gian thromboplastin hoạt hóa [aPTT ]).
Thành phần chính xác của thuốc thửPT và aPTT làđộc quyền và thường không được tiết lộ. Các thuốc thử PT được tiêu chuẩn hóa bằng cách sử dụng tỷ lệ chuẩn hóa quốc tế (INR).
Trong khi PT và aPTT cung cấp một đánh giá tổng thể về sự hình thành cục máu đông, chúng không cung cấp thông tin về sự liên kết chéo của fibrin hoặc sự hòa tan cục máu đông và do đó sẽ không nhạy cảm với những bất thường của chức năng yếu tố XIII hoặc sự tiêu sợi huyết bất thường.
3.2 Thời gian prothrombin (PT) và INR
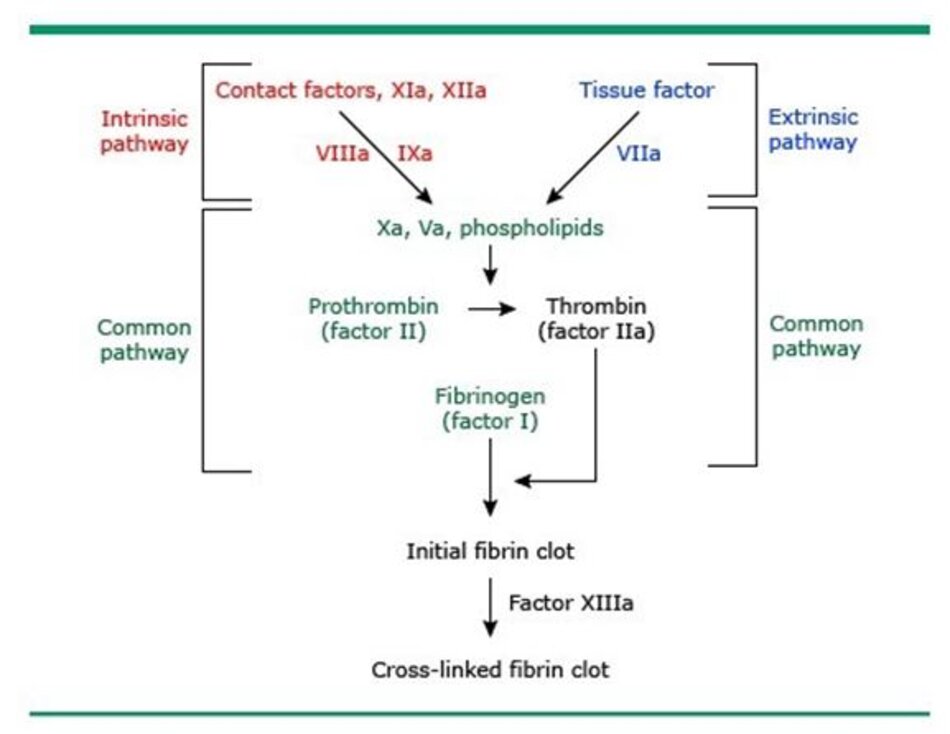
Thời gian prothrombin (PT) đo thời gian huyết tương đông lại khi tiếp xúc với yếu tố mô, đánh giá các con đường đông máu ngoại sinh và con đường chung (hình 1).
Xét nghiệm PT được thực hiện bằng cách phục hồi lại calci huyết tương bệnh nhân đã được citrate hóa với sự hiện diện của yếu tố mô và phospholipid và xác định thời gian cần thiết để hình thành cục máu đông fibrin. Sự hình thành cục máu đông được phát hiện bằng các phương pháp trực quan, quang học hoặc nguyên lý cơ. Kết quả được đo bằng giây và được báo cáo cùng với giá trị chứng và / hoặc INR. Phạm vi bình thường cho PT thay đổi tùy theo phòng xét nghiệm và sự kết hợp thuốc thử / dụng cụ, và nên sử dụng khoảng tham chiếu tại địa phương. Trong hầu hết các phòng xét nghiệm, phạm vi bình thường là khoảng 11 đến 13 giây.
INR được tính bằng tỷ lệ giữa PT của bệnh nhân với PT chứng và chỉ số nhạy cảm quốc tế thu được bằng cách sử dụng thromboplastin tham chiếu quốc tế do Tổ chức Y tế Thế giới (WHO) phát triển, theo công thức sau [11]:
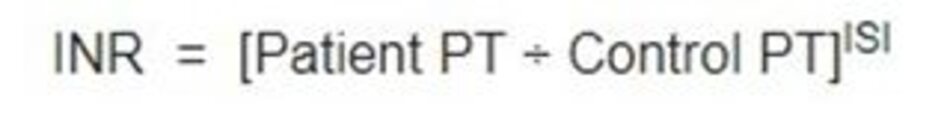
Control PT là PT bình thường trung bình do phòng xét nghiệm xác định từ ≥30 mẫu plasma tươi, bình thường được xử lý giống hệt như mẫu bệnh nhân. ISI (chỉ số nhạy cảm quốc tế) dựa trên thuốc thử thromboplastin tham chiếu quốc tế; tuy nhiên, sẽ rất hữu ích nếu giá trị ISI được xác nhận trong mỗi phòng xét nghiệm đối với từng thuốc thử và thiết bị sử dụng [12,13].
Không giống như PT, kết quả của INR sẽ tương tự dù mẫu máu được thực hiện trong bất kỳ phòng xét nghiệm nào, sử dụng bất kỳ hệ thống thiết bị / thuốc thử thromboplastin nào miễn là được hiệu chuẩn chính xác. Điều này cho phép so sánh kết quả của bệnh nhân được thực hiện tại các thời điểm và / hoặc địa điểm khác nhau, điều này rất có lợi cho việc theo dõi warfarin. Việc sử dụng INR cũng rất có giá trị đối với các nghiên cứu vì nó cho phép các nhà khoa học so sánh liều chống đông của bệnh nhân từ các cơ sở khác nhau.
3.3 Giá trị của PT / INR
Việc sử dụng PT / INR trên lâm sàng bao gồm:
- Đánh giá chảy máu không rõ nguyên nhân
- Chẩn đoán đông máu nội mạch lan tỏa
- Xác định giá trị nền trước khi bắt đầu liệu pháp chống đông
- Theo dõi liệu pháp warfarin
- Đánh giá chức năng tổng hợp của gan.
Như đã nói ở trên, INR được phát triểnđể cho phép bệnh nhân dùng warfarin có thể dễ dàng so sánh các kết quả xét nghiệm tại các thời điểm khác nhau và từ các phòng thí nghiệm khác nhau. INR cũng thường được sử dụng như một đại diện cho PT trong việc đánh giá tính toàn vẹn của các con đường đông máu ngoại sinh và con đường chung ở bệnh nhân chảy máu (hình 1) và để đánh giá bệnh gan giai đoạn cuối.
3.4 Nguyên nhân của PT kéo dài
Nguyên nhân của PT kéo dài bao gồm (bảng 1):
Thuốc đối kháng vitamin K – Thuốc đối kháng vitamin K như warfarin can thiệp vào giai đoạn sau chuyển đổi của các yếu tố đông máu II, VII, IX và X, dẫn đến PT kéo dài.
Các thuốc chống đông máu khác – Heparin (không phân đoạn hoặc trọng lượng phân tử thấp) và fondaparinux về lý thuyết sẽ kéo dài thời gian PT vì chúng ức chế thrombin và / hoặc yếu tố Xa. Tuy nhiên, hầu hết các thuốc thử PT chứa các hóa chất trung hòa heparin (ví dụ, heparinase, polybrene) ngăn chặn tác dụng này [14]. Tuy nhiên, PT có thể kéo dài ở nồng độ heparin trên 1 unit / mL, chẳng hạn như sau khi bolus một liều heparin, do sự bão hòa của chất trung hòa heparin. Sự kéo dài PT trong trường hợp này không nên được sử dụng để hướng dẫn điều trị; việc theo dõi heparin được thảo luận riêng.
Tất cả các thuốc chống đông máu tác dụng trực tiếp hiện có đều kéo dài thời gian PT, bao gồm thuốc ức chế thrombin trực tiếp qua đường tiêm và thuốc chống đông máu trực tiếp đường uống (DOAC) dabigatran, rivaroxaban, apixaban và edoxaban. Tuy nhiên, mức độ kéo dài khác nhau tùy theo loại thuốc cụ thể và thuốc thử PT được sử dụng, và do đó PT không đáng tin cậy để theo dõi tác dụng của thuốc. Tất cả các DOAC đều được chấp thuận sử dụng mà không cần giám sát. Chúng tôi không kiểm tra PTởbệnh nhân dùng DOAC và chúng tôi không thực hiện thay đổi về liều lượng hoặc theo dõi dựa trên kết quả của PT, ngoại trừ một số bệnh nhân bị chảy máu nghiêm trọng mà thời gian kéo dài PT có thể được coi là bằng chứng về tác dụng dai dẳng của thuốc.
Thiếu vitamin K – Các nguyên nhân tiềm ẩn bao gồm suy dinh dưỡng, sử dụng thuốc kháng sinh phổ rộng kéo dài hoặc hội chứng kém hấp thu chất béo. Khi thiếu vitamin K nhẹ, chỉ có thể kéo dài PT do ảnh hưởng chủ yếu đến yếu tố VII. Tuy nhiên, trong trường hợp thiếu vitamin K nghiêm trọng, cả PT và aPTT đều có thể kéo dài.
Bệnh gan – Bệnh gan có thể liên quan đến việc giảm sản xuất cả các yếu tố đông máu phụ thuộc vitamin K và không phụ thuộc vào vitamin K. Khi bệnh gan nhẹ chỉ PT có thể kéo dài do ảnh hưởng chủ yếu đến yếu tố VII. Tuy nhiên, trong bệnh gan nặng và / hoặc mãn tính, cả PT và aPTT đều có thể kéo dài. Điều quan trọng, bệnh gan cũng liên quan đến việc giảm sản xuất các yếu tố chống đông máu. Do đó, một PT kéo dài không phản ánh bức tranh cầm máu tổng thể.
DIC – Trong đông máu nội mạch lan tỏa (DIC), các yếu tố đông máu bị tiêu hao và cạn kiệt. Điều này có thể dẫnđến PT và aPTT kéo dài. Điều quan trọng là, các yếu tố chống đông máu cũng có thể bị cạn kiệt và PT không phản ánh bức tranh cầm máu tổng thể.
Thiếu hụt yếu tố – Thiếu hoạt động của các yếu tố đông máu trong con đường ngoại sinh có thể do rối loạn di truyền hoặc do chất ức chế mắc phải (ví dụ, tự kháng thể). Điều này bao gồm sự thiếu hụt fibrinogen và các yếu tố II, V, VII, hoặc X, hoặc sự thiếu hụt kết hợp liên quan đến một trong những yếu tố này.
Kháng thể kháng phospholipid – Kháng đông lupus hoặc kháng thể kháng phospholipid đặc hiệu cho prothrombin (yếu tố II) có thể gây giảm prothrombin máu và kéo dài thời gian PT; đôi khi những bệnh nhân có kháng thể như vậy và hiệu giá kháng thể cao có biểu hiện giảm prothrombin máu và chảy máu. Sự kết hợp giữa hiệu giá kháng thểkháng prothrombin cao và nồngđộprothrombin thấp có thể dẫn đến kết quả xét nghiệm kháng đông lupus âm tính giả vì hiệu ứng prozone [15]. Tuy nhiên, sự kéo dài riêng lẻ của aPTT là phổ biến hơn.
Như đã lưu ý ở trên, bệnh đa hồng cầu (hematocrit> 55%) có thể kéo dài PT giả tạo nếu lượng dung dịch chống đông citrate trong ống thu thập không được giảm một cách thích hợp.
3.5 Thời gian thromboplastin từng phần hoạt hóa (aPTT)
Thời gian thromboplastin từng phần hoạt hóa (aPTT, PTT) đo thời gian huyết tương đông lại khi tiếp xúc với các chất hoạt hóa yếu tố tiếp xúc, đánh giá các con đường đông máu nội sinh và con đường chung (hình 1).
Thử nghiệm aPTT được thực hiện bằng cách phục hồi lại calci huyết tương đã được citrate hóa khi có mặt vật liệu thromboplastic không có hoạt tính của yếu tố mô (do đó có thuật ngữ thromboplastin một phần) và một chất tích điện âm (ví dụ: celite, cao lanh [aluminum silicate], silica), dẫn đến hoạt hóa yếu tố tiếp xúc, do đó bắt đầu đông máu thông qua con đường đông máu nội sinh [16]. Vật liệu thromboplastic cung cấp nguồn phospholipid.
Giới hạn bình thường của aPTT thay đổi tùy theo phòng xét nghiệm và sự kết hợp thuốc thử / thiết bị, và nên sử tham chiếu tại địa phương. Trong hầu hết các phòng xét nghiệm, phạm vi bình thường là khoảng 25 đến 35 giây.
Không có tiêu chuẩn hóa xét nghiệm aPTT trên các hệ thống thuốc thử / thiết bị khác nhau tương tự như INR cho PT. Do đó, các giá trị aPTT từ các phòng thí nghiệm khác nhau không thể được so sánh trực tiếp. Để theo dõi heparin, mỗi phòng xét nghiệm nên thiết lập khoảng điều trị bằng cách xác định khoảng aPTT tương ứng với chuẩn độ protamine 0,2 đến 0,4 units /mL hoặc 0,3 đến 0,7 units/mL kháng yếu tố xa.
3.6 Giá trị lâm sàng của aPTT:
- Đánh giá chảy máu không rõ nguyên nhân
- Chẩn đoán đông máu nội mạch lan tỏa (DIC).
- Xác định giá trị nền trước khi bắt đầu liệu pháp chống đông.
- Theo dõi điều trị heparin không phân đoạn (đối với những người có aPTT ban
đầu bình thường). - Theo dõi liệu pháp điều trị bằng thuốc ức chế thrombin trực tiếp qua đường tiêm (ví dụ, argatroban, hirudin).
Lưu ý, các heparin trọng lượng phân tử thấp (LMW) thường không kéo dài aPTT. Nếu cần, có thể thực hiện theo dõi bằng xét nghiệm hoạt tính kháng yếu tố Xa. Tuy nhiên, việc theo dõi trong phòng xét nghiệm nói chung là không cần thiết ở những bệnh nhân không mang thai, vì đápứng chống đông máu với một liều cố định của LMW heparin tương quan nhiều với trọng lượng cơ thể của bệnh nhân.
3.7 Nguyên nhân của aPTT kéo dài (bảng 1):
Heparin – Heparin là một chất ức chế thrombin gián tiếp tạo phức với antithrombin (AT), chuyển đổi AT từ chậm thành chất bất hoạt thrombin nhanh chóng (yếu tố IIa), yếu tố Xa, và ở mức độ thấp hơn là các yếu tố IXa, XIa và XIIa. Heparin trong mẫu máu (ví dụ, do lấy từ đường truyền tĩnh mạch trung tâm) có thể làm tăng aPTT giả. Xét nghiệm lặp lại được chỉ định nếu đây được cho là lý do kéo dài aPTT. Trong những trường hợp phức tạp hơn (ví dụ, không thể lấy mẫu ngoại vi, nghi ngờ sử dụng lén lút heparin), thời gian reptilase có thể được sử dụng để xác định xem heparin có phải là nguyên nhân kéo dài aPTT hay không.
Thuốc ức chế thrombin trực tiếp và chất ức chế yếu tố Xa trực tiếp – Thuốc ức chế thrombin trực tiếp và chất ức chế yếu tố Xa trực tiếp đều có thể gây kéo dài aPTT, mặc dù không có mối tương quan rõ ràng giữa mức độ kéo dài và liều thuốc.
Các thuốc chống đông máu khác – Fondaparinux có thể gây kéo dài aPTT nhẹ. Warfarin có tác dụng yếuđối với hầu hết các thuốc thửaPTT, nhưng liều warfarin cao có thể làm tăng aPTT, và warfarin sẽ làm tăng độ nhạy của aPTT đối với tác dụng của heparin [17].
Bệnh gan – Khi bệnh gan nhẹ, chỉ PT có thể kéo dài do ảnh hưởng chủ yếu đến yếu tố VII. Tuy nhiên, trong bệnh gan nặng và / hoặc mãn tính, cả PT và aPTT đều có thể kéo dài. Điều quan trọng, bệnh gan cũng liên quan đến việc giảm sản xuất các yếu tố chống đông máu. Do đó, aPTT kéo dài không phản ánh bức tranh cầm máu tổng thể.
DIC – Như đã nói ở trên, các yếu tố đông máu bị tiêu hao và cạn kiệt ở bệnh nhân đông máu nội mạch lan tỏa (DIC). Điều này có thể dẫn đến PT và aPTT kéo dài. Điều quan trọng là, các yếu tố chống đông máu cũng có thể bị cạn kiệt và aPTT không phản ánh bức tranh cầm máu tổng thể.
Bệnh von Willebrand – bệnh von Willebrand (VWD) có thể gây kéo dài aPTT vì yếu tố von Willebrand là chất mang (và chất ổn định) của yếu tố VIII. Nếu nồng độ yếu tố VIII đủ thấp, aPTT có thể trở nên kéo dài. Những bệnh nhân khác bị VWD có thểcó aPTT bình thường.
Bệnh Hemophilia A hoặc B – Bệnh máu khó đông A (thiếu yếu tố VIII di truyền) và bệnh ưa chảy máu B (thiếu yếu tố IX di truyền) gây kéo dài aPTT ở những người bị thiếu hụt yếu tố nặng hoặc trung bình (ví dụ: hoạt động yếu tố ≤15%). Một số cá nhân mắc bệnh nhẹ có thể có aPTT bình thường.
DIC – Như đã nói ở trên, các yếu tố đông máu bị tiêu hao và cạn kiệt ở bệnh nhân đông máu nội mạch lan tỏa (DIC). Điều này có thể dẫn đến PT và aPTT kéo dài. Điều quan trọng là, các yếu tố chống đông máu cũng có thể bị cạn kiệt và aPTT không phản ánh bức tranh cầm máu tổng thể.
Bệnh von Willebrand – bệnh von Willebrand (VWD) có thể gây kéo dài aPTT vì yếu tố von Willebrand là chất mang (và chất ổn định) của yếu tố VIII. Nếu nồng độ yếu tố VIII đủ thấp, aPTT có thể trở nên kéo dài. Những bệnh nhân khác bị VWD có thểcó aPTT bình thường.
Bệnh Hemophilia A hoặc B – Bệnh máu khó đông A (thiếu yếu tố VIII di truyền) và bệnh ưa chảy máu B (thiếu yếu tố IX di truyền) gây kéo dài aPTT ở những người bị thiếu hụt yếu tố nặng hoặc trung bình (ví dụ: hoạt động yếu tố ≤15%). Một số cá nhân mắc bệnh nhẹ có thể có aPTT bình thường.
Thiếu hụt yếu tố đông máu di truyền khác:
- Thiếu yếu tố XI di truyền (đôi khi được gọi là bệnh ưa chảy máu C), thường gặp
ở người Do Thái Ashkenazi. - Thiếu yếu tố XII di truyền, không liên quan đến chảy máu lâm sàng.
- Thiếu di truyền các yếu tố X, V, prothrombin (yếu tố II), fibrinogen, hoặc thiếu hụt yếu tố phụ thuộc vitamin K kết hợp.
Có chất ức chếyếu tố đông máu –Chấtức chếyếu tố phổ biến nhất là yếu tố VIII. Đây có thể là các kháng thể (ví dụ, ở những bệnh nhân mắc bệnh ưa chảy máu A nặng phát triển đáp ứng miễn dịch với yếu tố VIII của người được truyền) hoặc các tự kháng thể. Các tự kháng thể đối với yếu tố VIII có thể liên quan đến bệnh tự miễn dịch, các bệnh hệ thống khác, hoặc biểu hiện xuất huyết mà không có nguyên nhân rõ ràng. Điều quan trọng là phải phân biệt giữa chất ức chế yếu tố VIII và các chất ức chế khác trong xét nghiệm aPTT như kháng đông lupus vì chất ức chế yếu tố VIII có thể liên quan đến chảy máu đe dọa tính mạng trong khi kháng đông lupus có thể liên quan đến huyết khối. Đặc điểm phân biệt của các chất ức chế yếu tố VIII là tăng thời gian kéo dài của aPTT sau một đến hai giờ ủ ở 37C so với mức độ kéo dài sau năm phút ủ.
Kháng đông Lupus: Một số kháng thể kháng phospholipid (aPL) có thể gây kéo dài Hậu quả là do sự can thiệp vào quá trình tạo thành phức hợp prothrombinase với phospholipid trong xét nghiệm in vitro. Kháng đông lupus được xác định bằng cách chứng minh sự kéo dài của xét nghiệm phụ thuộc phospholipid không trở lại bình thường khi bổ sung huyết tương bình thường nhưng lại trở lại bình thường khi bổ sung phospholipid dư thừa.
Trong một nghiên cứu 55 trẻ em có aPTT kéo dài khi xét nghiệm trước phẫu thuật, 39 (71%) có kháng đông lupus [18]. Nguyên nhân bao gồm nhiều chẩn đoán (hầu hết là lành tính nhưng một số có khả năng cần điều trị). Mặc dù kháng đông lupus gây kéo dài aPTT, nhưng kiểu hình phổ biến nhất là tăng nguy cơ hình thành huyết khối hơn là chảy máu. Kháng đông lupus đôi khi ảnh hưởng đến prothrombin và kéo dài thời gian PT.
Thuốc – Một số loại thuốc (ví dụ: oritavancin) có thể liên kết với phospholipid và gây kéo dài thời gian xét nghiệm đông máu trong ống nghiệm, đặc biệt là aPTT. Nếu bệnh nhân dùng thuốc kéo dài aPTT cần điều trị bằng heparin, việc theo dõi và dùng thuốc phải dựa trên một xét nghiệm không nhạy cảm với tác dụng này, chẳng hạn như xét nghiệm kháng yếu tố Xa.
Như đã lưu ý ở trên, bệnh đa hồng cầu (hematocrit> 55%) có thể kéo dài aPTT một cách giả tạo nếu lượng dung dịch chống đông máu citrate trong ống thu thập không được giảm một cách thích hợp.


Thời gian thrombin (TT) – Thời gian thrombin (TT) đo bước cuối cùng của quá trình đông máu, sự chuyển đổi fibrinogen thành fibrin (hình 1). Thử nghiệm được thực hiện bằng cách ủ huyết tương đã được citrate hóa với sự hiện diện của thrombin (bò hoặc người) và đo thời gian hình thành cục máu đông [19]. Khoảng bình thường đối với TT thay đổi tùy theo phòng thí nghiệm và thuốc thử; trong hầu hết các trường hợp, nó khoảng 14 đến 19 giây. Thời gian thrombin kéo dài nếu nồng độ fibrinogen thấp hoặc nếu có chất chống đông máu ức chế thrombin trong mẫu.
Không giống như PT và aPTT, thời gian thrombin không được sử dụng như một xét nghiệm sàng lọc ban đầu cho các bất thường về cầm máu. TT có thể được sử dụng trong các cơ sở lâm sàng sau:
- Đánh giá bệnh nhân có PT và aPTT kéo dài
- Đánh giá rối loạn fibrinogen di truyền
- Phát hiện heparin trong mẫu. Nếu có heparin, TT sẽ kéo dài đáng kể và thời gian reptilase sẽ bình thường.
Các tình huống sau đây có thể làm kéo dài TT, mặc dù TT không được sử dụng thường xuyên trong đánh giá ban đầu [20]:
- Thuốc chống đông máu – Heparin, LMW heparin, và các chất ức chế trực tiếp thrombin (ví dụ: bivalirudin hoặc argatroban) sẽ kéo dài TT. Ngược lại, các chất ức chế Xa trực tiếp đường uống, danaparoid, fondaparinux và warfarin không kéo dài thời gian thrombin.
- Rối loạn fibrinogen mắc phải – Nói chung, TT kéo dài trong tình trạng giảm fibrinogen huyết nếu mức fibrinogen huyết tương <100 mg / dL; TT cũng có thể kéo dài trong rối loạn tiêu sợi huyết.
- DIC – Trong đông máu nội mạch lan tỏa (DIC), các yếu tố đông máu bị tiêu hao và cạn kiệt, và sự phân hủy fibrin tăng lên. Điều này có thể dẫn đến TT kéo dài, cả do cạn kiệt fibrinogen và do ảnh hưởng của các sản phẩm phân giải fibrin, cả trong việc ức chế thrombin và cản trở quá trình trùng hợp fibrin. Điều quan trọng là, các yếu tố chống đông máu cũng có thể bị cạn kiệt, và TT không phản ánh bức tranh cầm máu tổng thể.
- Bệnh gan – Bệnh gan có thể liên quan đến giảm sản xuất fibrinogen và TT kéo dài. Điều quan trọng, bệnh gan cũng liên quan đến việc giảm sản xuất các yếu tố chống đông máu. Do đó, bệnh nhân bị bệnh gan có thể có nguy cơ bị cả huyết khối và chảy máu, và TT không phản ánh hình ảnh cầm máu tổng thể [21].
- Hạ albumin máu – Bệnh nhân giảm albumin máu có thể bị TT kéo dài [22].
- Paraproteinemias -Nồngđộcao của protein huyết thanh, nhưxảy ra trong bệnh
đa u tủy hoặc bệnh amyloidosis, có thể kéo dài TT do can thiệp với quá trình trùng hợp fibrin [23]. - Phơi nhiễm thrombin của bò – Những bệnh nhân trước đây đã tiếp xúc với thrombin của bò (ví dụ: trong quá trình phẫu thuật) có thể phát triển các kháng thể đặc hiệu cho protein của bò. Điều này sẽ dẫn đến TT in vitro kéo dài khi sử dụng thrombin bò trong thử nghiệm. TT sẽ bình thường nếu được thử nghiệm bằng cách sử dụng thrombin của người trong xét nghiệm. Những bệnh nhân như vậy không được cho là có nguy cơ chảy máu cao hơn, ngoại trừ một trường hợp hiếm hoi khi các kháng thể phản ứng chéo với thrombin của người. Tuy nhiên, những bệnh nhân tiếp xúc với thrombin của bò đã phát triển các kháng thể với yếu tố V của bò trong chế phẩm thrombin của bò, phản ứng chéo với yếu tố V của người và gây chảy máu [24,25].
3.8 Reptilase time (RT)
Thời gian reptilase (RT) tương tự như TT trong việc đo lường sự chuyển đổi fibrinogen thành fibrin [26]. Tuy nhiên, không giống như TT và aPTT, RT không nhạy cảm với tác dụng của heparin vì reptilase, một loại enzym có nguồn gốc từ nọc độc của rắn Bothrops, không bị ức chế bởi antithrombin hoặc phức hợp antithrombin-heparin.
Xét nghiệm được thực hiện tương tự như TT (bằng cách ủ huyết tương đã được citrate hóa với sự hiện diện của enzym pha loãng). Ngoại trừ reptilase được sử dụng thay cho thrombin, Reptilase khác với thrombin là convert fibrinogen thành fibrinopeptide A, mà không phải fibrinopeptide B và không bị sự ức chế của heparin thông qua antithrombin (AT).
RT hữu ích để phát hiện bất thường về fibrinogen (trong trường hợp này TT cũng kéo dài) và phát hiện sự hiện diện của heparin; heparin sẽ gây kéo dài TT chứ không kéo dài thời gian RT. Tương tự như heparin, thuốc ức chế trực tiếp thrombin kéo dài TT nhưng không kéo dài thời gian RT.
Sự hiện diện vô tình của chấtức chếthrombin trực tiếp ít có khảnăng liên quan đến lâm sàng, nhưng RT có thể được sử dụng để kiểm tra khả năng này.
3.9 DRVVT
Xét nghiệm dilute Russell viper venom time (dRVVT), còn được gọi là Russel viper venom time [RVVT]) là một xét nghiệm đông máu tận dụng khả năng hoạt hóa trực tiếp yếu tố X của nọc độc từ loài rắn hổ Russell (Daboia russelii) (hình 1).
Công dụng chính của dRVVT là trong kiểm tra sự hiện diện kháng đông lupus do kháng thể kháng phospholipid (aPL) gây ra. DRVVT đặc biệt nhạy cảm với sự hiện diện của kháng thể kháng beta-2-glycoprotein I, có tương quan chặt chẽ nhất với các biến cố huyết khối và hội chứng kháng phospholipid. Sự hiện diện của aPL có thể được xác nhận bằng cách bổ sung thêm phospholipid vào xét nghiệm [27].
DRVVT cũng nhạy cảm với tác dụng của thuốc chống đông máu đường uống trực tiếp (DOAC) và đã được đề xuất như một xét nghiệm có thể được điều chỉnh để theo dõi DOAC, mặc dù điều này chưa được xác nhận cho mục đích này và không được sử dụng trong lâm sàng [28].
Xét nghiệm yếu tố đông máu – Xét nghiệm yếu tố đông máu hầu hết được sử dụng để chẩn đoán các thiếu hụt yếu tố cụ thể.
- Thiếu yếu tố di truyền, bao gồm bệnh Hemophilia A (thiếu yếu tố VIII), bệnh Hemophilia B (thiếu yếu tố IX), thiếu yếu tố XI và các thiếu hụt yếu tố hiếm gặp khác.
- Chất ức chế yếu tố mắc phải, dựa trên việc phát hiện ra thời gian đông máu bất thường mà không trở lại bình thường trong thử nghiệm trộn.
Trong một số trường hợp, xét nghiệm chromogenic có thể được sử dụng để theo dõi liệu pháp điều trị bệnh ưa chảy máu hoặc theo dõi điều trị warfarin ở bệnh nhân có PT / INR ban đầu kéo dài.
3.10 Xét nghiệm dựa trên cục đông
Hoạt động của yếu tố có thể được đo bằng cách sử dụng aPTT (đối với các yếu tố con đường nội tại) hoặc PT (đối với yếu tố VII và các yếu tốconđường chung). Các xét nghiệm này sửdụngđiểmđông cuối và được hiệu chuẩn cho các yếu tố riêng lẻ bằng cách sử dụng các plasma thiếu yếu tố và được báo cáo dưới dạng hoạt độ phần trăm. Các xét nghiệm này, được gọi là xét nghiệm “một giai đoạn”, dựa trên cục đông, là phương pháp được sử dụng phổ biến nhất để xác định mức độ hoạt động của yếu tố.
3.11 Xét nghiệm chromogenic
Xét nghiệm chromogenic sử dụng sự phân cắt của cơ chất sinh màu và đường chuẩn để đánh giá hoạt tính của yếu tố.
Xét nghiệm yếu tố VIII chromogenic – Xét nghiệm chromogenic đối với hoạt tính của yếu tố VIII có thể hữu ích trong việc đánh giá nồng độ yếu tố VIII ở những bệnh nhân có aPTT bị nhiễu như trong trường hợp có kháng đông lupus.
Ngoài ra, ở một số bệnh nhân mắc bệnh ưa chảy máu A, xét nghiệm yếu tố VIII chromogenic tương quan tốt hơn với kiểu hình chảy máu so với xét nghiệm một giai đoạn dựa trên cục đông. Vì lý do này, các trung tâm điều trị bệnh Hemophilia thường có cả xét nghiệm hoạt tính yếu tố VIII một giai đoạn và chromogenic [29].
Một số sản phẩm yếu tố VIII và yếu tố IX có thời gian bán hủy dài được tái tổ hợp hoặc biến đổi trong nhiều trường hợp được theo dõi tốt hơn bằng các xét nghiệm chromogenic[30].
Xét nghiệm yếu tố X chromogenic – Xét nghiệm hoạt tính yếu tố X chromogenic rất hữu ích để theo dõi liệu pháp warfarin ở những bệnh nhân có các yếu tố ảnh hưởng đến phép đo PT / INR, chẳng hạn như do kháng đông lupus. Xét nghiệm yếu tố X chromgenic cũng có thể được sử dụng ở những bệnh nhân dùng argatroban hoặc các chất ức chế thrombin trực tiếp khác đang được chuyển đổi sang warfarin.
Khoảng INR từ 2 đến 3 tương ứng với yếu tố X chromogenic khoảng 20% đến 30%.
Cần lưu ý, xét nghiệm yếu tố X chromgenic khác với xét nghiệm hoạt tính kháng yếu tố Xa được sử dụng để theo dõi heparin, fondaparinux và các chất ức chế trực tiếp yếu tố Xa.
3.12 Xét nghiệm kháng nguyên
Các xét nghiệm kháng nguyên nhưELISA (xét nghiệm hấp thụ miễn dịch liên kết với enzym) cũng có thể được sử dụng để đo các yếu tố đông máu. Điều này thường được thực hiện khi cần phân biệt sự thiếu hụt số lượng hay chất lượng yếu tố đông máu (giảm cả hoạt tính kháng nguyên và chức năng hay giảm hoạt động chức năng nhưng nồng độ kháng nguyên bình thường). Các xét nghiệm này thường chỉ có ở các trung tâm chuyên khoa.
3.13 Fibrinogen
Fibrinogen là tiền thân của fibrin, thành phần chính của cục máu đông fibrin. Mức fibrinogen thấp bất thường (thường, <50 đến 100 mg / dL) có thể dẫn đến suy giảm hình thành cục máu đông và tăng nguy cơ chảy máu.
3.14 Ứng dụng lâm sàng của xét nghiệm fibrinogen
Xét nghiệm fibrinogen thường được sử dụng trong các bệnh cảnh lâm sàng sau:
- Đông máu nội mạch lan tỏa (DIC)
- Bệnh gan
- Rối loạn fibrinogen do di truyền hoặc mắc phải
3.15 Ly giải cục máu đông
Các xét nghiệm đánh giá ly giải cục máu đông khi có tác nhân giáng hóa mạnh có thể phát hiện những bất thường của yếu tố XIII, yếu tố này tạo các liên kết chéo lên cục máu đông sau khi nó hình thành. Ví dụ khả năng hòa tan trong 5M urê, chloroacetic 1% hoặc axit axetic 2%. Sự ly giải trong bất kỳ dung dịch nào trong số này trong vòng 24 giờ cho thấy sự thiếu hụt yếu tố XIII. Các xét nghiệm này sẽ phát hiện tình trạng thiếu hụt yếu tố XIII trầm trọng. Các xét nghiệm chức năng và miễn dịch đặc hiệu hơn cho sự thiếu hụt yếu tố XIII có sẵn ở các phòng xét nghiệm tham chiếu; chúng có thể được sử dụng để xác nhận tình trạng thiếu hụt yếu tố XIII nghiêm trọng hoặc để phát hiện tình trạng thiếu hụt yếu tố XIII nhẹ hơn.
3.16 D-dimer
D-dimer là một trong những sản phẩm thoái hóa fibrin chính được giải phóng khi phân cắt crosslinks fibrin bởi plasmin. Dimer bao gồm hai miền D từ các monome fibrin liền kề đã được liên kết chéo bởi yếu tố XIII hoạt hóa.
Mức bình thường của D-dimer trong xét nghiệm ELISA là <500 ng / mL FEU hoặc
<250 ng / mL DDU. Nồng độ D-dimer trong huyết tương tăng cho thấy hiện tượng đông máu nội mạch và tiêu sợi huyết gần đây hoặc đang diễn ra [31]. Plasmin phân cắt fibrin liên kết chéo tại nhiều vị trí, tạo ra các sản phẩm phân hủy fibrin khác (FDP), nhưng D-dimer là chất được nghiên cứu và xác nhận tốt nhất để đánh giá lâm sàng.
D-dimer sử dụng trên lâm sàng trong những trường hợp sau (bảng 2):
- Huyết khối tĩnh mạch sâu
- Thuyên tắc phổi
- DIC
- Tăng tiêu sợi huyết nguyên phát
| Bảng 2: Các rối loạn liên quan đến tăng nồng độ D-dimer |
Bệnh huyết khối động mạch
Bệnh huyết khối tĩnh mạch
Đông máu rải rác nội mạch Tiền sản giật và sản giật Tiêu sợi huyết bất thường; sử dụng thuốc làm tan huyết khối Bệnh tim mạch, suy xung huyết Nhiễm trùng nặng / nhiễm trùng huyết / viêm, bao gồm COVID-19 Phẫu thuật / chấn thương (ví dụ: thiếu máu cục bộ mô, hoại tử) Hội chứng đáp ứng viêm hệ thống Giai đoạn tắc mạch máu của bệnh hồng cầu hình liềm Bệnh gan nặng (giảm độ thanh thải) Bệnh ác tính Bệnh thận
Mang thai bình thường Dị dạng tĩnh mạch |
Xét nghiệm tại chỗ (point- of-care testing) – Xét nghiệm tại chỗ là các xét nghiệm có thể được thực hiện bằng cách sử dụng một thiết bị đặt tại hoặc gần vị trí của bệnh nhân (ví dụ: nhà của bệnh nhân, phòng phẫu thuật) chứ không phải trong phòng xét nghiệm trung tâm. Một số xét nghiệm có thể được thực hiện tại điểm chăm sóc, bao gồm thời gian đông máu (PT, INR, aPTT, ACT, TT) và D-dimer [32].
TEG và ROTEM là các xét nghiệm cầm máu được thực hiện trên máu toàn phần phản ánh chức năng tiểu cầu và đông máu. Các xét nghiệm này có thể được sử dụng tại điểm chăm sóc để đánh giá nhanh chóng về động học của sự hình thành cục máu đông, độ bền và sự hòa tan cục đông, cũng như để quản lý chảy máu và đánh giá đáp ứng với các biện pháp can thiệp điều trị. TEG, ROTEM và xét nghiệm liên quan thường được sử dụng trong các cơ sở chấn thương và phẫu thuật để hướng dẫn liệu pháp truyền máu.
Ưu điểm của xét nghiệm tại chỗ là việc tạo ra kết quả nhanh hơn sẽ cải thiện việc chăm sóc bệnh nhân. Thử nghiệm này phải tuân theo các quy trình kiểm soát chất lượng nghiêm ngặt giống như tại các phòng thí nghiệm trung tâm.
Ứng dụng lâm sàng của các POCT:
- Giám sát tại nhà đối với liệu pháp warfarin
- Đánh giá tình trạngđông cầm máu toàn thể ởbệnh nhân bệnh gan
- Chẩn đoán / xử trí rối loạn đông máu liên quan đến chấn thương
- Đánh giá / xử trí chảy máu trong phòng mổ
Những thách thức và hạn chế của các thiết bị này bao gồm chi phí, nhu cầu đào tạo chuyên ngành và tuân thủ nghiêm ngặt các tiêu chuẩn chất lượng bên ngoài môi trường phòng thí nghiệm lâm sàng.
4. Xét nghiệm theo dõi các liệu pháp điều trị
4.1 Theo dõi thuốc đối kháng vitamin K
Như đã đề cập ở trên và được thảo luận chi tiết hơn, PT / INR được sử dụng để theo dõi liệu pháp điều trị warfarin hoặc các thuốc đối kháng vitamin K khác (VKA).
Nếu bệnh nhân có INR cơ bản kéo dài và cần điều trị bằng warfarin, xét nghiệm yếu tố X chromogenic có thể được sử dụng.
4.2 Theo dõi heparin
Cần theo dõi heparin không phân đoạn theo liều điều trị. Heparin trọng lượng phân tử thấp (LMW) thường được sử dụng mà không cần theo dõi, bất kể liều lượng.
Heparin liều dự phòng (không phân đoạn hoặc LMW) không cần theo dõi, mặc dù xét nghiệm trong phòng thí nghiệm có thể thích hợp ở một số bệnh nhân để xác định xem có ảnh hưởng bất lợi của thuốc hay không (ví dụ: ở bệnh nhân bị chảy máu) hoặc ở bệnh nhân đang dùng liều dự phòng, để xác định liệu liều có quá cao hay không.
4.3 Heparin không phân đoạn
Bệnh nhân dùng heparin không phân đoạn ở liều điều trị đầy đủ có thể được theo dõi bằng aPTT hoặc sử dụng xét nghiệm hoạt tính kháng yếu tố Xa (đôi khi được gọi là “kháng Xa”). Anti-Xa là một xét nghiệm chức năng được thực hiện bằng cách thêm huyết tương bệnh nhân vào thuốc thử yếu tố Xa và đo hoạt tính của yếu tố Xa còn lại bằng cách sử dụng cơ chất sinh màu khi bị phân cắt (tức là xét nghiệm chromogenic) [33].
Khi được sử dụng để theo dõi trường hợp truyền Heparin liên tục, hoạt tính aPTT hoặc kháng yếu tố Xa có thể được đo bất kỳ lúc nào, như một mức ngẫu nhiên.
Hoạt động kháng yếu tố Xa đặc biệt hữu ích ở những người có aPTT kéo dài lúc ban đầu, chẳng hạn như những người bị hội chứng kháng phospholipid hoặc bệnh gan, hoặc có chất ức chế yếu tố mắc phải.
Lưu ý, khi sử dụng hoạt tính kháng yếu tố Xa, xét nghiệm phải được hiệu chỉnh cho từng chất chống đông. Heparin không phân đoạn được báo cáo bằng IU/mL, trong khi xét nghiệm kháng yếu tố Xa được hiệu chuẩn cho heparin LMW sẽ được hiệu chuẩn theo Units/ mL của kháng Xa, và các chất ức chế yếu tố Xa được báo cáo dưới dạng nồng độ thuốc, sử dụng đường chuẩn đặc hiệu cho thuốc.
Cũng cần lưu ý rằng xét nghiệm hoạt tính kháng yếu tố Xa khác với xét nghiệm yếu tố X chromogenic được sử dụng để theo dõi warfarin.
4.4 Heparin không phân đoạn liều cao
Bệnh nhân dùng heparin không phân đoạn liều cao để bắc cầu tim phổi hoặc các thủ thuật khác như (ECMO) hoặc thẩm tách máu có thể được theo dõi bằng cách sử dụng thời gian đông máu hoạt hóa (ACT). [34,35]. Trong những cơ sở này, aPTT có thể không hữu ích vì liều heparin được sử dụng thường dẫn đến nồng độ heparin trong huyết tương> 1 đơn vị / mL, làm kéo dài aPTT vượt ra ngoài phạm vi theo dõi tuyến tính. Ngược lại, ACT cho thấy đáp ứng với nồng độ heparin trong khoảng từ 1 đến 5 đơn vị / mL [36].
ACT sử dụng máu toàn phần (chứ không phải huyết tương) để đo thời gian tạo cục đông khi tiếp xúc với các chất hoạt hóa yếu tố tiếp xúc. Giống như aPTT, xét nghiệm này đánh giá các con đường đông máu nội sinh và con đường chung. Xét nghiệm ACT được thực hiện bằng cách thêm celite hoặc kaolin vào máu toàn phần mới lấy vàđo thời gian hình thành cục máu đông.
Heparin LMW – Heparin LMW thường được sử dụng mà không cần theo dõi. Nếu cần theo dõi, hoạt tính kháng yếu tố Xa được kiểm tra bốn giờ sau khi dùng thuốc. Xét nghiệm phải được hiệu chuẩn cho loại heparin LMW cụ thể.
Như đã thảo luận ở trên, các xét nghiệm hoạt tính kháng yếu tố Xa được hiệu chuẩn với chất chống đông cụ thể và không thể thay thế cho nhau.
Kết quả của các xét nghiệm kháng yếu tố Xa có thể khác nhau giữa các trung tâm do sự khác nhau về loại xét nghiệm được sử dụng. Do những khác biệt này, mức kháng yếu tố Xa mục tiêu có thể khác nhau đối với các phòng thí nghiệm khác nhau. Ví dụ:
- Một số trung tâm sử dụng các đường cong chuẩn độ riêng biệt cho các heparin trọng lượng phân tử thấp và không phân đoạn (LMW), trong khi các trung tâm khác sử dụng một đường cong lai đơn. Tùy thuộc vào cách sử dụng, có thể có sự khác biệt nhỏ trong các đơn vị hoạt động kháng yếu tố Xa được báo cáo từ các trung tâm khác nhau.
- Phần lớn các trung tâm (80% đến 90%) sử dụng các xét nghiệm không bổ sung antithrombin (AT). Hiếm khi, một trung tâm có thể sử dụng một xét nghiệm bổ sung AT ngoại sinh để tăng cường tác dụng của heparin. Điều này có thể ảnh hưởng đến kết quả của xét nghiệm anti-Xa ở những bệnh nhân bị thiếu AT nền.
4.5 Theo dõi argatroban và hirudin
aPTT được sử dụng để theo dõi liệu pháp điều trị bằng thuốc ức chế trực tiếp argatroban. Thời gian đông máu ecarin (ECT) cũng có thể được sử dụng [37]. Ecarin là một metalloproteinase có nguồn gốc từ nọc độc rắn Echis carinatus. Nó kích hoạt prothrombin thành meizothrombin, một bước trung gian trong quá trình chuyển đổi prothrombin thành thrombin.
Meizothrombin làm giảm rõ rệt hoạt động đông máu của fibrinogen (so với thrombin), và nó không dễ bị ức chế bởi antithrombin (AT) hoặc phức hợp heparin-AT (do cản trở steric), nhưng nó có thểdễdàng tạo phức với các chấtức chếtrực tiếp thrombin. Theođó, ECT kéo dài khi liều các tác nhân này tăng [38-40].
4.6 Theo dõi thuốc chống đông máu trực tiếp đường uống
Thuốc chống đông máu trực tiếp đường uống được sử dụng mà không cần theo dõi.
Trong một số trường hợp hiếm hoi, chẳng hạn như khi muốn xác định xem có hoạt tính chống đông máu hay không (đối với bệnh nhân bị chảy máu hoặc phẫu thuật cấp cứu), xét nghiệm có thể được sử dụng:
- Có thể xét nghiệm sự hiện diện của dabigatran bằng cách sử dụng thời gian thrombin (TT) hoặc ECT.
- Có thể xét nghiệm sự hiện diện của chất ức chế yếu tố Xa trực tiếp qua đường uống (apixaban, edoxaban, rivaroxaban) bằng xét nghiệm kháng yếu tố Xa được hiệu chuẩn cho loại thuốc cụ thể.
5. Đánh giá kết quả thường gặp
Tốc độ và mức độ của việc đánh giá xét nghiệm đông máu bất thường phụ thuộc vào tình trạng lâm sàng của bệnh nhân và liệu những bất thường đó có nghi ngờ nguyên nhân nào đó hay không.
5.1 Bệnh nhân chảy máu
Việc đánh giá thời gian đông máu bất thường ở bệnh nhân đang có chảy máu, tiền sử gợi ý chảy máu bất thường / quá nhiều, hoặc tiền sử gia đình có rối loạn chảy máu được trình bày chi tiết riêng.
Ngoài ra, bệnh nhân có thể bị chảy máu bất thường mặc dù aPTT và PT bình thường. Trong bối cảnh này, các nguyên nhân tiềm ẩn có thể bao gồm giảm tiểu cầu, rối loạn chức năng tiểu cầu, thiếu hụt nhẹ yếu tố von Willebrand, rối loạn mạch máu, và hiếm khi là thiếu hụt yếu tố XIII hoặc rối loạn hệ thống tiêu sợi huyết. Việc đánh giá những bệnh nhân như vậy được thảo luận riêng.
5.2 Bệnh nhân bị huyết khối
Việc đánh giá thời gian đông máu bất thường ở bệnh nhân bị huyết khối nên đánh giá khả năng xảy ra các tình trạng liên quan đến đông máu đang diễn ra. Chúng bao gồm:
- Đông máu nội mạch lan tỏa (DIC)
- Hội chứng kháng phospholipid (aPL) với hiển diện kháng đông lupus.
- Giảm tiểu cầu do heparin (HIT), trong đó thời gian đông máu có thể bất thường do sử dụng thuốc chống đông máu chứa heparin và có thể xuất hiện huyết khối do kháng thể HIT.
Ngược lại với những hội chứng này, các bệnh lý khối mạch vi huyết nhỏ (TMAs) như ban xuất huyết giảm tiểu cầu huyết khối (TTP), hội chứng huyết tán ure huyết HUS), hoặc TMA do thuốc (DITMA) không liên quan đến thời gian đông máu bất thường, ngoại trừ bệnh nhân thiếu máu cục bộ mô do TMA dẫn đến DIC.
PT và / hoặc aPTT kéo dài mà không có chảy máu hoặc huyết khối – Thời gian prothrombin (PT) và thời gian thromboplastin một phần hoạt hóa (aPTT) thường được chỉ định ở những bệnh nhân không có nghi ngờ chảy máu trên lâm sàng. Các giá trị kéo dài / tăng của các xét nghiệm này ở bệnh nhân không dùng thuốc chống đông cần được xem xét kỹ vì chúng cho thấy nguy cơ xuất huyết tăng cao (hoặc đôi khi là huyết khối), ngay cả khi chúng được ghi nhận là một phát hiện ngẫu nhiên.
Lặp lại (các) xét nghiệm có kết quả bất thường để xác minh tính chính xác của nó thường là bước đầu tiên. Tốc độ đánh giá phụ thuộc vào tình trạng lâm sàng của bệnh nhân. Trong nhiều trường hợp, cách tiếp cận từng bước để điều tra nguyên nhân có thể được thực hiện. Tuy nhiên, các tình huống khác có thể cần thực hiện ngay và đồng thời các xét nghiệm (ví dụ: xét nghiệm bất thường nghiêm trọng, thủ tục phẫu thuật cần gấp).
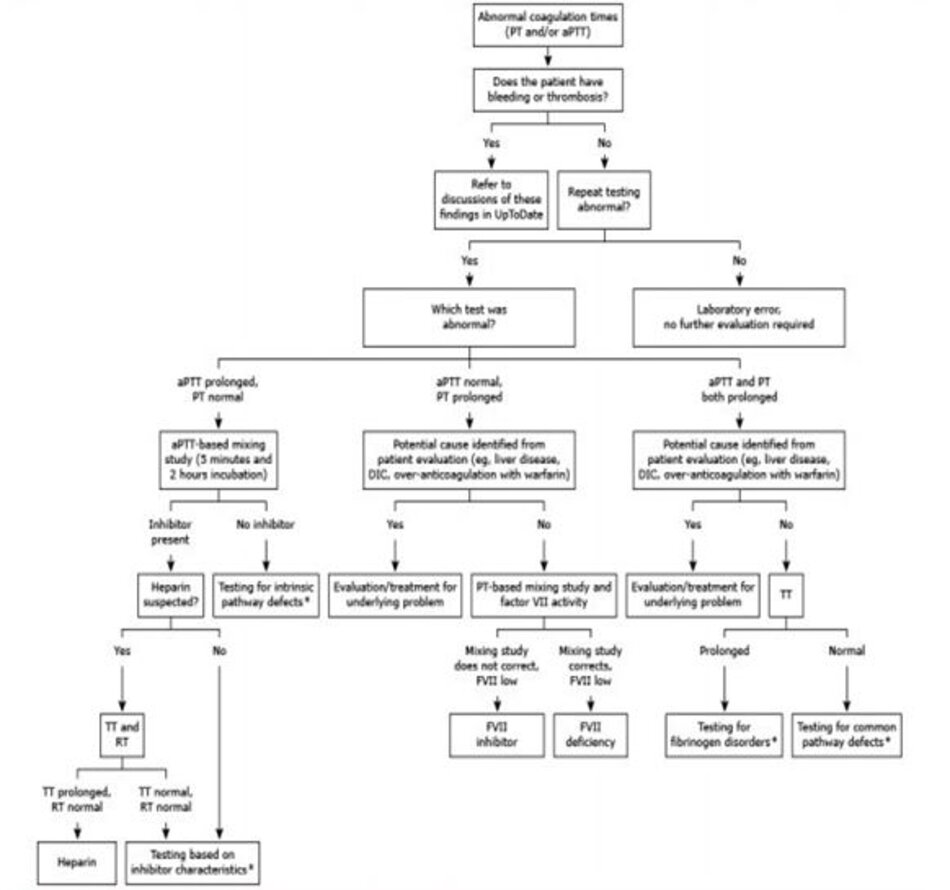
Cách tiếp cận chung của chúng tôi để đánh giá thời gian đông máu bất thường ở một bệnh nhân không có chảy máu hoặc huyết khối là trước tiên thực hiện một xét nghiệm trộn để xác định xem nguyên nhân của việc kéo dài thời gian đông máu là do thiếu hụt yếu tốhay chấtức chếyếu tố(sơ đồ1).
Đánh giá kết quả PT và aPTT có thể được sử dụng để xác định vị trí khiếm khuyết
đông máu ở con đường nội sinh, ngoại sinh hay con đường chung:
Nếu aPTT kéo dài và PT (INR) bình thường, vấn đề được khu trú tại con đường đông máu nội sinh, bao gồm các yếu tố XI, IX, VIII và XII. Các rối loạn chảy máu di truyền phổ biến nhất trong trường hợp này là bệnh von Willebrand (VWD), trong đó nồng độ yếu tố VIII có thể giảm do giảm tính ổn định của yếu tố VIII; hoặc thiếu hụt riêng biệt các yếu tố VIII (bệnh ưa chảy máu A), yếu tố IX (bệnh máu khó đông B), hoặc yếu tố XI.
Nguyên nhân mắc phải thường gặp của mô hình này là điều trị bằng heparin và hiện diện kháng đông lupus, gây ra bởi sự hiện diện của các kháng thể kháng phospholipid (aPL). VWD và sự thiếu hụt hoặc chất ức chế mắc phải của các yếu tố VIII, IX, hoặc XI có thể gây chảy máu lâm sàng, và kháng thể aPL có thể gây huyết khối.
Sự kéo dài đơn độc của aPTT cũng được thấy khi thiếu hụt các yếu tố XII, prekallikrein (PK), hoặc kininogen trọng lượng phân tử cao (HMWK); trái ngược với sự thiếu hụt các yếu tố VIII, IX và XI, sự thiếu hụt các yếu tố XII, PK và HMWK không liên quan đến chảy máu lâm sàng.
- Nếu bệnh nhân có tiền sử gia đình bị VWD hoặc thiếu hụt yếu tố cụ thể, thì việc kiểm tra các yếu tố này là phù hợp.
- Nếu nghi ngờ khả năng mẫu có heparin, thời gian thrombin (TT) và thời gian reptilase (RT) được thực hiện; phát hiện TT kéo dài và RT bình thường khẳng định sự có mặt của heparin.
Nếu aPTT bình thường và PT (INR) kéo dài, vấn đề nằm ở con đường ngoại sinh, bao gồm yếu tố VII, một yếu tố phụ thuộc vitamin K. Các nguyên nhân mắc phải phổ biến nhất là sử dụng warfarin, bệnh gan mãn tính và thiếu vitamin K. Nguyên nhân ít hơn bao gồm chất ức chế mắc phải của yếu tố VII hoặc thiếu hụt yếu tố VII bẩm sinh. Sử dụng warfarin, bệnh gan mãn tính và thiếu vitamin K thường rõ ràng từdanh sách thuốc sửdụng, tiền sửbệnh nhân và xét nghiệm chức năng gan. Tuy nhiên, nếu những điều này không được tiết lộ, xét nghiệm trộn và xét nghiệm hoạt tính của yếu tố VII là chỉ định thích hợp.
Nếu cả aPTT và PT (INR) đều kéo dài, vấn đề có thể là ở con đường chung, bao gồm yếu tố X, V và prothrombin (yếu tố II). Các tình trạng mắc phải phổ biến gây ra PT và aPTT kéo dài là bệnh gan, DIC, và quá liều warfarin hoặc chất đối kháng vitamin K khác (hoặc đôi khi thiếu vitamin K trầm trọng hoặc ngộ độc superwarfarin). Ít phổ biến hơn, rối loạn fibrinogen có thể là nguyên nhân. Những tình trạng này thường được phát hiện từ tiền sử bệnh nhân, khám lâm sàng và xét nghiệm chức năng gan và nồng độ fibrinogen.
Đối với những trường hợp mà nguyên nhân không rõ ràng, TT có thể được sử dụng để phân biệt các bất thường của con đường đông máu chung với các rối loạn fibrinogen.
Nếu TT bất thường thì nghi ngờ có rối loạn fibrinogen. Bệnh gan và DIC có thể gây ra tình trạng giảm fibrin trong máu nếu nghiêm trọng.
Nếu TT bình thường, thì vấn đề là do bất thường trong prothrombin, và / hoặc yếu tố V hoặc X. Điều này có thể thấy trong bệnh cảnh giảm sản xuất một hoặc nhiều yếu tố này (ví dụ, trong DIC hoặc thiếu vitamin K nặng). Ít phổ biến hơn, sự thiếu hụt yếu tố di truyền hoặc chất ức chế yếu tố mắc phải có thể là nguyên nhân. Xét nghiệm trộn có thể được sử dụng để phân biệt giữa các khả năng này.
5.3 Sử dụng xét nghiệm trộn (Mixtest)
Tổng quan về xét nghiệm trộn – Mixtest là xét nghiệm là thích hợp ở một bệnh nhân có thời gian đông máu kéo dài không giải thích được. Mixtest rất hữu ích vì chúng phân biệt giữa thời gian đông máu kéo dài bất thường do thiếu yếu tố hay do chất ức chế yếu tố. Các chất ức chế thường là các tự kháng thể can thiệp vào chức năng của yếu tố đông máu ở bệnh nhân (ví dụ, chất ức chế yếu tố VIII mắc phải) hoặc trong xét nghiệm (ví dụ, khángđông lupus). Các chất khác cũng có thểhoạt động như chất ức chế bao gồm heparin, fondaparinux, thuốc chống đông máu trực tiếp đường uống (DOAC) và protein phản ứng C tăng cao [41,42].
Mixtest có thể được thực hiện đối với bất kỳ xét nghiệm đông máu tiêu chuẩn nào, bao gồm thời gian prothrombin (PT), thời gian thromboplastin một phần hoạt hóa (aPTT) và thời gian thrombin (TT).
Thảo luận với bác sĩ huyết học và / hoặc nhân viên phòng xét nghiệm có thể hữu ích để đảm bảo rằng xét nghiệm thích hợp được thực hiện kịp thời.
Mixtest được thực hiện bằng cách đo thời gian đông máu của hỗn hợp trộn huyết tương của bệnh nhân và huyết tương bình thường. Thời gian đông máu của hỗn hợp 1: 1 giữa huyết tương bệnh nhân và huyết tương bình thường có thể được đo ngay khi ủ và sau khi ủ ở nhiệt độ cơ thể (thường là hai giờ). Mức độ “hiệu chỉnh” của thời gian đông máu ở cả hai thời điểm (ngay lập tức và sau khi ủ) được báo cáo.
5.4 Thời gian đông máu được hiệu chỉnh
Nguyên nhân phổ biến nhất dẫn đến thời gian đông máu bất thường được điều chỉnh trong Mixtest bao gồm:
Sự thiếu hụt một yếu tố thuần túy – Bất kỳ sự thiếu hụt yếu tố thuần túy nào sẽ được điều chỉnh trong Mixtest. Điều này là do hỗn hợp 1: 1 với huyết tương bình thường sẽ cung cấp ít nhất 50% hoạt tính của bất kỳ yếu tố nào cần thiết cho xét nghiệm, quá đủ để bình thường hóa thời gian đông máu. Nếu độ pha loãng 1: 1 hiệu chỉnh được xét nghiệm bất thường, (các) yếu tố bị thiếu có thể được xác định bằng các xét nghiệm yếu tố đông máu riêng lẻ. (Các) yếu tố đông máu được đánh giá phụ thuộc vào việc thử nghiệm đông máu nào kéo dài (bảng 1).
Thiếu hụt nhiều yếu tố – Một số điều kiện có thể gây ra tình trạng thiếu hụt nhiều yếu tố đông máu. Ví dụ như bệnh gan nặng, thiếu vitamin K và rối loạn đông máu di truyền hiếm gặp ảnh hưởng đến nhiều yếu tố.
5.5 Thời gian đông máu không được hiệu chỉnh
Hầu hết các chấtức chếyếu tố sẽ không được trung hòa đủ trong xét nghiệm Mixtest. Điều này là do hầu hết các kháng thể sẽ không được pha loãng đủ bởi một thể tích tương đương của huyết tương bình thường để có thể điều chỉnh thời gian đông máu. Tuy nhiên, điều quan trọng là một số kháng thể không tác động ngay lập tức lên yếu tố đông máu đích của chúng. Hoạt động trì hoãn này là đặc điểm của chất ức chế yếu tố VIII [43]. Trong những trường hợp như vậy, Mixtest sẽ có vẻ hiệu chỉnh vào thời điểm ban đầu, nhưng lại kéo dài sau một hoặc hai giờ ủ.
Nếu độ pha loãng 1: 1 không thể hiệu chỉnh thời gian đông, việc đánh giá tiếp theo phụ thuộc vào nguyên nhân nghi ngờ của chất ức chế và tình trạng lâm sàng của bệnh nhân. Cần có sự tham gia sớm của bác sĩ huyết học và / hoặc nhân viên phòng xét nghiệm vì một số tình trạng này có thể gây chảy máu có thể đe dọa tính mạng (ví dụ, thuốc ức chế yếu tố mắc phải), huyết khối (ví dụ, kháng thể kháng phospholipid), hoặc cả hai (ví dụ, đông máu nội mạch lan tỏa [DIC]).
Nguyên nhân phổ biến của chất ức chế đông máu và đánh giá chúng:
- DOAC – Tại cơ sở của chúng tôi, sự hiện diện của thuốc chống đông máu trực tiếp đường uống (DOAC) trong mẫu, thường gặp nhất là thuốc ức chế trực tiếp yếu tố Xa, là nguyên nhân phổ biến nhất của aPTT kéo dài được đưa đi xét nghiệm. Do đó, việc xem xét danh sách thuốc bệnh nhân trên hệ thống thông tin bệnh viện (HIS) hoặc xác nhận sự hiện diện của hoạt tính chống Xa trong mẫu có thể hữu ích trong việc giải quyết kéo dài aPTT ở những bệnh nhân này.
- Heparin – Heparin trong mẫu máu kéo dài aPTT và TT nhưng không kéo dài thời gian RT. Do đó, RT có thể được sử dụng để xác định nghi ngờ tác dụng của heparin.
- Kháng thể kháng phospholipid – Các kháng thể kháng phospholipid (aPL) thường kéo dài aPTT. Kháng đông lupus ảnh hưởng đến aPTT sẽ không được hiệu chỉnh trong Mixtest, nhưng nó sẽhiệu chỉnh với lượng phospholipid dưthừa. Nếu nghi ngờ có aPL, xét nghiệm dRVVT hoặc thuốc thử PTT có hàm lượng phospholipid thấp (ví dụ, PTT-LA) có thể được sử dụng để đánh giá khả năng này.
- DIC – Các sản phẩm giáng hóa fibrin có thể gây kéo dài thời gian PT và aPTT, nhưcó thể xảy ra ở bệnh nhân DIC hoặc thuyên tắc huyết khối.
- Chất ức chế yếu tố đông máu ở bệnh nhân Hemophilia – Các chất ức chế yếu tố VIII hoặc IX ở những bệnh nhân mắc bệnh máu khó đông nặng phát triển để đáp ứng với việc truyền yếu tố có thể gây ra tăng chảy máu và aPTT kéo dài không cải thiện khi truyền yếu tố.
- Chất ức chế yếu tố đông máu mắc phải – Các tự kháng thể chống lại các yếu tố VIII, IX, V hoặc X có thể kéo dài PT và / hoặc aPTT, tùy thuộc vào yếu tố nào được nhắm mục tiêu. Quan trọng là, một số chất ức chế yếu tố mắc phải có thể liên quan đến chảy máu đe dọa tính mạng.
Nếu có chất ức chế, xét nghiệm trộn cũng có thể được sử dụng để xác định hiệu giá của chất ức chế. Pha loãng huyết tương bệnh nhân ở các nồng độ liên tiếp, sau đó trộn với huyết tương bình thường. Nồng độ pha loãng cho kết quả xét nghiệm trộn được hiệu chỉnh được sử dụng để xác định hiệu giá kháng thể. Giá trị thường được báo cáo bằng đơn vị Bethesda (BU); hiệu giá bằng nghịch đảo của nồng độ pha loãng huyết tương bệnh nhân dẫn đến hoạt tính của yếu tố là 50%. Hiệu giá tương quan với độ mạnh của chất ức chế (tức là, chất ức chế càng mạnh, hiệu giá càng cao). Đánh giá hiệu giá kháng thể giúp quyết định bệnh nhân nên được truyền yếu tố thay thế hay cần các liệu pháp khác để cầm máu.
5.6 PT và / hoặc aPTT ngắn
Trong hầu hết các trường hợp, PT và / hoặc aPTT ngắn phản ánh kỹ thuật chuẩn bị mẫu hoặc thu thập mẫu kém.
Tuy nhiên, các yếu tố đông máu có thể được tăng lên hoặc kích hoạt in vivo, như trong bệnh ác tính, DIC, hoặc sau khi tập thể dục, dẫn đến rút ngắn thời gian đông máu, đặc biệt là aPTT [44].
Thời gianđông máu rút ngắn mà không phải do lỗi kỹthuật có liên quanđến tăng nguy cơ huyết khối, huyết khối tái phát, sẩy thai tái phát hoặc chảy máu và có thể làm tăng nguy cơ huyết khối liên quan đến các yếu tố nguy cơ huyết khối phổ biến khác (ví dụ: yếu tố V Leiden, béo phì, tăng nồng độ D-dimer) [45-52]. Không có biện pháp can thiệp cụ thể nào được khuyến nghị chỉ dựa trên kết quả xét nghiệm bất thường; điều trị tình trạng bệnh nền có thể làm giảm nguy cơ huyết khối.
5.7 Bệnh nhân đang dùng thuốc chống đông máu
Một số thuốc chống đông máu tạo ra những thay đổi có thểdự đoán được trong các xét nghiệm đông máu có thể được sử dụng trong việc theo dõi định kỳ và điều chỉnh liều. Ngoài ra, nhiều tác nhân này cũng có khả năng ảnh hưởng đến các xét nghiệm đông máu khác không được sử dụng trong việc theo dõi thường quy, tùy thuộc vào nồng độ thuốc và các yếu tố lâm sàng khác (ví dụ, nồng độ các yếu tố đông máu trong huyết tương). Thông tin về những tác dụng khác này có thể hữu ích trong việc ngăn ngừa việc đánh giá không cần thiết kết quả xét nghiệm bất thường và / hoặc xác minh rằng thuốc chống đông máu không còn tạo ra sự thay đổi có thể đo lường được trong các thông xét nghiệm (ví dụ: ở những bệnh nhân bị chảy máu hoặc sắp trải qua phẫu thuật).
Ảnh hưởng của thuốc chống đông máu đối với các xét nghiệm đông máu khác bao gồm (bảng 3):
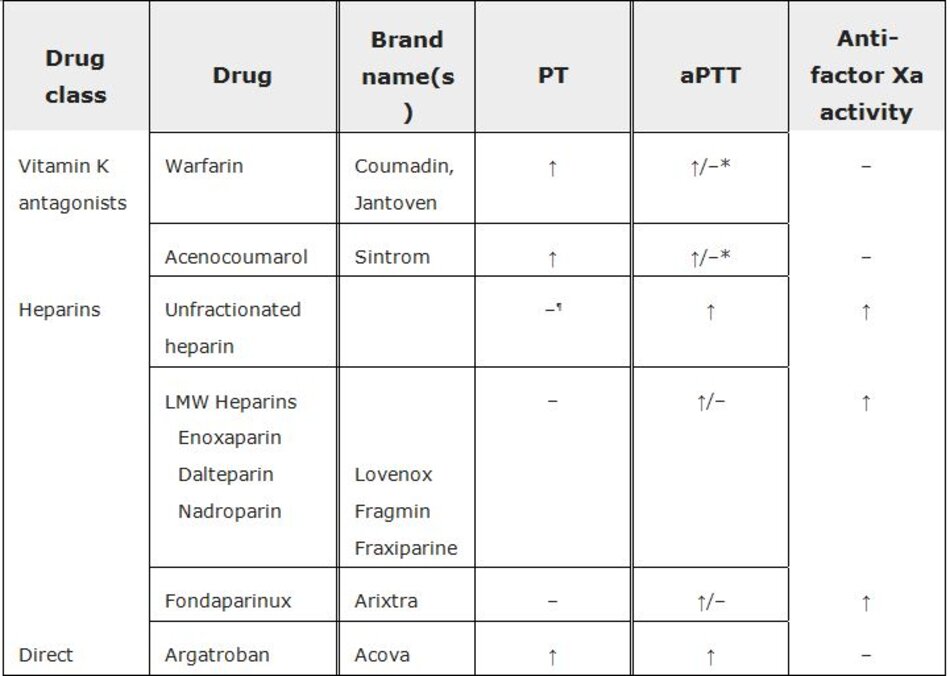
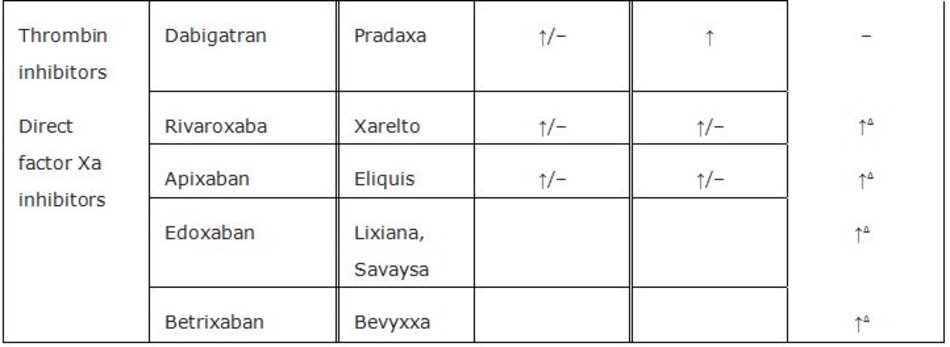
- Thuốc đối kháng vitamin K (ví dụ, warfarin) – Kéo dài PT / INR (dùng để theo dõi); có thể kéo dài aPTT một cách yếu ớt.
- Heparin không phân đoạn – Kéo dài aPTT (dùng để theo dõi), tăng hoạt tính kháng yếu tố Xa.
- Heparin trọng lượng phân tử thấp (LMW) (ví dụ, enoxaparin, dalteparin) – Có thể kéo dài aPTT, tăng hoạt tính kháng yếu tố Xa.
- Fondaparinux – Có thể kéo dài aPTT, làm tăng hoạt tính kháng yếu tố Xa.
- Thuốc ức chế thrombin trực tiếp (ví dụ: hirudin, argatroban, dabigatran) – Kéo dài PT / INR và aPTT (aPTT được sử dụng để theo dõi các thuốc đường tiêm).
- Thuốc ức chế trực tiếp yếu tố Xa (ví dụ, rivaroxaban, apixaban, edoxaban) – Kéo dài PT / INR và aPTT, tăng hoạt tính kháng yếu tố Xa.
Ở những bệnh nhân được chuyển từ thuốc chống đông máu này sang thuốc chống đông máu khác, nhiều xét nghiệm đông máu có thể bị kéo dài trong thời gian chuyển đổi.
Các tác nhân tiêu sợi huyết như chất hoạt hóa plasminogen mô tái tổ hợp (tPA) gây ra trạng thái ly giải hệ thống với fibrinogen thấp và các sản phẩm thoái hóa fibrin tăng lên, điều này sẽ làm kéo dài PT và aPTT. Hoạt tính kháng yếu tố Xa không được kéo dài bằng thuốc tiêu sợi huyết.
6. Tóm tắt và kiến nghị
Xét nghiệm đông máu chính xác yêu cầu mẫu máu phải được thu thập và xử lý thích hợp, đồng thời giải quyết các nguồn gây nhiễu xét nghiệm tiềm ẩn.
Thời gian prothrombin (PT) đo thời gian huyết tương đông lại khi tiếp xúc với yếu tố mô, đánh giá các con đường đông máu ngoại sinh và con đường chung (hình 1). Các nguyên nhân phổ biến của PT kéo dài bao gồm sử dụng thuốc chống đông máu, thiếu vitamin K, bệnh gan và đông máu nội mạch lan tỏa (DIC). Một số thiếu hụt yếu tố đông máu cũng có thể kéo dài thời gian PT (bảng 1). Tỷ lệ chuẩn hóa quốc tế(INR) được phát triển để cho phép bệnh nhân dùng warfarin so sánh các kết quả xét nghiệm tại các thời điểm khác nhau và từ các phòng xét nghiệm khác nhau; nó cũng thường được sử dụng như một đại diện cho PT ở bệnh nhân chảy máu và để đánh giá bệnh gan giai đoạn cuối.
Thời gian thromboplastin từng phần hoạt hóa (aPTT) đo thời gian huyết tương đông lại khi tiếp xúc với các chất hoạt hóa đông máu tiếp xúc, đánh giá các con đường đông máu nội sinh và con đường chung. Nguyên nhân của aPTT kéo dài bao gồm thuốc chống đông máu; bệnh gan; DIC; bệnh von Willebrand (VWD); thiếu hụt yếu tố VIII di truyền (bệnh ưa chảy máu A), yếu tố IX (bệnh máu khó đông B), yếu tố XI, hoặc các yếu tố đông máu khác; chất ức chế yếu tố mắc phải; và kháng thể kháng phospholipid (aPL).
Thời gian thrombin (TT), thời gian tái phát (RT) và dRVVT không được sử dụng trong sàng lọc ban đầu, nhưng những xét nghiệm này có thể đặc biệt hữu ích trong việc đánh giá một số rối loạn, xác định heparin trong mẫu hoặc phát hiện kháng đông lupus.
Một số xét nghiệm có sẵn để theo dõi liệu pháp chống đông máu.
Cách tiếp cận chung của chúng tôi để đánh giá một bệnh nhân có PT và / hoặc aPTT kéo dài được trình bày trong sơ đồ 1 và được nêu ở trên. Các xét nghiệm trộn được chỉ định ở một bệnh nhân có thời gian đông máu kéo dài không giải thích được; chúng phân biệt giữa thời gian đông máu kéo dài bất thường do thiếu yếu tố hay do chất ức chế yếu tố (điển hình là tự kháng thể).
7. References
1. Adcock DM, Kressin DC, Marlar RA. Minimum specimen volume requirements for routine coagulation testing: dependence on citrate concentration. Am J Clin Pathol 1998; 109:595.
2. Chuang J, Sadler MA, Witt DM. Impact of evacuated collection tube fill volume and mixing on routine coagulation testing using 2.5-ml (pediatric) tubes. Chest 2004; 126:1262.
3. Zürcher M, Sulzer I, Barizzi G, et al. Stability of coagulation assays performed in plasma from citrated whole blood transported at ambient temperature. Thromb Haemost 2008; 99:416.
4. Gottfried EL, Adachi MM. Prothrombin time and activated partial thromboplastin time can be performed on the first tube. Am J Clin Pathol 1997; 107:681.
5. Brigden ML, Graydon C, McLeod B, Lesperance M. Prothrombin time determination. The lack of need for a discard tube and 24-hour stability. Am J Clin Pathol 1997; 108:422.
6. McLaren G, Hanna C, Mills L, et al. Comparison of sampling methods for obtaining accurate coagulation values in hemodialysis patients with heparinized central venous catheters. Nephrol Nurs J 2001; 28:632.
7. Besley M, Thomas A, Salter S, et al. Control of oral anticoagulation in patients using long-term internal jugular catheters for haemodialysis access. Int J Artif Organs 1992; 15:277.
8. van Genderen PJ, Gomes M, Stibbe J. The reliability of Hickman catheter blood for the assessment of activation markers of coagulation and fibrinolysis in patients with hematological malignancies. Thromb Res 1994; 73:247.
9. Delate T, Witt DM, Jones JR, et al. Falsely elevated international normalized ratio values in patients undergoing anticoagulation therapy: a descriptive evaluation. Chest 2007; 131:816.
10. Spaet TH. Case 20-1979: false prolongation of prothrombin time in polycythemia.
N Engl J Med 1979; 301:503.
11. Hirsh J, Poller L. The international normalized ratio. A guide to understanding and correcting its problems. Arch Intern Med 1994; 154:282.
12. Becker DM, Humphries JE, Walker FB 4th, et al. Standardizing the prothrombin time. Calibrating coagulation instruments as well as thromboplastin. Arch Pathol Lab Med 1993; 117:602.
13. van den Besselaar AM, Poller L, Tripodi A. Guidelines for thromboplastins and plasmas used to control oral anticoagulant therapy. WHO Technical Report Series 1999; 889:64.
14. Funk DM. Coagulation assays and anticoagulant monitoring. Hematology Am Soc Hematol Educ Program 2012; 2012:460.
15. Jin J, Zehnder JL. Prozone Effect in the Diagnosis of Lupus Anticoagulant for the Lupus Anticoagulant-Hypoprothrombinemia Syndrome. Am J Clin Pathol 2016; 146:262.
16. Schmaier AH. Contact activation: a revision. Thromb Haemost 1997; 78:101. 17.Price EA, Jin J, Nguyen HM, et al. Discordant aPTT and anti-Xa values and
outcomes in hospitalized patients treated with intravenous unfractionated heparin. Ann Pharmacother 2013; 47:151.
18. Malbora B, Bilaloglu E. Lupus Anticoagulant Positivity in Pediatric Patients With Prolonged Activated Partial Thromboplastin Time: A Single-Center Experience and Review of Literature. Pediatr Hematol Oncol 2015; 32:495.
19. JIM RT. A study of the plasma thrombin time. J Lab Clin Med 1957; 50:45.
20.Mammen EF. Seminars in Thrombosis and Hemostasis. Semin Thromb Hemost
1983; 9:1.
21. Tripodi A, Mannucci PM. The coagulopathy of chronic liver disease. N Engl J Med 2011; 365:147.
22. Toulon P, Frere E, Bachmeyer C, et al. Fibrin polymerization defect in HIV- infected patients–evidence for a critical role of albumin in the prolongation of thrombin and reptilase clotting times. Thromb Haemost 1995; 73:349.
23. O’Kane MJ, Wisdom GB, Desai ZR, Archbold GP. Inhibition of fibrin monomer polymerisation by myeloma immunoglobulin. J Clin Pathol 1994; 47:266.
24. Zehnder JL, Leung LL. Development of antibodies to thrombin and factor V with recurrent bleeding in a patient exposed to topical bovine thrombin. Blood 1990; 76:2011.
25. Rapaport SI, Zivelin A, Minow RA, et al. Clinical significance of antibodies to bovine and human thrombin and factor V after surgical use of bovine thrombin. Am J Clin Pathol 1992; 97:84.
26. Niewiarowski S, Kirby EP, Stocker K. Throbocytin-a novel platelet activating enzyme from Bothrops atrox venom. Thromb Res 1977; 10:863.
27. Arnout J, Meijer P, Vermylen J. Lupus anticoagulant testing in Europe: an analysis of results from the first European Concerted Action on Thrombophilia (ECAT) survey using plasmas spiked with monoclonal antibodies against human beta2- glycoprotein I. Thromb Haemost 1999; 81:929.
28. Favaloro EJ. The Russell viper venom time (RVVT) test for investigation of lupus anticoagulant (LA). Am J Hematol 2019; 94:1290.
29. Potgieter JJ, Damgaard M, Hillarp A. One-stage vs. chromogenic assays in haemophilia A. Eur J Haematol 2015; 94 Suppl 77:38.
30. Kitchen S, Kershaw G, Tiefenbacher S. Recombinant to modified factor VIII and factor IX – chromogenic and one-stage assays issues. Haemophilia 2016; 22 Suppl 5:72.
31. Weitz JI, Fredenburgh JC, Eikelboom JW. A Test in Context: D-Dimer. J Am Coll Cardiol 2017; 70:2411.
32. Perry DJ, Fitzmaurice DA, Kitchen S, et al. Point-of-care testing in haemostasis.
Br J Haematol 2010; 150:501.
33. Teien AN, Lie M. Evaluation of an amidolytic heparin assay method: increased sensitivity by adding purified antithrombin III. Thromb Res 1977; 10:399.
34. Welsby IJ, McDonnell E, El-Moalem H, et al. Activated clotting time systems vary in precision and bias and are not interchangeable when following heparin management protocols during cardiopulmonary bypass. J Clin Monit Comput 2002; 17:287.
35. Furuhashi M, Ura N, Hasegawa K, et al. Sonoclot coagulation analysis: new bedside monitoring for determination of the appropriate heparin dose during haemodialysis. Nephrol Dial Transplant 2002; 17:1457.
36. Hirsh J, Warkentin TE, Raschke R, et al. Heparin and low-molecular-weight heparin: mechanisms of action, pharmacokinetics, dosing considerations, monitoring, efficacy, and safety. Chest 1998; 114:489S.
37. Nowak G. The ecarin clotting time, a universal method to quantify direct thrombin inhibitors. Pathophysiol Haemost Thromb 2003; 33:173.
38. Gosselin RC, King JH, Janatpour KA, et al. Comparing direct thrombin inhibitors using aPTT, ecarin clotting times, and thrombin inhibitor management testing. Ann Pharmacother 2004; 38:1383.
39. Fenyvesi T, Jörg I, Harenberg J. Monitoring of anticoagulant effects of direct thrombin inhibitors. Semin Thromb Hemost 2002; 28:361.
40. Salmela B, Joutsi-Korhonen L, Saarela E, Lassila R. Comparison of monitoring methods for lepirudin: impact of warfarin and lupus anticoagulant. Thromb Res 2010; 125:538.
41. van Rossum AP, Vlasveld LT, van den Hoven LJ, et al. False prolongation of the activated partial thromboplastin time (aPTT) in inflammatory patients: interference of C-reactive protein. Br J Haematol 2012; 157:394.
42. Devreese KM, Verfaillie CJ, De Bisschop F, Delanghe JR. Interference of C- reactive protein with clotting times. Clin Chem Lab Med 2015; 53:e141.
43. Lossing TS, Kasper CK, Feinstein DI. Detection of factor VIII inhibitors with the partial thromboplastin time. Blood 1977; 49:793.
44. el-Sayed MS. Effects of exercise on blood coagulation, fibrinolysis and platelet aggregation. Sports Med 1996; 22:282.
45. Ogasawara M, Aoki K, Katano K, et al. Activated partial thromboplastin time is a predictive parameter for further miscarriages in cases of recurrent fetal loss. Fertil Steril 1998; 70:1081.
46. Landi G, D’Angelo A, Boccardi E, et al. Venous thromboembolism in acute stroke.
Prognostic importance of hypercoagulability. Arch Neurol 1992; 49:279.
47. Reddy NM, Hall SW, MacKintosh FR. Partial thromboplastin time: prediction of adverse events and poor prognosis by low abnormal values. Arch Intern Med 1999; 159:2706.
48. Tripodi A, Chantarangkul V, Martinelli I, et al. A shortened activated partial thromboplastin time is associated with the risk of venous thromboembolism. Blood 2004; 104:3631.
49. Aboud MR, Ma DD. Increased incidence of venous thrombosis in patients with shortened activated partial thromboplastin times and low ratios for activated protein C resistance. Clin Lab Haematol 2001; 23:411.
50. Hron G, Eichinger S, Weltermann A, et al. Prediction of recurrent venous thromboembolism by the activated partial thromboplastin time. J Thromb Haemost 2006; 4:752.
51. Zakai NA, Ohira T, White R, et al. Activated partial thromboplastin time and risk of future venous thromboembolism. Am J Med 2008; 121:231.
52. Baccarelli A, Martinelli I, Zanobetti A, et al. Exposure to particulate air pollution and risk of deep vein thrombosis. Arch Intern Med 2008; 168:920.
53. Walenga JM, Fasanella AR, Iqbal O, et al. Coagulation laboratory testing in patients treated with argatroban. Semin Thromb Hemost 1999; 25 Suppl 1:61.