Bài viết Thông khí cơ học bảo vệ trong lúc phẫu thuật để dự phòng các biến chứng phổi hậu phẫu được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Intraoperative protective mechanical ventilation for prevention of postoperative pulmonary complications: a comprehensive review of the role of tidal volume, positive end-expiratory pressure, and lung recruitment maneuvers
TÓM TẮT
Các biến chứng phổi sau phẫu thuật liên quan đến tăng tần suất bệnh, tăng thời gian nằm viện và tăng tỉ lệ tử vong sau phẫu thuật lớn. Thông khí cơ học bảo vệ phổi trong phẫu thuật có khả năng làm giảm tỉ lệ các biến chứng phổi sau phẫu thuật. Review này thảo luận các tài liệu liên quan về định nghĩa và phương pháp dự đoán sự xuất hiện của biến chứng phổi sau phẫu thuật, sinh lý bệnh học của tổn thương phổi do thở máy, nhấn mạnh vào phổi không bị tổn thương và các chiến lược thông khí bảo vệ, bao gồm vai trò tương ứng của thể tích khí lưu thông, PEEP, và các thủ thuật huy động phế nang. Các tác giả đề xuất một protocol cho việc thông khí bảo vệ phổi dựa trên bằng chứng từ các thử nghiệm đối chứng ngẫu nhiên gần đây.
DẪN NHẬP
Các biến chứng phổi sau phẫu thuật (PPC, postoperative pulmonary complications) có thể có tác động quan trọng đến bệnh suất và tử vong của bệnh nhân cần phẫu thuật lớn. [1] Khoảng 5% bệnh nhân trải qua phẫu thuật tổng quát sẽ bị PPCs, và 1/5 bệnh nhân bị PPCs sẽ chết trong vòng 30 ngày sau khi phẫu thuật. [1] Hơn nữa, PPCs có liên quan chặt chẽ đến thời gian nằm viện sau phẫu thuật và tử vong ngắn hạn và dài hạn. [1,2]
Có nhiều bằng chứng cho thấy việc thông khí cơ học bảo vệ trong phẫu thuật bằng cách sử dụng thể tích khí lưu thông (VT) thấp, có hoặc không có PEEP cao và thủ thuật huy động phế nang (RM, recruitment maneuvers) ngăn ngừa PPCs tốt hơn so với thông khí cơ học có VT cao và mức PEEP thấp mà không có RM. [3-6]
Trong bài báo này, chúng tôi xem xét định nghĩa và phương pháp để dự đoán PPC, sinh lý bệnh tổn thương phổi do thở máy (VILI) nhấn mạnh vào phổi không bị tổn thương và các chiến lược thông khí để giảm thiểu PPC.
Để xác định những bằng chứng mới nhất từ tài liệu về các thử nghiệm ngẫu nhiên có đối chứng (RCTs) về thông khí bảo vệ trong phẫu thuật và các kết cục lâm sàng cũng như không lâm sàng sau phẫu thuật, chúng tôi đã tiến hành tìm kiếm trên MEDLINE bằng các thuật ngữ tìm kiếm dưới đây: “lower tidal volume” OR “low tidal volume” OR “protective ventilation” OR “recruitment maneuvers” OR “PEEP” OR “positive end expiratory pressure.” Các bài báo đã lấy được và các nghiên cứu chéo tham chiếu từ những bài báo này đã được sàng lọc cho các thông tin thích hợp.
ĐỊNH NGHĨA VÀ DỰ ĐOÁN PPC
Tổng hợp các định nghĩa PPC
Các biến chứng phổi sau phẫu thuật (PPC) thường được trình bày dưới dạng kết hợp, bao gồm các sự kiện hô hấp có thể không tử vong hoặc tử vong, mới xuất hiện trong giai đoạn hậu phẫu. Hiện tại, chưa có sự đồng ý về những sự kiện nào nên được coi là PPC, ví dụ như suy hô hấp, chấn thương phổi, viêm phổi, thở máy hoặc đặt ống nội khí quản thời gian kéo dài hoặc không giải thích được, giảm ôxy máu, xẹp phổi, co thắt phế quản, tràn dịch màng phổi, tràn khí màng phổi, ức chế hô hấp, và viêm phổi do hít. [7,8]
Từ góc độ lâm sàng, cần trình bày PPC như là một sự kết hợp bởi vì bất kỳ sự kiện nào trong số này hoặc đơn thuần hoặc sự liên kết giữa chúng có ảnh hưởng đáng kể đến kết cục sau phẫu thuật [1]. Tuy nhiên, rõ ràng là những sự kiện này có thể có các cơ chế bệnh sinh học khác nhau. Vì lý do này, một số nghiên cứu đã tập trung vào các sự kiện đơn lẻ, chủ yếu là suy hô hấp [9] và viêm phổi. [10]
Các biến chứng phổi sau phẫu thuật, phải liên quan đến gây mê và/hoặc phẫu thuật. Hơn nữa, khung thời gian phải được xác định rõ ràng. Thông thường, một sự kiện chỉ được coi là PPC nếu nó biểu hiện trong vòng 5 đến 7 ngày sau khi phẫu thuật. [8,11]
Dự đoán PPC
Dự đoán về PPC, hoặc bất kỳ sự kiện hô hấp sau phẫu thuật nào là một phần của kết hợp đó, có thể hữu ích trong việc lên kế hoạch cho các chiến lược trước khi phẫu thuật nhằm phòng ngừa và giảm chi phí cho hệ thống y tế. [12]
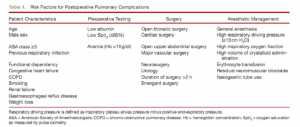
Trước tiên, phải xác định được các yếu tố nguy cơ liên quan đến sự phát triển của PPC. Năm 2006, Trường Cao đẳng Y khoa Hoa Kỳ công bố một bài tổng quan có hệ thống về tài liệu liệt kê một số yếu tố nguy cơ đối với các PPC theo mức độ bằng chứng tương ứng. [13]
Trong những năm gần đây, danh sách đó đã được mở rộng để bao gồm các yếu tố khác làm tăng nguy cơ PPC. Bảng 1 mô tả các yếu tố nguy cơ liên quan đến PPC theo tài liệu hiện tại. Khoảng 50% các yếu tố nguy cơ cho PPC là do điều kiện sức khoẻ của bệnh nhân, trong khi 50% khác có liên quan đến thủ thuật phẫu thuật và xử trí gây mê. [1]
Dựa vào các yếu tố nguy cơ, các điểm khác nhau đã được phát triển có khả năng dự đoán sự xuất hiện của các PPC [6,14-16] như thể hiện trong bảng 2. Tuy nhiên, tính khả dụng của chúng có thể bị giới hạn bởi vì chúng được bắt nguồn từ các thiết lập hạn chế [16], cơ sở dữ liệu hồi cứu [15], hoặc chỉ xác nhận cho các PPC cụ thể. [6,14] (xin xem bảng 2 trong bài gốc)
Đánh giá các triệu chứng hô hấp trong các bệnh nhân phẫu thuật trong nghiên cứu The Assess Respiratory RIsk in Surgical Patients in CATalonia (ARISCAT) được tiến hành trong một quần thể phẫu thuật tổng quát của Catalonia, Tây Ban Nha [1]. Sau khi phân tích đa biến, một điểm số dựa trên bảy yếu tố nguy cơ đã được phát triển và được xác nhận nội bộ, cho thấy một khả năng tiên đoán có liên quan lâm sàng (c-thống kê, 0.90). Gần đây, điểm số ARISCAT được xác nhận bên ngoài trong một mô hình phẫu thuật lớn của châu Âu (the Prospective Evaluation of a RIsk Score for Postoperative Pulmonary COmPlications in Europe study, PERSPPCOPE). [2]
Mặc dù sự khác biệt trong việc thực hiện điểm ARISCAT đã được quan sát thấy giữa các khu vực địa lý Châu Âu, điểm số này có thể phân biệt ba cấp độ rủi ro PPCs (thấp, trung bình và cao). Như vậy, hiện nay, điểm ARISCAT có thể là công cụ có giá trị nhất để dự đoán PPC ở các quốc gia khác nhau và các nhóm phẫu thuật.
Các cơ chế gây VILI
Sự tồn tại của các vùng phế nang đóng, có thể huy động và sẳn sàng có thể bị quá căng làm cho phổi dễ bị tổn thương do các ảnh hưởng bất lợi của stress và strain cơ học do thở máy gây ra. [19,20] Các lực vật lý ở một số vùng phế nang có thể vượt quá các đặc tính đàn hồi của phổi mặc dù các phép đo tổng thể áp lực đường thở hoặc cơ học phổi như thường được theo dõi dưới gây mê vẫn cho thấy thông khí cơ học ở khu vực “an toàn”. [21,22] Một vài cơ chế đã được đưa ra để mô tả sự phát triển của VILI. [23]
Tăng áp lực đường thở (barotrauma) hoặc thể tích khí lưu thông cao (volutrauma) có thể gây tổn hại hoặc làm gián đoạn các tế bào biểu mô phế nang, gây ra do áp lực xuyên phổi vượt quá các đặc tính đàn hồi của nhu mô phổi so với thể tích nghỉ ngơi của nó (strain). [24,25] Đặc biệt khi có xẹp phổi (atelectasis), thông khí cơ học có thể gây ra tổn thương do các đơn vị phế nang xẹp và mở lặp đi lặp lại, hiện tượng này được gọi là atelectrauma. [27] Tất cả ba cơ chế đó, cụ thể là barotrauma, volutrauma, và atelectrauma, có thể ảnh hưởng đến phế nang như các tế bào biểu mô và nội mô mạch máu [28,29] và thúc đẩy vỡ matrix ngoài tế bào. [30,31]
Matrix ngoại bào của nhu mô phổi dường như đặc biệt nhạy cảm với stress từ thở máy, như minh họa trong hình 1. Ban đầu, các proteoglycans ở trên tế bào nội mô và giữa các tế bào nội mô và tế bào biểu mô bị tổn hại phụ thuộc vào thể tích khí lưu thông [30] cũng như kiểu thở. [31]
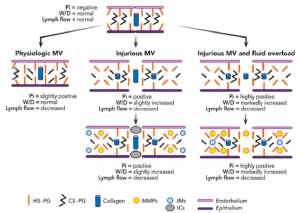
Các mảnh vỡ cơ học của matrix ngoại bào thúc đẩy phù mô kẽ và hoạt hóa metalloproteinase, tự nó làm tổn hại thêm matrix ngoại bào. Trong bước thứ hai, các mảnh vỡ của matrix ngoại bào có thể thúc đẩy hoạt động của các chất trung gian gây viêm. [32,33]
Hơn nữa, tổn hại của matrix ngoại bào gây ra bởi sự thông khí cơ học có thể bị trầm trọng hơn do quá tải dịch, điều này không phải là hiếm khi gây mê tổng quát. Tuy nhiên, tình trạng quá tải dịch dường như làm giảm phản ứng viêm, có thể bằng cách pha loãng các mảnh matrix ngoại bào hoặc thay đổi cấu trúc, do đó làm giảm phản ứng viêm tại chỗ. [34]
Điều này cho thấy (1) thông khí cơ học gây cho phổi dễ bị nhạy cảm hơn với tổn thương; và (2) ở phổi lành mạnh trước, VILI có thể được gây ra mà không tăng sớm các chất trung gian gây viêm.
Ở cấp độ tế bào, các kích thích vật lý được biến đổi thành các tín hiệu hóa học, ví dụ như các chất trung gian tiền viêm và kháng viêm do tổn thương tế bào trực tiếp hoặc gián tiếp kích hoạt các con đường tín hiệu tế bào. Quá trình này được gọi là “mechanotransduction”. [35]
Một số chất trung gian có thể thúc đẩy các tác động tại chỗ như tác động chết tế bào hoặc xơ hóa, trong khi một số khác lại hoạt động như các phân tử huy động tế bào miễn dịch ở tại chổ và từ xa (ví dụ, bạch cầu đa nhân trung tính và đại thực bào). [36] Các tác động tại chổ cũng như hậu quả miễn dịch của nó được tóm tắt bằng thuật ngữ “biotrauma”. [37]
Bên cạnh matrix ngoại bào, cả hai phần nội mạc và biểu mô của đơn vị mao mạch-phế nang đều bị ảnh hưởng bởi “stress and strain” có nguồn gốc từ thông khí cơ học. Trong tế bào nội mạc, stress cao có thể dẫn đến sự phá vỡ tế bào trực tiếp, dẫn đến “capillary stress failure”. [38,39]
Hơn nữa, stress cơ học cũng như các kích thích viêm (tức là tumor necrosis factor-α) có thể gây ra co thắt của khung tế bào, [40] gây gián đoạn các nút nối kết, [41] làm tăng tính thấm thấm nội mô và góp phần tạo thành phù nề. Tương tự với tế bào nội mô phổi, “stress and strain” cơ học làm tăng tính thẩm thấu của biểu mô phế nang, [42] một hiện tượng được tìm thấy trong quá trình thông khí ở thể tích phổi cao [43] và thể tích phổi thấp [44]. Ngoài ra, thông khí thể tích phổi thấp có thể dẫn đến xẹp và mở phổi lặp đi lặp lại, ảnh hưởng đến tế bào biểu mô đường hô hấp nhỏ, làm hỏng màng tế bào, [45] và hoại tử và sưng nề tế bào biểu bì. [46]
Sự thanh thải dịch phế nang rất cần thiết để duy trì cân bằng môi trường phế nang, thường bị tổn thương trong suốt quá trình VILI. Trong khi đó, thông khí với thể tích khí lưu thông cao trực tiếp làm giảm hoạt tính của Na+/K+ adenosine triphosphatase, [47] thông khí ở thể tích phổi thấp có thể gián tiếp làm giảm độ thanh thải của chất lỏng do tình trạng giảm oxy mô sau khi xẹp phế nang tăng lên. [48]
Sự suy giảm chức năng rào cản của tế bào nội mô và biểu mô, cũng như sự thanh thải dịch, dẫn đến sự phát triển của phù kẽ và phế nang, sau đó gây rối loạn chức năng surfactant, và làm suy giảm tính đàn hồi và tính đề kháng của phổi. [49] Sự rối loạn chức năng surfactant làm cho phổi dễ bị xẹp phế nang góp phần làm tồi tệ thêm cơ học phổi và làm giảm khả năng đề kháng của phổi. [50]
Mặc dù hầu hết các bằng chứng về sự thay đổi cấu trúc cơ bản của nội mô và biểu mô gây ra bởi sự thông khí cơ học bắt nguồn từ việc thăm dò in vitro tế bào nuôi cấy hoặc in vivo trong các mô hình tổn thương phổi cấp tính, [51] thông khí áp dụng liên quan đến lâm sàng trong phổi không bị tổn thương có thể ảnh hưởng đến chức năng hàng rào phế nang – mao mạch, đặc biệt là ở sự hiện diện của các chất kích hoạt gây viêm độc lập, làm cho thông khí cơ học trở nên mạnh mẽ khi có hiện tượng viêm hệ thống. [29] Do tính toàn vẹn bị xáo trộn của chức năng hàng rào phế nang – mao mạch và sự chuyển vị hệ thống của các mầm bệnh hoặc các chất trung gian gây viêm, VILI có thể dẫn đến đáp ứng viêm toàn thân ảnh hưởng không chỉ đến phổi mà còn từ các cơ quan xa. [52]
Sự không đồng nhất của phổi, ví dụ, do xẹp phổi, là một nhân tố chính gây ra VILI. Tuy nhiên, hầu hết các bằng chứng thực nghiệm đều bắt nguồn từ mô hình tổn thương phổi cấp tính. Mặc dù các cơ chế sinh bệnh cơ bản của chúng có thể tương tự nhau, nhưng cường độ và thời gian của sự hình thành xẹp phổi trong tổn thương phổi cấp tính có thể rất khác so với xẹp phổi xảy ra trong khi gây mê và thở máy trong thời gian ngắn. Sự tái hấp thu khí phế nang [53,54] và sự nén các cấu trúc phổi [55-58] có thể dẫn đến xẹp phổi trong thở máy ngắn trong phổi không bị tổn thương.
Trong mô hình viêm phổi thực nghiệm trên lợn, việc sử dụng surfactant ngoại sinh và thông khí theo phương pháp phổi mở làm giảm sự phát triển và sự dịch chuyển hệ thống của vi khuẩn bằng cách giảm thiểu xẹp phế nang và sự hình thành xẹp phổi. [59] Trong một mô hình thí nghiệm tương tự về viêm phổi thực nghiệm ở heo con thông khí cơ học, sự dịch chuyển của vi khuẩn thấp nhất với mức PEEP riêng biệt được điều chỉnh theo cá nhân, trong khi PEEP thấp và cao thúc đẩy sự dịch chuyển của vi khuẩn. [60] Ở phổi của chuột không tưới máu, cả 2 chiến lược “phổi mở” (thể tích khí lưu thông 6 ml/kg, thủ thuật mở phổi, và PEEP từ 14 đến 16 cm H2O) và “phổi nghỉ ngơi” (thể tích khí lưu thông là 6 ml/kg, PEEP từ 8 đến 10 cm H2O, và không mở phổi) liên quan đến đáp ứng viêm phổi giảm và cải thiện cơ học hô hấp so với thông khí cơ học gây tổn thương (thể tích khí lưu thông 20 ml/kg và PEEP 0 cm H2O). [61] Điều thú vị là chiến lược “phổi nghỉ ngơi” liên quan đến việc giảm apoptosis hơn nhưng tổn thương siêu cấu trúc tế bào nhiều hơn, có thể là do sự hoạt hóa của protein kinase – mitogen tăng lên so với “chiến lược phổi mở” [61]
Ở những con chuột khỏe mạnh, thông khí cơ học với thể tích khí lưu thông là 8 ml/kg và PEEP ở 4 cm H2O đã làm tăng cytokines huyết tương và mô phổi cũng như tăng dòng bạch cầu, nhưng sự toàn vẹn của mô phổi đã được bảo tồn. [62] Trong một cuộc điều tra khác, các thiết lập máy thở có hại ít nhất là gây ra VILI khi không có tổn thương ở phổi trước đây ở chuột. [63] Lưu ý, các ảnh hưởng có hại của thông khí cơ học trong phổi không tổn thương một phần phụ thuộc vào thời gian của nó. Tuy nhiên, một nghiên cứu thực nghiệm chứng minh rằng thể tích khí lưu thông lớn chỉ có những tác động có hại trên phổi ít, mặc dù thông khí cơ học kéo dài. [25] Có thể, điều này được giải thích là do thiếu tổn thương phổi trước đây, ví dụ như phẫu thuật. Trên thực tế, viêm hệ thống có thể làm cho phổi bị tổn thương bằng cách thở máy. [65]
CHIẾN LƯỢC THÔNG KHÍ CƠ HỌC BẢO VỆ TRONG THỜI GIAN PHẪU THUẬT
Xẹp phổi và thở máy bảo vệ trong khi phẫu thuật
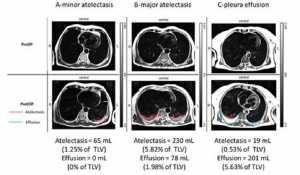
Xẹp phổi biệu hiện đến 90% bệnh nhân được gây mê tổng quát [66] và có thể tồn tại ở mức độ khác nhau sau khi phẫu thuật, cũng như tràn dịch màng phổi, như được minh họa trong hình 2. Khu vực mô phổi không thông khí sát gần cơ hoành thay đổi tùy thuộc vào tiến trình phẫu thuật và đặc điểm của bệnh nhân nhưng ước lượng trong khoảng từ 3-6% [67-69] đến 20-25% [66] và thậm chí còn cao hơn nếu tính toán theo số lượng mô.
Các cơ chế khác nhau đã được đưa ra, tạo thuận lợi cho sự hình thành xẹp phổi khi gây mê, bao gồm (1) sự xẹp của đường thở nhỏ, [70-72] (2) đè ép cấu trúc phổi, [55-58] (3) hấp thu dung tích khí trong phế nang, [54] và (4) suy giảm chức năng surfactant phổi. [73].
Chiến lược thông khí cơ học cho gây mê tổng quát đã bị ảnh hưởng quan trọng bởi sự giảm oxy hóa và độ giãn nở phổi. [74] Thể tích khí lưu thông lên đến 15 ml/kg trọng lượng cơ thể dự đoán đã được ủng hộ để tăng thể tích phổi cuối kỳ thở ra (EELV) và chống lại xẹp phổi trong thời gian phẫu thuật. [74] Nếu không có chống chỉ định, PEEP và thủ thuật mở phổi cũng có thể góp phần làm phục hồi lại hoặc ngăn ngừa sự mất EELV và đóng các đường thở nhỏ trong khi gây mê.
Thể tích khí lưu thông đối với thở máy bảo vệ trong khi phẫu thuật
Theo các nghiên cứu lâm sàng và thực nghiệm, thể tích khí lưu thông trong quá trình thở máy đã giảm đáng kể ở những bệnh nhân bị hội chứng suy hô hấp cấp tính (ARDS) để hạn chế sự quá căng phổi. [75] Phương pháp này áp dụng ở bệnh nhân ICU, xu hướng tương tự đã được quan sát thấy trong phòng phẫu thuật. Theo báo cáo của các nhà điều tra khác nhau, [76,77] thể tích khí lưu thông trung bình trong khoảng từ 6 đến 9 ml/kg trọng lượng cơ thể dự đoán đã được chấp nhận rộng rãi đối với phổi không bị thương, mặc dù thực nghiệm [25,78] và dữ liệu lâm sàng từ [79-81] cho thấy rằng các giá trị cao hơn không liên quan đến sự gia tăng tổn thương phổi hoặc viêm.
Hơn nữa, các chuyên gia gây mê đã giảm thể tích khí lưu thông một cách liên tục cũng như trong thông khí một phổi. Trong khi các nghiên cứu thực nghiệm, [82,83] và lâm sàng [84-87] đã cho thấy rằng thể tích khí lưu thông khoảng 4 đến 5 ml/kg có thể thích hợp hơn để bảo vệ phổi, trong khi đó vẫn cho phép trao đổi khí đầy đủ. Hơn nữa, một RCT nhỏ cho thấy sự xẹp phổi không gia tăng đáng kể với thể tích khí lưu thông thấp mà không có PEEP từ khi bắt đầu gây mê cho tới khi kết thúc phẫu thuật. [67] Điều này cũng được hỗ trợ bởi thực tế là thông khí cơ học có thể tích khí lưu thông thấp và PEEP không làm xấu đi compliance hệ thống hô hấp và trao đổi khí trong quá trình phẫu thuật mở bụng trong một RCT lớn hơn. [88] Cần phải lưu ý rằng thể tích khí lưu thông “thiết lập” và “thực tế” có thể khác biệt đáng kể [89] và các điều kiện đó phải được điều chỉnh một cách thận trọng.
PEEP đối với thở máy bảo vệ trong khi phẫu thuật
Các nghiên cứu lâm sàng cho thấy một PEEP 10 cm H2O là cần thiết để giảm hoặc loại bỏ xẹp phổi, [69,90,91] cải thiện compliance mà không làm tăng khoảng chết, [92,93] và duy trì EELV trong suốt thời gian gây mê toàn thân ở cả bệnh nhân không béo phì và béo phì. [94] Một nghiên cứu khác ở các đối tượng bình thường cho thấy rằng PEEP 10 cm H2O tăng khối lượng phổi nhưng không cải thiện chức năng hô hấp so với PEEP 0 cm H2O. [56]
Chắc chắn, mức PEEP nên được lựa chọn theo đặc điểm đặc biệt của bệnh nhân, đặc điểm của phẫu thuật và tư thế bệnh nhân. Một số mục tiêu đã được đề xuất việc điều chỉnh PEEP cho từng cá nhân khi gây mê tổng quát, bao gồm: (1) oxy hóa, [95] cũng kết hợp với khoảng chết [92] hoặc EELV, [93] (2) tính chất cơ học của hệ hô hấp, [96] và (3) phân phối thông khí bằng chụp cắt lớp điện trở kháng (electric impedance tomography). [97,98] Tuy nhiên, không có thông số nào trong số này giúp cải thiện kết quả bệnh nhân.
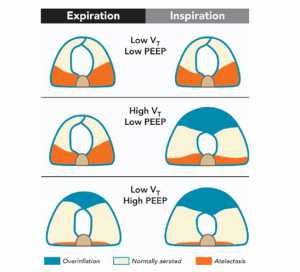
Mặc dù gây nhiều tranh cãi, một cách tiếp cận thay thế cho PEEP trong gây mê toàn thân là “xẹp phổi cho phép trong phẫu thuật”, khi PEEP được giữ ở mức tương đối thấp và không sử dụng thủ thuật mở phổi. Khái niệm này nhằm mục đích làm giảm stress tĩnh ở phổi, có liên quan chặt chẽ đến áp lực đường thở trung bình, giả định rằng mô phổi bị xẹp được bảo vệ chống lại các tổn thương từ thông khí cơ học (hình 3). “Xẹp phổi cho phép trong phẫu thuật” có thể bị giới hạn bởi sự xấu đi của oxy hóa, điều này có thể đòi hỏi tăng nồng độ oxy cao hơn. Ngoài ra, áp lực cắt (shear stress) có thể xảy ra ở giao diện giữa mô xẹp và mô mở, [20] có thể dẫn tới tổn thương phổi và viêm, thâm chí có thể xảy ra ở mức stress toàn phần thấp. [99]
Về mặt lý thuyết, PEEP thấp trong phẫu thuật có thể làm tăng tỷ lệ và số lượng xẹp phổi ngay cả trong giai đoạn hậu phẫu, kết quả là có thêm PPC. Nghiên cứu hồi cứu gần đây gần đây cho thấy việc sử dụng PEEP “tối thiểu” (2,2 đến 5 cm H2O) kết hợp với thể tích khí lưu thông thấp (6-8 ml/kg) có liên quan đến nguy cơ gia tăng tử vong ngày 30. [79]
Tuy nhiên, một RCT đa quốc gia lớn đã thách thức khái niệm PEEP “tối thiểu” kết hợp với thể tích khí lưu thông thấp trong thời gian phẫu thuật là có hại. [88] Cũng như ở những bệnh nhân lớn tuổi đang trải qua cuộc phẫu thuật mở bụng lớn, một chiến lược bao gồm thể tích khí lưu thông thấp, PEEP 12 cm H2O và thủ thuật mở phổi đã làm tăng PaO2 trong thời gian mổ so với chiến lược có thể tích khí lưu thông cao mà không có PEEP, nhưng hiệu quả này không được duy trì ở giai đoạn hậu phẫu. [100]
Ngay cả khi không thực hiện thủ thuật mở phổi, PEEP đã cải thiện oxy hóa trong phẫu thuật vùng bụng trên so với không đặt PEEP, nhưng một lần nữa ảnh hưởng như vậy đã được giới hạn trong thời gian phẫu thuật và không ngăn ngừa các biến chứng sau phẫu thuật. [101]
Thủ thuật mở phổi đối với thở máy bảo vệ trong khi phẫu thuật
PEEP là cách hiệu quả nhất để bảo vệ chức năng hô hấp nếu trước đó thực hiện thủ thuật mở phổi, vượt qua áp lực mở lên đến 40 cm H2O trong người không béo phì [102] và 40 – 50 cm H2O ở bệnh nhân béo phì, [103] trong trường hợp không có tổn thương phổi. Thủ thuật mở phổi có thể được thực hiện theo nhiều cách khác nhau bằng cách sử dụng máy gây mê, như được minh họa trong hình 4.
Thông thường nhất, những động tác này được thực hiện bằng cách “bóp giữ túi gây mê” bằng van giới hạn áp lực đường thở của máy gây mê (Hình 4A). Tuy nhiên, thủ thuật mở phổi được kiểm soát tốt hơn nếu được thực hiện trong quá trình thông khí, ví dụ như sử dụng tăng PEEP theo từng bước, hoặc tăng thể tích khí lưu thông, hoặc kết hợp cả hai (hình 4B). Với điều kiện không có chống chỉ định, áp lực áp lực cao tới 40 cm H2O có thể dẫn đến việc huy động phế nang đầy đủ. [104]
Trong các thiết bị gây mê cho phép thông khí kiểm soát áp lực, thủ thuật mở phổi có thể được thực hiện với áp lực không đổi từ 15 đến 20 cm H2O và bằng cách tăng PEEP lên đến 20 cm H2O theo từng bước 5 cm H2O (30 – 60 giây cho mỗi bước). Sau ba đến năm lần thở ở mức PEEP cho phép đạt được áp lực hít vào mục tiêu, PEEP và thể tích khí lưu thông được điều chỉnh đến mức mong muốn tương ứng (hình 4C).
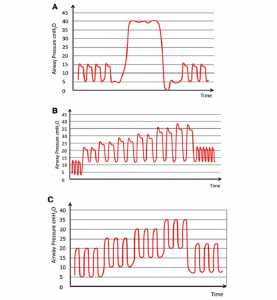
”Minh họa sự dao động áp lực của áp lực đường thở trong ba kiểu thủ thuật mở phổi để thông khí cơ học trong phẫu thuật (đường màu đỏ). (A) “Bóp giữ bóng gây mê” bằng van giới hạn áp lực đường thở của máy gây mê. Áp lực đường thở khó kiểm soát, có thể dẫn đến áp lực quá cao, có nguy cơ bị barotrauma, hoặc các giá trị thấp hơn áp suất đóng của đường thở nhỏ khi tiếp tục thông khí kiểm soát gây ra tái xẹp phổi. (B) “Tăng dần thể tích khí lưu thông” trong thông khí kiểm soát thể tích thể tích. PEEP được đặt ở 12 cm H2O, tần số thở từ 6 đến 8 lần/phút, và thể tích khí lưu thông tăng từ 8 ml/kg mỗi bước 4 ml/kg cho đến khi đạt áp lực mở mục tiêu (ví dụ, 30 – 40 cm H2O). Sau 3-5 nhịp thở ở áp lực đó, PEEP được giữ ở 12 cm H2O, thể tích khí lưu thông giảm xuống còn 6 đến 8 ml/kg, và tần số thở được điều chỉnh theo normocapnia. (C) Tăng PEEP dần từng bước và áp lực đẩy không đổi từ 15 đến 20 cm H2O trong thông khí kiểm soát áp lực. PEEP được gia tăng theo bước 5 cm H2O (30 đến 60 giây trên mỗi bước) lên đến 20 cm H2O. Sau 3-5 nhịp thở ở mức PEEP cho phép đạt được áp lực hít vào mục tiêu, PEEP và thể tích khí lưu thông được điều chỉnh theo mức mong muốn tương ứng.”
BẰNG CHỨNG MỚI ĐÂY VỀ THÔNG KHÍ BẢO VỆ TRONG LÚC PHẪU THUẬT
Nghiên cứu thử nghiệm ngẫu nhiên có kết quả chính không phải lâm sàng
Tìm kiếm tài liệu đã xác định được 11 RCTs so sánh chiến lược thông khí bảo vệ với chiến lược thông khí không bảo vệ trong gây mê toàn thân cho phẫu thuật liên quan đến kết quả chính không lâm sàng ở bệnh nhân được phẫu thuật lồng ngực, [80,84,85,105,106] phẫu thuật tim, [95,107,108] phẫu thuật ổ bụng, [80,100,109] hoặc phẫu thuật cột sống, [110] như mô tả trong bảng 3. Trong tám RCTs, chiến lược thông khí bảo vệ bao gồm cả thể tích khí lưu thông thấp hơn và mức PEEP cao hơn [80,85,100,105,107-110]; trong hai RCTs, nó bao gồm cả thể tích triều thấp hơn, [84] mức PEEP cao hơn. [95] Trong một RCT, thủ thuật mở phổi đã được sử dụng trong chiến lược thông khí bảo vệ. [106]
Các ảnh hưởng trên các phản ứng viêm là hơi mâu thuẫn. Mặc dù bốn nghiên cứu RCT cho thấy không có sự khác biệt về mức độ trung gian gây viêm giữa các bệnh nhân nhóm bảo vệ và nhóm không bảo vệ, [80,100,107,110] nhưng sáu RCTs [84,85,95,105,108,109] cho thấy chiến lược bảo vệ có liên quan đến mức độ trung gian gây viêm thấp hơn.
Nghiên cứu thử nghiệm ngẫu nhiên có kết quả chính là lâm sàng
Tổng cộng đã có 8 RCT được so sánh chiến lược thông khí bảo vệ với chiến lược thông khí không bảo vệ trong quá trình phẫu thuật liên quan đến kết cục lâm sàng ở bệnh nhân được lên kế hoạch phẫu thuật ổ bụng, [88.111-113] phẫu thuật lồng ngực, [87,114] phẫu thuật tim, [115] hoặc phẫu thuật cột sống, [116] như trong bảng 4. Trong bốn RCTs, chiến lược bảo vệ bao gồm cả thể tích khí lưu thông thấp hơn và mức PEEP cao hơn, [112-114,116] và trong bốn RCT còn lại, nó bao gồm hoặc thể tích khí lưu thông thấp hơn [87,111,115] hay PEEP cao hơn. [88]
Bốn thử nghiệm báo cáo về PPCs trong những ngày đầu sau phẫu thuật, bao gồm viêm phế quản, giảm ôxy máu, và xẹp phổi, [116] viêm phổi, cần thông khí xâm lấn hoặc không xâm lấn do suy hô hấp cấp, [112] “Điểm số nhiễm trùng phổi lâm sàng” và các bất thường X quang phổi, [113] và thiếu oxy máu, co thắt phế quản, nghi ngờ nhiễm trùng phổi, thâm nhiễm phổi, viêm phổi do hít, phát triển ARDS, xẹp phổi, tràn dịch màng phổi, phù phổi và tràn khí màng phổi. [88]
Trong RCT một trung tâm ở Trung Quốc, [116] đã so sánh thông khí bảo vệ (thể tích khí lưu thông 6 ml/kg và PEEP 10 cm H2O) so với không bảo vệ (thể tích khí lưu thông 10 – 12 ml/kg và PEEP 0 cm H2O) ở 60 bệnh nhân cao tuổi phẫu thuật cột sống. Bn nhận thông khí bảo vệ ít bị PPC hơn.
Trong một thử nghiệm đa trung tâm của Pháp, [112] thông khí bảo vệ (thể tích khí lưu thông 6 – 8 ml/kg và PEEP 6 – 8 cm H2O) được so sánh với thông khí không bảo vệ (thể tích khí lưu thông 10 đến 12 ml/kg và PEEP 0 cm H2O) ở 400 bệnh nhân không béo phì có nguy cơ biến chứng phổi ở mức trung bình đến cao sau phẫu thuật bụng. Kết cục chủ yếu (các biến chứng tại phổi và ngoài phổi) xảy ra ít hơn ở những bệnh nhân được thở máy “bảo vệ”. Những biến chứng như vậy được cho là do phóng thích các chất trung gian gây viêm từ phổi vào tuần hoàn hệ thống, ảnh hưởng đến phổi, [117] và các cơ quan ngoại vi. [52] Những bệnh nhân này có thời gian nằm viện ngắn hơn, nhưng tử vong không bị ảnh hưởng.
Một thử nghiệm một trung tâm ở Ý [113] đã khảo sát hiệu quả của việc thông khí bảo vệ (thể tích khí lưu thông 7 ml/kg và PEEP 10 cm H2O với thủ thuật huy động phế nang) so với thông khí không bảo vệ (thể tích khí lưu thông 9 ml/kg và PEEP = 0) ở 56 bệnh nhân phẫu thuật mở bụng kéo dài hơn 2 giờ. “Điểm số Nhiễm trùng Phổi Lâm Sàng” thấp hơn ở những bệnh nhân được thông khí bảo vệ. Những bệnh nhân này cũng có bất thường X quang phổi ít hơn và oxy hóa động mạch cao hơn so với những bệnh nhân được thở không bảo vệ.
Cuối cùng, chương trình VEntilation Network đã so sánh PEEP với 12 cm H2O kết hợp với thủ thuật mở phổi so với PEEP ở 2 cm H2O không có thủ thuật mở phổi [88] ở 900 bệnh nhân không béo phì có nguy cơ cao PPC dự định phẫu thuật mở bụng dưới sự thông khí với thể tích khí lưu thông là 8 ml/kg. tần suất PPC không khác biệt giữa những bệnh nhân nhận được thông khí bảo vệ và bệnh nhân được thông khí không bảo vệ.
Những thách thức của các nghên cứu sử dụng nguyên gói (Bundle)
Như phần trên đã trình bày các RCT sử dụng các kết quả chính phi lâm sàng và lâm sàng, hầu hết nhắm đến thông khí cơ học trong phẫu thuật so với các nhóm can thiệp bao gồm thể tích khí lưu thông và mức PEEP, kèm theo thủ thuật mở phổi. [112-114,116] Đáng chú ý là thử thuật mở phổi khác nhau giữa các thử nghiệm. Trong RCT ở Ý, [113] người ta sử dụng việc tăng thể tích khí lưu thông cho đến khi áp lực bình nguyên (Pplat) khoảng 30 cm H2O, ngay sau khi gây mê, sau khi bất kỳ khi nào tách khỏi máy thở và ngay trước khi rút ống, giống như ở PROVHILO. [88] Trong thử nghiệm “Intraoperative PROtective Ventilation”, [112] người ta thực hiện CPAP 30 cm H2O trong 30 giây mỗi 30 phút, còn được gọi là “sustained inflation”, sau khi nội khí quản. Cuối cùng, trong RCT ở Trung Quốc, [116] mở phổi theo cách tương tự, nhưng áp lực cao lên đến 35 cm H2O, và thực hiện mỗi 15 phút. Rất khó, nếu không phải là không thể, kết luận từ những thử nghiệm này cái nào tạo ra lợi ích, giảm thể tích khí lưu thông hoặc tăng PEEP hay cả hai, và vai trò của thủ thuật mở phổi. Hơn nữa, thủ thuật mở phổi đã thành công trong việc mở lại phổi đến mức nào chưa được phân tích trong các nghiên cứu khác nhau.
Tuy nhiên, kết quả của thử nghiệm PROVHILO cho thấy rằng thể tích khí lưu thông thấp hơn là PEEP kết hợp với mở phổi có tác dụng bảo vệ phổi trong thời gian mổ. Sự giải thích này cũng được hỗ trợ bởi một phân tích các nghiên cứu khác nhau về tỷ lệ chênh lệch của thể tích khí lưu thông thấp, [87,111,154] mức PEEP cao, [88] và sự kết hợp của 2 yếu tố đó [112-114,116] liên quan đến tần suất của các PPC (hình 5) cũng như một meta-analysis gần đây. [131]
Chắc chắn, những kết luận này chỉ có giá trị đối với dân số được nghiên cứu, đó là, những bệnh nhân không phải là người béo phì có nguy cơ mắc PPCs chịu phẫu thuật nội soi mổ bụng. Các nhóm bệnh nhân khác vẫn có thể hưởng lợi từ mức PEEP cao hơn và thủ thuật mở phổi.
Những thách thức về kết quả của các biện pháp tổng hợp
Kết quả kết hợp các biện pháp có lợi ích là tỷ lệ các sự kiện tăng lên, rất hữu ích để đảm bảo sức mạnh thống kê đầy đủ của một thử nghiệm. [8] Kết hợp hợp lý các kết quả liên quan đến các khía cạnh khác nhau của một quá trình sinh lý, ví dụ như PPC gây ra VILI. Tuy nhiên, có hai hạn chế lớn liên quan đến việc sử dụng các kết quả tổng hợp. Thứ nhất, các biến thành phần có thể khác biệt quan trọng về mức độ nghiêm trọng và tần suất. Thứ hai, sự khác biệt về tần số của các biến thành phần trong một kết quả tổng hợp có thể được che đậy.
Hạn chế của thông khí bảo vệ
Thuật ngữ “bảo vệ” trong hoàn cảnh thông khí cơ học có nghĩa là giảm các thành phần chính của VILI, cụ thể là atelectrauma, volutrauma và biotrauma. Tuy nhiên, một chiến lược bảo vệ phổi cũng có thể gây hại cho các hệ thống cơ quan khác. Khả năng gây tổn hại do thông khí bảo vệ được báo cáo trong thử nghiệm PROVHILO, [88] bệnh nhân nhận PEEP cao và thủ thuật mở phổi phổi đã bị giảm huyết áp trong phẫu thuật thường xuyên hơn và cần nhiều thuốc vận mạch hơn. Những phát hiện này ít nhất một phần là phù hợp với kết luận rằng thông khí bảo vệ có liên quan đến tỷ lệ hạ huyết áp trong phẫu thuật cao hơn trong thử nghiệm ở Pháp. [112]
Tiêu chuẩn chăm sóc so với các cài đặt không bình thường: Các nhóm kiểm soát của các thử nghiệm gần đây có đại diện cho thực hành lâm sàng?
Trong các nghiên cứu lâm sàng về sử dụng thông khí cơ học bảo vệ trong phẫu thuật, chiến lược được sử dụng để điều trị các nhóm đối chứng có thể đóng một vai trò quan trọng khi đưa ra kết luận về thực hành gây mê toàn thân hàng ngày. Meta-analysis cho thấy rằng thể tích khí lưu thông thấp hơn bảo vệ không chỉ trong thở máy kéo dài ở bệnh nhân nặng [118,119] mà còn hữu ích trong thông khí ngắn hạn khi gây mê cho phẫu thuật. [119] Theo đó, các chuyên gia gây mê đã sử dụng thể tích khí lưu thông trung bình khoảng 8 đến 9 ml/kg, và hiếm khi cao hơn 10 ml/kg, [76] cũng như minh họa trong hình 6A. Ngược lại với thực tế này, thể tích khí lưu thông được sử dụng trong các nhóm đối chứng của RCT gần đây là 9 ml/kg [113] đến 12 ml/kg, [112] trừ PROVHILO [88] (hình 6B), sử dụng thể tích khí lưu thông 7 ml/kg cả trong can thiệp và trong nhóm đối chứng. Tương tự, mức PEEP trong nhóm kiểm soát của ba trong số bốn RCT gần đây [112,113,116] đối với thông khí cơ học bảo vệ là thấp hơn nhiều so với tiêu chuẩn chăm sóc tại thời điểm các nghiên cứu tương ứng được thiết kế (Hình 6, C và D). Các dữ kiện trên cho thấy, trong số các RCT quan trọng nhất về thông khí cơ học bảo vệ trong phẫu thuật, chỉ có thử nghiệm PROVHILO đã sử dụng một nhóm kiểm soát sao chép chuẩn về chăm sóc gây mê tại thời điểm nó được tiến hành. Theo đó, thử nghiệm PROVHILO đã đưa ra một câu hỏi chính về thông khí cơ học trong khi gây mê, đó là liệu sự kết hợp của PEEP cao với thủ thuật mở phổi sẽ giúp bảo vệ PPCs. Trong nghiên cứu này, PEEP cao không phải là cá nhân hóa, nhưng dựa trên kết quả trước đó từ chụp cắt lớp [69,90,91] và nghiên cứu sinh lý học. [92,94]
![Hình 5. Odds ratios của biến chứng phổi hậu phẫu của nhóm thông khí “bảo vệ - protective” vs nhóm “không bảo vệ - nonprotective” trong các thử nghiệm so sánh khác biệt về thể tích khí lưu thông đơn thuần, [87,111,115] khác biệt về thể tích khí lưu thông và PEEP, [112–114,116] và khác biệt về PEEP đơn thuần. [88] df = degrees of freedom; M-H = Mantel-Haenszel.](https://www.healcentral.org/wp-content/uploads/2020/11/thong_khi_co_hoc_bao_ve_trong_luc_phau_thuat_de_du_phong_cac_bien_chung_phoi_hau_phau_8-300x172.jpg)
Thông khí cơ học trong phẫu thuật theo các bằng chứng gần đây nhất
Một số review cho thấy rằng thở máy trong phẫu thuật nên bao gồm thể tích khí lưu thông thấp (6- 8 ml/kg), mức PEEP vừa phải (6-8 cm H2O) và định kỳ mở phổi (ví dụ, mỗi 30 phút). [5,123-125]
![Hình 6. Cài đặt thể tích khí lưu thông (VT) (A) và PEEP (C) theo các nghiên cứu quan sta1 trong phòng mổ (Canada, [120] Pháp, [121] và Mỹ [3,76,77,122]); Cài đặt VT (B) và PEEP (D) trong nhóm thông khí “không bảo vệ” (đỏ) và “bảo vệ” (xanh) của 4 RCT (Severgnini et al., [113] Intraoperative PROtective VEntilation trial [IMPROVE], [112] Ge et al.,[116] và PROtective Ventilation using HIgh vs. LOw PEEP [PROVHILO] [88]). PBW = predicted body weight](https://www.healcentral.org/wp-content/uploads/2020/11/thong_khi_co_hoc_bao_ve_trong_luc_phau_thuat_de_du_phong_cac_bien_chung_phoi_hau_phau_9-300x261.jpg)
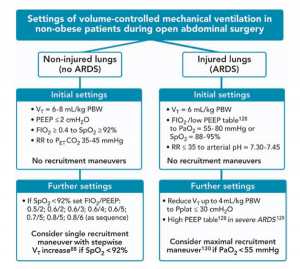
Ở những bệnh nhân không béo phì, không có ARDS [126] phẫu thuật mở bụng, nên thông khí cơ học với thể tích khí lưu thông thấp (xấp xỉ 6 – 8 ml/kg) kết hợp với mức PEEP thấp (≤ 2 cm H2O) bởi vì PEEP cao hơn kết hợp với thủ thuật mở phổi không mang lại sự bảo vệ thêm cho các PPC và có thể làm ảnh hưởng xấu huyết động học. Nếu thiếu oxygen máu diễn tiến và các nguyên nhân khác đã bị loại trừ (ví dụ, hạ huyết áp, giảm thông khí và thuyên tắc mạch phổi), FIO2 nên được tăng lên đầu tiên, tiếp theo là tăng PEEP và thủ thuật huy động phế nang dựa trên sự gia tăng theo từng bước thể tích khí lưu thông trong quá trình thông khí cơ học thông thường, theo lưu đồng xừ trí cứu mạng được mô tả trong thử nghiệm PROVHILO, [88] nếu không có chống chỉ định.
Ở những bệnh nhân ARDS [126] trải qua phẫu thuật mở bụng, nên thông khí cơ học trong phẫu thuật sẽ được hướng dẫn bởi protocol ARDSnet, [127], theo đó các giá trị PEEP cao hơn [128] có thể hữu ích trong ARDS nghiêm trọng hơn. [129] Nếu không đạt được mục tiêu PaO2 (55 đến 80 mmHg) hoặc SpO2 (88 đến 95%) thì có thể xem xét một thủ thuật mở phổi tối đa với một thử nghiệm giảm dần PEEP (để tìm PEEP tối ưu). [130]
Triển vọng tương lai
Mặc dù ngày càng có nhiều RCT chất lượng cao về thông khí cơ học, nhưng một số vấn đề vẫn chưa được giải quyết. Mặc dù các meta-analysis cho thấy thể tích khí lưu thông thấp trong quá trình thở máy trong phẫu thuật “bảo vệ” chống lại các PPC, nhưng không có RCT đơn nào có thể chứng minh được điều này. Bởi vì các meta-analysis trong lĩnh vực này thường bao gồm các nghiên cứu nhóm can thiệp cả “gói”, ví dụ như thể tích khí lưu thông thấp và PEEP cao với các thủ thuật mở phổi so với thể tích khí lưu thông cao mà không có PEEP, việc ước lượng các tác động của các biện pháp đơn lẻ không được công nhận. Do đó, RCTs có liên quan nhất đối với thực hành lâm sàng nếu họ kiểm tra các can thiệp đơn lẻ, và nếu các nhóm đối chứng đưa ra các tiêu chuẩn hiện hành. Trong khi đó, việc thử nghiệm trực tiếp giả thuyết cho thấy rằng thể tích khí lưu thông thấp trong quá trình bảo vệ chống lại các PPC vẫn còn thiếu, các vấn đề đạo đức cản trở việc thử nghiệm như vậy.
Mặc dù có bằng chứng thuyết phục rằng PEEP và thủ thuật huy động phế nang không mang lại sự bảo vệ thêm và thậm chí có thể làm rối loạn huyết động học trong chiến lược thông khí dựa trên thể tích khí lưu thông thấp trong phẫu thuật mở bụng, chúng tôi không biết liệu những bệnh nhân bị béo phì hoặc đang trải qua một quá trình gây mê một phổi có thể hưởng lợi từ những can thiệp đó hay không. Ngoài ra, chúng ta không thể loại trừ khả năng cách chuẩn độ PEEP theo từng cá nhân tùy theo chức năng phổi có thể mang lại kết quả khác nhau. Hơn nữa, vẫn chưa rõ ràng là xẹp phổi sau phẫu thuật, là PPC thường xảy ra nhất, ảnh hưởng đến tần suất của nhiễm trùng phổi và suy hô hấp nghiêm trọng và ảnh hưởng đến các kết cục khác có liên quan, bao gồm thời gian nằm viện và tỉ lệ tử vong.
Ngoài ra, các nghiên cứu tiếp theo cần làm sáng tỏ về những đóng góp tiềm năng của chiến lược thông khí trong quá trình khởi mê và gây mê cấp cứu, cũng như trong các nghiên cứu về thông khí giai đoạn sau mổ (ví dụ, thông khí không xâm lấn). Theo đó, cần phải điều tra khả năng gây ra PPC của các biện pháp không phải thông khí trong thời gian phẫu thuật (ví dụ như dùng thuốc liệt cơ, sử dụng chẹn thần kinh cơ tác dụng ngắn, theo dõi và đảo ngược tình trạng liệt cơ, vận động sớm, và vật lý trị liệu hô hấp) để giảm bớt các PPC. Những nghiên cứu như vậy là cần thiết để hỗ trợ các hướng dẫn trong tương lai về việc thực hiện thông khí cơ học và các biện pháp bổ trợ trong một phạm vi rộng của bệnh nhân cũng như các can thiệp phẫu thuật, cả mở và nội soi.
Kết luận
Khả năng thông khí cơ học bảo vệ phổi trong phẫu thuật để giảm tỷ lệ mắc PPC đã được xác định rõ. RCT đã cho thấy rằng thể tích khí lưu thông thấp, PEEP cao và thủ thuật mở phổi có thể bảo vệ phổi trong phẫu thuật, nhưng vai trò chính xác của từng can thiệp cần được xác định rõ ràng hơn. Một meta-analysis sử dụng số liệu lâm sàng gần đây nhất cho thấy rằng việc sử dụng các thể tích khí lưu thông thấp, chứ không phải là PEEP, hoặc là sự kết hợp của cả hai, là yếu tố quyết định quan trọng nhất để bảo vệ phổi trong quá trình thông khí cơ học. Ở những bệnh nhân không có ARDS đang trải qua phẫu thuật mở bụng, cần thông khí cơ học với thể tích khí lưu thông thấp (xấp xỉ 6 đến 8 ml/ kg) kết hợp với PEEP thấp vì sử dụng PEEP cao hơn kết hợp với thủ thuật mở phổi không đề cao việc bảo vệ chống lại PPC và có thể làm ảnh hưởng xấu huyết động học. Nếu tình trạng thiếu oxy máu nặng thêm, và nếu những nguyên nhân khác đã được loại trừ, ví dụ, hạ huyết áp, hạ huyết áp và tắc mạch phổi, thì FiO2 nên được tăng lên đầu tiên, tiếp theo là tăng PEEP và thủ thuật mở phổi dựa trên sự gia tăng theo từng bước thể tích khí lưu thông trong quá trình thông khí cơ học thường xuyên. Các nghiên cứu tiếp theo được đảm bảo để hướng dẫn thông khí cơ học trong phẫu thuật ra một phạm vi rộng hơn của bệnh nhân và can thiệp phẫu thuật.





