Bài viết Thông khí kiểm soát áp lực với tỉ lệ đảo ngược như một điều trị cứu mạng cho ARDS nặng được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Pressure-controlled inverse ratio ventilation as a rescue therapy for severe acute respiratory distress syndrome
1. Tóm tắt
Mục đích: Thông khí thể tích khí lưu thông thấp cải thiện kết quả của hội chứng suy hô hấp cấp tính (ARDS). Tuy nhiên, không có nghiên cứu nào đã nghiên cứu việc sử dụng liệu pháp cứu hộ liên quan đến thông khí cơ học khi thông khí thể tích khí lưu thông thấp không thể duy trì cân bằng nội môi. Tỷ lệ nghịch đảo (IRV) là một ứng cử viên cho liệu pháp cứu hộ như vậy, nhưng vai trò và tác dụng của IRV như một liệu pháp cứu hộ vẫn chưa được biết.
Phương pháp: Chúng tôi tiến hành đánh giá hồi cứu bệnh nhân ARDS đã nhận IRV tại bệnh viện của chúng tôi từ tháng 1 năm 2007 đến tháng 5 năm 2014. Dữ liệu trao đổi khí, thông khí và kết quả được thu thập và phân tích.
Kết quả: IRV với kiểm soát áp lực được sử dụng cho 13 bệnh nhân trong thời gian nghiên cứu. IRV điều khiển thể tích không được sử dụng. IRV được bắt đầu vào 4.4 ngày thông khí khi không thể duy trì trao đổi khí. IRV cải thiện đáng kể PaO 2/FiO2 từ 76 ± 27 đến 208 ± 91 mmHg mà không bị suy tuần hoàn. Thời gian trung bình của IRV là 10,5 ngày, và tất cả những người sống sót được cai máy khỏi thông khí cơ học và xuất viện. Tỷ lệ tử vong 90 ngày là 38,5%. Phân tích đơn biến cho thấy thời gian IRV có liên quan đến tỷ lệ tử vong 90 ngày. Không có bệnh nhân nào được chẩn đoán bị tràn khí màng phổi.
Kết luận: IRV kiểm soát áp lực cung cấp trao đổi khí chấp nhận được mà không có biến chứng rõ ràng và được xem như cầu nối thành công khi được sử dụng như một liệu pháp cứu hộ cho ARDS vừa đến nặng.
2. Bối cảnh
Ở những bệnh nhân bị hội chứng suy hô hấp cấp tính (ARDS), thông khí cơ học đóng một vai trò then chốt trong việc kích hoạt hoặc làm trầm trọng thêm phản ứng viêm ở phổi, lan rộng viêm phổi cục bộ sang tuần hoàn hệ thống và gây ra hội chứng rối loạn chức năng nhiều cơ quan (Slutsky và Tremblay 1998).
Phòng ngừa chấn thương phổi do máy thở gây ra (VILI) là trụ cột chính trong điều trị ARDS. Thông khí thể tích khí lưu thông thấp (LTV), được đặc trưng bởi giới hạn cả thể tích khí lưu thông (VT) và áp lực cao nguyên (Pplat) kết hợp với áp lực dương cuối kỳ thở ra (PEEP), được sử dụng để giảm thiểu quá tải phế nang và sự xẹp và mở của phế nang lập lại, cả hai kích thích gây VILI (ARDSnet 2000; Amato et al. 1998). Một nghiên cứu trước đây báo cáo rằng tử vong song song với mức Pplat (Hager et al. 2005), và ngưỡng Pplat an toàn được coi là 30 cmH2O.
Tuy nhiên, trong một số trường hợp nghiêm trọng của ARDS, LTV không thể cung cấp trao đổi khí đầy đủ (Slutsky và Ranieri 2013). Điều này một phần là do việc giới hạn Pplat hạn chế số lượng PEEP có thể được sử dụng; Ngoài ra, không thể đạt được thể tích khí lưu thông thích hợp khi có áp lực màng phổi cao. Bởi vì áp lực đường thở trung bình (mean airway pressure) có liên quan chặt chẽ với oxy hóa, một chế độ thông khí có thể làm tăng áp lực đường thở trung bình mà không làm tăng Pplat có thể là một phương tiện hữu ích để duy trì oxy hóa (Yanos et al. 1998).
Thông khí xả áp lực (APRV) (Modrykamien et al. 2011) và thông khí dao động tần số cao (HFOV) nhằm mục đích đạt được các mục tiêu này và đã được đề xuất cho các trường hợp ARDS nặng do viêm phổi do cúm A-H1N1 gây ra. Mặc dù oxy hóa màng ngoài cơ thể (ECMO) là một liệu pháp thay thế được đề xuất để tránh VILI và có thể có lợi cho bệnh nhân ARDS nặng (Webb et al. 2009; Peek et al. 2009), ứng dụng lâm sàng của nó bị giới hạn bởi vì kỹ thuật này rất tốn nhiều tài nguyên (Peek et al. 2009). Do đó, một phương thức thông khí có thể được thực hiện cho ARDS nghiêm trọng trong bối cảnh lâm sàng của bất kỳ cơ sở nào cần được bảo đảm.
Tỷ lệ nghịch đảo (IRV) là một kỹ thuật khác sử dụng các nguyên tắc tương tự để cải thiện oxy hóa (Cole et al. 1984; Lain et al. 1989; Gurevitch et al. 1986; Tharratt et al. 1988; Abraham và Yoshihara 1989) như phương pháp điều trị cứu mạng khác và có thể được thực hiện với phần lớn các máy thở đơn vị chăm sóc đặc biệt (ICU) mà không mất thêm chi phí.
Mặc dù có một số hứa hẹn, các nghiên cứu trước đây đã tìm thấy IRV có ít hoặc không có lợi ở bệnh nhân ARDS nặng (Mercat et al. 1993; Lessard et al.. 1994; Mancebo et al. 1994; Mercat et al. 1997; Zavala et al. 1998).
Tuy nhiên, những nghiên cứu này đã được tiến hành cách đây hơn 20 năm mà không có khái niệm về bảo vệ phổi và được thiết kế để so sánh các tác động ngắn hạn đối với trao đổi khí, các thông số huyết động học và độ giãn nở tĩnh.
Mục đích của nghiên cứu này là để đánh giá xem liệu IRV có khả thi như một liệu pháp cứu mạng cho sự suy giảm trao đổi khí đe dọa tính mạng khi các chế độ thông khí thông thường không thể duy trì được. Chúng tôi đã tiến hành xem xét lại các bệnh án và điều tra dữ liệu sinh lý, kết quả, và các biến chứng liên quan đến IRV.
3. Phương pháp
3.1 Chuẩn mực đạo đức
Giao thức nghiên cứu đã được ủy ban đạo đức của chúng tôi phê chuẩn (số tham chiếu 2721).
3.2 Thiết kế nghiên cứu và nhóm thuần tập bệnh nhân
Đây là một nghiên cứu quan sát, hồi cứu, đơn trung tâm. Một đánh giá hồi cứu về các hồ sơ lâm sàng của tất cả bệnh nhân ARDS được điều trị tại ICU của chúng tôi từ tháng 1 năm 2007 đến tháng 5 năm 2014 đã được thực hiện. Tất cả các bệnh nhân được chẩn đoán ARDS theo định nghĩa Berlin (Ranieri et al. 2012) và thông khí với IRV đã được đưa vào phân tích.
3.3 Dữ liệu
Chúng tôi ghi nhận tuổi, giới tính, trọng lượng cơ thể, các bệnh lý có từ trước, được cho là nguyên nhân của ARDS, chỉ định IRV, cân bằng acid-base, nồng độ lactate huyết thanh, điểm APACHE II, điểm Murray trước khi chuyển sang IRV. Tỷ lệ PaO2/FiO2 (P/F), thời gian bắt đầu IRV, thời gian IRV, tổng thời gian thở và tử vong 28 và 90 ngày cũng được thu thập. Huyết áp động mạch và nhịp tim trước và sau khi bắt đầu IRV và tỷ lệ tràn khí màng phổi được thu thập để đánh giá các tác dụng phụ.
3.4 Chiến lược thông khí và an thần cơ học
Thông khí cơ học được bắt đầu bằng thông khí điều khiển/hỗ trợ kiểm soát áp lực (ACV-PC) theo các quy trình của chúng tôi về suy hô hấp do thiếu oxy cấp tính. Tóm lại, giới hạn thể tích khí lưu thông < 8 ml/kg trọng lượng cơ thể dự đoán và Pplat < 30 cmH2O. Khi thiếu oxy máu kháng trị [SpO2 <90%] tiếp tục ngay cả khi Pplat đạt tới 30 cmH2O với FiO2 > 0,6, chế độ thông khí được chuyển sang APRV hoặc IRV với mục đích đạt được áp lực đường thở trung bình thích hợp và do đó duy trì oxy hóa được chấp nhận và ổn định.
Các thông số APRV được thiết lập theo đánh giá trước đó (Habashi 2005). Khi APRV không duy trì trao đổi khí, nó đã được chuyển thành IRV. Khi bắt đầu IRV, tỷ lệ thời gian hít vào và thở ra đã được cố định ở mức 2:1, và thể tích khí lưu thông ban đầu được đặt ở mức 4-7 ml/kg trọng lượng cơ thể dự đoán.
Ngoài ra, PEEP được áp dụng để duy trì áp lực đường thở trung bình cao hơn 2–4 cmH2O so với chế độ thông khí trước đó và được tăng lên cho đến khi đạt được trao đổi khí chấp nhận được. Tần số hô hấp, áp lực hô hấp đỉnh (PIP) và PEEP được điều chỉnh để tránh nhiễm toan hô hấp và duy trì pH > 7.25.
Siêu âm tim được thực hiện hàng ngày để đánh giá chức năng tâm thất phải. Thang điểm kích thích an thần của Richmond (Sessler et al. 2002) được duy trì ở mức −3 đến −4 trong IRV. Sự an thần đã không bị gián đoạn cho đến khi IRV chấm dứt.
3.4 Phân tích thống kê
Các phân tích thống kê được thực hiện bằng cách sử dụng JMP 9 (SAS Institute Inc., Cary, NC, USA). Ý nghĩa của các biến phân loại được tính toán bằng cách sử dụng kiểm tra chính xác của Fisher.
Một thử nghiệm t được sử dụng để so sánh các biến định lượng, được trình bày dưới dạng trung bình ± độ lệch chuẩn hoặc tỷ lệ (%). Phân tích đơn biến được thực hiện để sàng lọc các biến liên quan đến tỷ lệ tử vong 90 ngày. Giá trị p <0,05 được coi là có ý nghĩa thống kê.
4. Kết quả
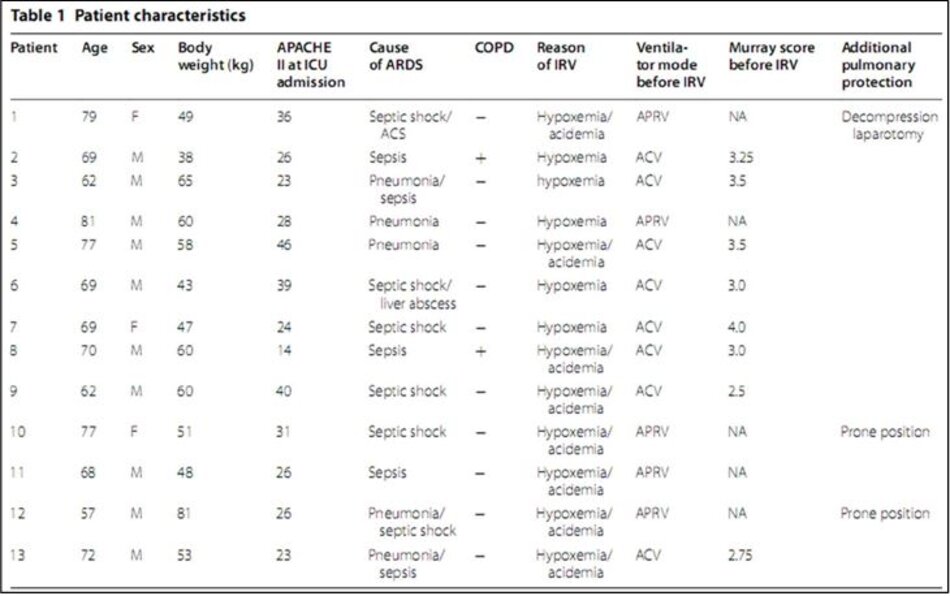
Trong số 116 bệnh nhân ARDS được sàng lọc trong thời gian nghiên cứu, 13 bệnh nhân đã được điều trị bằng IRV và được đưa vào phân tích; các đặc điểm của họ được tóm tắt trong Bảng 1. Điểm APACHE II tại ICU là 29,4 ± 8,7. Hai bệnh nhân đã được chẩn đoán mắc bệnh phổi tắc nghẽn mãn tính và đang được điều trị.
Các chỉ định cho IRV là thiếu oxy máu kháng trị ở tất cả các bệnh nhân. P/F tồi tệ nhất trước khi bắt đầu IRV là 76 ± 27 mmHg. Sau khi bắt đầu điều trị bằng IRV, bệnh nhân 1 đã trải qua quá trình giải phẫu để giải quyết hội chứng khoang bụng mức độ IV do tắc ruột, và bệnh nhân 10 và 12 nhận được tư thế nằm sấp. Các chế độ thông khí trước IRV là ACV (n = 8) hoặc APRV sau thất bại của ACV (n = 5).
Điểm số trung bình của Murray được tính toán ở 8 bệnh nhân được thông khí với ACV là 3,2 ± 0,5. Điểm số Murray không được tính toán ở bệnh nhân thông khí với APRV vì chỉ có thể đo thể tích xả – release volume (không phải thể tích khí lưu thông) với phương thức này. IRV được bắt đầu trong vòng 72 giờ sau khi bắt đầu thở máy.
Bệnh nhân 3 và 13 có ARDS muộn, và IRV được bắt đầu vào ngày 14 và 21 của máy thở. Bệnh nhân 12 được đánh giá vào ngày máy thở 4, và IRV được bắt đầu vào ngày đó. IRV điều chỉnh thể tích không được sử dụng trong nghiên cứu.
4.1 Thông số và tác động của thông khí IRV đối với trao đổi khí
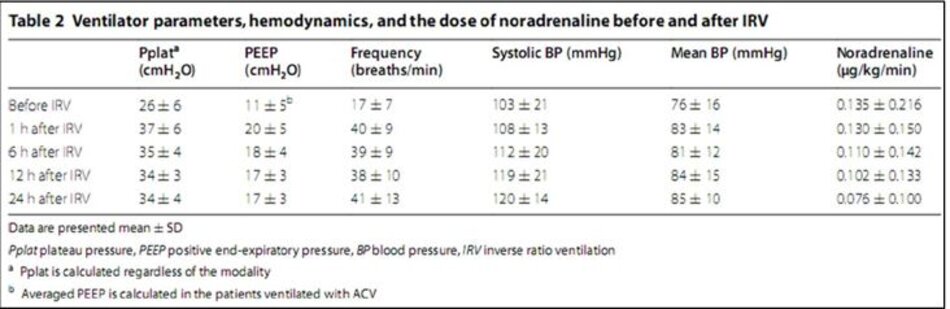
Pplat trung bình và PEEP trong ACV trước IRV lần lượt là 29,4 ± 3,3 và 12,4 ± 3,5 cmH2O. PEEP cao nhất trung bình trong APRV trước IRV là 29,0 ± 4,0 cmH2O. Tần số thở trong IRV là 31–57 nhịp thở/phút. Những thay đổi trong Pplat, PEEP và tần số thông khí theo thời gian được thể hiện trong Bảng 2. Pplat tăng đáng kể sau IRV (p = 0,00042).
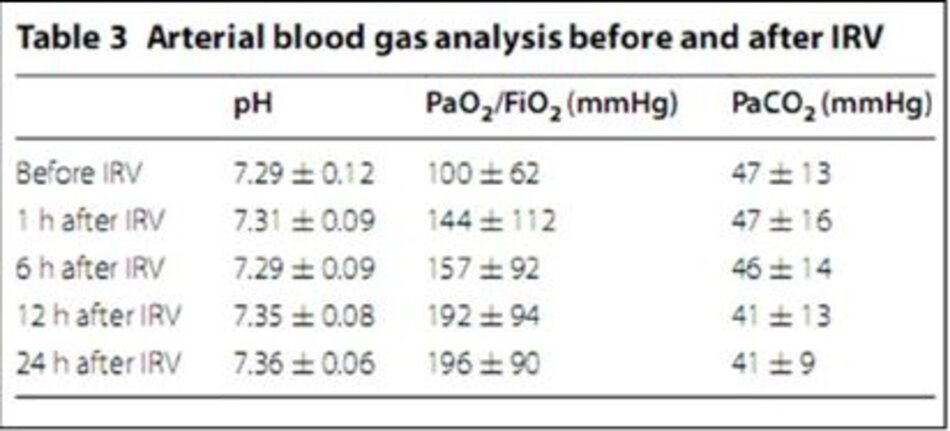
Giảm oxy máu và nhiễm toan được cải thiện theo thời gian sau khi IRV (Bảng 3). Tỷ lệ P/F theo thời gian trong mọi trường hợp được thể hiện trong hình 1. P/F tăng đáng kể lên 208 ± 91 mmHg trong vòng 24 giờ đầu tiên sau IRV so với trước IRV (p = 0.0000025).
4.2 Các sự kiện bất lợi liên quan đến IRV và tỷ lệ tử vong
Năm bệnh nhân bị sốc khi bắt đầu IRV. Bệnh nhân 1 trở nên không ổn định về mặt huyết động khi bắt đầu điều trị bằng IRV và được điều trị thành công với hồi sức thể tích và thuốc co mạch. Bốn bệnh nhân còn lại không yêu cầu thêm hồi sức. Huyết áp trung bình ổn định trong 24 giờ đầu sau khi bắt đầu IRV (Hình 1).
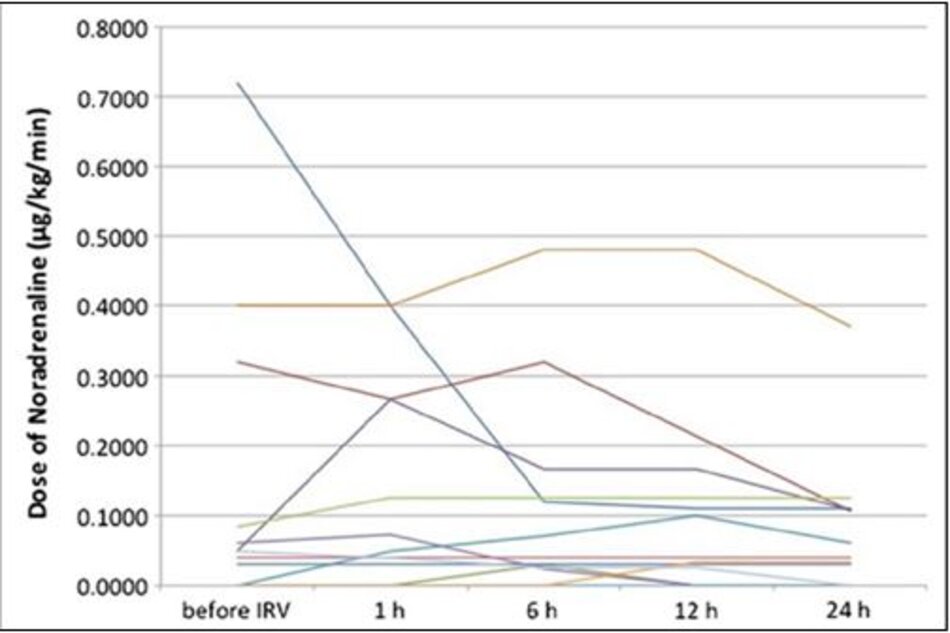
Noradrenaline được sử dụng ở 12 trong số 13 bệnh nhân. Liều noradrenaline đã giảm hoặc không thay đổi trong 24 giờ đầu tiên sau khi bắt đầu điều trị bằng IRV (Hình 2) và không thấy các biến cố tuần hoàn khác. Tất cả các bệnh nhân được an thần với một sự kết hợp của fentanyl, dexmedetomidine, và propofol để tạo điều kiện thông khí cơ học. Biến chứng tràn khí màng phổi không được quan sát thấy, mặc dù không có bệnh nhân nào dùng thuốc liệt cơ.
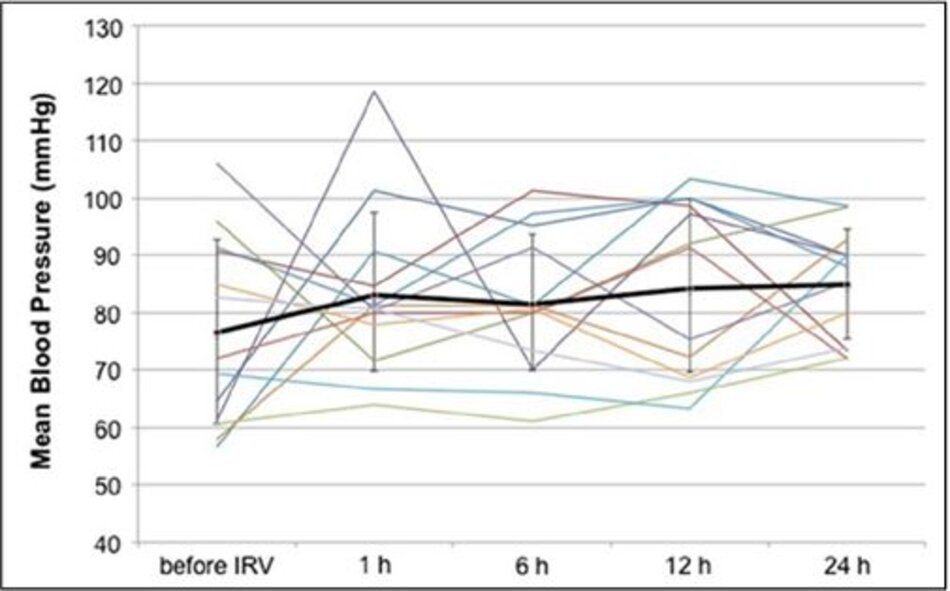
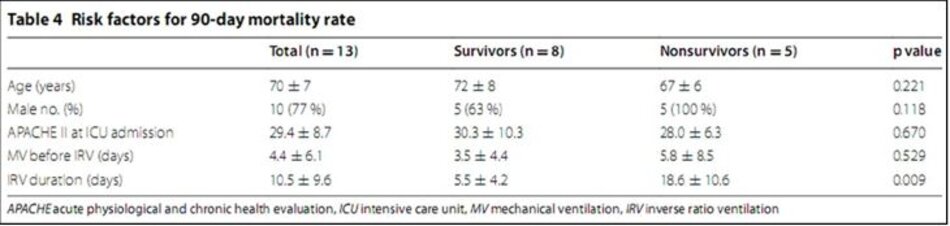
Tỷ lệ tử vong 28 và 90 ngày tương ứng là 30,8 và 38,5%. Tất cả những người sống sót đã được chuyển sang APRV để duy trì áp lực đường thở trung bình của họ và cai máy khỏi thông khí cơ học, trong khi tất cả những người không thở đều được thông khí với IRV đến hết. Tuổi, điểm số APACHE II, thời gian thông khí trước IRV và thời gian IRV ở những người sống sót và không sống sót được thể hiện trong Bảng 4. Phân tích đơn biến cho thấy thời gian IRV có liên quan đến tỷ lệ tử vong 90 ngày (p = 0,009).
5. Bàn luận
Chúng tôi thấy rằng IRV được bắt đầu ngay lập tức sau thất bại của LTV hoặc APRV, và cải thiện oxy mà không có biến chứng lớn như trụy tim mạch và tràn khí màng phổi. Điểm số Murray của bệnh nhân trong nghiên cứu đoàn hệ của chúng tôi, những người đủ các tiêu chí cho ECMO, phản ánh mức độ nghiêm trọng của ARDS. Không có khó khăn khi cai máy trở lại một chế độ thông khí thông thường hơn ở những người sống sót. Tỷ lệ tử vong đã được chấp nhận so với một báo cáo gần đây (Ranieri et al. 2012). Những phát hiện này cho thấy rằng IRV có khả năng là một lựa chọn an toàn và hiệu quả để tạm thời duy trì trao đổi khí cho tình trạng thiếu oxy máu kháng trị đã tỏ ra khó quản lý bằng cách sử dụng các chế độ thông khí thông thường. IRV là khả thi như một liệu pháp cứu hộ khi ECMO không có sẵn.
Trong nghiên cứu này, thông khí cơ học trước IRV được thực hiện theo khái niệm bảo vệ phổi, hạn chế thể tích khí lưu thông và Pplat. Mặc dù PEEP trước IRV thấp hơn mức khuyến cáo trong thử nghiệm ngẫu nhiên có đối chứng trước đây (ARDSnet 2000), PEEP thường được đặt thấp hơn để ngăn Pplat vượt ngưỡng an toàn (Checkley et al. 2008). Đây là một hạn chế lâm sàng của thông khí thông thường và xác nhận mối quan tâm của chúng tôi rằng một phương thức khác là bắt buộc trong các tình huống cụ thể.
Đó là giao thức đề nghị từng bước của chúng tôi cho việc áp dụng IRV góp phần ngăn chặn các tác dụng phụ. IRV được giới thiệu khi bệnh nhân được chẩn đoán là ARDS trong các nghiên cứu trước đây (Mercat et al, 1993; 1997; Lessard et al. 1994; Mancebo et al. 1994; Zavala et al. 1998). Trong nghiên cứu của chúng tôi, IRV được sử dụng như là lựa chọn cuối cùng để nâng áp lực đường thở trung bình với mức tăng nhỏ hơn trong PIP hoặc Pplat vì Pplat đã đạt đến ngưỡng an toàn.
Để tạo thuận lợi cho IRV, chúng tôi đã chọn các thông số thông khí giúp giảm thiểu những bất lợi hơn là những thông số cung cấp đầy đủ các lợi ích điều trị. Khi Pplat và PEEP tăng trong IRV, chuẩn độ từng bước được thực hiện để đạt được áp lực thích hợp thấp nhất.
Mặc dù Pplat vượt ngưỡng an toàn của chiến lược bảo vệ phổi trong một số trường hợp, thủ tục chuẩn độ từng bước duy trì áp lực tối thiểu an toàn, ngăn ngừa barotrauma. IRV cung cấp trao đổi khí chấp nhận được để tiếp tục điều trị cho bệnh nhân có nguy cơ đe dọa đến tính mạng, và đây là mục tiêu của IRV.
Chúng tôi đã cố gắng giảm thiểu thời gian IRV và ngay khi có thể thay đổi chế độ thành APRV, nó đã duy trì áp lực đường thở trung bình đáng tin cậy trong IRV và dễ dàng đồng bộ hóa với kiểu thở của bệnh nhân. Những yếu tố này có thể dẫn đến tỷ lệ thấp các tác dụng phụ và tỷ lệ tử vong tương đối thấp.
Một trong những cơ chế củng cố sự cải thiện oxy hóa được cho là khuyến khích huy động phế nang (Marini và Ravenscraft 1992) do thời gian hít vào dài hơn. Một cơ chế khác là phòng ngừa mất huy động do thời gian thở ra ngắn hơn.
Áp lực phế nang không đầy đủ có thể gây ra việc huy động/mất huy động có chu kỳ của phế nang, phơi nhiễm các vùng phổi với lực căng (Ochiai 2015). Một nghiên cứu trên động vật gần đây đã chứng minh rằng IRV giảm thiểu việc huy động/mất huy động chu kỳ của sự xẹp phổi và cải thiện oxy hóa so với chế độ thông thường (Boehme et al. 2015).
Điều này đi kèm với việc phân phối lại thông khí từ các vùng phổi phụ thuộc đến vùng phổi không phụ thuộc (Kotani et al., 2016). Vì tần số thở trong IRV là 31–57 nhịp thở/phút trong nhóm nghiên cứu của chúng tôi, thời gian thở ra rất ngắn góp phần vào việc ổn định phế nang phù hợp với thời gian hít vào dài hơn.
IRV có liên quan đến nguy cơ phát triển VILI vì áp lực cao hơn cần thiết để bắt đầu IRV. Cũng công nhận rằng IRV có thể gây mất ổn định huyết động như là kết quả của PEEP nội sinh và áp lực đường thở trung bình gia tăng (Cole et al. 1984).
Tuy nhiên, chúng tôi đã không quan sát thấy những sự kiện bất lợi này trong nghiên cứu hiện tại. Sự ảnh hưởng xấu lên huyết động học có thể được ngăn ngừa hoặc cải thiện bằng việc gia tăng áp lực thông khí cao hơn, hồi sức thể tích, hoặc liệu pháp vận mạch; đây là phương pháp mà chúng tôi đã áp dụng ở một trong những bệnh nhân bị bất ổn huyết động học trong nghiên cứu của chúng tôi.
Chúng tôi thấy rằng một PEEP cao hơn gây ra tăng CO2 máu, nhưng điều này đã được cải thiện bằng cách tăng tần số máy thở. Vì vậy, lợi ích tổng thể của IRV xuất hiện để vượt qua những bất lợi của nó.
Nghiên cứu của chúng tôi có một vài hạn chế. Đó là một nghiên cứu đơn trung tâm, hồi cứu, theo từng trường hợp. Ngoài ra, tình trạng lâm sàng của bệnh nhân không thường gặp và do đó kích thước mẫu nhỏ.
Cho dù các biến chứng nặng phát triển trong IRV phụ thuộc phần lớn vào trải nghiệm lâm sàng của nhân viên. Có một số yếu tố không được kiểm soát có ảnh hưởng đến kết quả, chẳng hạn như tình trạng bệnh nhân, cân bằng dịch, và thời gian bắt đầu và chấm dứt IRV. Việc chuyển sang IRV có thể đã xảy ra sớm hơn trong quá trình lâm sàng của bệnh nhân so với các nghiên cứu trước đây.
Chúng tôi không đo hoặc ghi lại các thông số phổi (ví dụ: áp lực đường thở trung bình và PEEP nội tại) hoặc áp lực thực quản. Tỷ lệ thời gian hít vào:thở ra là 2:1 đã được sử dụng trong nghiên cứu, nhưng hiệu quả của tỷ lệ này trên các kết quả là không rõ ràng.
Chúng tôi không thể xác định liệu IRV có làm giảm tổn thương phổi do chúng tôi không đo các dấu ấn sinh học nào liên quan đến VILI và không thường xuyên thực hiện sinh thiết phổi. Cuối cùng, tính khả thi của IRV với điều khiển thể tích không được biết vì chúng tôi không sử dụng nó.
6. Kết luận
IRV kiểm soát áp lực cung cấp cải thiện oxy hóa có thể chấp nhận được mà không có biến chứng lớn, cho thấy IRV kiểm soát áp lực là khả thi như một liệu pháp cứu hộ ở những bệnh nhân ARDS không đáp ứng với điều trị thông thường. Các nghiên cứu tiếp theo được bảo đảm để xác nhận tính hiệu quả và độ an toàn của IRV kiểm soát áp lực được sử dụng như một liệu pháp cứu hộ cho ARDS vừa đến nặng.
7. References
1. Abraham E, Yoshihara G. Cardiorespiratory effects of pressure controlled inverse ratio ventilation in severe respiratory failure. Chest. 1989;96:1356–1359. doi: 10.1378/chest.96.6.1356.
2. Amato MB, Barbas CS, Medeiros DM, Magaldi RB, Schettino GP, Lorenzi-Filho G, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998;338:347–354. doi: 10.1056/NEJM199802053380602.
3. Boehme S, Bentley AH, Hartmann EK, Chang S, Erdoes G, Prinzing A, et al. Influence of inspiration to expiration ratio on cyclic recruitment and derecruitment of atelectasis in a saline lavage model of acute respiratory distress syndrome. Crit Care Med. 2015;43:e65–e74. doi: 10.1097/CCM.0000000000000788.
4. Checkley W, Brower R, Korpak A, Thompson BT. Effects of a clinical trial on mechanical ventilation practices in patients with acute lung injury. Am J Respir Crit Care
Med. 2008;177:1215–1222. doi: 10.1164/rccm.200709-1424OC.
5. Cole AG, Weller SF, Sykes MK. Inverse ratio ventilation compared with PEEP in adult respiratory failure. Intensive Care Med. 1984;10:227–232. doi: 10.1007/BF00256258.
6. Gurevitch MJ, Van Dyke J, Young ES, Jackson K. Improved oxygenation and lower peak airway pressure in severe adult respiratory distress syndrome. Treatment with inverse ratio ventilation. Chest. 1986;89:211–213. doi: 10.1378/chest.89.2.211.
7. Habashi NM. Other approaches to open-lung ventilation: airway pressure release ventilation. Crit Care Med. 2005;33:S228–S240. doi:10.1097/01.CCM.0000155920.11893.37.
8. Hager DN, Krishnan JA, Hayden DL, Brower RG. Tidal volume reduction in patients with acute lung injury when plateau pressures are not high. Am J Respir Crit Care
Med. 2005;172:1241–1245. doi: 10.1164/rccm.200501-048CP.
9. Kotani T, Tanabe H, Yusa H, Saito S, Yamazaki K, Ozaki M. Electrical impedance tomography-guided prone positioning in a patient with acute cor pulmonale associated with severe acute respiratory distress syndrome. J Anesth. 2016;30:161–165. doi: 10.1007/s00540-015-2084-y.
10. Lain DC, DiBenedetto R, Morris SL, Van Nguyen A, Saulters R, Causey D. Pressure control inverse ratio ventilation as a method to reduce peak inspiratory pressure and provide adequate ventilation and oxygenation. Chest. 1989;95:1081–1088. doi: 10.1378/chest.95.5.1081.
11. Lessard MR, Guerot E, Lorino H, Lemaire F, Brochard L. Effects of pressure-controlled with different I:E ratios versus volume-controlled ventilation on respiratory mechanics, gas exchange, and hemodynamics in patients with adult respiratory distress
syndrome. Anesthesiology. 1994;80:983–991. doi: 10.1097/00000542-199405000-00006.
12. Mancebo J, Vallverdu I, Bak E, Dominguez G, Subirana M, Benito S, et al. Volume- controlled ventilation and pressure-controlled inverse ratio ventilation: a comparison of their effects in ARDS patients. Monaldi Arch Chest Dis. 1994;49:201–207.
13. Marini JJ, Ravenscraft SA. Mean airway pressure: physiologic determinants and clinical importance—part 2: clinical implications. Crit Care Med. 1992;20:1604–1616. doi: 10.1097/00003246-199211000-00020.
14. Mercat A, Graini L, Teboul JL, Lenique F, Richard C. Cardiorespiratory effects of pressure- controlled ventilation with and without inverse ratio in the adult respiratory distress syndrome. Chest. 1993;104:871–875. doi: 10.1378/chest.104.3.871.
15. Mercat A, Titiriga M, Anguel N, Richard C, Teboul JL. Inverse ratio ventilation (I/E = 2/1) in acute respiratory distress syndrome: a six-hour controlled study. Am J Respir Crit Care Med. 1997;155:1637–1642. doi: 10.1164/ajrccm.155.5.9154869.
16. Modrykamien A, Chatburn RL, Ashton RW. Airway pressure release ventilation: an alternative mode of mechanical ventilation in acute respiratory distress syndrome. Cleve Clin J Med. 2011;78:101–110. doi: 10.3949/ccjm.78a.10032.
17. Ochiai R. Mechanical ventilation of acute respiratory distress syndrome. J Intensive Care. 2015;3:25. doi: 10.1186/s40560-015-0091-6.
18. Peek GJ, Mugford M, Tiruvoipati R, Wilson A, Allen E, Thalanany MM, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet. 2009;374:1351–1363. doi: 10.1016/S0140-6736(09)61069-2.
19. Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307:2526–2533.
20. Sessler CN, Gosnell MS, Grap MJ, Brophy GM, O’Neal PV, Keane KA, et al. The Richmond Agitation–Sedation Scale: validity and reliability in adult intensive care unit patients. Am J Respir Crit Care Med. 2002;166:1338–1344. doi: 10.1164/rccm.2107138.
21. Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med. 2013;369:2126– 2136. doi: 10.1056/NEJMra1208707.
22. Slutsky AS, Tremblay LN. Multiple system organ failure. Is mechanical ventilation a contributing factor? Am J Respir Crit Care Med. 1998;157:1721–1725. doi: 10.1164/ajrccm.157.6.9709092.
23. Tharratt RS, Allen RP, Albertson TE. Pressure controlled inverse ratio ventilation in severe adult respiratory failure. Chest. 1988;94:755–762. doi: 10.1378/chest.94.4.755.
24. The acute respiratory distress syndrome network Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000;342:1301–1308. doi: 10.1056/NEJM200005043421801.
25. Webb SA, Pettila V, Seppelt I, Bellomo R, Bailey M, Cooper DJ, et al. Critical care services and 2009 H1N1 influenza in Australia and New Zealand. N Engl J Med. 2009;361:1925– 1934. doi: 10.1056/NEJMoa0908481.
26. Yanos J, Watling SM, Verhey J. The physiologic effects of inverse ratio ventilation. Chest. 1998;114:834–838. doi: 10.1378/chest.114.3.834.
27. Zavala E, Ferrer M, Polese G, Masclans JR, Planas M, Milic-Emili J, et al. Effect of inverse I:E ratio ventilation on pulmonary gas exchange in acute respiratory distress
syndrome. Anesthesiology. 1998;88:35–42. doi: 10.1097/00000542-199801000-00008.
Tham khảo thêm bài viết:
- Các tác dụng của Khoảng chết thiết bị trên PaCO2 ở bệnh nhân nhận thông khí bảo vệ phổi
- Bù trừ độ giãn nở của bộ dây máy thở trong thông khí bảo vệ phổi