Bài viết Tỷ lệ SpO2/FiO2 khi nhập viện là một chỉ số phát triển hội chứng suy hô hấp cấp tính sớm ở những bệnh nhân có nguy cơ được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: SpO2/FiO2 Ratio on Hospital Admission Is an Indicator of Early Acute Respiratory Distress Syndrome Development Among Patients at Risk
1. Tóm tắt
Mục đích: Tỷ lệ độ bão hòa oxy với nồng độ oxy khí hít vào (SpO 2/FiO2) đã được xác nhận là một dấu hiệu thay thế cho PaO2/FiO2 từ bệnh nhân thở máy với hội chứng suy hô hấp cấp (ARDS). Hiệu lực của phép đo SpO2/FiO2 trong dự đoán ARDS chưa được nghiên cứu. Gần đây, Điểm dự đoán tổn thương phổi (LIPS) đã được phát triển để giúp xác định bệnh nhân có nguy cơ phát triển ARDS.
Phương pháp: Đây là phân tích thứ cấp của nhóm LIPS-1. Một hồi quy logistic đa biến bao gồm tất cả các biến được thiết lập cho LIPS, APACHE 2, tuổi tác và các điều kiện phối hợp có thể ảnh hưởng đến SpO2/FiO2.
Kết quả chính là phát triển ARDS trong bệnh viện. Các kết cục thứ phát bao gồm tử vong trong bệnh viện, ngày trong bệnh viện phát triển ARDS và ngày tử vong trong bệnh viện.
Kết quả: Trong số 5584 bệnh nhân, chúng tôi đánh giá tất cả 4646 bệnh nhân với các giá trị SpO2/FiO2 đã ghi. Trung bình SpO2/FiO2 ở những người đã phát triển và không phát triển ARDS lần lượt là 254 (100, 438) và 452 (329, 467). Có mối liên hệ đáng kể giữa SpO2/FiO2 và ARDS (P .001). SpO2/FiO2 được tìm thấy là một yếu tố dự báo độc lập của ARDS theo cách “phụ thuộc vào liều”; cho SpO2/FiO2 < 100 thì odds ratios (OR) 2,49 (1,69-3,64, P <0,001), đối với SpO 2/FiO2 từ 100 đến < 200 thì OR 1,75 (1,16-2,58,P = .007) và cho SpO2/FiO2 từ 200 đến < 300 thì OR 1,62 (1,06-2,42, P = .025). Các
đặc điểm phân biệt của mô hình đa biến và SpO 2/FiO2 là một biến duy nhất thể hiện diện tích dưới đường cong (AUC) là 0,81 và AUC là 0,74, tương ứng.
Kết luận: Các SpO2/FiO2, đo trong vòng 6 giờ đầu tiên sau khi nhập viện, là một chỉ số độc lập về phát triển ARDS ở những bệnh nhân có nguy cơ.
2. Giới thiệu
Hội chứng suy hô hấp cấp tính (ARDS) là hội chứng lâm sàng đe dọa tính mạng với tử vong liên quan cao tới 40%. [1,2] Những người sống sót thường phải đối mặt với giới hạn hoạt động kéo dài, di chứng tâm lý và giảm chất lượng cuộc sống, điều này dẫn đến việc sử dụng dịch vụ chăm sóc sức khỏe gia tăng, đại diện cho gánh nặng sức khỏe chính. [3] Các thử nghiệm trị liệu hầu hết là đáng thất vọng và chiến lược trị liệu hiện tại phần lớn là hỗ trợ.
Gần đây, đã có một sự thay đổi trong cách tiếp cận can thiệp nhấn mạnh công tác phòng chống ở những bệnh nhân có nguy cơ cao phát triển ARDS. Trong số các nỗ lực để xác định bệnh nhân có nguy cơ, thành công nhất cho đến nay đã là Điểm dự đoán tổn thương phổi (LIPS, Lung Injury Prediction Score). [4] Điểm số này, xác định trong vòng 6 giờ đầu tiên sau khi nhập viện, đã được xác nhận trong một nhóm đa trung tâm lớn của bệnh nhân có nguy cơ. Điểm số kết hợp các điều kiện khác nhau và điều chỉnh rủi ro cũng như các dấu hiệu của tình trạng thiếu oxy (độ bão hòa oxy) và yêu cầu oxy (nồng độ oxy hít vào). LIPS bị hạn chế bởi sự phức tạp và nỗ lực cần thiết để thu thập các biến cần thiết, thúc đẩy sự phát triển và thử nghiệm các lựa chọn thay thế đơn giản hơn, bao gồm tỉ lệ độ bão hòa oxy chia cho nồng độ oxy hít vào (SpO2/FiO2).
Mặc dù các tiêu chí ARDS yêu cầu đo PaO2/FiO2, [5,6] phần lớn bệnh nhân có nguy cơ nhưng không có ARDS được thiết lập đầy đủ thì không có các mẫu máu động mạch được thực hiện. Một phép đo thay thế, không xâm lấn của oxy hóa, SpO2/FiO2 đã được sử dụng bởi Rice và cộng sự trong số các bệnh nhân ARDS để thay thế cho PaO2/FiO2. [7] Các tác giả này tiếp tục chi tiết mức ngưỡng cụ thể cho SpO2/FiO2 có thể được sử dụng ở bệnh nhân ARDS thay thế bất cứ khi nào PaO 2/FiO2 không khả dụng. Khemani và cộng sự cũng đã chứng minh sự đồng thuận chặt chẽ giữa PaO2/FiO2 và SpO2/FiO2, thừa nhận rằng SpO2/FiO2 là một chỉ số không xâm lấn của PaO2/FiO2 ở trẻ bị tổn thương phổi cấp tính (ALI) hoặc ARDS. [8,9]
Tuy nhiên, giá trị của SpO2/FiO2 như là một dự báo ban đầu của phát triển ARDS tiếp theo chưa được nghiên cứu. Do sự thay đổi mô hình trong phương pháp điều tra ARDS (để phòng ngừa và điều trị sớm), một dấu hiệu thay thế không xâm lấn của oxy suy giảm có thể được xác định sớm trong quá trình trình bày bệnh nhân là rõ ràng mong muốn. Chúng tôi đưa ra giả thuyết rằng SpO 2/FiO2 sẽ là một yếu tố dự báo độc lập sớm đáng tin cậy về phát triển ARDS.
3. Phương pháp
Đây là một phân tích thứcấp của nghiên cứu LIPS-1 được công bố trước đây,
[4] nghiên cứu thuần tập tiền cứu được tiến hành dưới sự bảo trợ của US Critical
Illness and Injury Trials Group (USCIITG). Điều tra ban đầu này nhằm đánh giá độ chính xác tiên đoán của LIPS, với kết quả chính là phát triển ARDS trong bệnh viện ở những bệnh nhân có nguy cơ. Nghiên cứu chính đã được tiến hành trong số 5584 bệnh nhân từ 22 bệnh viện, trong đó 377 (6,8%) đã phát triển ARDS, 95% trong số đó yêu cầu thở máy thở xâm lấn. [4] Giao thức nghiên cứu đã được phê duyệt bởi ban giám định thể chế tại mỗi địa điểm tham gia. Nghiên cứu thứ cấp này đã được ủy ban nghiên cứu phụ thuộc USCIITG / LIPS phê duyệt.
3.1 Dân số nghiên cứu
Ngắn gọn, bệnh nhân người lớn được nhận vào các bệnh viện chăm sóc sức khỏe cấp cứu và cộng đồng đủ điều kiện tham gia nghiên cứu nếu họ có ít nhất 1 yếu tố nguy cơ chính đối với ARDS: nhiễm trùng huyết, sốc, viêm tụy, viêm phổi, hít sặc, chấn thương có nguy cơ cao hoặc phẫu thuật có nguy cơ cao. Tiêu chí loại trừ là ALI hoặc ARDS tại thời điểm nhập viện hoặc trong vòng 6 giờ nhập viện, chuyển từ bệnh viện bên ngoài, tử vong trong khoa cấp cứu (ED), chăm sóc giảm nhẹ hoặc chăm sóc giai đoạn cuối hoặc tái nhập viện trong thời gian nghiên cứu. [4] Ngoài ra, với mục đích của nghiên cứu thứ cấp này, chúng tôi loại trừ những bệnh nhân không có các biến cần thiết cho tính toán SpO2/FiO2 được ghi lại trong vòng 6 giờ đầu tiên khi nhập viện.
3.2 Biến dự đoán
Thông tin nhân khẩu học và lâm sàng thu được tại thời điểm nhập viện hoặc trước mổ tại thời điểm phẫu thuật nhưng trong vòng 6 giờ sau khi nhập viện. Biến dự báo chính của nghiên cứu thứ cấp này là SpO2/FiO2, trong đó bao gồm độ bão hòa oxy thu được bằng cách đo qua pulse oximeter và nồng độ oxy khí hít vào, các biến trước đó được xác nhận trong cơ sở dữ liệu LIPS. [4]
Các biến này được xác định chắc chắn trong vòng 6 giờ đầu tiên nhập viện cho 22 bệnh viện tham gia. Điều tra viên chính tại mỗi địa điểm chịu trách nhiệm cho việc khai thác dữ liệu chính xác từ các hồ sơ y tế vào Nghiên cứu Dữ liệu Điện tử (REDCap), nơi độ bão hòa oxy và nồng độ oxy khí hít vào cùng một lúc được tóm tắt cùng nhau. Nếu các biến này được thu thập nhiều hơn một lần trong vòng 6 giờ đầu tiên, thì các giá trị thấp nhất được ghi lại. Chúng tôi đã đánh giá SpO 2/FiO2 là một biến số liên tục, cũng như biến phân loại bằng cách tạo các điểm cắt SpO 2/FiO2 được chọn tùy ý sau đây: <100, 100 – <200 và 200 – <300. Các ngưỡng cắt được đơn giản này được chọn theo phương pháp thực nghiệm để ước tính PaO 2/FiO2 Chúng tôi đánh giá khả năng dự đoán của SpO 2/FiO2 cho ARDS như một biến duy nhất cũng như điều chỉnh cho tất cả các biến LIPS được thiết lập khác (ngoại trừ SpO 2 và FiO2 để tránh trùng lặp), APACHE 2, tuổi tác, và điều kiện phối hợp khác có thể ảnh hưởng đến SpO2/FiO2 (hút thuốc lá, COPD, hen, xạ trị ngực và bệnh phổi mô kẽ).
3.3 Các biến kết quả
Kết quả chủ yếu là sự phát triển của ALI hoặc ARDS trong thời gian nằm viện. Tại thời điểm thu thập dữ liệu, sự hiện diện của ALI/ARDS được xác định theo tiêu chuẩn hội nghị tiêu chuẩn của Mỹ và Châu Âu (1994): sự phát triển của thâm nhiễm phổi hai bên, cấp tính và thiếu oxy máu (ALI: PaO2/FiO2 <300 và ARDS: PaO2/FiO2 <200) không có dấu hiệu lâm sàng của tăng áp tâm nhĩ trái như giải thích cho phù phổi. [5] Tuy nhiên, kể từ định nghĩa Berlin loại bỏ thuật ngữ ALI và phân loại lại tình trạng thiếu oxy trong phạm vi của PaO2/FiO2 <300 thành ARDS. [6] Do đó, chúng tôi đã sử dụng thuật ngữ ARDS trong báo cáo kết quả của chúng tôi. Các biện pháp kết cục thứ cấp bao gồm tử vong tại bệnh viện, ngày phát triển ARDS bệnh viện và ngày tử vong bệnh viện, liên quan đến giá trị SpO2/FiO2.
3.4 Phân tích thống kê
Lần đầu tiên chúng tôi thực hiện các phân tích đơn biến để xác định mối liên hệ giữa SpO2/FiO2 với sự phát triển của ARDS và tử vong tại bệnh viện. Sau đó, chúng tôi đã tập hợp mô hình hồi quy logistic đa biến bằng cách bao gồm SpO 2/FiO2 như một biến liên tục, tất cả các biến LIPS (ngoài độ bão hòa và nồng độ ôxy để tránh trùng lặp) và các điều kiện hấp thụ có thể ảnh hưởng đến SpO 2/FiO2. Trong phân tích độ nhạy, chúng tôi thay thế biến SpO2/FiO2 liên tục cho dạng phân loại bằng cách tạo 3 biến giả đại diện cho ngưỡng cắt SpO2/FiO2 đã xác định trước đó: <100, 100 -<200 và 200 -<300.
Chúng tôi cũng đánh giá SpO 2/FiO2 là một biến duy nhất trong một mô hình phù hợp. Chúng tôi đã phân tích các mô hình hồi quy logistic này để có khả năng phân biệt đối xử với những bệnh nhân tiếp tục phát triển ARDS từ những người không có kết quả thứ cấp trong tử vong của bệnh viện. Sau đó, chúng tôi sử dụng các ngưỡng cắt SpO2/FiO2 có nguồn gốc thực nghiệm (<100, <200 và <300) để tính độ nhạy, độ đặc hiệu và giá trị tiên đoán dương và âm cũng như tỷ lệ khả năng dương và âm của các biến này để dự đoán sự phát triển ARDS.
Cuối cùng, chúng tôi đã nghiên cứu phân phối kết quả thứ cấp, khám phá bao gồm ngày phát triển ARDS của bệnh viện và ngày tử vong bệnh viện liên quan đến ngưỡng cắt SpO 2/FiO2 theo kinh nghiệm (<100, <200 và <300) và đánh giá ý nghĩa tương ứng của nó. Phân tích 1 chiều phương pháp thử nghiệm phương sai, giả định phương sai bất bình đẳng. Phân bố tần số được trình bày dưới dạng tỷ lệ phần trăm, có nghĩa là với độ lệch chuẩn, hoặc trung vị với dải phân cách liên tiếp (IQR; thứ nhất và thứ ba), nếu thích hợp.
Đánh giá rủi ro được báo cáo là tỷ lệ chênh lệch (ORs) với khoảng tin cậy 95% (CIs). Thể hình của mô hình hồi quy được biểu diễn bằngđường cong đặc trưng của máy thu-vận hành. Giá trị P nhỏ hơn 0,05 được coi là có ý nghĩa thống kê. Tất cả các phân tích thống kê được thực hiện bằng phần mềm thống kê JMP 9.0.1 và SAS 9.1.3 (SAS Institute Inc, Cary, North Carolina).
4. Kết quả
Thông tin chi tiết về nhân khẩu học và đặc điểm lâm sàng của 5584 bệnh nhân thuộc nhóm LIPS-1 đã được mô tả. Trong số 5584 bệnh nhân trong nhóm thuần tập, chúng tôi ghi nhận tất cả 4646 bệnh nhân có giá trị SpO2/FiO2 trong vòng 6 giờ sau khi nhập viện.
Tổng số 321 bệnh nhân đã phát triển ARDS trong thời gian nằm viện, phần lớn trong khoảng từ 2 đến 5 ngày; trong số này 198 phát triển ARDS từ trung bình đến nặng theo tiêu chí Berlin. [6] Có 1 bệnh nhân phát triển ARDS vào ngày nhập viện (từ 6 đến 24 giờ sau khi nhập viện), 72 bệnh nhân phát triển ARDS vào ngày thứ hai (từ 24 đến 48 giờ), 110 ngày thứ ba và 60 vào ngày thứ tư và thứ năm sau nhập viện. Hơn 96% bệnh nhân cần thông khí xâm lấn và/hoặc không xâm lấn.
Trong số 12 bệnh nhân ARDS không thở máy, có 8 ARDS nhẹ theo tiêu chuẩn Berlin. Có mối liên hệ thống kê, không điều chỉnh giữa SpO2/FiO2 và phát triển ARDS, P .001 (Bảng 1).
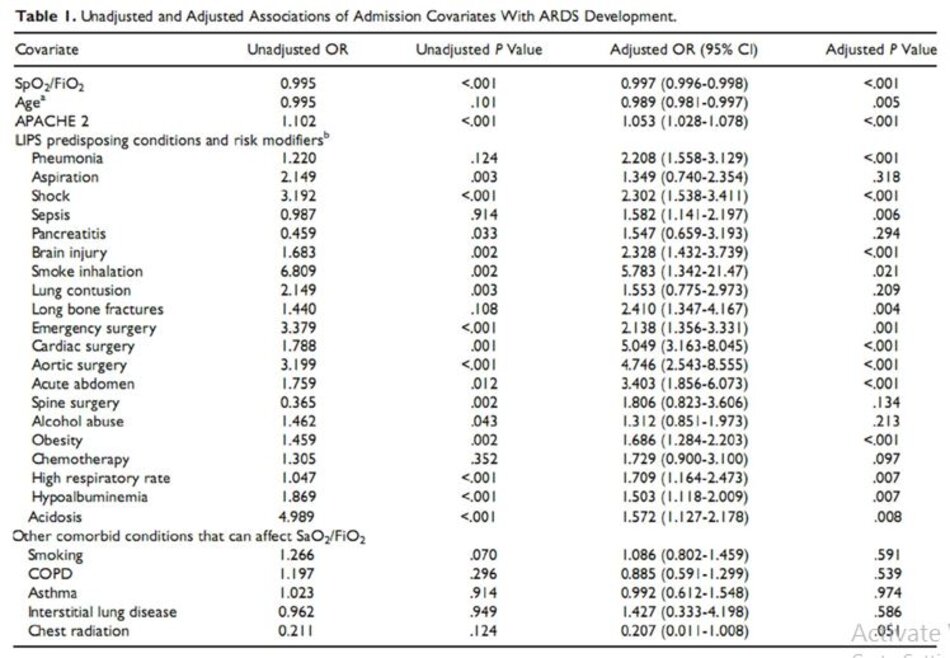
Giá trị trung bình SpO2/FiO2 (25% -75% IQR, không phân bố) trong toàn bộ nhóm là 448 (307, 467), và giá trị trung bình SpO2/FiO2 ở những người đã phát triển và không phát triển ARDS là 254 (100, 438 ) và 452 (329, 467), tương ứng. Khi điều chỉnh theo độ tuổi, các yếu tố kết hợp, APACHE 2 và các biến LIPS khác, SpO2/FiO2 vẫn liên kết độc lập với phát triển ARDS như một biến liên tục (Bảng 1) cũng như tại mỗi lần cắt định trước (Bảng 2). Khả năng phân biệt của mô hình này là tốt với diện tích dưới đường cong (AUC) là 0,81. Khả năng phân biệt của mô hình với SpO2/FiO2 là một biến duy nhất cho thấy AUC là 0,74.
Trong số những người phát triển ARDS, 77 người chết trong bệnh viện với tỷ lệ tử vong là 24% (OR 7.96, KTC 95% = 5.90-10.74, P <.0001). Giá trị trung bình nhập viện của SpO2/FiO2 ở những người đã chết và sống sót sau khi xuất viện là 298 (100, 443) và 452 (325, 467), tương ứng. Có một mối liên hệ có ý nghĩa thống kê, không điều chỉnh giữa SpO2/FiO2 và tử vong bệnh viện, P .001. Khi điều chỉnh theo tuổi tác, các yếu tố kết hợp, APACHE 2 và các biến LIPS khác, SpO2/FiO2 vẫn độc lập liên quan đến tỷ lệ tử vong bệnh viện, nhưng không đạt ý nghĩa thống kê với tất cả các ngưỡng cắt kinh nghiệm (Bảng 2). Khả năng phân biệt của mô hình này là tốt với AUC là 0,86. Khả năng phân biệt của mô hình với SpO2/FiO2 là một biến duy nhất cho thấy AUC là 0,70.
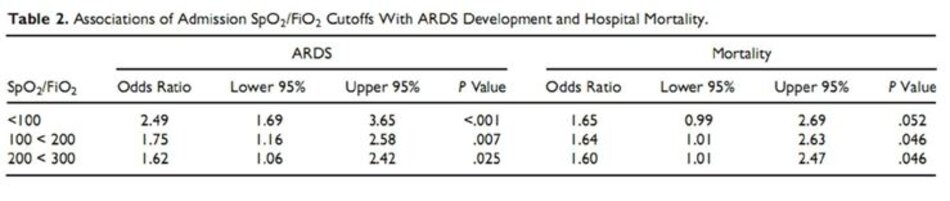
Công dụng của các ngưỡng cắt SpO2/FiO2 khác nhau cho dự đoán ARDS với độ nhạy, độ đặc hiệu, giá trị tiên đoán dương và âm tương ứng, và tỷ lệ khả năng âm và dương được trình bày trong Bảng 3. Ba giới hạn được trình bày thể hiện độ đặc hiệu tốt (94%, 88%, và 78%, tương ứng) trong khi độ nhạy thấp (tương ứng là 24%, 42% và 53%). Dựa trên SpO2/FiO2 nhập viện, tần suất phát triển ARDS trong bệnh viện tiếp theo tăng từ 15% trong nhóm điểm cắt <300 lên 24% ở nhóm điểm cắt <100.
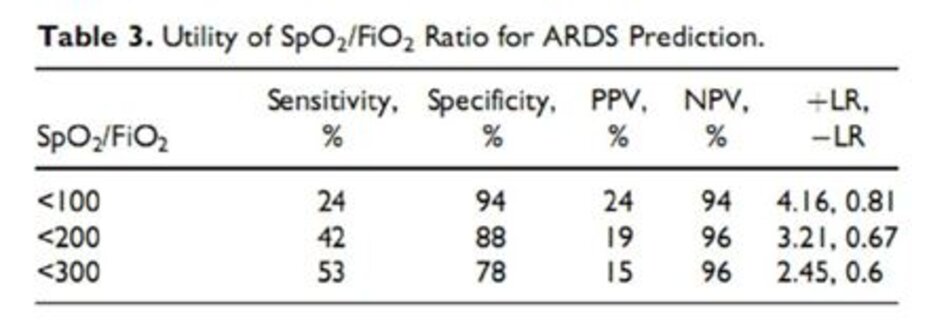
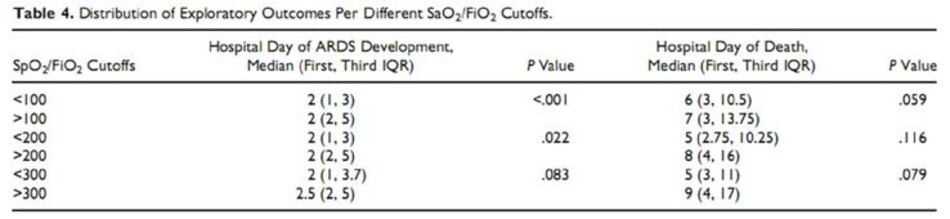
Cuối cùng, sự phân bố và tầm quan trọng của các kết quả thăm dò thứ cấp bao gồm ngày phát triển ARDS của bệnh viện và ngày bệnh viện tử vong liên quan đến ngưỡng cắt SpO2/FiO2 theo kinh nghiệm (<100, <200 và <300) được thể hiện trong Bảng 4. Điềm cắt thấp hơn có liên quan đến phát triển ARDS sớm hơn.
5. Thảo luận
Chúng tôi đã chứng minh rằng SpO 2/FiO2, như một dấu hiệu của oxy hóa suy giảm tại thời điểm nhập viện, là một yếu tố dự báo đáng kể về phát triển ARDS sớm và tử vong bệnh viện trong một nhóm bệnh nhân có nguy cơ. Ngoài ra, những người có giá trị SpO2/FiO2 thấp hơn dường như đã khởi phát sớm ARDS trong bệnh viện và xu hướng về cái chết sớm hơn, so với những người có giá trị SpO2/FiO2 cao hơn khi nhập viện.
Nhiều nghiên cứu đã chứng minh rằng SpO2/FiO2 có thể là một dấu hiệu đáng tin cậy của sự suy giảm oxy hóa. Nó được chứng minh là có mối tương quan tuyệt vời với PaO2/FiO2 ở những bệnh nhân suy hô hấp cấp tính và ở những bệnh nhân có thông khí áp lực dương. [7-12] Lưu ý, như các quần thể và phương pháp luận trong các nghiên cứu này khác nhau, phương trình hồi quy và các giá trị ngưỡng đã xác định cũng thay đổi đáng kể. Các SpO 2/FiO2 cũng được tìm thấy là hữu ích trong dự đoán thành công hay thất bại của thông khí không xâm lấn cả tại thời điểm bắt đầu của nó và theo dõi. [13-15] Hơn nữa, SpO2/FiO2 đã chứng minh hữu ích trong việc tính toán các điểm suy cơ quan trong khi không có lấy mẫu khí máu động mạch xâm lấn, bao gồm điểm tổn thương phổi (lung injury scores), đ[1iể6m] đánh giá suy cơ quan tuần tự (sequential organ failure assessments), đ[1iể7m,18s]inh lý cấp tính đơn giản II (simplified acute physiology score II),[19] và điểm số rối loạn chức năng đa cơ quan (multiorgan dysfunction scores). [20] Các đặc điểm không xâm lấn và tính toán dễ dàng cho phép đánh giá nhanh mức độ suy giảm oxy và điều này có thể dẫnđến việc nhận dạng ARDS sắp xảy ra sớm.
Điều này có lẽ tương tự với bệnh nhân nhiễm trùng huyết nhập khoa Cấp cứu với độ bão hòa oxy tĩnh mạch trung tâm thấp (ScvO2). Rivers và cộng sự đã chứng minh giá trị của việc chẩn đoán ScvO2 sớm, trong đó, trong số các thông số khác, đã hướng dẫn sự can thiệp nhanh chóng của các can thiệp trị liệu và dẫn đến kết quả được cải thiện ở bệnh nhân nhiễm trùng huyết, cũng có thể theo dõi SpO2/FiO2 liên tục trong thời gian bệnh viện có thể có khả năng tiên đoán tương tự ngoài phép đo đơn tại thời điểm đánh giá Cấp cứu ban đầu.
Điều này gần đây đã được chứng minh ở những bệnh nhân nhiễm trùng huyết, ở đó các phép đo SpO2/FiO2 được thu thập đến 8 giờ sau khi nhập viện vào đơn vị chăm sóc đặc biệt. [22] Điều quan trọng là phải nhấn mạnh rằng oxy bị suy giảm được chỉ định bởi SpO2/FiO2 thấp không phải là kết quả của sinh lý shunt phổi do viêm phổi và/hoặc tổn thương phổi, ví dụ, nhưng là một hệ quả của cú sốc, do nồng độ oxy tĩnh mạch hỗn hợp thấp. Như vậy, SpO 2/FiO2 phản ánh những bất thường oxy hóa sớm có nguồn gốc từ các chuyển động liên quan đến sốc và hệ thống, có liên quan đến sốc.
Kết quả của chúng tôi cũng cho thấy có sự chậm trễ thời gian giữa bản trình bày ban đầu với SpO 2/FiO2 thấp và ARDS được thiết lập đầy đủ. Quan trọng hơn, khoảng thời gian này có thể là một cơ hội để phòng ngừa hoặc điều trị sớm ARDS sắp xảy ra. Thật vậy, các thử nghiệm phòng ngừa liên tục, nghiên cứu phòng chống tổn thương phổi với aspirin (NCT01504867) và nghiên cứu phòng chống tổn thương phổi với budesonide và -agonist (NCT01783821), hiệnđang đánh giá khả năng phòng ngừa ARDS. [23] Những điều tra này sử dụng LIPS để ước tính nguy cơ ARDS. Tuy nhiên, một khi được ước tính, điểm tổng hợp LIPS không dễ dàng phân biệt giữa những người đã phát triển tổn thương phổi và những người có nguy cơ nhưng không bị tổn thương phổi tại thời điểm tính toán điểm. Nghiên cứu của chúng tôi nhắc lại tầm quan trọng và khả năng suy giảm oxy sớm trong việc xác định những người sẽ không chống lại ARDS được thiết lập đầy đủ sớm, trong vòng 24 đến 48 giờ. Khả năng dự đoán của SpO2/FiO2 dưới dạng một biến (tổng hợp) duy nhất cho ARDS trong nhóm thuần tập của chúng tôi là rất tốt (AUC 0.74). Gần đây, định nghĩa của Berlin đã củng cố quan điểm cho rằng tỷ lệ tử vong ARDS tăng lên đáng kể với mức độ thiếu oxy máu cao hơn được đánh giá với PaO2/FiO2. [6] Trong nghiên cứu của chúng tôi, điều này có thể quan trọng vì 2 lý do chính. Đầu tiên, như dữ liệu của chúng tôi cho thấy, các phép đo suy giảm oxy trước đó có thể chứng minh được tỷ lệ tử vong ở những người không có ARDS được thiết lập đầy đủ tại thời điểm đo. Thứ hai, các chiến lược điều trị và hỗ trợ sớm hơn ở những người bị chấn thương phổi nhẹ hơn có lẽ có thể làm giảm bớt hoặc ngăn chặn sự tiến triển thành các dạng ARDS nặng hơn. Thật vậy, 33% bệnh nhân ARDS nhẹ và 13% bệnh nhân ARDS vừa phải trong nhóm thuần tập định nghĩa ở Berlin tiến triển đến các giaiđoạn nặng hơn của ARDS. [6]
Do đó, phân tầng sớm nguy cơ tiến triển của bệnh nhân thành ARDS dựa trên suy giảm oxy có thể là yếu tố quan trọng để ngăn ngừa hoặc cải thiện ARDS và cải thiện tỷ lệ tử vong có liên quan. Làm thế nào sớm là sớm và những gì thời gian tối ưu và can thiệp là chưa rõ ràng, nhưng điều này có lẽ có thể phụ thuộc vào mức độ thiếu oxy như ước tính bởi các dấu hiệu đơn giản và dễ dàng xác định như SpO 2/FiO2. Điểm ALI sớm (EALI) mới được báo cáo gần đây đã chứng minh khả năng tiên đoán để xác định bệnh nhân tiến triển ARDS trước khi cần thở thông khí áp lực dương. [24]
Quan trọng hơn, điểm số này phụ thuộc rất nhiều vào các biện pháp oxy hóa, đặc biệt là yêu cầu oxy để duy trì độ bão hòa trong khoảng ổn định, ngoài sự hiện diện thâm nhiễm hai bên trên X quang ngực. Khái niệm lặp lại dường như là suy giảm ôxy, cho dù nó được đo bằng độ bão hòa oxy thấp, yêu cầu oxy cao, SpO 2/FiO2, PaO2/FiO2 hoặc EALI, thiết lập vai trò của nó trong việc dự đoán thời gian phát triển ARDS, mức độ nghiêm trọng của nó, và tỷ lệ tử vong liên quan của nó. Chúng tôi muốn bình luận về cách thức điểm cắt SpO2/FiO2 nhập viện khác nhau ảnh hưởng đến 2 kết quả thăm dò trong nghiên cứu của chúng tôi, ngày bệnh viện phát triển ARDS và ngày bệnh viện tử vong. Mặc dù có ý nghĩa thống kê rõ rệt giữa các nhóm trong các ngày điều trị ARDS của bệnh viện, nhưng ý nghĩa lâm sàng ít rõ ràng hơn trong những ngày trung bình tương tự để phát triển ARDS trong cả 3 lần cắt giảm (Bảng 4). Đây là một hạn chế khi chúng tôi không thể phân tích lại thời gian để tiến triển ARDS trong vài giờ, thay vì vài ngày, có thể có ý nghĩa lâm sàng hơn.
Ngược lại, mặc dù ngày trung bình nằm bệnh viện đến tử vong rõ ràng là khác nhau giữa các nhóm (Bảng 4), điều này không đạt được ý nghĩa thống kê có lẽ do mẫu nhỏ bệnh nhân tử vong. Có những hạn chế khác trong nghiên cứu của chúng ta nên được thảo luận thêm. Phân tích thứ cấp về dữ liệu tiềm năng được thu thập trước đây có thể đã đưa ra nhiễu và gây nhầm lẫn đáng kể. Mặc dù chúng tôi đã cố gắng giảm thiểu những điều này với việc sử dụng phương pháp thống kê, khả năng nhiễu không được bảo đảm vẫn còn. Có lẽ hạn chế quan trọng nhất là liên quan đến xác định chắc chắn của SpO 2/FiO2 như là một biến dự báo, bao gồm bão hòa oxy và nồng độ oxy khí hít vào. Nhiều yếu tố, bao gồm dạng sóng đo oxy không ổn định, đầu dò đo oxy không sạch và không đảm bảo vị trí, chuyển động của bệnh nhân và tình trạng bệnh, có thể làm giảm độ chính xác của độ bão hòa xác định. [25,26] Tương tự như trường hợp ước lượng nồng độ oxy khí hít vào, đặc biệt là do bệnh nhân đang thở một cách tự phát và không phải với sự trợ giúp của máy thở.
Mặc dù hướng dẫn đồng thuận [6] hỗ trợ việc sử dụng đánh giá đo lường PaO2/FiO2 và SpO2/FiO2 ở người lớn và trẻ em không nhận được thông khí cơ học thông qua ống nội khí quản, các phép đo có thể kém chính xác hơn khi oxy được truyền qua hệ thống không kín, 17% trong nhóm thuần tập thiếu một giá trị cần thiết cho phép tính SpO2/FiO2 và do đó, chúng bị loại trừ. Thường xuyên hơn, giá trị còn thiếu là nồng độ oxy khí hít vào (14%) và độ bão hòa oxy ít thường xuyên hơn (3%). Tuy nhiên, bất chấp những hạn chế về độ chính xác của xác định SpO2/FiO2, các ngưỡng cắt giảm kinh nghiệm được bắt nguồn trên phạm vi rộng của thiếu oxy (SpO 2/FiO2 <300) và tất cả đều được phát hiện độc lập với sự phát triển sớm của ARDS. Thật vậy, các phép đo SpO2/FiO2 được chuẩn hóa có thể đáng tin cậy hơn so với các thử nghiệm quan sát trước đó.
Độ nhạy của các phép đo SpO 2/FiO2 một mình cho dự đoán ARDS là kém đến khiêm tốn. Có lẽ kết hợp SpO2/FiO2 với các biến xác định dễ dàng khác có thể chứng minh là nhạy cảm hơn trong các nghiên cứu trong tương lai. Một số bệnh nhân, mặc dù thiếu oxy máu sớm, chưa bao giờ tiến triển thành ARDS hoàn toàn thành lập. Có thể chỉ có những người được tiếp xúc với các “lượt truy cập” phụ bổ sung được tiến triển thành ARDS được thiết lập đầy đủ như được chứng minh gần đây bởi Ahmed và cộng sự. [27] Cũng có thể nhiều bệnh nhân bị thiếu oxy máu có các sinh lý bệnh cơ bản khác với bệnh nhân đặc trưng cho ALI. Tuy nhiên, khả năng dự đoán của SpO 2/FiO2 thấp như một biến tổng hợp đơn là tốt hơn so với LIPS (25% ở mức cắt SpO 2/FiO2 thấp nhất so với 18% cho LIPS 4, tương ứng). Ngoài ra, khả năng phân biệt của SpO 2/FiO2 là một biến duy nhất cho dự đoán ARDS với AUC là 0,74 không thua kém khả năng phân biệt của LIPS phức tạp (AUC là 0,80). Chúng tôi không biết SpO2/FiO2 dự báo sẽ như thế nào trong một quần thể khác với mức tăng nguy cơ ARDS.
Ngoài ra, khi dữ liệu được thu thập từ nghiên cứu thuần tập đa trung tâm, có thể xem xét khả năng biến đổi xác định SpO 2/FiO2 giữa các trung tâm khác nhau. Các thủ tục xác định SpO2 và FiO2 quyết định rằng nếu có hơn 1 phép đo, thì giá trị tồi tệ nhất trong 6 giờ đầu tiên được ghi lại. Chúng tôi giả định, theo thực tế lâm sàng thông thường rằng các phép đo của yêu cầu bão hòa và oxy đã được thực hiện cùng một lúc; tuy nhiên, chúng tôi không thể xác nhận thời gian chính xác của các phép đo này một cách hồi tố. Vì các trung tâm tham gia hầu hết là các trung tâm học tập, giàu kinh nghiệm trong thu thập dữ liệu, và tất cả các nhà điều tra đã hoàn thành một khóa đào tạo và theo một hướng dẫn vận hành tiêu chuẩn hóa để thu thập dữ liệu, những mối quan tâm rõ ràng này đã phần nào bớt đi. Kích thước mẫu lớn và thu thập dữ liệu tiềm năng là những điểm mạnh bổ sung của cuộc điều tra này.
6. Kết luận
Các SpO2/FiO2 đo trong vòng 6 giờ đầu tiên nhập viện cho bệnh viện là một chỉ số độc lập về phát triển ARDS sớm ở những bệnh nhân có nguy cơ. SpO 2/FiO2 có thể được xem như là một dấu hiệu cảnh báo sớm về suy hô hấp sắp tới do ARDS ở những bệnh nhân có nguy cơ cao. Ít hơn SpO2/FiO2 có thể chỉ ra sự tiến triển sớm hơn đối với ARDS được thiết lập đầy đủ. Điều này có thể quan trọng đối với các thử nghiệm trong tương lai về phòng ngừa và điều trị sớm ARDS.
7. References
1. Zambon M, Vincent J-L. Mortality rates for patients with acute lung injury/ARDS have decreased over time. Chest. 2008; 133(5):1120-1127.
2. Phua J, Badia JR, Adhikari NKJ, et al. Has mortality from acute respiratory distress syndrome decreased over time? A systematic review. Am J Respir Crit Care Med. 2009;179(3):220-227.
3. Herridge MS, Tansey CM, Matte´ A, et al. Functional disability 5 years after acute respiratory distress syndrome. N Engl J Med. 2011;364(14):1293-1304.
4. Gajic O, Dabbagh O, Park PK, et al. Early identification of patients at risk of acute lung injury: evaluation of lung injury prediction score in a multicenter cohort study. Am J Respir Crit Care Med. 2011;183(4):462-470.
5. Bernard GR, Artigas A, Brigham KL, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994;149(3 pt 1):818-824.
6. Ferguson ND, Fan E, Camporota L, et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Med. 2012;38(10):1573- 1582.
7. Rice TW, Wheeler AP, Bernard GR, et al. Comparison of the SpO2/FiO2 ratio and the PaO2/FiO2 ratio in patients with acute lung injury or ARDS. Chest. 2007;132(2):410-417.
8. Khemani RG, Patel NR, Bart RD III, Newth CJ. Comparison of the pulse oximetric saturation/fraction of inspired oxygen ratio and the PaO2/fraction of inspired oxygen ratio in children. Chest. 2009;135(3):662-668.
9. Khemani RG, Thomas NJ, Venkatachalam V, et al. Comparison of SpO2 to PaO2 based markers of lung disease severity for children with acute lung injury. Crit Care Med. 2012;40(4):1309-1316.
10. Thomas NJ, Shaffer ML, Willson DF, Shih MC, Curley MA. Defining acute lung disease in children with the oxygenation saturation index. Pediatr Crit Care Med. 2010;11(1):12-17.
11. Tripathi RS, Blum JM, Rosenberg AL, Tremper KK. Pulse oximetry saturation to fraction inspired oxygen ratio as a measure of hypoxia under general anesthesia and the influence of positive end-expiratory pressure. J Crit Care. 2010;25(3):542.e549-542. e513.
12. Lobete C, Medina A, Rey C, Mayordomo-Colunga J, Concha A, Menendez S. Correlation of oxygen saturation as measured by pulse oximetry/fraction of inspired oxygen ratio with PaO(2)/fraction of inspired oxygen ratio in a heterogeneous sample of critically ill children. J Crit Care. 2013;28(4):538.e1-e7.
13. Spada C, Gandhi R, Patel SR, Nuccio P, Weinhouse GL, Lee PS. Oxygen saturation/fraction of inspired oxygen ratio is a simple predictor of noninvasive positive pressure ventilation failure in critically ill patients. J Crit Care. 2011;26(5):510-516.
14. Munoz Bonet JI, Flor Macian EM, Brines J, et al. Predictive factors for the outcome of noninvasive ventilation in pediatric acute respiratory failure. Pediatr Crit Care Med. 2010;11(6):675-680.
15. Mayordomo CJ, Pons M, Lopez Y, et al. Predicting non-invasive ventilation failure in children from the SpO2/FiO2 (SF) ratio. Intensive Care Med. 2013;39(6):1095-1103.
16. Murray JF, Matthay MA, Luce JM, Flick MR. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis. 1988;138(3):720-723.
17. Vincent JL, Moreno R, Takala J, et al. The SOFA (Sepsis-related organ failure assessment) score to describe organ dysfunction/failure. On behalf of the working group on sepsis-related problems of the European society of intensive care medicine. Intensive Care Med. 1996;22(7):707-710.
18. Pandharipande PP, Shintani AK, Hagerman HE, et al. Derivation and validation of SpO2/FiO2 ratio to impute for PaO2/FiO2 ratio in the respiratory component of the sequential organ failure assessment score. Crit Care Med. 2009;37(4):1317-1321.
19. Le Gall JR, Lemeshow S, Saulnier F. A new simplified acute physiology score (SAPS II) based on a European/North American multicenter study. JAMA. 1993;270(24):2957-2963.
20. Marshall JC, Cook DJ, Christou NV, Bernard GR, Sprung CL, Sibbald WJ. Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome. Crit Care Med. 1995;23(10):1638-1652.
21. Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001;345(19):1368-1377.
22. Serpa Neto A, Cardoso SO, Ong DSY, et al. The use of the pulse oximetric saturation/fraction of inspired oxygen ratio for risk stratification of patients with severe sepsis and septic shock. J Crit Care. 2013;28(5):681-686.
23. Kor DJ, Talmor DS, Banner-Goodspeed VM, et al. Lung injury prevention with aspirin (LIPS-A): a protocol for a multicentre randomised clinical trial in medical patients at high risk of acute lung injury. BMJ Open. 2012;2(5).
24. Levitt JE, Calfee CS, Goldstein BA, Vojnik R, Matthay MA. Early acute lung injury: criteria for identifying lung injury prior to the need for positive pressure ventilation. Crit Care Med. 2013;41(8):1929-1937.
25. Sasse SA, Chen PA, Mahutte CK. Variability of arterial blood gas values over time in stable medical ICU patients. Chest. 1994; 106(1):187-193.
26. Jubran A. Pulse oximetry. In: Hedenstierna G, Mancebo J, Brochard L & Pinsky MR, eds. Applied Physiology in Intensive Care Medicine. Berlin, Heidelberg: Springer; 2009:45-48.
27. Ahmed AH, Litell JM, Malinchoc M, et al. The role of potentially preventable hospital exposures in the development of acute respiratory distress syndrome: a population-based study [published online August 26, 2013]. Crit Care Med. 2013.