Bài viết Xác định không đồng bộ bệnh nhân – máy thở bằng cách sử dụng phân tích biểu đồ dạng sóng được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Identifying Patient-Ventilator Asynchrony Using Waveform Analysis
Tóm tắt
Một tỷ lệ đáng kể các bệnh nhân thở máy ở ICUs cho thấy một số dạng không đồng bộ bệnh nhân – máy thở (PVA, patient-ventilator asynchrony). Sự hiện diện của PVA có liên quan đến các biến chứng ảnh hưởng đến kết cục lâm sàng và các mục tiêu mà thông khí cơ học được sử dụng ở những bệnh nhân nặng. Hiện tại, máy thở có thể hiển thị các dạng sóng khác nhau cho phép xác định các loại PVA khác nhau theo cách không xâm lấn và đáng tin cậy. Tuy nhiên, để thực hiện việc giải thích và xử trí PVA thích hợp, các BS phải được đào tạo về chủ đề này.
Mở đầu
Thông khí cơ học được sử dụng ở ICUs nhằm làm giảm công thở, duy trì sự trao đổi khí và dỡ bỏ gánh nặng cho các cơ hô hấp [1-3]. Tuy nhiên, các mục tiêu này khó có thể đạt được nếu không có sự tương tác đầy đủ giữa bệnh nhân và máy thở, được gọi là sự không đồng bộ của bệnh nhân – máy thở (PVA) [3]. Epstein [2] định nghĩa PVA là “bất kỳ điều kiện nào mà tương tác giữa máy thở và bệnh nhân không phải là tối ưu.”
Dựa trên bằng chứng, khoảng 25% bệnh nhân sẽ biểu hiện một số dạng không đồng bộ trong quá trình thông khí cơ học [4]. Vì lý do đó, các BS nên chú ý đến, đặc biệt là khi giảm mức an thần, các hệ thống làm ẩm chủ động được sử dụng và khi cài đặt các thông số, nhằm đảm bảo sự tương tác thích hợp và để ngăn ngừa các biến chứng liên quan đến PVA [Bảng 1].
Hiện tại, máy thở cơ học được sử dụng trong các ICU hiển thị các dạng sóng khác nhau, như: áp suất – thời gian, lưu lượng – thời gian và thể tích – thời gian. Một trong những lý do chính tại sao các máy thở hiện tại hiển thị thông tin này là để xác định xem có tương tác đầy đủ giữa bệnh nhân và máy thở không. Xác định PVA bằng cách sử dụng phân tích dạng sóng, là một phương pháp không xâm lấn và đáng tin cậy, cho thấy có mối tương quan tốt với các phương pháp khác tương đương như xác định PVA bằng đo áp suất thực quản [4].
| Bảng 1: Các biến chứng kết hợp với mất đồng bộ bệnh nhân – máy thở |
| – Tăng công thở.
– Gắng sức không hiệu quả. – Bẫy khí. – Kiềm hô hấp và căng phổi quá mức (Auto-triggering). – Căng phổi động. – Auto PEEP (cũng còn gọi là PEEP nội sinh = PEEPi). – Kết quả cai máy kèm. – Tăng liều an thần. – Nhầm lẫn về tình trạng hiện tại của bệnh nhân. – Rối loạn giấc ngủ. – Thời gian nằm ICU và thở máy kéo dài. |
Một số tác giả chỉ ra rằng việc giải thích PVA bằng cách sử dụng phân tích dạng sóng là một kỹ năng mà tất cả các BS tiếp xúc với bệnh nhân thông khí phải biết để ngăn ngừa sự xuất hiện của PVA và các biến chứng của nó [3,5-9] (Bảng 1). Tuy nhiên, việc giải thích PVA là một kỹ năng đòi hỏi phải đào tạo cụ thể. Ví dụ, trong một số trường hợp, các BS có thể xác định nhiều loại PVA trong đồ họa thở máy cùng một lúc, điều này làm cho việc phân tích khó hơn. Do đó, việc xác định PVA không phải là một nhiệm vụ dễ dàng.
Ramírez et al [10] đánh giá khả năng của 366 BS làm việc trong ICUs để xác định PVA bằng cách sử dụng phân tích dạng sóng. Kết quả cho thấy chỉ có 21% các BS có thể nhận ra tất cả các loại PVA. Ngoài ra, họ đã chứng minh rằng BS không có kinh nghiệm để xác định PVA một cách chính xác bằng cách sử dụng phân tích dạng sóng. Tuy nhiên, họ nhận thấy rằng BS đã được đào tạo cụ thể về thông khí cơ học làm tăng khả năng nhận dạng PVA bằng cách sử dụng phân tích dạng sóng.
Vì lý do này, mục tiêu của bài viết là xem xét các loại PVA, ảnh hưởng của chúng đến bệnh nhân thở máy và phân tích dựa trên dạng sóng máy thở.
Chỉ số không đồng bộ (Asynchrony Index)
Chỉ số không đồng bộ (Asynchrony Index, AI) được định nghĩa là số sự kiện không đồng bộ chia cho tổng số tần số hô hấp (số lần không đồng bộ/số lượng tần số hô hấp toàn bộ (Số sự kiện không đồng bộ + Số chu kỳ được cung cấp hiệu quả bởi máy thở) x 100 [11 ].
AI đã được sử dụng trong các nghiên cứu khác nhau để đánh giá tác động và các biến chứng liên quan đến PVA. Giá trị được biểu diễn dưới dạng phần trăm và giá trị ≥ 10% có liên quan đến các biến chứng [4,12,13]. Các biến chứng liên quan đến PVA được tóm tắt trong Bảng 1.
Không đồng bộ liên quan đến kích hoạt (Trigger)
Sự không đồng bộ liên quan đến trigger (biến số bắt đầu hít vào) là loại PVA thường gặp nhất và được nghiên cứu ở những bệnh nhân thông khí [4]. Chao và cộng sự đã so sánh một nhóm bệnh nhân có PVA liên quan đến kích hoạt so với nhóm không có loại PVA này [12]. Kết quả cho thấy chỉ có 16% bệnh nhân trong nhóm có PVA liên quan đến kích hoạt, đã cai máy thành công so với 57% thành công của nhóm bệnh nhân không có PVA. Cũng thấy rằng trong nhóm đầu tiên, thời gian trung bình của quá trình cai máy (tính theo ngày) cao hơn đáng kể so với nhóm thứ hai, có thể được giải thích thành cần nhiều ngày hơn để thông khí cơ học và nằm ICU.
Phân loại không đồng bộ liên quan đến kích hoạt gồm có: nỗ lực không hiệu quả (ineffective efforts), kích hoạt tự động (auto-triggering), kích hoạt kép (double triggering) và kích hoạt ngược (reverse trigger).
Nỗ lực không hiệu quả (Ineffective Effort)
Nỗ lực không hiệu quả được định nghĩa là “những nỗ lực của bệnh nhân không được cảm nhận bởi máy thở” [6]. Nói cách khác, bệnh nhân tạo ra một nỗ lực hít vào, nhưng máy thở không nhận ra và không cung cấp nhịp thở cho bệnh nhân. Đặc điểm chính của nỗ lực không hiệu quả là làm giảm áp lực đường thở trong biểu đồ áp lực – thời gian, gây ra bởi nỗ lực hô hấp của bệnh nhân, làm giảm áp lực đường thở và sự thay đổi lưu lượng thở ra (có xu hướng quay trở lại mức 0 do nỗ lực hít vào của bệnh nhân) mà không cung cấp nhịp thở từ máy thở [4,14] [Hình 1].
Loại PVA này thường gặp nhất và xuất hiện thường xuyên hơn trong giai đoạn thở ra (cũng có thể xảy ra trong giai đoạn hít vào), ở tất cả các chế độ thở máy [4,15].
Thille et al nhận thấy rằng kích hoạt kép và kích hoạt không hiệu quả đã chiếm hơn 98% tổng số các sự cố không đồng bộ (85% là sự kiện kích hoạt không hiệu quả, và 13% là sự kiện kích hoạt kép) [4]. Trong số các sự kiện kích hoạt không hiệu quả, 78% xảy ra trong thời kỳ thở ra và 7% trong giai đoạn hít vào. De Wit và cộng sự đã đạt được những kết quả tương tự, trong đó những nỗ lực không hiệu quả chiếm 88,3% tổng số PVA [16].
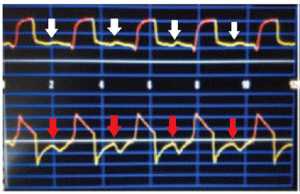
Loại PVA này phổ biến ở những bệnh nhân bị COPD, vì họ là những bệnh nhân phải tạo ra một nỗ lực tuyệt vời để vượt qua được auto-PEEP, còn được gọi là PEEP nội sinh [4, 9]. Mặt khác, những bệnh nhân này có thời gian thở ra ngắn, có thể gây bẫy khí, căng phổi động và auto-PEEP.
Tuy nhiên, có những nguyên nhân khác gây ra những nỗ lực không hiệu quả; ví dụ, cài đặt không thích hợp của độ nhạy trigger và mức độ hỗ trợ áp lực [4,12,17]. Leung và cộng sự đã chứng minh rằng khi mức hỗ trợ áp lực tăng làm giảm điều khiển hô hấp, dẫn đến bệnh nhân thở với thể tích khí lưu thông cao hơn, thời gian hít vào dài hơn và thời gian thở ra ngắn hơn, với những đặc điểm này sẽ thúc đẩy sinh ra nỗ lực không hiệu quả, dẫn đến bẫy khí, căng phổi động, auto-PEEP và những nỗ lực không hiệu quả [17].
Kích hoạt tự động (Auto-Triggering)
Kích hoạt tự động là một loại PVA có thể gây ra bởi rò rỉ trong bộ dây thở máy, ngưng tụ nước trong bộ dây, cài đặt không đúng độ nhạy và dao động của tim [6,14,19]. Kích hoạt tự động được định nghĩa là “thở không được lên lịch (dựa trên tần số hô hấp đặt) cũng không phải do bệnh nhân khởi xướng” gây thở nhanh hoặc tăng thông khí [6]
Có thể xác định tự động kích hoạt bằng cách nhìn vào biểu đồ áp lực – thời gian. Kích hoạt tự động hiển thị trong biểu đồ áp lực – thời gian, thiếu sự giảm áp lực đường thở hoặc các biến đổi trong dạng lưu lượng – thời gian ở giai đoạn khởi đầu của giai đoạn hô hấp (tức là thiếu trigger) [14] [Hình 2].
Các biến chứng liên quan đến loại PVA này bao gồm căng phổi động và kiềm hô hấp, có thể dẫn đến nhầm lẫn trong nhận định lâm sàng. Do đó, khi nghi ngờ kích hoạt tự động, điều quan trọng là đánh giá xem có nỗ lực hít vào trong biểu đồ sóng áp lực – thời gian không, kiểu thở, tình trạng chung, mức độ an thần, áp suất bóng chèn, vị trí ống nội khí quản, sự có mặt của ngưng tụ trong bộ dây máy thở, cài đặt độ nhạy trigger, dao động tim và loại máy thở được sử dụng [6,19-21].
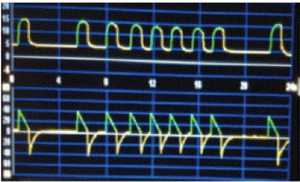
Trong một nghiên cứu ngẫu nhiên tiền cứu, Carteauxet đã đánh giá tần suất tự động kích hoạt tạo ra bởi các máy thở xâm lấn, bao gồm một thuật toán được sử dụng như một máy thở không xâm lấn so sánh với các máy thở không xâm nhập [21]. Trong một mẫu gồm 15 bệnh nhân, họ đã thực hiện 3 lần đo khoảng 20 phút mỗi lần, nơi họ thông khí cho bệnh nhân trước tiên sử dụng máy thở xâm nhập, với tùy chọn không xâm lấn đã bất hoạt; thứ hai, tùy chọn không xâm lấn được kích hoạt và bệnh nhân được thông khí không xâm lấn, sử dụng một giao diện mask mũi-miệng trong tất cả các trường hợp. Khi sử dụng thở không xâm lấn, tỷ lệ tự động kích hoạt thấp hơn đáng kể trong thở máy xâm lấn.
Một kết quả thú vị khác của nghiên cứu này là 27% trong số 15 bệnh nhân được đánh giá, biểu hiện AI > 10% khi thông khí xâm lấn với tùy chọn không xâm lấn được bất hoạt, nhưng chỉ có 13% với tùy chọn không xâm lấn được kích hoạt, và 0% khi sử dụng một máy thở không xâm lấn chuyên.
Điều quan trọng cần nhớ là một trong những đặc điểm chính của thông khí không xâm lấn là chúng sẽ bù lại sự rò rỉ, do đó sự xuất hiện của tự động kích hoạt sẽ không phải là vấn đề khi sử dụng loại máy thở này. Vì vậy, trong trường hợp thông khí xâm lấn, nguy cơ tự động kích hoạt sẽ luôn luôn có mặt, mặc dù thuật toán được sử dụng như là không xâm nhập đã được cài sẳn.
Như đã đề cập, nguyên nhân gây ra kích hoạt tự động khác là dao động tim. Imanaka và cộng sự đã đánh giá ảnh hưởng của việc kích hoạt lưu lượng so với kích hoạt áp lực ở 104 bệnh nhân sau phẫu thuật tim, phát hiện ra rằng khi kích hoạt lưu lượng, tỷ lệ tự động kích hoạt do dao động tim cao hơn, có liên quan đến áp lực đổ đầy thất cao, cung lượng tim cao, và tăng kích cỡ tim [19]. Một chương trình cài đặt trigger phù hợp không gây ra một nỗ lực lớn cho bệnh nhân, nhưng cũng không gây ra tự động kích hoạt.
Kích hoạt kép (Double Triggering)
Kích hoạt kép là một kiểu không đồng bộ có thể xảy ra trong các chế độ điều khiển bởi áp suất và thể tích [4].
Thille và các cộng sự thấy rằng các yếu tố liên quan đến tăng tần xuất kích hoạt kép là: tỷ lệ PaO2/FIO2 thấp, A/CV (thông khí hỗ trợ/điều khiển), thời gian hít vào ngắn, áp lực hít vào tối đa cao, và mức PEEP cao [4,22].
Kích hoạt kép có thể được định nghĩa là “hai chu kỳ được ngăn cách bởi thời gian thở ra rất ngắn, được định nghĩa là ít hơn một nửa thời gian hít vào trung bình, chu kỳ đầu tiên được kích hoạt bởi bệnh nhân” [4,15,24].
Loại PVA này có thể xảy ra khi thời gian hít vào của thần kinh dài hơn thời gian hít vào được đặt trên máy thở [2]. Điều này có thể gây ra hơi thở thứ hai bởi máy thở nếu nỗ lực gắng sức của bệnh nhân tiếp tục sau chu kỳ hít vào đến giai đoạn thở ra và nếu những nỗ lực này do bệnh nhân tạo ra có thể vượt qua ngưỡng kích hoạt được lập trình bởi bác sĩ lâm sàng [4].
Các nghiên cứu khác cũng đồng ý với những phát hiện của Thille et al., Takioka H và cộng sự cũng cho thấy có mối quan hệ giữa thời gian hít vào ngắn được lập trình trong máy thở và kích hoạt đôi, cũng liên quan đến nhu cầu thở cao [4,23].
Việc kích hoạt đôi có thể gây tổn hại lớn cho bệnh nhân thông khí vì nếu bệnh nhân không có đủ thời gian thở ra thì thể tích khí lưu thông từ nhịp thở thứ hai sẽ thêm vào thể tích khí lưu thông từ nhịp thở đầu có thể làm tăng gấp đôi thể tích khí lưu thông phân phối cho bệnh nhân gây ra quá căng phế nang, volutrauma và barotrauma. [Hình 3]
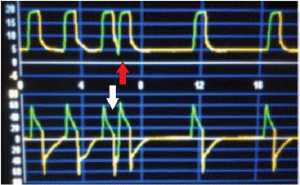
Điều quan trọng là phải nhận ra rằng chu trình đầu tiên được phân phối có thể được kích hoạt bởi nỗ lực của bệnh nhân hoặc máy thở. Liao và cộng sự phân loại kích hoạt kép thành các loại DT-P [double triggering by patient] (kích hoạt đôi khi bệnh nhân khởi động chu kỳ thứ nhất), DT-A [double triggering by auto-triggering] (kích hoạt kép khi chu kỳ đầu tiên được kích hoạt bằng kích hoạt tự động) và DT-V [double triggering by ventilator] (khi chu kỳ đầu tiên được kích hoạt bởi máy thở theo tiêu chuẩn đã được lập trình) [15]. Các kết quả trong cùng một nghiên cứu cho thấy DT-P có liên quan đến thời gian hít vào ngắn và một chương trình giảm thời gian hít vào làm giảm hoặc thậm chí là loại bỏ sự hiện diện của kích hoạt kép. Mặt khác, DT-V liên quan đến cài đặt tần số hô hấp và có thể được giải quyết bằng cách giảm thời gian hít vào hoặc chuyển sang chế độ tự thở (spontaneous). Những kỹ thuật này đã được áp dụng thành công ở 14 bệnh nhân.
Kích hoạt ngược (Reverse Triggering)
Kích hoạt ngược là một loại ít được công nhận của PVA. Muriaset al xác định kích hoạt ngược như “một loại PVA trong đó trung tâm hô hấp của bệnh nhân được kích hoạt để đáp ứng với tình trạng bơm phồng phổi thụ động” [25]. Trong quá trình kích hoạt ngược, có sự chậm trễ giữa sự khởi đầu của hơi thở được kích hoạt bằng máy và bắt đầu nỗ lực thở sâu của bệnh nhân. Kết quả là nỗ lực của bệnh nhân thường kéo dài đến khi giai đoạn hít vào được hoàn thành, điều này có thể gây ra kích hoạt kép nếu nỗ lực hít thở của bệnh nhân có thể vượt qua ngưỡng trigger được lập trình [25].
Biểu đồ áp lực – thời gian cho thấy nhịp thở được khởi động bởi máy thở (không có áp lực đường thở giảm xuống khi bắt đầu nhịp thở), và/hoặc áp lực đường thở trong giai đoạn hít vào và một phần của giai đoạn thở ra do sự kích hoạt hô hấp của bệnh nhân. Ngoài ra, sự cắt cụt hoặc biến dạng của lưu lượng đỉnh thở ra xuất hiện trên biểu đồ lưu lượng – thời gian chứng minh nỗ lực hô hấp của bệnh nhân được quan sát thấy [25] (Hình 4).
Akoumianaki et al chỉ ra rằng loại PVA này có thể gây co thắt liên tục của cơ hoành [26]. Sự co lại này liên quan đến việc giải phóng cytokine và tổn thương các sợi cơ. Ngoài ra, nó có thể sinh ra và làm tăng công hô hấp, tiêu thụ oxy, nhầm lẫn trong việc theo dõi áp lực bình nguyên và tăng áp lực bình nguyên ở các chế độ điều khiển thể tích.
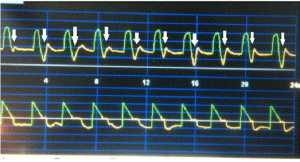
Không đồng bộ lưu lượng (Flow Asynchronies)
Loại PVA này xảy ra khi lưu lượng được lập trình trong máy thở không đáp ứng được yêu cầu về lưu lượng của bệnh nhân, làm tăng công thở. Nó xảy ra thường xuyên trong điều kiện thông khí với các chế độ kiểm soát thể tích, với suy hô hấp cấp và nhu cầu thông khí cao. Sự không đồng bộ của lưu lượng thường ít xảy ra hơn ở những bệnh nhân thở máy trong các chế độ kiểm soát áp lực vì lưu lượng là biến thiên [27-29].
Kallet et al so sánh hiệu quả của thông khí có kiểm soát áp suất và thông khí kiểm soát thể tích trên công thở ở bệnh nhân bị tổn thương phổi cấp tính và ARDS [27]. Họ thấy rằng công thở thấp hơn đáng kể trong chế độ kiểm soát áp lực.
Yang và cộng sự đã so sánh nỗ lực hô hấp trong VCV với PCV ở bệnh nhân suy hô hấp cấp bằng cách đo P0.1 (áp suất tạo ra trong 100 msec đầu tiên) [28]. Các kết quả thu được cho thấy P0.1 giảm 25% khi PCV được sử dụng, ngoài việc giảm sự khó chịu của bệnh nhân.
Macintyre và cộng sự gây ra sự không đồng bộ lưu lượng, bằng cách giảm lưu lượng chương trình 50% ở 16 bệnh nhân ổn định thở bằng thông khí A/C và sau đó đã cố gắng sửa chữa nó theo hai cách [30]. (1) Khởi tạo lưu lượng được lập trình ban đầu bằng cách thêm 25% giá trị lưu lượng ban đầu và (2) bằng chế độ áp lực. Đo lường nỗ lực hô hấp được thực hiện bằng cách tính sản phẩm thời gian áp suất (pressure-time product) và kiểu thở. Cả hai chiến lược đều cho thấy sự giảm đáng kể sự không đồng bộ lưu lượng: tuy nhiên, việc chuyển sang chế độ PCV hiệu quả hơn ở những bệnh nhân có mức độ không đồng bộ nghiêm trọng. Cần lưu ý rằng trong hầu hết các nghiên cứu, việc thở và khó chịu gây ra bởi dòng chảy không thích hợp giảm xuống khi áp dụng các phương thức kiểm soát áp lực ở bệnh nhân có nhu cầu thở máy cao, bởi vì họ thay đổi nỗ lực và nhu cầu thông khí trong mỗi nhịp thở [29]. Vì lý do này, việc lập trình một mức lưu lượng cố định (chẳng hạn như xảy ra trong các chế độ kiểm soát thể tích) sẽ tạo ra PVA do lưu lượng không được cung cấp đầy đủ.
Branson đã đề cập đến “phần dạng con sò” của dạng sóng áp suất – thời gian trong một nhịp thở được kích hoạt bởi bệnh nhân, là một dấu hiệu không đồng bộ của lưu lượng được công nhận. Nilsestuen và Hargett cũng đã đề cập đến làm thế nào để xác định không đồng bộ lưu lượng [31]. Họ giải thích rằng “khi nỗ lực của bệnh nhân tăng lên, lưu lượng đỉnh được đặt trên máy thở không còn đáp ứng nhu cầu lưu lượng của bệnh nhân và dạng sóng áp lực đường thở sẽ dần dần được đưa ra. Hiện tượng này được công nhận không chính thức là ” đói dòng” [8] [Hình 5].
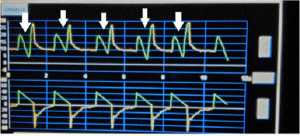
Chu kỳ sớm (Premature Cycling)
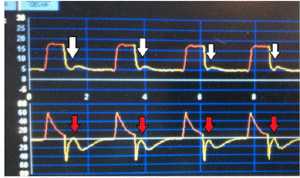
Chu kỳ có thể được xem là “biến số” được đo và sử dụng để kết thúc thì hít vào (và bắt đầu lưu lượng thở ra) [10]. Chu kỳ sớm cũng như kích hoạt kép là một dạng không đồng bộ xảy ra khi thời gian thở của thần kinh của bệnh nhân lớn hơn thời gian thở máy được cài đặt trong máy thở [8].
Sự khác biệt với kích hoạt kép, là trong chu kỳ sớm nỗ lực hô hấp của bệnh nhân không đủ để kích hoạt nhịp thở thứ hai. Chu kỳ sớm đã làm giảm đáng kể áp suất đường thở, có thể nhìn thấy ngay sau khi kết thúc giai đoạn hít vào đã được cài đặt trên máy thở, cùng với sự gia tăng lưu lượng hít vào có thể nhìn thấy trong biểu đồ lưu lượng – thời gian [32] (Hình 6).
Loại PVA này có thể bị lẫn lộn với một nỗ lực không hiệu quả trong giai đoạn thở ra, với sự khác biệt là chu kỳ sớm phản ứng lại sự thay đổi thời gian hít vào hoặc chu kỳ được cài đặt; còn nỗ lực không hiệu quả đáp ứng với những thay đổi về mức PEEP, mức độ nhạy trigger hoặc mức hỗ trợ PS [23].
Một điểm khác biệt nữa là ở chu kỳ sớm, áp suất đường thở sẽ giảm ngay sau khi giai đoạn hít vào kết thúc, cho thấy nỗ lực thở của bệnh nhân vẫn tiếp tục.
Takioka và cộng sự đã đánh giá ảnh hưởng của chu kỳ (độ nhạy thở ra) ở 45%, 35%, 20%, 5% và 1% lưu lượng đỉnh hít vào ở 8 bệnh nhân thông khí dưới chế độ hỗ trợ áp lực [23]. Họ phát hiện ra rằng có tăng công hô hấp và không đồng bộ (chu kỳ sớm và kích hoạt đôi) khi chu kỳ máy thở đặt ở 45 và 35% lưu lượng đỉnh hít vào (0.31 ± 0.12 J/L so với 0.51 ± 0.11 J/L với tiêu chuẩn chu kỳ là 1 % và 45%, tương ứng). Tỷ lệ phần trăm các tiêu chuẩn chu kỳ càng lớn, thời gian hít vào càng ngắn [8]. Do đó, khi bệnh nhân được thở bằng thông khí hỗ trợ áp lực, rất quan trọng xem xét khía cạnh này trong cài đặt để đảm bảo thông khí thích hợp.
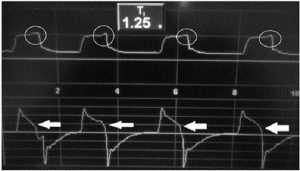
Chu kỳ muộn (Delayed Cycling)
Chu kỳ muộn xảy ra khi thời gian hít vào được cài đặt trong máy thở cơ học vượt quá thời gian hít vào của thần kinh bệnh nhân [6]. Điều này có nghĩa là hệ thống tiếp tục trong giai đoạn hít vào, một khi nỗ lực hít vào của bệnh nhân đã kết thúc, làm giảm thời gian cho giai đoạn thở ra. Điều này có thể tạo ra sự kích hoạt các cơ thở ra của bệnh nhân trước khi các tiêu chuẩn chu kỳ được thiết lập (thở ra tích cực), bẫy khí, căng phổi động và PEEP nội sinh, có thể làm tăng công thở và gây ra nỗ lực không hiệu quả [32-34].
Parthasarathy và cộng sự đã đề cập rằng “sự chậm trễ trong việc thư giãn các cơ hô hấp có thể khiến chúng duy trì hoạt động trong giai đoạn đầu của thì hít vào tiếp theo và bằng cách đi ngược lại sự chuyển động đi xuống của cơ hoành có thể cản trở hiệu quả của nỗ lực hít vào tiếp theo”
Loại PVA này thường gặp ở bệnh nhân COPD vì PEEP nội sinh và thời gian thở ra ngắn. Trong những trường hợp này, một giải pháp hiệu quả có thể làm giảm thời gian hít vào ở các chế độ A/C PC và SIMV-PC [33,34]. Thời gian hít vào cũng có thể giảm, bằng cách thay đổi các tiêu chuẩn chu kỳ trong PSV [23]. Do đó, bằng cách sửa đổi các tiêu chuẩn chu kỳ, kích hoạt không hiệu quả và thở ra chủ động do chu kỳ muộn có thể ngăn ngừa [35,36].
Chu kỳ muộn được chứng minh trong biểu đồ áp suất – thời gian như là sự gia tăng áp suất đường thở khi gần kết thúc của giai đoạn hít vào và dạng sóng lưu lượng – thời gian bằng sự giảm đột ngột lưu lượng thở vào, do kích hoạt các cơ thở ra (Hình 7).
Kết luận
Xác định không đồng bộ bệnh – nhân máy thở bằng cách sử dụng phân tích dạng sóng là một kỹ năng rất quan trọng mà các BS làm việc trong ICU phải học tập để tránh các biến chứng có thể ảnh hưởng đến kết quả của bệnh nhân thở máy. Điều quan trọng là phải thiết lập các định nghĩa chuẩn cho tất cả các loại PVA, xem xét rằng các định nghĩa khác nhau được sử dụng để mô tả cùng một vấn đề.





