Tác giả: Bác sĩ Đặng Thanh Tuấn
I. Phân tích khí động mạch
Cân bằng acid-base và hệ đệm
Độ pH của dịch cơ thể phản ánh nồng độ ion hydro ([H+ ]): sự thay đổi pH 0,1 cho thấy sự thay đổi 10 lần trong [H+ ]. Độ pH động mạch thường được giữ trong phạm vi hẹp bởi tác động của bộ đệm, bao gồm Hb và albumin. Phosphate (H2PO4 – /H2PO4 2-) đóng một vai trò nhỏ, với cặp đệm carbonic (yếu) axit/bicarbonate có tầm quan trọng lớn hơn nhiều:
H+ + HCO3 – <-> H2CO3 <-> H2O + CO2
Nếu sự đệm của H+ do chuyển hóa là không đủ, pH sẽ trở nên bất thường (“nhiễm toan chuyển hóa”). Phản ứng đầu tiên là sự gia tăng thông khí phút (tần số thở và thể tích khí lưu thông), “tăng thải” CO2 và do đó “kéo” H+ từ phía bên trái của phương trình. Nếu bệnh nhân được thông khí bắt buộc, thì bạn có thể làm điều này cho họ. Trong thời gian dài hơn (thường là nhiều ngày), bù trừ thận xảy ra: nhiễm toan đường hô hấp (trong COPD, ví dụ) có thể được bù đắp bằng cách giữ bicarbonat do thận.
Kiềm dư (BE, Base excess, thông thường –2 đến +2) là giá trị được tính toán, và đại diện cho số lượng mEq của bộ đệm cần phải được thêm vào một lít máu để khôi phục pH đến 7,4 ở nhiệt độ 37°C và pCO2 là 5,3 kPa. Nếu con số này là âm (tức là BE – 8), thì 8mEq sẽ cần phải được thêm vào để khôi phục pH – và máu của bệnh nhân là “quá axit”.
Toan chuyển hóa
Điều này có thể là do:
- Quá ít bicarbonate
- mất bicarbonate dư thừa (ví dụ, mất thận, hoặc mất từ ruột non fi stulae)
- giảm sản xuất bicarbonate (ví dụ:suy thận).
2. Quá nhiều axit
- sản xuất axit dư thừa (ví dụ, sản xuất axit lactic bởi khối u hoặc từ thiếu máu cục bộ hoặc toàn cầu; ketoacids trong nhiễm độc ketoacid)
- giảm độ thanh thải axit (ví dụ:suy gan), hoặc
- ăn quá nhiều axit (bất thường nhất!).
Khi phải đối mặt với một toan chuyển hóa, do đó, nên xác định rằng:
- Đường huyết là bao nhiêu và bình thường không (để loại trừ nhiễm toan keto- acide do tiểu đường)
- Lactate là bình thường (để loại trừ nhiễm toan lactic)
- Chức năng thận bình thường (hoặc, nếu không, có thể không phải là nguyên nhân duy nhất gây ra nhiễm toan)
- Clorua là bình thường. Tính trung lập điện phải được duy trì trong máu. Nếu các dung dịch giàu Cl được đưa ra (như nước muối sinh lý và nhiều loại dung dịch keo), mức Cl sẽ tăng lên. Để duy trì tính trung lập điện, nồng độ bicarbonate sẽ giảm, và với pH.
Hãy suy nghĩ về nước muối sinh lý (NS, Normal saline) 0,9%. Nó chứa 154mEq/L Na+ – chỉ cao hơn 10% nồng độ Na+ trong máu của bạn (140mEq/L). Nhưng nồng độ clorua trong NS cũng là 154mEq/L – cao hơn 54% so với trong máu của bạn (thường có lẽ là 100mEq/L). Ba lít NS do đó làm tăng [Na+ ] của bạn một chút … và tăng [Cl- ] của bạn rất nhiều … mức bicarbonate sẽ giảm … và pH sẽ giảm.
Nếu tất cả những điều này là bình thường, hãy kiểm tra khoảng trống anion – sự khác biệt giữa nồng độ các anion được đo thường xuyên và các cation, (Na+ + K+ ) – (Cl- + HCO3 – ) – thường là 8-12mEq/l.
Vì vậy, toan chuyển hóa tăng clo máu có một khoảng cách anion bình thường, và lactic – và keto-acidosis (không đo được) một khoảng cách anion lớn hơn. Nếu không có nguyên nhân nào trong số này là nguyên nhân, thì có thể một số axit ngoại sinh (ví dụ aspirin) nằm trong máu (xem Bảng 1, dưới đây).
| Anion gap tăng | Anion gap bình thường |
| Uống các chất có tính acid: ngộ độc salicylate, ethanol và methanol | Mất bicarbonate qua đường tiêu hóa: tiêu chảy, ileostomy |
| Lactic – và keto-acidosis | Vấn đề thận: toan hóa ống thận |
| Không có khả năng bài tiết acid: suy thận |
Toan hô hấp
Điều này xảy ra khi thanh thải CO2 không đủ so với sản xuất. Những tình huống này được thảo luận trong chương 2 (Suy hô hấp).
Kiềm chuyển hóa
Kiềm chuyển hóa được đặc trưng bởi sự gia tăng bicarbonate có hoặc không có sự gia tăng bù trừ CO2. Nó có thể xảy ra từ:
- Mất axit quá mức (chẳng hạn như hẹp môn vị).
- Uống quá nhiều kiềm (hiếm).
- Giữ bicarbonate do thận (hiếm).
- Do hậu quả của hạ kali máu (gây ra sự dịch chuyển H+ ).
Kiềm hô hấp
Nhiễm kiềm hô hấp xảy ra khi tăng thể tích và/hoặc tần số thông khí gây ra sự sụt giảm trong PaCO2. Sự thông khí tăng lên như vậy thường đáp ứng với sự đau đớn, lo âu, thiếu oxy hoặc sốt – hoặc khi bệnh nhân thở máy bắt buộc là “thông khí quá mức”.
Phân tích khí động mạch (ABG)
Một mẫu ABG có thể được lấy từ một catheter động mạch có sẳn, hoặc từ một “chích lấy máu động mạch”. Các nơi phổ biến nhất được sử dụng là động mạch quay, mặc dù cũng có thể sử dụng động mạch cánh tay, động mạch đùi, hoặc thậm chí động mạch mu chân. ABG là cách nhanh nhất để xác định chính xác mức độ giảm oxy máu thực sự. Nó cũng sẽ cho bạn biết tình trạng axit-base, và giúp bạn xác định nguyên nhân gây rối loạn (cho bạn biết PaCO2 và HCO3 – , lactate, clorua và mức glucose). Những thay đổi đe dọa tính mạng của K+ cũng sẽ được phát hiện và cho biết cả Hb. Do đó, đôi khi bạn sẽ thực hiện ABG khi bạn không quan tâm đến ‘các loại khí’ (xem Bảng 2).
| Table 2 | |
| Normal Value | |
| pH | 7.35 – 7.45 |
| PaCO2 | 4.5 – 6 kPa (35-50mmHg) |
| PaO2 | 11-14 kPa (83-105mmHg) |
| Standard bicarbonate | 22-28 mmol /l |
| Base deficit / excess | +/-2 |
| Chloride | 98-107 mmol/l |
Phân tích
Bạn nên đưa ra kế hoạch của riêng mình, nhưng trình tự sau đây thường hữu ích:
1. Nhìn vào K+ , Hb và glucose. Bây giờ bạn sẽ không bỏ lỡ mức kali/glucose đe dọa tính mạng, hoặc thiếu máu nặng.
2. Nhìn vào PaO2 và bão hòa oxy động mạch xác định bệnh nhân bị thiếu oxy máu như thế nào. Lưu ý FiO2 là bao nhiêu! (tức là PaO2 là 12kPa, hoặc bão hòa oxy 95% với thở oxy 80% là KHÔNG tốt! Như một “quy tắc ngón tay cái” PaO2 dự kiến – trong trường hợp không có bất thường oxy hóa – nên khoảng 10 kPa ít hơn so với FiO2, tức là 40% FiO2 sẽ dẫn đến PaO2 là 30 kPa)
3. Nhìn vào độ pH: nhiễm toan (< 7,35) hoặc nhiễm kiềm (> 7,45) ?
4. PaCO2 có bất thường không ? Nếu vậy, nó có thay đổi theo hướng mà thay đổi độ pH không?
5. HCO3 – bất thường không ? Nếu có, sự thay đổi trong cùng hướng với độ pH?
Trong bệnh nhân “không phải thở máy”:
- Nhiễm kiềm với bicarbonate thấp và PaCO2 thấp phản ánh nhiễm kiềm đường hô hấp nguyên phát với bù trừ chuyển hóa không hoàn toàn.
- Nhiễm toan với bicarbonat cao và PaCO2 cao là nhiễm toan hô hấp nguyên phát với bù trừ chuyển hóa không hoàn toàn.
- Nhiễm kiềm với bicarbonat cao và PaCO2 cao phản ánh nhiễm kiềm chuyển hóa nguyên phát với bù trừ hô hấp không hoàn toàn.
- Nhiễm toan với bicarbonat thấp và PCO2 cao là nhiễm toan chuyển hóa nguyên phát với bù trừ hô hấp không hoàn toàn.
- pH bình thường với PaCO2 cao và bicarbonat cao có thể phản ánh: một nhiễm kiềm chuyển hóa nguyên phát với bù trừ hô hấp hoàn toàn, hoặc nhiễm toan hô hấp nguyên phát với bù trừ chuyển hóa hoàn toàn.
- Vấn đề đi kèm với hỗ trợ thông khí cơ học, làm thay đổi mức độ PaCO2. Khi đó phải áp dụng sự nhạy bén lâm sàng: nếu, ví dụ, bình thường hóa PaCO2 gây ra một nhiễm kiềm đáng kể, và bicarbonate là cao, một nhiễm toan đường hô hấp chuyển hóa chuyển hóa hoặc một alkalosis chuyển hóa bù hô hấp, đã có mặt. Cuộc gọi của bạn như vậy!
6. Đo khoảng cách anion (anion gap).
2. Ngộ độc khí carbon monoxide
|
Độ bão hòa oxy động mạch và hàm lượng oxy động mạch
Giảm oxy máu có thể được phát hiện bằng phân tích ABG. Ngoài ra, đo oxy qua pulse oximeter thường được sử dụng để theo dõi độ bão hòa oxy (SaO2 – phần trăm độ bão hòa của Hb bởi oxy).
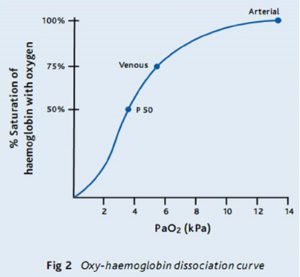
Biểu đồ SaO2 tương ứng với áp lực của O2 (tính bằng kPa) tạo ra đường phân ly oxy-hemoglobin – phần trăm độ bão hòa của Hb với O2 ở các áp lực riêng biệt khác nhau của O2 hòa tan trong huyết tương. Đường cong có thể thay đổi theo nhiều yếu tố khác nhau. Sự dịch chuyển sang “trái” nghĩa là, đối với cùng một PaO2, SaO2 sẽ cao hơn; tức là, Hb lấy và giữ O2 dễ dàng hơn, và ít sẵn sàng giải phóng oxy hơn. Sự dịch chuyển sang “phải” nghĩa là độ bão hòa thấp hơn ở bất kỳ áp lực riêng phần nào của O2: Hb lấy và giữ O2 ít dễ dàng hơn và sẵn sàng giải phóng oxy (Hình 2).
1g Hb có thể mang 1,34mL O2. Hàm lượng O2 động mạch (CaO2) của 1 lít máu – phần lớn được thực hiện bởi Hb (được đo bằng g/L), và không phải hòa tan trong dung dịch – là:
O2 content = SaO2 x 1,34 x Hb
Khi Hb là 150 g/L và máu 100% bão hòa, CaO2 là khoảng 200 mL O2 mỗi lít máu (100 x 1.34 x 150).
| Việc cung cấp O2 đến các mô trong một phút sẽ là lượng oxy trong mỗi lít x lượng tim (lít/phút). CO có thể được tính theo diện tích bề mặt cơ thể (CI) và thường là 2,5-3,5 L/phút/m2 da.
Chỉ số cung cấp oxy (Oxygen delivery index) DO2I = CI x CaO2 Giả sử CI = 3 l/phút/m2 và Hb 140g/l, và SaO2 98%, thì DO2I = 3 x (1,34 x Hb x SaO2) DO2I = 3 x (1,34 x 140 x 0,98) DO2I = 550 ml/phút/m2 |
| Các mẹo hàng đầu về độ bão hòa O2
1. Oxy hóa là một biện pháp đo thông khí rất kém. Do đó việc theo dõi SaO2 ở Guillain-Barre, hoặc hen suyễn nặng, hoặc tổn thương tủy sống cho bạn biết rất ít về mức độ thông khí của nó. Vào thời điểm SaO2 giảm, bệnh nhân có thể nhanh chóng bị mất bù. 2. Tìm hiểu một vài điểm chính trên đường cong phân ly O2: 99% SaO2 lên tới 11 kPa. Dưới 8 kPa, SaO2 bắt đầu giảm nhanh (từ khoảng 90%) cho một sự thay đổi nhỏ trong PaO2. 80% SaO2 là khoảng 6 kPa. 3. Luôn luôn nghĩ về SaO2 trong bối cảnh của FiO2 (không khí là 21% O2, vì vậy FiO2 là 0,21). Theo nguyên tắc chung, PaO2 = FiO2 (%) trừ 10. Bạn hít thở không khí, vì vậy bạn mong đợi PaO2 của bạn là khoảng 11 kPa. Vì vậy, nếu ai đó thở 60% FiO2 bằng mặt nạ, bạn sẽ mong đợi PaO2 là ~ 50 kPa. Nếu SaO2 là 94%, thì PaO2 có lẽ chỉ ~ 9 kPa (khi cần ~ 50 kPa). Một cái gì đó là sai khủng khiếp với phổi, và bệnh nhân nghiêm trọng hơn nhiều so với họ có thể thấy! |
Capnography
Capnometry (được thực hiện bởi capnograph) đo CO2 trong khí thở ra (phổ biến nhất là do hấp thụ hồng ngoại). Có hai loại capnography:
- Hệ thống dòng bên (Sidestream systems) (phổ biến nhất) liên tục hút khí từ bộ dây máy thở qua một ống mao dẫn. Bộ cảm biến và phân tích CO2 được đặt trong thiết bị chính cách xa đường thở. Ưu điểm: nó có thể được sử dụng trên bệnh nhân tỉnh táo, và với O2 cung cấp thông qua thở oxy ngạnh mũi (cannula).
- Trong các hệ thống dòng chính (mainstream systems) (cồng kềnh hơn), cảm biến CO2 nằm giữa mạch thở và ống nội khí quản. Ưu điểm: không cần lấy mẫu khí, và không chậm trễ trong quá trình ghi.
Nồng độ CO2 đo được thường được vẽ theo thời gian, biểu đồ thu được hiển thị ba pha riêng biệt:
- Giai đoạn I xảy ra vào lúc bắt đầu thở ra khi khoảng chết giải phẫu còn trống (nơi không có sự trao đổi khí giữa khí hít vào và máu).
- Giai đoạn II là sự gia tăng ban đầu của CO2 do sự pha trộn của khí phế nang với khí của khoảng chết.
- Giai đoạn III hầu như luôn là cao nguyên tăng chậm và kết thúc với CO2 cuối thì thở ra (end-tidal, ETCO2). Giá trị này thường là 35-38 mmHg (4,5-5 kPa).
- Sau khi giai đoạn III được hoàn thành, capnogram xuống nhanh chóng đến đường cơ sở (giai đoạn 0). Điều này thể hiện giai đoạn hít vào nơi hít khí không có CO2. (Hình 3)
Ứng dụng lâm sàng
Capnography phản ánh sự sản xuất (chuyển hóa), vận chuyển (lưu thông) và loại bỏ CO2. Do đó, đường biểu diễn sẽ bị thay đổi bởi các thay đổi trong:
a. Chuyển hóa tế bào Do đó, nồng độ có thể tăng theo nhiệt độ tăng (ví dụ như tăng thân nhiệt ác tính) hoặc hoạt động cơ bắp (ví dụ như run rẩy, co giật) hoặc tăng acid đệm (thiếu máu cục bộ – tái tưới máu, dùng bicarbonate);
b. Vận chuyển CO2 CO2 cuối khí lưu thông sẽ giảm nếu CO giảm với thông khí liên tục (ví dụ:tắc mạch phổi hoặc không khí] hoặc suy tim đột ngột);
c. Thông khí
Đường biểu diễn có thể xác định vị trí nội khí quản, và có thể được sử dụng như một đại diện cho phân tích ABG. Giảm đột ngột trong ETCO2 có thể hướng tới tắc nghẽn hoàn toàn hoặc tuột ống nội khí quản tình cờ.
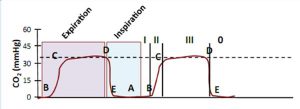
Trong thì hít vào, CO2 là số không và do đó hít vào được hiển thị tại đường cơ sở bằng không. Giai đoạn I xảy ra khi bắt đầu thở ra (A-B). Vào lúc bắt đầu thở ra, việc thiếu khí CO2 thải ra đại diện cho khí thở ra trong đường dẫn khí (không có CO2). Trong giai đoạn II tăng nhanh ở nồng độ CO2 (B-C) khi khoảng chết giải phẫu được thay thế bằng khí phế nang, dẫn đến giai đoạn III (C-D) tất cả khí đi qua cảm biến CO2 là khí phế nang gây ra capnograph là một đường dẹt nằm ngang. Điều này thường được gọi là Cao nguyên phế nang. CO2 cuối thì thở ra là giá trị ở giai đoạn cuối thì thở ra. Giai đoạn 0 là thì hít vào và được đánh dấu bằng một hướng xuống nhanh của capnograph (D-E). Giảm xuống này tương ứng với khí tươi không có carbon dioxide (trừ trường hợp thở lại). Capnograph sau đó sẽ vẫn ở mức zero cơ sở trong suốt thì hít vào.
Capnography thường được sử dụng để đảm bảo vị trí chính xác của ống nội khí quản (pha thở có CO2 không nhìn thấy nếu đặt nội khí quản vào thực quản). Các phép đo capnography cũng có thể hoạt động như một đại diện cho PaCO2. Khi trao đổi khí phổi bình thường, CO2 cuối thì thở ra chỉ thấp hơn so với PCO2 động mạch 2 đến 3 mmHg (0,2 – 0,4 kPa). Tuy nhiên, khi trao đổi khí trong phổi bị suy yếu, ETCO2 giảm tương đối so với PaCO2 (Hình 3).
| Nguyên nhân của tăng (PaCO2 – ETCO2) gradient:
Tăng khoảng chết giải phẫu:
Tăng khoảng chết sinh lý: Cung lượng tim thấp |
Trong một số trường hợp, ETCO2 có thể cao hơn CO2 động mạch. Điều này là có thể khi sản xuất CO2 cao và có thể tích hít vào thấp hoặc cung lượng tim (CO) cao Nhưng điều này thực sự rất không phổ biến.
Khi trao đổi khí là bất thường và PaCO2 cao hơn ETCO2, vẫn có thể theo dõi những thay đổi trong ETCO2 như một thước đo thay đổi trong PaCO2. Tuy nhiên, điều quan trọng là phải cài đặt gradient ETCO2 – PaCO2 cần được kiểm tra lại sau mỗi lần thay đổi cài đặt máy thở, vì điều này có thể ảnh hưởng đến độ chênh lệch.
Trong trường hợp tăng áp lực nội sọ, capnography được sử dụng để điều chỉnh thông khí nhằm duy trì ETCO2 mong muốn. Trong cài đặt này, gradient ETCO2-PaCO2 cần được theo dõi chặt chẽ để duy trì ETCO2 ở mức PaCO2 mục tiêu.
II. Liệu pháp oxy bổ sung
Khi sự cung cấp O2 giảm xuống dưới mức yêu cầu, O2 bổ sung nên được chỉ định để duy trì sự cung cấp O2 ở mức tương xứng với sự sống còn và lý tưởng là, các chức năng cơ quan không bị cản trở. Điều này có thể yêu cầu can thiệp để duy trì Hb và CO, cũng như việc sử dụng các kỹ thuật để duy trì độ bão hòa oxy động mạch. Cách đơn giản nhất là sử dụng oxy bổ sung.
Liệu pháp oxy bổ sung
Dùng O2 là một can thiệp cứu sống đơn giản, mặc dù nhắm mục tiêu một PaO2 lớn hơn mức cần thiết không có thêm lợi ích gì và PaO2 cao có thể được kết hợp với kết quả tồi tệ hơn trong các điều kiện nhất định (ví dụ, sau khi ngừng tim hoặc nhồi máu cơ tim). Mặt khác, người ta chỉ cần xem xét hình dạng sigmoid quen thuộc của đường phân ly oxy để thấy rằng bổ sung O2 không đầy đủ có thể có hậu quả nguy hiểm – bệnh nhân bị thiếu oxy nằm phía dưới của đường cong sigmoid và chỉ cần giảm một chút trong PaO2 là gây ra giảm đáng kể của SaO2 và sự cung cấp O2 cho mô.
Nhu cầu O2 có thể được đánh giá bằng cách xem xét cung cấp O2 ở tại giường: SaO2, PaO2 trên lấy mẫu khí máu động mạch, CO và Hb. Điều này nên được cân bằng với bao nhiêu công để cung cấp nó (tần số thở, công thở), và cho dù đó là đủ (lactate tăng cho thấy sự chuyển hóa kỵ khí, lú lẫn và thiểu niệu có thể gợi ý rối loạn chức năng cơ quan do thiếu oxy).
Mục tiêu của liệu pháp O2 nên là cung cấp đủ O2 để đưa PaO2 trở lại mức yêu cầu của bệnh nhân cụ thể đó. Trong thực tế, điều này thường có nghĩa là nhằm mục đích cho SaO2 94-98%. Nói chung, tuy nhiên, O2 cao được chỉ định trong sốc, nhiễm trùng huyết, đa chấn thương, sốc phản vệ, xuất huyết phổi và ngộ độc khí carbon monoxide.
Ghi chú: tăng oxy máu có thể làm trầm trọng thêm tình trạng bệnh nhân sau khi ngừng tim và nên tránh. Ở những bệnh nhân tăng CO2 máu mạn tính, có thể cần ít FiO2 hơn với mục tiêu SaO2 là 88-92%.
Ở những bệnh nhân này, tác dụng của FiO2 cao trong việc xác định tăng CO2 máu là nhiều yếu tố:
- Giảm kiểm soát của trung khu hô hấp do thiếu oxy (một số bệnh nhân bị COPD, xơ nang, bệnh lý thần kinh cơ / thành ngực, hội chứng giảm thông khí do béo phì/béo phì bệnh lý.
- Giảm co mạch phổi thiếu oxy và tăng thông khí khoảng chết.
- Hiệu ứng Haldane: đây là sự dịch chuyển CO2 liên kết với Hb bị khử oxy, được giải phóng trong huyết tương và tích tụ do hậu quả của tình trạng thiếu oxy máu mãn tính.
Một cái nhìn ABG ban đầu có thể hữu ích trong việc hướng dẫn bạn: nếu PaCO2 tăng, nhưng pH ít bị xáo trộn hơn bạn có thể mong đợi (với bicarbonate máu cao), thì đó là giảm thông khí mạn tính. Và nếu bạn thấy rằng tình trạng thiếu oxy máu không đe dọa tính mạng, thì có thể bắt đầu sử dụng FiO2 28%, tìm kiếm mục tiêu SaO2 là 88- 92%. Theo dõi thường xuyên ABG là điều cần thiết trong nhóm bệnh nhân này, vì nhiễm toan kéo dài và tăng CO2 máu có thể cần hỗ trợ thông khí không xâm lấn hoặc có thể đặt nội khí quản.
| Trong khi sinh viên thường được cảnh báo về bệnh nhân mà trung khu kiểm soát hô hấp phụ thuộc vào thiếu oxy, đôi khi sẽ chết khi bổ sung O2, đây là một trường hợp hiếm: ở bệnh nhân bị thiếu oxy máu nghiêm trọng, người ta nên cho nồng độ O2 cao hơn, và sau đó giảm nó theo đáp ứng lâm sàng và phân tích ABG. Nếu bệnh nhân chỉ thiếu oxy máu ít (hoặc nếu thiếu oxy máu dường như được dung nạp tốt, cho thấy nó có thể là mãn tính), có thể phù hợp hơn để cung cấp O2 liều thấp qua ống thông mũi. Lưu ý: nếu tổng trạng bệnh nhân đang tốt, thì kết quả khí trong máu bạn thấy có thể là “gần với bình thường của họ” và không cần phải có phản ứng hoảng sợ! |
Bổ sung O2 không xâm lấn có thể được cung cấp qua ống thông mũi hoặc mặt nạ. Có một loạt các thiết bị cung cấp O2 và rất hữu ích khi biết các ưu và nhược điểm tương đối của chúng. Tuy nhiên, FiO2 hít vào thực sự không chỉ phụ thuộc vào độ lớn của lưu lượng O2 vào đường thở mà còn về tần số thở, thể tích khí lưu thông và do đó là thông khí phút, tức là cho liều oxy 2 L/phút ở bệnh nhân nghỉ ngơi thở bình thường (RR = 12/min x TV = 500ml thông khí phút = 6 L/phút) sẽ làm tăng FiO2 nhiều hơn thở oxy 2 L/phút tương tự nhưng cho một bệnh nhân thở nhanh (ví dụ: RR 36). Đây không chỉ là vấn đề “nồng độ” đơn giản. Tần số thở cao thường có nghĩa là lưu lượng khí hít vào cao (tức là khí di chuyển nhanh khi hít vào). Giả sử lưu lượng khí hít vào cao nhất là 60 L/phút. Nếu O2 đang được cung cấp ở mức 15 L/phút (không có bộ phận dự trữ), thì không khí trong phòng thông thường sẽ bị hít thêm vào. FiO2 thật sự do đó sẽ thấp hơn rất nhiều so với bạn tưởng tượng!
Phân loại hệ thống cung cấp O2
- Các hệ thống công năng thay đổi (ống thông mũi, mặt nạ)
- Hệ thống công năng cố định (mặt nạ loại Venturi)
- Hệ thống lưu lượng cao
- Khác
Ống thông mũi – Nasal cannulae (như mặt nạ đơn giản) sử dụng khoảng chết của vùng mũi hầu (hoặc bản thân thiết bị) làm khoảng dự trữ O2. Không khí bị trộn lẫn với không khí trong khoảng dự trữ và khí hít vào được làm giàu với O2.
Đối với hầu hết bệnh nhân, và theo nguyên tắc chung, mỗi 1 L/phút của O2 thông qua ống thông mũi tăng FiO2 lên ~ 4%. Lượng O2 tối đa có thể được dùng thông qua ống thông mũi là 6 L/phút tức là khoảng 45% O2. Ưu điểm bao gồm sự thoải mái và dễ duy trì (không cần bỏ ra để nói, ăn hoặc uống). Tuy nhiên, thật khó để đánh giá chính xác FiO2. Có thể xảy ra tình trạng tắc nghẽn mũi, và có thể xảy ra khô và kích ứng mũi.
Mặt nạ đơn giản – Simple face masks (ví dụ: mặt nạ Hudson) cung cấp nồng độ O2 từ 40% đến 60%. FiO2 cung cấp sẽ không hằng định, tùy thuộc vào lưu lượng oxy và kiểu thở của bệnh nhân (xem ở trên), nhưng có thể thay đổi bằng cách sử dụng lưu lượng O2 là 5-10 L/phút. Tốc độ lưu lượng nhỏ hơn 5 L/phút có thể gây ra khí CO2 thải ra trong mặt nạ (do đó là một loại khoảng chết, trang 25) và do đó để hít lại. Vì những lý do này, và xem xét trước đây, những mặt nạ này thường nên tránh ở những người bị suy hô hấp loại 2.
Mặt nạ nồng độ oxy cao có túi dự trữ – High concentration reservoir masks, cung cấp O2 ở nồng độ 60-90% và được sử dụng với lưu lượng 10-15 lít/phút. Một túi hoạt động như một túi dự trữ O2 100%. Tuy nhiên, một lần nữa, nồng độ oxy hít vào không được đo chính xác và sẽ phụ thuộc vào kiểu thở. Những mặt nạ này được sử dụng trong trường hợp khẩn cấp hoặc bệnh nhân chấn thương khi có yêu cầu O2 cao và không ứ CO2 (Hình 4, dưới đây).

Mặt nạ Venturi – Venturi masks, cung cấp FiO2 theo ước tính ở bất kể lưu lượng (miễn là nó cao hơn mức tối thiểu được ghi ở mặt bên của van) – mặc dù FiO2 HIỆU QUẢ vẫn có thể bị ảnh hưởng bởi tần số thở và mô hình của bệnh nhân, đặc biệt là ở FiO2 cao hơn. Các khe hở được tìm thấy ở mặt bên cho phép không khí bị hút vào (Hình 5, bên dưới). Kích thước của chúng (và mức độ hút khí vào) thay đổi, cũng như đường kính của điểm vào O2. Lượng khí bị hút vào bị ảnh hưởng trực tiếp bởi lưu lượng O2 vào nó, với các mặt nạ khác nhau cho phép tỷ lệ chọn lọc của O2 mặc dù lượng khí khác nhau được hút vào. Có rất nhiều van được mã hóa màu – 24% (Xanh lam), 28% (Trắng), 35% (Vàng), 40% (Đỏ), 60% (Xanh lục) – và chúng đặc biệt hữu ích khi có nhu cầu kiểm soát lượng O2 được cung cấp, ví dụ trong COPD (Hình 6).

III. Làm ẩm
Khi một bệnh nhân thở qua mũi, không khí hít vào được làm ấm đến nhiệt độ cơ thể và trở nên bão hòa với hơi nước trước khi vào khí quản. Khí y tế có độ ẩm rất thấp và được cung cấp qua ống nội khí quản hoặc mở khí quản, làm lạnh và làm khô đường thở dưới. Chất nhầy trở nên đặc hơn (đường thở “bị bịt lại”). Biểu mô đường dẫn khí trở nên khô, khiến cho giảm chuyển động vi nhung mao tế bào biểu mô và tổn thương biểu mô. Nguy cơ xẹp phổi, xẹp phổi thùy và nhiễm trùng tăng lên.
Để tránh hậu quả như vậy, các loại khí hít vào phải được làm ấm và làm ẩm. Các thiết bị chủ động, chẳng hạn như máy tạo độ ẩm ấm (heated humidifers), thêm hơi nước ấm vào khí hít vào của bệnh nhân. Thiết bị thụ động, chẳng hạn như bộ trao đổi nhiệt và độ ẩm (HME, heat and moisture exchangers), giữ lại một số nhiệt và độ ẩm mà nếu không nó sẽ thở ra, để làm ấm khí vào.
Tiêu chuẩn cho độ ẩm được sử dụng với bệnh nhân đặt nội khí quản: độ ẩm tối thiểu 33 gm-3, hoặc độ ẩm tương đối là 75%. Độ ẩm này tương đương với độ ẩm được đo trong khoảng dưới thanh môn khi thở mũi bình thường. Rất ít HME có độ ẩm ở mức này. Tuy nhiên, HMEs rẻ hơn và dễ sử dụng hơn.
Thiết bị thụ động (Passive devices)
Bộ trao đổi nhiệt và độ ẩm (HME) được sử dụng phổ biến nhất và dùng một lần. Nếu nó có thể lọc vi khuẩn, vi rút và các hạt trong cả hai hướng của lưu lượng khí, thì được gọi là Bộ lọc trao đổi nhiệt và độ ẩm (HMEF). Định vị trên bộ dây máy thở ở “đầu nối Y. Bên trong đơn vị này là vật liệu có chất hút ẩm. Khí ẩm thở ra đi qua thiết bị này, nước bị ngưng tụ cùng với sự giải phóng nhiệt tiềm ẩn trong đó cũng làm ấm nó. Trong thì hít vào, không khí khô lạnh đi qua thiết bị – và được làm ấm và làm ẩm – thiết bị này hoạt động như một ‘mũi nhân tạo’. Chức năng tối ưu chỉ đạt được sau 5-20 phút, với các thiết bị này thường thay đổi sau 24 giờ (mặc dù chức năng có thể kéo dài 48 hoặc thậm chí 96 giờ).
HME nên tránh, tốt nhất khi:
- Thể tích khí lưu thông nhỏ (khi khoảng chết bổ sung của HME có thể dẫn đến tăng PaCO2).
- Chất tiết đặc, lượng nhiều hoặc có máu, chúng có thể lắng đọng trên thành phần trao đổi độ ẩm, tăng sức cản đường thở, ảnh hưởng đến khả năng cai máy từ máy thở và có thể thay đổi ‘độ nhạy kích hoạt’ (chương 12). Sự lắng đọng tiết cũng có thể làm tăng nguy cơ lây nhiễm các sinh vật như pseudomonas.
- Khi thể tích thông khí rất cao (khi chúng trở nên thiếu).
- Khi nhiệt độ cơ thể trung tâm < 32 ° C (khi chúng không hoạt động hiệu quả).
- Khi thể tích thở ra là < 70% thể tích khí lưu thông được giao (dò phế quản).
Thiết bị chủ động
- Phương pháp đơn giản nhất để làm ẩm khí hít vào là thông qua sự nhỏ giọt của nước trực tiếp vào khí quản – bằng cách bơm vào 5-10 ml nước muối 0,9% (ví dụ) qua Nội khí quản mỗi giờ, hoặc bằng cách “nhỏ giọt” qua 1 bầu kiểm soát thể tích mỗi giờ. Điều này đôi khi được thực hiện khi đàm đặc và có thể giúp đỡ rất nhiều trong việc loại bỏ các cục đàm đặc trong bệnh hen suyễn.
- Các thiết bị làm ấm và ẩm bằng nhiệt (ví dụ: hệ thống Fisher-Paykel) có hai hệ thống sưởi hoạt động bằng điện riêng biệt. Thứ nhất, một buồng nước nằm trên một tấm nóng. Khí đi qua buồng này, và sau đó qua một dây nóng ở trung tâm của ống dẫn đến bệnh nhân. Hai cảm biến theo dõi nhiệt độ khí tại cổng kết nối của bệnh nhân và ổ cắm buồng mạch tương ứng, và kiểm soát nhiệt độ dây nóng.
- Nhiệt độ của khí ở đầu cuối của ống cung cấp cho bệnh nhân do đó có thể thay đổi, như độ ẩm tương đối: nếu nhiệt độ của khí ở mức cổng kết nối của bệnh nhân sẽ được đặt cao hơn ở đầu cuối ra khỏi buồng làm ẩm, khí được làm ấm liên tục khi nó đi qua ống cung cấp, do đó, mức độ nước ngưng tụ sẽ giảm, nhưng độ ẩm tương đối của khí cũng giảm. Ngoài ra, nếu khí được phép làm lạnh dần khi nó đi qua ống cung cấp, nó sẽ được bão hòa hoàn toàn với hơi nước.
- Một bẫy nước thu thập nước ngưng tụ nằm ở nhánh thở ra. Buồng làm ẩm và bẫy nước phải được đặt dưới mức của ống khí quản để ngăn chặn nước ngưng tụ đổ vào đường hô hấp.
- Hệ thống làm ấm thành tố (heated element humidifier) nhỏ giọt nước vào một thiết bị điện làm nóng đến 100°C, nhiệt độ cao đảm bảo vô khuẩn. Một bẫy nước thu nước thừa. Lượng hơi nước được cung cấp từ các hệ thống làm ẩm này phải được kiểm soát theo thể tích phút và độ ẩm cần thiết.
- Máy phun khí dung có thể được kiểm soát bằng khí hoặc siêu âm. Trong cả hai thiết bị, các giọt khí dung được tạo ra; lý tưởng với đường kính khoảng 1 μm. Các giọt nước bốc hơi trong khí được cung cấp cho bệnh nhân để khí được bão hòa hoàn toàn với hơi nước. Vì nhiệt là cần thiết cho sự bay hơi, nhiệt độ của khí sẽ giảm. Một máy làm nóng (heater) có thể duy trì nhiệt độ mong muốn của khí. Tuy nhiên, với những thiết bị này, tương đối dễ dàng thêm độ ẩm quá mức vào khí được cung cấp, vì một số giọt không bay hơi, dẫn đến nguy cơ quá tải phổi với nước.
IV. Đánh giá nhu cầu hỗ trợ không khí
Có ba chỉ định chính cho thông khí cơ học:
- Để hỗ trợ oxy hóa máu (bằng cách cải thiện sự cung cấp và/hoặc giảm tiêu thụ thông qua giảm công thở).
- Để hỗ trợ thanh thải CO2, và
- Giảm bớt công thở – hỗ trợ hoặc cho các cơ hô hấp “nghỉ ngơi”.
Ngoài ra, thông khí cơ học đôi khi cần thiết như là một phần của một gói chăm sóc trong việc quản lý bệnh nhân đang kích thích (ví dụ như bệnh nhân bị kích động do đa chấn thương).
Hỗ trợ oxy hóa
Điều này đòi hỏi phải đánh giá sự cân bằng của việc cung cấp O2 và mức tiêu thụ O2 (xem phần Suy hô hấp, trang 36).
Sự cung cấp O2 có thể được tính là:
Cung lượng tim (tính bằng lít/phút) x SaO2 x 1,34 x Hb
Bạn thường có thể xác định Hb và SaO2 dễ dàng đủ, và có thể ước tính cung lượng tim từ nhịp tim và cảm nhận cho thể tích mạch đập – pulse volume (cao, bình thường hoặc thấp). Điều đó cho phép khả năng cung cấp oxy tại giường sẵn sàng và sẵn sàng.
O2 tiêu thụ có thể được ước tính lâm sàng bằng cách đánh giá sự hiện diện của hoạt động cơ bắp (run rẩy, bồn chồn, đau), sốt, và công thở (phập phồng cánh mũi, chuyển động ngực bụng ngược chiều, dao động lớn trên đường cong CVP) – tất cả liên quan với nhu cầu O2 tăng lên.
Hữu ích, mặc dù các chỉ số gián tiếp về việc liệu O2 có đáp ứng được nhu cầu O2 là lactate máu động mạch có tăng hay không (hoặc cho thấy sự hiện diện của quá trình chuyển hóa kỵ khí) hoặc độ bão hòa oxy thấp của Hb lấy từ tĩnh mạch chủ trên (ScvO2) – nhưng không phải từ catheter trung tâm ở đùi.
Nếu ScvO2 thấp, rất có khả năng có sự thiếu hụt trong cung cấp O2 so với nhu cầu. Tuy nhiên, cần lưu ý rằng ScvO2 bình thường hoặc cao không loại trừ sự thiếu hụt cung cấp O2 trong một số tình trạng lâm sàng nhất định như nhiễm trùng huyết khi các mô ngoại vi không thể trích xuất O2 từ máu mao mạch.
Khi một sự mất cân đối về nhu cầu O2 và sự cung cấp O2 tồn tại, người ta có thể giải quyết cả hai bên của phương trình:
- Giảm nhu cầu có thể đạt được bằng cách hạ sốt các bệnh nhân sốt (lau mát hoặc với paracetamol), giảm công thở với máy phun khí dung (nếu hen suyễn), hoặc cung cấp an thần đầy đủ, liệt cơ thần kinh cơ hoặc giảm đau.
- Tăng cung cấp có thể đạt được bằng cách sử dụng oxy bổ sung, các kỹ thuật khác để cải thiện oxy hóa (ví dụ: sử dụng PEEP, huy động phế nang hoặc thay đổi tỷ lệ I:E, tăng nồng độ Hb và tăng CO (với việc sử dụng dịch và/hoặc thuốc tăng co bóp khi được chỉ định).
Thông khí cơ học có thể giúp giải quyết cả hai mặt của phương trình. Hoạt động cơ bắp ở bệnh nhân an thần thấp hơn và giảm hơn nữa nếu bệnh nhân bị liệt cơ bằng thuốc. Công thở – nơi tiêu thụ oxy mạnh – cũng bị hạn chế. Vì vậy, khi nghỉ ngơi, khoảng 4ml trong mỗi 100ml oxy mà cơ thể bạn đang sử dụng được tiêu thụ bởi công thở. Ở một bệnh nhân sau khi phẫu thuật ngực, công thở này có thể tăng gấp đôi, trong khi COPD nặng hoặc phù phổi, công thở tăng lên nhiều hơn.
Hỗ trợ thanh thải CO2
Đôi khi, công thở vượt quá khả năng, và thông khí phút trở nên không đủ để thanh thải CO2. Trong hoàn cảnh như vậy, việc hỗ trợ của máy thở có thể tối đa hóa thông khí phút phế nang. Hãy nhớ, để xem liệu lượng CO2 tăng lên là mãn tính và được bù trừ như sau: CO2 là 14kPa có lẽ không cần hỗ trợ khẩn cấp nếu độ pH gần như bình thường do bù trừ chuyển hóa mãn tính. Cũng nên đặt ABG trong bối cảnh lâm sàng: một vận động viên chạy nước rút 17 tuổi bị hen cấp tính có thể duy trì sự thông khí của phút – và khi lượng CO2 gia tăng cho thấy có sự mệt mỏi cơ hô hấp có thể gây tử vong nhanh chóng.
Hỗ trợ bệnh nhân bị kích động
Đôi khi, thông khí cơ học được chỉ định khi “phổi lành”. Do đó, một bệnh nhân bị kích động không nằm im để chụp CT đầu có thể cần phải dùng thuốc liệt cơ, đặt nội khí quản và thông khí. Điều tương tự cũng đúng, ví dụ, của nạn nhân của đánh bom với chấn thương nghiêm trọng, những người đang cố gắng ngăn chặn không để cho bác sĩ đặt catheter trung tâm nhằm đánh giá và xử trí thích hợp.
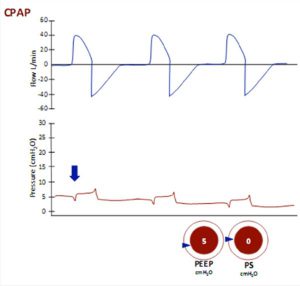
V. Áp lực đường thở dương liên tục (CPAP)
CPAP là áp dụng áp lực đường thở dương liên tục trong suốt chu kỳ hô hấp ở bệnh nhân thở tự nhiên. Phế nang giống như quả bong bóng: khi nó nhỏ, cần rất nhiều công để thổi nó lên, và (đặc biệt là khi nhỏ) nó có xu hướng xẹp xuống. Điều này xảy ra, phế nang sẽ sụp đổ vào cuối mỗi nhịp thở, cần rất nhiều công sức để tái bơm phồng chúng với mỗi nhịp thở. Ngoài ra, một số phế nang sẽ không bơm phồng lên với nhịp thở nhỏ hơn, dẫn đến sự không phù hợp V:Q, và thiếu oxy máu.
Hai tiến trình giúp khắc phục những vấn đề này:
1. Phế nang sản xuất chất hoạt động bề mặt (surfactant) – chất làm giảm áp lực bề mặt của thành phế nang. Hiệu ứng này tăng khi kích thước phế nang giảm. Tuy nhiên, trong phổi bị viêm gây tổn thương phế nang, gây ra protein có khả năng rò rỉ vào phế nang, và ngăn cản chúng tạo ra chất hoạt động bề mặt.
2. Đóng cửa một phần của thanh quản (khép dây thanh âm) ở phần cuối của thì thở ra làm “bẫy” một số không khí trong phổi, và giữ áp lực trong đường hô hấp khoảng 3-5 cm H2O lớn hơn áp lực khí quyển.
Áp lực dương tính này trong phế nang vào cuối thời gian thở ra được gọi là “Áp lực lực dương cuối kỳ thở ra” hoặc PEEP, và giúp giữ phế nang mở. Đặt ống nội khí quản giữ cho thanh quản và dây thanh âm luôn mở, vì vậy PEEP bị mất và phế nang có xu hướng sụp đổ trừ khi chúng ta áp dụng PEEP ngoài.
Khi phế nang xẹp, thông khí cục bộ giảm trong khi tưới máu cục bộ có thể được duy trì – kết quả V:Q không phù hợp gây ra tình trạng thiếu oxy máu. Điều này có thể cải thiện một phần bằng cách tăng áp lực đường thở với một “áp lực phụ” liên tục trong suốt chu trình hô hấp. Áp lực đường thở dương liên tục (CPAP) làm tăng FRC, giảm không phù hợp V:Q, và cải thiện oxy hóa. Công thở có thể được giảm bớt bằng cách duy trì độ chênh lệch miệng-đến-phế nang, và bằng cách giúp giữ cho phế nang mở. Ngoài ra CPAP có tác dụng tim mạch làm giảm tiền tải của tim và giảm hậu tải tâm thất trái bằng cách giảm áp lực xuyên thành thất trái. Những tác dụng này có lợi ở bệnh nhân phù phổi do tim.
Do đó, các biện pháp “thành công” trong việc sử dụng CPAP là:
- Cải thiện kiểu thở (do cải thiện oxy hóa và giảm công thở do giảm khó thở).
- Cải thiện oxy hóa.
Để làm việc, CPAP cần:
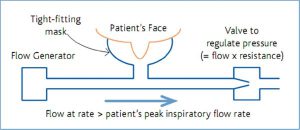
1. Một hệ thống kín. Vì vậy, mặt nạ phải khít và không bị rò rỉ. Mặt nạ mặt và mặt nạ mũi đều được sử dụng. Bệnh nhân thường thích dùng mặt nạ mũi (nasal mask), nhưng phải ngậm kín miệng, vì áp lực đường thở dương bị mất mỗi khi miệng mở. Ở hầu hết bệnh nhân bị suy hô hấp cấp tính, mặt nạ toàn mặt (full face mask) là một lựa chọn phù hợp hơn. Mặt nạ thường được làm từ vật liệu không gây kích ứng như cao su silicon, và có khoảng chết tối thiểu và bóng đệm mềm (thường là có thể bơm phồng lên được) để làm khít với da. Tất cả các mặt nạ đều gây áp lực lên cầu mũi và có thể gây loét. Hệ thống “nón trùm cả đầu” (helmet) tránh được vấn đề này.
2. Một luồng khí liên tục với lưu lượng vượt quá lưu lượng hít vào đỉnh ở tất cả thời gian. Nếu không, áp lực trong hệ thống sẽ giảm xuống trong thì hít vào.
3. Một hệ thống làm ẩm khí được cung cấp, nếu sử dụng trong thời gian dài.
4. Một van ở cung lượng của hệ thống, duy trì áp lực được xác định trước (thường là 5, 7,5 hoặc 10 cmH2O).
Tuy nhiên CPAP có thể được cung cấp bằng cách sử dụng một loạt các máy thở thông thường ICU sử dụng phương thức không xâm lấn (Hình 7, dưới đây).
Một số bệnh nhân không phù hợp với việc sử dụng mặt nạ CPAP, có lẽ do kích động hoặc hình dạng khuôn mặt (hô hoặc móm có thể khó áp dụng mặt nạ). Râu trên mặt có thể là một vấn đề – có thể giải quyết bằng cách cạo râu (với sự đồng ý).
Khi áp dụng mặt nạ, có thể hữu ích khi trước tiên cho phép bệnh nhân tự giữ nó, vì nhiều bệnh nhân có thể cảm thấy ngột ngạt. Mặt nạ sau đó được giữ trên mặt bằng dây nịt đi qua phía sau đầu.

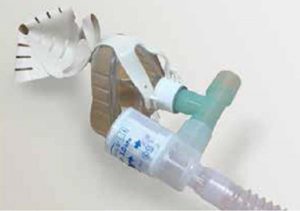
Khi thắt chặt dây đai, điều quan trọng là phải cân bằng giữa việc mặt nạ lỏng lẻo và bị rò rỉ lớn với việc làm cho thật kín và nó gây khó chịu. FiO2 ban đầu được chọn thường cao hơn một chút so với bệnh nhân nhận được trước khi áp dụng CPAP. Sau đó nó được điều chỉnh để đạt được SaO2 yêu cầu.
Không phải mọi bệnh nhân thiếu oxy đều hưởng lợi từ CPAP. Ví dụ, trong bệnh hen suyễn đơn giản, thiếu oxy máu là do bít tắc các đường hô hấp nhỏ với đờm đặc. CPAP nói chung sẽ không giải quyết những vấn đề này, cản trở việc làm ẩm và sử dụng máy phun khí dung, và cũng có thể làm trầm trọng thêm do làm quá căng các đơn vị phổi khác. “Phổi bị cứng hoặc bị chặn” (‘Solid or blocked lung’) (ví dụ: đông đặc của thùy phổi do khối u hoặc viêm phổi) có thể có ít lợi ích, vì phế nang không thể ‘mở cửa trở lại’. Trong hoàn cảnh như vậy, việc áp dụng CPAP có thể gây ra tình trạng căng thẳng và có lợi thế hạn chế. Một số bệnh nhân COPD có thể có lợi ích – nhưng những người khác có thể bị căng chướng quá mức các đơn vị phổi, và do đó làm trầm trọng thêm tình trạng thông khí. Tuy nhiên, điều này thường rất khó dự đoán – và một thử nghiệm điều trị thường được bảo đảm: chỉ 30-40% “bệnh nhân thiếu oxy máu nói chung” cuối cùng sẽ phải đặt nội khí quản nếu họ thử dùng CPAP hoặc NIV (chương 7 và 8).
CPAP có thể cải thiện quá trình oxy hóa và vai trò chính của nó là do suy hô hấp loại I (hypoxaemic). Tuy nhiên, CPAP cũng có thể nong cho đường hô hấp trên mở ở những bệnh nhân bị ngưng thở khi ngủ do tắc nghẽn, do đó ngăn ngừa sự xuất hiện của sự mất độ bão hòa về đêm (nocturnal desaturation) và tăng CO2 máu (hypercarbia). Trong các điều kiện khác, quá trình huy động phế nang có thể làm tăng thể tích khí lưu thông và thể tích phút, và do đó làm giảm nồng độ CO2. Điều này có thể đúng với phù phổi cấp, khi tình trạng tăng VD/VT có thể làm giảm sự thông khí phế nang, và mệt mỏi cơ bắp hô hấp và sự tắc nghẽn có thể làm cho CO2 tăng lên. ABG hữu ích để đánh giá những thay đổi về oxy hóa và thanh thải CO2. Một CO2 tăng có thể cho thấy hiện tượng căng phế nang quá mức hoặc tình trạng mệt mỏi và người bệnh cần thiết phải được hỗ trợ máy thở không xâm lấn (chương 8) hoặc thông khí cơ học.
Biến chứng của CPAP
CPAP nói chung là an toàn. Biến chứng không thường xuyên bao gồm hoại tử da do chèn ép, đặc biệt là cầu mũi. Ứng dụng sớm của băng keo (hoặc tương tự) có thể giúp tránh điều này. Dưới áp lực, không khí có thể bị nuốt vào, và căng chướng dạ dày không phải là hiếm. Điều này có thể gây khó chịu, trong khi kết quả đẩy ngược cơ hoành lên có thể gây xẹp phổi vùng đáy. Nếu sử dụng CPAP kéo dài, việc sử dụng song song ống mũi dạ dày có thể được xem xét – mặc dù điều này thực tế có thể làm trầm trọng thêm tình trạng căng chướng dạ dày do ống thống làm mở cơ tâm vị. Rò rỉ không khí phía trên có thể dẫn đến kích thích giác mạc/kết mạc. Tồi tệ nhất là gây loét giác mạc. Điều này có khả năng nghiêm trọng – vì vậy việc chăm sóc phải được thực hiện để tránh bị ‘rò rỉ lên trên’ đáng kể. Pneumothorax hiếm khi có thể làm phức tạp ở những bệnh nhân có nguy cơ (ví dụ như chấn thương, COPD).
VI. Thông khí xâm lấn
Mặc dù CPAP (chương 7) là một loại hỗ trợ ‘thông khí’ không xâm lấn, nhưng thường có nghĩa là ‘một dạng hỗ trợ áp lực dương’ khi nói về thông khí không xâm lấn, hoặc ‘NIV’ – Non-invasive ventilation. Sự hỗ trợ áp lực này là cần thiết khi công thở vượt quá khả năng thực hiện của bệnh nhân – do yếu hoặc suy giảm co cơ (ví dụ Guillain-Barre), công thở rất cao (ví dụ cổ trướng chèn ép cơ hoành, phù phổi), hoặc một sự kết hợp (ví dụ như bệnh nhân COPD).
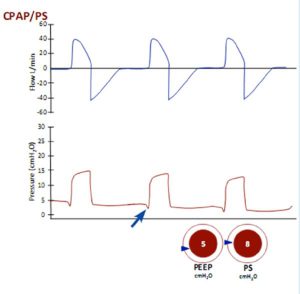
Thông thường, sự co cơ hô hấp sẽ làm giãn thể tích khoang ngực, giảm áp lực màng phổi, áp lực mô kẽ, và áp lực phế nang dưới mức áp lực khí quyển. Do đó không khí được đẩy vào phổi từ khoang miệng (tất nhiên, ở áp lực khí quyển). Thiết bị phù hợp có thể cảm nhận được sự bắt đầu của luồng khí đi vào (cảm biến lưu lượng, flow sensing) hoặc, áp lực giảm (cảm biến áp lực, pressure sensing), nhận ra sự khởi đầu của thì hít vào, và áp dụng áp lực dương vào miệng. Sự chênh lệch (gradient) về áp lực giữa miệng và phế nang do đó tăng lên, luồng khí đi vào phổi tăng (với sự bơm phồng tốt nhất ở các khu vực có độ giãn nở tốt nhất của phổi), và công hô hấp của nhịp thở giảm. Nói chung, áp lực hít vào dương tính này được sử dụng cùng với áp lực thì thở ra cao (PEEP), giúp giữ cho phế nang mở. Khi áp dụng bằng mặt nạ, sự kết hợp giữa PEEP và hỗ trợ áp lực này thường được gọi là ‘Thông khí không xâm lấn’ hoặc ‘NIV’ về từ ngữ.
NIV thường được sử dụng khi nhu cầu hỗ trợ ‘thông khí’ có thể ngắn hạn (phù phổi cấp tính), hoặc khi chỉ định đặt nội khí quản có nguy cơ cao hơn so với lợi ích, hoặc ở những bệnh nhân có điều kiện dẫn đến suy hô hấp loại 2 mãn tính. Việc áp dụng NIV có thể ngăn ngừa đặt nội khí quản. Đặt NKQ có xu hướng làm tăng khoảng chết, thường đòi hỏi thuốc an thần, hạn chế khả năng cử động, có thể gây khó chịu, và ngăn chặn phát âm và dinh dưỡng qua đường miệng, tự điều chỉnh nhu cầu dịch và các khía cạnh khác của tự chăm sóc. Tuy nhiên, NIV không nên trì hoãn đặt nội khí quản và thở máy khi cần thiết.
Trang thiết bị
Các yêu cầu cơ bản là máy thở, bộ dây máy thở (ventilator tubing) và giao diện (interface) để kết nối hệ thống với bệnh nhân. Máy thở không xâm lấn di động được sử dụng rộng rãi, cả trên ICU và các khoa hô hấp. Các kiểu máy thở khác nhau có độ phức tạp khác nhau, mặc dù tất cả đều có khả năng cung cấp lưu lượng khí cao để duy trì áp lực đường thở đặt trước ở cuối kỳ thở ra, hoặc EPAP – thực sự chỉ là một cách khác để nói ‘PEEP’, cũng như cảm nhận nỗ lực hít vào của bệnh nhân và cung cấp ‘áp lực đường thở dương tính thì hít vào” (hoặc IPAP). Ứng dụng của hai mức áp lực này đôi khi được gọi là “Áp lực đường khí dương kép” – hoặc BiPAP. Ở hầu hết các bệnh nhân bị suy hô hấp cấp tính, mặt nạ toàn bộ mặt (full face masks) được sử dụng và có hiệu quả hơn mặt nạ mũi (nasal masks) trong việc giảm nồng độ CO2.
Các máy cao cấp hơn có thể cung cấp tới 100% O2, trong khi ở các máy đơn giản hơn, O2 được thêm vào bộ dây máy thở phần xa thông qua một cổng phụ. Với hệ thống thứ hai này, nồng độ O2 thì hít vào thay đổi, phụ thuộc vào lưu lượng khí trong bộ dây, và không thể cung cấp hơn 60% O2 hít vào. Điều này rất quan trọng để xem xét khi điều trị bệnh nhân thiếu oxy máu.
Một số máy cũng có khả năng cố gắng cung cấp một thể tích khí được cài đặt với mỗi nhịp thở (lên đến áp lực tối đa được cài đặt) – bằng cách kiểm soát lưu lượng khí hít vào, và thời gian của chu kỳ hít vào (nghĩa là khí liên tục được đẩy vào theo tần số và thời gian cài đặt, để cung cấp một thể tích khí cài đặt) – nhưng các máy như vậy không thể nhận ra các rò rỉ xung quanh mặt nạ. Nói chung, hỗ trợ áp lực và PEEP đặt trước (như BiPAP) được sử dụng.
Chỉ định cho NIV
Bằng cách sử dụng một hệ thống kín hoàn toàn trong đó không khí không thể bị hít thêm vào, các hệ thống CPAP/BiPAP có thể cung cấp nồng độ O2 cao thực sự chính xác (FiO2 = 1.0) và do đó có hiệu quả trong điều trị tình trạng thiếu oxy. Huy động phế nang (và làm giảm sự bất tương xứng V:Q) cũng có thể được hỗ trợ. CPAP do đó được chỉ định khi việc huy động phế nang có thể xảy ra, và BiPAP/NIV khi công thở đòi hỏi phải tăng cường. Vai trò của cả CPAP và NIV trong xử trí phù phổi được xác định rõ ràng. Một vai trò có thể có trong bệnh hen suyễn gây tranh cãi nhiều hơn – và có thể giới hạn việc sử dụng phun khí dung.
- Trong xử trí đợt cấp của bệnh phổi tắc nghẽn mãn tính (COPD), NIV hiện là phác đồ điều trị đầu tiên được khuyến cáo cho bệnh nhân suy hô hấp loại 2. Ở đây, suy hô hấp cấp tính thường do cơ chế tăng công thở từ “xẹp đường thở động” (dynamic airway collapse). Những yếu tố này có thể ngăn chặn sự thở ra hoàn toàn trước khi thì hít vào tiếp theo bắt đầu, và “sự quá căng phổi động” (dynamic hyperinflation). Kết quả là một áp lực dương trong phế nang vào cuối thời gian thở ra (“PEEP nội sinh”, intrinsic PEEP). Áp lực này cần phải được khắc phục trước khi có thể xảy ra lưu lượng hít vào kế tiếp. Do đó, tải lượng thì hít vào tăng lên. Thở nhanh, nông thường dẫn đến việc làm tăng VD/VT) và vì vậy với sự mệt mỏi cơ hô hấp khiến PaCO2 tăng lên. NIV làm tăng áp lực đường hô hấp trên làm giảm sự xẹp đường thở, quá căng phổi động và PEEP nội sinh. Tăng thể tích khí lưu thông và tăng thanh thải CO2, và tần số thở giảm. Tỷ lệ đặt nội khí quản, tử vong và thời gian nằm ICU và nàm viện được giảm. Những người đáp ứng tốt nhất là những bệnh nhân nhiễm toan hô hấp vừa phải (pH 7,25-7,35) do bắt đầu điều trị sớm.
- Sử dụng CPAP trong phù phổi do tim, giúp huy động phế nang, làm giảm bất tương xứng V:Q, cải thiện oxy hóa và phục hồi các triệu chứng nhanh hơn. Nó cũng làm giảm công thở, giảm phù nề đường hô hấp trên, và mở trở lại các phế nang bị sụp đổ. Thật vậy, khoảng 70% tổng lượng O2 tiêu thụ có thể được sử dụng bởi cơ hô hấp. BiPAP có thể được xem xét, đặc biệt là nếu tăng CO2 máu được xác nhận, hoặc khi công thở tăng lên.
- Trong chấn thương ngực, NIV có thể giảm đau bằng cách cung cấp một số hỗ trợ hô hấp.
- NIV cũng có thể có vai trò trong việc hỗ trợ cho rút ống NKQ sớm bệnh nhân có bệnh nền COPD. Ở những bệnh nhân không chọn lọc, việc sử dụng NIV như một liệu pháp cứu hộ sau rút ống thất bại đã cho thấy làm tăng tỷ lệ tử vong.
- Suy hô hấp ở bệnh nhân ức chế miễn dịch có thể có kết cục kém: tỷ lệ tử vong (ví dụ, ở bệnh nhân cấy ghép tủy xương) có thể > 90%. Đặc biệt ở những người bị suy cơ quan đơn lẻ do nhiễm trùng cơ hội, một thử nghiệm của NIV có thể cải thiện kết quả của họ bằng cách tránh nguy cơ viêm phổi do máy thở. Một số thử nghiệm không kiểm soát đã cho thấy NIV thành công trong khoảng hai phần ba số bệnh nhân AIDS, bệnh huyết học ác tính, hoặc viêm phổi sau khi ghép phổi.
Chống chỉ định với NIV
Chống chỉ định tuyệt đối là rất ít. Tuy nhiên, tốt nhất nên tránh NIV, và đặt nội khí quản được ưu tiên, khi:
- Bệnh nhân không thể duy trì/bảo vệ đường hô hấp (điều này có thể bao gồm bệnh liệt do hành tủy).
- Độ giãn nở là một vấn đề, có lẽ thông qua sự kích động mà không thể kiểm soát được. Có nguy cơ bị ngưng thở.
- Chấn thương đầu hoặc mặt.
- Chống chỉ định tương đối bao gồm các yếu tố gây khó khăn khi mặt nạ khít với mặt (biến dạng khuôn mặt hoặc phẫu thuật gần đây), nuốt không khí có thể gây ra vấn đề (phẫu thuật thực quản/dạ dày gần đây), các trường hợp cần thiết phải gián đoạn thông khí để làm sạch các dịch tiết đặc, tắc ruột non hoặc đại tràng.
- Có vùng phổi đông đặc trên X-quang ngực (NIV làm tăng tỷ lệ tử vong)
Các vấn đề NIV thực tế
FiO2 được lựa chọn cao hơn một chút so với bệnh nhân nhận được trước khi NIV, và sau đó được điều chỉnh để đạt được một SaO2 thích hợp cho bệnh lý có từ trước.
EPAP thường được cài đặt ban đầu ở mức 5 cmH2O. IPAP (áp lực đường thở dương thì hít vào) là tổng áp lực hít vào (bao gồm EPAP) và thường ban đầu được đặt ở 10-15 cmH2O. Đáp ứng với những áp lực này nên được sử dụng để chuẩn độ IPAP cho các mục tiêu, thường là 20-30 cmH2O, tùy thuộc vào khả năng dung nạp và mức độ rò rỉ của mặt nạ. Hầu hết các máy thở có thể tạo ra áp lực cao (mặc dù hiếm khi được sử dụng) lên đến 40 cmH2O. Nếu cần áp lực cao hơn, rò rỉ xung quanh mặt nạ thường là một vấn đề, và thông khí xâm lấn thông thường có thể được chỉ định.
Cũng như đối với CPAP, các dấu hiệu cho NIV thành công bao gồm:
- Cải thiện khó thở: bệnh nhân ‘cảm thấy tốt hơn’ và tần số thở giảm.
- Cải thiện tần số thở và kiểu thở (do cải thiện oxy hóa và giảm công thở, giảm khó thở).
- Cải thiện oxy hóa: FiO2 có thể tăng lên, và điều chỉnh EPAP để cải thiện việc huy động phế nang, tạo điều kiện cho bệnh nhân trigger ở các trường hợp có PEEP nội sinh cao.
- Giảm PaCO2 và nhiễm toan hô hấp: IPAP có thể tăng lên và cải thiện thể tích khí lưu thông.
Điều quan trọng là phải quan sát bệnh nhân trong khi sử dụng NIV, để đảm bảo đồng bộ hóa đầy đủ với máy thở. Mỗi nỗ lực của bệnh nhân nên xác định sự gia tăng áp lực đường thở và giai đoạn hít vào không tiếp tục sau khi bệnh nhân bắt đầu thở ra. Nguyên nhân phổ biến nhất của sự không đồng bộ là rò rỉ mặt nạ: do đó cần phải có mặt nạ thích hợp.
Tất cả việc sử dụng NIV cấp tính cần được xem xét thử nghiệm. Nếu công thở tăng lên, khí động mạch không cải thiện đầy đủ hoặc xấu đi, hoặc nếu có sự suy giảm về mức độ nhận thức hoặc khả năng dung nạp, đặt nội khí quản và thở máy nên được xem xét. Điều này được thực hiện tốt nhất là ‘chọn lọc’ và không nên để cho diễn tiến đạt đến điểm khủng hoảng.
Biến chứng của NIV
Tương tự như với CPAP.
Tác dụng trên tim mạch của thông khí áp lực dương
Sự hít vào bình thường có liên quan đến áp lực trong lồng ngực âm tính, kéo máu tĩnh mạch vào tâm nhĩ phải, và mở rộng thành mạch máu phổi, làm giảm sức cản mạch máu phổi và tăng thể tích “máu được giữ” trong phổi. Thể tích tâm thất phải do đó tăng một chút trong hít vào chậm, trong khi cung lượng thất trái giảm nhẹ. Điều ngược lại là đúng với pha thở ra.
Trong quá trình thông khí áp lực dương, sự gia tăng áp lực trong lồng ngực và giảm máu tĩnh mạch trở lại, cung lượng tâm thất phải, và lưu lượng máu phổi ở thì hít vào. Khi thở ra, áp lực trong lồng ngực sẽ giảm và sự trở lại tĩnh mạch tăng lên. Nói cách khác, chu kỳ đổ đầy và làm trống bình thường của tim phụ thuộc theo chu kỳ hô hấp bị đảo ngược. Áp lực trong lồng ngực dương từ PEEP cũng ức chế sự trở lại tĩnh mạch.
Nói chung, thông khí áp lực dương có nghĩa là tiền tải thất phải giảm:
- Áp lực dương trong lồng ngực làm giảm gradient áp lực cho máu tĩnh mạch hệ thống đi vào ngực.
- Áp lực dương tác dụng trên bề mặt bên ngoài của tim làm giảm khả năng giãn nở của tim, và gây ra giảm đổ đầy tâm thất cuối thì tâm trương.
- Chèn ép các mạch máu phổi làm tăng sức cản mạch máu phổi, cản trở cung lượng nhát bóp thất phải (RV) (tăng hậu tải RV), khiến RV giãn nở, vách ngăn tâm thất lệch vào buồng thất trái (LV), kích thước buồng LV đến giảm, và do đó đổ đầy LV thì tâm trương bị giảm.
Như một sự đối trọng, các hiệu ứng ép tim trong quá trình tâm thu có xu hướng có tác dụng tích cực lên tâm thu, (như bàn tay bóp tâm thất trong tâm thu). Do đó, thông khí áp lực dương có xu hướng làm giảm đổ đầy tâm thất trong thời gian tâm trương nhưng tăng cường làm trống tâm thất trong thì tâm thu. Hiệu ứng tổng thể trên cung lượng tim sẽ phụ thuộc vào hiệu ứng trên tiền tải hoặc hậu tải chiếm ưu thế, và tim nhạy cảm như thế nào với những thay đổi này (theo bản chất của bệnh tim, hoặc tình trạng tải/đổ đầy hiện tại). Khi thể tích trong mạch máu là bình thường và áp lực trong lồng ngực không quá mức, tác động lên giảm hậu tải chiếm ưu thế, và thông khí áp lực dương làm tăng cung lượng nhát bóp tim. Tuy nhiên, trong giảm thể tích máu, hiệu ứng chiếm ưu thế là giảm tiền tải tâm thất và CO. Thông khí áp lực dương cũng cản trở lưu lượng bạch huyết: tăng áp lực mô kẽ phổi (bao gồm cả áp lực từ PEEP) chèn ép mạch bạch huyết ngoại vi có vách mỏng.
Thông khí áp lực dương (và PEEP) có thể, ở mức cao, làm tăng nước phổi: PEEP giúp loại bỏ dịch từ phế nang, nhưng giảm sự thoát dịch trong lồng ngực có thể dẫn đến duy trì trạng thái phù mô kẽ và tràn dịch màng phổi. Giữ nước và muối toàn thân cũng có thể tăng lên: do áp lực tĩnh mạch cao thúc đẩy phù nề, và các tác động lên tâm nhĩ có thể thúc đẩy tiết hormon chống bài niệu và ức chế tiết ra peptide natiuretic.
Tuy nhiên, các hiệu ứng này hiếm khi có tầm quan trọng lâm sàng trong việc sử dụng NIV và có thể có tác động lớn hơn trong quá trình thông khí áp lực dương xâm lấn kéo dài, mà chúng ta sẽ giải quyết trong các chương sau.
VII. Đường thở nhân tạo
Thông khí cơ học khó có thể cung cấp bằng phương pháp không xâm lấn. Do đó, đường thở chắc chắn là điều bắt buộc. Đây có thể là đường thở orotracheal – được gọi thông tục là ống nội khí quản (endotracheal tube) (thường được sử dụng ngày nay), hoặc ống mở khí quản (tracheostomy).
Ống nội khí quản
Ống nội khí quản cung cấp một phương tiện để đảm bảo đường thở của bệnh nhân (tức là đảm bảo việc tiếp cận khí quản để thông khí, đồng thời hạn chế nhiễm khuẩn từ hầu họng).
Chúng được trang bị một quả bóng có thể bơm lên ở đầu xa (cuff) – bóng chèn, được sử dụng để bít kín khí quản và ngăn chặn sự thất thoát áp lực dương từ khí quản qua thanh quản và bảo vệ phổi khỏi sự xâm nhập của các dịch tiết hầu họng hoặc dịch trào ngược từ dạ dày. Trong khi đầu gần có đầu nối tiêu chuẩn 15 mm, các ống có chiều dài khác nhau từ 25 đến 35 cm và có kích thước theo đường kính bên trong của chúng. Kích thước 8-9 mm sẽ dành cho hầu hết nam giới và kích thước 7-8 mm cho hầu hết phụ nữ. Chiều dài được đánh dấu bằng centimet ở bên ngoài ống (hình 9).
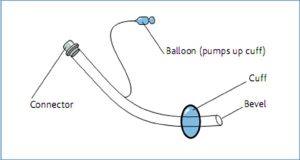
Biến chứng chậm gây ra do chấn thương áp lực chèn ép các mô xung quanh: tắc nghẽn của xoang hàm trên gây viêm xoang (đối với đặt nội khí quản mũi), mô hạt thanh quản hoặc khí quản và tắc nghẽn, và loét khí quản (gây xuất huyết).
Vị trí chính xác
Đối với nội khí quản, chiều dài từ đầu ống đến mức cung răng thường khoảng 20-22 cm ở nữ và 21-24 cm ở nam giới. Tuy nhiên, một XQ ngay sau khi đặt nội khí quản là bắt buộc, vì việc đặt ống sâu vào phế quản chính bên phải có thể dễ dàng xảy ra, và điều quan trọng là phải đánh giá chiều cao của ống ở mức trên carina. Một ống kết thúc 3-5 cm phía trên carina với tư thế đầu ở vị trí trung lập thường là lý tưởng. Ống có thể được “cắt” bớt để đảm bảo rằng nó không quá dài – mặc dù các ICU khác nhau đôi khi có quan điểm khác nhau về việc có nên thực hiện điều này hay không! Chiều dài ống ở môi nên được lưu ý, và kiểm tra điều dưỡng thường xuyên được thực hiện để đảm bảo rằng ống không trượt quá xa vào trong. N.B. Gập và ngữa cổ gây ra di chuyển 2 cm của ống nội khí quản.
Ống nội khí quản và công thở
Sức cản đường thở thông qua ống nội khí quản (NKQ, Endotracheal tube) có liên quan trực tiếp đến chiều dài của nó, và đến lũy thừa 4 của bán kính ống. Nói chung, do đó, đường kính NKQ nên > 8 mm đối với bệnh nhân được nhận vào ICU. Một bệnh nhân được thông khí trong một thời gian dài hơn có thể tạo biofilm trên lòng trong của ống và điều này có thể làm giảm đường kính hiệu quả. Cũng nên nhớ rằng nếu một bệnh nhân ICU cần soi phế quản, thì sẽ rất khó để soi phế quản một bệnh nhân có kích thước ống < 8 mm. Bất cứ khi nào bệnh nhân được đặt nội khí quản, công thở tự nhiên thường tăng lên. Người ta thường nói rằng áp lực hỗ trợ 6-8 cmH2O với một NKQ tại chỗ tương đương với công ‘bình thường’ của nhịp thở ở một bệnh nhân không đặt nội khí quản.
Ống nội khí quản và viêm phổi do máy thở (VAP)
Ngày càng trở nên rõ ràng rằng việc hít các dịch tiết nhiễm trùng ở vùng hầu họng và sự phát triển của một bioflm trong NKQ dẫn đến VAP. Do đó, một loạt các NKQ cải tiến (‘modified’) hiện đã có sẵn và đã được chứng minh là giảm tỷ lệ VAP. Do đó có hai chiến lược chính được sử dụng NKQ để cố gắng giảm VAP:
1. Giảm hít sặc vào phổi của dịch tiết hầu họng:
- Hệ thống hút dịch dưới thanh môn và trên bóng chèn: NKQ với một cổng hút bổ sung nằm phía trên bóng chèn để cho phép hút sạch các dịch tiết ở vùng hầu họng tập trung phía trên bóng chèn;
- Các bóng chèn (cuff) bằng polyurethane (mỏng): cuff này giới hạn sự hình thành các nếp gấp trong bóng chèn, đóng góp vào việc gây ra sự khít chặt vào khí quản, giảm vi hít sặc (microaspiration);
- Đo áp lực cuff: nhiều thiết bị hiện có sẵn để duy trì áp lực cuff trong phạm vi lý tưởng 20-30 cmH2O.
2. Giảm sự hình thành màng sinh học (biofilm) trên lòng trong nội khí quản
- Một NKQ mạ bạc: giảm sự hình thành biofilm và có thể giảm VAP;
- Mucus shaver: là loại ”dao cạo” cao su – silicone để có thể loại bỏ chất nhầy và biofilm khỏi lòng ống NKQ
VIII. Mở màng giáp nhẫn (Cricothyroidotomy)
Việc này KHÔNG giống như mở khí quản. Đó là một thủ tục khá khác biệt, trong đó dụng cụ tạo đường thở được đưa vào khí quản qua màng giáp nhẫn (cricothyroid membrane).
Minitrachs: Tiếp cận với một ống nhỏ (một ‘minitrach’) có thể hỗ trợ hút dịch tiết ở những người có độ thanh thải kém.
Chọc dò màng giáp nhẫn bằng kim: đây là một thủ thuật tạo đường thở cứu mạng được thực hiện trong một tình huống mà thời gian là yếu tố quan trọng nhất. Kỹ thuật này cung cấp khả năng phun khí O2 phản lực (jet insuffation of O2) trong trường hợp đường thở bị tắc nghẽn một phần.
Cách thực hiện:
- Chuẩn bị ống O2 – hoặc một lỗ bên được cắt ở gần đầu ống, hoặc đầu nối Y được gắn vào. Đầu kia được kết nối với nguồn O2.
- Đặt bệnh nhân vị trí nằm ngửa, với cổ ở mức trung tính hoặc hơi ngữa, và chuẩn bị sát trùng da, và sau đó giảm đau bằng thuốc tê cục bộ (ví dụ: 2ml 1% lidocaine với adrenaline 1:200.000).
- Gắn kim luồn tĩnh mạch 12G (hoặc 14G) vào ống tiêm 10ml.
- Giữa sụn giáp và sụn nhẫn, sờ vào màng giáp – nhẫn ở đường giữa. Với ngón tay cái và ngón trỏ của bàn tay không thuận của bạn ổn định khí quản để ngăn chặn khí quản di chuyển sang bên.
- Đâm thủng màng bằng kim tiêm, hướng góc 45° về phía ngực, trong khi nhẹ nhàng hút ống tiêm. Hút được không khí có nghĩa là đã xâm nhập vào khí quản.
- Tháo kim kim loại ra trong khi cẩn thận đẩy ống thông bằng nhựa xuống dưới. Cẩn thận không để làm thủng thành phía sau của khí quản.
- Gắn ống O2 vào trung tâm của ống thông và cố định ống thông vào cổ của bệnh nhân. Một người trợ lý thận trọng nên giữ ống thông để ngăn chặn bị gập. Thông khí liên tục đạt được bằng cách bít lỗ bên của ống trong 1 giây, sau đó nhả nó trong 4 giây. Thở ra thụ động (thông qua hầu họng, không thông qua ống thông) có thể xảy ra khi lỗ không bị bịt.
Oxy hóa đầy đủ chỉ có thể được cung cấp tối đa 45 phút (hạn chế chính là ứ CO2 động mạch), nhưng nó có thể được sử dụng để có thời gian chờ sự hỗ trợ của chuyên gia hoặc chuẩn bị thiết bị (ví dụ đặt nội khí quản). Quan sát chặt chẽ là bắt buộc!
Các biến chứng bao gồm:
- Thông khí không đầy đủ dẫn đến tình trạng thiếu oxy mô và tử vong. Nếu đường hô hấp bị tắc nghẽn ở đầu gần của ống thông, bệnh nhân khó có khả năng vượt qua sự tắc nghẽn khi thở ra và và vì vậy nên xem xét ngay mở màng giáp nhẫn bằng phẫu thuật. Trong tình huống này, chỉ một lượng nhỏ O2 được đưa vào, trong khi lượng khí thở ra không thể đưa ra ngoài. Ngoài ra còn có một khả năng khác là ống thông nhỏ có thể dễ dàng bị bít và bị nghẹt hoặc gập.
- Chảy máu, dẫn đến hình thành khối tụ máu và/hoặc hít máu vào phổi gây viêm phổi liên quan.
- Thủng thực quản, tuyến giáp hoặc thủng thành sau khí quản và tràn khí màng phổi.
- Tràn khí dưới da hoặc tràn khí trung thất.
Mở màng giáp nhẫn bằng phẫu thuật: cung cấp một đường thở xác định khi đường hô hấp trên bị tổn thương do chấn thương, nhiễm trùng hoặc sưng nề, và đặt ống nội khí quản qua đường miệng hoặc mũi không thể thực hiện được.
Cách thực hiện:
- Giống như đối với chọc màng giáp nhẫn bằng kim (xem ở trên), bệnh nhân nên được đặt ở vị trí nằm ngửa, với cổ ở vị trí trung lập. Cổ được chuẩn bị bằng chất khử trùng và nếu bệnh nhân tỉnh táo và thời gian cho phép, sẽ gây tê cục bộ (ví dụ:2ml 1% lidocaine với adrenaline 1:200.000) phải được thực hiện.
- Cố định sụn giáp với bàn tay không thuận để tránh chuyển động trong quá trình phẫu thuật.
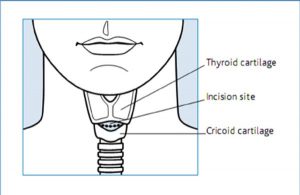
- Thực hiện vết rạch da ngang trên màng giáp nhẫn và sau đó rạch qua màng giáp nhẫn (hình 10).
- Đưa cán dao mổ (KHÔNG phải là cán bằng nhựa) qua vết rạch và xoay 90° để làm rộng lỗ mở đường thở. Nếu có, dùng các kẹp động mạch cong (ví dụ như kẹp cầm máu) hoặc dụng cụ mở khí quản có thể được sử dụng để mở đường thở.
- Chèn một ống nội khí quản có kích thước thích hợp (thường là đường kính trong 5-7 mm) hoặc ống mở khí quản. Các ống nên được quay xuồng phía dưới.
- Bơm bóng chèn và thông khí cho bệnh nhân. Sau đó, cố định ống chắc chắn.
- Nghe phổi và đánh giá phế âm 2 bên bằng nhau.
Mở màng giáp nhẫn khẩn cấp, tuy nhiên, kết hợp với một tỷ lệ cao hẹp thanh quản và hẹp dưới thanh môn. Một thủ thuật mở khí quản chính thức nên được thay thế khi có cơ hội sớm nhất.
Các biến chứng khác bao gồm:
- Xuất huyết và hình thành khối máu tụ, và hít sặc
- Tạo đường thở sai o Loét thực quản hoặc khí quản
- Liệt dây thanh
- Tràn khí dưới da và tràn khí trung thất
IX. Mở khí quản (Tracheostomies)
Mở khí quản là một đường thở nhân tạo được đặt vào khí quản giữa các vòng 1 và 4 (Hình 11). Trong ICU, chỉ định thông thường nhất cho phẫu thuật mở khí quản là yêu cầu thông khí cơ học kéo dài.
Ưu điểm của mở khí quản:
1. Bệnh nhân thoải mái hơn (và ít thuốc an thần hơn, thúc đẩy sự tham gia tích cực vào cai máy và phục hồi chức năng);
2. Giảm chiều dài ống (và khoảng chết) và do đó giảm công thở;
3. Cải thiện chăm sóc răng miệng;
4. Cho phép các giai đoạn xen kẽ bật hoặc tắt thông khí cơ học, giúp cai máy;
5. Tiếp tục tiếp cận đường thở của bệnh nhân trong khi bật hoặc tắt thông khí cơ học do đó cho phép hút thường xuyên các dịch tiết khí quản;
6. Bảo vệ đường thở liên tục (ví dụ, ở những người có bệnh bại liệt hoặc chấn thương não);
7. Uống bằng miệng, và thậm chí là cơ hội để nói (nếu sử dụng các loại ống và van được thiết kế đặc biệt).
Nhược điểm chính của ống mở khí quản là vị trí đặt của nó. Khi vùng mũi hầu họng được tách riêng khỏi khí quản, phương pháp bình thường của chúng ta về sự lọc, làm ấm và làm ẩm không khí bị bỏ qua. Do đó, điều quan trọng là cần phải sử dụng máy làm ẩm và ấm khi cung cấp O2.
Kỹ thuật đặt
Mở khí quản có thể được thực hiện như là một phẫu thuật mở, hoặc bằng cách đặt ống mở khí quản qua da tại giường (sử dụng một số phương pháp khác nhau). Hiện nay, hơn 90% các ống mở khí quản qua da được thực hiện trong ICU bằng một thủ thuật đặt qua da.
Biến chứng
Kết hợp các kỹ thuật phẫu thuật và đặt qua da ống mở khí quản, tỷ lệ tử vong < 0,25%, và các tác dụng phụ đáng chú ý xảy ra ở < 3% trường hợp.
Biến chứng sớm bao gồm:
Mất kiểm soát đường thở trong khi đặt (với thông khí không đầy đủ hoặc viêm phổi do hít): vì lý do này, KHÔNG BAO GIỜ để đến giai đoạn cuối, trừ khi bạn có kinh nghiệm hoặc được giám sát chặt chẽ.
Xuất huyết tại chổ (cầm máu đơn giản có thể đạt kết quả, nhưng hãy cẩn thận khi mất máu là đáng kể, cục máu đông có thể hình thành và gây tắc nghẽn phế quản, có thể đe dọa đến tính mạng).
Tràn khí dưới da/tràn khí màng phổi (đặc biệt là từ tổn thương của thành khí quản sau).
Sự tắc nghẽn ống (do tuột ra trong khoảng dưới da, thoát vị bóng chèn, tắc đầu ống do áp vào carina hoặc thành khí quản).
Sau khoảng 1 tuần, đã tạo thành “lỗ dò”. Trước đó, tụt ống tai biến có thể dẫn đến mất đường thở ngay lập tức, và việc đặt lại mù thường dễ bị sai vào các mô dưới da. Đặt nội khí quản có thể là cách an toàn nhất để tái lập đường thở trong tình huống này.
Biến chứng muộn bao gồm:
Hẹp dưới thanh môn hoặc hẹp khí quản.
Hiếm khi, loét vào động mạch chủ có thể gây xuất huyết thảm khốc.
Ống có bóng chèn và không bóng chèn
Các ống mở khí quản có kích thước khác nhau và có thể có bóng chèn và không bóng chèn. Bóng chèn được kết nối với một quả bóng test nhỏ thông qua đó chúng có thể được bơm phồng lên. Không khí được bơm cho đến khi không có bằng chứng rò rỉ xung quanh bóng chèn (nghĩa là không có không khí đi ra khỏi miệng trong quá trình thông khí áp lực dương) cho thấy kín giữa ống mở khí quản và thành khí quản.
Việc sử dụng mở khí quản có bóng chèn cho phép lưu lượng khí vào và ra khỏi phổi và hạn chế lưu lượng khí đến thanh môn, và giới hạn các chất tiết từ miệng hít vào phổi. Các ống không bóng chèn có thể được sử dụng ở những người có chức năng hành tủy tốt trong đó có đường thở thông thoáng có thể hút khi cần.
Các loại bóng chèn có thể là:
1. Thể tích thấp – áp lực cao (có thể ngăn ngừa chất nôn, chất tiết hoặc máu đi vào phổi: nếu để ở một vị trí trong thời gian dài có thể gây hoại tử niêm mạc khí quản).
2. Thể tích cao – áp lực thấp (giảm thiểu nguy cơ tổn thương khí quản do áp lực). Trong mọi trường hợp, áp lực bơm lên không được vượt quá 25 mmHg (~ 35 cmH2O).
Rò rỉ bóng chèn (không khí từ miệng) có thể là do áp lực quá thấp, hoặc do tiếp xúc giữa tường khí quản và dải quấn không đồng đều. Nếu áp lực trong bóng chèn vượt quá 35 cmH2O, hoặc rò rỉ vẫn tiếp tục mặc dù có thể thêm thể tích, ống mở khí quản có thể cần được thay thế bằng kích thước lớn hơn hoặc ống dài hơn, hoặc ống có thể tích cao.
Ống mở khí quản có cửa sổ và không cửa sổ
Một số ống được cung cấp với nòng bên trong, có thể được lấy ra và làm sạch thường xuyên (ngăn ngừa tích tụ dịch tiết khô có thể làm tắc ống). Ống cũng có thể phân loại là:
1. Non-fenestrated Ống không cửa sổ (ống ngoài rắn và ống bên trong rắn). Đây thường là lựa chọn đầu tiên cho bệnh nhân thông khí vì nó hạn chế không khí vào vùng hầu họng hoặc mô dưới da thông qua chỗ bị rạch.
2. Fenestrated Với những ống này, ống bên ngoài có lỗ. Chúng đi kèm với một bộ ống bên trong tùy chọn: rắn (được sử dụng khi bệnh nhân đang ở trên máy thở – về cơ bản làm cho ống hoạt động như một ống ‘non-fenestrated’) hoặc một ống có lỗ để phù hợp với ống ngoài) sử dụng khi không bơm bóng chèn, cho phép không khí lên đến dây thanh quản và họng hầu họng, và do đó người bệnh có thể nói được nếu bệnh nhân đủ mạnh (hình 12).
Cổng hút dưới thanh môn
Như đã thảo luận cho NKQ – các cổng hút dưới thanh môn cho phép hút dịch tiết và giảm hít sặc vào phổi và giảm tỷ lệ mắc VAP.
Van nói
Đây là những van một chiều gắn vào các ống mở khí quản mở ra trong thì hít vào (cho phép luồng không khí đi vào) và đóng trong khi thở ra để cho phép không khí thoát qua dây thanh âm và phát ra tiếng nói. Một số loại van nói tồn tại với sức đề kháng và sự thoải mái khác nhau. Van nói có một đĩa nhựa di động mở ra vào thì hít vào nhưng đóng vào lúc thở ra. Điều này có nghĩa là trong thời gian thở ra không có không khí có thể thoát ra qua lỗ của ống mở khí quản. Thay vào đó nó được chuyển hướng qua thanh quản (Hình 27).
X. Thông khí áp lực dương xâm lấn
Máy thở tạo ra một sự khác biệt về áp lực để cung cấp khí vào phổi, và sau đó cho phép khí đi ra. Có một số loại khác nhau, một số trong số đó bạn chỉ có thể thấy trong các đơn vị chuyên môn rất cao:
- Máy thở áp lực âm hoạt động theo phương pháp sinh lý hơn. Các hộp kín được bao quanh ngực của bệnh nhân (“cuirass”), hoặc một cái hộp toàn thân (chỉ có đầu và cổ bên ngoài – một “phổi sắt”) áp lực bên trong của nó bị giảm xuống. Khung sườn bị hút ra ngoài, áp lực bên trong lồng ngực bị giảm xuống, và không khí bị hút vào miệng.
- Máy thở dao động tần số cao (Máy thông khí phản lực không thường xuyên được nhìn thấy).
- Giường xoay (xoay bệnh nhân nằm ngửa sang nằm sấp, giảm tác dụng chèn ép lên cơ hoành của các tạng trong ổ bụng và mở rộng phổi).
Ngoài ra, các máy khác có thể ‘tiếp nhận’ chức năng phổi bằng cách trực tiếp oxy hóa máu và/hoặc thanh thải CO2 – oxy hóa qua màng ngoài tế bào/extracorporeal CO2 – ECMO/ECCO2R.
Nói chung, bạn sẽ được tiếp xúc (trong thực hành người lớn) với máy thở áp lực dương, bơm phồng phổi dưới áp lực dương. Chúng thường được trang bị nguồn điện (nguồn điện hoặc pin), mặc dù một số (đặc biệt là máy cầm tay) sử dụng năng lượng của nguồn khí nén (bình gas/cổng khí). Máy thở cơ học bao gồm bốn yếu tố chính:
- Một nguồn khí áp lực bao gồm một bộ trộn khí cho không khí và O2.
- Một van hít vào, van thở ra và bộ dây máy thở.
- Một hệ thống kiểm soát, bao gồm bảng kiểm soát, hệ thống giám sát và hệ thống báo động.
- Một hệ thống để cảm nhận khi bệnh nhân đang cố gắng hít thở.
Các chế độ hỗ trợ thông khí
Máy thở ICU có thể rất khó hiểu vì có nhiều chế độ khác nhau. Thật không may là không có danh pháp tiêu chuẩn nào được sử dụng và các chế độ cơ bản giống nhau có thể có các tên khá là khác nhau tùy theo nhà sản xuất máy thở. Tuy nhiên, hầu hết các chế độ có thể được phân loại theo các câu hỏi sau:
- Nhịp thở được cung cấp như thế nào: áp lực đặt trước hoặc thể tích đặt trước?
- Nhịp thở được cung cấp ở tần số đã đặt (chế độ kiểm soát) (controlled mode), hoặc đáp ứng với các nỗ lực hô hấp của bệnh nhân (chế độ tự nhiên) (spontaneous mode) hoặc kết hợp cả hai (hỗ trợ kiểm soát hoặc hỗ trợ tự nhiên) (assist-control or spontaneous-assisted).
Các chế độ được sử dụng phổ biến được nêu dưới đây:
- Kiểm soát thể tích (VCV) (còn được gọi là Thông khí bắt buộc liên tục [CMV], Thông khí áp lực dương liên tục [IPPV]).
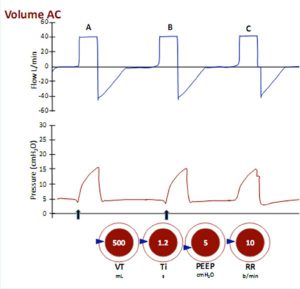
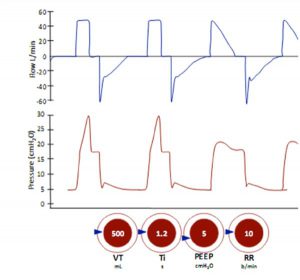
Trong chế độ này, bạn đặt máy thở để tạo ra nhịp thở với thể tích khí lưu thông nhất định (VT) trong một khoảng thời gian nhất định và ở tần số đã đặt (tần số thở). Thể tích đặt trước sẽ được cung cấp được đặt trên máy thở, và lưu lượng cần thiết để tạo ra thể tích đó sẽ được cung cấp trong một khoảng thời gian định trước hoặc với tốc độ lưu lượng đặt trước (ví dụ 0,5-2L/giây).
Áp lực đẩy (áp lực đỉnh trừ đi PEEP) cần thiết để đạt được mỗi thay đổi sẽ tùy thuộc vào cơ học hô hấp của bệnh nhân. Trong kiểm soát thể tích, số lượng nhịp thở được cài đặt có thể được coi là tần số tối thiểu vì có thể cho phép thở bổ sung nếu bệnh nhân cố gắng hô hấp thường xuyên hơn so với tần số đặt trước (nhịp thở hỗ trợ).
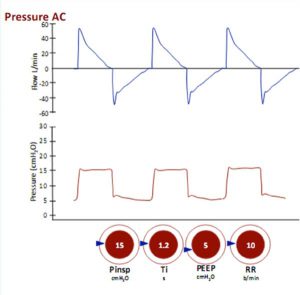
- Kiểm soát áp lực (PCV)
Máy thở được đặt lên đường thở với áp lực nhất định trong một khoảng thời gian nhất định và ở tần số đã đặt. Thể tích cung cấp sẽ phụ thuộc vào cách ‘co giãn’ hoặc độ giãn nở phổi và thành ngực: nếu độ giãn nở là thấp, thì áp lực cao vẫn có thể cung cấp một thể tích khí lưu thông thấp. Điều tương tự cũng xảy ra nếu sức đề kháng đường thở tăng lên (ví dụ, với bệnh hen suyễn hoặc nút nhầy tắc nghẽn đường thở). Một nguy hiểm không được công nhận: sự thông khí dưới mức mong muốn: nếu độ giãn nở giảm, VT sẽ giảm xuống như vậy. Máy thở hiện đại có thể cài đặt báo động để cảnh báo bạn về vấn đề này.
Một mối nguy hiểm khác là nếu sự độ giãn nở tăng (ví dụ như do lợi tiểu làm giảm phù phổi hoặc hồi phục tình trạng viêm phổi) thì phổi trở nên co giãn tốt hơn và VT tăng với cùng áp lực đẩy nhất định. Điều này có thể dẫn đến tình trạng căng phổi quá mức của phế nang (volutrauma), vì vậy cần chú ý đến VT được cung cấp trong các chế độ PCV.
PCV sẽ cho phép các nhịp thở bổ sung được cung cấp trên tần số đã đặt để đáp ứng các nỗ lực hô hấp của bệnh nhân. Một ưu điểm so với các chế độ kiểm soát thể tích là cải thiện sự thoải mái trong những nhịp thở bắt đầu của bệnh nhân, vì lưu lượng hít vào không được xác định và sẽ thay đổi tùy theo nỗ lực và cơ học phổi của bệnh nhân.
- Hỗ trợ áp lực (PS, hoặc ASB/Nhịp thở tự nhiên được hỗ trợ) Máy thở giúp cung cấp sự hỗ trợ hít vào bằng cách tăng áp lực đường thở để đáp ứng các nỗ lực thở tự nhiên của bệnh nhân. Mức hỗ trợ hít vào hoặc hỗ trợ áp lực là sự khác biệt giữa áp lực hít vào và thở ra tối đa được cài đặt. Thời gian hít vào không được cài đặt nhưng được xác định bởi thời gian nỗ lực hít vào của bệnh nhân.
Tốc độ của tạo áp lực ban đầu (đôi khi được gọi là độ dốc) có thể được điều chỉnh trên một số máy thở, để cố gắng phù hợp với điều khiển hô hấp của bệnh nhân hoặc cơ học phổi. Hít vào kết thúc khi máy thở cảm nhận sự sụt giảm trong lưu lượng hít vào dưới một tỷ lệ phần trăm nhất định của lưu lượng hít vào đỉnh (thường dưới 25%, nhưng có thể được điều chỉnh).
Áp lực hỗ trợ là một chế độ tự nhiên và bệnh nhân phải có một trung tâm điều khiển hô hấp bình thường, không có nhịp thở cung cấp nếu bệnh nhân ngừng thở. Tuy nhiên, hầu hết các máy thở đều có báo động ngưng thở và cung cấp nhịp thở dự phòng ở chế độ kiểm soát nếu bệnh nhân trở nên ngưng thở. Hỗ trợ áp lực có thể được coi là một phương pháp hỗ trợ thông khí một phần và thường được sử dụng khi bệnh nhân cải thiện và trong khi cai máy (hình 13 và 14).
Chú ý lưu lượng hít vào và thở ra và nhịp thở tự nhiên hoàn toàn được báo hiệu bởi sự sụt giảm áp lực ban đầu (mũi tên) do bệnh nhân kích hoạt (trigger).
Chú ý lưu lượng hít vào và thở ra và nhịp thở tự nhiên hoàn toàn được báo hiệu bởi sự sụt giảm áp lực ban đầu (mũi tên) do bệnh nhân kích hoạt (trigger).
Các nỗ lực hô hấp được “hỗ trợ” bởi máy thở bằng áp lực hít vào bổ sung (hỗ trợ áp lực). Thời gian hít vào theo chu kỳ lưu lượng có nghĩa là hít vào bị chấm dứt khi lưu lượng hít vào giảm xuống đến một giá trị nhất định (thông thường là 25%) của lưu lượng đỉnh hít vào.
Hỗ trợ kiểm soát (AC)
Nó là một chế độ hỗn hợp trong đó bệnh nhân nhận được một nhịp thở bắt buộc với thể tích khí lưu thông cài đặt (nếu kiểm soát thể tích AC) hoặc áp lực (kiểm soát áp lực AC). Nhịp thở bắt buộc có thể được kiểm soát hoàn toàn nếu bệnh nhân không kích hoạt máy thở hoặc hỗ trợ nếu bệnh nhân có thể kích hoạt máy thở (Hình 15, bên dưới).
Thể tích khí lưu thông được cài đặt và nhịp thở có thể được kích hoạt bởi bệnh nhân hoặc máy thở. Mỗi nhịp thở là đều là bắt buộc. Nhịp thở được kích hoạt bởi bệnh nhân là những nhịp thở bị giảm áp lực ban đầu (mũi tên) do bệnh nhân gây ra một nỗ lực hô hấp.
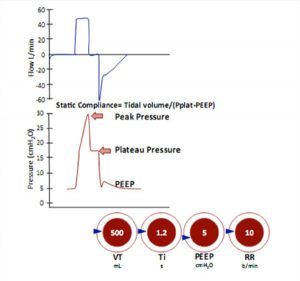
Chú ý sự khác biệt lớn giữa Ppeak và Pplat.
Sự khác biệt giữa áp lực đỉnh và cao nguyên là do sức cản đường thở. Độ giãn nở tĩnh (đo trong quá trình và thủ thuật ngưng cuối thì hít vào) được tính toán bằng thể tích khí lưu thông chia cho sự chênh lệch giữa áp lực cao nguyên và PEEP.
Hai nhịp thở đầu tiên được cung cấp với lưu lượng dạng ‘sóng vuông’ với sự ngừng lúc kết thúc thì hít vào, hai nhịp thở cuối cùng được cung cấp với lưu lượng giảm.
Chú ý sự khác biệt lớn giữa Ppeak và Pplat trong thông khí với lưu lượng dạng sóng vuông, nhưng không thấy trong thông khí với lưu lượng giảm và chênh lệch áp lực đỉnh giữa hai chế độ cung cấp, mặc dù áp lực cao nguyên giống nhau và cùng thể tích khí lưu thông.
Chú ý sự khác biệt nhỏ giữa Ppeak và Pplat trong lưu lượng giảm.
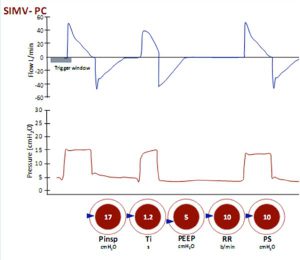
Thông khí bắt buộc ngắt quãng đồng bộ (SIMV)
Đây là một chế độ hỗn hợp kết hợp nhịp thở có kiểm soát bắt buộc và nhịp thở được hỗ trợ tự nhiên. Nhịp thở bắt buộc có thể là kiểm soát thể tích hoặc kiểm soát áp lực. Nếu bệnh nhân không có nỗ lực hô hấp thì nhịp thở bắt buộc được cung cấp ở tần số thông thường và chế độ có hiệu quả giống như kiểm soát thể tích hoặc áp lực. Sự khác biệt với SIMV là cách máy thở phản ứng với nỗ lực của bệnh nhân. Nếu nỗ lực hít vào được thực hiện khi nhịp thở bắt buộc đến hạn (cửa sổ thời gian ‘đồng bộ hóa’), thì máy thở sẽ đồng bộ hóa với những nỗ lực của bệnh nhân và cung cấp nhịp thở bắt buộc. Tuy nhiên, nếu bệnh nhân thở với tần số lớn hơn tần số cài đặt thì máy thở sẽ cung cấp nhịp thở hỗ trợ áp lực cho mỗi nhịp thở của bệnh nhân cao hơn tần số đặt trước. SIMV ban đầu được giới thiệu như một phương pháp cai máy, mặc dù bây giờ hầu hết các bác sĩ lâm sàng sẽ chuyển bệnh nhân sang hỗ trợ áp lực một mình khi bệnh nhân có trung khu kiểm soát nhịp thở thích hợp (hình 19-21).
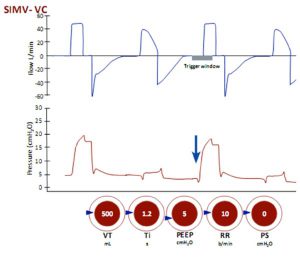
Thể tích khí lưu thông được cài đặt và nhịp thở có thể được kích hoạt bởi bệnh nhân hoặc máy thở. Khi nhịp thở được kích hoạt, mỗi nhịp thở là bắt buộc nếu chúng xuất hiện trong thời gian ‘cửa sổ kích hoạt’. Nhịp thở được kích hoạt là những nhịp thở bị giảm áp lực ban đầu (mũi tên) do bệnh nhân tạo ra nỗ lực hít vào. Nếu các nỗ lực hít vào xảy ra bên ngoài ‘cửa sổ kích hoạt’ và thường xuyên hơn tần số thở cài đặt thì chúng là những nhịp thở tự nhiên như CPAP.
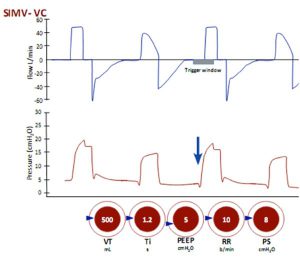
Thể tích khí lưu thông được cài đặt và nhịp thở có thể được kích hoạt bởi bệnh nhân hoặc máy thở. Khi nhịp thở được kích hoạt, mỗi nhịp thở là bắt buộc nếu chúng xuất hiện trong thời gian ‘cửa sổ kích hoạt’. Nhịp thở được kích hoạt là những nhịp thở bị giảm áp lực ban đầu (mũi tên) do bệnh nhân tạo ra nỗ lực hít vào. Nếu những nỗ lực hít vào xảy ra bên ngoài ‘cửa sổ kích hoạt’ và thường xuyên hơn tần số thở cài đặt, chúng sẽ tự động hỗ trợ nhịp thở như PS.
Áp lực hít vào được cài đặt và nhịp thở có thể được kích hoạt bởi bệnh nhân hoặc máy thở. Khi nhịp thở được kích hoạt, mỗi nhịp thở là bắt buộc nếu chúng xuất hiện trong thời gian ‘cửa sổ kích hoạt’.
Nhịp thở được kích hoạt là những nhịp thở bị giảm áp lực ban đầu do bệnh nhân gây ra một nỗ lực hít vào. Nếu các nỗ lực hít vào xảy ra bên ngoài ‘cửa sổ kích hoạt’ và thường xuyên hơn tần số thở cài đặt, chúng sẽ hỗ trợ tự động các nhịp thở như CPAP/PS.
Thông khí xả áp lực đường thở (APRV)
Duy trì áp lực đường hô hấp cao (CPAP cao) trong một thời gian dài (ví dụ: 4-5 giây), thỉnh thoảng “xả ra” trong thời gian ngắn ở áp lực thấp hơn (< 0,5 giây). VT được cung cấp với từng nhịp thở sẽ phụ thuộc vào sự khác biệt giữa áp lực cao (hít vào) và áp lực thấp (thởra), và độ giãn nở của phổi (hình 22).
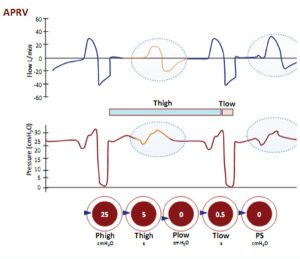
Tương tự như áp lực dương liên tục (CPAP), nơi Phigh là mức CPAP với thời gian Thigh. Thỉnh thoảng cứ sau vài giây (Thigh), pha CPAP liên tục được xả đến mức Plow trong một phần nhỏ của giây (Tlow) để cho phép xả áp lực nhưng không đủ dài để tránh được xẹp phổi. Nhịp thở tự nhiên xảy ra trong suốt thời gian Thigh (dạng sóng CPAP là dạng sóng trong khu vực khoanh tròn).
Thông khí BiLevel (BIPAP/áp lực dương hai pha)
BIPAP là PCV với nhịp thở tự nhiên được phép trong suốt chu kỳ hô hấp. Van được thiết kế khéo léo cho phép thở tự nhiên ở mức CPAP cao hoặc CPAP thấp. Nhịp thở có thể được hỗ trợ áp lực.
Tỷ lệ hít vào:thở ra (Tỷ số I:E, xem bên dưới) thường là 8 hoặc 9:1. Nếu bệnh nhân không thực hiện bất kỳ nỗ lực tự nhiên nào và tần suất và tỷ lệ I:E được đặt ở các giá trị thông thường thì BiLevel giống hệt với kiểm soát áp lực bình thường (hình 23).
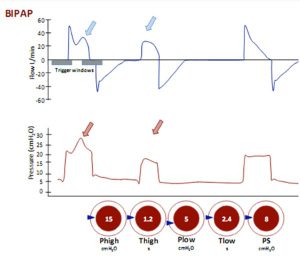
Áp lực hít vào được cài đặt và nhịp thở có thể được kích hoạt bởi bệnh nhân hoặc máy thở. Bệnh nhân có thể thở ở áp lực thấp và áp lực cao (hai mức CPAP) được hỗ trợ (PS) hoặc không được hỗ trợ. Mũi tên đại diện cho nhịp thở kích hoạt xảy ra trong hít vào và thở ra.
Kích hoạt – điều gì khiến máy thở bắt đầu phát ra nhịp thở?
1. Cảm biến áp lực (Pressure sensing) Máy cảm nhận áp lực giảm trong bộ dây máy thở khi bệnh nhân cố gắng hít vào. Vấn đề với cảm biến áp lực là các bộ dây máy thở và được làm bằng nhựa dẻo – bệnh nhân có thể cần nhịp thở/nỗ lực rất lớn trước khi áp lực âm được tạo ra. Sau đó, lúc bệnh nhân có thể đang cố gắng thở ra – thì máy máy thở lại thổi không khí vào một lần nữa! Điều này dẫn đến bệnh nhân không đồng bộ nhịp thở với máy thở.
2. Cảm biến thể tích/lưu lượng (Volume/flow sensing)
Ở đây, có một dòng khí không đổi thông qua bộ dây máy thở – và lượng khí trở lại được so sánh với lượng khí phát ra. Một sự khác biệt nhỏ bị giảm có nghĩa là bệnh nhân đang hít vào – và một nhịp thở được kích hoạt. Nói chung, cảm biến lưu lượng nhạy cảm hơn cảm biến áp lực và có khả năng ‘đồng bộ hóa tốt’ hơn.
3. Hỗ trợ máy thở điều chỉnh theo thần kinh (NAVA, Neurally adjusted ventilator assist)
Đây là một chế độ thông khí đặc biệt, cảm nhận hoạt động điện của cơ hoành – thông qua một điện cực thực quản để kích hoạt hít vào và chu kỳ thở ra. Chế độ NAVA (Maquet ® Servo-i), kích hoạt máy thở từ hoạt động điện của cơ hoành (EAdi), trái ngược với lưu lượng hoặc áp lực. Trong NAVA, áp lực đường thở ngay lập tức phản ánh trung khu kiểm soát hô hấp của bệnh nhân và không bị ảnh hưởng bởi sự thay đổi trong cơ học hô hấp hoặc bộ dây máy thở không hoàn chỉnh (ví dụ, rò rỉ), do đó cung cấp sự tương tác tối ưu giữa bệnh nhân và máy thở. EAdi thu được từ phần cơ hoành thông qua một ống dạ dày với một mảng chín điện cực và được hiển thị dưới dạng dạng sóng, có trục x là thời gian và trục y là mV. Với NAVA, máy thở áp dụng áp lực để mở đường thở trong suốt thì hít vào tương ứng với tín hiệu EAdi được nhân với hằng số có thể điều chỉnh được biểu thị bằng cmH2O/mV, được gọi là ‘mức NAVA’.
Chu kỳ – điều gì làm nút chuyển từ hít vào sang thở ra?
Bốn phương pháp có thể được sử dụng để làm nút chuyển từ hít vào sang thở ra:
a. Chu kỳ thời gian
Giai đoạn hít vào được cài đặt để kéo dài trong một khoảng thời gian, sau đó máy thở sẽ tự động chuyển sang giai đoạn thở ra;
b. Chu kỳ thể tích
Khi VT đã được cài sẵn, máy thở sẽ chuyển sang giai đoạn thở ra;
c. Chu kỳ áp lực
Giai đoạn hít vào kéo dài cho đến khi đạt được mức áp lực đặt trước tại thời điểm chuyển sang thở ra xảy ra; và
d. Chu kỳ lưu lượng
Giai đoạn hít vào chuyển đổi khi lưu lượng khí giảm xuống dưới một mức nhất định (tức là khi nhịp thở hoàn tất).
Trong mọi trường hợp, thể tích của từng nhịp thở được ghi lại thường bằng cách đo lượng khí trở về máy thở. Điều này có thể gây ra các vấn đề trong trường hợp có rò rỉ khí đáng kể qua ống dẫn nước.
Thời gian hít vào và tỷ lệ I:E
Thông thường (đối với bạn và tôi), người ta hít vào trong 1 giây và 2-3 giây thở ra (tỷ lệ hít vào:thở ra, hay tỷ lệ I:E, là 1:2-3). Trong chế độ thông khí kiểm soát thời gian hít vào cần phải được cài đặt hoặc bằng cách điều chỉnh tỷ lệ I:E hoặc thời gian hít vào. Thông thường một máy thở được cài đặt với tỷ lệ I:E là 1:2 hoặc 1:3 hoặc thời gian hít vào là 1-1,5 giây. Tuy nhiên, đôi khi tỷ lệ I:E được rút ngắn hoặc đảo ngược. Việc này được thực hiện để:
- Tăng áp lực trung bình đường thở mà không tăng áp lực đỉnh đường thở;
- Cho phép nhiều thời gian hơn để bơm khí vào (ví dụ: khi có tăng sức cản đường thở) hoặc để bơm phồng lên được các đơn vị phổi chậm bơm phồng; hoặc
- Thông qua các cơ chế này, cho phép các vùng phổi được ‘huy động’; hoặc
- Cho phép thời gian trao đổi khí xảy ra.
Tuy nhiên, khi tỷ lệ này bị đảo ngược thì sẽ có ít thời gian hơn để thở ra, do đó, người ta phải bảo vệ chống lại ‘bẫy khí’.
Chế độ thông khí nào được ưa thích phụ thuộc ít hơn vào bằng chứng và nhiều hơn nữa trên bệnh nhân và ICU. Ở những bệnh nhân suy hô hấp nặng, chế độ kiểm soát áp lực thường được ưu tiên, kiểm soát chính xác áp lực trong khi điều chỉnh thời gian dành cho hít vào nhiều hơn so với thời gian thở ra – nhưng không có nghĩa là tất cả các Chuyên gia ICU đều đồng ý về điều này!
XI. Cài đặt thông khí điển hình
Đối với ‘người lớn trung bình’, ‘các cài đặt cơ bản’ sau đây hợp lý để thông khí kiểm soát:
- Áp lực dương cuối kỳ thở ra (PEEP): 5 cmH2O. (Trong bệnh hen suyễn nặng, có lẽ là “ZEEP” hoặc không phải là PEEP, để bắt đầu. Trong phù phổi/ARDS, bắt đầu cao hơn nhiều ở 8-10 cmH2O).
- Tần số thở: 14-16 lần mỗi phút.
- Thể tích khí lưu thông: 6-8 mL/kg (dựa trên trọng lượng cơ thể lý tưởng) cho phổi bình thường.
- Tỷ lệ I:E = 1:2.
- FiO2: bắt đầu cao, và giảm tùy thuộc vào theo dõi SaO2. Trong một bệnh nhân thiếu oxy nặng, bắt đầu với 100% để được an toàn.
Cài đặt ‘đặc biệt’ có thể cần thiết ở bệnh nhân ARDS, hen suyễn và COPD – xem các chương sau.
Thông khí dao động tần số cao (HFOV)
HFOV là loại thông khí nhân tạo trong đó piston định kỳ nén khí liên tục để tạo ra dạng sóng áp lực dao động với biên độ nhất định (delta P) ở tần số từ 3-10 Hz và VT dưới mức khoảng chết là 1-4 mL/Kg trọng lượng cơ thể.
Các thông số HFOV thường được đề cập như sau:
- Lưu lượng khí (Bias flow): đây là tỷ lệ khí tươi đi vào bộ dây máy thở. Nó tạo điều kiện thanh thải CO2 và thiết lập một áp lực căng liên tục (continuous distending pressure) hoặc áp lực đường thở trung bình (mPaw).
- Tần số (Frequency): tỷ lệ dao động áp lực tính theo đơn vị Hertz (1 Hz = 60 nhịp mỗi phút).
- Áp lực căng liên tục (Continuous distending pressure) hoặc áp lực đường thở trung bình (mPaw, mean airway pressure): xác định thể tích phổi trung bình, huy động phổi và do đó oxy hóa máu.
- Biên độ áp lực dao động (Oscillatory pressure amplitude) (delta P) mô tả ‘peak to peak’ xung quanh mPaw (khoảng thông thường 60-90 cmH2O). Delta P được kiểm soát bởi cài đặt công suất (power) được đo bằng các đơn vị tùy ý từ 1 đến 10. Mối quan hệ giữa power và delta P không được xác định nhưng phụ thuộc vào các đặc tính cơ học của hệ hô hấp.
- Thời gian hít vào: tỷ lệ phần trăm của chu kỳ hô hấp được phân bổ cho hít vào – thường được đặt ở 33% (I:E ratio 1:2).
HFOV bây giờ chủ yếu được sử dụng như một điều trị cứu hộ trong suy hô hấp thiếu oxy trong bệnh nhân không phù hợp cho hỗ trợ qua màng ngoài cơ thể và thất bại với thông khí thông thường trong tư thế nằm sấp.
Chỉ định cho HFOV
- Hội chứng suy hô hấp cấp tính (ARDS), với các tiêu chí nghiêm trọng sau:
+ FiO2 > 0,7 và/hoặc SaO2 < 88% trên thông khí cơ học thông thường (CMV) với PEEP > 15 cmH2O,
+ Hoặc áp lực Pplateau > 30 cmH2O,
+ Hoặc áp lực khí đường thở (mPAW) > 24 cmH2O
- Dập phổi
- Các loại dò phế quản – màng phổi (BPF, Bronchopleural fistulas) và rò rỉ khí lớn
- Chấn thương phế quản
Cách cài đặt bệnh nhân trên HFOV
Cài đặt ban đầu
- FiO2 là 1,0.
- Tần số dao động ban đầu là 4-6 Hz.
- Tỷ lệ I:E 33%.
- Bias flow đặt ở 30-60 L/phút.
- Một mPAW là 3 cmH2O trên mức mPAW được sử dụng trong CMV trước khi sử dụng HFOV.
- Delta P thường khoảng 80-90 cmH2O. (Giảm bớt trong trường hợp rò rỉ khí nghiêm trọng).
Quản lý oxy hóa
Oxy hóa được kiểm soát thông qua FiO2 và mPaw.
Tăng mPaw sẽ tăng thể tích phổi có ga (huy động).
Quản lý thông khí (loại bỏ CO2)
- Kích thước của NKQ (đường kính trong càng lớn thì áp lực truyền đến phế nang càng cao thì VT càng lớn).
- Delta P: Delta P lớn hơn, VT càng cao.
- Tần số: tần số thấp hơn sinh ra càng lớn VT. Thông khí sử dụng Delta P lớn hơn và Hz cao hơn có vẻ bảo vệ hơn so với sử dụng cài đặt với Delta P nhỏ hơn và Hz thấp hơn.
- Tần số cao ảnh hưởng đến việc huy động phế nang khi vận tốc khí cao tạo ra áp lực có thể vượt quá ngưỡng cho việc mở phế nang.
- Hiệu suất thông khí (Q) phụ thuộc nhiều hơn vào VT và được biểu thị bằng: Q = f.VT 2 .
- Mục tiêu của HFOV là để đạt được loại bỏ CO2 đầy đủ, với tần số cao nhất bệnh nhân chấp nhận được.
Tránh HFOV nếu:
- Mất ổn định huyết động đáng kể.
- Hạ huyết áp có thể xảy ra.
- Nhiễm toan hô hấp có thể xảy ra.
- Rò rỉ khí không ổn định với tái phát nhiều lần.
Cai máy cho bệnh nhân từ HFO
Cân nhắc đưa bệnh nhân ra khỏi HFOV khi mPAW < 22 cmH2O và FiO2 là 0,4 trong 24 giờ.
XII. Chăm sóc bệnh nhân thông khí
Giảm đau, an thần và liệt cơ
Hiểu rằng sử dụng an thần, giảm đau và liệt cơ KHÔNG giống nhau.
Trong khi một số thuốc giảm đau và giảm lo âu có thể an thần (và ngược lại), tác động chính và mục đích sử dụng khác nhau với từng loại thuốc.
Đau là phổ biến trong ICU do tình trạng cơ bản, hoặc từ các thủ thuật mà bệnh nhân phải chịu. Điều này cũng đúng do các stress đơn giản (ví dụ như đặt ống nội khí quản) hoặc lo lắng. Do đó, an thần, giảm lo âu và giảm đau thường là cần thiết. Nhiều loại thuốc khác nhau có thể được sử dụng, một số còn có lợi thế là ức chế trung tâm hô hấp, và do đó cải thiện đồng bộ bệnh nhân – máy thở. Trong những tình huống mà thông khí hiệu quả là khó khăn, thuốc liệt cơ với các tác nhân chẹn thần kinh cơ cũng có thể cần thiết. Thuốc này không ngăn ngừa stress (nó có thể gây ra stress nếu bệnh nhân còn nhận thức) nhưng ngăn chặn stress biểu hiện ra bên ngoài là hiển nhiên. Tất cả bệnh nhân bị liệt cơ do đó phải được an thần trừ khi đã bất tỉnh.
Trong khi sử dụng thuốc an thần và thuốc giảm đau là rất phổ biến và cần thiết, có những nhược điểm khi sử dụng:
- Ức chế chức năng tim (trực tiếp, hoặc thông qua trung tâm giao cảm nội sinh), và giãn mạch có thể gây hạ huyết áp;
- Suy hô hấp (một thanh kiếm hai lưỡi – xem ở trên);
- Một số chất chuyển hóa, chẳng hạn như chất chuyển hóa midazolam, thực sự kích thích và có thể làm tăng kích động, góp phần vào sự phát triển của mê sảng, do đó có khả năng làm tăng nhu cầu an thần hơn;
- Nhiều tác nhân (hoặc các chất chuyển hóa của chúng) tích tụ đặc biệt trong sự hiện diện của rối loạn chức năng gan hoặc thận. Trạng thái protein thấp, mất thể tích cơ thể và tương tác thuốc đều có thể đóng góp vào điều này. Thanh thải thuốc trong điều trị thay thế thận cũng biến đổi.
Do đó, việc sử dụng các tác nhân này có thể kéo dài thời gian thông khí và chăm sóc đặc biệt. Do đó sử dụng giảm thiểu số lượng của các thuốc này được đưa ra. Do đó, nhiều ICU thực hiện như sau:
- Chuyển sang dùng thuốc an thần opioid, và tránh sử dụng benzodiazepine;
- Tránh việc sử dụng truyền tĩnh mạch liên tục các thuốc an thần/giảm đau của midazolam/morphine, để sử dụng các liều bolus nhỏ ngắt quãng;
- Ngưng ‘thuốc an thần’ (thường được kết hợp với các thử nghiệm thở tự nhiên); nghĩa là tắt tất cả thuốc an thần và thuốc giảm đau đầu tiên vào buổi sáng ở những bệnh nhân thích hợp và cho phép họ bắt đầu ‘tỉnh dậy’. Bệnh nhân tỉnh lại nhanh và hoàn toàn, truyền thuốc có thể được khởi động lại ở cùng một tốc độ. Nếu bệnh nhân tỉnh chậm, tiêm truyền thuốc an thần có thể được khởi động lại với tốc độ thấp hơn khi bệnh nhân tỉnh táo;
- Giám sát độ sâu an thần chặt chẽ hơn. Để giảm thiểu số lượng thuốc an thần được sử dụng, nhiều bảng điểm (score) đã được phát triển để đánh giá mức độ an thần (bảng 3). Lý tưởng nhất, thuốc an thần sẽ cho phép bệnh nhân hoặc là tỉnh táo nhưng hợp tác hoặc được an thần nhẹ nhưng đáp ứng với các y lệnh (nghĩa là số điểm từ 0 đến -2).
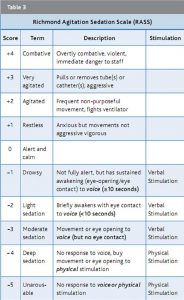

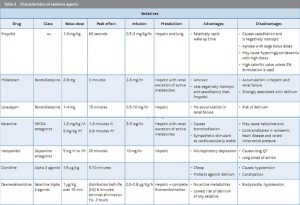
Lựa chọn thuốc (bảng 4 và 5)
Thông thường, một opioid được sử dụng một mình hoặc kết hợp với một thuốc an thần. Cần giảm sử dụng thường xuyên các thuốc benzodiazepin, vì thuốc này có thể kéo dài thời gian thông khí và tăng tỷ lệ mê sảng (delirium).
Thuốc chẹn thần kinh (bảng 6)
Nếu thông khí cơ học kém hiệu quả (ví dụ do mất đồng bộ bệnh nhân – máy thở hoặc các vấn đề cơ học), liệt cơ với một thuốc chẹn thần kinh cơ có thể được kết hợp với thông khí bắt buộc.
Điều này đặc biệt đúng trong trường hợp tăng PaCO2 cho phép (permissive hypercapnia) – thường kết hợp với thay đổi tỷ lệ I:E hoặc tần số thông khí chậm. Một số loại thuốc có sẵn để cung cấp phong tỏa thần kinh cơ, xem Bảng 6, nhưng phổ biến nhất được sử dụng là rocuronium là một thuốc dùng bolus, hoặc atracurium là một thuốc truyền tĩnh mạch liên tục. Bệnh nhân bị liệt cơ PHẢI được an thần đầy đủ, vì liệt cơ mà không an thần dẫn đến bệnh nhân ‘vần còn nhận thức’ và gây sang chấn tâm lý có ý nghĩa.
An thần là khó để đánh giá ở những bệnh nhân bị liệt cơ vì các điểm an thần không thể được sử dụng – một số ICU hiện đang sử dụng Bispectral Index Monitor.
Chăm sóc khu vực bị đè ép
Các bệnh nhân đang thở máy, đặc biệt là những người được an thần, mất khả năng cử động có nguy cơ phát triển các vết loét chèn ép. Những phát triển phổ biến nhất nơi da bao phủ ngoài xương. Các biện pháp phòng ngừa bao gồm thay đổi tư thế bệnh nhân sau mỗi 2-4 giờ, sử dụng giường và nệm giảm áp lực, và thường xuyên kiểm tra các vùng chịu áp lực để can thiệp sớm khi phát hiện thấy tổn thương da.
Chăm sóc mắt
Khô mắt, bệnh lý giác mạc do tiếp xúc và bệnh trầy xước giác mạc thường gặp ở những bệnh nhân chăm sóc đặc biệt do mất các cơ chế bảo vệ bình thường như khả năng nhắm mắt hoặc chớp mắt. Những biến chứng này được ngăn ngừa tốt nhất với việc sử dụng nước mắt nhân tạo hoặc chất bôi trơn mắt để giữ cho củng mạc ẩm hoặc băng hydrogel ẩm ướt hoặc băng để giữ cho mắt nhắm lại. Phù nề giác mạc có thể được ngăn ngừa bằng cách giữ cho đầu của bệnh nhân được nâng lên.
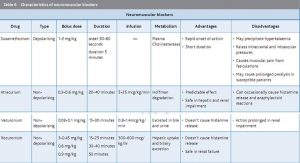
Chăm sóc răng miệng
Thường xuyên đánh răng (12 giờ), giữ cho miệng ẩm và loại bỏ các mảnh vụn và nước bọt là cần thiết để ngăn ngừa loét miệng và viêm nướu răng. Việc sử dụng thuốc khử trùng vùng răng miệng như gel chlorhexidine 1% có liên quan đến việc giảm tỷ lệ viêm phổi do máy thở (VAP) và bây giờ là một phần của hướng dẫn phòng ngừa VAP của Bộ Y tế.
Vệ sinh đường thở
Khi phản xạ ho bị suy giảm hoặc bị suy yếu ở những người tăng tiết dịch đường hô hấp được đặt nội khí quản và an thần, có thể tắc đờm nếu không được hút. Điều quan trọng là phải loại bỏ chúng để ngăn ngừa nhiễm trùng và tắc nghẽn đường thở và để cho phép thông khí tối ưu. Điều này đạt được với sự kết hợp giữa vật lý trị liệu ngực và hút đàm. Hút được thực hiện bằng cách sử dụng ống thông hút PVC đưa vào qua ống NKQ hoặc ống mở khí quản. Chúng có thể được giữ bên trong ống nội khí quản để chúng không bị ngắt kết nối và kết nối lại mỗi lần đường thở cần hút. Có thể gắn bẫy đờm vào thiết bị hút để cho phép thu thập mẫu hút khí quản tương đối sạch.
Phòng chống loét do stress
Các bệnh nhân bị viêm loét dạ dày có nguy cơ loét dạ dày và tá tràng mặc dù tỷ lệ chảy máu rất thấp hiện nay (<0,5%). Phòng ngừa là tốt nhất bằng cách đảm bảo tưới máu mô đầy đủ (tức là hồi sức máu/dịch) và dinh dưỡng đường ruột – khuyến khích tưới máu niêm mạc. Nếu điều này không thể thực hiện được, các chất đối kháng H2 hoặc chất ức chế bơm proton cần được chỉ định để ngăn chặn sự sản xuất axit dạ dày.
XIII. Viêm phổi mắc phải trong bệnh viện (HAP)
HAP (Hospital acquired pneumonia) được định nghĩa là sự phát triển của những thay đổi mới trên phim X quang ngực với bằng chứng nhiễm trùng sau > 72 giờ nằm viện. HAP là một trong những nguyên nhân hàng đầu gây tử vong do nhiễm trùng bệnh viện và thường xảy ra bên ngoài ICU. Hít sặc vào phổi có lẽ là nguyên nhân phổ biến nhất. Các đường hô hấp trên trở nên bị xâm nhập bởi vi khuẩn gram âm (75% trong vòng 48 giờ), tình hình trở nên trầm trọng hơn do dùng kháng sinh phổ rộng và thuốc làm thay đổi pH dạ dày có nghĩa là đường tiêu hóa trên (GI) không còn vô trùng nữa. Nguy cơ hít sặc tăng lên do mức độ ý thức giảm (ví dụ như dùng thuốc quá liều/co giật), khó nuốt, các tình trạng ở đường tiêu hóa trên ảnh hưởng đến đóng cơ vòng (ví dụ: ống thông mũi dạ dày [NG] đang đặt) và nguyên nhân gây gia tăng trào ngược (ví dụ: thức ăn bơm qua ống thông dạ dày có thể tích cao). Các yếu tố nguy cơ khác bao gồm bệnh phổi mãn hoặc các bệnh khác (đặc biệt là bệnh tiểu đường), tuổi tác, dùng steroid và các thuốc độc tế bào.
XIV. Viêm phổi do máy thở (VAP)
VAP được xác định là viêm phổi xảy ra ở bệnh nhân thở máy sau 48 giờ đặt nội khí quản, và ảnh hưởng đến 5-25% bệnh nhân đặt nội khí quản. Trên lâm sàng, các dấu hiệu viêm nhiễm có thể tăng lên, sốt có thể có hoặc tăng lên, và tình trạng oxy hóa có thể tồi tệ hơn, với sự phát triển của tổn thương mới trên X quang. Nó liên quan đến thông khí cơ học kéo dài và (như một yếu tố độc lập) với tỷ lệ tử vong cao.
Một số ICU sử dụng tỷ lệ VAP, đặc biệt là VAP khởi phát muộn, như một chỉ số chất lượng của dịch vụ chăm sóc được cung cấp cho bệnh nhân bị bệnh nặng.
Thời gian khởi phát là một biến dịch tễ học quan trọng
- VAP khởi phát sớm xảy ra trong vòng 5 ngày đầu tiên của thông khí cơ học, có tiên lượng tốt hơn và có nhiều khả năng gây ra bởi các vi sinh vật cộng đồng (Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus nhạy cảm với methicillin và bacilli Gram âm nhạy cảm kháng sinh).
- VAP khởi phát muộn xảy ra sau ngày thứ 5 và thường xuyên hơn do các tác nhân gây bệnh đa kháng thuốc như Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii hoặc S. aureus kháng methicillin, với tỷ lệ tử vong cao hơn.
Tỷ lệ VAP có thể được giảm xuống bằng cách sử dụng ‘gói chăm sóc’. Một gói chăm sóc là một tập hợp nhỏ, đơn giản của các yếu tố căn cứ vào khoa học (thường là 3-5), khi được thực hiện cùng nhau sẽ cải thiện kết quả.
Các yếu tố của gói chăm sóc Bộ Y tế 2011 Gói VAP bao gồm sáu yếu tố. 6 hành động được nêu bên dưới là phương pháp hay được đề xuất:
1. Độ cao của đầu giường: Đầu giường được nâng lên 30-45° (trừ khi có chống chỉ định);
2. Đánh giá mức độ an thần: Trừ khi bệnh nhân tỉnh táo và thoải mái, thuốc an thần được giảm/giữ để đánh giá ít nhất mỗi ngày (trừ khi chống chỉ định);
3. Vệ sinh răng miệng: Miệng được vệ sinh bằng Chlorhexidine Gluconate (≥ 1-2% gel hoặc chất lỏng) mỗi 6 giờ (vì Chlorhexidine có thể bị bất hoạt bởi kem đánh răng, khoảng cách ít nhất 2 giờ sau khi vệ sinh bằng Chlorhexidine và đánh răng). Răng được chải mỗi 12 giờ với kem đánh răng tiêu chuẩn;
4. Hút dịch dưới thanh môn: Một ống khí quản (endotracheal hoặc tracheostomy) có một cổng hút dịch tiết phía dưới thanh môn và trên bóng chèn được sử dụng nếu bệnh nhân được dự kiến sẽ được đặt nội khí quản > 72 giờ. Các dịch tiết được hút qua cổng dưới thanh môn này mỗi 1-2 giờ.
5. Áp lực bóng chèn ống nội khí quản: áp lực cuff được đo mỗi 4 giờ, duy trì từ 20-30 cmH2O (hoặc 2 cmH2O trên áp lực hít vào đỉnh) và ghi trên biểu đồ ICU;
6. Dự phòng loét do căng thẳng: Dự phòng loét do căng thẳng chỉ được kê đơn cho bệnh nhân có nguy cơ cao theo hướng dẫn tại địa phương. Dự phòng được xem xét hàng ngày.
Các biện pháp can thiệp khác (chẳng hạn như khử nhiễm chọn lọc đường tiêu hóa [SDD, selective decontamination of digestive tract]) vẫn còn gây tranh cãi và thiếu bằng chứng rõ ràng về độ chín.
Việc điều trị VAP có thể bị khó khăn do sự phát triển kháng thuốc do tăng thời gian thở máy và sử dụng kháng sinh phổ rộng trước đó; tham khảo hướng dẫn địa phương của bạn hoặc thảo luận với bác sĩ vi sinh của bạn.
XV. Khắc phục sự cố máy thở
Quy tắc cơ bản
Các bác sĩ mới thường hoảng sợ khi ‘có điều gì không đúng’ trong một bệnh nhân thông khí cơ học. Nói chung, một cách tiếp cận hợp lý và có hệ thống giải quyết hầu hết các vấn đề và ‘thuật toán cơ bản’ được học theo thời gian. Để tăng tốc mọi thứ, chúng tôi sẽ cung cấp cho bạn quan điểm của chúng tôi tại đây. Nhưng các quy tắc cơ bản vẫn áp dụng:
Hãy nhớ (giả sử vấn đề là với bệnh nhân chứ không phải là máy !!):
- Đường thở (ống nối khí quản hoặc ống ET có bị dịch chuyển hay bị nghẹt không? Máy thở có bị ngắt kết nối không?).
- Nhịp thở (Có tràn khí màng phổi không? Đờm trong phế quản? Mất nỗ lực hít vào của bệnh nhân đang thở hỗ trợ áp lực?
- Tuần hoàn (Mất lưu lượng mạch máu phổi có ảnh hưởng đến trao đổi khí không? Có một sự kiện hô hấp gây ra thay đổi tuần hoàn không? Có một ‘cơn bão nhiễm trùng’ ảnh hưởng đến cả tuần hoàn và thông khí không?).
- Gọi trợ giúp sớm nếu không chắc chắn. Đừng tự hào.
Hầu hết ‘rắc rối’ được chẩn đoán bằng cách kiểm tra lâm sàng nhanh chóng, với sự xác nhận của X quang phổi. Nhưng nếu bệnh nhân đang hấp hối, đừng chờ đợi X quang. Hãy hành động!
Tương tự như vậy, hầu hết các “rắc rối” đều được xử trí bằng các thao tác lâm sàng đơn giản: tự bóp bòng giúp thở cho bệnh nhân, hoặc thậm chí rút bỏ một NKQ/ống mở khí quản và sử dụng thông khí qua bóng và mặt nạ trên 100% O2 thường có thể giúp bạn thoát khỏi rắc rối.
Mất bão hòa và thiếu oxy mô (Desaturation and hypoxia)
Mất độ bão hòa thường được gây ra bởi sự gia tăng đột ngột trong bất tương xứng V:Q. Trong khi một số khu vực của phổi thông khí có thể không còn được tưới máu (ví dụ như sau khi bị thuyên tắc phổi), thì vấn đề phổ biến nhất là các khu vực tưới máu tốt đột nhiên không còn thông khí nữa. Giảm PaO2 thường được xử trí bằng cách tăng FiO2. Tuy nhiên, sự nếu giảm oxy hóa máu nhiều hơn và kéo dài hơn cần chẩn đoán và can thiệp nhanh chóng.
Hoạt động
- Chú ý đến bệnh nhân kịp thời.
- Tăng FiO2 một cách thích hợp (đến 100% O2 nếu cần thiết, trong thời gian tìm kiếm và xử lý nguyên nhân).
- Bệnh nhân có thông khí không? Kiểm tra chuyển động của thành ngực trực quan trong khi nhìn vào máy thở (đối với các báo động thể tích khí lưu thông thấp / áp lực cao).
- Nếu thông khí không đầy đủ, ngắt kết nối với máy thở và bóp bóng giúp thở bằng tay trên 100% O2. Sau đó, xác định nguyên nhân nào có khả năng xảy ra nhất và điều trị:
- Ống nội khí quản bị tắc hoặc di chuyển sẽ làm cho bóp bóng thấy cứng. Ống hút đàm có thể đưa vào qua ống NKQ không? Nếu không có thời gian, hoặc nghi ngờ, rút ống ra và thông khí bóng mask (che lỗ mở khí quản nếu cần).
- Tràn khí màng phổi có áp lực sẽ khiến cho việc “bóp bóng” trở nên khó khăn. Tràn khí màng phổi đơn giản có thể vẫn dễ dàng bóp bóng. Nếu lâm sàng nghi ngờ tràn khí có áp lực, nên thực hiện chọc dò màng phổi giải áp bằng kim. Lưu ý rằng, trong ARDS, tràn khí màng phổi khu trú thường xảy ra và có thể nhiều ổ. Do đó, một ống dẫn lưu ngực vẫn có thể sủi bọt tốt, điều này không loại trừ sự xuất hiện của tràn khí màng phổi khác trên cùng một bên! Tìm kiếm tràn khí màng phổi ở phổi đã bị tràn khí trước (cùng một bên phổi – ‘phổi sáng’ hơn so với phổi kia trên XQ? Có hình ảnh nào không rõ hãy yêu cầu chụp phim ngực nghiêng bên. Các nhà chụp X quang ghét làm điều này, nhưng đôi khi nó là cách duy nhất để chẩn đoán nhanh chóng an toàn. Sau khi ổn định nếu muốn, bạn có thể cần một CT.
- Nút nhày làm tắc phế quàn chính/phế quản phân thùy lớn. Bóp bóng (có hoặc không có nước muối 5-10ml bơm xuống NKQ) với kỹ thuật viên vật lý trị liệu ngực (cùng với bạn và y tá sẽ làm việc như một nhóm) có thể làm sạch nó. Khi ‘an toàn’, có thể cần soi phế quản);
- Nội khí quản đi sâu vào phế quản. NKQ vào quá sâu và ở trong phế quản gốc bên phải;
- Phù phế nang cấp tính (ARDS nặng, xuất huyết phổi, hoặc phù phổi). Điều này thường là hiển nhiên khi thấy đàm bọt hồng xuất hiện trong NKQ. Với ‘ARDS’, nên kết nối lại với máy thở, tăng PEEP và xử trí một cách thích hợp là tốt nhất. Nếu có nguồn gốc tim mạch, thì dùng các loại thuốc thích hợp (nitrate đường tĩnh mạch, lấy dịch dư nếu đang lọc máu liên tục) cần được chỉ định.
Nói chung, bóp bóng giúp thở cho đến khi khôi phục độ bão hòa – và quay trở lại máy thở với PEEP cao hơn có thể hạn chế sự xẹp phổi và cải thiện độ giãn nở, trong khi XQ cứu cấp được thực hiện để giúp xác định nguyên nhân.
Theo quy tắc chung, bắt đầu với mức PEEP xấp xỉ 1/5 của FiO2 yêu cầu duy trì PaO2 ở 8 kPa. ARDSNet cung cấp thang đo PEEP/FiO2 có thể được sử dụng khi bắt đầu thông khí cơ học.
Thủ thuật huy động phế nang
PEEP hoạt động như một giá đỡ đối với các đường dẫn khí xa và đối trọng với lực nén tạo ra bởi sự đàn hồi của phổi và thành ngực/bụng. Ngoài việc ngăn ngừa tình trạng xẹp phổi, PEEP cũng có thể mở phế nang bị xẹp và đảo ngược xẹp phổi. Do đó, PEEP có thể được sử dụng trong các thủ thuật huy động cụ thể để mang các vùng phế nang bị xẹp ‘trở lại hoạt động’ – cho phép phế nang đã bị xẹp tham gia vào trao đổi khí.
Nhiều phương pháp đã được mô tả – bao gồm cả ‘giữ’ áp lực hít vào ở áp lực 30-40 cmH2O trong 30-40 giây. Trong quá trình huy động, áp lực cao có thể gây ra ảnh hưởng xấu lên huyết động học. Điều này sẽ làm ngừng thủ thuật. Khi phổi đã được huy động, PEEP cần phải được áp dụng để giữ cho phổi đã huy động được mở: duy trì PEEP nâng cao hơn và tránh ngắt kết nối máy thở (ví dụ như phun khí dung).
Hiệu quả của PEEP đối với việc huy động phổi có thể được theo dõi bằng tỷ lệ PaO2/FiO2, là thước đo hiệu quả của trao đổi O2 qua phổi. Nếu PEEP có tác dụng thuận lợi và chuyển đổi các khu vực xẹp phổi thành các đơn vị phế nang – mao mạch chức năng, sẽ có sự gia tăng tỷ lệ PaO2/FiO2 (cải thiện oxy hóa). PEEP có cùng sự ảnh hưởng trên các yếu tố quyết định hiệu suất của tim như thông khí áp lực dương, nhưng khả năng giảm tiền tải của thất thường trở nên nổi bật hơn với PEEP.
PaCO2 tăng- Hypercapnia
Độ thanh thải CO2 sẽ giảm nếu thể tích phút phế nang giảm. Điều này có thể xảy ra do:
- Tần số thở thấp.
- Thể tích khí lưu thông thấp.
- Khoảng chết giải phẫu hoặc sinh lý tăng.
Sự gia tăng PaCO2 có thể gây bất lợi: áp lực nội sọ có thể tăng lên, O2 phế nang có thể bị ‘pha loãng’ bởi CO2 làm cho nồng độ O2 (và do đó ở động mạch) bắt đầu giảm và bệnh nhân có thể trở nên hôn mê. Ngoài ra, có rất ít dữ liệu cho thấy mức độ nhiễm toan hô hấp nặng có hại trực tiếp ở bệnh nhân đặt nội khí quản. Thật vậy, cố gắng “tăng hoạt động phổi” để làm sạch CO2 có thể gây hại nhiều hơn. Mức độ ổn định của CO2 cho độ pH là 7.25 hoặc thậm chí ít hơn thường được chấp nhận. Với thời gian, chức năng thận (bình thường) sẽ bù lại bằng cách giữ lại bicarbonate, khôi phục pH đến gần bình thường hơn.
Tình huống phổ biến nhất là thể tích khí lưu thông giảm trong quá trình thông khí kiểm soát áp lực:
Ở đây, cần phân tích tình trạng thiếu oxy do nguyên nhân gì: máy thở làm việc không? Ống NKQ/tracheostomy có bị tắc toàn bộ/một phần không? Nếu bạn đang ở trên một chế độ kiểm soát áp lực, độ giãn nở có giảm, do đó giảm thể tích khí lưu thông? phế quản có bị tắc không? Có tràn khí màng phổi không? Một tràn khí màng phổi có áp lực? Hoặc là vấn đề do thở nhanh. Nếu được chẩn đoán và xử lý một cách thích hợp, thì thể tích khí lưu thông sẽ được phục hồi. Một khi bạn đã ‘thực hiện tốt nhất bạn có thể’ để có được thể tích khí lưu thông bạn cần, thì bạn có thể vẫn cần tăng tần số thở ở các tình trạng nhạy cảm (với khí máu lặp lại sau mỗi thay đổi 20 phút hoặc với theo dõi CO2 end-tidal nếu liên quan). Tuy nhiên, có một số tình huống đặc biệt trong đó điều này có thể không lý tưởng, chẳng hạn như trong bệnh hen suyễn nặng. Ở đây, một tỷ lệ chậm (+/- thể tích khí lưu thông thấp) là trụ cột của liệu pháp. Tương tự như vậy, COPD có thể khó khăn để quản lý. Hãy tưởng tượng rằng thể tích khí lưu thông thấp. Toan máu xảy ra khi PaCO2 tăng:
- Bạn tăng tần số thở từ 24 lên 28.
- Mọi thứ trở nên tồi tệ hơn.
- Bạn tăng tần số thở một lần nữa.
- Tệ hơn nữa.
- Cần làm gì?
Rất thường gặp, vấn đề ở đây là ‘nhịp thở xếp chồng’ (breath stacking), còn được gọi là ‘bẫy khí’ (gas trapping’) hoặc ‘căng phổi động’ (dynamic hyperinfation), kết quả từ việc chấm dứt sớm thì thở ra thụ động trước khi thể tích phổi đạt đến dung tích cặn chức năng: không có đủ thời gian không khí đã đẩy ‘vào’ kịp thoát ‘ra’. Mức PEEP nội sinh (PEEPi) do đó tăng lên làm giảm lưu lượng máu phổi và làm tăng khoảng chết với kết quả là phần lớn lượng khí lưu thông được cung cấp không góp phần giải phóng CO2. Điều này có thể là do giai đoạn thở ra ngắn (thông khí tỷ lệ đảo ngược), một lưu lượng thở ra chậm (hen suyễn) hoặc cả hai.
Kỳ lạ thay, cách tiếp cận đầu tiên đôi khi là làm chậm tần số xuống. Sau đó nhìn vào biểu đồ dạng sóng. Nếu có bẫy khí (tức là lưu lượng không đạt đến số không khi thở ra), bạn có thể ngắt kết nối máy thở và nhấn vào ngực – và nghe thấy tiếng thở dài “chậm” khi khí thoát ra. Khi kết nối lại, thể tích khí lưu thông thường được phục hồi. Điều chỉnh tần số (và, trong PCV, thời gian thở ra liên quan đến hít vào) sao cho bẫy khí được giảm thiểu là việc then chốt. Lưu ý, tuy nhiên, bạn có thể phải chấp nhận một PaCO2 hơi tăng. Cuối cùng, nếu PEEP nội sinh hoặc ‘tự động’ rất cao, đôi khi bạn có thể khắc phục điều này (và cho phép giải phóng bẫy khí mà không ngắt kết nối) bằng cách tăng PEEP lên 80-90% autoPEEP. Ví dụ, nếu auto-PEEP là 10 cmH2O, việc áp dụng PEEP bên ngoài là 8 cmH2O có thể cải thiện việc làm trống phế nang. Ứng dụng thường quy của phương pháp này cần đánh giá cẩn thận về auto-PEEP và cần điều chỉnh thường xuyên vì đây là hiện tượng động mà nếu không được kiểm soát có thể dẫn đến tác dụng xấu trên huyết động học nghiêm trọng. Những tình huống này rất khó để quản lý và yêu cầu trợ giúp cấp cao!
Thở nhanh
Điều trị thở nhanh ở bệnh nhân trên các phương thức hỗ trợ áp lực thông khí (và liệu điều trị có được bảo đảm hay không) phụ thuộc vào nguyên nhân (Bảng 7). Điều trị nên được hướng dẫn theo nguyên nhân. Xử trí thể tích khí lưu thông thấp phần lớn được đề cập ở trên (trang 131). Tuy nhiên, đôi khi, tần số thở nhanh (có lẽ do lo lắng) có thể gây ra bẫy khí (hoặc giảm thông khí phế nang hiệu quả) ở những người bị bệnh phổi, và do đó làm giảm thể tích khí lưu thông xuống. Ở đây, đánh giá đáp ứng với bolus thuốc giảm đau/giảm lo âu có thể vừa là chẩn đoán vừa điều trị.
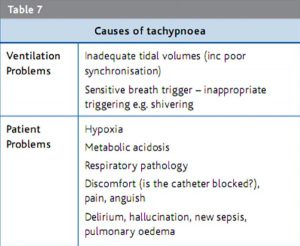
Không đồng bộ bệnh nhân – máy thở
Điều này đề cập đến một tình huống mà máy thở đang cố gắng cung cấp nhịp thở khi bệnh nhân đang cố gắng thở ra – và/hoặc ngược lại.
Tương tác của máy thở bệnh nhân có thể được mô tả như là mối quan hệ giữa 2 máy bơm hô hấp:
- Hệ thống phổi của bệnh nhân, được kiểm soát bởi hệ thống thần kinh cơ và bị ảnh hưởng bởi các đặc tính cơ học của phổi và ngực, và
- Máy thở, được kiểm soát bởi cài đặt máy thở và chức năng của các van lưu lượng.
Khi chức năng bơm 2 đồng bộ, mọi giai đoạn của nhịp thở đều hoàn toàn phù hợp. Bất cứ điều gì làm rối loạn sự hài hòa giữa 2 máy bơm dẫn đến sự không đồng bộ và gây khó chịu cho bệnh nhân và tăng công thở không cần thiết.
Sự không đồng bộ xảy ra khi có sự khác biệt giữa bệnh nhân và máy thở trong một hoặc nhiều giai đoạn thở:
1. Cơ chế kích hoạt (tức là bắt đầu hít vào), được cài đặt bởi cài đặt kích hoạt – độ nhạy, nỗ lực của bệnh nhân và đáp ứng van (hình 24, 25).
2. Giai đoạn hít vào. Trong cả thông khí kiểm soát thể tích và kiểm soát áp lực, nhu cầu của bệnh nhân cần được đánh giá cẩn thận, sử dụng các dạng sóng áp lực và lưu lượng để chẩn đoán.
3. Chấm dứt nhịp thở (cuối giai đoạn hít vào). Máy thở chấm dứt lưu lượng hít vào đồng bộ với thời gian thần kinh của bệnh nhân, nhưng thường thì máy thở ngừng hít vào sớm hơn hoặc muộn hơn thời gian thần kinh của bệnh nhân.
Trong quá trình thông khí kiểm soát thể tích, chúng tôi có thể điều chỉnh các biến có ảnh hưởng đến thời gian hít vào (ví dụ, lưu lượng đỉnh, thể tích khí lưu thông). Trong quá trình thông khí hỗ trợ áp lực hoặc kiểm soát áp lực, chúng tôi có thể điều chỉnh các biến có ảnh hưởng đến thời điểm lưu lượng hít vào chấm dứt (ví dụ: thời gian hít vào, độ nhạy thở ra).
4. Giai đoạn thở ra. Sự có mặt của PEEP tự động có thể dẫn đến khó khăn khi kích hoạt máy thở. Trong hỗ trợ áp lực hoặc chế độ IMV đồng bộ, điều này thường là do độ nhạy trigger cần điều chỉnh. Nếu đặt độ nhạy quá thấp, và bệnh nhân cố gắng hít vào’ trên máy thở, và chỉ tạo ra đủ áp lực hoặc lưu lượng để kích hoạt nhịp thở vào phút cuối – khi bệnh nhân chuẩn bị thở ra. Điều này cũng có thể là một vấn đề ở những người bị suy yếu cơ hô hấp/phổi và thể tích khí lưu thông nhỏ, tắc nghẽn đường thở đáng kể (ngăn chặn sự truyền áp lực đường thở) hoặc hạn chế (làm cho thể tích khí lưu thông nhỏ). Cài đặt độ nhạy quá cao, và các rung động nhỏ/run rẩy/cử động gây ra một nhịp thở, mà không được đồng bộ với nỗ lực nhịp thở thực sự. Do đó, sự không đồng bộ của máy thở phổ biến hơn ở những người có thể tích khí lưu thông thấp và/hoặc tần số thở cao – và đôi khi được giải quyết bằng cách dùng thuốc để hạ thấp tần số đó (ví dụ, trong điều trị lo âu/không dung nạp ống NKQ/đau).
Nếu trao đổi khí bị suy giảm, và vấn đề không thể giải quyết được, sự an thần sâu hơn thường được ưu tiên hơn, với việc chuyển sang thông khí bắt buộc (có hoặc không có phong tỏa thần kinh cơ) nếu cần.
Các chế độ thông khí khác có thể có vấn đề, với các chế độ bắt buộc đôi khi ít được dung nạp tốt hơn so với SIMV/PS. Tương tự, tỷ lệ I:E gần với tỷ lệ thở bình thường (1:2) thường được dung nạp tốt hơn so với tỷ lệ ‘I:E’ đảo ngược.
Chế độ kích hoạt nhịp thở cũng có thể là một vấn đề: nếu áp lực âm gây ra có thể được tạo ra không đủ để kích hoạt nhịp thở, các kích hoạt lưu lượng là thích hợp hơn. Mức PEEP nội sinh cao là nguyên nhân phổ biến của sự không đồng bộ, vì nó ngăn chặn nhịp thở được kích hoạt. PEEP bên ngoài sẽ cải thiện kích hoạt trong tình huống này (hình 24).
Ngoài ra, máy thở có thể cung cấp nhịp thở không được kích hoạt vì bộ kích hoạt đặt quá nhạy hoặc có rò rỉ bộ dây thở hoặc quanh ống NKQ (hình 25).
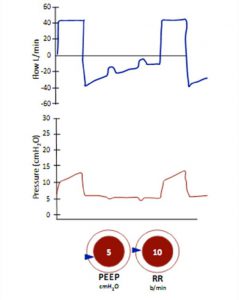
Lưu ý: hai thay đổi về áp lực (độ lệch âm) và lưu lượng (độ lệch dương). Chúng đại diện cho những nỗ lực hô hấp mà không kích hoạt máy thở. Cài đặt mức kích hoạt quá cao hoặc sự hiện diện của PEEP nội sinh có thể gây ra sự kích hoạt không hiệu quả.
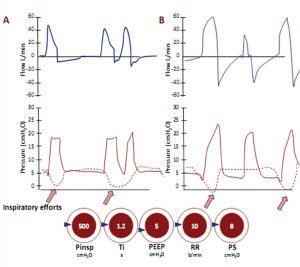
Chu kỳ kép: Hai chu kỳ máy thở xảy ra trong 1 nỗ lực hô hấp của một bệnh nhân
Tự động kích hoạt: máy thở cung cấp một nhịp thở mà không được kích hoạt (mong muốn) – bởi bệnh nhân. Sự không đồng bộ này có thể xảy ra khi kích hoạt hít vào quá nhạy cảm hoặc có sự rò rỉ. ‘Chu kỳ tự động’ không cho thấy sự giảm áp lực đường thở ban đầu.
Áp lực đường thở cao
Máy thở đo áp lực đường thở. Áp lực đường thở phát sinh từ việc cung cấp nhịp thở ở bệnh nhân thụ động được kiểm soát bằng phương trình chuyển động đơn giản cho hệ hô hấp:
Airway Pressure = (Lưu lượng x sức cản đường thở) + (Thể tích khí lưu thông x 1/độ giãn nở) + PEEP tổng
Kiến thức về dạng sóng áp lực rất hữu ích khi cố gắng xác định nguyên nhân gây áp lực đường thở cao. Trong thông khí kiểm soát áp lực, áp lực tăng lên đến đỉnh cao đặt trước, và sau đó áp lực đẩy được giữ. Các phổi có độ giãn nở tốt sẽ tiếp tục mở rộng, và lưu lượng khí tiếp tục trong thời gian này. Áp lực cao nguyên có thể đo được ở những bệnh nhân ngưng thở hoặc liệt cơ bằng cách nhấn phím ngưng thở tạm thời cuối thì hít vào. Tại thời điểm này không có lưu lượng (từ công thức trên) áp lực đường thở sẽ tương đương với áp lực phế nang.
- Trong thông khí kiểm soát thể tích, áp lực đường thở đỉnh với cao nguyên thấp hơn nhiều cho thấy sự gia tăng sức cản đường thở – bao gồm cả tắc nghẽn đường thở. Nếu đột ngột, NKQ có thể bị nghẽn với đàm; đầu NKQ có thể bị tắc do thoát vị bóng chèn; khí quản với mô hạt.
- Áp lực cao nguyên tăng cho thấy độ giãn nở phổi thấp. Có thể do đặt nội khí quản vào phế quản gốc; tràn khí màng phổi; phù phổi/xuất huyết; bẫy khí; chướng bụng gây chèn ép cơ hoành; xẹp phổi/thùy phổi.
Thể tích khí lưu thông thấp
Thể tích khí lưu thông không hiệu quả có thể gây ra sự thông khí không đầy đủ, và do đó ứ CO2. Nguyên nhân làm giảm lượng khí lưu thông (và xử trí chúng được trình bày ở trên.
Tuy nhiên, một lời cảnh báo: hầu hết các máy thở đều đo thể tích khí lưu thông khi trở về máy thở. Do đó, nếu có rò rỉ ở đâu đó trong bộ dây máy thở, thì thể tích khí lưu thông được ghi lại sẽ không đại diện cho thể tích khí lưu thông thực sự bơm vào phổi của bệnh nhân. Một bệnh nhân với một ống dẫn lưu màng phổi có thể được thông khí tốt – nhưng không khí thoát qua ống dẫn lưu sẽ không được ghi lại. Tương tự, các máy phun khí dung cung cấp khí đẩy, và có thể làm tăng thể tích khí lưu thông đo được, và độ ẩm trên các cảm biến khiến chúng đọc kết quả sai.
Bẫy khí /PEEP nội sinh
Có thể nhận dạng xu hướng bẫy khí bằng cách quan sát đường cong lưu lượng – thời gian, như được thể hiện trong hình 26: (a), lưu lượng khí thở ra ngừng trước khi bắt đầu phát hiện hít vào, cho thấy tất cả khí hít vào đều được thở ra; (b), lưu lượng thở ra tiếp tục phát triển ngay cho đến khi nhịp thở tiếp theo bắt đầu, cho thấy rằng không phải tất cả khí hít vào đều được thở ra. Điều này sẽ làm PEEP nội sinh (tự động) tăng lên và có thể đo PEEP tự động bằng cách thực hiện ngưng cuối thì thở ra ở bệnh nhân ngưng thở, như hình 26. Bẫy khí có thể bị hạn chế bằng cách xử lý đầy đủ co thắt phế quản, đảm bảo đủ điều kiện thời gian thở ra bằng cách tăng phần thở ra của tỷ lệ I:E và đảm bảo rằng tần số thở không quá cao, và đảm bảo thể tích khí lưu thông được cung cấp không quá lớn.
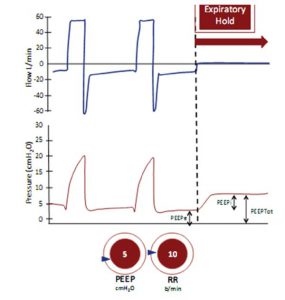
PEEP nội sinh (PEEPi) có thể được tính bằng cách lấy PEEP tổng (PEEPtot) trừ PEEP cài bên ngoài (PEEPTot)
Ngưng thở
Trừ khi máy thở hư hỏng, hoặc các bộ dây máy thở bị tắc, ngưng thở không thể xảy ra với các chế độ thông khí bắt buộc vì tần số cài đặt của nhịp thở luôn luôn phải được cung cấp. Ngưng thở có thể xảy ra ở các chế độ hỗ trợ thông khí nếu không có tần số thở bắt buộc dự phòng. Ngưng thở có thể có nguồn gốc não (bệnh lý tại não, tác dụng của thuốc an thần) hoặc nguồn gốc tủy sống/ngoại biên (bệnh thần kinh cơ) – các thuốc gây liệt cơ, bệnh thần kinh cơ nghiêm trọng, Guillain-Barre hoặc hội chứng cắt ngang tủy. Cả hai sự giảm thông khí và tăng thông khí đều có thể dẫn đến ức chế hô hấp và ngưng thở. Sự giảm thông khí dẫn đến sự tích lũy CO2 và suy giảm ý thức. Tuy nhiên, thường bệnh nhân COPD (những người có thể là những người bị ứ CO2) sợ nhất là ‘thông khí quá mức’ và trở nên kiềm hóa máu. Trong trạng thái này (ngay cả khi PaCO2 là 8 kPa!), trung khu hô hấp sẽ bị ức chế và bệnh nhân ngưng thở. Mặc dù tương đối không phổ biến, những bệnh nhân có ứ CO2 mạn tính có thể dựa vào tình trạng thiếu oxy để kiểm soát hô hấp: ở những bệnh nhân này, việc cung cấp quá nhiều O2 sẽ làm giảm khả năng hô hấp.
Thông khí phút thấp
Việc duy trì thông khí đầy đủ là rất cần thiết để đảm bảo thanh thải CO2 và tất cả các máy thở có báo động thông khí phút thở ra. Máy thở cũng đo thể tích khí lưu thông hít vào và thở ra liên tục. Một số tình huống có thể dẫn đến thông khí thấp bao gồm: thay đổi cơ học phổi (tăng sức đề kháng hoặc giảm độ giãn nở) hạn chế thể tích khí lưu thông, ngắt kết nối, rò rỉ trong bộ dây thở hoặc giảm nhịp thở/ngưng thở ở bệnh nhân thở tự nhiên. Bởi vì máy thở giám sát thể tích khí lưu thông hít vào và thở ra, chúng thường sẽ phát hiện nếu có sự khác biệt đáng kể và báo cáo sự hiện diện của rò rỉ trong bộ dây. Như với tất cả các báo động, nếu nguyên nhân là không rõ ràng và ngay lập tức điều trị được điều đầu tiên cần làm là ngắt kết nối bệnh nhân với máy thở và bắt đầu thông khí bằng tay với bóng giúp thở.
Rò rỉ có thể gây ra hiện tượng thông khí phút thấp. Bạn sẽ nghe thấy tiếng khí thoát ra từ đường thở. Hãy cảnh giác với việc phản ứng với điều này bằng cách đơn giản là bơm bóng chèn. Ống nội khí quản hiện đại hiếm khi phát triển rò rỉ từ bóng chèn. Cho đến nay, lý do phổ biến nhất cho một ‘rò rỉ cuff’ là do dịch chuyển ra ngoài của ống nội khí quản với kết quả là bóng chèn không kín vì nó đang thoát vị trên dây thanh âm. Luôn kiểm tra vị trí của bóng chèn bằng đèn soi thanh quản ở bệnh nhân phát triển rò rỉ bóng chèn và chuẩn bị để đưa ống tiếp tục vào đường thở hoặc đặt lại ống với ống dài hơn nếu cần.
Báo động áp lực cao
Khi báo động áp lực cao được kích hoạt, máy thở sẽ ngay lập tức ngừng hít vào và chuyển sang thì thở ra. Nếu báo động tiếp tục được kích hoạt, thông khí phút sẽ giảm nhanh chóng do đó báo động này cần phải được trả lời ngay lập tức. Báo động áp lực cao có nhiều khả năng được kích hoạt trong chế độ thể tích, bởi vì áp lực đường thở được đặt trước trong chế độ áp lực. Sự gia tăng đáng kể sức cản đường thở hoặc giảm độ giãn nở có thể dẫn đến sự gia tăng đáng kể áp lực đường thở và kích hoạt báo động trong quá trình thông khí thể tích. Các nguyên nhân khác bao gồm kích động, ho và tắc ống nội khí quản. Nguyên nhân phổ biến nhất của tắc ống là do bệnh nhân cắn.
XVI. Khuyến cáo chăm sóc bệnh nhân thông khí.
Phun khí dung
Nebulisers tạo ra những giọt chất lỏng nhỏ, cung cấp ‘nước’ (ví dụ như máy phun khí dung nước muối để làm lỏng chất tiết) hoặc các loại thuốc (như salbutamol trong bệnh hen suyễn) đến vùng phổi xa. Chúng cũng được sử dụng khi thuốc hít định liều (MDI) không thể cung cấp công thức thích hợp (ví dụ như prostacyclin nebulised), hoặc khi bệnh tật/kỹ thuật can thiệp kém. Loại thứ hai áp dụng cho nhiều bệnh nhân ICU, những người có thể yếu, lú lẫn, hôn mê hoặc thở máy.
Có hai loại máy phun khí dung chủ yếu:
- Máy phun khí dung phản lực (Jet nebulizer) (phổ biến nhất) dùng khí nén (thường là không khí hoặc O2) thông qua một buồng chứa chất lỏng được cung cấp. Sản xuất ra hạt khí dung phụ thuộc vào tốc độ khí: hầu hết yêu cầu 6-10 lít/phút và tạo ra các hạt có đường kính 15-500 μm. Tốc độ lưu lượng phải được đặt chính xác: nếu các hạt quá lớn, chúng có thể không thoát ra khỏi buồng phun khí dung, hoặc có thể tác động lên mặt sau của cổ họng và chảy xuống để nuốt. Quá nhỏ (< 0,5 μm) và chúng có thể được thở ra bởi bệnh nhân mà không lắng đọng xuống phế quản – phổi.
- Máy phun khí dung siêu âm (Ultrasonic nebulisers) sử dụng dòng điện để rung màng và “lắc” chất lỏng thành các hạt nhỏ. Trong một nghiên cứu nhỏ ở châu Âu về bệnh nhân thông khí sau khi phẫu thuật tim, hệ thống siêu âm cung cấp hơn gấp đôi hạt cho phổi so với một máy phun khí dung phản lực, và nhanh hơn. Tuy nhiên, chi phí và không sẵn có nên bị hạn chế sử dụng chúng ở Anh.
Chỉ định phun khí dung tại ICU
Trong hen suyễn và COPD
Salbutamol nebuliser cung cấp chủ vận beta-2. Liều (2,5-5mg) và tần suất (6 giờ hoặc nhiều liều liên tiếp) được xác định theo mức độ nghiêm trọng của bệnh.
Một đường truyền tĩnh mạch của salbutamol (2-20 microgram/phút) hoặc aminophylline (liều 5 mg/kg sau đó là 500-700 microgam/kg/giờ, điều chỉnh theo nồng độ trong huyết tương) có thể được thêm vào. Lưu ý, aminophylline có một phạm vi điều trị hẹp (tác dụng phụ bao gồm nhịp tim nhanh, kích động, loạn nhịp tim và co giật); chăm sóc và theo dõi chặt chẽ những người đang uống theophylline/aminophylline (tránh IV trừ khi được hướng dẫn bằng nồng độ huyết tương); các thuốc macrolides như clarithromycin/erythromycin làm tăng nồng độ trong huyết tương của theophylline, cũng như các thuốc chẹn kênh canxi; và có sự gia tăng nguy cơ co giật khi chỉ định cùng lúc với các thuốc kháng sinh quinolone. Thuốc ipratropium bromide (một chất chống muscarinic) thường được sử dụng thêm đến 4 lần mỗi ngày với liều 500mcg. Đặc biệt chú ý cần phải làm ẩm đầy đủ (xem bên dưới).
ARDS
Prostacyclin nebulised là chất giãn mạch phổi ở các bộ phận thông khí tốt nhất của phổi, do đó cải thiện sự phù hợp thông khí/tưới máu. Với chu kỳ bán hủy ngắn ngủi của nó, nó thường được cung cấp bởi máy phun khí dung liên tục với tốc độ 5-20 ng/kg/phút mà không có nguy cơ hạ huyết áp hệ thống. Mặc dù oxy hóa có thể cải thiện trong ngắn hạn, không có nghiên cứu cho đến nay đã cho thấy bằng chứng rằng nó cải thiện kết cục. Là một thuốc giãn mạch phổi chọn lọc, oxit nitric dạng hít (như một loại khí – không được khí dung. Có tác dụng tương tự, và cũng có thể cải thiện oxy hóa, nhưng một lần nữa không có bằng chứng cho thấy sự sống còn được cải thiện. Tác dụng phụ mạch máu toàn thân phần lớn bị loại bỏ bởi vì Hb liên kết với oxit nitric với ái lực cao. Thiết bị chuyên dụng là cần thiết cho việc cung cấp oxit nitric.
Các yếu tố hạn chế hiệu suất của máy phun khí dung
Chỉ có khoảng 10% lượng thuốc trong các máy phun khí dung lắng đọng ở đường hô hấp xa của bệnh nhân. Ở những bệnh nhân nặng, tỷ lệ này có thể thấp hơn:
- Kiểu thở và thể tích khí lưu thông sẽ ảnh hưởng đến phân bố khí dung đến vùng xa, cho dù có thở máy hay không. Do đó, nhịp thở nhanh và nông có thể ít hiệu quả hơn. Lưu lượng khí hít vào thấp (30-60 L/phút ở người lớn) có thể cải thiện việc cung cấp khí dung đến đường hô hấp dưới của bệnh nhân thở máy.
- Bệnh phổi có thể có một vấn đề: khoảng chết giải phẫu cao sẽ là một vấn đề, và các thùy phổi bị xẹp, hẹp đường thở và đường dẫn khí tắc nghẽn do nút nhày có thể ngăn chặn sự phân bố hạt đến vùng ngoại vi của phổi thông khí.
- Thông khí cơ học tự giới hạn hiệu quả lắng đọng, các nghiên cứu cho thấy chỉ khoảng 0-42% cho hiệu quả của cung cấp hạ khí dung cho đường hô hấp dưới.
- Kích thước hạt: (xem ở trên). Mức độ can thiệp sẽ phụ thuộc vào loại máy phun khí dung được sử dụng, thuốc và kích thước của ống nội khí quản.
- Bộ dây máy thở được làm nóng và làm ẩm: Chúng được ước tính là làm giảm tỷ lệ lắng đọng hạt trong phổi khoảng 40%. Điều này một phần là do sự gia tăng kích thước hạt.
- Vị trí bên trong bộ dây: Đặt một máy phun khí dung ở khoảng cách 30 cm so với NKQ thay vì giữa bệnh nhân và NKQ, cho phép ống của máy thở hoạt động như bình đệm để bình phun tích tụ giữa nhịp thở hô hấp.
- Thể tích chết đề cập đến lượng dung dịch bị kẹt bên trong máy phun khí dung và ống dẫn, do đó không thể tạo thành hạt khí dung để hít. Nó thường nằm trong khoảng từ 1 đến 3 ml.
Ghi chú: Máy hít định liều có thể được đưa vào bộ dây máy thở, và một số xem xét chúng có hiệu quả như máy phun khí dung.
Làm ẩm đường thở/thiết bị trao đổi nhiệt và độ ẩm (HME)
Ở bệnh nhân không có triệu chứng, O2 hít vào là ‘khô’ – và do đó có thể làm khô đường hô hấp trên (gây ra sự ngừng hoạt động của chức năng lông chuyển, và mất biểu mô đường thở lâu dài) và cũng làm tiết dịch đặc hơn. O2 thường được làm ẩm để ngăn chặn điều này – thông thường nhất bằng cách đưa nó qua nước trước khi hít vào. Máy làm ấm và ẩm là có hiệu quả, nhưng ít thường được sử dụng.
Ở bệnh nhân thở máy, khí được đi qua mở khí quản/NKQ giảm tác dụng làm ấm và làm ẩm của mũi và đường hô hấp trên. Thông thường, vấn đề này được khắc phục bằng cách sử dụng ‘bộ trao đổi nhiệt và độ ẩm’ (HME, heat and moisture exchangers) được đưa vào bộ dây máy thở. HME có kháng lực đường thở thấp, và giữ hơi ấm và độ ẩm thở ra của từng nhịp thở ra. Ở những bệnh nhân có chất tiết rất đặc, có thể sự cải thiện độ ẩm bằng cách cho khí hít vào đi qua một buồng chứa nước nung nóng (heated water bath) được đặt ở nhánh hít vào của bộ dây máy thở. Buồng nước được đun nóng đến 39°C và dây máy thở thông thường sẽ chứa các dây nung nhiệt (heating wires) để đảm bảo rằng các khí hít vào vẫn được làm nóng đến 37°C để ngăn sự ngưng tụ nước đáng kể trong bộ dây thở. Máy làm ấm và ẩm chủ động không được kết hợp với một HME, vì nếu như vậy, HME sẽ bị ngập nước và cuối cùng sẽ cản trở dòng khí.
Phun khí dung nước muối sinh lý cũng giúp giữ cho dịch tiết lỏng, sao cho chúng có thể bị hút ra bằng ống hút. Trong trường hợp không cải thiện, nước muối có thể được nhỏ giọt xuống ống ET và để ở đó trong nhiều phút: 5-10 ml/giờ hoặc thường được sử dụng cho đến khi các chất tiết lỏng – và phương pháp này thường rất hữu ích trong bệnh hen với đàm đặc.
XVII. Cai máy
Việc cai máy sớm giúp ngăn ngừa các đợt viêm phổi do máy thở kết hợp, mất trương lực cơ hô hấp, và các biến chứng của thông khí kéo dài và đặt nội khí quản. Nhiều phương pháp có thể được sử dụng, nhưng tất cả đều liên quan đến việc đánh giá đáp ứng với sự giảm hỗ trợ, và tăng công thông khí của bệnh nhân. Nói chung, sẽ chuyển dần bệnh nhân từ thông khí bắt buộc có kiểm soát sang hỗ trợ áp lực và có thể cho CPAP. Một số bệnh nhân sẽ cai máy nhanh chóng và sẽ qua một thử nghiệm thở tự nhiên (SBT, spontaneous breathing trial) ngay lập tức trong khi ở những người khác cần giảm dần sự hỗ trợ dần dần. Cai máy này có thể liên tục, hoặc có thể kéo dài thời gian hỗ trợ giảm trong các block, với sự hỗ trợ tăng lên giữa (chủ yếu vào ban đêm). Hầu hết các yêu cầu tham gia chủ động từ bệnh nhân, và kết quả làm cho nhu cầu chuyển hóa tăng lên.
Ví dụ về kế hoạch cai máy cho bệnh nhân mở khí quản
- NGÀY 1:
PS 8 cmH2O 08:00-22:00
3 x 30-60 phút thở oxy qua mask thời gian trong ngày
Xả bóng chèn với van nói (hình 27)
PS 14 cmH2O 23:00-08:00
2. NGÀY 2:
PS 8 cmH2O 08:00-24:00
4 x 2 giờ thở oxy qua mask thời gian trong ngày
Xả bóng chèn với van nói
PS 12 cmH2O 24:00-08:00
3. NGÀY 3:
Thở oxy qua mask thời gian trong ngày 08:00-20:00 với van xả và van nói
PS 8 cmH2O 20:00-08:00
4. NGÀY 4:
Thở oxy qua mask cho 24 giờ mỗi ngày với
Xả bóng chèn với van nói
5. NGÀY 5:
Đánh giá rút ống mở khí quản
Sự tiến triển hàng ngày sẽ thay đổi tùy từng bệnh nhân và khoảng thời gian ngưng thông khí cần được đánh giá trên cơ sở cá nhân.
Đánh giá sự sẵn sàng để cai máy
Một số thông số sinh lý chủ quan và khách quan có thể được sử dụng để đánh giá sự sẵn sàng cho cai máy. Bệnh nhân cần được đánh giá hàng ngày theo những điều sau đây:
1. Đánh giá lâm sàng
- Ho đầy đủ
- Không có các chất tiết đường hô hấp quá mức
- Hồi phục giai đoạn cấp của bệnh mà bệnh nhân đặt nội khí quản
2. Đo đạc khách quan
a. Ổn định lâm sàng
- Ổn định huyết động học (nghĩa là nhịp tim < 140, huyết áp tâm thu 90–160 mmHg, không có hoặc tối thiểu vasopressors)
- Trạng thái chuyển hóa ổn định
b. Oxy hóa đầy đủ
- SatO2 > 90% trên FiO2 ≤ 0.5 (hoặc PaO2/FiO2 ≥ 20 kPa)
- PEEP ≤ 8 cmH2O
c. Đầy đủ chức năng phổi
- RR ≤ 35 nhịp thở/phút
- Áp lực hít vào tối đa ≤ -20 – -25 cmH2O
- Thể tích khí lưu thông (TV) > 5 mL/kg
- Dung tích sống (VC) > 10 mL/kg
- RR/TV < 105 nhịp thở/phút/L
- Không có nhiễm toan đường hô hấp đáng kể
d. Tư vấn đầy đủ
e. Không có thuốc an thần hoặc tư vấn đầy đủ về an thần (hoặc thần kinh bệnh nhân ổn định)
Những yếu tố dự báo về thành công cai máy có thể không nhất thiết phải có mặt đồng thời; nó chỉ đơn thuần là một hướng dẫn mà các quyết định lâm sàng có thể được thực hiện, chứ không phải là các tiêu chuẩn nghiêm ngặt để cai máy. Nói chung một bệnh nhân không sốt, cảnh giác và huyết động ổn định, có mức oxy hóa chấp nhận trong khi thở 50% O2 với mức tối thiểu của PEEP áp dụng, là một ứng cử viên thích hợp cho một thử nghiệm thở tự nhiên.
Đánh giá tính sẳn sàng cho rút ống
Ngưng an thần sớm và đều đặn là bắt buộc để tránh tích lũy thuốc an thần, và để cho phép đánh giá sẳn sàng cai máy. Điều này có thể được kết hợp (nếu thích hợp) với ‘thử nghiệm thở tự nhiên’ (SBT) – một thử nghiệm khả năng thở của bệnh nhân mà không cần hỗ trợ thông khí đáng kể. Hỗ trợ hô hấp của bệnh nhân được giảm trong một thời gian ngắn và được theo dõi chặt chẽ trong thời gian dùng thử này. Việc rút ống thành công được dự đoán nếu bệnh nhân dung nạp thử nghiệm thở tự nhiên. Các nghiên cứu lớn đã chứng minh rằng chỉ có 13% bệnh nhân được rút ống sau các thử nghiệm thở tự nhiên thành công cần tái đặt lại nội khí quản. Ở những bệnh nhân được rút ống mà không có các thử nghiệm thở tự nhiên, tỷ lệ thất bại là khoảng 40%. Trong SBT, hỗ trợ áp lực thấp (≤7 cmH2O) hoặc áp lực dương liên tục (CPAP) hoặc thông khí tự nhiên không được hỗ trợ với một ống T có thể được sử dụng cho hiệu quả tương tự. Gần đây hơn, máy thở đã được sản xuất với các cài đặt bù ống tự động (ATC, Automatic Tube Compensation), cho phép biết áp lực chính xác được cung cấp để khắc phục sức cản nội sinh của ống nội khí quản. Điều này cũng đã được chứng minh là ít nhất cũng hiệu quả như PSV thấp trong các thử nghiệm thở tự nhiên. Bệnh nhân có thể được thử nghiệm từ 30 phút đến 120 phút mỗi lần. Các nghiên cứu về thời gian tối ưu của các thử nghiệm thở tự nhiên đã cho thấy các khoảng thời gian có thể tương tự nhau về kết cục.
Điều kiện để vượt qua hoặc thất bại SBT, bao gồm đầy đủ về trao đổi khí, ổn định huyết động học và bệnh nhân thoải mái. Nếu các dấu hiệu sau đây có mặt, bệnh nhân nên được coi là đã thất bại trong SBT:
1. Đánh giá lâm sàng và các chỉ số chủ quan
- Kích động và lo âu
- Trạng thái tinh thần lú lẫn
- Vã mồ hôi
- Tím tái
- Bằng chứng về tăng nỗ lực
- Tăng cường hoạt động cơ hô hấp phụ
- Dấu hiệu rối loạn hô hấp trên khuôn mặt
- Khó thở
2. Đo đạc khách quan
- PaO2 ≤ 6.67–8 kPa trên FiO2 ≥ 0.5 hoặc SaO2 <90%
- PaCO2 > 6,67 kPa hoặc tăng PaCO2 > 1,07 kPa
- pH < 7,32 hoặc giảm pH ≥ 0,07 d) RR/TV > 105 nhịp thở/phút/L
- RR > 35 nhịp/phút hoặc tăng ≥ 50%
- HR> 140 nhịp/phút hoặc tăng ≥ 20%
- HA tâm thu > 180 mmHg hoặc tăng ≥ 20%
- Huyết áp tâm thu < 90 mmHg
- Loạn nhịp tim
Sau đây là một giao thức được đề xuất để tiến hành thử nghiệm thở tự nhiên
- Giảm/ngừng thuốc an thần để bệnh nhân thở tự nhiên.
- Giảm hỗ trợ thông khí cho ATC (nếu có) trong 30 phút.
- Ngừng thử nghiệm ngay sau khi bất kỳ điều kiện nào trên đây xuất hiện.
- Nếu bệnh nhân dung nạp thành công 30 phút, hãy xem xét rút ống hoặc xem xét kéo dài thời gian dùng thử đến 120 phút.
- Nếu bệnh nhân không tiếp tục thử, tiếp tục các cài đặt thông khí cơ học trước đó và dần dần rút hỗ trợ thông khí (ví dụ: giảm nhẹ FiO2, PS hoặc PEEP).
- Lặp lại thử nghiệm vào ngày hôm sau.
Chỉ số thở nhanh nông
Thở nhanh và nông thường gặp ở những bệnh nhân không dung nạp nhịp thở tự nhiên. Chỉ số thở nhanh nông là tỷ số giữa tần số thở (mỗi phút) với thể tích khí lưu thông tính bằng lít (RR/Vt). Các giá trị bình thường là 20-40. Chỉ số trên 100 thường được tìm thấy ở những bệnh nhân không dung nạp nhịp thở tự nhiên. Nghiên cứu ban đầu về giá trị tiên đoán của tỷ lệ RR/Vt cho thấy 95% bệnh nhân có tỷ lệ RR/Vt trên 105 thất bại với cai thở máy và 80% bệnh nhân có tỷ lệ RR/Vt dưới 105 được cai máy thành công. Do đó, kết quả của nghiên cứu này cài đặt tỷ lệ RR/Vt ngưỡng xấp xỉ 100 để dự đoán thành công hoặc thất bại trong việc tiếp tục thở tự nhiên. Tuy nhiên, trong khi hữu ích, các giá trị tiên đoán dương và âm liên kết với các hình ảnh như vậy là thấp, và do đó đánh giá như vậy không nên được sử dụng như một yếu tố duy nhất tiên đoán khả năng thành công hay thất bại.
Khó khăn trong cai máy
Nếu bệnh nhân được thông khí trong một thời gian dài, thông thường sẽ giảm dần mức hỗ trợ thông khí (qua nhiều ngày hoặc thậm chí vài tuần) khi trao đổi khí cải thiện và để ‘đào tạo lại các cơ hô hấp’. Đi ra khỏi máy thở rất dễ dàng nếu bệnh nhân tỉnh táo, ý thức và có động lực, có khả năng hô hấp tốt, có thể bảo vệ đường hô hấp, có công thở chậm (độ giãn nở phổi tốt, không tắc nghẽn đường thở) dễ dàng khớp với cơ hô hấp (mạnh mẽ, có sức chịu đựng), và với dự trữ tim mạch tốt để đối phó với công thở bổ sung được áp đặt. Không có được ‘một người nào đó ra khỏi máy thở’ (hoặc tiến bộ theo hướng này) là ‘thất bại với cai máy’ – và – gợi ý một vấn đề với một hoặc nhiều thông số này.
Đau và não
- Giảm đau không đầy đủ sẽ cản trở cai máy, nếu nhịp thở tự gây đau.
- Quá an thần gây thiếu động lực và sự tham gia
- Phiền muộn
- Kiểm soát trung tâm hô hấp kém có thể phát sinh từ:
- Quá cao FiO2 ở những người thường phụ thuộc vào thông khí thiếu oxy
- Nhiễm kiềm (bạn có thông khí quá mức cho bệnh nhân không?)
- Quá nhiều thuốc an thần (đặc biệt là với opioid)
Hiếm khi, tổn thương não có thể làm giảm điều khiển trung khu hô hấp, hoặc co giật cận lâm sàng hoặc ngưng thuốc phiện nhanh chóng có thể cản trở cai máy. Tâm trạng kém và lo âu cũng có thể làm chậm sự cai máy.
Cơ hô hấp yếu
Điểm yếu cơ đặc biệt có thể là do tổn thương dây thần kinh (ví dụ như liệt dây thần kinh hoành ở những người mắc bệnh phổi hoặc trung thất/phẫu thuật ngực).
Mất thể tích cơ bắp tổng quát có thể phát sinh từ:
- Quyết định
- Dị hóa hoặc dinh dưỡng kém
- Bệnh lý thần kinh căn bệnh nghiêm trọng
Đánh giá thể tích cơ bắp trong tất cả các nhóm, cũng như trương lực, sức mạnh và phản xạ. EMG và các nghiên cứu dẫn truyền thần kinh có thể giúp chẩn đoán bệnh cơ do thần kinh, nhưng dữ liệu thu được là tốt nhất sau 3 tuần.
Suy nhược cơ bắp tổng quát cũng có thể là do:
- Thuốc như steroid
- Các bất thường về chuyển hóa (ví dụ: phosphate thấp hoặc kali thấp)
Tăng công thở
- Giảm độ giãn nở ngực từ các yếu tố ngoài phổi:
- Cổ trướng/béo phì. Xem xét chọc dò/dẫn lưu cổ trướng. Giữ cho bệnh nhân ‘ngồi dậy’
- Chấn thương cột sống, hoặc phẫu thuật ngực làm giảm chuyển động của xương sườn
- Bệnh màng phổi – Đây là kết quả phổ biến nhất của sự tích tụ dịch tràn dịch màng phổi. Chọc dò và dẫn lưu khi cần thiết, nhưng lưu ý rằng sự tích lũy lại sẽ xảy ra nếu bệnh nhân vẫn quá tải nước toàn cơ thể.
- Hẹp đường hô hấp lớn do tăng tiết đờm đặc, hẹp khí quản, nhuyễn hóa khí phế quản (đặt nội khí quản dài có thể gây ra đường hô hấp “mềm”), béo phì (cổ mỡ làm xẹp đường thở), mô hạt khí quản. Nội soi phế quản có thể giúp đỡ. Nếu nghi ngờ, hãy tìm kiếm lời khuyên của chuyên gia ‘tai mũi họng’.
- Đường hô hấp nhỏ hẹp do hen suyễn hoặc đờm
- Xẹp phổi hoặc xẹp phổi thùy có thể cản trở cai máy
- Nhiễm trùng ngực liên tục hoặc tái phát
- Bẫy khí
Bệnh tim
Suy tim có thể xảy ra khi nhu cầu về tim hoạt động vượt quá khả năng đáp ứng.
- Với tâm thất kém, sự kích động trong khi cai máy có thể làm tăng hậu tải. Huyết áp sau đó tăng lên, với sự gia tăng áp lực nhĩ trái và phù phổi sau đó.
- Điều tương tự cũng có thể áp dụng nếu có hở 2 lá: điều này có thể tồi tệ hơn đáng kể (hoặc thậm chí mới xuất hiện) nếu sau khi hậu tải tăng.
- Suy tim do thiếu máu cục bộ cũng có thể xảy ra trong khi cai máy.
Một mẹo hữu ích – Nhược giáp có thể tiết lộ chính nó trong bệnh nặng, và không chỉ làm giảm điều khiển trung tâm hô hấp, nhưng còn làm giảm hiệu suất cơ tim và cơ xương.
Bệnh cấp tính có thể làm cho việc giải thích các xét nghiệm chức năng tuyến giáp khó khăn (‘hội chứng tuyến giáp bình thường bệnh’ – sick euthyroid syndrome, hoặc sử dụng Amiodarone). Đôi khi, cần đo T3 tự do ngoài TSH và T4.
Mức độ hỗ trợ thông khí cần thiết trong quá trình cai máy có thể được đánh giá từ ABG (tăng CO2 gợi ý ‘mệt mỏi’) và từ các thông số lâm sàng (phập phồng cánh mũi và sử dụng các cơ phụ trợ gợi ý công thông khí cao). Trong một bệnh nhân mệt mỏi, chúng ta có thể quan sát thấy thở nhanh nông với tần số thở nhanh và thể tích khí lưu thông nhỏ hơn. Sức mạnh cơ bắp cũng phải được đánh giá: bệnh cơ bản quan trọng không chỉ ảnh hưởng đến các nhóm cơ ngoại vi mà còn ảnh hưởng đến các cơ hô hấp.
Như vậy, việc đánh giá sức mạnh cơ ngoại vi có thể cung cấp một cái nhìn sâu sắc về cách bệnh nhân có thể được cai máy nhanh. Tương tự như vậy, quá trình cai máy cần được cân bằng với nhu cầu chuyển hóa tăng lên gây ra bởi sự phục hồi và tăng cường. Nếu một bệnh nhân cai máy quá tích cực, họ có thể có ít năng lượng dự trữ để tham gia phục hồi chức năng và ngược lại.
Liên quan đến bệnh nhân và cung cấp phản hồi trực quan dưới dạng biểu đồ cai máy cũng có thể giúp thúc đẩy sự tham gia của bệnh nhân.
XVIII. Rút ống.
Điều này sẽ diễn ra sau một thử nghiệm thở tự nhiên thành công. Bệnh nhân nên tỉnh táo, có khả năng ho và bảo vệ đường hô hấp của mình. Bệnh nhân nên được ngồi thẳng đứng, và dụng cụ hút nên có sẵn. Bóng chèn của ống nội khí quản có thể được xả bớt để có thể rò rỉ khí. Không có âm thanh do rò rỉ cuff có thể gợi ý phù nề thanh quản nhưng không phải là một chống chỉ định để rút ống. Vùng hầu họng của bệnh nhân có thể được hút để loại bỏ các dịch tiết trước khi rút ống. Ống nội khí quản sau đó có thể được loại bỏ nhanh chóng với bệnh nhân ho mạnh.
Thở rít sau rút nội khí quản
Phù nề thanh quản/mô hạt có thể gây tắc nghẽn đường thở có ý nghĩa (thường được chứng minh bằng thở rít) sau khi rút ống. Việc sử dụng corticosteroids dự phòng (thường dexamethasone 2-4mg IV trước khi rút ống và sau đó 2 liều tiếp theo cách nhau 8 giờ) có thể được hưởng lợi trong việc ngăn ngừa thở rít sau khi rút ống. Tuy nhiên, việc sử dụng thường quy là gây tranh cãi – và hầu hết dự trữ thuốc này cho những người có bằng chứng không có ‘rò rỉ’ đối với xả bóng chèn.
Stridor sau khi rút ống không phải lúc nào cũng là dấu hiệu cho đặt lại nội khí quản. Nếu bệnh nhân không ở mức cực đoan, được phun khí dung Epinephrine (2,5ml 1% Epinephrine) có thể được sử dụng. Hiệu quả của nó đã được chứng minh ở trẻ em, nhưng vẫn còn có thể tranh cãi ở người lớn. Dexamethasone được cho như trên.
Hít phải hỗn hợp khí helium-O2 (heliox) có thể hữu ích, nhưng chưa được chứng minh.
Vai trò của mở khí quản trong cai máy
Mở khí quản mang lại sự thoải mái cho bệnh nhân, đồng thời duy trì sự bảo vệ đường thở và khả năng hít sặc, và khả năng ‘kết nối và ngắt kết nối’ bệnh nhân. Tất cả điều này hỗ trợ bệnh nhân cai máy. Đối với những bệnh nhân bị rối loạn chức năng hành tủy, suy giảm động tác nuốt hoặc suy yếu cử động cơ do thở máy kéo dài, phẫu thuật mở khí quản có cửa sổ và một chương trình kiểm soát bóng chèn có thể giúp đánh giá và huấn luyện lại kiểm soát cơ hầu họng thông thường. Xả bóng chèn cơ bản sẽ mở lại khí quản bình thường của bệnh nhân. Với sự trợ giúp của van nói hoặc van Passy Muir, bệnh nhân có thể hít vào qua miệng và chổ mở khí quản. Tuy nhiên, khi thở ra, van đóng lại, cho phép khí chuyển hướng qua các dây thanh âm (hình 27). Trong khi điều này có lợi cho giao tiếp, bệnh nhân có thể có nguy cơ hít nước bọt. Theo dõi chặt chẽ chất lượng âm thanh, cường độ ho, thể tích dịch tiết và thông số hô hấp là cần thiết khi thực hiện bù trừ. Trường hợp có vấn đề về bảo vệ đường hô hấp bị nghi ngờ, thời gian xả bóng chèn phải ngắn, và tăng dần theo thời gian.
Để đánh giá mức độ sẵn sàng đối với rút ống mở khí quản, việc mở ống được giới hạn và xả bóng chèn. Bệnh nhân phải thở được hoàn toàn qua miệng. Bất kỳ khó khăn thở trong tình huống này có thể nhi tắc nghẽn thanh quản hoặc dưới thanh môn.
Một ví dụ về chương trình cai máy cho bệnh nhân bị cắt bỏ khí quản được cung cấp trong trang 153.
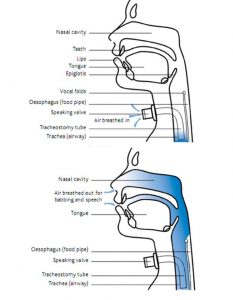
XIX Hỗ trợ thông khí trong trường hợp đặc biệt
Bệnh suyễn
Bệnh suyễn, đặc trưng bởi tắc nghẽn đường thở lan tỏa và đảo ngược được, là phổ biến: 21% trẻ em và 15% người lớn có thể bị bệnh.
Nhập khoa ICU thường được thực hiện khi các liệu pháp theo hướng dẫn của Hiệp hội Lồng ngực Anh (BTS) đáp ứng không đầy đủ, hoặc khi tình trạng đe dọa đến tính mạng khi nhập viện (Bảng 8).

Mức độ trầm trọng của cơn hen suyễn thay đổi (Bảng 9). Tất cả các đánh giá phải được đặt trong bối cảnh: tăng PaCO2 cho thấy mệt mỏi hô hấp, và có thể đang gần đến giai đoạn cuối nếu không được hỗ trợ.
Đáng chú ý là tình trạng thiếu oxy mô. Sự gia tăng sức đề kháng đường hô hấp đơn giản không gây ra tình trạng thiếu oxy, khi nó xảy ra vì một trong ba lý do sau:
1. Có đông đặc phổi cơ bản (ví dụ: từ viêm phổi, PE hoặc tràn khí màng phổi) gây ra shunt sinh lý.
2. Có đàm đặc, gây bất tương hợp V:Q
3. Mức CO2 đang gia tăng: với cùng một lượng không khí trong phế nang, số lượng “khoảng trống còn lại” cho O2 ít hơn (phương trình khí phế nang). Sự gia tăng trong PaCO2 cho thấy mệt mỏi cơ hô hấp (tức là suy giảm thông khí) – và điều này có thể gợi ý rằng bệnh nhân gần trạm cuối.
Thật khó để biết liệu có mặt cả 3 hay không, ngay cả khi nghi ngờ một yếu tố (1 hoặc 2). Đây là lý do tại sao thiếu oxy là một báo động màu đỏ trong bệnh hen suyễn!

Xử trí tại ICU
ICU có thể tiếp tục điều trị tiêu chuẩn, với lợi thế tỷ lệ điều dưỡng 1:1, và tiếp cận động mạch để theo dõi ABG thường xuyên. Tuy nhiên, nếu oxy hóa kém/xấu đi, hypercarbia là đáng kể/xấu đi, hoặc các biến chứng nội khoa khác đang xảy ra (ví dụ: loạn nhịp tim), đặt nội khí quản được chỉ định.
Cài đặt thông khí
1. Kiểm tra xem bạn không bắt đầu với tràn khí màng phổi hay không.
2. An thần bệnh nhân bằng một loại thuốc không gây giải phóng histamine (ví dụ: Propofol hoặc Fentanyl thay vì Morphine). Thuốc tác dụng ngắn là tốt nhất: bệnh nhân thường được rút ống trong vòng 2-24 giờ. Nếu điều trị thích hợp không hiệu quả, thì Ketamine có thể được sử dụng (với một benzodiazepine): thuốc gây mê này cũng là thuốc giãn phế quản.
3. Làm liệt cơ bệnh nhân.
4. Bắt đầu với một cao FiO2: 100% O2 ban đầu, điều chỉnh theo khí máu.
5. Bắt đầu với PEEP thấp hoặc không có (ZEEP).
6. Bắt đầu với tần số thở thấp và lượng khí lưu thông thấp (TV). Vấn đề chính với bệnh hen suyễn là thở ra, có nghĩa là một máy thở có thể đẩy không khí vào nhưng không thể đẩy khí ra ngoài hoàn toàn. Điều này gây ra căng chướng phổi (hyperinflation), và tăng áp lực trong lồng ngực. Điều này có thể ngăn chặn sự thông khí (áp lực đường thở tăng lên, giảm TV), gây ra tràn khí màng phổi hoặc làm giảm trở lại tĩnh mạch và gây hạ huyết áp – vì vậy KHÔNG NÊN ĐỂ XẢY RA BẪY KHÍ. Đặt TV thấp và cho phép nhiều thời gian để thở ra (tần số thở thấp) là một khởi đầu tốt – có lẽ 6 ml/kg TV với tần số không quá 8-10 lần/phút. Sau đó kiểm tra thở ra trước khi hít vào bắt đầu: nghe phổi, nhìn thấy thành ngựcxẹp xuống dừng lại trước khi hít vào, nhìn vào biểu đồ sóng máy thở và đảm bảo rằng dừng thở ra trước khi hít vào bắt đầu. Nếu không chắc chắn, hãy ngắt kết nối định kỳ máy thở và lắng nghe/cảm nhận tại NKQ: khí có thể tiếp tục từ từ đi ra nếu bẫy khí đã xảy ra. Thao tác ngắt kết nối này có thể cần được lặp lại – nhưng chỉ khi bạn đặt máy thở đúng cách để ngăn sự cố lặp lại. Thời hạn thở ra (E) có thể được kéo dài so với thời gian hít vào, tức là tỷ lệ I:E bị thay đổi, có lẽ là 1:5 hoặc 1:6.
7. Chấp nhận PaCO2 và toan máu cao, pH 7.1 và PaCO2 11 kPa có thể chấp nhận được.
8. Giữ cho phổi ẩm. Đàm đặc là đặc trưng của bệnh hen suyễn, và trụ phế quản làm tắc nghẽn phế quản nhỏ hơn. Vì vậy, luôn luôn sử dụng HME, và cung cấp khí dung nước muối sinh lý thường xuyên giữa các thuốc giãn phế quản. Trong một số trường hợp, 10 ml nước muối nên được nhỏ xuống NKQ mỗi giờ và không hút ngay lập tức trở lại. Điều này là để cố gắng làm lỏng các tiết. Cũng cần có bù đủ nước qua đường tĩnh mạch.
9. Theo dõi kali, chất này có tác dụng với liệu pháp beta-agonist. Một catheter trung tâm có thể là cần thiết để bù kali.
10. Nếu vấn đề trở nên tồi tệ hơn, hãy cân nhắc sử dụng thuốc gây mê dễ bay hơi như Isofluorane. Tuy nhiên, bạn sẽ cần sự trợ giúp của chuyên gia, vì đây không chỉ là vấn đề cắm khí gây mê vào máy thở.
11. Giữ cho người chăm sóc tâm lý ổn định. Họ sẽ lo lắng bởi độ pH thấp và sẽ cố gắng tăng tần số thông khí. Họ thậm chí có thể muốn cho bicarbonate (tạo ra nhiều CO2 hơn – và điều này sẽ không giúp gì cho pH!).
12. Với liệu pháp thích hợp, tất cả sẽ tốt hơn.
Trước khi xuất viện, điều quan trọng là bệnh nhân được bác sĩ hô hấp thăm khám. Điều này sẽ tạo điều kiện tiếp tục nghiên cứu sâu hơn, và tích hợp bệnh nhân vào theo dõi thích hợp.
Bệnh phổi tắc nghẽn mãn tính (COPD)
COPD được đặc trưng bởi tắc nghẽn đường thở, mà chỉ có thể đảo ngược một phần (‘thành phần hen’). Các đợt cấp trầm trọng (thường là nguồn gốc nhiễm trùng) được quản lý theo Hướng dẫn NICE năm 2010, nhưng đáp ứng điều trị kém có thể buộc nhập ICU vì mục đích giám sát chuyên sâu hơn (ví dụ, với catheter động mạch), khi cần hỗ trợ thông khí hoặc khi tình trạng lâm sàng khác (hạ huyết áp, thiểu niệu) cùng tồn tại. Việc sử dụng thông khí không xâm lấn (NIV) được thảo luận trong chương 8.
Các chất kích thích (các chất kích thích hô hấp như Doxapram) không còn được coi là liệu pháp điều trị phác đồ và chỉ được khuyến cáo nếu NIV không có hoặc cảm thấy không phù hợp.
Xử trí trong ICU
ICU có thể tiếp tục điều trị tiêu chuẩn, với lợi thế tỷ lệ điều dưỡng 1:1, và tiếp cận động mạch để theo dõi ABG thường xuyên. Tuy nhiên, nếu oxy hóa kém/xấu đi, tăng CO2 là đáng kể/xấu đi, hoặc các biến chứng nội khác đang xảy ra (ví dụ như rối loạn nhịp tim), đặt nội khí quản có thể được chỉ định. Mục tiêu thông khí cho những bệnh nhân này là cho phép thời gian cho các liệu pháp về thuốc làm việc và các cơ hô hấp kiệt sức được nghỉ ngơi, trong khi cải thiện việc trao đổi khí. Hãy nhớ rằng, không có biện pháp duy nhất nào có giá trị tiên đoán tích cực tốt để xác định thành công hay thất bại của điều trị chuyên sâu, và kết quả có thể tốt hơn chúng ta nghĩ: một nghiên cứu của Mỹ về bệnh nhân được nhận vào ICU với đợt cấp COPD cho thấy tỷ lệ tử vong 2, 6, 12 và 24 tháng lần lượt là 20%, 33%, 43% và 49%, trong đó độ tuổi trung bình là 70 và trung bình FEV1 0.8. Hơn nữa, chất lượng cuộc sống (được chúng tôi coi là nghèo) có thể thực sự rất phù hợp với bệnh nhân. Nói chung, sau đó, người ta nên sai về phía cho, thay vì giữ, hỗ trợ thông khí cơ học. Nếu có thể, một bệnh nhân có quyền được lựa chọn.
Cài đặt thông khí
1. Kiểm tra xem bạn không bắt đầu với tràn khí màng phổi hay không.
2. An thần bệnh nhân bằng một loại thuốc không gây giải phóng histamine (ví dụ: Propofol, hoặc Fentanyl thay vì Morphine) nếu được cho là thành phần ‘hen suyễn’ đáng chú ý. Tác nhân tác dụng ngắn là tốt nhất: bệnh nhân thường được rút ống trong vòng 2-24 giờ. Nếu điều trị thích hợp không hiệu quả, thì Ketamine có thể được sử dụng (với một benzodiazepine): Ketamine có đặc tính giãn phế quản.
3. Làm liệt cơ bệnh nhân để bắt đầu, nói chung.
4. Chọn FiO2 phù hợp với bệnh nhân. Nếu nghi ngờ bị thiếu oxy thông khí (lưu giữ CO2 được biết, được chứng minh bằng đa hồng cầu, hoặc bù chuyển hóa cho nhiễm toan hô hấp), sau đó nhắm đến SaO2 88-92%.
5. Bắt đầu với thể tích khí lưu thông thấp và tần số thở thấp, vì những lý do được giải thích theo ‘hen suyễn’.
6. Tránh thông khí quá mức. Bệnh nhân COPD thường có nồng độ CO2 và bicarbonate cao khi đang ‘khỏe mạnh’. “Sửa chữa” CO2 ban đầu sẽ gây ra một chứng nhiễm kiềm (và các giai đoạn ngưng thở sau này), trước khi pH bình thường … và sau đó có thể là một nhiễm toan hô hấp khi bạn cai máy. Hơn nữa, nếu bệnh nhân COPD được thông khí với thể tích phút ‘bình thường’ để giảm CO2, điều này có thể dẫn đến tình trạng bẫy khí bổ sung do giảm thời gian thở ra.
7. Cẩn thận bẫy khí và điều chỉnh PEEP. Đánh giá lưu lượng khí thở ra giống như hen suyễn, và điều chỉnh tỷ lệ I:E/tần số thở/TV một cách thích hợp. Ban đầu, chấp nhận độ pH/CO2 ở mức tồi tệ. Nhưng việc điều chỉnh PEEP rất phức tạp và có thể phản trực giác. Hãy tưởng tượng rằng bạn có tần số thở chậm và thời gian thở ra kéo dài, nhưng bạn phải tìm bằng chứng về bẫy khí và tăng ‘PEEP’ tự động. Sự hiện diện của PEEP tự động sẽ làm cho hít vào khó khăn hơn vì lưu lượng khí sẽ không đi vào trong phổi cho đến khi mức PEEP tự động được bù đắp. Trong thông khí cơ học kiểm soát, lưu lượng hít vào sẽ không bắt đầu cho đến khi áp lực đường thở tăng lên trên mức PEEP tự động. Trong khi thở tự nhiên áp lực màng phổi cần giảm tương đương với mức PEEP tự động, thể hiện tải hít vào tương ứng. Áp dụng PEEP bên ngoài thường không phụ thuộc vào mức PEEP tự động và do đó sẽ giảm gradient áp lực giữa máy thở và phổi, điều này sẽ chống lại tác động của PEEP tự động đối với thì hít vào.
8. So sánh mức PEEP bên ngoài với mức tự động PEEP, do đó có thể giảm đáng kể công thở của bệnh nhân trong các nỗ lực thở tự nhiên (ví dụ: kích hoạt, hỗ trợ áp lực). PEEP bên ngoài cũng có thể được sử dụng để giảm khí bẫy bằng cách nong đường hô hấp mở và ngăn chặn sự sụp đổ đường thở trong thời gian thở ra. Điều này gây tranh cãi nhưng rất có thể có hiệu quả ở bệnh nhân bị khí thũng khi đóng đường thở động xảy ra, và tương tự như thở ra qua môi mím chặt. Nếu cố gắng, PEEP phải được áp dụng dần dần trong khi giám sát mức PEEP tổng. Nếu hiệu quả trong việc giảm bẫy khí, PEEP tổng, áp lực đường thở đỉnh và thể tích khí bị bẫy tất cả sẽ giảm như một hệ quả.
Hội chứng suy hô hấp cấp tính (ARDS)
ARDS được kích hoạt bởi chấn thương phổi (phổ biến nhất là viêm phổi, nhưng cũng do hít sặc, dập phổi, hít khói, viêm phổi, hoặc thậm chí thuyên tắc mỡ/nước ối) hoặc bệnh lý ngoài phổi (nhiễm trùng huyết phổ biến nhất, nhưng cũng do truyền máu số lượng lớn, chấn thương hoặc bỏng nặng). Dịch giàu protein rò rỉ từ các mao mạch phổi, gây ra ‘phù phổi áp lực nhĩ trái thấp’. Các điểm nổi bật là sự thâm nhiễm phổi hai bên trên chụp X quang ngực và tỷ lệ PaO2/FiO2 < 300mmHg hoặc 40 kPa, trong trường hợp không có nghi ngờ phù phổi do tim gây ra. Tình trạng này là các phản ứng viêm – bạch cầu đa nhân trung tính được tuyển chọn và kích hoạt – và được theo sau đó (ở 10-14 ngày) bởi giai đoạn tăng sinh xơ hóa (sẹo) với mức độ nghiêm trọng thay đổi. Kết quả là tình trạng thiếu oxy (do bất tương xứng V:Q). Giảm độ giãn nở phổi (ban đầu do mất chất hoạt động bề mặt và sự sụp đổ phế nang, nhưng sau đó do sự tăng sinh mô sợi hoặc ‘sẹo phổi’) gây ra một công thở cao và thể tích khí lưu thông thấp. Thông khí không hiệu quả do đó có thể khiến PaCO2 tăng lên. Áp lực động mạch phổi có thể tăng lên (do co mạch phổi do thiếu oxy).
Xử trí tại ICU
Nhập khoa ICU là bắt buộc. Một đường động mạch phải được đặt, và tiếp cận tĩnh mạch trung tâm được bảo đảm. Trong khi NIV có thể được cố gắng trong giai đoạn đầu, đặt nội khí quản và thông khí cơ học là cần thiết. Suy đa cơ quan thường theo sau. Lên đến 1/3 số bệnh nhân từ vong.
Có 5 chìa khóa trong xử trí:
- Nguyên nhân cơ bản của ARDS phải được tìm kiếm và điều trị. Nếu nhiễm trùng không có, thì nguyên nhân là gì?
- Giảm thiểu áp lực đường thở. Áp lực đường thở cao và thể tích khí lưu thông cao có thể làm hư hỏng phổi, làm trầm trọng thêm ARDS và kết quả tồi tệ hơn.
- Tránh ‘cú đấm lần thứ hai’. Việc hít sặc/phát triển viêm phổi do thở máy (VAP) trong quá trình phục hồi từ ARDS có thể kích hoạt ARDS toàn bộ một lần nữa nhưng kết cục thường tồi tệ hơn nhiều ở ‘cú đấm thứ hai’.
- Trong giai đoạn sớm của nhiễm trùng huyết, hồi sức thể tích lớn là cần thiết. Sau khi đã vượt qua ‘cú đấm cấp tính’, ARDS sẽ hoạt động tốt hơn với bệnh nhân “khô” (chứ không phải là bệnh nhân “ướt” hơn).
- Thời gian chữa lành mọi bệnh tật. Họ đang cải thiện, đừng hỗ trợ quá nhanh.
Cài đặt thông khí
1. Ban đầu, an thần và làm liệt cơ bệnh nhân của bạn để có được sự kiểm soát.
2. Bắt đầu với thông khí kiểm soát áp lực, và nhằm mục đích cho thể tích khí lưu thông 6ml/kg trọng lượng cơ thể lý tưởng, được tính như sau:
- Dành cho nam giới: 50 + 0,91 (chiều cao cm – 152,4)
- Đối với nữ: 45,5 + 0,91 (chiều cao cm – 152,4)
3. Huy động phế nang. Huy động phế nang là một phương pháp cố gắng cải thiện oxy hóa ở bệnh nhân mất độ bão hòa cấp tính mặc dù được thông khí. Có rất nhiều cách, nhưng một là áp dụng PEEP 40 cm H2O trong 40 giây thông qua máy thở. Hãy chuẩn bị tinh thần rằng thời gian huy động càng ngắn thì thời gian tăng PaO2 càng ngắn, đặc biệt nếu PEEP không được điều chỉnh.
4. Điều chỉnh PEEP. Nói chung, PEEP cao hơn là cần thiết, chỉ để giữ cho phế nang mất chất hoạt động bề mặt được mở. Nói chung, quy mô PEEP/FiO2 sau có thể được sử dụng:
| FiO2 | 1.0 | 0.9 | 0.8 | 0.7 | 0.6 | 0.5 | 0.4 | 0.3 |
| PEEP | 20-24 | 14-18 | 14 | 10-14 | 10 | 8-10 | 5-8 | 5 |
5. Khi phế nang mở ra, hãy giữ chúng mở. Việc mở và đóng chu kỳ của phế nang cũng đã được đổ lỗi cho việc ly giải cytokine và chấn thương phổi trong quá trình thông khí do lực xé. Trong khi đó, khi PEEP bị mất, sẽ gây xẹp phế nang và khó có thể huy động được. Tránh ngắt kết nối từ máy thở lặp đi lặp lại.
6. Mục tiêu cho giới hạn trên của áp lực cao nguyên là 28-30 cmH2O.
7. Cân nhắc điều chỉnh tỷ lệ I:E.
8. Chấp nhận mức O2 thấp, cho phép các mục tiêu giảm thấp trong nhiều ngày. Bản thân O2 ở nồng độ cao có thể gây ra tổn thương phổi, và cũng gây sụp đổ phế nang. Cơ thể thích nghi với thời gian O2 thấp hơn: với một tuần lên núi, SaO2 < 80% là hoàn toàn có thể sống sót. Theo nguyên tắc, SaO2 > 90% và PaO2 > 8 kPa là mục tiêu tốt trong vòng một hoặc hai ngày.
9. Chấp nhận PaCO2 cao. Đây là điều không thể tránh khỏi nếu áp lực khí lưu thông và áp lực cao nguyên thấp. Với thời gian, bù thận sẽ bình thường hóa độ pH.
10. Nếu oxy hóa không cải thiện, hãy xem xét tư thế nằm sấp sớm. Nếu bạn đã làm tất cả mọi thứ, và bệnh nhân của bạn vẫn O2 hít vào còn trên 95% mà PaO2 chỉ là 6 kPa, bạn có thể muốn làm một cái gì đó để giảm FiO2. Lực hấp dẫn có thể làm cho dịch và đàm nhớt ứ đọng ở vùng phổi ‘phụ thuộc’ phía sau lưng trong tư thế nằm ngửa, nơi mà lực hấp dẫn cũng làm chuyển hướng phần lớn lưu lượng máu. Do đó, vùng phổi thông khí tồi tệ nhất được tưới máu tốt nhất. Xoay bệnh nhân nằm sấp lại trên mặt trước của họ do đó làm giảm áp lực màng phổi của các vùng lưng dẫn đến mở phế nang và ngược lại làm tăng áp lực màng phổi của các vùng ngực trước do đó làm giảm sự căng phế nang quá mức. Sự chênh lệch về tỉ lệ thông khí/tưới máu ít hơn là giai đoạn ban đầu. Tuy nhiên, lưu ý rằng bản thân thủ thuật này cần rất nhiều nhân viên (nói chung là 8 người) và các rủi ro của chính nó (ví dụ như tụt NKQ ngẫu nhiên, mất các đường truy cập mạch máu hoặc bất ổn huyết động học). Đây là một quyết định tư vấn, và cần đội ngũ nhân viên điều dưỡng được đào tạo và có kinh nghiệm. Gần đây, cải thiện tỷ lệ tử vong lớn đã được chứng minh ở nhóm bệnh nhân ARDS nặng hơn.
11. Cân nhắc các liệu pháp bổ trợ khác. Nitric oxide dạng hít, hoặc prostacyclin khí dung tất cả có thể cải thiện sự tương xứng V:Q và do đó cải thiện oxy hóa máu (trang 16), nhưng bằng chứng về lợi ích kết cục là còn thiếu. Lưu ý: mặc dù ARDS là một tình trạng viêm, nhưng không nên dùng corticosteroids như là một phần của điều trị. Một nghiên cứu trong năm 2006 liên quan đến 180 bệnh nhân ARDS cho thấy mặc dù methylprednisolone có thể cải thiện sinh lý tim phổi, nhưng không có cải thiện về tỷ lệ tử vong sau 60 ngày. Trên thực tế, đã có một số bằng chứng cho thấy rằng nếu chúng được bắt đầu sau 14 ngày, thì thực tế có nguy cơ tử vong cao hơn.
12. Xem xét giới thiệu đến một Trung tâm lớn hơn để hỗ trợ oxy hóa qua màng ngoài cơ thể (ECMO) nếu thất bại các biện pháp trên.
Sốc tim
Sốc tim là một tình trạng nghiêm trọng được đặc trưng bởi sự giảm tưới máu toàn thể gây ra bởi chức năng tâm thất không đầy đủ. Bệnh nhân nên được nhập viện vào ICU, vì ngay cả với sốc tim được xử trí chuyên sâu nhất cũng có tỷ lệ tử vong khoảng 90%. Định nghĩa bao gồm HA tâm thu < 90 mmHg trong > 30 phút và chỉ số tim < 2,2L/phút/m2 . Nó thường xảy ra nhất là trực tiếp kết quả của nhồi máu cơ tim: thử nghiệm SHOCK “Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock?”) phát hiện 75% trường hợp sốc tim gây ra do nhồi máu cơ tim xảy ra trong vòng 24 giờ sau sự kiện.
Xử trí tại ICU
Một đường động mạch phải được đặt, và bệnh nhân sẽ cần truy cập tĩnh mạch trung tâm để theo dõi CVP và sự oxy hóa tĩnh mạch trung tâm (SvO2), và cho phép truyền các thuốc tăng co bóp. Việc xử trí tình trạng này nằm ngoài phạm vi của văn bản này, nhưng các chiến lược nhằm cải thiện việc cung cấp O2 (đảm bảo đổ đầy tim, cải thiện khả năng co bóp bằng cách sử dụng inotropes, điều chỉnh hậu tải để duy trì tưới máu và huyết áp, đảm bảo Hb > 10g/dl). Nguyên nhân nên được điều trị (ví dụ như nhịp tim nhanh kéo dài) và chèn ép màng ngoài tim. Trong bối cảnh thiếu máu cục bộ cấp tính, giới thiệu ngay lập tức cho can thiệp mạch vành là bắt buộc.
Nghiên cứu ‘SHOCK’ đã được tiến hành hơn 5 năm ở Mỹ, với hơn 300 bệnh nhân tham gia, những người đã được xử trí nội khoa chuyên sâu, bao gồm bơm bóng trong động nạch chủ (IABPs, Intra-Aortic Balloon Pumps) hoặc can thiệp qua da hoặc ghép động mạch vành (CABG). Kết quả cho thấy giảm tử vong tuyệt đối đáng kể là 12,8% trong nhóm tái tưới máu mạch vành (revascularisation) sau 6 tháng – một lợi ích kể từ khi được duy trì ở 6 năm. Các lợi ích bắt nguồn từ việc bảo toàn càng nhiều chức năng càng tốt trong tâm thất trái. Ngoài ra, suy tim do các nguyên nhân có thể đảo ngược như viêm cơ tim có thể có lợi ích từ các thiết bị hỗ trợ cơ học.
Thông khí
Trong phù phổi cấp tính, việc sử dụng NIV thường thành công trong việc tránh đặt nội khí quản và thông khí. Tuy nhiên, an thần và liệt cơ sẽ loại bỏ nhu cầu O2 đáng kể, và loại bỏ hoàn toàn công thở. Vì vậy, cần đặt nội khí quản và thông khí cơ học. FiO2 nên được nâng lên để điều chỉnh hoàn toàn bất kỳ tình trạng thiếu oxy máu nào.
Trong suy thất phải, có thể cần phải thận trọng, để đảm bảo tiền tải đầy đủ, và PEEP thấp (3-5cm H2O) nên được sử dụng (vì PEEP cao hơn có thể ảnh hưởng đến đổ đầy RV).
Trong suy thất trái, PEEP cao hơn có thể cần thiết để giải quyết phù phổi, nhưng mức tối thiểu có lợi ích phải được sử dụng khi oxy hóa đã được bình thường hóa.
Viêm phổi mắc phải trong cộng đồng (CAP, Community acquired pneumonia)
CAP thường là do vi khuẩn, với một tác nhân duy nhất được nhận diện trong 85% các trường hợp.
• Viêm phổi do Streptococcus/phế cầu khuẩn
Phổ biến nhất và chủ yếu là vào mùa đông. Nó có thể liên quan đến tiêu chảy và/hoặc nhiễm toan chuyển hóa có thể là dấu chứng sớm.
• Legionella
52% trường hợp ở Anh liên quan đến du lịch (đặc biệt là từ Địa Trung Hải. Chủ yếu là tháng Chín/tháng Mười).
• Staphylococcus aureus (tụ cầu)
50% những người được nhận vào ICU có nhiễm trùng đồng thời với vi-rút cúm (do đó tăng vào mùa đông). Ghi chú: bệnh cảnh của nhiễm khuẩn huyết tụ cầu khuẩn toàn thân (bao gồm cả viêm nội tâm mạc).
• Mycoplasma pneumoniae
dịch bệnh mỗi 4 – 5 năm
• Bệnh cúm
Vi-rút. Chủ yếu là mùa đông. 3% phát triển viêm phổi. Thường đồng nhiễm với S. aureus.
• Chlamydia (không phổ biến)
- Psittaci: 20% lịch sử tiếp xúc với chim
- BurnNKQi: phơi nhiễm nghề nghiệp (cừu) ở 8%
CAP dẫn đến nhập viện trong 22-42% trường hợp, trong đó tỷ lệ tử vong là 5- 14%, và lên đến 50% cho những người nhập ICU. (Xem bên dưới để biết các yếu tố tiên lượng kém).
Các yếu tố tiên lượng kém bao gồm:
- PaO2 < 8 kPa
- Số lượng bạch cầu < 4 hoặc > 20 x109
- X quang: thâm nhiễm phổi 2 bên hoặc nhiều thùy và những thay đổi tiến triển ở bệnh nhân thở máy
- Bệnh cùng mắc (bệnh tim/tiểu đường/COPD)
- Lú lẫn: trạng thái tinh thần < 8 điểm (thang điểm Mini Mental state exam)
- Ure > 7 mmol/l
- RR > 30/phút (dự đoán rất đáng tin cậy về mức độ nghiêm trọng nhưng thường cao ở giai đoạn ban đầu trong COPD nặng)
- Cấy máu dương tính o Huyết áp thấp (tâm thu < 90 mmHg, tâm trương < 60 mmHg)
- Tuổi > 65
- Những chữ in nghiêng (‘CURB 65’) đã được đưa vào điểm số tiên lượng 6 điểm:
| Score | 30-day Mortality (%) |
| 0 | 0.7 |
| 1 | 3.2 |
| 2 | 13 |
| 3 | 17 |
| 4 | 41.5 |
| 5 | 57 |
XX. Hỗ trợ oxy hóa qua màng cơ thể (ECMO)
ECMO sử dụng công nghệ nối tắt tim phổi (CPB, cardiopulmonary bypass) đơn giản để cung cấp hỗ trợ hô hấp (ECMO tĩnh mạch – tĩnh mạch) hoặc hỗ trợ tim mạch – hô hấp (ECMO tĩnh mạch – động mạch). Chỉ định chính cho VV-ECMO là ở những bệnh nhân suy hô hấp nặng không đáp ứng với điều trị thông thường, nguyên nhân bệnh gây suy hô hấp có thể đảo ngược và không chống chỉ định chống đông máu hệ thống, điều cần thiết để tránh đông máu của mạch ngoài cơ thể. ECMO là một kỹ thuật chuyên môn sâu chỉ nên được cung cấp ở các trung tâm ECMO có thể được tìm thấy trên trang web của Tổ chức Hỗ trợ Đời sống ngoài cơ thể (ELSO, Extracorporeal Life Support Organisation). Trong VV-ECMO, máu được lấy ra từ một hoặc cả hai tĩnh mạch chủ qua tĩnh mạch cảnh hoặc tĩnh mạch đùi, được bơm qua một bộ oxygenator và quay trở lại trực tiếp vào tâm nhĩ phải, qua đó bảo tồn được lưu lượng máu phổi, mạch đập máu hệ thống và oxy hóa máu ở tâm thất bên trái và gốc động mạch chủ.
Mạch ECMO có hai thành phần chính: bộ trao đổi oxy và máy bơm. Các thành phần mạch bổ sung bao gồm cannulas, ống và bộ trao đổi nhiệt.
Bơm
Máy bơm là trung tâm của mạch ECMO. Có hai loại máy bơm hiện có sẵn. Đây là những máy bơm ly tâm và máy bơm con lăn:
Các máy bơm ly tâm sử dụng động tác quay của cone để tạo ra lực hút máu vào đầu bơm và đẩy nó ra phía bộ trao đổi oxy. Máy bơm ly tâm phải được sử dụng với sự theo dõi áp lực đường tĩnh mạch để ngăn chặn áp lực âm và tan huyết.
Bộ trao đổi oxy (Oxygenator)
Chúng được gọi chính xác hơn là ‘phổi màng’ vì chức năng của chúng là trao đổi khí. Bộ trao đổi oxy cấu tạo dạng sợi rỗng bằng Polymethylpentene (PMP) có sức cản thấp hơn, thể tích mồi thấp hơn và tương thích sinh học hơn. Bộ trao đổi oxy PMP không phát triển rò rỉ plasma như các thiết bị polypropylene. Một luồng khí quét (sweep) thông qua bộ trao đổi oxy theo hướng ngược dòng với chiều của máu và kiểm soát việc loại bỏ CO2. Ôxy được kiểm soát bằng cách tăng tốc độ lưu lượng máu (4-5 L/phút) và CO2 bằng cách tăng tỷ lệ khí quét. Khí quét thường được bắt đầu ở 4-5 L/phút và sau đó được chuẩn độ để giữ PaCO2 trong phạm vi bình thường. Heparin thường có thể được chuẩn độ để duy trì thời gian thromboplastin được kích hoạt một phần (APTT) ở mức 1,2-1,8 lần bình thường (được đo hàng ngày). Ngoài ra, thời gian đông máu được kích hoạt (ACT) 1,5 lần bình thường (được đo theo giờ) có thể được nhắm mục tiêu.
Khi bệnh nhân đang sử dụng ECMO, thông khí “phổi nghỉ” được áp dụng để giảm thiểu tổn thương phổi do máy thở gây ra khi sử dụng áp lực đỉnh 20-25 cmH2O, PEEP 10 cmH2O, RR 10/phút và FiO2 = 0.3.
Loại bỏ CO2 qua màng ngoài cơ thể (ECCO2R)
Loại bỏ CO2 động mạch – tĩnh mạch (hoặc gần đây hơn tĩnh mạch – tĩnh mạch) là đơn giản hơn nhiều so với ECMO. Lưu lượng máu máu thấp hơn nhiều so với ECMO (khoảng 1L/phút). Đối với hệ thống động mạch, lưu lượng được ‘đẩy’ bằng huyết áp động mạch thông qua một ống thông 13F trong động mạch đùi, thông qua màng PMP sức cản thấp và sau đó quay trở lại bệnh nhân qua ống thông nằm ở tĩnh mạch đùi đối diện. Hệ thống này rất hiệu quả trong việc kiểm soát CO2 thông qua lưu lượng khí quét, nhưng không cung cấp sự gia tăng đáng kể oxy hóa.
Thanh thải CO2 hiệu quả có thể đạt được chỉ với 10-15 ml/kg/phút máu, trong khi oxy hóa hiệu quả thường đòi hỏi ít nhất 50-60 ml/kg/phút, mặc dù giá trị này có thể cao tới 80-100 ml/kg/phút và thay đổi theo cả lượng tái tuần hoàn và tổng lượng CO2. Tương tự như ECMO, ECCO2R yêu cầu chống đông máu để ngăn ngừa sự đông máu của mạch máu/màng.





