Bài viết Mất đồng bộ bệnh nhân – Máy thở được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Patient-Ventilator Dyssynchrony
Tóm tắt
Ở những bệnh nhân thở máy (MV), MV hỗ trợ được sử dụng sớm, sau giai đoạn cấp tính của bệnh hiểm nghèo, để loại bỏ các tác động bất lợi của MV kiểm soát, đáng chú ý nhất là sự phát triển của rối loạn chức năng cơ hoành do máy thở. Tuy nhiên, lợi ích của MV hỗ trợ thường bị phản tác dụng bởi sự phát triển của mất đồng bộ bệnh nhân – máy thở. Mất đồng bộ bệnh nhân – máy thở xảy ra khi bắt đầu và/hoặc chấm dứt hơi thở cơ học không phù hợp với việc bắt đầu và chấm dứt thì hít vào thần kinh, hoặc nếu cường độ của hỗ trợ cơ học không đáp ứng với nhu cầu hô hấp của bệnh nhân. Vì mất đồng bộ bệnh nhân – máy thở có liên quan đến một số tác dụng phụ và có thể ảnh hưởng xấu đến kết quả của bệnh nhân, mọi nỗ lực nên được thực hiện để nhận ra và khắc phục sự cố này xảy ra ở đầu giường. Để phát hiện các mất đồng bộ bệnh nhân – máy thở, bác sĩ nên đánh giá sự thoải mái của bệnh nhân và kiểm tra cẩn thận các dạng sóng áp lực và lưu lượng, có sẵn trên màn hình máy thở của tất cả các máy thở hiện đại. Máy thở hiện đại cung cấp một số cài đặt có thể sửa đổi để cải thiện tương tác bệnh nhân – máy thở. Các chế độ thông khí tỷ lệ mới cũng rất hữu ích trong việc cải thiện tương tác bệnh nhân – máy thở.
Giới thiệu
Thông khí cơ học (MV, mechanical ventilation) có thể được phân biệt thành hai loại chính: MV kiểm soát, trong đó hơi thở hoàn toàn được kiểm soát bởi máy thở và MV hỗ trợ, trong đó hệ thống hô hấp của bệnh nhân và máy thở làm việc cùng nhau. Thông khí có kiểm soát chủ yếu được áp dụng trong thời gian ngắn, đặc biệt là trong giai đoạn cấp tính của bệnh. Ngay khi không có chống chỉ định giảm thuốc an thần và bệnh nhân có thể thở tự nhiên, chế độ MV hỗ trợ nên được áp dụng. Thực hành này đã được quyết định bởi rất nhiều bằng chứng nhấn mạnh tác động bất lợi của MV kiểm soát và các cơ hít vào liên quan đến bất hoạt, đáng chú ý nhất là sự phát triển của rối loạn chức năng cơ hoành do máy thở [1,2]. Ngược lại, MV hỗ trợ có liên quan đến việc giảm liều và thời gian an thần và giảm sử dụng ức chế thần kinh cơ đã được chứng minh là thúc đẩy sự ổn định huyết động, làm giảm nguy cơ mắc bệnh đa dây thần kinh do bệnh nặng, cải thiện trao đổi khí và rút ngắn thời gian MV [3-6].
Với sự khởi đầu của MV hỗ trợ, hai hệ thống hoàn toàn khác nhau được kêu gọi hợp tác: hệ thống hô hấp và máy thở. Chất lượng tương tác, thời gian và định lượng của chúng là bắt buộc để MV có lợi và được mô tả bằng từ “đồng bộ” [synchrony] của Hy Lạp. Đồng bộ bệnh nhân – máy thở xảy ra khi (1) máy thở cung cấp lưu lượng và áp lực ngay khi nỗ lực của bệnh nhân bắt đầu; (2) cường độ của áp lực và lưu lượng này đáp ứng nhu cầu hô hấp của bệnh nhân; và (3) hỗ trợ máy thở chấm dứt khi nỗ lực của bệnh nhân kết thúc. Bất cứ khi nào, bất kỳ điều nào ở trên không được thực hiện, mất đồng bộ bệnh nhân – máy thở xảy ra. Các tác dụng bất lợi của mất đồng bộ bệnh nhân – máy thở bao gồm: tăng công hô hấp, khó chịu của bệnh nhân, quá căng phế nang và tổn thương phổi, rối loạn giấc ngủ, thở định kỳ, sử dụng thuốc an thần không cần thiết và quá tải cơ hoành gây ra tình trạng rối loạn chức năng cơ hoành do thở máy. [7-10]. Để phát hiện các mất đồng bộ bệnh nhân – máy thở, bác sĩ nên đánh giá sự thoải mái của bệnh nhân và kiểm tra cẩn thận các dạng sóng áp lực và lưu lượng, có sẵn trên màn hình máy thở của tất cả các máy thở hiện đại.
Tổng quan này nhằm mục đích mô tả các dạng khác nhau của mất đồng bộ bệnh nhân – máy thở, tập trung vào cách xác định chúng ở đầu giường, để phân tích nguyên nhân của chúng, các hành động cần thiết để giảm hoặc loại bỏ chúng và tác động lâm sàng của chúng. Trước đó, một phần tóm tắt ngắn gọn về sinh lý bệnh của hơi thở và các nguyên tắc cơ bản chỉ đạo hoạt động của các chế độ thông khí hỗ trợ sẽ được cung cấp.
Sinh lý bệnh
Để hiểu được sự không đồng bộ bệnh nhân – máy thở trong MV hỗ trợ, trước tiên người ta phải hiểu những áp lực phát triển trong hệ hô hấp trong một hơi thở tự nhiên. Để bắt đầu một hơi thở, các cơ hít vào co lại, tuân theo các kích thích thần kinh đến từ trung tâm kiểm soát hô hấp. Sự co cơ hít vào làm giãn phế nang và giảm áp lực phế nang dưới áp lực khí quyển, đẩy khí vào phổi. Sự co cơ hít vào tạo ra một áp lực (Pmus), mà bất cứ lúc nào trong khi hít vào (t), đều tiêu tốn để vượt qua hai áp lực chống lại bơm phồng hệ hô hấp, áp lực sức đề kháng (Pres, resistance pressure) và áp lực đàn hồi (Pel, elastance pressure) của hệ hô hấp (giả định là quán tính không đáng kể) [11]. Điều này được mô tả chính xác bởi phương trình chuyển động của hệ hô hấp:
Pmus(t) = Pres(t) + Pel(t) = Rrs x V'(t) + Ers x ΔVFRC(t) (1)
Trong đó Rrs và Ers là sức đề kháng và độ đàn hồi của hệ hô hấp tương ứng, ΔVFRC (t) là thể tích tức thời trên dung tích cặn chức năng thụ động (FRC) và V’(t) là lưu lượng tức thời. Nếu ΔV liên quan đến thể tích phổi cuối thì thở ra (EE):
Pmus(t) = Pres(t) + Pel(t) = Rrs x V'(t) + Ers x ΔVEE(t) + PEEPi (2)
Trong đó PEEPi, là áp lực đàn hồi của hệ hô hấp khi thở ra.
Trong MV kiểm soát, các cơ hít vào không co lại, Pmus bằng 0 và áp lực cần thiết để vượt qua độ đàn hồi và sức đề kháng của hệ hô hấp hoàn toàn do máy thở cung cấp. Phương trình chuyển động trong trường hợp này được sửa đổi như sau:
Paw = Pres(t) + Pel(t) = Rrs x V'(t) + Ers x ΔVEE(t) + PEEPi (3)
Trong đó Paw là áp lực được cung cấp bởi máy thở.
Trong MV hỗ trợ, tổng áp lực áp dụng cho các hệ hô hấp xuất phát từ cả máy thở và cơ hít vào và phương trình chuyển động được điều chỉnh như sau:
PTOT = Paw + Pmus = Pres(t) + Pel(t) = Rrs x V'(t) + Ers x ΔVEE(t) + PEEPi (4)
trong đó PTOT là áp lực tổng. Rõ ràng là các biến của phương trình trên phụ thuộc chặt chẽ với nhau và mỗi thay đổi của một phương thức này có thể ảnh hưởng đến các phương trình khác. Mối quan hệ chặt chẽ này được mô tả sơ đồ trong Hình 1 [11].
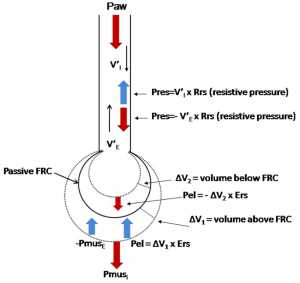
”Hệ thống hô hấp được trình bày dưới dạng một quả bóng với dung tích cặn chức năng thụ động (FRC) (đường liên tục). Hai đường đứt nét biểu thị các thể tích ở trên (ΔV1) và dưới (ΔV2) FRC. Ở những bệnh nhân thở máy trong áp lực thở máy (Paw) và áp lực do cơ hí vào (PmusI) tạo ra lưu lượng và thể tích tăng lên trên FRC thụ động. Tổng của hai áp lực này được tiêu tốn để vượt qua áp lực đàn hồi (Pel) và áp lực trở kháng (Pres). Tất cả những áp lực này có giá trị dương trong phương trình chuyển động. Áp lực phát triển do sự co rút của cơ hít vào (PmusE), áp lực đàn hồi do thể tích dưới FRC thụ động và áp lực trở kháng do V’E có giá trị âm trong phương trình. V’I: lưu lượng hít vào; Rrs: sức đề kháng của hệ hô hấp; V’E: lưu lượng thở ra; Ers: độ đàn hồi của hệ hô hấp. Được sửa đổi từ Kondili et al. Br J Anaesth 2003; 91: 106-19, với sự cho phép của Nhà xuất bản Đại học Oxford [43].”
Nguyên tắc cơ bản của thông khí hỗ trợ
Để giải thích các dạng sóng cơ bản và sau đó để nhận ra các mất đồng bộ bệnh nhân – máy thở, rất hữu ích khi thảo luận về các nguyên tắc cơ bản chỉ ra hoạt động của các chế độ máy thở được hỗ trợ.
Ba biến xác định chức năng của máy thở áp lực dương: (1) biến kích hoạt [triggering variable], (2) biến kiểm soát [control variable] áp lực hoặc lưu lượng trong hít vào cơ học và (3) biến số chấm dứt chu kỳ [cycling off variable].
Biến kích hoạt là tín hiệu khởi động hơi thở cơ học. Trong thông khí hỗ trợ, các biến kích hoạt được sử dụng phổ biến nhất là lưu lượng và áp lực. Hít vào cơ học bắt đầu khi nỗ lực hít vào của bệnh nhân giảm lưu lượng (kích hoạt lưu lượng) hoặc áp lực (kích hoạt áp lực) trong mạch máy thở xuống mức đặt trước. Người ta thường tin rằng kích hoạt lưu lượng thân thiện hơn với bệnh nhân liên quan đến công hô hấp, bởi vì áp lực kích hoạt đòi hỏi sự co thắt đẳng thể tích (isometric contraction) của cơ hít vào [12,13]. Tuy nhiên, các nghiên cứu đã chỉ ra rằng, trong các máy thở hiện đại, có sự khác biệt tối thiểu, nếu có, liên quan đến công thở giữa hai cách kích hoạt [12-14]. Các biến kích hoạt khác bao gồm dạng sóng lưu lượng, thể tích, áp lực xuyên cơ hoành (Pdi) và hoạt động điện cơ của cơ hoành (EAdi; máy trợ thở điều chỉnh tự nhiên [NAVA]) nhưng việc sử dụng chúng trong thực hành lâm sàng bị hạn chế [12,15-21].
Biến kiểm soát cung cấp áp lực và lưu lượng phân biệt các chế độ MV được hỗ trợ khác nhau [22,23]. Trong kiểm soát/hỗ trợ thể tích, máy thở cung cấp một thể tích khí lưu thông đặt trước với một kiểu lưu lượng – thời gian đặt trước. Đây là các biến độc lập, trong khi áp lực đường thở (Paw) cần thiết để cung cấp lưu lượng và thể tích đặt trước phụ thuộc vào tính chất cơ học của hệ hô hấp và là biến phụ thuộc. Trong kiểm soát áp lực hoặc hỗ trợ áp lực, máy thở cung cấp một áp lực đặt trước (biến độc lập). Các biến phụ thuộc vào chế độ đặt trước áp lực là thể tích và lưu lượng. Các biến này thay đổi theo tính chất cơ học của hệ hô hấp và áp lực được cung cấp. Trong các chế độ thông khí tỷ lệ, không có biến nào được đặt trước: máy thở cung cấp hỗ trợ tỷ lệ thuận với nỗ lực hít vào của bệnh nhân. Cái sau được thể hiện thông qua những thay đổi trong lưu lượng và thể tích tức thời (thông khí hỗ trợ tỷ lệ [PAV]) hoặc thông qua những thay đổi trong hoạt động thần kinh của cơ hoành (NAVA) [11,22,24].
Biến số chấm dứt chu kỳ được định nghĩa là tín hiệu kết thúc giai đoạn cung cấp. Tiêu chí chu kỳ thông thường trong các chế độ cài đặt áp lực được hỗ trợ của MV là áp lực hoặc lưu lượng đường thở: máy thở chấm dứt hỗ trợ và mở van thở ra khi tăng hoặc giảm lưu lượng đến tiêu chí định sẵn. Các tiêu chí khác của chu kỳ là thời gian, thể tích, phương pháp dạng sóng và EAdi trong NAVA [15]. Lý tưởng nhất là việc chu kỳ nên xảy ra đồng thời với sự kết thúc của hít vào thần kinh. Tuy nhiên, thực tế này hiếm khi, nếu có, xảy ra và sự không đồng bộ thở ra là một sự kiện phổ biến với tất cả các chế độ thông khí hỗ trợ thông thường.
Với các chế độ đặt trước áp lực, thời gian tăng (rise time) là cài đặt xác định tốc độ của máy thở sẽ đến được Paw đã chọn. Nó có sẵn trong các máy thở thế hệ mới trong quá trình hỗ trợ áp lực và thông khí kiểm soát áp lực. Thời gian tăng nhanh có liên quan đến sự gia tăng mạnh của lưu lượng hít vào và có thể gây ra áp lực quá mức và thúc đẩy chứng khó thở. Thời gian tăng rất chậm có thể được nhận ra bởi một lưu lượng hít vào hình tròn [25-27]. Cả thời gian tăng thấp và cao có thể làm thay đổi thời gian hít vào cơ học và thể tích được cung cấp và có thể gây ra sự phân ly giữa hít vào cơ học và thần kinh [27,28]. Vì, không có quy tắc nào để thiết lập thời gian tăng tối ưu, nên tránh cả thời gian tăng rất nhanh và chậm và thời gian tăng nên điều chỉnh theo trung khu kiểm soát hô hấp của bệnh nhân [25-28].
Mất đồng bộ bệnh nhân – máy thở
Mất đồng bộ bệnh nhân – máy thở có thể được phân biệt thành hai loại chính: (1) rối loạn đồng bộ xảy ra do hơi thở thần kinh không cùng pha với hơi thở cơ học. Nhóm này bao gồm: độ trễ kích hoạt [triggering delay], nỗ lực không hiệu quả [ineffective efforts], tự động kích hoạt [auto-triggering], kích hoạt ngược [reverse triggering], mở van thở chậm, mở van thở sớm, kích hoạt kép [double triggering] và nhịp thở chồng [breath stacking] và (2) rối loạn đồng bộ liên quan đến sự khác biệt giữa mức độ hỗ trợ bệnh nhân cần và sự hỗ trợ thực tế mà máy thở cung cấp.
1) Sự chậm trễ của các nỗ lực kích hoạt và nỗ lực không hiệu quả
Độ trễ kích hoạt là khoảng thời gian giữa sự khởi đầu của hít vào thần kinh và cơ học [11,18]. Nếu có theo dõi áp lực thực quản (Pes) hoặc EAdi, nó được quan sát khi thời gian trôi qua giữa việc giảm Pes hoặc tăng EAdi (bắt đầu hít vào thần kinh) và tăng đột ngột của lưu lượng hoặc Paw (bắt đầu hít vào cơ học).
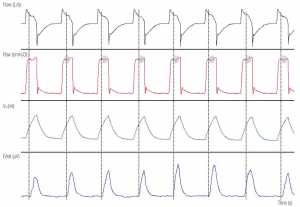
Những nỗ lực không hiệu quả là những nỗ lực của bệnh nhân không thể kích hoạt máy thở. Mặc dù thường được mô tả là rối loạn đồng bộ kích hoạt, những nỗ lực không hiệu quả có thể xảy ra bất cứ lúc nào trong hơi thở cơ học, trong giai đoạn hít vào cơ học, thở ra hoặc ở giai đoạn chuyển tiếp giữa hai giai đoạn này. Tiêu chuẩn vàng cho sự công nhận của họ là quan sát đồng thời hoạt động hít vào của bệnh nhân. Điều này đạt được thông qua việc ghi lại Pes hoặc EAdi (Hình 2). Cả hai phương pháp đều xâm lấn và yêu cầu đặt các ống thông được chỉ định: ống thông thực quản, cho theo dõi Pes và NAVA, cho ghi EAdi. Trong hầu hết các trường hợp, những nỗ lực không hiệu quả có thể được xác định không xâm lấn ở đầu giường, bằng cách quan sát các dạng sóng lưu lượng – thời gian và áp lực – thời gian tại màn hình máy thở. Những nỗ lực không hiệu quả gây ra sự biến dạng ở Paw và rõ ràng hơn là ở đường cong lưu lượng – thời gian: sự gia tăng đột ngột lưu lượng hít vào và giảm lưu lượng thở ra cho thấy sự hiện diện của những nỗ lực không hiệu quả trong quá trình hít vào và thở ra tương ứng (Hình 2 và 3) [11 , 18].
Độ trễ kích hoạ và nỗ lực không hiệu quả chia sẻ các cơ chế sinh lý bệnh phổ biến. Nguyên nhân của chúng có thể được phân thành hai loại chính: cài đặt máy thở và đặc điểm bệnh nhân [8,29-31]. Cài đặt máy thở có thể gây ra sự chậm trễ và nỗ lực không hiệu quả là mức hỗ trợ cao, độ mở của van thở chậm và độ nhạy kích hoạt thấp. Những yếu tố này được xác định bởi các bác sĩ. Các đặc điểm chính của bệnh nhân bao gồm kiểm soát trung khu hô hấp thấp (ví dụ: an thần, bệnh thần kinh trung ương, v.v.), cơ hít vào yếu (nghĩa là bệnh đa dây thần kinh do bệnh nặng, nhược cơ, v.v.), và sức đề kháng và độ đàn hồi cao làm tăng hằng số thời gian của hệ hô hấp.
Tỷ lệ mắc và mức độ chậm trễ của việc kích hoạt và nỗ lực không hiệu quả không phải là nhỏ trong thực hành lâm sàng. Những nỗ lực không hiệu quả là hình thức phổ biến nhất của mất đồng bộ bệnh nhân – máy thở.
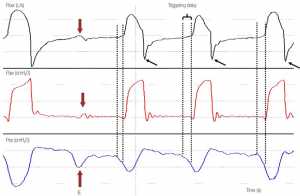
”Quan sát thấy lần giảm thứ hai của Pes, đại diện cho nỗ lực hít vào của bệnh nhân, không theo hơi thở cơ học. Đây là nỗ lực không hiệu quả (IE) trong khi thở ra và được biểu hiện bằng sự giảm nhẹ ở Paw, liên quan đến giảm lưu lượng thở ra đồng thời (mũi tên đỏ). Lưu ý rằng tín hiệu của biến dạng lưu lượng rõ ràng hơn nhiều so với thay đổi Paw tương ứng. Trong mỗi hơi thở cơ học, có một độ trễ thời gian giữa bắt đầu hít vào thần kinh (đường chấm chấm thứ nhất) và bắt đầu hít vào cơ học (đường chấm chấm thứ hai). Thời gian trễ này là độ trễ kích hoạt. Quan sát sự tăng vọt sớm của lưu lượng thở ra (mũi tên đen) sau mỗi hơi thở cho thấy sức cản đường thở cao và liên tục trong thời gian dài gây ra thở ra không hoàn toàn (lưu lượng không bằng 0 trước hơi thở tiếp theo). Siêu bơm phồng động gây ra sự chậm trễ kích hoạt và, kết hợp với nỗ lực của bệnh nhân tương đối yếu hơn (độ lệch thứ hai nhỏ hơn các yếu tố khác) dẫn đến kích hoạt không hiệu quả.”
Vaporidi et al. [32] đã đánh giá vai trò của những nỗ lực không hiệu quả trong MV về kết cục của các bệnh nhân bị bệnh nặng. Các sự kiện của những nỗ lực không hiệu quả đã được xác định ở 38% bệnh nhân có MV kéo dài và những sự kiện này có liên quan đến MV kéo dài và tăng tỷ lệ tử vong. Tỷ lệ mắc bệnh của họ cao hơn ở những bệnh nhân mắc bệnh phổi tắc nghẽn [29,33]. Ở những bệnh nhân này, áp lực đàn hồi thấp và/hoặc tăng sức đề kháng làm tăng thời gian cần thiết để bệnh nhân thở ra (hằng số thời gian cao), dẫn đến bẫy khí và siêu bơm phồng động (dynamic hyperinflation). Siêu bơm phồng động là nguyên nhân quan trọng nhất gây ra sự chậm trễ kích hoạt và những nỗ lực không hiệu quả. Với sự hiện diện của siêu bơm phồng động, tải trọng ngưỡng đàn hồi (PEEPi) được áp đặt lên các cơ hít vào khi bắt đầu hít vào. Các cơ hít vào trước tiên phải đối trọng PEEPi để giảm áp lực phế nang dưới áp lực dương cuối thì thở ra bên ngoài (PEEPe) và kích hoạt máy thở [34-36]. Điều này tạo ra một sự chậm trễ giữa việc bắt đầu nỗ lực hít vào và kích hoạt máy thở. Trong trường hợp nghiêm trọng của siêu bơm phồng động, đặc biệt là nếu nỗ lực yếu, bệnh nhân có thể không kích hoạt máy thở (nỗ lực không hiệu quả). Sức cản đường thở cao có thể được nhận ra trong tất cả các chế độ máy thở bằng cách quan sát đường cong lưu lượng – thời gian thở ra. Giai đoạn sớm của thì thở ra, một sự tăng vọt của lưu lượng thở ra biểu thị sự nén động của đường thở trung tâm [11]. Sau đó, lưu lượng thở giảm nhưng rất chậm, nếu có, trở về dòng 0 trước thì hít vào tiếp theo sau (Hình 2 và 3).
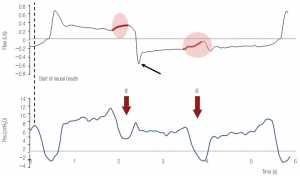
”Sự khởi đầu của hít vào thần kinh (đường chấm chấm) được biểu thị bằng sự giảm nhanh chóng của Pes liên quan đến việc giảm lưu lượng thở ra nhanh chóng (lưu lượng thở ra nhanh chóng trở về dòng 0). Hai nỗ lực tiếp theo của bệnh nhân không đi kèm với hơi thở cơ học và thể hiện những nỗ lực không hiệu quả (IE, mũi tên đỏ). Cả hai có thể được xác định bởi sự biến dạng lưu lượng liên quan. IE đầu tiên diễn ra trong hít vào cơ học và gây ra sự gia tăng dạng sóng dòng thở. IE thứ hai xảy ra trong khi thở ra và được biểu hiện bằng sự giảm lưu lượng thở ra. Sự tăng vọt sớm của lưu lượng thở ra (mũi tên đen) do sức cản đường thở cao và thở ra không hoàn toàn (lưu lượng không bằng 0 trước hơi thở tiếp theo) là dấu hiệu của siêu bơm phồng động.”
Các kích hoạt bị trễ hoặc bị mất biểu thị các cơn co thắt lệch tâm (eccentric contraction) của cơ hoành có thể gây khó chịu cho chức năng của nó. Chúng có thể gây ra rối loạn và trong sự hiện diện của chúng, nhịp hô hấp trên màn hình máy thở không phản ánh nhịp thở thực sự của bệnh nhân. Các chiến lược để giảm độ trễ kích hoạt và số lượng nỗ lực không hiệu quả cần được nghiên cứu [8,11,22,29,31]. Đầu tiên, cần sửa đổi cài đặt máy thở. Đặt kích hoạt nhạy nhất mà không gây ra tự động kích hoạt là một tùy chọn. Liên quan đến việc độ nhạy kích hoạt, người ta đã chứng minh rằng phương pháp dạng sóng dòng (flow-waveform method) [15], so với kích hoạt lưu lượng, làm tăng cường độ nhạy và do đó làm giảm tỷ lệ của các sự kiện này. Hơn nữa, các phương pháp mới hơn để kích hoạt thông khí kiểm soát đôi theo Pdi [20] và NAVA [21] loại bỏ các sự kiện này.
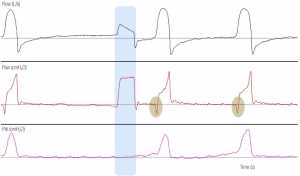
”Như được chỉ ra bởi sự vắng mặt của Pdi, không có nỗ lực hít vào trước hơi thở cơ học thứ hai (hơi thở tự động, nhìn thấy khu vực bóng mờ màu xanh). Chúng ta có thể quan sát rằng, so với hơi thở do bệnh nhân kích hoạt, trong đó sự sụt giảm của Paw được quan sát trước khi bắt đầu bơm phồng cơ học (các khu vực bóng mờ màu xám), không có biến dạng trong Paw – (không giảm ở Paw) và đường cong lưu lượng thời gian trong hơi thở tự động. Hơn nữa, hình dạng của đường cong thời gian của dòng thở là khác so với hơi thở của bệnh nhân. Lưu ý sự vắng mặt của siêu bơm phồng động ở bệnh nhân này (lưu lượng thở trở về 0 sau mỗi hơi thở).”
Cài đặt máy thở làm giảm siêu bơm phồng động và do đó, gây ra giảm bớt sự chậm trễ kích hoạt và nỗ lực không hiệu quả là: (1) giảm thông khí phút bằng cách giảm trợ giúp (giảm áp lực, đặt thể tích khí lưu thông) và giảm tần số thở, (2) kéo dài thời gian thở ra bằng cách tăng ngưỡng chu kỳ lưu lượng, và thời gian tăng nhanh hơn trong hỗ trợ áp lực, hoặc lưu lượng hít vào cao hơn và áp lực hít vào cao nguyên ngắn hơn trong chế độ kiểm soát/hỗ trợ thể tích và (3) ứng dụng PEEPe. PEEPe thu hẹp sự khác biệt giữa áp lực phế nang và ngưỡng áp lực cho sự khởi đầu của hít vào cơ học, do đó giúp bệnh nhân kích hoạt máy thở. Điều này đặc biệt hữu ích ở một số bệnh nhân mắc bệnh phổi tắc nghẽn nặng [29,33]. Thứ hai, các nguyên nhân liên quan đến bệnh nhân nên được xem xét. Cần chú ý trung khu kiểm soát hô hấp và các yếu tố có thể làm giảm nó, chẳng hạn như an thần và kiềm quá mức. Những nỗ lực để giảm cường độ siêu bơm phồng động cũng nên được thực hiện, ví dụ, việc sử dụng corticosteroid, điều trị giãn phế quản và hút dịch tiết có thể dẫn đến giảm sức cản đường hô hấp.
2) Tự động kích hoạt (Autotriggering)
Tự động kích hoạt xảy ra khi máy thở được kích hoạt trong trường hợp không có nỗ lực của bệnh nhân [37,38]. Hiện tượng này cũng có thể được nhận ra bằng cách kiểm tra các dạng sóng của máy thở. Việc không giảm Pes (nếu được theo dõi) hoặc ở Paw trước giai đoạn cung cấp, đặc biệt là khi có lưu lượng bằng 0 đủ lâu trước một nhịp thở cơ học, là dấu hiệu cho thấy bệnh nhân không được kích hoạt hơi thở. Kiểu hình lưu lượng – thời gian của hơi thở tự động thường là khác với nhịp thở tương ứng của bệnh nhân (Hình 4). Nếu dịch tiết hoặc dao động của tim là nguyên nhân, người ta có thể nhận thấy sự biến dạng lưu lượng liên quan và nghi ngờ hiện tượng này.
Tự động kích hoạt có thể được gây ra bởi một ngưỡng thấp để kích hoạt và/hoặc tín hiệu nhiễu có thể gây ra sự sụt giảm của Paw hoặc lưu lượng, bị máy thở hiểu sai là nỗ lực của bệnh nhân. Các loại nhiễu thường xuyên gây ra tự động kích hoạt là rò rỉ mạch, sự hiện diện của nước trong mạch, nấc cụt và bộ dao động tim mạnh [37,38]. Các yếu tố khiến bệnh nhân tăng nguy cơ tự động kích thích là nhịp hô hấp và tần số thở thấp, hằng số thời gian thấp của hệ hô hấp (tăng độ đàn hồi, sức đề kháng thấp) và sự hiện diện của tuần hoàn tăng cường (cung lượng tim lớn hơn và áp lực làm đầy tâm thất cao hơn ).
Tự động kích hoạt là một hiện tượng phổ biến trong các chế độ được hỗ trợ của MV (xâm lấn và không xâm lấn) [18,39]. Khi rõ ràng, nhịp hô hấp bị làm sai lệch. Những hơi thở bổ sung này có thể dẫn đến tăng thông khí, nhiễm kiềm hô hấp, siêu bơm phồng và rối loạn chức năng cơ hoành [2,40].
Để loại bỏ tự động kích hoạt, bác sĩ phải cố gắng khắc phục nguyên nhân cơ bản: tăng cường kiểm soát trung khu hô hấp bằng cách giảm an thần, điều trị nhiễm kiềm bằng cách giảm mức độ hỗ trợ, hút dịch tiết và giảm thiểu rò rỉ mạch. Hơn nữa, ngưỡng kích hoạt cao hơn, hoặc thay đổi từ kích hoạt lưu lượng sang kích hoạt áp lực có thể xóa bỏ hơi thở tự động [37,38].
3) Chu kỳ sớm (Premature cycling off)
Khi van thở ra của máy thở mở quá sớm, sự kéo dài của thì hít vào cơ học ngắn hơn hít vào thần kinh. Hình thức không đồng bộ này thường liên quan đến việc hỗ trợ không đủ. Nỗ lực cơ hít vào sau khi kết thúc quá trình bơm khí của máy thở làm tăng công thở và khiến bệnh nhân có nguy cơ bị kích hoạt kép. Sự không đồng bộ này có thể hiện diện theo các cách sau [11]. (1) Lưu lượng hít vào bằng không hoặc nhỏ một thời gian sau khi mở van thở ra (Paw giảm xuống mức 0 hoặc mức PEEP) cho thấy cơ hít vào tiếp tục co lại sau khi kết thúc hít vào cơ học [41]. (2) Sự sụt giảm mạnh từ mức thở ra cao nhất kéo dài vài mili giây sau đó tăng dần rồi giảm dần về 0 khi thở ra: mô hình này trong dạng sóng lưu lượng – thời gian cũng là một dấu hiệu cho thấy hoạt động cơ hít vào đáng kể sau khi mở van thở ra. Khi hít vào cơ học kết thúc, áp lực đàn hồi cuối hít vào lớn hơn áp lực cơ hít vào, tạo ra áp lực phế nang dương và do đó, lưu lượng thở ra. Áp lực đàn hồi giảm trong khi thể tích phổi giảm do co thắt cơ hít vào. Áp lực đối nghịch ngày càng tăng đối với lưu lượng thở ra, gây ra sự giảm đột ngột lưu lượng thở ra. Sự giảm này bị gián đoạn do sự thư giãn của cơ hít vào và lưu lượng thở ra tăng và do đó, theo lộ trình được xác định bởi áp lực đàn hồi và kháng lực đường thở của bệnh nhân và mạch thở [11]. (3) Kích hoạt kép (hoặc nhiều): điều này đề cập đến việc cung cấp hai (hoặc thậm chí nhiều hơn) các nhịp thở máy trong một nỗ lực hít vào duy nhất. Sự co cơ hít vào đủ lớn để áp đảo áp lực đàn hồi của hệ hô hấp và kích hoạt máy thở nhiều lần.
Chu kỳ sớm có liên quan đến các cài đặt máy thở cụ thể, chẳng hạn như mức hỗ trợ thấp, ngưỡng chuyển chu kỳ sang thở ra tương đối cao và thời gian bơm phồng ngắn. Hằng số thời gian ngắn của hệ hô hấp và thời gian cung cấp hít vào thần kinh dài là những yếu tố ảnh hưởng đến sự không đồng bộ này. Hơn nữa, các yếu tố rủi ro cho nhiều kích hoạt là độ đàn hồi thấp khi kết thúc bơm phồng cơ học và hoạt động cơ hít vào mãnh liệt [11,22].
Như đã đề cập, việc mở van thở ra sớm có liên quan đến việc tăng nhịp thở. Hơn nữa, kích hoạt kép có thể gây ra thể tích khí lưu thông cao (lên đến hai lần giá trị định trước) khiến bệnh nhân có nguy cơ bị tổn thương phổi do thông khí và rối loạn chức năng cơ hoành do thông khí.
Có thể giảm thiểu mở van thở ra sớm và kích hoạt nhiều lần liên quan bằng cách tăng thời gian hít vào cơ học và/hoặc, nếu có thể, bằng cách giảm thời gian hít vào thần kinh. Loại thứ hai nên được xem xét ở những bệnh nhân có nỗ lực hít vào kéo dài do sử dụng quá nhiều opioid. Các hành động làm tăng thời gian bơm phồng cơ học bao gồm ngưỡng lưu lượng chuyển chu kỳ thấp hơn, hỗ trợ cao hơn và thời gian tăng chậm hơn với chế độ hỗ trợ áp lực [11,28]. Với các chế độ kiểm soát, có thể dễ dàng đạt được thời gian cao hơn của hít vào cơ học bằng cách điều chỉnh đúng các cài đặt máy thở, như thời gian hít vào, lưu lượng hít vào hoặc áp dụng tạm dừng cuối hít vào [11,22].
4) Chu kỳ bị trì hoãn (Delayed cycling off)
Khi van thở ra mở quá muộn, thì hít vào cơ học kéo dài đến thì thở ra thần kinh. Điều này có thể thúc đẩy hoạt động cơ hít vào nghiêm ngặt và tăng công thở ra khi bệnh nhân đấu tranh để chấm dứt thì hít vào. Hơn nữa, nó có thể làm tăng thể tích khí lưu thông được cung cấp một cách không cần thiết và rút ngắn thời gian thở ra. Những tác động này có thể thúc đẩy siêu bơm phồng động và rối loạn đồng bộ liên quan (độ trễ kích hoạt, nỗ lực không hiệu quả), đặc biệt ở những bệnh nhân mắc bệnh phổi tắc nghẽn hoặc căng quá mức phổi.
Việc nhận ra sự chậm trễ của việc mở van thở ra thường là một thách thức. Trong chế độ hỗ trợ áp lực, nó có thể được biểu thị bằng sự giảm nhanh của lưu lượng hít vào, sau đó là giảm theo lũy thừa về cuối hít vào cơ học [11]. Sự gia tăng đột ngột (tăng đột biến) của Paw gần cuối hít vào cơ học là dấu hiệu của sự thư giãn cơ hít vào hoặc co thắt cơ thở ra [42]. Dù nguyên nhân là gì, sự tăng đột biến này là một bằng chứng về việc chậm chu kỳ (Hình 5). Với thông khí kiểm soát/hỗ trợ thể tích, sự gia tăng mạnh mẽ của Paw về cuối hơi thở cơ học cho thấy hít vào cơ học dài hơn thần kinh.
Ngưỡng lưu lượng chuyển chu kỳ thấp hơn, hỗ trợ cao và thời gian tăng thấp là những yếu tố ảnh hưởng đến sự không đồng bộ này trong quá trình thông khí hỗ trợ áp lực [43]. Với chế độ kiểm soát/hỗ trợ thể tích, thể tích khí lưu thông cao, thời gian bơm phồng tăng, lưu lượng hít vào thấp và áp dụng tạm dừng cuối hít vào có thể gây ra việc mở van thở ra chậm [43]. Với chế độ hỗ trợ áp lực, việc mở van thở chậm thường thấy ở những bệnh nhân có hằng số thời gian hệ hô hấp dài, chẳng hạn như ở những bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính [44].
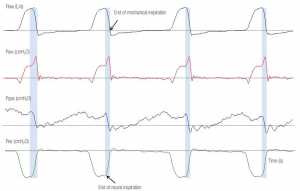
”Dạng sóng lưu lượng, áp lực đường thở (Paw), áp lực dạ dày (PGas) và áp lực thực quản (Pes) theo thời gian ở bệnh nhân được thở máy với thông khí hỗ trợ áp lực. Có một độ trễ thời gian đáng kể (khu vực bóng mờ màu xanh) giữa phần cuối của thì hít vào thần kinh, được nhận ra bởi sự gia tăng nhanh chóng của Pes và kết thúc của thì hít vào cơ học, được biểu thị bằng cách chấm dứt lưu lượng hít vào (lưu lượng hít vào bằng 0). Quan sát sự gia tăng nhanh chóng của Paw về cuối thì hít vào cơ học, cho thấy sự thư giãn cơ hít vào.”
Không phụ thuộc vào chế độ thông khí, nên thay đổi cài đặt máy thở bằng các biện pháp giảm thiểu sức cản đường thở và siêu bơm phồng động (tức là, giãn phế quản, điều trị steroid, hút dịch tiết).
5) Kích hoạt ngược (Reverse triggering)
Kích hoạt ngược được mô tả đầu tiên bởi Akoumianaki et al. [45], trong một nhóm bệnh nhân bị an thần nặng, sự xuất hiện của những nỗ lực hít vào của bệnh nhân được kích hoạt bởi máy thở. Hiện tượng này, được gọi là rối loạn hô hấp, đã được mô tả trước đây ở động vật, đối tượng khỏe mạnh và trẻ sinh non [40,46,47]. Nó khác với các loại rối loạn đồng bộ khác ở chỗ bệnh nhân mất hoàn toàn sự biến đổi nhịp thở bình thường và thực sự thở như một cái máy, thể hiện mối quan hệ tạm thời cố định (1:1 hoặc, ít phổ biến hơn, 1:2 hoặc 1:3) giữa khởi phát những nỗ lực hít vào của bệnh nhân và sự khởi đầu của hơi thở cơ học. Phản hồi của dây thần kinh X và ảnh hưởng vỏ não có liên quan đến cơ chế sinh lý bệnh của những sự kiện này [46,47].
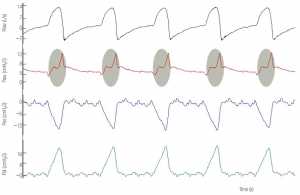
”Có một nỗ lực hít vào của bệnh nhân (đường chấm chấm), bằng chứng là sự gia tăng nhanh chóng hoạt động điện cơ của cơ hoành (EAdi) sau mỗi bơm phồng cơ học (mối quan hệ 1:1). Khoảng thời gian giữa sự khởi đầu của hít vào cơ học và thần kinh được cố định. Bằng chứng gián tiếp về hoạt động hít vào của bệnh nhân trong quá trình bơm phồng cơ học là phần notch ở Paw (khu vực bóng mờ màu xám). Paw: áp lực đường thở; VT: thể tích khí lưu thông.”
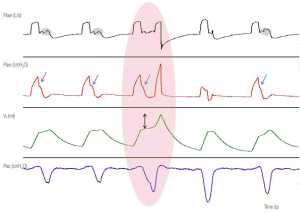
”Giảm áp lực thực quản cho thấy những nỗ lực hít vào của bệnh nhân (đường màu xanh) sau mỗi lần bơm phồng cơ học trong mối quan hệ 1:1. Bằng chứng gián tiếp về hoạt động hít vào của bệnh nhân trong quá trình bơm phồng cơ học là biến dạng lưu lượng (vùng bóng mờ màu xám) và sự biến mất (mũi tên màu xanh) của áp lực đường thở cao nguyên (Paw) trong dạng sóng lưu lượng – thời gian và áp lực – thời gian, tương ứng. Ở bệnh nhân này, hơi thở kích hoạt ngược đủ mạnh để kích hoạt máy thở ở cuối hít vào cơ học, gây ra tình trạng nhịp thở xếp chồng (khu vực bóng mờ màu đỏ). Thể tích khí lưu thông tăng (VT) trong quá trình hơi thở xếp chồng tăng từ 444 ml lên 800 ml (mũi tên kép).”
Hơi thở kích hoạt ngược có thể xảy ra ở bất kỳ giai đoạn nào của chu kỳ hô hấp và trong các giai đoạn khác nhau. Sự xác nhận loại mất đồng bộ này, khi không có khả năng ghi Pes hoặc EAdi, thường rất khó khăn và yêu cầu kiểm tra cẩn thận các dạng sóng áp lực – thời gian và lưu lượng – thời gian (Hình 6 và 7). Tùy thuộc vào giai đoạn của hơi thở cơ học mà chúng xảy ra, chúng có thể gây ra các cơn co thắt đẳng hướng hoặc lệch tâm của cơ hít vào, làm tăng thể tích khí lưu thông trong các chế độ nhắm mục tiêu áp lực hoặc thậm chí kích hoạt hơi thở thứ hai (hơi thở xếp chồng) gây ra tăng thông khí và tăng nguy cơ quá căng phổi (Hình 7).
6) Rối loạn đồng bộ liên quan đến sự khác biệt giữa nhu cầu của bệnh nhân và hỗ trợ máy thở
Mức hỗ trợ không phù hợp (hỗ trợ không đầy đủ hoặc quá mức) liên quan đến nhu cầu máy thở của bệnh nhân là một nguyên nhân khác gây ra mất đồng bộ bệnh nhân – máy thở [11,22]. Mức độ hỗ trợ không đầy đủ thường được quan sát thấy ở những bệnh nhân có nhu cầu cao và tăng kiểm soát trung khu hô hấp (nghĩa là nhiễm trùng huyết và nhiễm toan chuyển hóa). Sự khác biệt này được kết hợp với tăng công thở và các triệu chứng lâm sàng của bệnh nhân cho thấy điều này (nghĩa là sử dụng các cơ hít vào phụ, tần số hô hấp cao).
Mức hỗ trợ quá mức thường là kết quả của kiểm soát trung khu hô hấp thấp và/hoặc cài đặt máy thở không phù hợp, nhưng tác dụng phụ của sự không tương thích này rất quan trọng. Siêu bơm phồng động, nhiễm kiềm hô hấp, nhịp thở chu kỳ do ngưỡng ngưng thở thấp hơn, rối loạn giấc ngủ, rối loạn chức năng cơ hoành do thở máy và/hoặc tổn thương phổi là những hậu quả tiềm tàng của hỗ trợ cao [44,48].
”Quan sát sự co thắt mạnh mẽ của cơ hít vào (tăng Pdi) trong hít vào cơ học. Độ lớn của sự co lại này gây ra một lưu lượng hô hấp tròn và sự sụt giảm lớn của Paw (vùng bóng mờ màu xám) từ dạng hình vuông dự kiến trong khi hít vào. Lưu lượng tròn và giảm Paw là dấu hiệu của máy thở hỗ trợ thấp cho nhu cầu máy thở của bệnh nhân.”
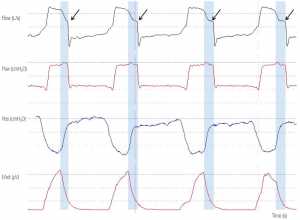
”Quan sát áp lực đường thở hình vuông (Paw) và sự giảm đột ngột lưu lượng hít vào đến ngưỡng lưu lượng chuyển chu kỳ về cuối hít vào (mũi tên). Ngoài ra còn có một độ trễ chu kỳ đáng kể (khu vực bóng mờ màu xanh), thường thấy ở mức hỗ trợ cao. Áp lực thực quản (Pes) và hoạt động điện cơ của cơ hoành (EAdi) giảm nhanh chóng nhưng bơm phồng cơ học vẫn tiếp tục. Điều quan trọng, cơ thở ra co thắt trong suốt thời gian thở ra.”
Bằng cách kiểm tra dạng sóng của Paw hoặc lưu lượng, nỗ lực hít vào liên quan đến mức hỗ trợ có thể được ước tính [11,22]. Paw giảm khi cơ hít vào co lại và tăng khi cơ thở ra co lại. Paw nhạy hơn trong thông khí kiểm soát thể tích hỗ trợ vì nó là biến phụ thuộc. Mặc dù trong các chế độ nhắm mục tiêu áp lực, Paw phải duy trì tương đối ổn định, hình dạng của nó có thể thay đổi khi các cơ hít vào co bóp nghiêm ngặt (Hình 8). Hơn nữa, sự thay đổi trong mô hình lưu lượng vượt ra ngoài kiểu lưu lượng giảm điển hình là một dấu hiệu của nỗ lực cơ hô hấp [49].
Chu kỳ bị trì hoãn cũng có thể chỉ ra sự hỗ trợ quá mức. Mặt khác, lưu lượng tròn hoặc hằng định thể hiện nỗ lực hô hấp đáng kể và có thể là do hỗ trợ không đầy đủ (Hình 6). Hỗ trợ không đầy đủ cũng là nguyên nhân của xuất hiện các chu kỳ sớm hoặc kích hoạt kép.
Các chế độ thông khí mới
Ngoài việc điều chỉnh cài đặt máy thở, việc giới thiệu các chế độ mới của MV, được gọi là chế độ thông khí tỷ lệ, là một bước quan trọng để tương tác với máy thở của bệnh nhân tốt hơn. Các chế độ này chia sẻ các nguyên tắc tương tự: chúng cung cấp hỗ trợ tương ứng với nỗ lực của bệnh nhân. Nỗ lực của bệnh nhân được thể hiện bằng sự thay đổi lưu lượng và thể tích tức thời (PAV) hoặc là sự thay đổi trong EAdi (NAVA). Bác sĩ lâm sàng thiết lập mức tăng ích để tăng cường nỗ lực và áp lực của bệnh nhân và thay đổi lưu lượng của hơi thở theo nhu cầu của máy thở. Kích hoạt trong PAV tương tự như các chế độ hỗ trợ thông thường nhưng trong NAVA, EAdi kích hoạt máy thở. PAV cũng đo các cơ chế hô hấp thông qua phần mềm chuyên dụng. Một số nghiên cứu lâm sàng cho thấy PAV và NAVA cải thiện đáng kể sự đồng bộ giữa bệnh nhân và máy thở. Cụ thể là những nỗ lực không hiệu quả, việc mở van thở chậm hoặc sớm và hỗ trợ máy thở quá mức được giảm thiểu đáng kể [10,51-55]. Lý do cho sự đồng bộ bệnh nhân – máy thở được cải thiện là mối liên kết chặt chẽ giữa nỗ lực của bệnh nhân và hỗ trợ máy thở: bệnh nhân giữ được sự kiểm soát đáng kể về nhịp thở và thể tích khí lưu thông. Ngay cả ở mức độ hỗ trợ cao, các phản hồi tiêu cực từ bộ kiểm soát hô hấp giảm thiểu rủi ro cho thể tích khí lưu thông quá mức, bảo vệ khỏi sự quá căng phế nang và thông khí quá mức [53,56].
Kết luận
MV hỗ trợ cung cấp những lợi thế đáng kể so với MV kiểm soát nhưng cần chú ý đến sự hiện diện của mất đồng bộ bệnh nhân – máy thở. Mất đồng bộ bệnh nhân – máy thở là phổ biến; nó có thể xảy ra ở bất kỳ giai đoạn nào của chu kỳ hô hấp và có thể là do sự khác biệt về thời gian hoặc sự trợ giúp của máy thở/sự khác biệt về nhu cầu hô hấp giữa bệnh nhân và máy thở. Nó có liên quan đến nhiều tác dụng không mong muốn và, có thể ảnh hưởng xấu đến kết quả. Tiêu chuẩn vàng cho sự công nhận của họ là ghi nhận về nỗ lực của bệnh nhân. Tuy nhiên, trong một số trường hợp, kiểm tra cẩn thận màn hình máy thở cùng với hình ảnh lâm sàng của bệnh nhân là đủ để bác sĩ nhận ra mất đồng bộ bệnh nhân – máy thở. Máy thở hiện đại cung cấp một số cài đặt có thể sửa đổi để cải thiện tương tác bệnh nhân – máy thở. Các chế độ thông khí tỷ lệ mới cũng rất hữu ích trong việc cải thiện tương tác bệnh nhân – máy thở.





