Bài viết Tìm hiểu về đa ối: Căn nguyên, chẩn đoán và quản lý được biên dịch bởi Bs Vũ Tài từ sách Đa ối: Căn nguyên, chẩn đoán và quản lý của tác giả Ron Beloosesky, MD, Michael G Ross, MD.
1. GIỚI THIỆU
Đa ối (Polyhydramnios hay hydramnios) là tình trạng quá nhiều nước ối. Nó liên quan đến việc gia tăng nguy cơ các kết cục thai kỳ bất lợi khác nhau, bao gồm sinh non, nhau bong non và dị tật thai nhi [ 1-3 ].
Đa ối nên được nghi ngờ trên lâm sàng khi kích thước tử cung lớn so với tuổi thai (chiều cao tử cung [cm] lớn hơn số tuần tuổi thai> 3). Chẩn đoán được đưa ra trước sinh dựa trên siêu âm cho thấy quá nhiều nước ối (AFV) bằng kỹ thuật định lượng không xâm lấn, chẳng hạn như chỉ số ối >24 cm hoặc túi ối sâu nhất >8 cm.
Chủ đề này sẽ thảo luận về các vấn đề liên quan đến đa ối. Các phương pháp đánh giá thể tích dịch ối (AFV) được xem xét riêng. (See “Assessment of amniotic fluid volume”.)
2.TỶ LỆ MẮC BỆNH
Nhìn chung, tỷ lệ mắc đa ối ở quần thể sản khoa chung dao động từ 1 đến 2 % [ 4-8 ]. Tỷ lệ được báo cáo bị ảnh hưởng nhiều bởi tuổi thai tại thời điểm kiểm tra siêu âm (sinh non cao hơn, già tháng thấp hơn), quần thể được nghiên cứu (nguy cơ thấp hay cao, khám siêu âm sàng lọc hay được chỉ định, trước sinh hoặc trong khi sinh) và sự khác nhau trong tiêu chuẩn chẩn đoán ( sử dụng chỉ số ối so với túi ối sâu nhất).
Trong một loạt hơn 93.000 trường hợp mang thai đơn sinh trong vòng 6 năm tại một bệnh viện duy nhất, đa ối được chẩn đoán trong quá trình siêu âm trước sinh với tỷ lệ 0,7% và được mô tả là nhẹ, trung bình hoặc nặng tương ứng ở 66, 22 và 12% [ 5 ].
3. SINH LÝ
Thể tích nước ối phản ánh sự cân bằng giữa sản xuất dịch và sự dịch chuyển dịch ra khỏi túi ối. Cơ chế phổ biến nhất gây đa ối là giảm khả năng nuốt của thai nhi và tăng đi tiểu [ 9-11 ].
Cơ chế cân bằng nội môi, chẳng hạn như hấp thụ trong màng ối (dịch chuyển nước ối qua màng ối vào tuần hoàn thai nhi), hoạt động để duy trì thể tích nước ối; những cơ chế này tỏ ra thành công hơn trong việc ngăn ngừa đa ối hơn là ngăn ngừa thiểu ối. (See “Physiology of amniotic fluid volume regulation”.)
4. CĂN NGUYÊN
Đa ối có thể là vô căn hoặc liên quan đến nhiều loại rối loạn bào thai, bao gồm:
• Bất thường cấu trúc bào thai, bất thường nhiễm sắc thể, các khối u
• Tình trạng cung lượng tim thai nhi cao (ví dụ, bất kỳ tình trạng nào dẫn đến thiếu máu)
• Hội chứng truyền máu song thai (TTTS)
• Mẹ bị đái tháo đường
• Rối loạn thần kinh cơ bào thai cản trở khả năng nuốt
• Nhiễm trùng bào thai (ví dụ: parvovirus B19)
• Hội chứng Bartter thai nhi
Dị tật thai nhi (thường liên quan đến hội chứng hoặc bất thường di truyền cơ bản) là căn nguyên phổ biến nhất gây đa ối nặng, trong khi đái tháo đường ở mẹ, đa thai và các yếu tố vô căn thường liên quan đến các trường hợp nhẹ hơn.
4.1.Dị tật thai nhi và các khối u
Dị tật thai nhi chiếm khoảng một phần ba các trường hợp mang thai đơn bị đa ối [ 12 ].
Đa ối có liên quan đến dị tật thai nhi ở hầu hết các hệ cơ quan. Các dị thường phổ biến nhất cản trở quá trình nuốt và/hoặc hấp thụ dịch của thai nhi [ 13,14 ]. Giảm khả năng nuốt có thể do tắc nghẽn đường tiêu hóa nguyên phát (ví dụ: tá tràng, thực quản hoặc chít hẹp ruột đoạn trên), rối loạn thần kinh cơ (ví dụ, thai vô sọ, loạn dưỡng trương lực cơ), hoặc tắc nghẽn thứ phát đường tiêu hóa (ví dụ: thận loạn sản 1 bên lan tỏa, khối u lớn ở lồng ngực, thoát vị cơ hoành).
Đôi khi, nhiều con đường tham gia vào quá trình sản xuất quá nhiều nước ối. Ví dụ, u trung bì phôi thận bẩm sinh liên quan đến đa ối ở khoảng 70% trường hợp và góp phần vào tỷ lệ sinh non cao (25%).
Nước ối tăng có thể được cho là tăng sản xuất nước tiểu do tăng tưới máu thận, giảm hấp thu ở đường tiêu hóa do chèn ép ruột, hoặc khối u tiết prostaglandin dẫn đến đa niệu gây tăng calci máu [15 ]. Hiếm khi xảy ra suy tim và phù thai [ 16 ].
4.2.Thể lệch bội
Sự kết hợp giữa thai chậm tăng trưởng và đa ối thể gợi ý trisomy 18; thường có các dấu hiệu khác trên siêu âm của trisomy 18. Quá nhiều nước ối trong hội chứng này có thể liên quan đến khó nuốt hoặc các bất thường về đường ruột. (See “Sonographic findings associated with fetal aneuploidy”, section on ‘Trisomy 18’.)
Các thể lệch bội khác cũng liên quan đến đa ối, thường gặp nhất là trisomy 21, có khả năng liên quan đến các trường hợp chít hẹp tá tràng. (See “Sonographic findings associated with fetal aneuploidy”, section on ‘Trisomy 21 (Down syndrome)’.)
4.3.Tình trạng cung lượng tim cao
Tình trạng cung lượng tim thai cao có thể dẫn đến tăng sản xuất nước tiểu của thai nhi. Thiếu máu là một nguyên nhân phổ biến gây tình trạng cung lượng tim cao ở thai nhi và có thể do bất đồng miễn dịch, nhiễm parvovirus B19, xuất huyết mẹ-thai nhi lớn hoặc mạn tính, alpha-thalassemia, tan máu thứ phát do thiếu hụt glucose-6-phosphate dehydrogenase và các rối loạn khác [ 17 ]. Tình trạng cung lượng tim cao cũng có thể do shunt động tĩnh mạch (ví dụ, u quái vùng cùng cụt, TTTS).
4.4.Hội chứng truyền máu song thai
Đa thai chiếm tới 10% trường hợp đa ối. Trong đa thai một màng đệm, liên tục đa ối/thiểu ối gợi ý nhiều nhất đến TTTS. (See “Twin-twin transfusion syndrome and twin anemia polycythemia sequence: Screening, prevalence, pathophysiology, and diagnosis”.)
Đái tháo đường ở mẹ – Đái tháo đường ở mẹ chiếm 8 đến 25% các trường hợp thai nghén bị đa ối [ 18 ]. Cơ chế gây đa ối trong thai kỳ biến chứng bởi đái tháo đường ở mẹ không rõ ràng. Tăng đường huyết thai nhi dẫn đến đa niệu là một nguyên nhân có khả năng và được hỗ trợ bởi quan sát thấy đa ối thường liên quan đến nồng độ hemoglobin glycated (A1C) của mẹ cao và thai to[ 19,20 ]. Khả năng nuốt của thai nhi giảm hoặc sự mất cân bằng trong dịch chuyển nước giữa các khoang của mẹ và thai ở thai kỳ bị đái tháo đường là những cơ chế khác có thể xảy ra.
Một nghiên cứu hồi cứu bao gồm 1545 bệnh nhân bị đa ối phát hiện chỉ có 8,5% số trường hợp có thể là do đái tháo đường và những bệnh nhân này thường bị đa ối nhẹ (được định nghĩa là chỉ số ối từ 26,0 đến 35,9 cm) [ 18 ]. Các nhà nghiên cứu khác đã chứng minh rằng những trường hợp mang thai có nghiệm pháp dung nạp glucose bình thường xuất hiện đa ối và thai nhi tăng trưởng nhanh có nguy cơ các biến chứng ở mẹ và trẻ sơ sinh cao hơn, trong khi đa ối đơn thuần không có thai tăng trưởng nhanh làm tăng nguy cơ biến chứng khi sinh mà không tăng tỷ lệ mắc bệnh sơ sinh [ 21 ].
4.5.Hội chứng Bartter
Loại hội chứng Bartter trước sinh phổ biến nhất là một rối loạn ống thận hiếm gặp di truyền lặn trên nhiễm sắc thể thường liên quan đến tình trạng nhiễm kiềm hạ kali máu ở ống thận trong tử cung. Kết quả, thai nhi xuất hiện đa niệu và đa ối sau đó từ 24 đến 30 tuần tuổi thai. Trẻ sơ sinh có biểu hiện đa niệu sau sinh và mất muối thận kéo dài, cần điều trị suốt đời.
Một dạng nặng nhưng thoáng qua của hội chứng Bartter trước sinh được cho là do đột biến ở MAGED2, nằm trên nhiễm sắc thể X và dường như rất cần thiết cho sự tái hấp thu muối ở thận thai nhi và duy trì cân bằng nội môi nước ối bình thường [ 22 ]. Rối loạn trên nhiễm sắc thể X này khởi phát đa ối nặng rất sớm (trung bình từ 19 đến 20 tuần tuổi thai), thường dẫn đến sinh non (trung bình từ 22 đến 34 tuần tuổi thai), nhưng các dấu hiệu và triệu chứng của rối loạn chức năng thận sẽ tự hết sau khi sinh. (See “Bartter and Gitelman syndromes”.)
4.6.Các trường hợp vô căn
Khoảng 40% đa ối là vô căn [ 12 ]. Sau khi sinh, một bất thường được chẩn đoán lên tới 25% các trường hợp được xem là vô căn trước khi sinh [ 12,23-25 ]. Thiếu máu thai nhi, hội chứng Bartter, nhiễm trùng và rối loạn thần kinh cơ giải thích cho một số trường hợp được coi là vô căn trước sinh và cần được xem xét trong chẩn đoán phân biệt nếu đã loại trừ bất thường cấu trúc và đái tháo đường mẹ, mặc dù hội chứng Bartter và các bệnh thần kinh cơ khá hiếm gặp và nhiễm trùng ( TORCH [toxoplasmosis, khác, rubella, cytomegalovirus, và herpes simplex virus], parvovirus) hiếm khi liên quan đến đa ối đơn thuần.
Trong một nghiên cứu quan sát hồi cứu trên 294 trường hợp mang thai đơn bị đa ối và sàng lọc huyết thanh để tìm nhiễm trùng TORCH và parvovirus B19, chỉ có hai bệnh nhân có kết quả xét nghiệm dương tính với parvovirus và chỉ một bệnh nhân nhiễm toxoplasmosis [ 26 ]. Trong số những bệnh nhân này, 72% được chẩn đoán đa ối vô căn, 13% mắc đái tháo đường, 5% bị tổn thương đường tiêu hóa tắc nghẽn, 0,3% bị bất đồng miễn dịch Rh và 1% bị bất thường nhiễm sắc thể hoặc hội chứng di truyền.
5. DẤU HIỆU LÂM SÀNG
Đa ối biểu hiện với kích thước tử cung lớn so với tuổi thai hoặc là một phát hiện tình cờ khi khám siêu âm trước sinh.
Sự gia tăng thể tích nước ối thường không có triệu chứng, nhưng khó thở dai dẳng, kích thích tử cung và các cơn co, và khó chịu ở bụng có thể xảy ra khi căng giãn tử cung nặng. Các triệu chứng có thể liên quan đến các yếu tố cơ học do tử cung quá lớn và áp lực nước ối cao [ 27,28 ].
6. CHẨN ĐOÁN
Chẩn đoán đa ối dựa trên hình ảnh siêu âm về sự gia tăng thể tích nước ối. Chúng tôi đồng thuận với các khuyến cáo từ hội đồng đồng thuận tại hội thảo hình ảnh thai nhi [ 29 ] và được xác nhận bởi Hiệp hội Y học Bà mẹ-Thai nhi [ 30 ], đề xuất sử dụng một trong các ngưỡng sau để chẩn đoán đa ối:
• Túi ối sâu nhất (SDP) >8 cm, hoặc
• Chỉ số ối (AFI) >24 cm
Nó cũng có thể được phân loại là nhẹ, trung bình hoặc nặng ( bảng 1 ).
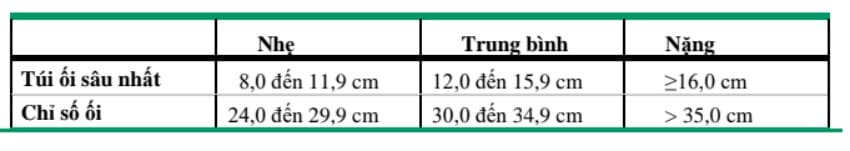
Mặc dù ban đầu có thể đưa ra đánh giá định tính như đa ối nhẹ, trung bình hoặc nặng, nhưng chúng tôi khuyến cáo nên sử dụng phương pháp định lượng vì nó cung cấp con số cụ thể có thể được so sánh qua các lần kiểm tra nối tiếp. Cả SDP và AFI đều là các tiêu chuẩn được chấp nhận để chẩn đoán và quản lý lâm sàng. Mặc dù các xét nghiệm này thực hiện tương đối kém so với các phép đo định lượng bằng cách sử dụng phương pháp pha loãng thuốc màu (thực hiện trong nghiên cứu), chúng có liên quan đến việc tăng nguy cơ kết cục bất lợi và do đó có lợi ích trên lâm sàng.
Dường như SDP chẩn đoán quá mức đa ối so với AFI. Tuy nhiên, cần lưu ý, AFI có thể chẩn đoán quá mức khi so sánh với SDP [ 31 ].
7. ĐÁNH GIÁ SAU CHẨN ĐOÁN
Đánh giá sau đây thích hợp nhất cho song thai 2 màng đệm và đơn thai không phù. Trong song thai một màng đệm với liên tục đa ối / thiểu ối, hội chứng truyền máu song thai là chẩn đoán có khả năng nhất và được xem xét riêng. (See “Twin-twin transfusion syndrome and twin anemia polycythemia sequence: Screening, prevalence, pathophysiology, and diagnosis” and “Twin-twin transfusion syndrome: Management and outcome”.)
Cách tiếp cận để xác định căn nguyên gây đa ối:
• Có được bệnh sử chi tiết để đánh giá các bệnh di truyền liên quan đến đa ối. Ví dụ, co cứng khớp bẩm sinh thường biểu hiện trong ba tháng giữa với đa ối và co cứng nhiều khớp bẩm sinh, cần được xác định bằng siêu âm. Hơn 150 hội chứng di truyền có liên quan đến co cứng khớp bẩm sinh; đa số các trường hợp là di truyền lặn hoặc đột biến mới. Nếu nghi ngờ, bệnh nhân nên được chuyển đến bác sĩ chuyên khoa di truyền để kiểm tra phả hệ ba thế hệ và cha mẹ.
Ở những bệnh nhân mà tiền sử bản nhân / gia đình gợi ý thiếu máu di truyền (ví dụ, alpha-thalassemia) hoặc lỗi chuyển hóa bẩm sinh, xét nghiệm tìm rối loạn liên quan được chỉ định. (See “Prenatal screening and testing for hemoglobinopathy” and “Diagnosis and management of glucose-6-phosphate dehydrogenase (G6PD) deficiency”, section on ‘Pregnancy’ and “Inborn errors of metabolism: Identifying the specific disorder”.)
• Đánh giá tình trạng phù thai – Nếu đa ối kèm theo phù thai, ưu tiên đánh giá nguyên nhân miễn dịch hoặc không do miễn dịch. Thiếu máu thai nhi là một nguyên nhân phổ biến gây phù và có cả nguyên nhân miễn dịch và không do miễn dịch. (See “Nonimmune hydrops fetalis”, section on ‘Postdiagnostic evaluation’.)
• Đánh giá dị tật thai nhi – Nên thực hiện đánh giá siêu âm toàn diện để tìm dị tật thai nhi. Khả năng xác định căn nguyên gây đa ối trước sinh tương quan với mức độ đa ối. Trong một nghiên cứu, căn nguyên chỉ được xác định ở 17% các trường hợp mang thai bị đa ối nhẹ nhưng ở 91% những trường hợp bị đa ối trung bình hoặc nặng [ 4 ]. Trong một nghiên cứu khác, tần suất trẻ sơ sinh bất thường trong tình trạng đa ối nhẹ, vừa và nặng lần lượt là 8, 12 và 31% [ 5 ]. Nhìn chung, 80% trẻ sơ sinh bất thường được phát hiện trước sinh. Các dị tật thường bị bỏ sót nhất bao gồm lỗ rò thực quản-khí quản, dị tật vách ngăn tim và hở hàm ếch.
Trong các trường hợp đa ối với nghi ngờ chít hẹp thực quản (bóng dạ dày thai nhi nhỏ hoặc không thể nhìn thấy được), nồng độ gamma-glutamyl transpeptidase và alpha-fetoprotein trong nước ối tăng gợi ý chẩn đoán và có thể được thực hiện tại thời điểm chọc dịch ối để nghiên cứu di truyền [ 32 ].
• Đo tốc độ sau tâm thu (PSV) động mạch não giữa (MCA) – Chúng tôi khuyến cáo nên đo MCA-PSV ở lần đánh giá ban đầu của tất cả các trường hợp đa ối vô căn, ngay cả khi không có phù thai. Mặc dù phù thai có trước đa ối trong phần lớn các trường hợp đa ối liên quan đến thiếu máu thai nhi, chúng tôi đã gặp các trường hợp thiếu máu thai trong đó đa ối có trước khi xuất hiện phù thai. Nếu MCA- PSV > 1,5 lần mức trung bình, chúng tôi khuyến cáo nên kiểm tra các nguyên nhân miễn dịch và không do miễn dịch gây thiếu máu thai nhi (See “Nonimmune hydrops fetalis”, section on ‘Postdiagnostic evaluation’.)
• Thực hiện tư vấn di truyền và nghiên cứu di truyền thai nhi – Chúng tôi khuyến cáo nên tư vấn di truyền và thực hiện microarray thai nhi, đặc biệt nếu kết quả sẽ ảnh hưởng đến việc quản lý thai nghén, khi:
• Một dị tật bẩm sinh được phát hiện, hoặc
• Trong tất cả các trường hợp đa ối nặng (bao gồm cả những trường hợp đa ối đơn thuần)
Chúng tôi khuyến cáo sử dụng microarray trên tế bào ối vì nguy cơ bất thường nhiễm sắc thể tăng lên khi có bất thường, khả năng không phát hiện được các bất thường khi siêu âm và nguy cơ chọc ối thấp để lấy nước ối phân tích di truyền. Trong những trường hợp đa ối có kèm theo bất thường mà không có tăng nguy cơ bất thường nhiễm sắc thể rõ ràng (ví dụ: chít hẹp hỗng tràng), chúng tôi thực hiện tư vấn di truyền để quyết định làm microarray hoặc các xét nghiệm di truyền khác.
Trong các trường hợp đa ối nặng với một microarray bình thường và siêu âm phát hiện bất thường, giải trình tự gen có thể phát hiện ra bất thường di truyền có ý nghĩa lâm sàng [ 33,34 ]. Ví dụ, hội chứng Noonan thường liên quan đến chứng đa ối, cũng như các bất thường khác, và có thể được chẩn đoán bằng giải trình tự gen. (See “Prenatal genetic evaluation of the fetus with anomalies or soft markers”.)
Việc nghiên cứu di truyền có nên được thực hiện trong trường hợp không có dị tật thai nhi hoặc đa ối nặng hay không vẫn còn tranh cãi vì khả năng lệch bội thấp hơn trong bối cảnh này [ 5 ].
Tuy nhiên, một nghiên cứu sử dụng microarray để phân tích di truyền đã báo cáo gần 10% thai nhi (46/464) có chỉ số ối> 25 cm có bất thường di truyền sau khi khám siêu âm thai chi tiết bình thường [ 35 ]. Các bất thường bao gồm vi xóa đoạn/ vi lặp đoạn (15 trường hợp), trisomy 21 (10 trường hợp), trisomy 18 (10 trường hợp), lệch bội nhiễm sắc thể giới tính (8 trường hợp), tetrasomy12 p (2 trường hợp) và di truyền đơn gen 14 (1 trường hợp). Trong các trường hợp đa ối trong tam cá nguyệt thứ hai mà không có dị tật thai nhi hoặc đa ối nặng, chúng tôi khuyến cáo nên giới thiệu đến tư vấn y học mẹ-thai và/hoặc di truyền.
• Xem xét hội chứng Bartter – Đối với những trường hợp mang thai là nam giới và đa ối nặng không rõ nguyên nhân trong ba tháng giữa, đặc biệt với tiền sử đa ối nặng trước đó, nên tiến hành nghiên cứu di truyền để xác định các đột biến ở MAGED2, nguyên nhân gây ra hội chứng Bartter trước sinh [ 22 ]. Chẩn đoán chính xác trước khi sinh có thể tránh điều trị có hại tiềm tàng cho trẻ sinh non. (See “Bartter and Gitelman syndromes”, section on ‘Prenatal diagnosis’.)
• Sàng lọc đái tháo đường cho mẹ nếu không được thực hiện trước đó. (See “Diabetes mellitus in pregnancy: Screening and diagnosis”.)
Nhiễm trùng bẩm sinh có thể liên quan đến các dấu hiệu hoặc triệu chứng nhiễm trùng ở mẹ và/hoặc các bất thường của thai nhi (ví dụ: phù, chậm tăng trưởng, gan lách to, não thất to, vôi hóa nội sọ và trong ổ bụng, ruột thai nhi tăng âm, cổ chướng). Trong trường hợp không có các dấu hiệu và triệu chứng của mẹ hoặc dấu hiệu ở thai nhi (ngoại trừ đa ối), nhiễm trùng bẩm sinh (rubella, cytomegalovirus, toxoplasmosis, giang mai) có lẽ không phải là nguyên nhân gây đa ối đơn thuần [26,36 ].
8. KẾT CỤC
Nhiều trường hợp đa ối vô căn tự khỏi , đặc biệt nếu nhẹ [ 1,37 ]. Tuy nhiên, đa ối có liên quan đến việc gia tăng nguy cơ có kết cục bất lợi bên cạnh các kết cục kém liên quan đến các bất thường hình thái thai đi kèm. [ 38-40 ]:
• Suy hô hấp của mẹ
• Ối vỡ non
• Chuyển dạ và sinh non
• Ngôi thai bất thường
• Thai to (có khả năng dẫn đến đẻ khó do kẹt vai)
• Sa dây rốn
• Nhau bong non khi ối vỡ
• Giai đoạn 2 chuyển dạ kéo dài hơn
• Đờ tử cung sau sinh
Những biến chứng này làm tăng nguy cơ sinh mổ và nhập viện vào đơn vị chăm sóc đặc biệt cho trẻ sơ sinh.
Suy hô hấp mẹ, ngôi thai bất thường, sa dây rốn và đờ tử cung sau sinh liên quan đến tình trạng tử cung căng giãn quá mức do quá nhiều nước ối.
Tiên lượng thai nhi / trẻ sơ sinh
Chuyển dạ sớm và ối vỡ non có thể dẫn đến sinh non tự phát; sinh non ở những thai kỳ bị ảnh hưởng cũng có thể do can thiệp điều trị để quản lý các biến chứng thai kỳ. (See “Short-term complications of the preterm infant” and “Long-term outcome of the preterm infant” and “Incidence and mortality of the preterm infant”.)
Nguy cơ tử vong chung ở thai nhi và trẻ sơ sinh dường như tăng lên ở các thai kỳ bị đa ối so với thai kỳ có nước ối bình thường, ngay cả sau khi đã điều chỉnh các yếu tố gây nhiễu, chẳng hạn như dị tật bẩm sinh và đái tháo đường ở mẹ [ 7,41-45 ]. Nguy cơ tương đối dường như tăng lên khi mức độ đa ối tăng. Nguy cơ tử vong tuyệt đối phụ thuộc vào căn nguyên. Ví dụ, sự kết hợp giữa thai nhỏ so với tuổi thai và đa ối có tiên lượng đặc biệt kém (bao gồm tử vong chu sinh) do tỷ lệ bất thường cấu trúc và nhiễm sắc thể thai nhi cao trong bối cảnh này [ 46,47 ].
Các di chứng bất lợi ở trẻ bị đa ối mà những cái khác bình thường khi siêu âm tử cung có thể liên quan đến các căn nguyên tiềm ẩn, chẳng hạn như dị tật, hội chứng di truyền và rối loạn thần kinh được xác định lần đầu tiên sau sinh [ 48 ].
9. QUẢN LÝ ĐA ỐI Ở TRƯỜNG HỢP MANG THAI ĐƠN
Quản lý song thai được xem xét riêng. (See “Twin-twin transfusion syndrome and twin anemia polycythemia sequence: Screening, prevalence, pathophysiology, and diagnosis” and “Twin-twin transfusion syndrome: Management and outcome”.)
Đa ối với căn nguyên có thể xác định được
• Căn nguyên nền cụ thể gây đa ối phải hướng dẫn việc giám sát thai nhi và bà mẹ trước sinh, quản lý trong khi sinh và thời điểm sinh. (Tham khảo các chủ đề về căn nguyên cụ thể.)
• Đối với những bệnh nhân bị đa ối nặng có triệu chứng, quản lý các triệu chứng ở mẹ tương tự như những bệnh nhân bị đa ối vô căn. (See ‘Patients with severe polyhydramnios’ below.)
Đa ối vô căn – Quản lý đa ối vô căn phụ thuộc vào tuổi thai, mức độ, và sự hiện diện của các triệu chứng.
Tất cả bệnh nhân – Chúng tôi thực hiện theo dõi thai trước sinh ở tất cả bệnh nhân bị đa ối vô căn:
• Đối với đa ối nhẹ đến trung bình, chúng tôi thực hiện trắc đồ sinh vật lý (BPP) với thành phần nonstress test (NST) khi chẩn đoán và sau đó cứ mỗi 1 đến 2 tuần cho đến tuần thứ 37, và sau đó hàng tuần từ tuần thứ 37 đến khi sinh.
• Đối với đa ối nặng, chúng tôi thực hiện BPP (bao gồm cả NST) hàng tuần từ khi chẩn đoán cho đến khi sinh. Khi diễn giải điểm số BPP, bác sĩ lâm sàng nên thận trọng khi kết luận tình trạng thai nhi khỏe mạnh với điểm số ranh giới (6/8) vì hai điểm về thể tích nước ối (AFV) trong những trường hợp này không đảm bảo.
Không có thử nghiệm ngẫu nhiên nào đánh giá liệu các thai kỳ phức tạp do đa ối vô căn có lợi từ bất kỳ phương pháp giám sát trước sinh nào hay không. Mặc dù không có dữ liệu nào cho thấy việc đánh giá như vậy làm giảm tỷ lệ tử vong chu sinh, với tăng nguy cơ kết cục thai kỳ bất lợi và tăng gấp hai đến năm lần nguy cơ tử vong chu sinh (bao gồm cả tử vong thai nhi [ 45 ]) trong những trường hợp này, chúng tôi thực hiện theo dõi thai trước sinh. Hiệp hội Y học Bà mẹ-Thai nhi (SMFM) không coi việc giám sát thai nhi trước sinh là bắt buộc ở những thai kỳ bị đa ối vô căn nhẹ và không có chỉ định giám sát nào khác [ 30 ].
Bệnh nhân không bị đa ối nặng – Bệnh nhân không bị đa ối nặng không phải là đối tượng để can thiệp vì họ thường không có các triệu chứng nặng liên quan đến đa ối, kết cục thai kỳ có thể không bị ảnh hưởng xấu và không có biện pháp can thiệp nào giúp cải thiện kết cục thai kỳ [ 30,49].
Bệnh nhân bị đa ối nặng – Đa ối nặng (chỉ số ối [AFI] >35 cm hoặc túi ối sâu nhất >16 cm) có thể khiến mẹ khó thở, khó chịu ở bụng và cơn co tử cung. Quyết định can thiệp phụ thuộc vào mức độ nặng của triệu chứng. Cách tiếp cận của chúng tôi được thảo luận dưới đây và được thể hiện trong lưu đồ ( lưu đồ 1).
Bệnh nhân không có triệu chứng và bệnh nhân có các triệu chứng nhẹ – Không chỉ định can thiệp để giảm lượng nước ối ở các bệnh nhân không có triệu chứng hoặc các bệnh nhân bị khó thở, khó chịu ở bụng và/hoặc kích thích tử cung nhẹ mà có thể dung nạp khá tốt, vì kết cục thai kỳ có thể không bị ảnh hưởng xấu và không có biện pháp can thiệp nào giúp cải thiện kết cục thai kỳ [ 30,49 ].
Bệnh nhân khó thở và/hoặc khó chịu ở bụng nặng
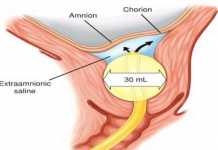
• Đối với những bệnh nhân bị đa ối nặng gây khó thở và/hoặc khó chịu ở bụng nặng (tức là ảnh hưởng đáng kể đến khả năng thực hiện các hoạt động bình thường trong cuộc sống hàng ngày của bệnh nhân), chúng tôi đề xuất chọc ối giải áp để bình thường hóa thể tích dịch. Mục đích là để giảm bớt sự khó chịu đáng kể cho mẹ và tránh sinh non do điều trị đối với các chỉ định của mẹ [ 49,50 ]. Không có bằng chứng cho thấy thủ thuật này kéo dài thai kỳ bằng cách giảm nguy cơ chuyển dạ và sinh non tự nhiên. Chúng tôi cũng sử dụng 1 liệu trình betamethasone trước sinh . Quy trình chọc ối giải áp ban đầu và sau đó được mô tả dưới đây. (See ‘Amnioreduction (decompression amniocentesis)’ below.)
Không có thử nghiệm ngẫu nhiên nào so sánh trực tiếp việc chọc ối giải áp với xử trí bảo tồn hoặc indomethacin để quản lý đa ối. Trong một nghiên cứu lớn nhất về chọc ối giải áp để điều trị đa ối (n = 138 bệnh nhân), 46% bệnh nhân cần> 1 thủ thuật, thời gian trung bình từ thủ thuật đầu tiên cho đến khi sinh là 26 ngày, và 4% thủ thuật có liên quan đến sinh non ngoài kế hoạch trong vòng 48 giờ, đó là biến chứng duy nhất trong nghiên cứu này (không có trường hợp nào bị viêm màng ối hoặc nhau bong non) [ 49 ]. Mặc dù dữ liệu về việc giảm triệu chứng không được thu thập, theo giai đoạn, các tác giả cảm thấy rằng bệnh nhân thường có đáp ứng tốt.
SMFM khuyến cáo nên xem xét chọc ối giải áp để làm giảm khó chịu, khó thở nặng ở mẹ hoặc cả hai trong trường hợp đa ối nặng và khuyến cáo không sử dụng indomethacin với mục đích duy nhất là giảm nước ối trong những trường hợp này vì lo ngại các biến chứng sơ sinh do thuốc [ 30 ].
Bệnh nhân có chuyển dạ sớm/cơn co tử cung thường xuyên
• Tuổi thai <32 tuần và không đáp ứng các tiêu chí về triệu chứng để chọc ối giải áp – Đối với những bệnh nhân chuyển dạ sớm/kích thích tử cung gây khó chịu nhưng không khó thở hoặc khó chịu ở bụng nặng cần chọc ối giải áp, chúng tôi chỉ dùng một đợt ngắn (<48 giờ) indomethacin để giảm cơn co tử cung và có khả năng trì hoãn sinh. Một ưu điểm khác của indomethacin là nó có thể làm giảm AFV. Chúng tôi cũng dùng một đợt betamethasone trước sinh , vì nguy cơ sinh non.
• Tuổi thai <32 tuần và đáp ứng các tiêu chí về triệu chứng để chọc ối giải áp- Đối với những bệnh nhân <32 tuần được chọc ối giải áp vì khó thở hoặc khó chịu ở bụng nặng và những người có cơn co tử cung trước, trong hoặc sau khi làm thủ thuật, chúng tôi dùng đợt ngắn (48 giờ) indomethacin trước và/hoặc sau thủ thuật để tận dụng cả tác dụng giảm co và điều trị của nó (giảm tỷ lệ tích tụ lại nước ối và đa ối tái phát). Chọc ối giải áp cũng có thể làm giảm hoạt động của tử cung [ 51 ].
• >32 và <34 tuần – Chúng tôi không sử dụng indomethacin để điều trị chuyển dạ sớm/kích thích tử cung gây khó chịu ở thai kỳ >32 và <34 tuần tuổi vì có khả năng gây tác dụng bất lợi cho thai nhi / trẻ sơ sinh. Chúng tôi sẽ dùng một loại thuốc giảm co khác (ví dụ: nifedipine hoặc một chất đồng vận thụ thể beta-2), nếu cần, để trì hoãn sinh và cho phép dùng một đợt betamethasone trước sinh .
• >34 tuần – Chúng tôi không dùng bất kỳ loại thuốc giảm co nào để điều trị chuyển dạ sớm/ kích thích tử cung gây khó chịu ở thai kỳ >34 tuần. Theo hướng dẫn chuẩn, chúng tôi sẽ dùng một liệu trình betamethasone ban đầu cho những thai kỳ từ 34+0 đến 36+6 tuần tuổi có nguy cơ sinh non cao trong vòng bảy ngày. (See “Antenatal corticosteroid therapy for reduction of neonatal respiratory morbidity and mortality from preterm delivery”.)
Liều và tác dụng phụ của indomethacin được thảo luận bên dưới. (Xem ‘Indomethacin’ bên dưới.) Bệnh nhân kháng trị – Chọc ối giải áp sẽ làm giảm các triệu chứng của mẹ ngay lập tức, nhưng nước ối có thể tích tụ trở lại trong vòng vài ngày đến vài tuần.
• Tuổi thai <34 tuần – Đối với những bệnh nhân có các triệu chứng nặng do đa ối tái phát sau lần chọc ối giải áp đầu, chúng tôi thực hiện thủ thuật thứ hai và dùng một đợt indomethacin ngắn (48 giờ) khác cho những bệnh nhân <32 tuần bị kích thích tử cung dai dẳng [ 30 ].
Nếu đa ối có triệu chứng nặng tái phát mặc dù đã chọc ối giải áp lần hai lúc <32 tuần, chúng tôi cân nhắc việc sử dụng indomethacin dài hơn để giảm thiểu nước ối tùy từng trường hợp cụ thể. Nếu dùng trong hơn 48 giờ, chúng tôi theo dõi thai nhi xem có bị đóng ống động mạch sớm không trong khoảng thời gian từ hai đến bảy ngày. (Xem ‘Indomethacin’ bên dưới.)
• Tuổi thai >34 tuần – Đối với những bệnh nhân đa ối có triệu chứng nặng >34 tuần trong đó hai lần chọc ối giải áp không thành công do tích tụ dịch nhanh, chúng tôi thảo luận về việc sinh non để giảm bớt sự khó chịu cho mẹ và đưa ra quyết định chung này cho từng trường hợp cụ thể.
Chọc hút nước ối (chọc ối giải áp) – Không có sự đồng thuận về việc loại bỏ bao nhiêu nước ối, tốc độ loại bỏ nước ối hoặc sử dụng thuốc giảm co và kháng sinh. Chúng tôi không dùng kháng sinh dự phòng và chỉ bắt đầu dùng indomethacin như một loại thuốc giảm co ở những bệnh nhân có cơn co tử cung.
• Kỹ thuật – Một kỹ thuật phổ biến là:
• Làm sạch vị trí chọc hút bằng bông ngoại khoa và sau đó gây tê tại chỗ da và mô dưới da.
• Dưới hướng dẫn của siêu âm liên tục để giảm thiểu sự va chạm vào thai nhi, đưa một cây kim 18-gauge với đầu hướng về phía dịch ối. Thông thường, rất hữu ích khi đưa mũi kim hướng về phía chân với đốc kim hướng về phía đầu bệnh nhân để kim có thể tiến vào sâu
Đa ối: Căn nguyên, chẩn đoán và quản lý – UpToDate
hơn khi tử cung trở nên nhỏ hơn với sự giải áp.
• Gắn dây truyền dịch có khóa ba chạc vào kim và nối với bình hút chân không. Dịch có thể được hút trực tiếp vào bình chứa hoặc cách khác, loại bỏ dịch bằng bơm tiêm 50 mL dưới sự hút có kiểm soát, nhưng việc này có thể gây mệt mỏi khi có nhiều dịch.
• Một hướng dẫn hợp lý là loại bỏ không quá 2,0 đến 2,5 lít trong một lần chọc và loại bỏ dịch không nhanh hơn 1000 mL trong 20 phút, mặc dù tốc độ 100 đến 125 mL / phút đã được báo cáo [ 49 ].
• Kết thúc thủ thuật khi AFV trở về bình thường (thường AFI 15 đến 20 cm hoặc túi ối sâu nhất < 8 cm) [ 27 ]. Đôi khi, thủ thuật cần phải kết thúc sớm vì bệnh nhân khó chịu, tắc kim hoặc bong màng ối.
• Các biến chứng – Tỷ lệ biến chứng ở một nghiên cứu nhỏ nói chung là thấp, dao động từ 1 đến 10% các thủ thuật. Các biến chứng bao gồm chuyển dạ sớm và ối vỡ non, là những biến chứng thường gặp nhất và nhau bong non, nhiễm trùng dịch ối và giảm protein máu ít gặp hơn. [ 49,50,52 ].
• Theo dõi sau thủ thuật – Sau khi chọc ối giải áp, chúng tôi theo dõi AFV mỗi một đến ba tuần theo chỉ định với sự tiến triển và mức độ của quá trình tích tụ lại nước ối.
• Lặp lại thủ thuật – Lặp lại thủ thuật có thể được thực hiện bất kỳ lúc nào. Trung bình, hai thủ thuật cách nhau ít nhất một tuần là cần thiết để giảm AFV mạn tính, mặc dù một số bệnh nhân cầu nhiều thủ thuật hơn [ 50,52 ]. Một báo cáo ca bệnh bất thường đã mô tả 12 lần chọc ối giải áp trong 12 tuần đã loại bỏ tổng cộng 21.600 mL dịch; đứa trẻ được chẩn đoán mắc hội chứng West khi theo dõi 16 tháng sau sinh [ 24 ].
Indomethacin – SMFM khuyến cáo không dùng indomethacin với chỉ định duy nhất là giảm lượng nước ối [ 30 ]. Như đã nói ở trên, đối với thai <32 tuần tuổi có chuyển dạ sớm/kích thích tử cung, đôi khi chúng tôi sử dụng một đợt indomethacin ngắn (48 giờ), chủ yếu vì tác dụng giảm co. Đôi khi chúng tôi dùng một liệu trình dài hơn ở những bệnh nhân <32 tuần mà lần chọc ối thứ hai không thành công trong việc kiểm soát các triệu chứng. Giảm AFV là một lợi ích bổ sung, nhưng tác dụng bất lợi lên thai nhi là một mối quan tâm khi thuốc được dùng > 3 ngày và khi thuốc được dùng lúc > 32 tuần. (See ‘Patients with preterm labor/frequent uterine contractility’ above and ‘Refractory patients’ above.)
Mẹ dùng thuốc ức chế men tổng hợp prostaglandin làm giảm AFV ở thai kỳ có AFV ban đầu bình thường hoặc bất thường. Những thuốc này có thể kích thích bào thai tiết arginine vasopressin và tạo điều kiện thuận lợi cho đáp ứng chống bài niệu ở thận do vasopressin và giảm lưu lượng máu đến thận, do đó làm giảm lưu lượng nước tiểu thai nhi. Chúng cũng có thể làm giảm sản xuất hoặc tăng cường tái hấp thu dịch ở phổi [ 53 ].
• Liều lượng – Các phác đồ indomethacin khác nhau đã được sử dụng, nhưng cách tiếp cận phổ biến là liều khởi đầu 25 mg, uống bốn lần/ ngày và giới hạn điều trị đối với thai <32 tuần và với một đợt điều trị ngắn (48 giờ) [ 54 ].
• Tác dụng phụ đối với mẹ và thai – Các tác dụng phụ đối với mẹ, chẳng hạn như buồn nôn,
trào ngược thực quản, viêm dạ dày và nôn, chủ yếu được nghiên cứu ở những phụ nữ nhận thuốc để ức chế chuyển dạ sớm; tỷ lệ các tác dụng phụ ở quần thể này là 4%. Rối loạn chức năng tiểu cầu có thể xảy ra. Những thay đổi trong sinh lý tim mạch mẹ là rất ít. (See “Nonselective NSAIDs: Overview of adverse effects”.) ■
Mối lo lắng chính đối với thai khi sử dụng indomethacin là co thắt ống động mạch. Tác dụng phụ này dễ xảy ra hơn khi thời gian tiếp xúc với indomethacin vượt quá 72 giờ và khi tuổi thai >32 tuần.
Các tác dụng phụ khác có thể xảy ra đối với thai bao gồm viêm ruột hoại tử ở trẻ sơ sinh và xuất huyết não thất, nhưng những mối liên quan này còn nhiều tranh cãi. Ảnh hưởng của indomethacin đối với thai nhi/trẻ sơ sinh được thảo luận chi tiết hơn ở chuyên đề riêng. (See “Techniques for ripening the unfavorable cervix prior to induction” and “Induction of labor with oxytocin”.)
Quản lý chuyển dạ – Trong quá trình chuyển dạ, chúng tôi kiểm tra vị trí thai nhi thường xuyên để xác nhận việc duy trì ngôi đầu. Quá nhiều nước ối cho phép thai nhi di chuyển dễ dàng hơn, do đó có thể xảy ra hiện tượng chuyển sang ngôi mông, ngôi phức tạp hoặc ngôi ngang. Nhịp tim thai được theo dõi liên tục vì những thai này có nguy cơ bất thường cao hơn [ 55,56 ].
Ối vỡ tự nhiên có thể gây chèn ép tử cung nặng đột ngột với nguy cơ sa hoặc đứt dây rốn. Chọc ối giải áp từ từ qua cổ tử cung hoặc qua thành bụng dự phòng bằng kim khi đầu được cố định có thể ngăn ngừa những biến chứng này khi chuyển dạ. Nguy cơ sa dây rốn nên được xem xét nếu vỡ màng ối ở vị trí cao chỉ dự định để giải áp tử cung. Bấm ối có kiểm soát trong phòng mổ được thực hiện bằng cách dùng một kim nhỏ chọc thủng màng ối ở một hoặc nhiều vị trí, trong khi phẫu thuật viên thứ hai đang ổn định thai nhi ở ngôi đầu/ nằm dọc. Điều này giảm thiểu nguy cơ nước ối vọt ra và cho phép sinh mổ nhanh chóng trong trường hợp sa dây rốn. Tương tự, bấm ối nên được thực hiện giữa các cơn co tử cung, không phải trong cơn co, nếu có thể.
Thời điểm sinh – Mặc dù không có chống chỉ định tuyệt đối sử dụng oxytocin hoặc prostaglandin để làm chín muồi cổ tử cung và khởi phát chuyển dạ ở bệnh nhân đa ối, nhưng nên dùng những thuốc này một cách thận trọng. Có sự gia tăng rõ rệt tỷ lệ xuất huyết sau sinh liên quan đến đờ tử cung ở bệnh nhân đa ối; sử dụng các thuốc kích thích tử cung có thể làm tăng nguy cơ này và thuyên tắc ối [ 54,57 ]. Tuy nhiên, chúng tôi dùng prostaglandin để làm chín muồi cổ tử cung và oxytocin để khởi phát chuyển dạ, như được chỉ định trên lâm sàng. (See “Techniques for ripening the unfavorable cervix prior to induction” and “Induction of labor with oxytocin”.)
Thời điểm sinh bị ảnh hưởng bởi căn nguyên nền và mức độ nặng của đa ối:
• Đa ối nhẹ đến trung bình – Ở những bệnh nhân đa ối vô căn nhẹ đến trung bình ( bảng 1 ) và BPP bình thường, chúng tôi khởi phát chuyển dạ ở tuổi thai 39 đến 40 tuần vì nguy cơ thai chết dường như tăng đáng kể khi đủ tháng [ 45 ].
SMFM cho rằng chuyển dạ nên để xảy ra một cách tự nhiên khi đủ tháng đối thai phụ bị đa ối vô căn nhẹ [ 30 ]. Trường các bác sĩ Sản phụ khoa Hoa Kỳ khuyến cáo sinh lúc 39 + 0 đến 39 + 6 tuần trừ khi có thêm các biến chứng thai kỳ cần sinh sớm hơn [ 58 ]
• Đa ối nặng – Ở những bệnh nhân bị đa ối vô căn nặng, chúng tôi tiến hành khởi phát chuyển dạ ở tuần thứ 37 để giảm thiểu nguy cơ sa dây rốn và/hoặc nhau bong non trong trường hợp ối vỡ non tự nhiên. Chúng tôi thực hiện sinh sớm hơn tùy từng trường hợp cụ thể cho những bệnh nhân từ 34 đến 37 tuần có các triệu chứng không thể dung nạp được và những người không đáp ứng với các thủ thuật chọc ối giải áp.
Thai phụ bị đa ối vô căn nặng được khuyến cáo sinh tại trung tâm cấp ba vì những bất thường thai quan trọng về mặt lâm sàng có thể chưa được xác định trước sinh.
10. TÓM TẮT VÀ KHUYẾN CÁO
• Đa ối thường do thai nhi giảm nuốt hoặc tăng đi tiểu. Các căn nguyên phổ biến nhất là dị tật thai nhi và/hoặc rối loạn di truyền, mẹ bị đái tháo đường, đa thai và thiếu máu thai nhi. Nguyên nhân hiếm gặp bao gồm nhiễm virus bẩm sinh hoặc hội chứng Bartter. (See ‘Pathogenesis’ above and ‘Etiology’ above.)
• Nếu có dấu hiệu định tính về đa ối, chúng tôi đề nghị nên thực hiện một phép đo định lượng, chẳng hạn như chỉ số ối (AFI). Chúng tôi sử dụng túi ối sâu nhất (SDP) >8 cm hoặc AFI >24 cm để xác định đa ối. Các chỉ số định lượng được tiêu chuẩn hóa và cung cấp một số đo mà có thể được theo dõi khi kiểm tra định kỳ, mặc dù độ nhạy và giá trị dự đoán dương tính dưới mức tối ưu. (See ‘Diagnosis’ above.)
• Đánh giá siêu âm toàn diện được khuyến cáo để xác định xem có dị tật thai nhi hoặc phù thai hay không. Các đánh giá cận lâm sàng được đề xuất phụ thuộc vào kết quả siêu âm và có thể bao gồm sàng lọc đái tháo đường thai kỳ, xét nghiệm xuất huyết mẹ-thai nhi nếu nghi ngờ thiếu máu thai, xét nghiệm huyết thanh mẹ để xác định phơi nhiễm với các tác nhân nhiễm trùng (ví dụ: giang mai, parvovirus, cytomegalovirus, toxoplasmosis, rubella) và các xét nghiệm thích hợp đối với thiếu máu di truyền (ví dụ, alpha-thalassemia) hoặc các lỗi chuyển hóa bẩm sinh. (See ‘Post-diagnostic evaluation’ above.)
• Chúng tôi khuyến cáo nên thực hiện phân tích microarray thai nhi ở các trường hợp đa ối nặng hoặc nếu có các dị tật giải phẫu kèm theo, đặc biệt nếu kết quả sẽ ảnh hưởng đến việc xử trí.
Các phân tích sinh hóa nước ối có thể giúp chẩn đoán chứng chít hẹp thực quản và hội chứng Bartter. (See ‘Post-diagnostic evaluation’ above.)
• Kết cục thai kỳ phức tạp bởi đa ối thay đổi theo mức độ nặng và căn nguyên nền gây tích tụ dịch quá nhiều. Các biến chứng có thể xảy ra bao gồm tổn suy hô hấp mẹ, chuyển dạ sớm, ối vỡ non, ngôi thai bất thường, nhau bong non, và sa dây rốn và/hoặc đờ tử cung sau sinh. (See ‘Outcome’ above.)
• Chúng tôi giới hạn điều trị đa ối vô căn với các trường hợp mang thai đơn tử bị đa ối nặng (AFI >35 cm hoặc SDP >16 cm) và các triệu nặng (tức là ảnh hưởng đáng kể đến khả năng thực hiện các hoạt động bình thường trong cuộc sống hàng ngày của bệnh nhân).
• Đối với những bệnh nhân không có triệu chứng hoặc những bệnh nhân bị khó thở, khó chịu ở bụng và/hoặc kích thích tử cung nhẹ có thể dung nạp khá tốt, chúng tôi đề nghị nên tránh can thiệp giảm dịch ối (Grade 2C). (See ‘Asymptomatic patients and patients with mild symptoms’ above.)
• Đối với những bệnh nhân bị đa ối nặng gây khó thở và/hoặc khó chịu ở bụng đáng kể, chúng tôi đề nghị chọc ối giải áp thay vì indomethacin để bình thường hóa thể tích dịch (Grade 2C). Indomethacin có thể có các tác dụng bất lợi đối với thai nhi. Chúng tôi cùng dùng một liệu trình betamethasone trước sinh . (See ‘Patients with severe shortness of breath and/or -abdominal discomfort’ above and ‘Indomethacin’ above.)
• Đối với những bệnh nhân <32 tuần đã thực hiện chọc ối và có các cơn co tử cung trước, trong và sau khi thực hiện thủ thuật, chúng tôi đề nghị một đợt ngắn (48 giờ) indomethacin trước và/hoặc sau thủ thuật (Grade 2C). Điều này tận dụng cả tác dụng giảm co và điều trị của nó (làm giảm tỷ lệ tích tụ lại nước ối và đa ối tái phát). (See ‘Patients with preterm labor/frequent uterine contractility’ above.)
• Đối với những bệnh nhân <32 tuần bị đa ối nặng và chuyển dạ sớm/kích thích tử cung gây khó chịu nhưng không có khó thở hoặc khó chịu ở bụng đáng kể cần chọc ối giải áp, chúng tôi đề nghị chỉ một đợt ngắn (48 giờ) indomethacin để giảm hoạt động co tử cung và có thể trì hoãn sinh (Grade 2C). Một ưu điểm khác của indomethacin là nó có thể làm giảm thể tích nước ối. Chúng tôi cũng sử dụng một đợt betamethasone trước sinh vì nguy cơ sinh non. (See ‘Patients with preterm labor/frequent uterine contractility’ above.)
• Đa ối vô căn kháng trị (see ‘Refractory patients’ above):
Đa ối: Căn nguyên, chẩn đoán và quản lý – UpToDate
• Đối với những bệnh nhân có các triệu chứng nặng do đa ối tái phát sau lần chọc ối đầu, chúng tôi thực hiện lần chọc ối thứ 2 và dùng một đợt indomethacin ngắn (48 giờ) khác cho những người <32 tuần bị kích thích tử cung dai dẳng.
Nếu tình trạng đa ối có triệu chứng nặng tái phát mặc dù đã chọc ối lần hai lúc <32 tuần, chúng tôi cân nhắc dùng indomethacin dài hơn để giảm thiểu nước ối tùy từng trường hợp cụ thể. Nếu dùng > 48 giờ, chúng tôi theo dõi thai nhi xem có bị đóng ống động mạch sớm hay không trong khoảng thời gian từ hai đến bảy ngày.
• Đối với những bệnh nhân bị đa ối có triệu chứng nặng lúc > 34 tuần, trong đó 2 lần chọc ối không thành công do tích tụ lại dịch, chúng tôi thảo luận về việc sinh non để giảm bớt sự khó chịu cho mẹ và đưa ra quyết định chung này tùy từng trường hợp cụ thể.
Trong quá trình chuyển dạ, chúng tôi kiểm tra vị trí thai nhi thường xuyên bởi quá nhiều nước ối cho phép thai nhi di chuyển dễ dàng hơn, do đó có thể xảy ra hiện tượng chuyển sang ngôi mông, ngôi phức tạp hoặc ngôi ngang. Ối vỡ tự nhiên có thể gây chèn ép tử cung nặng đột ngột với nguy cơ sa hoặc đứt dây rốn. Chọc ối giải áp từ từ qua cổ tử cung hoặc qua thành bụng dự phòng bằng kim khi đầu được cố định có thể ngăn ngừa những biến chứng này khi chuyển dạ. (See ‘Labor management’ above.)
Thời điểm sinh phụ thuộc vào căn nguyên và mức độ đa ối. (See ‘Timing of delivery’ above.)
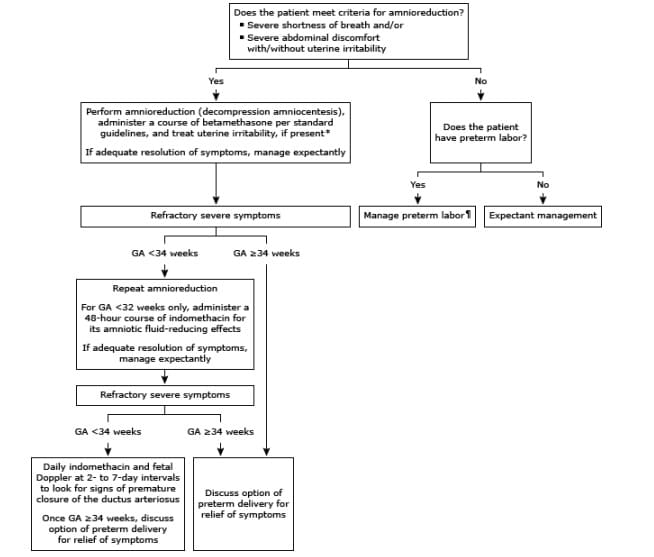
Đa ối nặng được định nghĩa là chỉ số ối >35 cm hoặc túi ối sâu nhất >16 cm. Các triệu chứng nặng có thể được định nghĩa là ảnh hưởng đáng kể đến khả năng thực hiện các hoạt động bình thường trong cuộc sống hàng ngày của bệnh nhân. Chọc ối giải áp làm giảm các triệu chứng ngay lập tức, nhưng nước ối có thể tích tụ lại trong vòng vài ngày đến vài tuần. Can thiệp làm giảm lượng nước ối không được chỉ định ở những bệnh nhân không có triệu chứng hoặc những bệnh nhân khó thở, khó chịu ở bụng và/hoặc kích thích tử cung nhẹ có thể dung nạp khá tốt.
GA: tuổi thai.
* Kích thích tử cung được điều trị giống như chuyển dạ sớm:
■ Đối với GA <32 tuần: Dùng indomethacin trong 48 giờ để giảm cơn co và tác dụng giảm nước ối của nó.
■ Đối với GA từ 32 đến <34 tuần: Dùng nifedipine hoặc thuốc giống giao cảm beta trong tối đa 48 giờ để giảm cơn co.
■ Đối với GA >34 tuần: Không dùng thuốc giảm co.
Dùng 1 liệu trình betamethasone theo hướng dẫn chuẩn, và
■ Đối với GA <32 tuần: Dùng indomethacin trong 48 giờ để giảm cơn co và tác dụng giảm nước ối của nó.
■ Đối với GA từ 32 đến <34 tuần: Dùng nifedipine hoặc thuốc giống giao cảm beta trong tối đa 48 giờ để giảm cơn co.
■ Đối với GA >34 tuần: Không dùng thuốc giảm co.
11. REFERENCES
1. Golan A, Wolman I, Sagi J, et al. Persistence of polyhydramnios during pregnancy–its significance and correlation with maternal and fetal complications. Gynecol Obstet Invest 1994; 37:18.
2. Many A, Hill LM, Lazebnik N, Martin JG. The association between polyhydramnios and preterm delivery. Obstet Gynecol 1995; 86:389.
3. Smith CV, Plambeck RD, Rayburn WF, Albaugh KJ. Relation of mild idiopathic polyhydramnios to perinatal outcome. Obstet Gynecol 1992; 79:387.
4. Hill LM, Breckle R, Thomas ML, Fries JK. Polyhydramnios: ultrasonically detected prevalence and neonatal outcome. Obstet Gynecol 1987; 69:21.
5. Dashe JS, McIntire DD, Ramus RM, et al. Hydramnios: anomaly prevalence and sonographic detection. Obstet Gynecol 2002; 100:134.
6. Thompson O, Brown R, Gunnarson G, Harrington K. Prevalence of polyhydramnios in the third trimester in a population screened by first and second trimester ultrasonography. J Perinat Med 1998; 26:371.
7. Biggio JR Jr, Wenstrom KD, Dubard MB, Cliver SP. Hydramnios prediction of adverse perinatal outcome. Obstet Gynecol 1999; 94:773.
8. Pri-Paz S, Khalek N, Fuchs KM, Simpson LL. Maximal amniotic fluid index as a prognostic factor in pregnancies complicated by polyhydramnios. Ultrasound Obstet Gynecol 2012; 39:648.
9. Harding R, Bocking AD, Sigger JN, Wickham PJ. Composition and volume of fluid swallowed by fetal sheep. Q J Exp Physiol 1984; 69:487.
10. PRITCHARD JA. DEGLUTITION BY NORMAL AND ANENCEPHALIC FETUSES. Obstet Gynecol 1965; 25:289.
11. Pritchard JA. Fetal swallowing and amniotic fluid volume. Obstet Gynecol 1966; 28:606.
12. Abele H, Starz S, Hoopmann M, et al. Idiopathic polyhydramnios and postnatal abnormalities. Fetal Diagn Ther 2012; 32:251.
13. Ben-Chetrit A, Hochner-Celnikier D, Ron M, Yagel S. Hydramnios in the third trimester of pregnancy: a change in the distribution of accompanying fetal anomalies as a result of early ultrasonographic prenatal diagnosis. Am J Obstet Gynecol 1990; 162:1344.
14. Stoll CG, Alembik Y, Dott B. Study of 156 cases of polyhydramnios and congenital malformations in a series of 118,265 consecutive births. Am J Obstet Gynecol 1991; 165:586.
15. Maymon R, Strauss S, Herman A, et al. The prenatal scan pitfall for the diagnosis of renal mass: case report. Prenat Diagn 2004; 24:932.
16. Liu YC, Mai YL, Chang CC, et al. The presence of hydrops fetalis in a fetus with congenital mesoblastic nephroma. Prenat Diagn 1996; 16:363.
17. Sieck UV, Ohlsson A. Fetal polyuria and hydramnios associated with Bartter’s syndrome. Obstet Gynecol 1984; 63:22S.
18. Moore LE. Amount of polyhydramnios attributable to diabetes may be less than previously reported. World J Diabetes 2017; 8:7.
19. Vink JY, Poggi SH, Ghidini A, Spong CY. Amniotic fluid index and birth weight: is there a relationship in diabetics with poor glycemic control? Am J Obstet Gynecol 2006; 195:848.
20. Idris N, Wong SF, Thomae M, et al. Influence of polyhydramnios on perinatal outcome in pregestational diabetic pregnancies. Ultrasound Obstet Gynecol 2010; 36:338.
21. Crimmins S, Mo C, Nassar Y, et al. Polyhydramnios or Excessive Fetal Growth Are Markers for Abnormal Perinatal Outcome in Euglycemic Pregnancies. Am J Perinatol 2018; 35:140.
22. Laghmani K, Beck BB, Yang SS, et al. Polyhydramnios, Transient Antenatal Bartter’s Syndrome, and MAGED2 Mutations. N Engl J Med 2016; 374:1853.
23. Dorleijn DM, Cohen-Overbeek TE, Groenendaal F, et al. Idiopathic polyhydramnios and postnatal findings. J Matern Fetal Neonatal Med 2009; 22:315.
24. Touboul C, Boileau P, Picone O, et al. Outcome of children born out of pregnancies complicated by unexplained polyhydramnios. BJOG 2007; 114:489.
25. Touboul C, Picone O, Levaillant JM, et al. Clinical application of fetal urine production rate in unexplained polyhydramnios. Ultrasound Obstet Gynecol 2009; 34:521.
26. Pasquini L, Seravalli V, Sisti G, et al. Prevalence of a positive TORCH and parvovirus B19 screening in pregnancies complicated by polyhydramnios. Prenat Diagn 2016; 36:290.
27. Fisk NM, Tannirandorn Y, Nicolini U, et al. Amniotic pressure in disorders of amniotic fluid volume. Obstet Gynecol 1990; 76:210.
28. Katsura D, Takahashi Y, Iwagaki S, et al. Relationship between higher intra-amniotic pressures in polyhydramnios and maternal symptoms. Eur J Obstet Gynecol Reprod Biol 2019; 235:62.
29. Reddy UM, Abuhamad AZ, Levine D, et al. Fetal imaging: executive summary of a joint Eunice Kennedy Shriver National Institute of Child Health and Human Development, Society for Maternal-Fetal Medicine, American Institute of Ultrasound in Medicine, American College of Obstetricians and Gynecologists, American College of Radiology, Society for Pediatric Radiology, and Society of Radiologists in Ultrasound Fetal Imaging workshop. Obstet Gynecol 2014; 123:1070.
30. Society for Maternal-Fetal Medicine (SMFM). Electronic address: pubs@smfm.org, Dashe JS, Pressman EK, Hibbard JU. SMFM Consult Series #46: Evaluation and management of polyhydramnios. Am J Obstet Gynecol 2018; 219:B2.
31. Hughes DS, Magann EF, Whittington JR, et al. Accuracy of the Ultrasound Estimate of the Amniotic Fluid Volume (Amniotic Fluid Index and Single Deepest Pocket) to Identify Actual Low, Normal, and High Amniotic Fluid Volumes as Determined by Quantile Regression. J Ultrasound Med 2020; 39:373.
32. Czerkiewicz I, Dreux S, Beckmezian A, et al. Biochemical amniotic fluid pattern for prenatal diagnosis of esophageal atresia. Pediatr Res 2011; 70:199.
33. Lamouroux A, Mousty E, Prodhomme O, et al. [Absent or hypoplastic thymus: A marker for 22q11.2 microdeletion syndrome in case of polyhydramnios]. J Gynecol Obstet Biol Reprod (Paris) 2016; 45:388.
34. Boito S, Crovetto F, Ischia B, et al. Prenatal ultrasound factors and genetic disorders in pregnancies complicated by polyhydramnios. Prenat Diagn 2016; 36:726.
35. Allaf B, Dreux S, Schmitz T, et al. Amniotic fluid biochemistry in isolated polyhydramnios: a series of 464 cases. Prenat Diagn 2015; 35:1331.
36. Fayyaz H, Rafi J. TORCH screening in polyhydramnios: an observational study. J Matern Fetal Neonatal Med 2012; 25:1069.
37. Odibo IN, Newville TM, Ounpraseuth ST, et al. Idiopathic polyhydramnios: persistence across gestation and impact on pregnancy outcomes. Eur J Obstet Gynecol Reprod Biol 2016; 199:175.
38. Ross MG, Brace RA, National Institute of Child Health and Development Workshop Participants. National Institute of Child Health and Development Conference summary: amniotic fluid biology–basic and clinical aspects. J Matern Fetal Med 2001; 10:2.
39. Karahanoglu E, Ozdemirci S, Esinler D, et al. Intrapartum, postpartum characteristics and early neonatal outcomes of idiopathic polyhydramnios. J Obstet Gynaecol 2016; 36:710.
40. Wiegand SL, Beamon CJ, Chescheir NC, Stamilio D. Idiopathic Polyhydramnios: Severity and Perinatal Morbidity. Am J Perinatol 2016; 33:658.
41. Magann EF, Chauhan SP, Doherty DA, et al. A review of idiopathic hydramnios and pregnancy outcomes. Obstet Gynecol Surv 2007; 62:795.
42. Maymon E, Ghezzi F, Shoham-Vardi I, et al. Isolated hydramnios at term gestation and the occurrence of peripartum complications. Eur J Obstet Gynecol Reprod Biol 1998; 77:157.
43. Mazor M, Ghezzi F, Maymon E, et al. Polyhydramnios is an independent risk factor for perinatal mortality and intrapartum morbidity in preterm delivery. Eur J Obstet Gynecol Reprod Biol 1996; 70:41.
44. Panting-Kemp A, Nguyen T, Chang E, et al. Idiopathic polyhydramnios and perinatal outcome. Am J Obstet Gynecol 1999;181:1079.
45. Pilliod RA, Page JM, Burwick RM, et al. The risk of fetal death in nonanomalous pregnancies affected by polyhydramnios. Am J Obstet Gynecol 2015; 213:410.e1.
46. Erez O, Shoham-Vardi I, Sheiner E, et al. Hydramnios and small for gestational age are independent risk factors for neonatal mortality and maternal morbidity. Arch Gynecol Obstet 2005; 271:296.
47. Sickler GK, Nyberg DA, Sohaey R, Luthy DA. Polyhydramnios and fetal intrauterine growth restriction: ominous combination. J Ultrasound Med 1997; 16:609.
48. Yefet E, Daniel-Spiegel E. Outcomes From Polyhydramnios With Normal Ultrasound. Pediatrics 2016; 137:e20151948.
49. Dickinson JE, Tjioe YY, Jude E, et al. Amnioreduction in the management of polyhydramnios complicating singleton pregnancies. Am J Obstet Gynecol 2014; 211:434.e1.
50. Elliott JP, Sawyer AT, Radin TG, Strong RE. Large-volume therapeutic amniocentesis in the treatment of hydramnios. Obstet Gynecol 1994; 84:1025.
51. Jauniaux E, Holmes A, Hyett J, et al. Rapid and radical amniodrainage in the treatment of severe twin-twin transfusion syndrome. Prenat Diagn 2001; 21:471.
52. Leung WC, Jouannic JM, Hyett J, et al. Procedure-related complications of rapid amniodrainage in the treatment of polyhydramnios. Ultrasound Obstet Gynecol 2004; 23:154.
53. Kramer WB, Van den Veyver IB, Kirshon B. Treatment of polyhydramnios with indomethacin. Clin Perinatol 1994; 21:615.
54. Harman CR. Amniotic fluid abnormalities. Semin Perinatol 2008; 32:288.
55. Aviram A, Salzer L, Hiersch L, et al. Association of isolated polyhydramnios at or beyond 34 weeks of gestation and pregnancy outcome. Obstet Gynecol 2015; 125:825.
56. Khan S, Donnelly J. Outcome of pregnancy in women diagnosed with idiopathic polyhydramnios. Aust N Z J Obstet Gynaecol 2017; 57:57.
57. Kramer MS, Rouleau J, Baskett TF, et al. Amniotic-fluid embolism and medical induction of labour: a retrospective, population-based cohort study. Lancet 2006; 368:1444.
58. ACOG Committee Opinion No. 764: Medically Indicated Late-Preterm and Early-Term Deliveries. Obstet Gynecol 2019; 133:e151.