Nguồn: Oishi P, Teitel DF, Hoffman JI, Fineman JR. Cardiovascular Physiology. Roger’s Textbook of Pediatric Intensive Care, 4th Edition. Dịch bởi PGS – Tiến sĩ Bác sĩ Lê Minh Khôi – Trưởng đơn vị Phẫu thuật tim mạch, Bệnh viện Đại học Y Dược TPHCM – Đại học Y Dược TP Hồ Chí Minh.
Những điểm mấu chốt
- Hệ tim mạch cung cấp những chất chuyển hoá thiết yếu cho tổ chức và thải loại những sản phẩm cặn bã của tổ chức.
- Suy giảm chức năng tim mạch là hậu quả của một số quá trình bệnh lý có thể đưa đến bệnh nặng do vậy nhiều liệu pháp điều trị được sử dụng trong hồi sức được thiết kế nhằm phục hồi chức năng tim mạch.
- Các cấu phần của hệ tim mạch có thể bị ảnh hưởng khác nhau bởi bệnh và trị liệu đo đó người thầy thuốc lâm sàng cần phải biết đánh giá đúng những đáp ứng của chúng.
- Kháng lực cản trở dòng máu chảy trong giường mạch đóng vai trò trung tâm trong chức năng tim mạch vì đây là yếu tố chính quyết định cung lượng tim cũng như phân bố máu trong hệ tuần hoàn.
- Tế bào nội mô mạch máu có chức năng rất quan trọng sản xuất rất nhiều yếu tố hoạt mạch khác nhau. Tương tác giữa các tế bào nội mô mạch máu và các tế bào cơ trơn điều hoà những thay đổi động của kháng lực mạch máu.
- Các cơ chế thần kinh, thể dịch, đáp ứng có nguồn gốc cơ trơn và chuyển hoá cục bộ cũng là một phần không thể thiếu của quá trình điều hoà trương lực mạch.
- Các đường cong chức năng mạch máu và tim và tương tác của chúng có thể được sử dụng như là một mô hình lý thuyết giúp hiểu được hoạt động của hệ tim mạch ở những điều kiện sinh lý và bệnh lý khác nhau. Tại bất kỳ thời điểm nào thì hệ tim mạch cũng hoạt động ở một điểm giao cắt giữa đường cong chức năng mạch máu và đường cong chức năng tim.
- Lưu lượng máu đến hầu hết các cơ quan được điều hoà tự động làm cho lưu lượng máu duy trì khá ổn định trong khi huyết áp có thể dao động trong một khoảng lớn.
- Ở thai nhi, thất phải cung cấp hầu hết máu qua ống động mạch đến động mạch chủ xuống để đến rau thai nhằm lấy ôxy. Thất trái cung cấp hầu hết máu của nó đến não và tim để cung cấp ôxy. Các shunt quan trọng trong tuần hoàn bào thai tạo điều kiện để quá trình này xảy ra bình thường.
- Hầu hết các biến cố quan trọng trong quá trình chuyển tiếp từ tuần hoàn thai nhi sang tuần hoàn sau sinh xảy ra nhanh chóng đưa đến giảm nhanh và mạnh kháng lực mạch máu phổi rất lớn cũng như cắt đứt liên kết tuần hoàn rốn-rau thai.
- Trong điều kiện bình thường, kháng lực mạch máu hệ thống là yếu tố chính ảnh hưởng đến hậu tải và cung lượng tim nhưng trong trường hợp suy tim phải thì giường mạch máu phổi lại có vai trò rất quan trọng.
- Giường mạch máu phổi được chủ động duy trì ở trạng thái giãn và có kháng lực thấp. Những biến loạn trong quá trình này đóng vai trò trung tâm trong sinh lý bệnh của một số các rối loạn mạch máu phổi và có thể có tác động sâu sắc đến hoạt động tổng thể của hệ tim mạch.
- Co mạch máu phổi do hạ ôxy máu là một đặc trưng cốt lõi và độc đáo của hệ mạch máu phổi vì nó cho phép duy trì được tương xứng thông khí/tưới máu.
- Những thay đổi trong lưu lượng máu vành hỗ trợ công tim theo cách cho phép hoạt động cơ tim (cung cấp ôxy) tương xứng với nhu cầu tổng thể (nhu cầu ôxy) của toàn bộ cơ thể.
- Thất trái chiết tách gần như tối đa lượng ôxy đi qua cơ tim nhờ đó tuần hoàn vành có thể đáp ứng được sự gia tăng nhu cầu ôxy cơ tim.
- Co thắt và giãn các động mạch vành thiết lập nên một cơ chế tiên phát qua đó lưu lượng máu vành có thể thay đổi tuỳ theo nhu cầu ôxy của cơ tim.
- Các điều kiện sinh lý bệnh khác nhau đưa đến những sự thay đổi khác nhau trong các cấu phần của hệ tuần hoàn.
- Xử trí bệnh nhân nặng đòi hỏi thầy thuốc phải hiểu thấu đáo cơ sở sinh lý tổng quát của hệ tim mạch, các đích điều trị và ảnh hưởng của các trị liệu lên các giường mạch máu của từng vùng khác nhau.
- Các trị liệu trong tương lai cần phải nhắm đến các đích đặc hiệu hơn tức là nhắm đến từng cấu phần cụ thể của hệ tim mạch.
Chức năng chính của hệ tim mạch là cung cấp những sản phẩm thiết yếu cho tổ chức nhằm duy trì chức năng chuyển hoá bình thường và thải trừ những sản phẩm cặn bã từ tổ chức. Rối loạn chức năng tim mạch là một phần quan trọng trong sinh lý bệnh của một loạt các quá trình bệnh lý nặng. Ngoài ra, có nhiều liệu pháp điều trị được sử dụng trong điều trị, đặc biệt là trong hồi sức có ảnh hưởng trực tiếp hoặc gián tiếp đến hệ tim mạch theo cách có thể cải thiện hoặc ức chế chức năng của hệ này. Vấn đề càng trở nên phức tạp hơn khi các cấu phần trong hệ tim mạch có thể bị ảnh hưởng khác nhau và/hoặc với mức độ khác nhau bởi các liệu pháp đặc hiệu nào đó. Điều này đòi hỏi người thầy thuốc phải biết kết nối, điều hoà nhiều đáp ứng khác nhau.
Chương này đề cập đến giải phẫu cơ bản mạch máu và những nguyên lý huyết động học nền tảng kiểm soát dòng máu trong hệ tuần hoàn, cung cấp những khảo sát về các cơ chế chung điều hoà trương lực mạch và bàn luận chi tiết về tuần hoàn từng vùng. Ngoài ra, bài viết cũng đề cập đến những vấn đề đặc thù của tuần hoàn rau thai cũng như tuần hoàn chuyển tiếp trong giai đoạn chu sinh. Một hiểu biết tường tận về những khái niệm này giúp người thầy thuốc hồi sức điều trị những bệnh nhân có suy sụp hệ tim mạch ước lượng được nhu cầu khác nhau của tuần hoàn vùng khác nhau.
Sơ lược giải phẫu hệ tim mạch
Hệ tim mạch được cấu tạo bởi một bơm và một hệ thống mạng lưới các ống dẫn mang máu cùng với tất cả các chất chuyển hoá của nó đến và đi khỏi tổ chức. Bơm này là tim, trên thực tế là hai bơm hoạt động theo kiểu nối tiếp: thất phải bơm máu lên tuần hoàn phổi và thất trái bơm máu vào tuần hoàn hệ thống. Một số tác giả chia tuần hoàn thành tuần hoàn trung ương bao gồm tuần hoàn phổi cùng các động tĩnh mạch lớn và tuần hoàn ngoại biên bao gồm các giường mạch máu khác nhau của cơ thể.
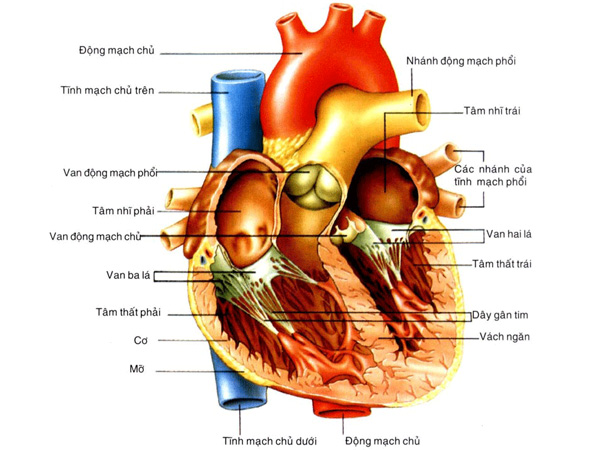
Mạch máu được thiết kế phù hợp với chức năng của chúng trong hệ tuần hoàn. Các mạch máu bao gồm các lớp đồng tâm tính từ trong ra ngoài là lớp áo trong (intima) lớp áo giữa (media) và lớp áo ngoài (adventitia) mặc dù có một số loại mạch máu sẽ không có đủ ba lớp này. Lớp trong cùng được gọi là lớp áo trong là nội mô mạch máu chịu trách nhiệm chính cho những đáp ứng chuyển hoá mạch máu quan trọng nhất. Ngoài ra, nó còn có chức năng như là một màng ngăn đối với dịch, khí và chất hoà tan đi vào khoảng kẽ. Màng ngăn này có tính thấm khác nhau tuỳ thuộc vào vị trí của chúng trong hệ tuần hoàn. Ở các động mạch lớn, lớp chun giãn trong ngăn cách lớp áo giữa với lớp áo trong. Lớp áo giữa được cấu tạo chủ yếu bởi các tế bào cơ trơn. Ngoài ra, lớp chun giãn này còn có chứa các sợi thần kinh, các mạch máu xuyên có tác dụng nuôi dưỡng chính động mạch lớn được gọi là các mạch nuôi mạch (vasa vasorum). Lớp chun giãn ngoài ngăn cách lớp áo giữa với lớp áo ngoài. Lớp áo ngoài chứa thần kinh, mạch nuôi mạch và tổ chức liên kết. Các động mạch nhỏ hơn có ít mô chun giãn hơn và tiểu động mạch lại càng ít hơn nữa. Tế bào cơ trơn co rút làm giảm giãn năng của các mạch máu làm chúng trở nên cứng hơn và làm giảm đường kính lòng mạch. Một số yếu tố làm tế bào cơ trơn mạch máu co hoặc giãn. Tình trạng co của tế bào cơ trơn mạch máu tạo nên nền tảng của trương lực mạch máu. Các mao mạch là những mạch máu có thành mỏng, đặc biệt là chúng chỉ có lớp tế bào nội mô mà không có các lớp khác. Chính điều này làm chúng thích hợp với vai trò vận chuyển và nhận các chất đến và đi khỏi tổ chức mà chúng hiện diện. Các tĩnh mạch có các lớp cơ bản giống như động mạch nhưng được tổ chức kém hơn và có thành mỏng hơn nhưng có đường kính lòng mạch lớn hơn khi so với động mạch tương ứng. Ngoài ra, nhiều tĩnh mạch còn chứa các van một chiều ngăn máu không cho trào ngược theo hướng ra xa khỏi tim.
Các nguyên lý huyết động học
Không có một mô hình vật lý đơn giản nào về động học của dịch có thể đúng với hệ tim mạch. Tuy nhiên, những hiểu biết cơ bản về các nguyên lý huyết động học đóng vai trò thiết yếu trong điều trị bệnh nhân có rối loạn chức năng tim mạch.
Lưu lượng, Vận tốc và Thiết diện
Vận tốc dòng máu trong một đoạn nào đó của hệ tuần hoàn có đơn vị khoảng cách và thời gian (Vd: cm/giây). Lưu lượng máu đi trong hệ tuần hoàn có đơn vị là thể tích và thời gian (Vd: lít/phút). Khi lưu lượng máu hằng định thì vận tốc dòng máu qua một mạch máu tương quan với diện tích cắt ngang của mạch máu đó. Tương quan này được biểu diễn bằng phương trình: V = Q/A. Trong đó: V là vận tốc dòng máu Q là lưu lượng máu, và A là diện tích cắt ngang của mạch máu (thiết diện).
Như vậy vận tốc tỉ lệ thuận với lưu lượng và tỉ lệ nghịch với thiết diện. Chính vì vậy vận tốc máu ở động mạch chủ là lớn nhất và ở mao mạch là thấp nhất. Vận tốc tăng dần trở lại khi đi từ mao mạch về phía các tĩnh mạch trung tâm.
Áp lực, Lưu lượng và Sức cản Những yếu tố quyết định lưu lượng máu trong một phân đoạn mạch máu nào đó là áp lực dòng máu đi vào (Pi), áp lực dòng máu đi ra (Po) và sức cản mạch máu (R). Nếu máu chảy theo kiểu dòng tuần tự (laminar flow) thì mối quan hệ này có thể biểu diễn bằng định luật Poiseuille: Q = (Pi-Po)πr4/8ŋl. Trong đó: r là bán kính mạch máu ŋ là độ nhớt của máu, và l là độ dài của đoạn mạch máu đó.
Như vậy lưu máu sẽ tăng lên khi đường kính của mạch máu cũng như chênh áp ở hai đầu tăng lên. Ngược lại Q sẽ giảm xuống khi độ nhớt của máu và chiều dài của đoạn mạch tăng lên.
Những thay đổi về đường kính mạch máu do thay đổi của tình trạng co của các cơ trơn mạch máu đóng vai trò trung tâm trong điều hòa lưu lượng máu đặc biệt là lưu lượng máu từng vùng. Có thể hiểu mối tương quan giữa lưu lượng và sức cản qua định luật Ohm: R = (Pi – Po)/Q.
Kết hợp với định luật Poiseuille, ta có: R = (Pi – Po)/Q = 8ŋl/πr4.
Vì chiều dài mạch máu trong cơ thể là không đổi nên từ phương trình trên ta thấy kháng lực được quyết định bởi kích thước mạch máu và độ nhớt máu. Vì sức cản thay đổi theo lũy thừa bậc 4 của bán kính mạch máu nên tình trạng co hoặc giãn mạch có một tác động sâu sắc đến lưu lượng máu trong mạch máu. (Điều này cũng đúng đối với lưu lượng khí đi qua đường hô hấp).
Áp lực máu giảm dần từ động mạch đến tĩnh mạch chủ đoạn nối vào tim nhưng chỗ giảm đột ngột nhất là từ tiểu động mạch sang mao mạch mặc dù đường kính của mao mạch nhỏ hơn nhiều so với tiểu động mạch. Điều này được giải thích là do các tiểu động mạch trước mao mạch sắp xếp theo cách nối tiếp còn mao mạch lại sắp xếp theo cách song song. Khi tính kháng trở của các kháng trở mắc nối tiếp thì kháng trở toàn bộ R sẽ bằng tổng của các kháng trở, tức là R = R1 + R2 +..+Rn) trong khi đó với mao mạch có trở kháng mắc song song thì kháng trở toàn bộ sẽ là R = 1/R1 + 1/R2 +…+ 1/Rn.
Như vậy, tổng kháng trở trong mao mạch sẽ thấp hơn kháng trở trong từng mao mạch. Ngoài ra, tại mỗi cơ quan có thể còn có thêm một số mạch chạy song song phía trước mao mạch. Những mạch máu này có thể mở hoặc có thể được tái huy động. Điều này làm nảy sinh hệ quả là phương trình Poiseuille có thêm hệ số k. R = 8πl/ŋr4k.
Như vậy, nếu hệ số k này tăng lên thì sức cản mạch máu sẽ giảm xuống. Ngược lại, trong một số tình trạng bệnh lý (bệnh lý động mạch phổi ngoại vi trong tăng áp phổi mạn tính, huyết khối) thì hệ số k này sẽ giảm xuống. Cuối cùng, những thay đổi áp lực khi lưu lượng máu tăng và tăng sức cản có thể được diễn tả khi tái sắp xếp lại định luật Ohm như sau: Pi = QR + Po.
Như vậy, áp lực mạch máu có thể tăng lên khi sức cản mạch máu hoặc lưu lượng dòng máu tăng lên. Những yếu tố này không độc lập với nhau và áp lực có thể không thay đổi khi lưu lượng mau tăng lên vì lượng máu tăng lên này có thể làm giảm sức cản ví dụ thông qua làm giãn hoặc tái huy động các mạch máu đã bị đóng. Như vậy nếu tích QR không thay đổi thì áp lực cũng không thay đổi.
Giãn năng (compliance)
Thay đổi áp lực trong lòng mạch sẽ làm thay đổi thể tích nội mạch tương ứng. Mức độ thay đổi thể tích (ΔV) trên một đơn vị áp lực thay đổi (ΔP) định nghĩa giãn năng C của một mạch máu như trong phương trình sau đây: C = ΔV/ΔP.
Thành tĩnh mạch mỏng hơn, ít cơ trơn hơn nên có C gấp 20 lần động mạch tương ứng. Do vậy tại bất cứ một thời điểm nào thì lượng máu lưu thông chủ yếu nằm ở tĩnh mạch và liệu pháp bù dịch làm tăng dịch chủ yếu ở phần tĩnh mạch.
Sự không chính xác của các mô hình toán học
Mặc dù các mô hình toán học không hoàn toàn chính xác trong hệ thống mạch máu của sinh vật vì máu chảy trong cơ thể không hoàn toàn tuân theo quy luật Newton, lòng mạch không trơn láng, đường kính mạch máu thay đổi, uốn khúc, phân nhánh và các mạch máu không phải mở cùng một lúc… nhưng nguyên lý về độ nhớt và đường kính vẫn đóng vai trò quan trọng trong thực hành lâm sàng.
Tương tác giữa Bơm tim và Hệ mạch
Cung lượng tim được quyết định bởi tần số tim, sức co bóp, tiền tải và hậu tải. Tần suất và sức co bóp cơ tim là những đặc tính liên quan trực tiếp đến bản thân tim. Tiền tải và hậu tải liên quan đến cả tim lẫn hệ mạch máu. Sự tương tác này có thể hiểu được thông qua nghiên cứu đường cong chức năng mạch máu và đường cong chức năng tim hay còn gọi là đường cong Starling cũng như sự tương tác của chúng.
Đường cong Chức năng mạch máu
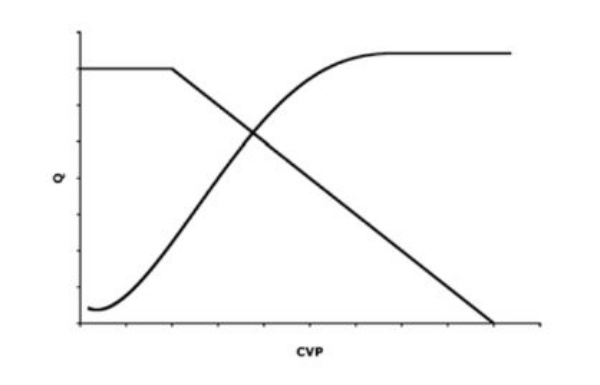
Đường cong chức năng mạch máu (vascular function curve), mô tả sự thay đổi của cung lượng tim ảnh hưởng như thế nào đến áp lực tĩnh mạch trung tâm (CVP) hay hồi lưu tĩnh mạch (Hình 1).
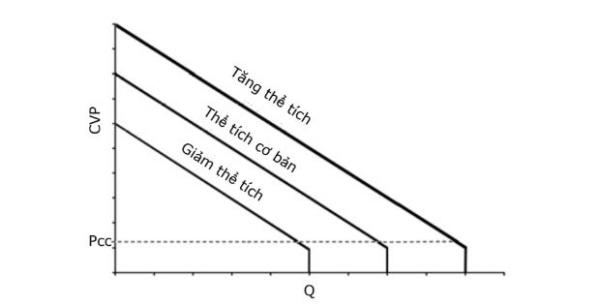
Đường cong chức năng mạch máu mô tả ảnh hưởng của cung lượng tim Q lên áp lực tĩnh mạch trung tâm (CVP) hoặc hồi lưu tĩnh mạch. Tăng Q làm giảm CVP trong khi giảm Q làm tăng CVP. Giá trị Q cực đại xuất hiện ở áp lực đóng tuần hoàn tĩnh mạch tại đó không thể làm giảm thể tích máu trong mao mạch xuống được nữa. Điểm này biểu diễn CVP thấp nhất có thể có và Q cao nhất có thể có cho mỗi thể tích máu nhất định nào đó (Pcc: áp lực đóng). Tại điểm Q không, hệ thống đạt đến sự cân bằng trong đó áp lực trong khoang động mạch và tĩnh mạch chỉ được quyết định bằng giãn năng cho mỗi thể tích máu nhất định. Tăng thể tích lưu thông và giảm thể tích máu gây nên những thay đổi tăng hoặc giảm song song trong đường cong chức năng mạch máu.
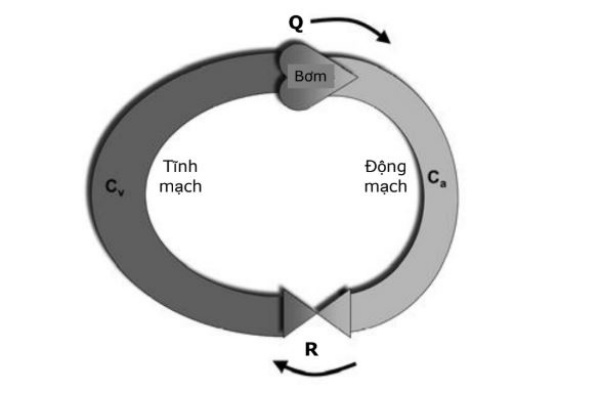
Để hiểu rõ được đường cong này chúng ta hãy xem xét một mô hình bao gồm một bơm, một khoang động mạch có một giãn năng nhất định (Ca), một kháng trở (biểu hiện sức cản của tiểu động mạch, mao mạch và tiểu động mạch) và một khoang tĩnh mạch có giãn năng nhất định (Cv) (Hình 2). Bơm sẽ dịch chuyển máu từ khoang tĩnh mạch sang khoang động mạch ở một tốc độ nào đó. Trong mô hình này, tốc độ bơm máu của bơm biểu diễn cung lượng tim. Giãn năng của khoang động mạch cho phép khoang này có thể chứa được một phần máu trước khi được đẩy qua kháng trở vi mạch để sang khoang tĩnh mạch. Khoang tĩnh mạch có thể chứa được một thể tích máu lớn hơn nhiều do giãn năng cao. Tăng Q sẽ làm giảm thể tích máu trong khoang tĩnh mạch và do vậy sẽ làm giảm áp lực trong khoang tĩnh mạch. Áp lực này tương ứng với CVP. Ngược lại, giảm Q sẽ làm tăng thể tích máu trong khoang tĩnh mạch và làm tăng CVP.
Từ mô hình trên có thể rút ra những khái niệm quan trọng nếu xem xét ở các giá trị cực điểm của đường cong (Hình 1). Ở một điểm nào đó, Q đạt được giá trị cực đại, tại đó thể tích máu trong khoang tĩnh mạch không thể giảm hơn được nữa. Lấy máu từ khoang tĩnh mạch vượt quá điểm này sẽ tạo nên áp lực âm trong khoang tĩnh mạch tạo nên tình trạng xẹp thành mạch. Điểm này được gọi là áp lực đóng (critical closing pressure, Pcc). Nó biểu diễn mức CVP thấp nhất có thể có và Q cao nhất có thể có đối với mỗi một thể tích máu nhất định nào đó. Ngược lại, khi Q bằng không, hệ thống này đạt được sự cân bằng trong đó áp lực trong các khoang động mạch và tĩnh mạch chỉ được quyết định bởi giãn năng của các khoang. Trong trường hợp này, CVP sẽ đạt được giá trị cực đại với mỗi thể tích máu nhất định. Cũng cần phải chú ý rằng đường cong này bị ảnh hưởng bởi thể tích máu. Như đã thấy trong Hình 1, tăng thể tích máu làm đường cong dịch chuyển song song lên trên và giảm thể tích máu làm đường cong tịnh tiến xuống dưới.
Đường cong Chức năng Tim
Đường cong chức năng tim (cardiac function curve) là nghịch đảo của đường cong chức năng mạch máu. Nghĩa là nó khảo sát tác động của CVP lên Q (Hình 3). Mối tương quan này dựa trên định luật Starling. Định luật này phát biểu rằng sự gia tăng của Q là do sự tăng sự căng giãn của cơ tim làm tăng khả năng co bóp. Trên phần sườn dốc của đường cong, tăng CVP, thông qua tăng hồi lưu tĩnh mạch sẽ làm căng thất phải (nghĩa là làm tăng tiền tải), làm tăng co bóp cơ thất phải và do vậy lưu lượng máu lên phổi tăng theo. Lượng máu lên phổi tăng làm lượng máu tĩnh mạch phổi trở về nhĩ trái tăng lên làm tăng tiền tải thất trái và cuối cùng là tăng cung lượng tim hệ thống. Mặc dù đường cong chức năng tim liên quan trực tiếp đến CVP nhưng nó cũng có thể bị ảnh hưởng bởi những yếu tố khác như hậu tải, sức co bóp cơ tim và tần số tim. Ví dụ, tăng sức cản mạch máu hệ thống làm tăng hậu tải có thể đưa đến tình trạng đường cong bị hạ thấp xuống trong khi giãn mạch hệ thống làm giảm hậu tải sẽ làm đường cong dịch chuyển lên trên (Hình 3).
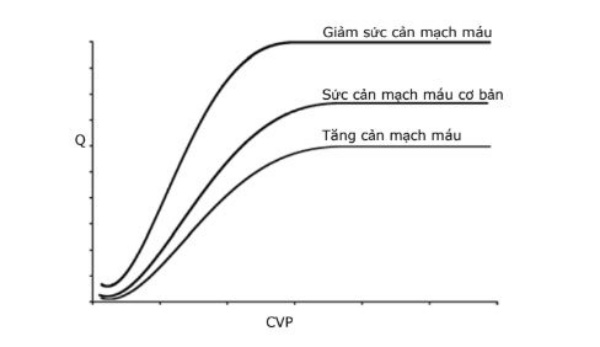
Đường cong chức năng tim mô tả áp lực tĩnh mạch trung tâm (CVP) hay hồi lưu tĩnh mạch phổi ảnh hưởng như thế nào đến cung lượng tim (Q). Ở phần dốc lên của đường cong, tăng CVP làm tăng co bóp thất. Tăng kháng lực mạch máu hệ thống (làm tăng hậu tải) làm đường cong dịch chuyển xuống dưới trong khi giảm kháng lực hệ thống (làm giảm hậu tải) làm dịch chuyển đường cong lên trên.
Tương tác của đường cong chức năng mạch và đường cong chức năng tim
Tại bất kỳ thời điểm nào đó thì hệ tim mạch cũng sẽ hoạt động tại một điểm giao cắt lý thuyết giữa đường cong mạch máu và đường cong chức năng tim (Hình 4). Di lệch khỏi điểm giao cắt này chỉ là tạm thời khi các đường cong này chính xác. Ví dụ, theo mô hình giản lược được trình bày ở đây thì nếu bơm tim đột ngột tống một lượng máu gia tăng thì thể tích và áp lực sẽ tăng lên trong khoang động mạch và giảm trong khoang tĩnh mạch. Điều này làm dịch chuyển tạm thời đường cong mạch máu sang trái. Theo đường cong chức năng tim thì lần tống máu tiếp theo sẽ giảm xuống vì CVP giảm xuống. Sau một khoảng thời gian rất ngắn, sự giảm Q này sẽ làm tăng CVP đồng thời với đường cong chức năng mạch máu làm hệ thống trở lại điểm giao cắt ban đầu.
Hình 4. Hệ tim mạch hoạt động tại một điểm giao cắt lý thuyết giữa đường cong chức năng mạch máu và đường cong chức năng tim. Di lệch ra khỏi điểm này chỉ là thoáng qua nếu như các đường cong này chính xác.
Việc biểu diễn các đường cong này ứng với các tình trạng sinh lý khác nhau trên cùng một biểu đồ rất có ích vì nó minh hoạ các tương tác quan trọng giữa cung lượng tim, tiền tải, sức cản mạch máu ngoại biên (hay hậu tải) và thể tích máu. Ví dụ, ở Hình 5, chúng ta có thể thấy rằng những biến đổi của sức cản mạch máu ảnh hưởng đến cả đường cong chức năng mạch máu lẫn đường cong chức năng tim trong khi thay đổi thể tích máu chỉ tác động lên đường cong chức năng mạch máu (Hình 6). Hơn nữa chúng ta có thể thấy rằng trong khi thay đổi thể tích máu đưa đến những thay đổi song song của đường cong chức năng mạch máu (Hình 1 và Hình 6) thì những thay đổi của sức cản chỉ làm thay đổi độc dốc của đường cong mà không thay đổi CVP ở Q không bởi vì điểm này chỉ phụ thuộc vào thể tích máu và giãn năng (Hình 5).
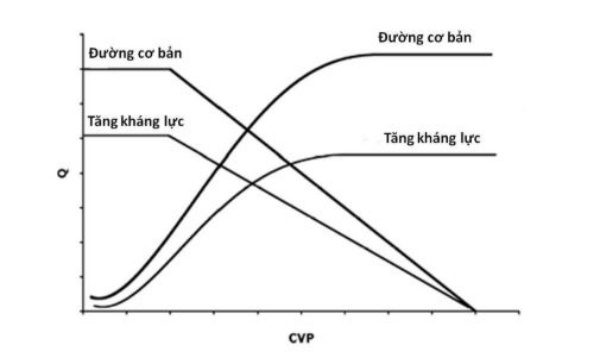
Hình 5. Ảnh hưởng của tăng kháng lực mạch máu hệ thống lên các đường cong chức năng tim và đường cong chức năng mạch máu. Tăng kháng lực mạch máu hệ thống (hoặc hậu tải) làm hai đường cong đi xuống dưới do đó điểm giao cắt hoạt động của hệ tim mạch cũng di lệch xuống dưới. Tăng kháng lực mạch máu ngoại biên không thay đổi đường cong chức năng mạch máu khi Q có giá trị 0 vì CVP tại điểm này chỉ được quyết định bởi giãn năng của khoang tĩnh mạch cho dù thể tích máu là như thế nào.
Vì hệ tim mạch hoạt động ở một điểm giao cắt giữa hai đường cong này nên những thay đổi về thể tích máu sẽ làm dịch chuyển trạng thái hoạt động của hệ này thậm chí nó còn làm biến đổi cả chức năng nội tại của tim (Hình 6). Các bệnh lý nặng, cùng những biến loạn sinh lý của chúng, sẽ ảnh hưởng đến hệ tim mạch theo các phương thức khác nhau và có thể tác động lên đường cong chức năng tim và mạch theo những cách khác nhau. Tương tự như vậy, các trị liệu cũng có những hiệu ứng khác nhau. Do đó, mặc dù mô hình lý thuyết mô tả các đường cong chức năng mạch máu và tim rõ ràng là quá giản lược nhưng chúng cũng cung cấp cho thầy thuốc một nền tảng lý thuyết để tìm ra được cách tiếp cận điều trị thích hợp cho những bối cảnh lâm sàng khác nhau.
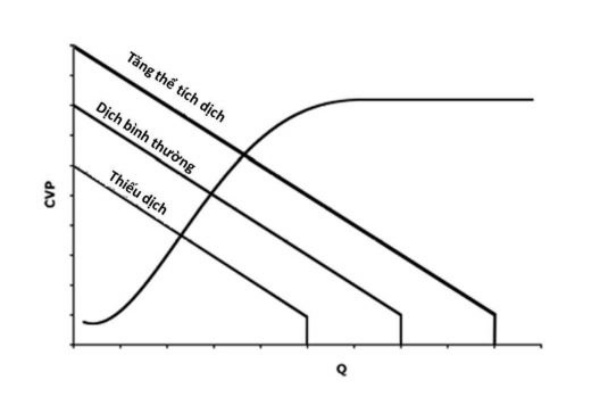
Truyền dịch làm tăng và thiếu dịch làm giảm đường cong chức năng mạch máu. Đường cong chức năng tim không bị thay đổi bởi thay đổi của thể tích dịch. Vì hệ tim mạch hoạt động tại điểm giao cắt giữa hai đường cong nên tình trạng chức năng của toàn hệ cũng chịu ảnh hưởng của tình trạng thể tích trong lòng mạch.
Điều hoà kháng lực mạch máu hệ thống
Tình trạng co của giường mạch máu (trương lực) đóng vai trò trung tâm trong sinh lý tim mạch vì kháng lực mạch máu ảnh hưởng trực tiếp đến hậu tải, một trong bốn yếu tố quyết định chính đến cung lượng tim. Cũng chính bởi vì những biến đổi của kháng lực máu bên trong và ở giữa các giường mạch máu sẽ quyết định dòng máu đi đến các cơ quan khác nhau và sự phân bố máu trong toàn bộ cơ thể. Vị trí chính quyết định kháng lực mạch máu là ở các tiểu động mạch. Tuy nhiên, các động mạch lớn và tĩnh mạch có kích thước khác nhau cũng ảnh hưởng đến kháng lực mạch máu và có thể trở thành vị trí quyết định chính của kháng lực trong một số bệnh lý đặc biệt. Các yếu tố giải phẫu cũng góp phần tạo nên kháng lực nhưng chính trương lực cơ trơn mạch máu mới là yếu tố quan trọng nhất trong cơ chế điều hoà kháng lực.
Có một số cơ chế kiểm soát tình trạng co của cơ trơn mạch máu, tức là kiểm soát kháng lực mạch máu bao gồm: kiểm soát thần kinh, kiểm soát thể dịch, các yếu tố có nguồn gốc nội mô, quá trình đáp ứng có nguồn gốc cơ trơn và các sản phẩm chuyển hoá tại chỗ. Quá trình tự điều hoà là một thuật ngữ chung mô tả một hiện tượng có thể liên quan đến một hoặc nhiều cơ chế đặc hiệu nói trên.
Cơ chế tự điều hoà
Dòng máu đến tổ chức được duy trì tương đối ổn định trong một khoảng dao động huyết áp khá lớn nhờ vào cơ chế tự điều hoà (autoregulation) (Hình 7).
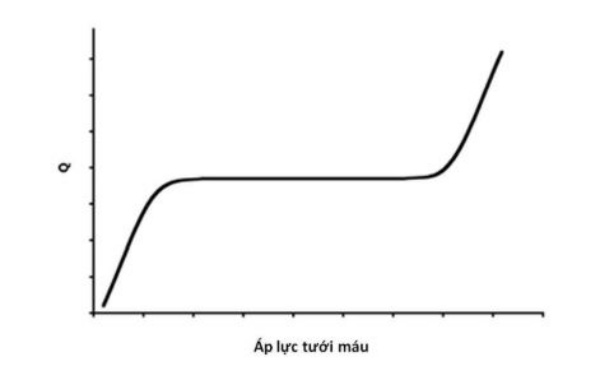
Lưu lượng máu (Q) trong hầu hết các cơ quan trong cơ thể được duy trì hằng định trong một khoảng huyết áp khá rộng. Nhìn chung, giảm áp lực tưới máu sẽ đưa đến giãn mạch trong khi tăng áp lực tưới máu sẽ làm co mạch. Tại các điểm uốn đi xuống và đi lên, giãn mạch tối đa hoặc co mạch tối đa xuất hiện và lưu lượng máu hằng định không thể được duy trì nếu áp lực tưới máu tiếp tục giảm hoặc tăng thêm nữa.
Phần lớn các cơ chế của quá trình tự điều hoà còn chưa được biết rõ. Hiện có một số cơ chế mang tính giả thuyết bao gồm kiểm soát chuyển hoá cục bộ, đáp ứng có nguồn gốc cơ trơn của cơ trơn và áp lực tổ chức. Những cơ chế này có thể hoạt động đơn độc hoặc kết hợp với nhau. Giả thuyết chuyển hoá gợi ý rằng lưu lượng máu có liên quan chặt chẽ với chuyển hoá của tổ chức. Theo thuyết này thì lưu lượng máu phải đủ để hỗ trợ cho các nhu cầu chuyển hoá của một cơ quan. Tăng nhu cầu chuyển hoá hoặc cung cấp không đủ các cơ chất chuyển hoá thì các chất giãn mạch sẽ được sản sinh và/hoặc phóng thích để làm tăng dòng máu đến. Khi lưu lượng máu tăng, các chất chuyển hoá sẽ được mang đi nhờ đó tái lập nồng độ bình thường. Tại các cơ quan có tiêu thụ ôxy cao, quá trình tự điều hoà lưu lượng máu phụ thuộc chủ yếu vào cung cấp ôxy tổ chức. Tuy nhiên một số chất có thể đóng góp vào quá trình này bao gồm CO2, ion H+ , lactic acid, histamine, K+ , prostaglandin, endothelin (ET)-1, nitric oxide (NO) và adenosine. Một cơ chế thứ hai được nêu ra để giải thích quá trình tự điều hoà là kiểm soát đáp ứng có nguồn gốc cơ trơn [12]. Theo thuyết này, tăng áp lực nội mạch sẽ kích thích co mạch của các cơ trơn mạch máu. Một phản xạ tĩnh-động mạch cũng đã được mô tả: tăng áp lực tĩnh mạch làm co tiểu động mạch có thể là thông qua cơ chế điều hoà thần kinh [12]. Áp lực tổ chức là một cơ chế khác có thể giải thích quá trình tự điều hoà. Theo cơ chế này thì tăng áp lực tổ chức ở các vùng trong các cơ quan có vỏ bọc hoặc trong não sẽ làm giảm lưu lượng máu đến các vùng này. Quá trình tự điều hoà dường như đóng vai trò quan trọng hơn trong kiểm soát lưu lượng máu lúc nghỉ ở các cơ quan sinh tử như não và tim và càng trở nên quan trọng hơn ở các vùng khác trong lúc nhu cầu chuyển hoá tăng cao. Hơn nữa, có nhiều cơ chế khác nhau có thể đặc hiệu cho một cơ quan nhất định như tín hiệu của tổ chức macula densa tại thận.
Kiểm soát thần kinh
Kiểm soát thần kinh cho phép điều hoà nhanh chóng và kiểm soát đồng thời nhiều vùng khác nhau của hệ tuần hoàn. Điều hoà thần kinh bao gồm thông tin hồi tác (nhánh hướng tâm) thu nhận được từ các áp thụ quan (baroreceptor) cũng như các thụ quan căng giãn của tim (cardiac strech receptor) và kiểm soát có nguồn gốc thần kinh (nhánh ly tâm) thông qua hệ thần kinh tự động. Hệ này bao gồm hệ thần kinh giao cảm và phó giao cảm. Gần như tất cả mạch máu trong cơ thể đều được phân bố thần kinh tự động nhưng hiệu ứng của quá trình kiểm soát này khác nhau tuỳ theo từng giường mạch.
Nhánh hướng tâm của các cơ chế kiểm soát thần kinh bao gồm các hoá thụ quan ở thành động mạch và các thụ quan căng giãn bên trong cơ tim. Các hoá thụ quan được tìm thấy ở xoang cảnh và ở cung động mạch chủ. Có hai loại hoá thụ quan đã được xác định. Các hoá thụ quan loại 1 kiểm soát những thay đổi động của huyết áp còn hoá thụ quan loại 2 kiểm soát huyết áp lúc nghỉ [7]. Những hoá thụ quan này đáp ứng với sự căng của thành động mạch và gửi những xung động thần kinh đến các trung tâm ức chế tim cũng như trung tâm vận mạch ở hành tuỷ. Kích thích thụ quan ở xoang cảnh làm chậm tần số tim, giãn mạch và giảm huyết áp động mạch. Cơ trơn thành động mạch ở vùng có các hoá thụ quan được phân bố thần kinh ly tâm gây co mạch. Điều này gợi ý rằng hoạt động giao cảm có thể làm thay đổi đáp ứng của các hoá thụ quan.
Các thụ quan căng giãn cũng được tìm thất ở thành tâm nhĩ và tâm thất. Các thụ quan căng giãn ở nhĩ nằm ở cả hai nhĩ ngay vị trí tĩnh mạch đổ vào nhĩ. Có hai loại thụ quan nhĩ được tìm thấy. Các thụ quan loại A phát xung trong quá trình nhĩ thu và đáp ứng với những thay đổi áp lực buồng nhĩ. Thụ quan nhĩ loại B phát xung trong quá trình thất co bóp và đáp ứng với những thay đổi thể tích buồng nhĩ. Các thụ quan loại A kích thích còn thụ quan loại B ức chế hoạt động giao cảm. Những thụ quan căng giãn này gửi những thông tin hồi tác về vùng dưới đồi và ức chế tiết hormone bài niệu (vasopressin). Căng buồng nhĩ kích thích phóng thích yếu tố bài natri nhĩ (ANF) sẽ được bàn luận kỹ hơn trong phần sau. Các thụ quan nhĩ cũng làm thay đổi kích thích giao cảm của tuần hoàn thận [7]. Thông qua những cơ chế này, các thụ quan căng ở nhĩ đóng một vai trò quan trọng trong điều hoà thể tích nội mạch. Chúng cũng chịu trách nhiệm trong sự kích thích tăng tần số tim thông qua phản xạ Bainbridge.
Có hai loại thụ quan căng được tìm thấy trong cơ thất. Loại thứ nhất phát xung theo kiểu xung theo nhịp tim và có số lượng ít. Loại thứ hai đáp ứng với kích thích cơ học và với nhiều loại thuốc cũng như hoá chất thông qua các sợi thần kinh hướng tâm không bọc myelin, được gọi là các sợi C chủ yếu nằm ở thất trái. Kích thích các sợi C làm hạ huyết áp và chậm nhịp tim do kích thích phó giao cảm đồng thời ức chế giao cảm. Có những bằng chứng gợi ý rằng hoá thụ quan ở động mạch cảnh có vai trò quan trọng hơn trong kiểm soát điều hoà giao cảm dòng máu đến cơ trong khi các thụ quan tim có vai trò quan trọng hơn trong điều hoà lưu lượng máu thận.
Nhánh ly tâm của kiểm soát thần kinh, tức hệ thần kinh tự động, được chia thành hệ giao cảm và phó giao cảm. Có hai loại sợi thần kinh giao cảm: co mạch và giãn mạch. Kích thích giao cảm các tiểu động mạch bởi các sợi co mạch làm tăng kháng lực mạch máu. Những mạch máu này do vậy được gọi là mạch máu trở kháng (resistance vessel). Đầu tận thần kinh của các sợi giao cảm co mạch chứa norepinephrine. Chất co mạch này được phóng thích khi sợi thần kinh chứa nó bị kích thích. Các chất khác hiện diện ở bản khớp thần kinh mạch máu bao gồm các monoamine, polypeptide, purine và amino acid có thể ảnh hưởng đến sự phóng thích cũng như tác động của norepinephrine [7]. Những xung động đi trong sợi co mạch góp phần vào duy trì một trương lực mạch máu bình thường hay một tình trạng co mạch cơ bản ở hầu hết giường mạch máu trong trạng thái nghỉ. Những sợi co mạch này hiện diện nhiều nhất ở cơ vận động. Tại đây, trương lực mạch nội tại cao hơn trong trạng thái nghỉ. Tuy nhiên chúng lại rất ít ở não và mạch vành. Co mạch giao cảm ở các động mạch lớn và tĩnh mạch làm thay đổi thể tích của các mạch máu này do vậy làm thay đổi thể tích lưu thông. Những mạch máu này được gọi là các mạch dung chứa (capacitance vessel). Kích thích giao cảm cũng làm tăng lưu lượng máu thông qua hoạt hoá các sợi giãn mạch vốn được tìm thấy chủ yếu ở các giường mạch máu cơ hệ vận động. Chất trung gian của các sợi giãn mạch có thể là acetylcholine mặc dù ở loài linh trưởng, chất này có thể là epinephrine. Các sợi giãn mạch này có thể gây nên một sự gia tăng lượng máu nhỏ đến cơ vận động tuy nhiên khi có gắng sức cơ vận động thì cơ chế giãn mạch cục bộ có thể đóng vai trò quan trọng hơn.
Hệ thần kinh phó giao cảm chủ yếu kiểm soát chức năng và tần số tim và có vai trò rất nhỏ trong kiểm soát tuần hoàn ngoại vi. Các chất trung gian được lưu trữ trong đầu tận dây thần kinh là acetylcholine. Các sợi giãn mạch phó giao cảm được tìm thấy trong tuần hoàn não và bàng quang, trực tràng và bộ phận sinh dục ngoài.
Kiểm soát thể dịch
Kiểm soát thể dịch tuần hoàn ngoại biên có thể được mô tả rõ nhất là tình trạng co mạch hoặc giãn mạch khi đáp ứng với các hormone lưu hành trong máu. Hệ mạch máu ngoại biên có tính đáp ứng với nhiều chất lưu hành trong máu bao gồm các catecholamine, angiotensin II, vasopressin, eicosanoid, NO, neurokinin và các hormone có bản chất peptide.
Các catecholamine là những hormone của hệ adrenergic. Các thụ quan adrenergic đối với các catecholamine hiện diện ở cơ trơn ở toàn bộ hệ mạch máu ngoại biên và có thể được chia thành các α- và β-receptor. Kích thích α-receptor làm cơ trơn mạch máu co lại gây co mạch trong khi kích thích β-receptor gây giãn cơ làm giãn mạch. Những thụ quan này đáp ứng với catecholamine có nguồn gốc nội sinh lẫn ngoại sinh và các thuốc giống giao cảm (sympathomimetic drug). Norepinephrine, một chất chủ vận α-adrenergic, được tiết bởi tuỷ thượng thận và được dòng máu đưa đến các thụ quan ở giường mạch ngoại biên. Các sợi giao cảm trước hạch (preganglionic sympathetic fiber) phân bố cho tuỷ thượng thận và kích thích giải phóng norepinephrine. Như vậy, quá trình điều hoà thể dịch này được điều hoà bởi thần kinh trung ương. Epinephrine cũng được phóng thích bởi tuỷ thượng thận nhưng là chất kích thích mạch yếu hơn và dường như có khuynh hướng có hiệu ứng chủ vận β ở nồng độ sinh lý.
Angiotensin II, một chất co mạch mạnh, được sản xuất bởi sự hoạt hoá hệ renin- angiotensin-aldosterone. Bộ máy cận tiểu cầu (juxtaglomerular apparatus) trong thận tiết renin khi huyết áp động mạch thận giảm xuống hoặc giảm thể tích ngoại bào. Renin sau đó sẽ cắt angiotensinogen thành angiotensin I. Angiotensin I lại được chuyển thành angiotensin II bởi men chuyển angiotensin (angiotensin-converting-enzyme, ACE) hiện diện ở phổi và nội mô mạch máu. Angiotensin II có hoạt tính co mạch trực tiếp và tác động lên trung tâm thần kinh kích thích các trung tâm co mạch của não và kích thích phóng thích hormone chống bài niệu (vasopressin). Ngoài ra, renin còn có thể được hình thành tại chỗ ở nhiều cơ quan. Chính điều này phần nào giải thích vì sao ức chế thụ thể angiotensin có một tác động lâm sàng cộng hợp với các chất ức chế ACE. Hormone chống bài niệu được tổng hợp ở vùng hạ đồi và được tiết bởi tuyến yên sau. Đây là chất co mạch rất mạnh nhưng chỉ đóng vai trò tối thiểu trong điều hoà tuần hoàn ở trạng thái nghỉ.
Các prostaglandin và các eicosanoid khác đóng một vai trò nhỏ trong điều hoà lưu lượng máu ở tuần hoàn hệ thống. ANF là một hormone khác tham gia vào quá trình điều hoà tuần hoàn hệ thống. Hormone có bản chất peptide này được phóng thích từ tế bào cơ nhĩ ở cả hai nhĩ và từ tế bào cơ thất với một lượng nhỏ. Sản xuất ANF từ thất sẽ giảm xuống theo tuổi: giai đoạn bào thai thất sản xuất một lượng lớn ANF trong khi ở người lớn, thất chỉ sản xuất một lượng rất nhỏ ANF. Khi một trong hai nhĩ bị căng lên, ANF sẽ được phóng thích. Lượng ANF lưu hành trong máu tăng lên khi áp lực nhĩ trái tăng ngay cả khi áp lực nhĩ phải bình thường. Tại thận, ANF làm giảm tái hấp thu Natri tại ống thận. Trên hệ tuần hoàn, ANF có tác dụng giãn mạch và ức chế tim. Nồng độ ANF lưu hành trong máu tăng lên trong một số điều kiện sinh lý bệnh chẳng hạn như trong tim bẩm sinh có tăng áp lực nhĩ, suy tim xung huyết, bệnh van tim, tăng huyết áp, tắc hẹp động mạch vành và loạn nhịp nhĩ. Ngoài ra, peptide thải natri loại B (BNP), được sản xuất bởi cơ thất khi thất bị căng giãn, cũng có tác dụng thải Natri, thải nước và có tính chất hoạt mạch. Định lượng BNP được dùng trong chẩn đoán, phân tầng nguy cơ và trong xử trí bệnh tim ở người lớn và càng ngày càng được sử dụng rộng rãi hơn ở trẻ em bệnh tim.
Các yếu tố có nguồn gốc nội mô
Tế bào nội mô mạch máu có khả năng sản xuất nhiều chất hoạt mạch khác nhau tham gia vào quá trình điều hoà trương lực mạch bình thường. Những chất này, ví dụ như NO và ET-1, có khả năng gây giãn mạch và/hoặc co mạch điều hoà khuynh hướng đông máu và cảm ứng và/hoặc ức chế di chuyển cũng như tăng sinh tế bào cơ trơn [6][14] (Hình 8).
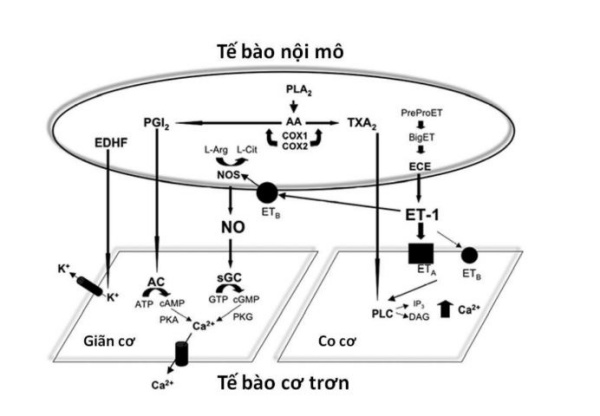
EDHF, yếu tố tăng phân cực có nguồn gốc nội mô; PGI2: prostaglandin I2; L-Arg: L-arginine; L-Cit: L-citrulline; PLA2: phospholipase A2; AA, arachidonic acid; COX1, cyclooxygenase-1; COX2, cyclooxygenase-2; TXA2: thromboxane A2; PrePro ET: PrePro endothelin; BigET: Big endothelin; NOS: nitric oxide synthase; ECE: men chuyển endothelin; ETB, thụ thể endothelin B; NO: nitric oxide; ET-1: endothelin-1; K+:kênh Kali; AC: adenylate cyclase; sGC: guanylate cyclase hoà tan; ATP: adenosine-triphosphate; cAMP: adenosine monophosphate vòng; GTP: guanosine-triphosphate; cGMP: guanosine-monophosphate vòng; PKA: phosphokinase A; PKG: phosphokinase G; ETA: thụ thể endothelin A; PLC: phospholipase C; IP3: inositol triphosphate; DAG: diacylglycerol.
Hiểu biết rõ hơn về vai trò của nội mô mạch máu trong điều hoà lưu lượng máu khi khoẻ và trong lúc bệnh đã đưa đến một số chiến lược điều trị nhắm đến đích là nội mô. Những trị liệu này bao gồm NO đường hít trong điều trị tăng áp động mạch phổi; bổ sung L- arginine trong bệnh mạch vành và bệnh phổi ở bệnh nhân mắc chứng hồng cầu hình liềm; ức chế phosphodiesterase (ví dụ sildenafil, có tác dụng ngăn ngừa giáng hoá của guanosine 3-5 monophosphate, cGMP) trong điều trị tăng áp động mạch phổi, chất đối kháng thụ thể endothelin trong tăng áp phổi và xuất huyết dưới nhện và chất ức chế NO trong hạ huyết áp kháng trị trong nhiễm trùng huyết hoặc còn ống động mạch. Trên thực tế, mặc dù nhiều trị liệu đã được ứng dụng lâu đời ví dụ như chất giãn mạch có nguồn gốc nitrate có tác động lên chức năng của nội mô chỉ mới được hiểu rõ gần đây.
NO là một yếu tố thể dịch mong manh, được sản xuất bởi men NO synthase, có nguồn gốc từ L-arginine trong tế bào nội mô mạch máu. NO khuếch tán vào tế bào cơ trơn và gây giãn mạch do làm tăng nồng độ của cGMP thông qua hoạt hoá guanylate cyclase hoà tan (Hình 8). NO được phóng thích dưới tác động của nhiều yếu tố khác nhau bao gồm sự cọ xát của dòng máu và sự gắn của một số chất giãn mạch phụ thuộc nội mô (endothelium-dependent vasodilator) như acetylcholine, ATP và bradykinin với thụ quan trên tế bào nội mô. Phóng thích NO ở mức cơ bản là một yếu tố quan trọng điều hoà trương lực mạch máu phổi và hệ thống ở trạng thái nghỉ của thai nhi, trẻ sơ sinh và người lớn. Đây cũng là yếu tố trung gian làm giảm kháng lực mạch máu phổi xuất hiện vào thời điểm đứa trẻ được sinh ra [17].
Endothelin-1 (ET-1) là một polypeptide có 21 amino acid được sản xuất bởi tế bào nội mô mạch máu [27]. Các tính chất hoạt mạch của ET-1 rất phức tạp. Các nghiên cứu đã cho thấy tác động huyết động thay đổi khác nhau của ET-1 trên những giường mạch máu khác nhau. Tuy nhiên, tính chất quan trọng nhất của nó là duy trì tác động tăng huyết áp. Thực ra ET-1 là chất co mạch mạnh nhất được phát hiện cho đến thời điểm hiện tại, mạnh gấp 10 lần angiotensin II. Hiệu ứng trên huyết động của ET-1 được điều hoà bởi ít nhất là hai quần thể receptor khác nhau: ETA và ETB. Các ETA receptor nằm ở các tế bào cơ trơn mạch máu có tác dụng điều hoà quá trình co mạch. Các ETB receptor có thể nằm ở tế bào nội mô và tế bào cơ trơn có tác dụng điều hoà cả quá trình co mạch lẫn giãn mạch (Hình 8). Endothelin xuất hiện với nồng độ thấp trong huyết tương, thường là dưới ngưỡng hoạt mạch. Điều này gợi ý rằng chúng chủ yếu chỉ tác động tại vị trí được phóng thích. Tuy nhiên, ngay cả với nồng độ thấp này thì nó cũng có thể tạo điều kiện tăng cường tác động của các chất co mạch khác như norepinephrine và serotonin. Vai trò của ET-1 nội sinh trong điều hoà trương lực mạch bình thường vẫn chưa được tường minh cho đến thời điểm hiện tại. Cho dù là như vậy thì những thay đổi của ET-1 cũng có vai trò trong sinh lý bệnh của một số tình trạng bệnh lý khác nhau [25].
Yếu tố tăng phân cực có nguồn gốc nội mô (endothelial-derived hyperpolarizing factor, EDHF) là chất có thể khuếch tán được và có khả năng gây nên giãn mạch bằng cách tăng phân cực tế bào cơ trơn. Đây cũng là một yếu tố nội mô quan trọng. EDHF vẫn chưa được nhận diện nhưng những bằng chứng hiện nay gợi ý rằng tác động của EDHF phụ thuộc vào kênh K+ [8] (Hình 8). Hoạt hoá kênh K+ ở tế bào cơ trơn mạch máu đưa đến tình trạng quá khử cực của màng tế bào làm đóng các kênh Ca++ phụ thuộc điện thế (voltage-dependent calcium channel) và cuối cùng là giãn mạch. Các kênh K+ cũng hiện diện ở tế bào nội mô. Hoạt hoá bên trong tế bào nội mô đưa đến sự thay đổi của dòng Ca++ và có thể đóng vai trò quan trọng trong giải phóng NO, prostacyclin I2, và EDHF. Các phân nhóm kênh K+ bao gồm kênh K+ nhạy cảm với ATP (ATP-sensitive K+ channel), kênh K+ phụ thuộc Ca++ (Ca++-dependent K+ channel), kênh K+ phụ thuộc điện thế và kênh K+ hướng nội (inward-rectifier K+ channel) [8].
Giáng hoá phospholipid bên trong tế bào nội mô đưa đến sự sản xuất các sản phẩm chuyển hoá phụ quan trọng của arachidonic acid bao gồm PGI2 và thromboxane A2 (TXA2). PGI2 hoạt hoá adenylate cyclase làm tăng sản xuất AMP vòng và gây nên giãn mạch. TXA2 gây co mạch thông qua con đường tín hiệu phospholipase C (Hình 8). Các prostaglandin khác và leukotriene cũng có hoạt tính hoạt mạch mạnh.
Nhìn chung, tuần hoàn vùng có khả năng điều hoà lưu lượng máu để có thể thu nhận được lượng ôxy và dưỡng chất theo nhu cầu chuyển hoá và tất cả các cơ chế được mô tả ở phần trước đều có thể tham gia vào. Tuy nhiên, có một nguyên lý chủ đạo là mức độ cọ xát phải được giữ trong một giới hạn hẹp để tránh làm tổn thương nội mô. Bất kỳ sự gia tăng lưu lượng máu cục bộ nào cũng đều được nhận biết bởi integrin nội mô. Integrin kích hoạt một dòng thác đáp ứng với điểm đến cuối cùng là phóng thích NO [22].
Các quá trình đáp ứng có nguồn gốc cơ trơn
Năm 1902, Baylins mô tả một sự gia tăng trương lực cơ nội tại khi áp lực bên trong lòng mạch tăng lên. Đáp ứng này làm thay đổi trương lực cơ xuất hiện sau những thay đổi về áp lực xuyên thành và căng thành [11]. Đáp ứng này đặc biệt quan trọng ở mức tiểu động mạch và được cho là có tham gia vào quá trình tự điều hoà tại chỗ. Tăng áp lực nội mạch và/hoặc sức căng làm tăng trương lực cơ trơn tiểu động mạch trong khi giảm áp lực có tác dụng ngược lại. Các cơ chế chính xác điều hoà đáp ứng này vẫn chưa biết rõ nhưng nghiên cứu cũng đã nhận thấy vai trò của những thay đổi động của nồng độ Ca++ nội bào và quá trình phosphoryl hoá myosin chuỗi nhẹ [5]. Các công trình gần đây tập trung vào vai trò của con đường phosphoryl hoá tyrosin trong đáp ứng này [16].
Các sản phẩm chuyển hoá cục bộ
Các tổ chức có khả năng điều hoà chính lưu lượng máu của chúng khi nhu cầu chuyển hoá thay đổi. Môi trường hoá học tại chỗ ở tiểu động mạch có thể gây giãn mạch hoặc co mạch ở một mức độ nhẹ hơn. Ví dụ giảm PO2, tăng PCO2 và tăng nồng độ ion H+ hoặc K+ đều làm giãn tiểu động mạch. Rất nhiều tổ chức phóng thích adenosine, một chất giãn mạch mạnh, khi nhu cầu chuyển hoá tăng hoặc giảm áp lực ôxy. Các yếu tố trung gian khác bao gồm lactic acid, histamine, prostaglandin, ET-1 và NO.
Điều hoà tuần hoàn cục bộ
Kháng lực mạch máu bên trong tuần hoàn cục bộ quyết định sự phân bố lưu lượng máu đến từng cơ quan. Hiểu biết rõ các yếu tố điều hoà kháng lực bên trong từng giường mạch cục bộ đặc biệt có tầm quan trọng thiết yếu để các bác sĩ hồi sức có thể ứng phó thích hợp với những nhiễu loạn tim mạch vì mỗi cơ quan có những nhu cầu thay đổi nếu không nói là khác biệt.
Ngoài ra, khi điều trị trẻ sơ sinh, việc hiểu được tuần hoàn bào thai cũng là điều cốt lõi vì một số vấn đề có thể xuất hiện khi quá trình chuyển tiếp bình thường từ tuần hoàn sơ sinh sang tuần hoàn sau sinh bị rối loạn. Mặc dù tuần hoàn bào thai không phải là tuần hoàn cục bộ nhưng hệ tuần hoàn này lạị được đánh dấu bởi những khác biệt quan trọng so với tuần hoàn sau sinh xét trên phương diện lưu lượng máu vùng.
Tuần hoàn bào thai
Sự hiện diện của các luồng shunt trung tâm cho phép tuần hoàn bào thai đặc biệt hiệu quả trong cung cấp ôxy và cơ chất chuyển hoá. Các buồng thất của thai nhi chủ yếu thực hiện vai trò như sau: thất phải của thai nhi cung cấp phần lớn cung lượng của nó vào ĐM phổi, qua ống động mạch vào động mạch chủ xuống để đến rau thau với mục đích nhận ôxy. Thất trái bơm phần lớn cung lượng máu của nó vào động mạch chủ lên để đến tim và não với mục đích cung cấp ôxy (Hình 9). Để tuần hoàn tĩnh mạch trung tâm có thể trợ giúp nhiệm vụ này, máu tĩnh mạch ít bão hoà nhất phải được hướng đến thất phải và máu được bão hoà ôxy nhiều nhất phải đi đến thất trái. Để hiểu được quá trình được thực hiện như thế nào, cách tốt nhất là chúng ta tạm chia tuần hoàn tĩnh mạch trung tâm thành năm cấu phần: máu trở về từ phần trên của cơ thể, từ cơ tim, từ phổi, từ phần dưới của cơ thể và từ rau thai.
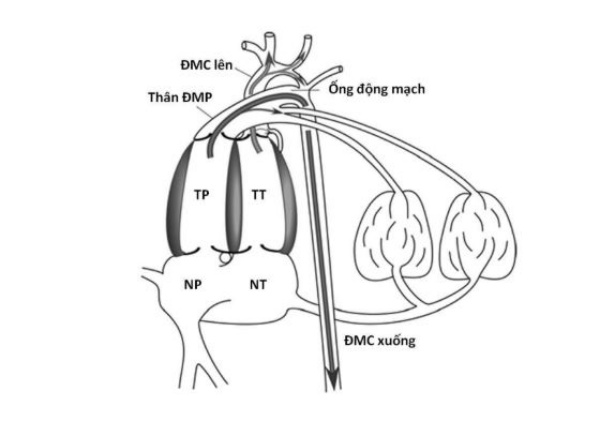
Thất trái (TT) nhận máu từ nhĩ trái (NT) và tống phần lớn vào ĐMC lên đến tim và phần trên của cơ thể là những nơi có nhu cầu chuyển hoá rất cao. Thất phải (TP) nhận máu từ nhĩ phải (NP) và tống phần lớn qua thân ĐMP qua ống động mạch xuống ĐMC xuống và đến rau thai để nhận ôxy từ hồ máu mẹ.
Máu ít bão hoà nhất trở về từ phần trên cơ thể qua TMC trên và từ cơ tim qua xoang vành. Máu này chủ yếu đi qua van ba lá để vào thất phải. Ngoài ra, vị trí của xoang vành cũng nằm phía dưới lỗ bầu dục lên máu từ cơ tim cũng được hướng về van ba lá để qua thất phải (Hình 9). Máu trở về từ phổi không được bão hoà nhưng do vị trí giải phẫu tự nhiên nên máu này sẽ vào nhĩ trái và qua thất trái. Tuy nhiên, vì lượng máu TM phổi chiếm không quá 8% cung lượng thất nên nó không ảnh hưởng nhiều đến cung cấp ôxy cho thai nhi.
Tĩnh mạch chủ dưới dẫn máu từ phần dưới cơ thể và từ rau thai. Phần lớn máu từ phần dưới cơ thể, trừ máu từ gan, đi lên theo TMC dưới. Dòng máu này tương đối kém bão hoà đi vào bờ bên của thất phải và sau đó đi qua van ba lá. Máu từ rau thai (tĩnh mạch rốn) và từ gan có đường đi tương đối phức tạp (Hình 10). Trong điều kiện bình thường ở bào thai cừu, khoảng 55% lượng máu rốn có bão hoà ôxy cao đi lên qua ống tĩnh mạch đổ vào chỗ nối TMCD-nhĩ phải và tại đây nó chủ yếu đi qua lỗ bầu dục. Khoảng gần một nửa máu tĩnh mạch rốn còn lại đi vào thuỳ trái của gan để rồi từ đó nó đổ vào tĩnh mạch gan trái. TM gan trái nối với ống tĩnh mạch gần TMCD nhờ đó mà máu có bão hoà ôxy cao cũng được hướng đi qua lỗ bẫu dục. Rìa của lỗ bầu dục giúp hướng máu đi vào nhĩ trái. Phần còn lại của máu tĩnh mạch rốn, cùng với 95% máu của tĩnh mạch cửa kém bão hoà sẽ được đi qua thuỳ gan bên phải. Từ đây, lượng máu có độ bão hoà thấp này sẽ đi đến tĩnh mạch gan phải và để qua van ba lá cùng với lượng máu kém bão hoà của TMC dưới đã nói ở trên. Máu động mạch gan có bão hoà ôxy cao nhưng chỉ chiếm dưới 10% lưu lượng máu gan của bào thai nên nó không đóng góp đáng kể vào cung cấp ôxy. Máu động mạch gan được phân bố cho cả gan bên phải và bên trái nhưng bên phải có nhận nhiều hơn một chút.
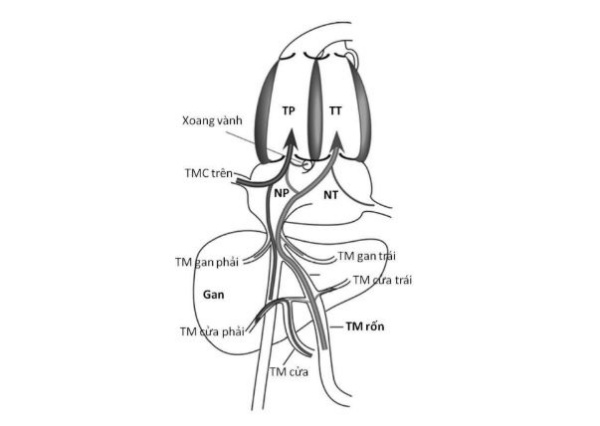
Máu có độ bão hoà ôxy cao từ tĩnh mạch rốn đi qua ống tĩnh mạch và tĩnh mạch gan trái để vào nhĩ trái (NT) rồi vào thất trái. Máu có độ bão hoà ôxy thấp từ TMC dưới, tĩnh mạch gan phải, xoang vành và TMC trên qua nhĩ phải (NP) để vào thất phải.
Như vậy, dòng máu có hướng ưu tiên khác nhau từ các nguồn khác nhau cho phép máu có độ bão hoà ôxy thấp từ phần trên và phần dưới của cơ thể đi vào nhĩ phải, qua van ba lá và vào thất phải trong khi đó máu có độ bão hoà ôxy cao từ tĩnh mạch rốn lại đến được thất trái. Mặt dù sự phân cách của cung lượng thất của thai nhi không hiệu quả bằng sau sinh nhưng đây cũng là điều đáng ghi nhận rằng tim thai có khả năng thực hiện chức năng cung cấp ôxy rất tốt.
Chuyển tiếp từ tuần hoàn bào thai sang tuần hoàn sau sinh
Những thay đổi của tuần hoàn trung tâm vào lúc sinh chủ yếu gây nên bởi các biến cố bên ngoài hơn là những thay đổi của bản thân hệ tuần hoàn. Biến cố quan trọng nhất là sự giảm nhanh với mức giảm lớn của kháng lực phổi (PVR) và sự cắt đứt liên kết tuần hoàn rốn-rau thai. Có nhiều cơ chế khác nhau gây nên sự giảm của PVR, sẽ được bàn ở phần sau. Đột ngột ngay lúc sinh, máu qua ống động mạch sẽ chuyển hướng từ phải sang trái thành từ trái sang phải (từ ĐMC sang ĐMP) cho đến thời điểm đóng hoàn toàn khoảng vài giờ đến vài ngày sau sinh. Luồng shunt qua ống động mạch có thể kéo dài hơn ở trẻ đẻ non gây nên trộm máu ở các giường mạch máu vùng có kháng lực cao nhất.
Như đã nói ở phần trước, ống tĩnh mạch mang máu tĩnh mạch rốn chủ yếu đổ về thất trái. Mặc dù lượng máu tĩnh mạch rốn đi vào ống TM dao động và bị ảnh hưởng rất lớn với các kích tác như hạ ôxy máu, thay đổi của dòng máu dường như không phải do co mạch chủ động của ống tĩnh mạch mà dường như chỉ là hiện tượng thụ động tương thích với sự thay đổi của dòng máu rốn. Vào lúc sinh, tuần hoàn rốn-rau thai bị cắt đứt làm cho giảm lưu lượng máu qua ống tĩnh mạch và dòng máu vào gan trái. Tuy nhiên, dòng máu tĩnh mạch cửa qua ống tĩnh mạch lại tăng lên từ < 5% đến > 50% sau 1 giờ tuổi do vậy cho dù lượng máu tĩnh mạch của tăng lên sau sinh nhưng lượng máu qua gan lại giảm đi rõ rệt. Luồng shunt của máu TM cửa qua ống tĩnh mạch chỉ xuất hiện tạm thời, thường chỉ tồn tại trong khoảng 1 ngày đến 2 tuần. Ống TM đóng về mặt chức năng có thể là một hiện tượng thụ động mặc dù người ta đã chứng minh rằng ống tĩnh mạch biệt lập có thể giãn khi có mặt của prostaglandin E1. Như vậy, quá trình đóng ống TM có thể được khởi hoạt bởi những thay đổi thể dịch tương tự như đối với trường hợp đóng ống động mạch.
Mặc dù các quá trình chủ động có liên quan đến đóng ống ĐM và có thể là ống TM nhưng đóng lỗ bầu dục vào thời điểm ra đời là một quá trình hoàn toàn thụ động thứ phát sau những biến đổi của tương quan lượng máu về nhĩ trái và nhĩ phải. Trước khi sinh, lượng máu tĩnh mạch phổi đổ trực tiếp về nhĩ trái chỉ chiếm 8% tổng lượng máu tĩnh mạch đổ về. Như vậy, chênh áp từ phải sang trái giúp duy trì một lượng máu lớn đi qua lỗ bầu dục và nắp lỗ bầu dục giống như một túi gió phình sang phía nhĩ trái. Khi bắt đầu có ôxy đi vào phổi do lần thở đầu tiên của trẻ sơ sinh, tỉ lệ máu TM phổi đi về nhĩ trái tăng lên đáng kể (50%) so với tổng lượng máu tĩnh mạch đổ về tim [24] do lưu lượng máu phổi tăng đột ngột, kể cả sự góp phần của luồng máu từ ĐMC sang phổi qua ống ĐM chưa đóng. Áp lực nhĩ trái vì vậy tăng cao hơn bên nhĩ phải và phần nắp lỗ bầu dục trước đây phình sang nhĩ trái nay được ép sát vào vách liên nhĩ. Luồng shunt trái sang phải nhỏ có thể phát hiện được bằng siêu âm Doppler ở trẻ sơ sinh tuy nhiên luồng shunt này không có ý nghĩa huyết động học. Mặc dù lỗ bầu dục có thể vẫn chưa đóng hoàn toàn trong vài năm đầu đời nhưng một luồng shunt có ý nghĩa huyết động học chỉ có thể xảy ra khi có khiếm khuyết của vách tiên phát tạo nên thông liên nhĩ lỗ thứ phát hoặc khi bệnh nhân bị thông liên nhĩ tiên phát.
Tương tác giữa tuần hoàn hệ thống và tuần hoàn phổi
Mô hình giản ước của hệ tuần hoàn được trình bày ở Hình 2 mô tả kháng lực như là một bộ kháng trở đơn nằm giữa các ĐM lớn và TM lớn của tuần hoàn hệ thống. Trên thực tế, tổng kháng lực hệ thống là tổng của các kháng lực ở mỗi giường mạch vùng. Kháng lực mạch máu phổi (Pulmonary Vascular Resistance, PVR), thường có trị số khoảng 10 đến 20% kháng lực mạch máu hệ thống (Systemic Vascular Resistance, SVR), có đặc tính khác biệt vì thất phải bơm máu riêng biệt vào hệ thống mạch máu phổi. Như vậy, trong điều kiện bình thường chỉ cần quan tâm đến kháng lực hệ thống như là một tác nhân ảnh hưởng đến cung lượng tim. Tuy nhiên trong trường hợp tim phải bị suy, PVR sẽ phải được tính theo kiểu nối tiếp vào tổng SVR. Hiệu ứng này càng thấy rõ trong trường hợp thất phải bị suy mà hệ mạch máu phổi lại có kháng lực cao. Như vậy, trong một số bệnh lý nặng khác nhau, cần phải đánh giá cả SVR lẫn PVR.
Tuần hoàn phổi
Các cơ chế chính xác liên quan đến giãn và co cơ trơn mạch máu phổi nội tại vẫn chưa được hiểu tường tận tuy nhiên những tiến bộ gần đây đã tập trung vào vai trò của nội mô mạch máu phổi trong quá trình này. Những thay đổi trong kháng lực mạch máu phổi có thể xuất hiện ở nhiều cấp độ khác nhau trong hệ tuần hoàn và các chất hoạt mạch cũng như tính chất của chúng có thể thay đổi khi đi qua giường mạch phổi do hoạt động chuyển hoá của phổi.
Phát triển hình thái học
Giai đoạn phát triển hình thái của tuần hoàn phổi ảnh hưởng đến đáp ứng đối với các kích thích khác nhau trong giai đoạn chu sinh. Ở thai nhi và trẻ sơ sinh, các động mạch phổi nhỏ có tỉ suất giữa lớp cơ áo giữa dày và đường kính lòng mạch lớn hơn tỉ suất này ở người lớn. Sự gia tăng lớp cơ này là một phần nguyên nhân của tính tăng đáp ứng của mạch máu phổi cũng như tăng PVR ở trẻ sơ sinh ngay sau khi ra đời.
Các nghiên cứu ở phổi người đã nhận thấy rằng các động mạch phổi nhỏ so với đường dẫn khí. Các động mạch song hành cùng với đường thở cho đến tận phế nang. Nếu đi dọc những mạch máu này ra xa, chúng ta sẽ đến được một điểm mà ở đó lớp cơ áo giữa không còn bao bọc toàn bộ chu vi của mạch máu nữa. Thay vào đó nó nhường chỗ cho những vùng được cơ bao bọc không hoàn toàn. Ở những động mạch chỉ được bọc cơ một phần này, cơ trơn được sắp xếp theo hình xoắn ốc. Các phần không có cơ của mạch máu này có chứa những tế bào tiền thân sinh cơ. Trong một số điều kiện nào đó, ví dụ như thiếu ôxy, những tế bào tiền thân này biệt hoá nhanh chóng thành các tế bào cơ trưởng thành. Nếu đi dọc các mạch máu này ra xa hơn nữa, chúng ta sẽ đi đến vùng hoàn toàn không có cơ. Tuy nhiên, những mạch máu này vẫn có kích thước lớn hơn mao mạch. Ở những động mạch này, có một lớp tế bào ngoại mạch (pericyte) không hoàn chỉnh nằm dưới lớp nền của nội mô.
Ở thai nhi gần đủ tháng, chỉ có khoảng một nửa tiểu động mạch trước mao mạch (những mạch máu này đi kèm với các tiểu phế quản hô hấp) có cơ hoặc có cơ một phần còn các động mạch đi kèm với phế nang thì không có cơ trơn. Trong 4 đến 6 tuần đầu sau sinh, có sự thoái triển dần của lớp cơ áo giữa bọc quanh động mạch làm giảm độ dày tổng cộng của lớp cơ của động mạch phổi nhỏ. Ở người trưởng thành, lớp cơ bao bọc này lại lan đến ngoại biên dọc theo các động mạch trong tiểu thuỳ (intra-acinar artery). Do vậy, hầu hết động mạch đều có lớp cơ trơn mặc dù đây chỉ là một lớp rất mỏng. Kiểu cấu trúc này đạt được vào tuổi dậy thì. Một số rối loạn mạch máu phổi thời kỳ sơ sinh (ví dụ bệnh tim bẩm sinh có tăng luồng máu lên phổi) gây nên sự đình trệ của quá trình thoái triển nói trên và/hoặc diễn tiến sớm đến kiểu cấu trúc của người trưởng thành.
Trong quá trình phát triển thai nhi, số lượng động mạch nhỏ tăng lên rất nhanh. Ở người, các nhánh động mạch phổi tiền phân thuỳ chính (main preacinar pulmonary arterial branch) song hành cùng với các đường dẫn khí lớn phát triển vào tuần thứ 16 của thai kỳ tuy nhiên tuần hoàn trong tiểu thuỳ chỉ xuất hiện chậm sau này cùng với sự phát triển của phế nang. Và sau khi sinh, các động mạch tăng nhanh số lượng khi các phế nang phát triển. Quá trình này kết thúc khi trẻ được khoảng 10 tuổi [18].
Dòng máu trong tuần hoàn thai nhi
Ở thai nhi, trao đổi khí xuất hiện tại rau thai và lưu lượng máu phổi thấp, chỉ cung cấp nhu cầu dinh dưỡng cho sự phát triển của phổi cũng như đảm bảo cho phổi thực hiện chức năng chuyển hoá hoặc cận tiết (paraendocrine function). Lưu lượng máu phổi ở thai cừu gần đủ tháng chiếm khoảng 8-10% tổng cung lượng hai thất vì máu thất phải không được dẫn vào phổi mà qua ống động mạch nở lớn để sang động mạch chủ ngực xuống rồi đến rau thai nhằm trao đổi khí (Hình 9). Áp lực trung bình động mạch phổi thai nhi tăng dần theo thai kỳ và đạt khoảng 50 mmHg khi thai đủ tháng, cao hơn HA trung bình khoảng 1 đến 2 mmHg. Tổng kháng lực phổi cực kỳ cao ở thai nhi so với kháng lực của nhũ nhi hoặc người lớn.
Điều hoà kháng lực mạch máu trong thai nhi
Kháng lực mạch máu phổi ở phổi thai nhi cao và giảm dần trong suốt quý thứ ba của thai kỳ. Có rất nhiều yếu tố bao gồm cả những tác động cơ học, tình trạng cung cấp ôxy mô và sự sản xuất các chất hoạt mạch có tác dụng điều hoà trương lực tuần hoàn phổi thai nhi. Yếu tố quan trọng nhất làm tăng kháng lực mạch máu phổi thai nhi là áp lực ôxy riêng phần trong máu thấp (PO2 của máu ĐMP khoảng 17 đến 20 mmHg). Cơ chế và vị trí chính xác của co mạch máu phổi do hạ ôxy trong tuần hoàn phổi thai nhi vẫn chưa được rõ ràng. Bên cạnh môi trường ôxy thấp, nhiều chất khác như chủ vận α, TXA2 và leukotriene cũng làm co mạch máu phổi thai nhi. Tuy vậy dường như chúng đóng vai trò không đáng kể trong việc duy trì một SVR cao. Bên cạnh sự sản xuất các chất co mạch thì tuần hoàn thai nhi cũng sản xuất các chất giãn mạch có vai trò điều hoà mức độ co mạch trong các điều kiện bình thường và có thể đóng vai trò chủ động hơn trong lúc thai nhi bị stress. NO có vẻ đóng vai trò đặc biệt quan trọng. Ở thai cừu, ức chế tổng hợp NO làm tăng rõ rệt kháng lực mạch máu phổi lúc nghỉ và ức chế sự giảm kháng lực phổi do ôxy. Hơn nữa, các nghiên cứu động mạch trong phổi và các chế phẩm phổi biệt lập ở cừu đã cho thất sự gia tăng theo mức độ trưởng thành của quá trình giãn mạch được điều hoà bởi NO trong giai đoạn cuối của thai kỳ cũng như giai đoạn sớm sau sinh.
Điều hoà kháng lực mạch máu phổi trong quá trình chuyển tiếp chu sinh
Vào lúc sinh, cùng với việc phổi được thông khí, kháng lực phổi giảm xuống nhanh chóng làm tăng từ 8 đến 10 lần lưu lượng máu phổi. Vào ngày thứ nhất sau sinh, áp lực phổi trung bình còn khoảng một nửa huyết áp hệ thống. Sau khi áp lực và kháng lực phổi giảm đột ngột, quá trình giảm diễn ra chậm hơn và đạt đến mức của người lớn vào khoảng 2 đến 6 tuần sau sinh (Hình 11).
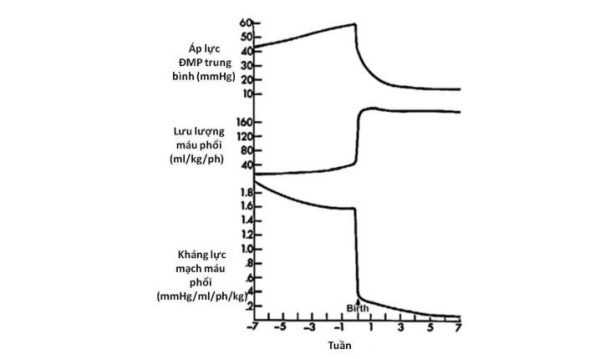
Các cơ chế điều hoà sự giảm kháng lực phổi và tăng lưu lượng máu phổi sau sinh phần lớn có liên quan đến áp lực riêng phần ôxy và sự giãn nở cơ học của phổi. Vai trò của ôxy được chứng minh bằng một thực tế là lưu lượng máu phổi tăng khi được thở ôxy lưu lượng cao mà không cần thông khí. Vai trò của giãn nở cơ học phổi được thể hiện ở chỗ khi phổi được làm giãn bằng một hỗn hợp khí có ôxy nồng độ thấp không làm thay đổi thành phần khí máu nhưng vẫn gây được sự giãn mạch phổi. Các cơ chế chính xác của hiện tượng giãn mạch phổi do ôxy trong tuần hoàn chuyển tiếp từ thai sang trẻ sơ sinh vẫn còn chưa rõ ràng. Tăng áp lực ôxy phế nang hay động mạch làm giảm kháng lực mạch máu phổi có thể qua hoạt hoá trực tiếp kênh K+ hoặc gián tiếp thông qua kích thích sự sản xuất các chất giãn mạch như PGI2, bradykinin, adenosine, ATP và NO. Giãn nở phổi đơn độc cũng có thể làm giảm kháng lực phổi thông qua các cơ chế cơ học hoặc hoá học. Một trong những cơ chế đó liên quan đến sự thay đổi sức căng bề mặt phế nang. Một cơ chế khác quan trọng hơn là sự sản xuất và phóng thích prostaglandin (chủ yếu là PGI2) xuất hiện bởi kích thích cơ học của phổi hoặc do sự giãn nở theo nhịp của phổi [13].
NO được coi là một chất trung gian quan trọng làm giảm kháng lực phổi vào lúc sinh có liên quan đến tăng ôxy. Ví dụ ức chế tổng hợp NO làm giảm mức độ tăng lưu lượng máu phổi do ôxy ở thai cừu khi cho cừu mẹ thở ôxy áp lực cao hoặc thông khí có ôxy trong tử cung. Thông khí trong tử cung mà không làm thay đổi khí máu thai làm tăng sự biểu hiện của gene NO synthetase nội mô ở chủ mô phổi của thai cừu. Sự tổng hợp này còn gia tăng hơn nữa khi thông khí với 100% ôxy. Các dữ liệu in vitro phát hiện có sự tăng sản xuất NO theo tuổi trưởng thành vào cuối thai kỳ và đầu thời kỳ sau sinh. Sự gia tăng này được điều hoà một phần bởi ôxy. Hơn nữa, ức chế tổng hợp NO cấp tính lẫn mạn tính trước khi sinh đều làm giảm đáng kể sự tăng lưu lượng máu vào lúc sinh. Những dữ liệu này gợi ý rằng hoạt động của NO có vai trò quan trọng trong tuần hoàn chuyển tiếp. Tuy nhiên, sự giảm tức thời của kháng lực phổi trong một vài phút đầu sau sinh không bị giảm bởi ức chế NO nói trên. Như vậy, sự giảm PVR là do sự khởi đầu của thông khí và cung cấp ôxy. Thứ nhất, giãn mạch phổi gây nên do căng giãn cơ học phổi và sự sản xuất prostaglandin (PGD2 và PGI2). Hai quá trình này có thể không liên quan đến sự cung cấp ôxy bào thai và gây nên một sự tăng lưu lượng máu phổi và giảm PVR không nhiều lắm. Thứ hai, sự giãn mạch máu phổi tiếp diễn có liên quan đến sự cung cấp ôxy bào thai. Quá trình này độc lập với sự sản xuất prostaglandin và dường như là do sự tổng hợp NO mặc dù kích thích nào vẫn chưa được nhận diện. Cả hai cấu phần này cần thiết cho quá trình chuyển tiếp sang đời sống ngoài tử cung được diễn ra suôn sẻ.
Điều hoà kháng lực mạch máu phổi sau sinh
Chuyển tiếp tuần hoàn phổi thành công từ đời sống trong tử cung ra đời sống ngoài tử cung được đánh dấu bởi sự duy trì giường mạch phổi ở trạng thái giãn và có kháng lực thấp. Các bằng chứng gợi ý rằng sự phóng thích NO ở mức cơ bản và sự tăng nồng độ GMP vòng sau đó điều hoà một phần kháng lực mạch máu phổi thấp ở trạng thái nghỉ của trẻ sơ sinh [20]. Các chất hoạt mạch khác bao gồm histamine, 5-hydroxytryptamine, bradykinin và các chất chuyển hoá của arachidonic acid qua con đường cyclooxygenase và lipoxygenase cũng có vai trò trong điều hoà trương lực mạch máu phổi sau sinh. Tuy vậy, vai trò của chúng vẫn chưa được làm sáng tỏ. Hai trong số những yếu tố quan trọng nhất ảnh hưởng đến PVR trong giai đoạn sau sinh là nồng độ ôxy và pH. Giảm áp lực ôxy và giảm pH gây nên co mạch máu phổi. Hạ ôxy phế nang làm co tiểu động mạch phổi, chuyển máu ra khỏi vùng phổi thiếu ôxy đến vùng phổi được cung cấp ôxy tốt hơn nhờ đó tăng cường tương xứng thông khí/tưới máu. Đáp ứng này của mạch máu phổi là độc nhất và có mức độ lớn hơn ở động vật trẻ so với động vật trưởng thành. Thực tế, ở hầu hết giường mạch (kể cả mạch máu não) hạ ôxy là yếu tố gây giãn mạch mạnh.
Cơ chế chính xác của co mạch phổi do hạ ôxy vẫn chưa được hiểu hoàn toàn nhưng dường như liên quan đến sự thay đổi nồng độ tại chỗ của các gốc ôxy phản ứng (reactive oxygen species, ROS). Các chất này điều hoà các kênh K+ và Ca++ phụ thuộc điện thế [15]. Nhiễm toan làm mạnh hơn đáp ứng co mạch do hạ ôxy trong khi nhiễm kiềm có tác dụng ngược lại [21]. Cơ chế chính xác của tính đáp ứng của mạch máu phổi được điều phối bởi pH vẫn còn phải được làm sáng tỏ thêm nhưng có vẻ độc lập với PaCO2. Các dữ liệu đã gợi ý rằng kênh K+ cũng có thể đóng vai trò quan trọng trong điều hoà những đáp ứng này [3]. Tác động lên áp lực ôxy phế nang và pH động mạch hệ thống là những chiến lược cơ bản làm thay đổi trương lực mạch máu phổi trong hồi sức. Tăng ôxy phế nang và nhiễm kiềm thường được sử dụng để hạ trương lực mạch máu phổi vì chúng thường đảo ngược được tình trạng co mạch máu phổi mà ít có ảnh hưởng đến tuần hoàn hệ thống. Tuy nhiên, nên tránh gây nhiễm kiềm nặng vì hạ CO2 máu nặng hoặc nhiễm kiềm nặng lại có tác động xấu đến lưu lượng máu não [14].
Mặc dù phổi được phân bố rất nhiều thần kinh nhưng tác động của thần kinh không đóng vai trò quan trọng trong duy trì trương lực mạch máu cơ bản. Tuy nhiên vì các receptor thần kinh thể dịch của phổi nhạy cảm với các chất chủ vận α-adrenargic, β-adrenardic và dopaminergic nên các tác nhận vận mạch kích thích các thụ thể này cũng sẽ có tác động đến trương lực mạch của cả tuần hoàn hệ thống lẫn tuần hoàn phổi. Vì những thay đổi trong trương lực mạch khi có mặt các tác nhân này phụ thuộc vào trương lực tương đối của một giường mạch máu ở một thời điểm nhất định nên đáp ứng với các tác nhân này rất khó để tiên đoán ở từng bệnh nhân cụ thể trong đơn vị hồi sức.
Lưu lượng máu phổi sau sinh
Một số yếu tố khác, độc nhất của phổi, ảnh hưởng đến lưu lượng máu phổi bên cạnh trương lực mạch máu phổi. Khi ở tư thế đứng, do trọng lực nên áp lực phổi trung bình tăng dần từ đỉnh phổi xuống đáy phổi nhưng áp lực phế nang thì tương đối hằng định trong toàn bộ phổi. Như vậy, tương quan giữa áp lực bên trong lòng mạch và áp lực phế nang không đồng nhất ở các vùng phổi khác nhau mà nó phụ thuộc vào chiều cao bên trong phổi. Mối tương quan này càng trở nên phức tạp do những tác động của sự căng phổi lên áp lực mạch máu phổi. Tác động này lại phụ thuộc vào tương quan không gian giữa phế nang và mạch máu. Các mạch máu phổi được gọi là ngoài phế nang, góc hoặc trong phế nang. Các mạch máu ngoài và góc phế nang tăng kích thước khi phổi căng giãn do chủ mổ phổi kéo thành mạch máu theo hướng ly tâm. Tuy nhiên, các mạch máu trong phế nang lại có liên quan trực tiếp đến các phế nang và như vậy lại bị xẹp lại khi phế nang căng lên.
Để đặc tính hoá mối tương quan này, West đã chia phổi thành ba vùng lý thuyết đi từ đỉnh phổi xuống đáy phổi và dựa vào tương quan giữa áp lực ĐM phổi (PAP) hay áp lực dòng máu vào, áp lực phế nang (Pav) và áp lực tĩnh mạch phổi (Pven) hay áp lực dòng máu đi ra. Về mặt lý thuyết thì sẽ không có dòng máu đi vào vùng I do Pav lớn hơn PAP hay Pav>PAP>Pven. Trong vùng này, các mạch máu trong phế nang bị xẹp. Trên lâm sàng, vùng I như vậy không tồn tại ở phổi lành vì rõ ràng dòng máu có đi đến đỉnh phổi. Chính các mạch máu ngoài phế nang và góc vẫn mở giúp duy trì dòng máu đến được đỉnh phổi. Ở vùng II, PAP lớn hơn Pav và do vậy dòng máu không phụ thuộc vào áp lực dòng máu đi ra hay PAP>Pav>Pven. Trong vùng này, dòng máu tăng lên ở phần thấp của phổi vì chỉ có PAP bị ảnh hưởng bởi trọng lực chứ không phải Pav. Trong vùng III, lưu lượng máu được quyết định bởi mối tương quan bình thường giữa PAP và Pven hay áp lực máu vào trừ đi áp lực dòng máu đi ra. Trong vùng này, lưu lượng máu không thay đổi đáng kể ở phần dưới của phổi như ở trong vùng II vì trong lực ảnh hưởng đến PAP và Pven như nhau hay PAP>Pven>Pav. Sau đó, người ta cũng đã mô tả thêm một vùng nữa, vùng IV, trong đó lưu lượng máu phổi giảm ở phần tận đáy của phổi. Sự giảm này xảy ra là do tác động trọng lượng phổi lên mạch máu ngoài phế nang và mạch máu góc. Trọng lượng phổi sẽ chèn ép làm tăng sức cản và giảm thông khí ở vùng đáy làm gây nên các vùng thiếu ôxy tương đối và do vậy đưa đến tình trạng co mạch phổi do hạ ôxy.
Trong điều kiện bình thường, lưu lượng máu phổi chủ yếu được quyết định bởi vùng III. Tuy nhiên, trong điều kiện bệnh lý, những điều kiện ít thuận lợi hơn có thể chiếm ưu thế. Đặc biệt quan trọng đối với hồi sức nhi khoa là ảnh hưởng của thông khí áp lực dương với mức áp lực đỉnh thở vào cao. Tăng áp lực phế nang có thể làm giãn vùng II và cho phép vùng I thực sự hiện diện làm bất xứng thông khí/tưới máu tạo shunt trong phổi gây hạ ôxy máu và tăng carbonic. Tương tự, viêm phổi và phù phổi có thể làm tăng vùng IV. Cuối cùng, hạ huyết áp do các nguyên nhân khác nhau như xuất huyết có thể tăng vùng I và vùng II.
Tuần hoàn vành
Lưu lượng máu và cung cấp ôxy cho toàn bộ cơ thể phụ thuộc vào bơm tim. Tăng nhu cầu cơ thể phải được đáp ứng bởi tăng cung cấp các chất chuyển hoá. Điều này thường đòi hỏi phải tăng cung lượng tim và điều này đồng nghĩa với tăng tiêu thụ ôxy cơ tim. Nhu cầu ôxy cơ tim hầu như được đáp ứng chỉ bằng cách tăng cung lượng vành. Cung lượng vành được điều hoà không chỉ bởi nhu cầu của cơ tim mà là nhu cầu của toàn bộ cơ thể tại một thời điểm nhất định.
Giải phẫu mạch vành
Dòng máu đến cơ tim được cung cấp bởi các động mạch vành phải và trái bắt nguồn từ các xoang Valsalva phía sau là vành phải và vành trái của van động mạch chủ. ĐM vành phải cung cấp máu cho nhĩ phải và thất phải trong khi ĐMV trái chia thành hai nhánh là nhánh liên thất trước trái và nhánh mũ vành cung cấp máu cho nhĩ trái và thất trái. Tĩnh mạch trở về nhĩ phải chủ yếu là nhờ xoang vành và một phần nhỏ hơn qua các tĩnh mạch vành trước. Ngoài ra, các mạch máu động mạch xoang, động mạch lòng và Thebese nối hệ thống ĐMV với các buồng tim tạo thành một đám rối mạch máu dưới nội mạc phức tạp.
Điều hoà lưu lượng máu vành
Lưu lượng máu vành được điều hoà bởi các lực cơ học có liên quan đến vị trí giải phẫu của hệ mạch vành bên trong và xung quanh cơ tim động, bởi những yếu tố chuyển hoá liên kết lưu lượng máu vành với nhu cầu ôxy và bởi các yếu tố thần kinh. Trong điều kiện bình thường, khi áp lực tưới máu hay dòng máu vào của tuần hoàn vành không thay đổi nhiều thì những biến đổi trong lưu lượng máu vành chủ yếu được quyết định bởi sự thay đổi của kháng lực mạch máu do thay đổi đường kính lòng mạch.
Các yếu tố cơ học điều hoà lưu lượng máu vành
Áp lực tưới máu vành có liên quan trực tiếp với áp lực động mạch chủ. Lưu lượng máu bên trong hệ mạch vành có tính động vì các mạch máu này chịu ảnh hưởng của nhiều áp lực khác nhau trong một chu chuyển tim. Vào cuối kỳ tâm trương, khi thất giãn ra, áp lực bên trong các động mạch vành trong thành tim tương tự nhau và tương tự áp lực động mạch chủ. Vào đầu thì tâm thu, áp lực tổ chức dưới nội tâm mạc tăng lên bằng với áp lực bên trong buồng tim nhưng lại giảm tuyến tính từ trong ra ngoài vách. Áp lực này sẽ được truyền đến mạch vành. Như vậy, áp lực bên trong lòng mạch vành nằm dưới nội mạc cao hơn áp lực chủ trong khi đó áp lực trong lòng mạch nằm dưới ngoại tâm mạc lại thấp hơn áp lực ĐMC. Trên thực tế, trong giai đoạn sớm của tâm thu thất trái, dòng máu ở dưới nội tâm mạc của thất trái bị đảo ngược tạm thời do bị chèn ép từ bên ngoài. Trong thì tâm trương sớm, máu đầu tiên chảy vào mạch máu dưới thượng tâm mạc không bị chèn ép và sau đó chảy vào các mạch máu dưới nội tâm mạc co nhỏ hơn. Trong điều kiện bình thường thì mạch máu dưới nội tâm mạc và dưới thượng tâm mạc được tưới máu như nhau trong thì tâm trương. Tuy nhiên, nếu thì tâm trương bị rút ngắn quá mức như trong nhịp nhanh trầm trọng và/hoặc áp lực tưới máu giảm thì thiếu máu dưới nội tâm mạc có thể diễn ra. Mặc khác, dòng máu bên trong mạch vành tưới cho cơ tim thất phải thường được duy trì trong thì tâm thu và tâm trương vì mạch máu phổi có áp lực thấp hơn làm cho áp lực bên trong buồng thất phải cũng thấp hơn [2]. Tưới máu thất phải đã bị phì đại trong trường hợp hẹp phổi nặng hoặc tứ chứng Fallot có thể giống với bên thất trái.
Tương quan nhu cầu-cung cấp ôxy cơ tim
Thất trái tách xuất một lượng ôxy gần như tối đa từ máu đi qua cơ tim do vậy nên nếu nhu cầu ôxy cơ tim tăng lên thì cách đáp ứng phải thông qua tăng lưu lượng mạch vành. Trong gắng sức tối đa, tiêu thụ ôxy thất trái có thể tăng lên đến 4 lần và tương tự, lưu lượng máu vành cũng tăng lên gấp bốn. Tăng áp lực tưới máu vành đơn độc không thể tăng lưu lượng đến mức như vậy được và do vậy để tăng lưu lượng vành, bắt buộc phải giảm sức cản mạch máu vành.
Trên thực tế, lưu lượng máu vành có tương quan chặt chẽ với tỉ suất cung cấp ôxy với nhu cầu ôxy. Lưu lượng máu vành tăng khi cung cấp ôxy giảm và/hoặc nhu cầu ôxy tăng lên. Theo cách này, lưu lượng vành có liên kết hữu cơ với nhu cầu ôxy của toàn bộ cơ thể vì tăng cung lượng tim sẽ làm tăng tiêu thụ ôxy. Tương tự, khi nhu cầu chuyển hoá của cơ thể giảm xuống (khi nghỉ) thì tiêu thụ ôxy cơ tim cũng giảm xuống và do vậy lượng máu vành cũng giảm xuống. Các cơ chế đảm bảo sự gắn kết chặt chẽ này vẫn còn cần phải làm sáng tỏ thêm. Tuy vậy, có một một số chất được biết là có ảnh hưởng đến trương lực mạch có thể tham gia vào quá trình này. Các chất này bao gồm adenosin, ôxy, NO, ion H+ , K+ , CO2 và prostaglandin.
Dự trữ vành
Trong điều kiện bình thường, lưu lượng máu vành có khả năng tự điều hoà để mà khi áp lực tưới máu tăng lên hoặc giảm xuống thì lưu lượng máu vành sẽ không thay đổi, ít nhất là trong một khoảng nào đó của áp lực tưới máu. Tăng áp lực sẽ kích thích co mạch và giảm áp lực sẽ gây nên giãn mạch [10]. Khi áp lực tưới máu vượt quá một giới hạn trên nào đó thì lưu lượng máu sẽ tăng lên có thể là do áp lực cao này thắng được sự co mạch. Quan trọng nhất là ở áp lực tưới máu thấp, lưu lượng máu sẽ giảm chứng tỏ rằng hệ mạch vành đã bắt đầu đạt đến mức giãn mạch tối đa và không thể nào giảm kháng lực thêm được nữa để bù trừ cho áp lực tưới máu thấp. Ở giai đoạn này trở đi, nếu áp lực tưới máu giảm hơn nữa thì tình trạng thiếu máu cơ tim sẽ xuất hiện.
Trong điều kiện bình thường, khi dòng máu trong tuần hoàn vành có khả năng tự điều hoà thì lưu lượng máu tối đa ở bất kỳ một áp lực đầu vào hay áp lực tưới máu đều được giới hạn bởi sự co mạch chủ động. Sự khác biệt giữa lưu lượng máu được điều hoà tự chủ (autoregulated flow) và dòng máu tối đa có thể có (maximal potential flow) khi không có bất kỳ mức độ co mạch nào (giãn vành tối đa) được gọi là dự trữ vành (coronary flow reserve) [9]. Dự trữ vành là lưu lượng máu phụ trội mà cơ tim có thể nhận được ở một áp lực tưới máu nhất định để đáp ứng với nhu cầu tiêu thụ ôxy gia tăng. Dự trữ vành không đủ xảy ra khi cung cấp ôxy không đủ đáp ứng cho nhu cầu ôxy cơ tim tăng lên. Điều này dẫn đến thiếu máu cục bộ cơ tim. Lưu lượng vành thường thấp hơn ở vùng dưới nội mạc khi so với vùng dưới thượng tâm mạc do vậy giảm lưu lượng mạch vành thường nặng nề ở dưới nội tâm mạc hơn là dưới thượng tâm mạc.
Dự trữ vành có thể bị ảnh hưởng theo một số cách khác nhau. Ví dụ, nếu sự tự điều hoà bình thường nhưng lưu lượng tối đa giảm thì dự trữ vành cũng sẽ bị giảm xuống. Một sự thay đổi như vậy có thể gặp trong (a) tim quá nhanh, (b) giảm số lượng mạch máu vành do bệnh các mạch máu nhỏ như trong một số bệnh lý mô liên kết đặc biệt là lupus ban đỏ rải rác; (c) tăng kháng lực ở một hoặc nhiều mạch máu vành lớn do thuyên tắc, huyết khối, xơ vữa hoặc co thắt; (d) giảm khả năng giãn cơ tim do thiếu máu cục bộ; (e) phù nề cơ tim; (f) tăng đáng kể áp lực tâm trương thất trái; (g) tăng đáng kể áp lực tâm thu thất trái nếu áp lực tưới máu vành không tăng tương ứng như trong hẹp hoặc hở chủ và (h) tăng độ nhớt của máu, thường trở nên quan trọng khi hematocrit trên 65%.
Dự trữ vành cũng có thể bị suy giảm nếu lưu lượng máu tối đa bình thường nhưng dòng máu được điều hoà tự chủ lại tăng lên gặp trong gắng sức, tim nhanh, thiếu máu, ngộ độc CO, đường cong phân ly hemoglobin lệch sang trái (ví dụ trẻ nhũ nhi có tỉ lệ HbF cao), hạ ôxy máu, nhiễm độc giáp, giãn thất cấp (do tăng sức căng thành), sử dụng thuốc catecholamine gây tăng co bóp và phì đại thất mắc phải.
Ngoài ra, lưu lượng máu được điều hoà tự chủ và lưu lượng máu tối đa có thể giảm đồng thời ví dụ như trong tăng tần số tim quá mức hoặc bệnh tim bẩm sinh có tím gây hạ ôxy máu, phì đại thất và đa hồng cầu. Trong những trường hợp này, dự trữ mạch vành có thể giảm đáng kể. Hơn nữa, tràn dịch màng ngoài tim gây chèn ép, tăng áp lực tâm trương thất phải hoặc thất trái và kích thích α-adrenergic cũng làm tăng ngưỡng áp lực mà ở đó sự tự điều hoà không còn có khả năng bù trừ khi áp lực tưới máu giảm.
Một điều quan trọng nữa là dự trữ vành cũng giảm đáng kể trong trường hợp phì đại thất. Stress thành cơ tim được điều hoà trong một giới hạn khá hẹp trong trường hợp không có phì đại lẫn trường hợp có phì đại cơ tim. Hệ quả là lưu lượng máu vành trên đơn vị khối cơ khá hằng định. Giữa stress thành cơ tim đỉnh và tỉ số của khối cơ thất phải với thể tích có một mối tương quan chặt chẽ [23][26]. Nếu không có phì đại cơ tim thì dự trữ vành bình thường nhưng nếu khối cơ tăng lên thì dự trữ vành giảm xuống. Trong trường hợp buồng tim bị giãn cấp tính, tỉ suất khối so với thể tích giảm xuống, stress thành và tiêu thụ ôxy cơ tim tăng lên và dự trữ vành giảm xuống. Giảm thiểu sự giãn buồng tim bằng giảm hậu tải và tiền tải sẻ đảo ngược được những biến cố không thuận lợi này và là một lý do nữa là để cải thiện chức năng thất.
Lưu lượng máu cơ tim thất phải
Lưu lượng dòng máu cơ tim thất phải tuân theo các nguyên lý chung của lưu lượng máu vành tuy nhiên cũng có những khác biệt so với thất trái liên quan đến áp lực tâm thu thất phải thấp và do những biến đổi của áp lực động mạch chủ sẽ làm thay đổi áp lực tưới máu vành mà không làm thay đổi công tiêu thụ do thắng áp lực của thất phải. Ví dụ, nếu thất phải bình thường bị giãn nhanh chóng do thuyên tắc phổi, suy thất phải cuối cùng cũng sẽ xuất hiện. Tăng stress thành mạch làm tăng tiêu thụ ôxy trong khi đó tăng áp lực tâm thu lại làm giảm lưu lượng máu vành. Do vậy khi cung cấp ôxy không đáp ứng đủ nhu cầu thì thiếu máu cục bộ thất phải xuất hiện. Tăng áp lực tưới máu động mạch chủ cơ học hoặc bằng các chất chủ vận α-adrenergic làm tăng lưu lượng máu cơ tim thất phải, giảm mức độ thiếu máu cục bộ và hồi phục chức năng thất phải về mức bình thường. Cải thiện lưu lượng máu vành không phải là cơ chế duy nhất giải thích được sự cải thiện này. Tăng hậu tải thất trái làm cho vách liên thất lệch sang thất phải và cải thiện chức năng thất trái [1]. Nếu áp lực thất phải đã tăng mạn tính đến mức đã có hiện tượng phì đại thất phải (ví dụ như trong hẹp phổi, nhiều thể bệnh tim bẩm sinh có tím và một số bệnh phổi mạn tính) thì dòng máu cơ tim thất phải cũng có kiểu đáp ứng giống như dòng máu bên thất trái, ngoại trừ một trường hợp. Nếu áp lực chủ thấp xuống thì áp lực thất trái cũng thấp và do vậy công thất và tiêu thụ ôxy của thất trái giảm. Tuy nhiên, công bên thất phải sẽ không hề giảm (nếu không có thông liên thất) do đó sẽ có sự mất cân bằng giữa cung cấp ôxy và nhu cầu tiêu thụ ôxy. Trường hợp mất cân bằng tồi tệ nhất có thể gặp là khi áp lực động mạch chủ vẫn được duy trì nhưng áp lực tưới máu vành lại giảm như trong trường hợp bệnh nhân tứ chứng Fallot được phẫu thuật shunt Blalock-Taussig quá lớn. Áp lực chủ cao làm cho nhu cầu tiêu thụ ôxy cơ tim vẫn cao ở cả hai thất trong khi áp lực tâm trương ĐMC chủ thấp do BT shunt lại làm cho hai thất bị thiếu máu cục bộ và suy.
Các yếu tố thần kinh
Lưu lượng máu vành tăng khi có kích thích giao cảm nhưng các cơ chế giải thích sự gia tăng này không phải rõ ràng. Vì kích thích giao cảm có khuynh hướng làm tăng nhu cầu tiêu thụ ôxy của cơ tim, một phần lớn là do tăng co bóp và tăng tần số tim nên lưu lượng máu vành tăng để đáp ứng được nhu cầu này theo cách đã được mô tả ở trước. Tuy nhiên, các nghiên cứu thực nghiệm cho thấy rằng nếu tách biệt những ảnh hưởng của kích thích giao cảm lên động mạch vành khỏi những biến đổi của công cơ tim chúng ta sẽ thấy rằng trên thực tế hiện tượng co mạch là tác động chủ đạo của kích thích giao cảm lên mạch vành. Ngay cả khi các α-receptor và β-receptor hiện diện ở mạch vành, những nghiên cứu này chúng tỏ rằng lưu lượng máu vành bị ảnh hưởng mạnh mẽ nhất bởi các quá trình chuyển hoá có vai trò điều hoà sự tương xứng giữa nhu cầu và cung cấp ôxy cơ tim.
Kết luận và viễn cảnh
Việc hiểu rõ những cấu phần và các cơ chế khác nhau tạo nên hệ tim mạch là cực kỳ quan trọng tuy nhiên nó chỉ có ích khi kiến thức này được đặt trong một bối cảnh chung khi người thầy thuốc lâm sàng đối diện với một tình huống lâm sàng cụ thể. Những điều kiện sinh lý bệnh cũng như các trị liệu khác nhau đưa đến những biến đổi trong các cấu phần khác nhau này của hệ tim mạch. Những biến đổi này dệt nên bức tranh lâm sàng dẫu bức tranh này có hình hài luôn thay đổi. Những điều kiện này làm cho hệ tim mạch dịch xa khỏi cân bằng nội môi cơ bản và khởi hoạt những đáp ứng bù trừ. Ví dụ, nhiễm trùng huyết có thể gây nên giãn mạch làm giảm áp lực động mạch. Tình trạng này sẽ được các hoá thụ quan và áp thụ quan nhận biết và thông qua nhiều quai hồi tác trung ương và tại chỗ khác nhau sẽ làm tăng hoạt tính giao cảm, tần số tim, co bóp cơ tim và trương lực mạch. Lưu lượng máu đến da, cơ và tuần hoàn tạng bị giảm thiểu và dự trữ máu từ tuần hoàn tạng và cơ sẽ được huy động. Các cơ chế tự điều hoà sẽ được khởi động để duy trì lưu lượng máu đến các cơ quan sinh tử như não và tim. Hơn nữa, các cơ chế thận cũng được khởi động để giữ muối và nước trong một nỗ lực làm tăng thể tích nội mạch. Những đáp ứng này có thể bình thường hoá tạm thời huyết áp động mạch và có thể bù trừ tác động ban đầu. Dĩ nhiên, cơ thể phải trả giá sinh lý cho những cơ chế này và cùng với thời gian nếu những kích thích ban đầu vẫn còn tồn tại thì hệ quả có hại của những đáp ứng này sẽ bắt đầu nổi trội. Ví dụ, nếu lượng lượng máu giảm kéo dài, thiếu máu tạng sẽ xuất hiện và hậu quả là có sự chuyển dịch các vi sinh vật ruột vào trong dòng máu, nhu cầu ôxy tăng cao trên mức có thể đáp ứng được và suy tim sẽ bắt đầu. Hơn nữa, các cơ chế bù trừ của thận cũng có thể làm chính thận bị suy. Như vậy, người thầy thuốc lâm sàng phải có một sự đánh giá chính xác đâu là những nhiễu loạn tiên phát, đâu là những đáp ứng bù trừ và ảnh hưởng của điều trị lên toàn thể các hệ thống này như thế nào.
Hơn nữa, một số tình huống lâm sàng cũng có thể đặt những cấu phần của hệ tim mạch vào một sự xung đột. Ví dụ, những trẻ em bị tứ chứng Fallot có đường thoát thất phải hẹp nặng nề kèm với tình trạng thiếu ôxy máu mạn tính có thể được điều trị với chất chủ vận α-adrenergic (ví dụ phenylephrine) để làm tăng kháng lực mạch máu hệ thống và lưu lượng máu phổi. Điều trị này làm tăng hậu tải thất trái và như vậy làm giảm cung lượng tim. Cung cấp ôxy có tăng lên hay không phụ thuộc và độ bão hoà ôxy có tăng lên đủ để thắng được sự giảm cung lượng tim. Tình huống này đòi hỏi người thầy thuốc lâm sàng phải hiểu được sinh lý tổng quan của bệnh, các đích điều trị và tác động của điều trị lên các giường mạch khác nhau.
Sự gia tăng dần dần hiểu biết của chúng ta về hệ tim mạch đã đưa đến sự gia tăng về những khả năng hỗ trợ bệnh nhân với nhiều tình huống lâm sàng khác nhau. Sự hỗ trợ này thể hiện dưới nhiều hình thức bao gồm cả hỗ trợ cơ học và sử dụng các tác nhân dược lý làm thay đổi công năng tim và chức năng mạch. Cho đến hiện nay vẫn có rất nhiều bài báo ra đời liên quan đến sinh lý học tim mạch. Chúng minh chứng một điều rằng có rất nhiều quá trình cơ bản như vai trò trung tâm của nội mô mạch máu trong sinh học mạch áu cũng chỉ mới được khám phá gần đây. Như vậy, một điều rất có thể là những nghiên cứu đang diễn ra và những nghiên cứu trong tương lai sẽ đưa đến những liệu pháp mới cho phép chúng ta nhắm đến được những đích đặc hiệu hơn liên quan đến những cấu phần khác nhau của hệ tim mạch. Nhờ đó chúng ta có thể tối đa hoá những can thiệp điều trị trong khi lại có thể giảm thiểu những hậu quả không mong muốn.





