Mục tiêu sau khi đọc chương này, người đọc sẽ tìm hiểu:
- Những yếu tố chính quyết định hồi lưu tĩnh mạch và cung lượng tim?
- Áp suất đổ đầy hệ thống trung bình là gì, tầm quan trọng của nó là gì và độ chênh của hồi lưu tĩnh mạch là gì?
- Ý nghĩa của áp lực tĩnh mạch trung tâm trong bối cảnh hồi lưu tĩnh mạch là gì?
- Thử thách dịch truyền hiệu quả, sử dụng Pmsf là gì?
Tác giả: Thạc sĩ – Bác sĩ Hồ Hoàng Kim – ICU Bệnh viện NGUYỄN TRI PHƯƠNG.
https://drive.google.com/file/d/1j0j5pyggEepnnHkR-UnTlHt7mt9h8VrF/view?fbclid=IwAR0pNF6fDwOLi9MLCvmX5MKBit8M926Lpsb8LSIbcCf19LA2Gce-ItaGLFw
Giới thiệu
Suy tim mạch là một trong những lý do phổ biến nhất nhập viện vào các đơn vị chăm sóc đặc biệt. Chức năng chính của hệ thống tim mạch là vận chuyển oxy (O2) đến các mô. Nếu nồng độ của hemoglobin ổn định, yếu tố chính quyết định sự vận chuyển O2 là cung lượng tim (CO).
CO là tổng thể tích máu được huy động bởi tim trên một đơn vị thời gian và được đo bằng đơn vị lưu lượng (L/phút). Trong điều kiện ổn định, hệ thống tim mạch là một hệ thống vòng kín và tim chỉ có thể đẩy ra lượng máu mà nó nhận được. Do đó, tổng thể tích đẩy ra trong một khoảng thời gian sẽ bằng tổng thể tích máu trở về từ hệ thống tĩnh mạch. Do đó, hồi lưu tĩnh mạch bằng cung lượng tim.
Trong chương này, chúng ta sẽ phân tích các yếu tố quyết định hồi lưu tĩnh mạch, tác động của chúng đối với sinh lý tim mạch và ý nghĩa thực tế rằng những yếu tố này có thể đóng vai trò trong điều trị bệnh nhân nguy kịch. Các yếu tố chính quyết định sự hồi lưu tĩnh mạch của tim từ tuần hoàn hệ thống là:
- Mức độ đổ đầy của tuần hoàn.
- Khả năng của tim duy trì áp lực nhĩ phải thấp.
- Sức cản của dòng máu giữa các mạch ngoại vi và tâm nhĩ phải.
- Sức cản dòng máu giữa tim và mao mạch.
Thể tích máu và áp lực đổ đầy trung bình hệ thống
Hệ thống tĩnh mạch chứa khoảng 70% tổng lượng máu, trong khi đó hệ thống động mạch chỉ chứa 13 – 18% và mao mạch là 7% [1, 2]. Hệ thống tĩnh mạch là một bể chứa máu, có thể điều chỉnh khả năng của mình theo các điều kiện huyết động. Thành tĩnh mạch mỏng hơn nhiều so với thành động mạch, vì máu lưu thông ở áp suất thấp, nhưng nó vẫn chứa các sợi cơ trơn, có thể co lại và giãn ra theo tình trạng huyết động. Trong quá trình giảm thể tích máu, các phản xạ thần kinh giao cảm gây ra chứng co thắt tĩnh mạch, đưa máu trở lại tuần hoàn trung tâm, tăng tiền tải và tăng cung lượng tim. Trên thực tế, ngay cả sau khi 20% tổng lượng máu đã bị mất, hệ thống tuần hoàn hoạt động gần như bình thường do chức năng biến đổi hồ chứa các tĩnh mạch này [1].
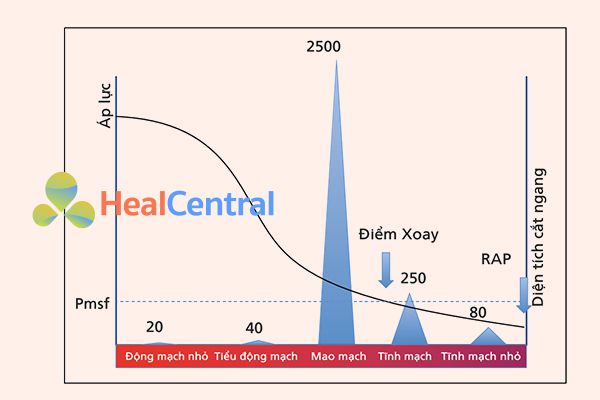
Tim bơm máu liên tục vào động mạch chủ giữ áp suất động mạch trung bình cao, trung bình 80 – 100 mmHg. Áp lực này giảm dần khi máu chảy vào tuần hoàn hệ thống, thấp bằng mức áp suất nhĩ phải (Pra). Sự suy giảm áp lực này chủ yếu được gây ra bởi tổng diện tích mặt cắt ngang tăng lên trong mỗi cấp độ của cây mạch máu (Hình 4.1). Khi tim ngừng đập, áp lực động mạch giảm và RAP tăng dần. Tại một số điểm nhất định, máu sẽ không chảy và nếu các tiểu động mạch không sụp xẹp tạo thành bẫy máu trong không gian động mạch, áp lực sẽ giống nhau trong tất cả các khu vực của hệ thống tuần hoàn. Áp suất này là áp suất đổ đầy hệ thống trung bình (Pmsf). Áp lực này được mô tả bởi Bayliss và Starling [3], và họ đoán rằng ở đâu đó trong tuần hoàn, phải có một điểm mà áp lực không thay đổi khi tim ngừng đập. Trên thực tế, trong khi ngừng tim, áp lực trong các tĩnh mạch nhỏ (< 1 mm) và tĩnh mạch không thay đổi đáng kể; chúng là “điểm xoay” của hệ thống (Hình 4.1) [4]. Áp suất này nhỏ hơn áp lực mao quản, gần với áp lực tĩnh mạch cửa và lớn hơn RAP. Vị trí giải phẫu của nó không nhất thiết phải ở cùng một nhánh phân nhánh tĩnh mạch trong mỗi cơ quan. Tầm quan trọng của áp lực này, thay vì vị trí giải phẫu của nó, là nó cung cấp một phép đo định lượng về tình trạng đổ đầy nội mạch độc lập với chức năng tim: giá trị của nó bằng Pmsf.
Chúng ta hãy tưởng tượng hồ chứa máu là một khoang có thể mở rộng. Thể tích cần thiết để đổ đầy một ống có thể mở rộng, chẳng hạn như lốp xe hoặc mạch máu, không tăng áp suất được gọi là “thể tích không tạo ra áp lực – unstress volume” (Vo). Mở rộng thể tích hơn nữa sẽ có nghĩa là nhất thiết phải tăng áp lực và độ co giãn đàn hồi của thành ống, phụ thuộc vào compliance (C) của thành tĩnh mạch. Thể tích này là “thể tích tạo ra áp lực – stress volume” (Vs) và có liên quan đến áp lực trong phương trình tiếp theo: Pmsf =V/Cs.
Áp lực nhĩ phải
Để di chuyển một chất dịch trên một ống hay hệ thống ống, các biến số được mô tả trong định luật Poiseuille. Do đó, đó là độ chênh của áp suất giữa hai điểm trong hệ thống, không phải bất kỳ áp suất đơn lẻ nào tại bất kỳ điểm cụ thể nào, điều này quyết định tốc độ dòng chảy [5, 6]. Cho rằng phần lớn máu nằm trong bể chứa tĩnh mạch, áp lực tại thời điểm này đặc biệt thú vị. Theo phương trình định luật Poiseuille, Guyton chỉ ra rằng hồi lưu tĩnh mạch có thể được xác định bởi ba tham số: áp lực đổ đầy hệ thống trung bình (Pmsf), Pra và kháng trở của hồi lưu tĩnh mạch (RVR). Điều này cũng có thể được biểu diễn bằng phương trình toán học như sau: VR = (Pmsf – Pra)/RVR.
Guyton [7] đã vẽ các đường cong hồi lưu tĩnh mạch ở những con chó vừa mới chết. Trái tim đã được thay thế bằng một máy bơm và Pra được điều khiển bằng cách tăng hoặc giảm công suất phút của máy bơm. Tăng hoặc giảm tổng lượng máu đã kiểm soát được áp lực đổ đầy tuần hoàn trung bình. Từ những đường cong này (Hình 4.2), người ta có thể thấy rằng đối với một Pra nhất định, Pmsf càng lớn, thể tích hồi lưu tĩnh mạch càng lớn. Điều quan trọng, trong điều kiện thể tích tuần hoàn đủ và ổn định, Pra càng lớn, hồi lưu tĩnh mạch càng thấp. Do đó, với mối quan hệ tuyến tính này, nếu có thể đo và thay đổi hồi lưu tĩnh mạch mà không thay đổi tình trạng thể tích, độ dốc của đường có thể được tính toán (RVR) và Pmsf có thể được ước tính. Trong điều đẳng thể tích, Pra phụ thuộc chủ yếu vào chức năng thất phải và khả năng tích chứa và bơm máu đến tuần hoàn phổi. Bất kỳ sự suy giảm chức năng tim nào sẽ làm tăng Pra và do đó tạo ra “sung huyết” trong tuần hoàn tĩnh mạch.
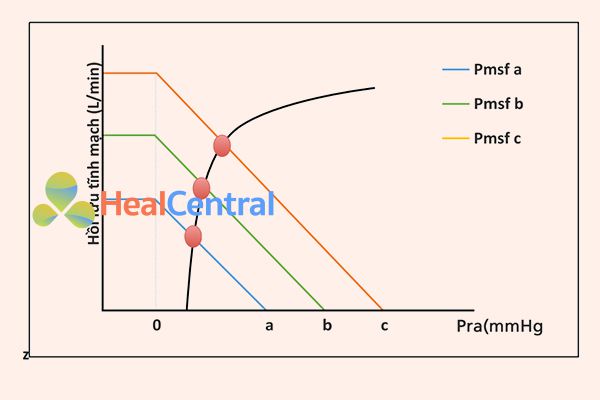
Một yếu tố thứ hai ảnh hưởng đến Pra là áp lực bên trong lồng ngực và áp lực màng ngoài tim. Trong trường hợp bình thường, áp suất trong khoang ngực là âm hoặc bằng áp suất khí quyển. Bất kỳ sự gia tăng áp lực nào có nghĩa là tăng Pra sẽ dẫn đến giảm hồi lưu tĩnh mạch. Hiện tượng tương tự được quan sát thấy nếu có sự gia tăng áp lực màng ngoài tim, sẽ làm tăng Pra, và sẽ dẫn đến giảm thể tích hồi lưu tĩnh mạch.
Kháng trở tiểu động mạch và nhu cầu chuyển hóa
Vì hệ thống tĩnh mạch chỉ có thể vận chuyển lượng thể tích đến từ hệ thống mao mạch, nên sự điều hòa lưu thông mao mạch cũng sẽ quyết định sự hồi lưu của máu tĩnh mạch. Mỗi mô trong cơ thể có khả năng kiểm soát lưu lượng máu cục bộ tương ứng với nhu cầu trao đổi chất của nó. Những thay đổi nhanh chóng trong co mạch hoặc giãn mạch của tiểu động mạch, siêu tiểu động mạch và cơ vòng tiền mao mạch có thể xảy ra trong vòng vài giây để cung cấp lưu lượng máu đầy đủ cho mô cục bộ. Các yếu tố chính liên quan đến việc kiểm soát cấp tính lưu lượng máu cục bộ là:
- Chuyển hóa mô: đây là yếu tố mạnh nhất. Nhu cầu oxy tại khu vực càng cao thì lưu lượng máu càng cao.
- Sự sẵn có của oxy cho mô: khi thiếu oxy cung cấp cho mô (giảm oxi mô), sẽ có sự gia tăng lưu lượng máu cục bộ. Thiếu oxy có thể xảy ra theo một số cách, chẳng hạn như (1) suy giảm trong quá trình oxy hóa máu (ARDS, viêm phổi, v.v.), (2) suy giảm trong việc vận chuyển oxy bởi hemoglobin (ngộ độc CO) hoặc (3) suy giảm trong khả năng mô để sử dụng oxy (shock nhiễm trùng, ngộ độc xyanua).
- Thiếu hụt các chất dinh dưỡng khác: trong điều kiện đặc biệt, việc thiếu glucose, thiamine, niacin và riboflavin có thể gây giãn mạch.
Kiểm soát trương lực mạch: kháng trở của hồi lưu tĩnh mạch
Một số bộ phận của hệ thống tĩnh mạch có compliance đặc biệt: chúng bao gồm lách, gan, tĩnh mạch lớn ở bụng và đám rối tĩnh mạch bên dưới da. Các tĩnh mạch lách và da có mật độ cao của các thụ thể α1- và α2-adrenergic, vì vậy chúng rất nhạy cảm với kích thích adrenergic, trái với tĩnh mạch ở mô xương và cơ [8]. Việc kiểm soát hệ thống tĩnh mạch đã được nghiên cứu rộng rãi trên các mô hình động vật. Có đầu mút thần kinh trong phần gần của nhiều cơ trơn tĩnh mạch nhỏ [9] nhưng không có trong các tĩnh mạch của cơ xương [10]. Tuy nhiên, catecholamine tuần hoàn có thể gây ra sự co của tĩnh mạch và tĩnh mạch của cơ xương và mạc treo [9, 10]. Vì vậy, có lẽ catecholamine được giải phóng từ sự các đầu mút thần kinh giao cảm của phía động mạch có thể đi qua giường mao mạch và ảnh hưởng đến hệ thống tĩnh mạch.
Các cơ trơn của tĩnh mạch và động mạch không nhất thiết đáp ứng theo cùng một cách với các tín hiệu hóa học. Dihydroergotamine có thể kích hoạt các tĩnh mạch nhưng không phải động mạch [11]. Hệ thống tĩnh mạch chủ yếu có các thụ thể α-adrenergic [12 – 15]. Kích thích các thụ thể β-adrenergic của tiểu động mạch gây giãn mạch nhưng ít ảnh hưởng đến tĩnh mạch [16, 17]. Angiotensin có thể làm tăng Pmsf [16, 18]. Isoproterenol, một chất chủ vận β-adrenergic, gây giảm Pmsf khi các tĩnh mạch co với angiotensin. Mặt khác, vasopressin có rất ít tác dụng đối với Pmsf [19] hoặc lên khả năng chứa mạch máu một khi phong bế phản xạ [20] và kết quả tương tự đã được báo cáo về peptide natriuretic [21].
Nitroglycerin và nitroprusside làm giảm Pmsf và tăng thể tích máu unstress nhưng không thay đổi compliance mạch máu ở chó bị phong tỏa hạch [22]. Verapamil và nifedipine làm tăng hồi lưu tĩnh mạch bằng cách giảm kháng trở hồi lưu tĩnh mạch mà không thay đổi Pmsf, trong khi nitroglycerin với liều lượng nhỏ có thể làm giảm Pmsf mà không thay đổi kháng trở hồi lưu tĩnh mạch [23]. Diltiazem làm giảm cả sức đề kháng và Pmsf tăng CO [23].
Tăng CO2 máu mức độ vừa và thiếu oxy có một ít tác dụng trực tiếp lên CO và Pmsf thông qua con đường không phản xạ [24]. Tăng CO2 máu nặng (PaCO2 đến 114 mmHg (15,2 KPa)) gây ra sự gia tăng Pmsf thêm 5,5 mmHg, trong khi PaO2 là 34 mmHg (4,5 KPa) gây ra sự gia tăng Pmsf thêm 2,5 mmHg [25].
Đo lường Pmsf ở người có tuần hoàn nguyên vẹn
Pmsf không dễ đo ở bệnh nhân có vòng tuần hoàn nguyên vẹn. Schipke và cộng sự. [26] đã thực hiện trình tự khử rung tim ở 82 bệnh nhân trong quá trình cấy ghép máy khử rung tim để đo Pmsf trong hơn 13 giây. Một áp lực cân bằng thực sự đã không đạt được, và chênh lệch áp lực tĩnh mạch trung tâm – động mạch là 13,2 ± 6,2 mm Hg, và sự khác biệt vẫn còn tồn tại trong các chuỗi 20 giây.
Pinsky [27] đã đề xuất một mô hình ở động vật với sự lưu thông nguyên vẹn để xây dựng các đường cong hồi lưu tĩnh mạch quan sát mối quan hệ giữa thay đổi đẳng thể tích trong CO và Pra trong quá trình huy động áp lực dương gián đoạn. Pmsf được ước tính bằng cách tính độ dốc và ngoại suy giá trị Pra thành 0 của CO. Pmsf tính toán được tìm thấy tương tự như giá trị Pmsf được đo trong khi tuần hoàn bị ngưng. Các nghiên cứu khác [28 – 30] đã xác nhận mối quan hệ tuyến tính này giữa VR và Pra và Pmsf xuất phát từ phương trình hồi quy trong các mô hình động vật với tuần hoàn nguyên vẹn. Maas và cộng sự [31] đã áp dụng cùng một lý do để nghiên cứu hiệu quả của nghiệm pháp giữ thời gian hít vào trong 12 giây đối với ba mức độ ổn định khác nhau đối với áp lực tĩnh mạch trung tâm (CVP), như ước tính của Pra và lưu lượng máu (CO) đo được thông qua phương pháp phân tích xung liên tục trong 3 giây cuối ở bệnh nhân thở máy sau phẫu thuật tim. Nghiên cứu này một lần nữa cho thấy mối quan hệ tuyến tính giữa những thay đổi trong CVP và CO, và quan trọng, Pmsf có thể được ước tính ở đầu giường ở những bệnh nhân chăm sóc tích cực với tuần hoàn nguyên vẹn. Rõ ràng kỹ thuật này chỉ khả thi ở những bệnh nhân được an thần hoàn toàn có thở máy. Keller và cộng sự [32] đã sử dụng phương pháp này để đánh giá sự thay đổi của hồi lưu tĩnh mạch với thao tác nâng chân thụ động (PLR): họ quan sát thấy chín bệnh nhân sau phẫu thuật tim tại mức nền, trong PLR và sau khi mở rộng thể tích (500 ml hydroxyethyl starch). Họ đã báo cáo một Pmsf mức nền là 19,7 mmHg. Điều này tăng lên 22 mmHg sau PLR và 26,9 mmHg sau khi mở rộng thể tích (VE). Mặc dù CO tăng sau PLR và VE, độ chênh của áp lực hồi lưu tĩnh mạch (chênh lệch giữa Pmsf và CVP) tăng 2 mmHg sau PLR và 5,8 mmHg sau VE. Điều này có thể giải thích tại sao nghiệm pháp PLR không tăng CO không nhất quán ở bệnh nhân đáp ứng với dịch truyền [33] hoặc thậm chí đối với thử thách dịch truyền, tăng Pmsf là điều kiện thiết yếu để kiểm tra hiệu quả đáp ứng tim.
Parkin và Wright [34] đã đề xuất một phương pháp để ước tính áp suất làm đầy hệ thống trung bình tương tự (Pmsa) bằng cách sử dụng áp suất động mạch trung bình (MAP), dữ liệu Pra, CO và nhân trắc học. Lượt Pmsa được mô tả đầy đủ trong các ấn phẩm khác [35]. Về bản chất, họ xây dựng một mô hình toán học sử dụng dữ liệu bệnh nhân của bệnh nhân làm dự đoán về Pmsa. Giá trị lâm sàng của phương pháp này đã được thử nghiệm ở mười bệnh nhân trong suy thận cấp được lọc máu liên tục liên tục [36]. Liệu pháp thay thế dịch được kiểm soát bằng cơ điện đến giá trị đích của Pmsa. Phương pháp này cũng được sử dụng để phân tích các thay đổi huyết động sau khi thử thách dịch truyền (250 ml dung dịch keo hoặc tinh thể trong 5 phút) ở những bệnh nhân được chăm sóc đặc biệt [37]: Pmsa tăng tương tự ở người đáp ứng và người không đáp ứng, như mong đợi, nhưng thú vị là Pra tăng trong những người không đáp ứng, vô hiệu hóa những thay đổi trong độ dốc của áp lực hồi lưu tĩnh mạch như mô tả của Guyton. Gần đây, Gupta et al. [38] đã sử dụng Pmsa để thăm dò hiệu suất của công suất tim (được định nghĩa là sản phẩm của áp lực động mạch và cung lượng tim) so với Pmsa (CPvol). CPvol đại diện cho một phép đo hiệu suất tim được điều chỉnh theo trương lực mạch máu. Theo các tác giả, các giá trị dưới 0,047 của CPvol có độ nhạy cao (97%) và độ đặc hiệu không cao (57,5%) để dự đoán khả năng đáp ứng dịch truyền.
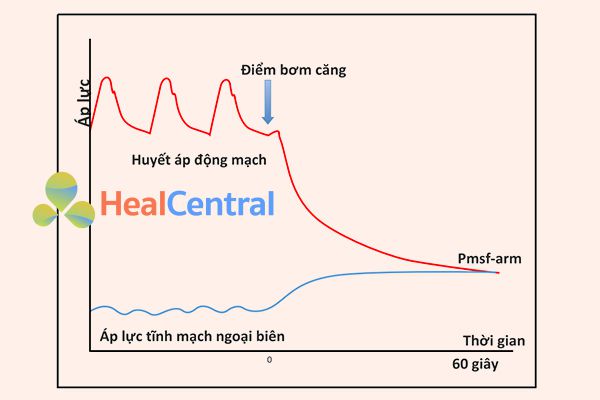
Anderson [39] đã đề xuất một kỹ thuật không xâm lấn để đo Pmsf bằng cách tắc nhanh chóng tuần hoàn ở cánh tay (Pmsf-arm). Khi áp lực động mạch (Pa) và áp lực tĩnh mạch (Pv) trong cánh tay cân bằng, áp suất đo được sẽ là Pmsf (Hình 4.3). Maas et al. [40] so sánh ba phương pháp này ở 11 bệnh nhân phẫu thuật tim sau phẫu thuật. Phân tích Bland- Altman cho sự khác biệt giữa Pmsf-arm và Pmsf cho thấy độ lệch −1.0 (± 3.1) mmHg (p = 0.06) và hệ số biến đổi (CV) là 15%. Mặc dù có sự sai lệch thống kê không có ý nghĩa, người ta có thể nghĩ rằng điều này thực sự khá quan trọng khi xem xét cỡ mẫu nhỏ của nghiên cứu này. Liên quan đến sự khác biệt giữa Pmsf và Pmsa, có độ lệch −6.0 (± 3.1) mmHg (p <0,001) và CV là 17%. Ba phương pháp rất hữu ích để theo dõi các thay đổi sau khi mở rộng thể tích.
Độ chính xác của kỹ thuật cánh tay Pmsf đã được nghiên cứu gần đây [41]. Bốn phép đo lặp lại được thực hiện ở 20 bệnh nhân sau phẫu thuật tim. Pa và Pv cân bằng sau 60 giây ga rô. Đối với một phép đo duy nhất, hệ số sai số (CE) là 5% (± 2%) và thay đổi ít có ý nghĩa nhất (LSC) là 14% (± 5%). Tính trung bình hai lần đo, CE cải thiện thành 4% (± 1%) và LSC đã giảm xuống 10% (± 4%).
Ý nghĩa thực hành
Mặc dù việc đo trương lực mạch máu ở phía hệ tĩnh mạch của tuần hoàn có thể có nhiều ứng dụng tiềm năng, nhưng vẫn có rất ít bằng chứng về tác động lâm sàng của thông tin này đối với việc quản lý bệnh nhân bị bệnh nặng.
- Hiểu về sự hồi lưu của tĩnh mạch giúp cải thiện việc quản lý bệnh nhân huyết động không ổn định. Rangappa và cộng sự. [42] đã thăm dò hiệu quả của một hệ thống hỗ trợ ra quyết định trên máy tính (Navigator TM, Sinh lý học ứng dụng, Sidney, Úc) để cải thiện tính nhất quán của các quyết định điều trị và đánh giá huyết động của các bác sĩ lâm sàng của đơn vị hồi sức với trình độ chuyên môn và kinh nghiệm khác nhau ở 20 bệnh nhân được lựa chọn sau phẫu thuật tim. Các tác giả kết luận rằng hệ thống này cải thiện tính nhất quán trong việc ra quyết định. Sondergaard et al. [43] đã thực hiện một thử nghiệm lâm sàng thí điểm nhỏ ở 27 bệnh nhân sau phẫu thuật cần điều trị theo mục tiêu để đánh giá hiệu quả của hệ thống Navigator TM trong việc đạt được các mục tiêu huyết động (đo thời gian phần trăm trong vùng mục tiêu và khoảng cách chuẩn hóa trung bình (ASD) từ trung tâm của mục tiêu và thời gian để đạt được mục tiêu) và mức độ phù hợp giữa liệu pháp được đề xuất bởi hệ thống và một bác sĩ lâm sàng chuyên gia. Thời gian phần trăm trung bình trong vùng mục tiêu là 36,7% đối với nhóm chứng và 36,5% đối với nhóm can thiệp và ASD là 1,5 trong kiểm soát và 1,6 trong can thiệp (không có giá trị p nào được báo cáo). Có sự phù hợp cao giữa khuyến nghị hỗ trợ quyết định và hành động của bác sĩ thực hành (84,3%). Các tác giả kết luận rằng phương pháp điều trị được đề xuất bởi hệ thống Navigator TM đã phản ánh một bác sĩ gây mê cao cấp trong việc đạt được các mục tiêu trị liệu. Thật không may, nghiên cứu này có lẽ không đủ sức mạnh để chỉ ra sự khác biệt trong các phép đo hiệu quả, cân bằng dịch hoặc thuốc vận mạch.
- Những thay đổi trong Pmsf có thể được sử dụng để đánh giá compliance hệ thống và hướng dẫn lựa chọn giữa dịch truyền hoặc thuốc vận mạch. Sự đồng thuận hiện nay về shock tuần hoàn và theo dõi huyết động khuyến cáo rằng ngay cả trong bối cảnh bệnh nhân đáp ứng với dịch truyền, quản lý dịch nên được điều chỉnh cẩn thận, đặc biệt là khi có áp lực đổ đầy nội mạch tăng cao [44]. Nguyên tắc tương tự áp dụng cho Pmsf. Một thử thách dịch truyền có thể được sử dụng để đánh giá khả năng đáp ứng với truyền dịch và cũng như được Maas và đồng nghiệp phát hiện [45], để đánh giá sự compliance của hệ thống mạch máu. Trong nghiên cứu này, comliance hệ thống được báo cáo từ 15 bệnh nhân hậu phẫu sau phẫu thuật tim khoảng 64 mL / mmHg. Compliance tĩnh mạch toàn thân có thể là thông tin rất hữu ích để ưu tiên điều trị: compliance cao sau khi thử thách dịch có thể cho thấy việc sử dụng sớm thuốc co mạch thay vì truyền một lượng lớn dịch. Một nghiên cứu khác [46] cho thấy sử dụng noradrenaline (chất chủ vận α1-adrenergic) làm tăng CO ở bệnh nhân có đáp ứng với tiền tải. Noradrenaline tăng Pmsf bằng cách giảm comliance tĩnh mạch hoặc do co tĩnh mạch (giảm dung tích tĩnh mạch và chuyển thể tích unstress sang stress; xem hình 4.2). Thật không may, các tác giả đã không đánh giá tác dụng của noradrenaline đối với compliance tĩnh mạch. Ở những bệnh nhân còn lại, noradrenaline có tác dụng chủ yếu là co mạch máu, làm tăng hậu tải của tim. Nghiên cứu này nhấn mạnh tầm quan trọng của việc theo dõi trương lực tĩnh mạch và CO khi sử dụng thuốc vận mạch.
- Pmsf cũng có thể được sử dụng để đánh giá hiệu quả của truyền dich vào trong tuần hoàn, bất kể đáp ứng của tim và hiệu quả của thử thách dịch. Trong một nghiên cứu gần đây về các thử thách dịch [47], việc quan sát Pmsa cùng với các biến số huyết động khác đã mô tả hiệu quả ngắn hạn kỹ thuật này và chỉ ra rằng sự thay đổi tối đa của CO là khoảng 1 phút sau khi kết thúc truyền dịch IV. Pmsf- arm cũng đã được sử dụng để đánh giá khối lượng tối thiểu cần thiết để thử thách dịch hệ thống tim mạch. Đây là một thử nghiệm lâm sàng bán ngẫu nhiên với 80 bệnh nhân đã nhận được từ 1 đến 4 ml / kg chất lỏng IV trong 5 phút. Pmsf-arm chỉ tăng đáng kể trong nhóm 4 ml / Kg, và tỷ lệ đáp ứng dịch truyền tăng đáng kể từ 20% trong nhóm 1 mL / Kg lên 65% trong nhóm 4 mL / Kg.
- Vì hồi lưu tĩnh mạch tương đương với CO, trong thực tế, thay đổi CO và CVP có thể cung cấp hầu hết các thông tin về cách nhìn của Guyton về tuần hoàn. Tuy nhiên, nếu không hiểu cách thức hoạt động như thế nào của trương lực tĩnh mạch, các giá trị của CVP có thể bị hiểu nhầm. Bằng chứng về điều này là một số nghiên cứu đã xem CVP như một yếu tố dự báo khả năng đáp ứng dịch truyền [48]. CVP tạo thành điểm gặp gỡ giữa hồi lưu tĩnh mạch và chức năng tim: CVP cao có thể liên quan đến Pmsf cao hoặc chức năng tim thấp hoặc cả hai. Do đó, biết Pmsf sẽ giúp các bác sĩ lâm sàng hiểu rõ hơn về tình trạng huyết động của bệnh nhân bị bệnh nặng ở tại giường.
- Bất kỳ can thiệp tim mạch nào ở bệnh nhân bị bệnh nặng nên xem xét đến các điều hòa chính về cung lượng tim xảy ra ở các mô ngoại biên.
Do đó, điều trị cũng nên được hướng dẫn bằng các dấu hiệu tưới máu mô, và không chỉ bằng các phép đo huyết động.
Kết luận
Hệ thống tĩnh mạch đóng một vai trò quan trọng trong sự ổn định huyết động. Hầu hết lượng máu được lưu trữ và điều tiết trong khu vực tĩnh mạch. Hiện tại có thể đo được áp suất đổ đầy hệ thống trung bình và đó là áp suất của “điểm xoay” của tuần hoàn, nơi áp suất không phụ thuộc vào lưu lượng máu. Áp lực này là áp lực đẩy của tuần hoàn và ảnh hưởng, cùng với chức năng tim, hồi lưu tĩnh mạch. Có 3 phương pháp đã được mô tả để đo Pmsf ở đầu giường, ở những bệnh nhân có tuần hoàn nguyên vẹn. Biến số này hiện có thể được tích hợp dưới dạng một thông tin khác giúp tìm hiểu các điều kiện của bệnh nhân và hướng dẫn liệu pháp huyết động phù hợp với sinh lý học của bệnh nhân.
Thông tin cốt lõi
Hồi lưu tĩnh mạch, tương đương với cung lượng tim, được kiểm soát tốt ở cấp độ vi tuần hoàn trong các mô ngoại vi. Luôn nhớ rằng hãy đặt huyết động trong bối cảnh đó.
Hai yếu tố chính ảnh hưởng đến lưu lượng máu trong các mô ngoại biên là mức độ trao đổi chất và sự sẵn có của oxy. Hai cũng là yếu tố quyết định hồi lưu tĩnh mạch.
Chất chủ vận α1-Adrenergic gây co thắt tĩnh mạch, làm tăng thể tích máu từ bể chứa tĩnh mạch để tăng cung lượng tim và huyết áp. Điều này rất hữu ích trong việc gây mê cho bệnh nhân không ổn định, vì hầu hết các thuốc gây mê có thể gây giãn mạch sâu và giảm nghiêm trọng trở lại tĩnh mạch.
Để thực hiện một thử thách dịch truyền hiệu quả, cần phải truyền đủ thể tích để tăng Pmsf; mặt khác, có khả năng đáp ứng âm tính giả. 4 ml/ kg là một liều thích hợp ở hầu hết bệnh nhân sau phẫu thuật.
Tài liệu tham khảo
1. Guyton AC. Textbook of medical physiology. 12th ed. Philadelphia: Elsevier Saunders; 2011.
2. Rothe CF. Reflex control of veins and vascular capacitance. Physiol Rev. 1983;63(4):1281–342.
3. Bayliss WM, Starling EH. Observations on venous pressures and their relationship to capillary pressures. J Physiol. 1894;16(3–4):159–318 7.
4. Rothe CF. Mean circulatory filling pressure: its meaning and measurement. J Appl Physiol (1985). 1993;74(2):499–509.
5. Guyton AC, Lindsey AW, Kaufmann BN, Abernathy JB. Effect of blood transfusion and hemorrhage on cardiac output and on the venous return curve. Am J Phys. 1958;194(2):263–7.
6. Guyton AC, Lindsey AW, Kaufmann BN. Effect of mean circulatory filling pressure and other peripheral circulatory factors on cardiac output. Am J Phys. 1955;180(3):463–8.
7. Guyton AC. Determination of cardiac output by equating venous return curves with cardiac response curves. Physiol Rev. 1955;35(1):123–9.
8. Rowell LB. Human cardiovascular control. New York: Oxford University Press; 1993.
9. Furness JB, Marshall JM. Correlation of the directly observed responses of mesenteric vessles of the rat to nerve stimulation and noradrenaline with the distribution of adrenergic nerves. J Physiol. 1974;239(1):75–88.
10. Marshall JM. The influence of the sympathetic nervous system on individual vessels of the microcirculation of skeletal muscle of the rat. J Physiol. 1982;332:169–86. 4
11. Mellander S, Nordenfelt I. Comparative effects of dihydroergotamine and noradrenaline on resistance, exchange and capacitance functions in the peripheral circulation. Clin Sci. 1970;39(2):183–201.
12. Appleton CP, Lee RW, Martin GV, Olajos M, Goldman S. Alpha 1- and alpha 2- adrenoceptor stimulation: changes in venous capacitance in intact dogs. Am J Phys. 1986;250(6 Pt 2):H1071–8.
13. Patel P, Bose D, Greenway C. Effects of prazosin and phenoxybenzamine on alpha- and beta-r eceptor- mediated responses in intestinal resistance and capacitance vessels. J Cardiovasc Pharmacol. 1981;3(5):1050–9.
14. Ruffolo RR Jr. Distribution and function of peripheral alpha-adrenoceptors in the cardiovascular system. Pharmacol Biochem Behav. 1985;22(5):827–33.
15. Shi AG, Ahmad S, Kwan CY, Daniel EE. Characterization of alpha-adrenoceptor subtypes by [3H]prazosin and [3H]rauwolscine binding to canine venous smooth muscle membranes. Can J Physiol Pharmacol. 1989;67(9):1067–73.
16. Hirakawa S, Itoh H, Kotoo Y, Abe C, Endo T, Takada N, et al. The role of alpha and beta adrenergic receptors in constriction and dilation of the systemic capacitance vessels: a study with measurements of the mean circulatory pressure in dogs. Jpn Circ J. 1984;48(7):620–32.
17. Rothe CF, Flanagan AD, Maass-Moreno R. Role of beta-adrenergic agonists in the control of vascular capacitance. Can J Physiol Pharmacol. 1990;68(5):575–85.
18. Lee RW, Lancaster LD, Buckley D, Goldman S. Peripheral circulatory control of preload-afterload mismatch with angiotensin in dogs. Am J Phys. 1987;253(1 Pt 2):H126–32.
19. Pang CC, Tabrizchi R. The effects of noradrenaline, B-HT 920, methoxamine, angiotensin II and vasopressin on mean circulatory filling pressure in conscious rats. Br J Pharmacol. 1986;89(2):389–94.
20. Martin DS, McNeill JR. Whole body vascular capacitance response to vasopressin is mediated by autonomic function. Am J Phys. 1991;261(2 Pt 2):H493–9.
21. Chien Y, Pegram BL, Kardon MB, Frohlich ED. ANF does not increase total body venous compliance in conscious rats with myocardial infarction. Am J Phys. 1992;262(2 Pt 2):H432–6.
22. Ogilvie RI, Zborowska-Sluis D. Effects of nitroglycerin and nitroprusside on vascular capacitance of anesthetized ganglion-blocked dogs. J Cardiovasc Pharmacol. 1991;18(4):574–80.
23. Ito H, Hirakawa S. Effects of vasodilators on the systemic capacitance vessels, a study with the measurement of the mean circulatory pressure in dogs. Jpn Circ J. 1984;48(4):388–404.
24. Rothe CF, Flanagan AD, Maass-Moreno R. Reflex control of vascular capacitance during hypoxia, hypercapnia, or hypoxic hypercapnia. Can J Physiol Pharmacol. 1990;68(3):384–91.
25. Rothe CF, Stein PM, MacAnespie CL, Gaddis ML. Vascular capacitance responses to severe systemic hypercapnia and hypoxia in dogs. Am J Phys. 1985;249(6 Pt 2):H1061–9.
26. Schipke JD, Heusch G, Sanii AP, Gams E, Winter J. Static filling pressure in patients during induced ventricular fibrillation. Am J Physiol Heart Circ Physiol. 2003;285(6):H2510–5.
27. Pinsky MR. Instantaneous venous return curves in an intact canine preparation. J Appl Physiol Respir Environ Exerc Physiol. 1984;56(3):765–71.
28. Versprille A, Jansen JR. Mean systemic filling pressure as a characteristic pressure for venous return. Pflugers Arch. 1985;405(3):226–33.
29. Den Hartog EA, Versprille A, Jansen JR. Systemic filling pressure in intact circulation determined on basis of aortic vs. central venous pressure relationships. Am J Phys. 1994;267(6 Pt 2):H2255–8.
30. Hiesmayr M, Jansen JR, Versprille A. Effects of endotoxin infusion on mean systemic filling pressure and flow resistance to venous return. Pflugers Arch. 1996;431(5):741–7.
31. Maas JJ, Geerts BF, van den Berg PC, Pinsky MR, Jansen JR. Assessment of venous return curve and mean systemic filling pressure in postoperative cardiac surgery patients. Crit Care Med. 2009;37(3):912–8.
32. Keller G, Desebbe O, Benard M, Bouchet JB, Lehot JJ. Bedside assessment of passive leg raising effects on venous return. J Clin Monit Comput. 2011;25(4):257– 63.
33. Mahjoub Y, Touzeau J, Airapetian N, Lorne E, Hijazi M, Zogheib E, et al. The passive leg-raising maneuver cannot accurately predict fluid responsiveness in patients with intra-abdominal hypertension. Crit Care Med. 2010;38(9):1824–9.
34. Parkin WG, Wright CA. Three dimensional closed loop control of the human circulation. Int J Clin Monit Comput. 1991;8(1):35–42.
35. Parkin WG, Leaning MS. Therapeutic control of the circulation. J Clin Monit Comput. 2008;22(6):391–400.
36. Parkin G, Wright C, Bellomo R, Boyce N. Use of a mean systemic filling pressure analogue during the closed-loop control of fluid replacement in continuous hemodiafiltration. J Crit Care. 1994;9(2):124–33.
37. Cecconi M, Aya HD, Geisen M, Ebm C, Fletcher N, Grounds RM, et al. Changes in the mean systemic filling pressure during a fluid challenge in postsurgical intensive care patients. Intensive Care Med. 2013;39(7):1299–305.
38. Gupta K, Sondergaard S, Parkin G, Leaning M, Aneman A. Applying mean systemic filling pressure to assess the response to fluid boluses in cardiac post-surgical patients. Intensive Care Med. 2015;41:265.
39. Anderson RM. The gross physiology of the cardiovascular system. 2012 ed. Tucson: Racquet Press; 1993.
40. Maas JJ, Pinsky MR, Geerts BF, de Wilde RB, Jansen JR. Estimation of mean systemic filling pressure in postoperative cardiac surgery patients with three methods. Intensive Care Med. 2012;38(9):1452–60.
41. Aya H, Rhodes A, Fletcher N, Grounds M, Cecconi M, editors. Transient stop-flow arm arterial-venous equilibrium pressure measurement: determination of precision of the technique. Annual Congress of the European Society of Intensive Care Medicine. Barcelona/New York: Springer; 2014.
42. Rangappa R, Sondergaard S, Aneman A. Improved consistency in interpretation and management of cardiovascular variables by intensive care staff using a computerised decision-support system. Crit Care Resusc. 2014;16(1):48–53.
43. Sondergaard S, Wall P, Cocks K, Parkin WG, Leaning MS. High concordance between expert anaesthetists’ actions and advice of decision support system in achieving oxygen delivery targets in high-r isk surgery patients. Br J Anaesth. 2012;108(6):966–72.
44. Cecconi M, De Backer D, Antonelli M, Beale R, Bakker J, Hofer C, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2014;40(12):1795–815.
45. Maas JJ, Pinsky MR, Aarts LP, Jansen JR. Bedside assessment of total systemic vascular compliance, stressed volume, and cardiac function curves in intensive care unit patients. Anesth Analg. 2012;115(4):880–7.
46. Maas JJ, Pinsky MR, de Wilde RB, de Jonge E, Jansen JR. Cardiac output response to norepinephrine in postoperative cardiac surgery patients: interpretation with venous return and cardiac function curves. Crit Care Med. 2013;41(1):143–50.
47. Aya HD, Ster IC, Fletcher N, Grounds RM, Rhodes A, Cecconi M. Pharmacodynamic analysis of a fluid challenge. Crit Care Med. 2016;44(5):880–91.
48. Cecconi M, Aya HD. Central venous pressure cannot predict fluid-responsiveness. Evid Based Med. 2014;19(2):63.