Bài viết Xử trí dịch truyền trong phòng mổ được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: State-of-the-art fluid management in the operating room
Tóm tắt
Các nguyên tắc cơ bản hướng dẫn xử trí dịch truyền trong bất kỳ bối cảnh nào là rất đơn giản: duy trì thể tích nội mạch trung tâm bình thường, và tránh dư thừa muối và nước. Tuy nhiên, những nguyên tắc này thường dễ nêu ra hơn là đạt được. Bằng chứng từ các tài liệu gần đây cho thấy rằng việc tránh thừa dịch truyền là rất quan trọng, với việc sử dụng quá nhiều dung dịch tinh thể dẫn đến tăng cân trong phẫu thuật và tăng biến chứng. Một phương pháp cân bằng zero nhằm mục đích tránh dư thừa dịch truyền được khuyến nghị cho tất cả bệnh nhân. Đối với phẫu thuật lớn, có một lượng lớn bằng chứng cho thấy một liệu pháp điều trị bằng dịch truyền nhắm mục tiêu cá nhân (GDFT, goal-directed fluid therapy) cải thiện kết quả. Tuy nhiên, trong một Enhanced Recovery program, chỉ có một vài nghiên cứu được công bố, cho đến nay GDFT vẫn chưa đạt được lợi ích tương tự. Dung dịch tinh thể cân bằng được khuyến cáo cho hầu hết bệnh nhân. Việc sử dụng dung dịch keo vẫn còn gây tranh cãi; tuy nhiên, bằng chứng hiện tại cho thấy chúng có thể có lợi ở những bệnh nhân phẫu thuật với bằng chứng khách quan về giảm thể tích máu.
Mở đầu
Các nguyên tắc cơ bản hướng dẫn xử trí dịch truyền trong bất kỳ môi trường nào rất đơn giản: duy trì thể tích nội mạch trung tâm bình thường, và tránh dư thừa muối và nước, nói cách khác, duy trì tuần hoàn đầy đủ để cho phép tưới máu tế bào tối ưu bình thường trong khi tránh bất kỳ phù ngoại biên hoặc mô kẽ nào, và tăng trọng lượng cơ thể. Điều này, tất nhiên, thường dễ nói hơn là đạt được, đặc biệt là trong phòng mổ (OR), nơi mất máu và di chuyển dịch có thể làm cho việc xử trí dịch truyền trở nên khó khăn.
Những nguyên tắc này đã được hiển thị bằng đồ họa dưới dạng đường cong hình chữ U (Hình 1) [1]. Các đợt giảm thể tích máu, nếu không được phát hiện, có thể dẫn đến giảm tưới máu và rối loạn chức năng cơ quan, với các kết quả bất lợi liên quan [2]. Điều quan trọng, và có lẽ không được thừa nhận, dùng dịch truyền dư thừa có thể dẫn đến phù nề mô và kết quả bất lợi [3]. Mặc dù cả hai quá trình này có thể là cực đoan, phổ biến hơn, nhưng chúng tinh tế với tuần hoàn các tạng đặc biệt có nguy cơ.
Một trong những đáp ứng đầu tiên đối với chứng giảm thể tích máu là huy động dự trữ các tạng, có khả năng làm giảm lưu lượng trong tuần hoàn các tạng để duy trì tưới máu cốt lõi đến các cơ quan quan trọng. Ở những người tình nguyện khỏe mạnh, tưới máu trung tâm bình thường có thể được duy trì sau khi xuất huyết có kiểm soát 25% thể tích máu, không có triệu chứng giảm thể tích máu và thay đổi tối thiểu về nhịp tim hoặc huyết áp [4]. Tuy nhiên, đồng thời, đo pH dạ dày (tonometry) cho thấy bằng chứng của giảm tưới máu lách một khi thâm hụt thể tích tuần hoàn vượt quá 10% [5]. Các nghiên cứu khác cũng chỉ ra rằng ruột là khu vực đầu tiên bị giảm tưới máu do hậu quả của giảm thể tích máu cấp tính [5,6].
Ngược lại, dùng dịch truyền dư thừa sẽ dẫn đến dịch truyền di chuyển ra khỏi tuần hoàn và vào mô kẽ [7]. Một lần nữa, ruột có nguy cơ, và kết quả phù nề mô kẽ có thể dẫn đến phù nề của thành ruột và hồi tràng sau phẫu thuật kéo dài. Ngay cả cân bằng muối và nước dương tính gây tăng cân 3 kg sau khi cắt bỏ đại tràng chọn lọc đã được chứng minh là có liên quan đến việc phục hồi chậm chức năng đường tiêu hóa, tăng biến chứng và thời gian nằm viện kéo dài [8].
Do đó, rối loạn chức năng đường tiêu hóa (GI) là biến chứng phẫu thuật thường gặp nhất sau phẫu thuật bụng [9]. Bất kỳ sự chậm trễ nào trong phục hồi GI có liên quan chặt chẽ với thời gian nằm viện, với việc xuất viện thường vào ngày sau khi phục hồi GI [10].
Liệu pháp dịch truyền cân bằng zero
Một số nghiên cứu đã kiểm tra xem liệu chế độ điều trị dịch truyền “giới hạn” có liên quan đến các biến chứng ít hơn hay không. Tuy nhiên, thuật ngữ này gây nhầm lẫn với sự khác biệt nhiều giữa các nghiên cứu trong chế độ dịch truyền khiến việc giải thích trở nên khó khăn [11]. Thuật ngữ “hạn chế” và “giới hạn”, thường được hiểu là ngụ ý làm cho giảm thể tích máu, trong khi nó chỉ đơn giản là tránh sự dư thừa dịch, thường nhìn thấy trong nhóm “tự do”.
Một trong những nghiên cứu “hạn chế” nổi tiếng và được trích dẫn thường xuyên nhất là nghiên cứu của Brandstrup et al. xuất bản năm 2003. Thử nghiệm đa trung tâm này đã chọn ngẫu nhiên 172 bệnh nhân chủ yếu là ASA I-II hoặc một chế độ truyền dịch tĩnh mạch (IV) trong phẫu thuật “hạn chế” vs “tiêu chuẩn”. Phác đồ hạn chế nhằm duy trì trọng lượng cơ thể trước phẫu thuật, trong khi chế độ tiêu chuẩn giống như thực hành hàng ngày, bao gồm cả việc thay thế mất dịch truyền khoang thứ ba. Kết quả cho thấy, nhóm “hạn chế” đã giảm đáng kể tỷ lệ biến chứng lớn và nhỏ, như xì dò miệng nối, phù phổi, viêm phổi và nhiễm trùng vết thương. Tuy nhiên, xem xét kỹ hơn về các giao thức dịch truyền cho thấy rằng trong các bệnh nhân nhóm “hạn chế” đã nhận được trung bình 2740 ml dịch truyền trong ngày phẫu thuật, đó là hỗn hợp của dung dịch tinh thể và dung dịch keo. Ngược lại, nhóm “tự do” nhận được hơn 5388 ml dịch truyền với phần lớn dịch truyền dư là nước muối sinh lý (NS), với bốn bệnh nhân cần đặt lại ống nội khí quản do phù phổi. Một cách giải thích phổ biến của nghiên cứu này là nhóm tự do đã nhận quá nhiều dịch truyền và nhóm hạn chế có thể tích dịch truyền thích hợp. Thật vậy, các tác giả đã tìm thấy mối quan hệ liều lượng giữa các biến chứng, tăng thể tích dịch IV (P <0,001) và tăng trọng lượng cơ thể (P <0,001) vào ngày phẫu thuật độc lập với nhóm phân bổ.
![Hình 1. Lượng dịch truyền so với các biến chứng (được sửa đổi từ Bellamy) [1]. Cả giảm thể tích máu và tăng thể tích máu đều có thể dẫn đến rối loạn chức năng cơ quan và kết quả bất lợi. Thách thức là giữ bệnh nhân trong vùng tối ưu.](https://www.healcentral.org/wp-content/uploads/2020/09/xu_tri_dich_truyen_trong_phong_mo_1-300x202.jpg)
Do đó, một câu hỏi quan trọng là tại sao việc sử dụng dịch truyền tự do là phổ biến cho đến gần đây để thay thế các thiếu hụt thể tích giả định như mất khoang thứ ba và bay hơi thường xuyên dẫn đến tăng 3-6 kg trọng lượng cơ thể mỗi lần phẫu thuật. Lý thuyết khoang thứ ba đã được phát triển vào những năm 1960, được mô tả như một khoang không có chức năng, nơi dịch truyền có thể bị giam giữ, và do đó cần phải lấp đầy [13]. Bằng chứng gần đây không hỗ trợ sự tồn tại của khoang thứ ba [7]. Dịch truyền chỉ đơn giản là trong khoang nội mạch hoặc trong mô kẽ. Sử dụng dịch truyền dư thừa để gây ra tình trạng tăng thể tích máu sẽ làm tăng áp suất thủy tĩnh trong tuần hoàn với sự giải phóng atrial natriuretic peptide (ANP) sau đó, gây tổn thương glycocalyx và tăng rò rỉ dịch truyền từ tuần hoàn vào mô kẽ như được mô tả bởi Chappell. [7] Sau đó, “khoang thứ ba” này thường được thay thế bằng nhiều dịch truyền IV hơn tạo ra một chu kỳ trong đó dịch truyền tích tụ trong kẽ và bệnh nhân tăng cân trong quá trình phẫu thuật. Sự lấp đầy theo kinh nghiệm của khoang giả định này, không được xác nhận, và chúng tôi tin rằng thuật ngữ khoang thứ ba khoang nên được bỏ qua. Tương tự, mất dịch do bay hơi trong phẫu thuật cũng đã bị phóng đại [14]. Bây giờ đã hơn 30 năm kể từ Lamke et al. được chứng minh bằng cách đo trực tiếp tốc độ bay hơi cơ bản mà tổn thất dịch truyền điển hình trong phẫu thuật bụng lớn là 0,5-1 ml/kg/giờ [15].
Do đó, mục tiêu đầu tiên của chúng tôi đối với điều trị bằng dịch truyền trong phẫu thuật nên tránh dịch truyền dư thừa. Vì dung dịch tinh thể thường được sử dụng để duy trì hydrat hóa, việc tránh các dung dịch tinh thể dư thừa là rất quan trọng. Một cách tiếp cận dịch truyền cân bằng zero (zero-balance fluid approach) có thể đạt được với truyền dung dịch tinh thể cân bằng ở mức 2-3 ml/kg/giờ dựa trên trọng lượng cơ thể lý tưởng. Đối với nhiều phẫu thuật, áp dụng phương pháp cân bằng zero có thể là đủ. Tuy nhiên, trong cuộc phẫu thuật lớn, cũng có một lượng bằng chứng đáng kể ủng hộ phương pháp trị liệu bằng dịch truyền hướng đến mục tiêu (GDFT, goal-directed fluid therapy) nhằm mục đích cá nhân hóa trị liệu bằng dịch truyền.
GDFT cá nhân hóa
Trị liệu theo mục tiêu (GDT, goal-directed therapy) là một thuật ngữ đã được sử dụng trong gần 30 năm để mô tả các phương pháp tối ưu hóa tình trạng dịch truyền và huyết động để cải thiện kết quả cho bệnh nhân phẫu thuật có nguy cơ cao. Tuy nhiên, thuật ngữ được sử dụng trong tài liệu không nhất quán và khó hiểu [16]. Thuật ngữ này lần đầu tiên được sử dụng để mô tả GDT nhắm mục tiêu oxy sớm vào những năm 1980 và 1990, sử dụng ống thông động mạch phổi (PAC, pulmonary artery catheter) để tăng lượng oxy cung cấp đến mức cao trên bình thường ở bệnh nhân phẫu thuật có nguy cơ cao. Gần đây, một số monitor các thông số huyết động dựa trên lưu lượng (flow-based hemodynamic parameters) xâm lấn tối thiểu đã được phát triển. GDFT đề cập đến việc xử trí dịch truyền cá nhân hóa có hoặc không có inotropes được hướng dẫn bằng các biện pháp đáp ứng tim mạch bằng cách tối đa hóa thể tích nhát bóp (SV, stroke volume) trong khi cũng tránh tình trạng quá tải dịch truyền. Dịch truyền chỉ được cung cấp nếu có đáp ứng dịch truyền có thể chứng minh được và nếu không thì ngưng lại. Kỹ thuật này cũng đã được đề cập đến trong tài liệu là SV tối ưu hóa [17]; cho mục đích của bài viết này, chúng tôi sẽ sử dụng thuật ngữ GDFT.
Về lý thuyết, GDFT cho phép đánh giá khách quan về đáp ứng tim mạch của từng bệnh nhân đối với việc bolus dịch truyền IV. Hầu hết các monitor này sử dụng các phương pháp dự đoán độ nhạy của dịch truyền như biến đổi thể tích nhát bóp (SVV, stroke volume variation), biến đổi áp suất xung (PPV, pulse pressure variation), thời gian lưu lượng hiệu chỉnh (FTc, corrected flow time) hoặc chỉ số biến thiên pleth (PVI, pleth variability index). Đây là một thị trường ngày càng cạnh tranh với số lượng ngày càng tăng các thiết bị không xâm lấn có sẵn cho các bác sĩ lâm sàng.
Hai câu hỏi quan trọng liên quan đến trị liệu dịch truyền cá nhân như sau:
1. Chúng ta có thể đo lường đáp ứng đối với một thách thức dịch truyền (fluid challenge)?
2. Chúng ta có thể dự đoán một bệnh nhân sẽ đáp ứng với một thách thức dịch truyền?
Làm thế nào chúng ta có thể đo lường đáp ứng đối với một thách thức dịch truyền?
Các monitor dựa trên lưu lượng xâm lấn tối thiểu có thể ước tính cung lượng tim (CO, cardiac output) và SV sau đó có thể được sử dụng để theo dõi đáp ứng với thách thức dịch truyền (Hình 2). Điều này cung cấp một cách tinh vi để chuẩn độ dịch truyền IV cho bệnh nhân phức tạp. GDFT sử dụng các thuật toán kết hợp các thách thức dịch truyền để tối ưu hóa SV và tránh các đợt giảm thể tích máu và nợ oxy sau phẫu thuật.
Chúng tôi có thể dự đoán bệnh nhân sẽ đáp ứng với thách thức dịch truyền?
Phân tích dạng sóng động mạch với máy theo dõi CO xâm lấn tối thiểu cũng đo lường các thông số động lực học của đáp ứng dịch, dựa trên các tương tác tim phổi, như SVV và PPV. Các biến động này vượt trội so với các chỉ số tĩnh truyền thống như CVP và là các chỉ số đáng tin cậy về khả năng đáp ứng thể tích ở bệnh nhân thở máy với sự tương tác nhịp tim và nhịp thở phù hợp (thể tích khí lưu thông đầy đủ trong nhịp xoang và điều kiện ngực kín).
Sinh lý học đằng sau SVV và PPV là: thông khí áp lực dương gây ra những thay đổi theo chu kỳ trong điều kiện tải của tâm thất phải (RV), với việc giảm tiền tải trong quá trình bơm phồng phổi cơ học (giai đoạn hít vào) [18]. Điều này dẫn đến những thay đổi theo chu kỳ trong RV-SV tương ứng với chu kỳ hô hấp, ở mức tối thiểu vào cuối giai đoạn hít vào. Sau thời gian vận chuyển phổi (thời gian trễ từ hai đến ba nhịp để máu đi qua hệ thống phổi), giảm tiền tải tâm thất trái (LV) sẽ xảy ra, dẫn đến giảm LV-SV ở mức tối thiểu vào cuối thời kỳ thở ra.
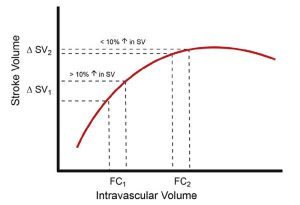
”Khi một bệnh nhân bị giảm thể tích máu và trên phần tăng dần của đường cong Frank-Starling, thử thách truyền dịch tĩnh mạch (VC1) sẽ dẫn đến tăng SV > 10%. Một bệnh nhân như vậy có thể huy động được SV, và đang ở trạng thái đáp ứng với dịch truyền. Khi bệnh nhân không còn bị giảm thể tích máu (VC2), thử thách dịch truyền tương tự sẽ dẫn đến tăng < 10% thể tích nhát bóp. Bệnh nhân bây giờ không đáp ứng với dịch truyền và sẽ không được hưởng lợi từ một thách thức dịch truyền hơn nữa.”
Ở những bệnh nhân bị suy giảm thể tích, khi tâm thất hoạt động ở phần dốc của đường cong Starling, cường độ của những thay đổi này trong SV và áp lực xung sẽ lớn hơn. Điều này sẽ thể hiện như là một dao động huyết áp tâm thu đặc trưng trong các dạng sóng áp lực động mạch theo chu kỳ hô hấp. PPV và SVV đại diện cho những thách thức tiền tải ảo xảy ra trong mỗi chu kỳ hô hấp ở bệnh nhân thở máy. Không cần xử trí dịch truyền để dự đoán người đáp ứng, với SVV hoặc PPV > 12-13% dự đoán chính xác đáp ứng dương tính đối với thách thức dịch truyền [19-21]. Vì các chỉ số động này dự đoán các đáp ứng lại với độ chính xác cao hơn CVP và vì không có giá trị ngưỡng CVP nào đáng tin cậy để chẩn đoán đáp ứng dịch truyền, nên ít có nhu cầu về các đường xâm lấn chỉ nhằm mục đích giám sát [19,22]. Trong một số nghiên cứu so sánh PPV và SVV, PPV dường như là biến số nhạy cảm và đặc hiệu nhất [19,20,23].
Việc sử dụng các tham số động để đánh giá khả năng đáp ứng của dịch truyền có một số hạn chế quan trọng. PPV và SVV yêu cầu khoảng thời gian R-R không đổi (nghĩa là nhịp xoang bình thường) và các áp lực “đầy đủ” ở ngực và bụng, nếu không giá trị tiên đoán của chúng bị giảm [24]. Kỹ thuật này dựa trên các tương tác tim phổi, và do đó, bất kỳ thay đổi nào về thể tích khí lưu thông và/hoặc áp lực trong lồng ngực sẽ ảnh hưởng đến tương tác. Tăng áp lực trong ổ bụng sẽ gây ra áp lực trong lồng ngực cao hơn và tương tác tim phổi thái quá sẽ làm tăng ngưỡng đáp ứng thể tích độc lập với tiền tải [23]. Chỉ PPV đã được xác nhận trong tình huống này, và bác sĩ lâm sàng cần hiểu về sinh lý học và tìm kiếm đáp ứng với một thách thức dịch truyền để xác định ngưỡng cho đáp ứng của dịch truyền [23]. Ví dụ, với trường hợp trán khí phúc mạc, một bệnh nhân có thể có PPV là 15% khi thể tích máu bình thường và chỉ đáp ứng với thử thách dịch truyền với SV tăng 10% khi PPV > 20%. Ngưỡng tăng này sau đó có thể được sử dụng để dự đoán khi nào cần thêm các thách thức về dịch truyền.
GDFT có cải thiện kết quả không?
Có một số công nghệ có thể được sử dụng cho GDFT. Nghiên cứu rộng rãi nhất là máy theo dõi Doppler thực quản (EDM, Deltex Medical, Chichester, UK). Đầu dò Doppler được đặt trong thực quản và tập trung tại động mạch chủ ngực nhánh xuống, trong đó nó sử dụng nguyên lý Doppler để đo tốc độ dòng máu và tạo ra dạng sóng cho vận tốc theo thời gian. Tích phân vận tốc này (khu vực dưới đường cong vận tốc và thời gian) sau đó được chuyển đổi thành SV bằng cách sử dụng một biểu đồ về chiều cao, cân nặng và tuổi để ước tính diện tích mặt cắt ngang của động mạch chủ đoạn xuống. Các giá trị SV đo từ EDM đã được xác nhận tốt trong các môi trường và các tình huống lâm sàng khác nhau.
Có một số nghiên cứu cho thấy kết quả được cải thiện với tối ưu hóa dịch truyền theo hướng EDM, được chứng minh bằng sự hồi phục nhanh hơn của chức năng đường tiêu hóa, giảm các biến chứng sau phẫu thuật và giảm thời gian nằm viện (LOS) [25]. Tất cả các nghiên cứu này đã sử dụng một thuật toán để tối ưu hóa SV (các dịch truyền nối tiếp khi có sự cải thiện > 10% trong SV), thường được kết hợp với đánh giá FTc để dự đoán khả năng đáp ứng của dịch truyền; và tất cả các dịch truyền dung dịch tinh thể được sử dụng với các dung dịch keo để tối ưu hóa.
Mythen và Webb đã chứng minh rằng GDFT làm giảm tỷ lệ suy giảm chức năng niêm mạc đường tiêu hóa và các biến chứng chính sau phẫu thuật tim [6]. Gan et al. chọn ngẫu nhiên 100 bệnh nhân phẫu thuật không do tim chọn lọc với lượng máu mất dự kiến > 500 ml để so sánh chăm sóc thường quy hoặc GDFT theo hướng dẫn của EDM [26]. Bệnh nhân trong nhóm GDFT có LOS trung vị ngắn hơn đáng kể (5 so với 7 ngày, p <0,05) và khả năng dung nạp thức ăn rắn sớm hơn (3 so với 5 ngày, p <0,05). Các nghiên cứu của Noblett [27] và Wakeling [28] cho thấy giảm LOS tương tự ở bệnh nhân phẫu thuật đại trực tràng, cũng như thời gian ngắn hơn để chế độ ăn uống đầy đủ cho thấy cải thiện chức năng đường tiêu hóa.
Mặc dù EDM có nhiều bằng chứng nhất về lợi ích kết quả, một số kinh nghiệm được yêu cầu để trở nên thành thạo trong việc sử dụng thiết bị này và tín hiệu tối ưu có thể khó thu được. Việc đọc thường xuyên có thể cần thiết để duy trì sự liên kết với lưu lượng. Ngoài ra, có một số lo ngại rằng thiết bị chỉ đo lưu lượng qua động mạch chủ xuống và một số giả định toán học có thể khiến nó không chính xác [29] và việc sử dụng máy đốt điện có thể gây nhiễu tín hiệu.
Có một số máy theo dõi CO sử dụng phân tích đường viền xung của dạng sóng động mạch (ví dụ: LiDCO, Vigileo và PiCCO) để tính toán SV, CO, cũng như các chỉ số đo động của đáp ứng tiền tải, như PPV và SVV. Ngày càng có nhiều nghiên cứu về kết quả tích cực sử dụng các thiết bị này. Các hệ thống PiCCO và LiDCOplus sử dụng phương pháp pha loãng nhiệt và lithium xuyên phổi tương ứng để hiệu chỉnh SV thu được từ phân tích áp lực xung. Do đó, các hệ thống này phù hợp để sử dụng trong phẫu thuật có nguy cơ cao hoặc phòng chăm sóc đặc biệt (ICU). Tối ưu hóa huyết động trong phẫu thuật theo mục tiêu sử dụng PiCCO đã được chứng minh là làm giảm yêu cầu đối với thuốc tăng co bóp/thuốc vận mạch và rút ngắn thời gian thở máy ở bệnh nhân trải qua phẫu thuật tim thông thường [30]. Pearse et al.. đã sử dụng hệ thống LiDCOplus (LiDCO Ltd, Cambridge, Vương quốc Anh) để tối ưu hóa bệnh nhân phẫu thuật có nguy cơ cao sau phẫu thuật, sử dụng kết hợp dung dịch keo và inotropes [31]. Có ít biến chứng hơn (44% so với 68%) và LOS ngắn hơn trong nhóm GDT.
Ngược lại, các hệ thống Flotrac/Vigileo (Edwards, Irving, TX, USA) và LiDCOrapid (LiDCO Ltd, Cambridge, UK) không yêu cầu hiệu chuẩn và thường được sử dụng cho GDFT. Benes et al. chọn ngẫu nhiên 120 bệnh nhân trải qua phẫu thuật bụng lớn với lượng máu mất dự kiến > 1000 ml vào GDFT với Flotrac/Vigileo hoặc chăm sóc phẫu thuật thường quy [32]. Mục tiêu của nhóm GDFT là duy trì SVV < 10% bằng cách sử dụng bolus dung dịch keo 3 ml/kg. Kết quả cho thấy khả năng ổn định huyết động trong phẫu thuật tốt hơn, giảm lactate huyết thanh khi kết thúc phẫu thuật và tỷ lệ biến chứng cơ quan sau phẫu thuật thấp hơn (34% so với 77%; p = 0,0066) với GDFT.
GDFT sử dụng Flotrac/Vigileo cũng đã được chứng minh là cải thiện kết quả ở nhiều nhóm bệnh nhân khác nhau. Cecconi et al. cho thấy kết quả cải thiện ở 40 bệnh nhân được gây tê vùng cho phẫu thuật khớp hông [33]. Kapoor et al. cho thấy giảm thời gian thở máy, ICU LOS và LOS bệnh viện ở bệnh nhân trải qua phẫu thuật tim [34]. Nhắm mục tiêu PPV < 10% đã được chứng minh là cải thiện kết quả sau phẫu thuật và giảm thời gian điều trị tích cực và thời gian nằm viện ở bệnh nhân phẫu thuật có nguy cơ cao [35].
Tuy nhiên, y học lâm sàng hiếm khi “không bao giờ hoặc luôn luôn”, khi bệnh nhân có PPV < 10% sẽ không bao giờ đáp ứng với dịch truyền và bệnh nhân có PPV > 10% sẽ luôn đáp ứng với dịch truyền. Do đó, cách tiếp cận vùng xám đã được ủng hộ với hai lần cắt: bệnh nhân có PPV < 9% loại trừ đáp ứng dịch chắc chắn, trong khi bệnh nhân có PPV > 13% sẽ luôn đáp ứng với dịch truyền (Bảng 1) [36]. Khoảng 25% bệnh nhân nằm trong vùng xám (PPV 9-13%) trong đó PPV không có kết luận: do đó, quyết định cho truyền dịch hay không sẽ phụ thuộc vào bức tranh tổng thể, xu hướng và nhu cầu cá nhân của bệnh nhân (tức là, nếu bệnh nhân bị rối loạn chức năng thận, có thể nên thận trọng giữ PPV < 9%, trong khi đó nếu bệnh nhân bị rối loạn chức năng phổi tránh việc thừa dịch truyền ngưỡng có thể là ưu tiên cao hơn). Một thách thức dịch truyền nhỏ hơn cũng có thể được xem xét [37]. Cách tiếp cận này có vẻ hợp lý và thực tế.
Các công nghệ không xâm lấn khác có thể được sử dụng cho GDFT bao gồm máy theo dõi CO không xâm lấn (NICOM, Cheetah Medical, Vancouver, WA, USA) và Nexfin (Edwards, Irving, TX, USA). NICOM là một monitor dựa trên đáp ứng sinh học đã được chứng minh là hoạt động tương tự như EDM trong hướng dẫn GDFT [38]. Nexfin đo chính xác và liên tục cả huyết áp động mạch [39] và CO [40, 41] bằng cách sử dụng bóng chèn ngón tay bơm hơi được (inflatable finger cuff).
| Bảng 1 Tần suất và số người đáp ứng cho một thách thức dịch truyền ở các giá trị PPV khác nhau [36]. | ||
| Patient (%) | Respondents (%) | |
| PPV < 9% | 159 (38%) | 18 (11%) |
| PPV 9-13% | 98 (24%) | 49 (50%) |
| PPV>13% | 156 (38%) | 142 (91%) |
Hamilton et al. gần đây đã thực hiện đánh giá hệ thống và phân tích tổng hợp về việc sử dụng liệu pháp GDT ở bệnh nhân phẫu thuật nguy cơ từ trung bình đến cao [42]. Hai mươi chín nghiên cứu được xác định liên quan đến 4805 bệnh nhân đã sử dụng các hình thức theo dõi huyết động khác nhau bao gồm PAC, Doppler thực quản, LiDCO, PiCCO và FloTrac. Can thiệp bao gồm điều trị bằng dịch truyền có hoặc không có hỗ trợ inotropic. Các tác giả nhận thấy rằng việc sử dụng theo dõi huyết động phòng ngừa giảm đáng kể các biến chứng phẫu thuật (tỷ lệ chênh lệch 0,43 (0,34-0,53); P < 0,0001). Phân tích phân nhóm cho thấy hiệu ứng này là tương tự nhau bất kể loại monitor được sử dụng và loại can thiệp.
Trung tâm Dịch vụ Medicare ở Hoa Kỳ đã xem xét tài liệu và hỗ trợ một khoản phí chuyên nghiệp được trả cho các bác sĩ lâm sàng bằng cách sử dụng tối ưu hóa phẫu thuật theo hướng dẫn EDM [43]. EDM đã được chứng nhận bởi National Institute for Health and Care Excellence (NICE) tại Vương quốc Anh vào năm 2011. Họ tuyên bố rằng vụ việc áp dụng Doppler thực quản trong NHS được hỗ trợ bởi bằng chứng; giảm các biến chứng trong bệnh viện, giảm sử dụng catheter tĩnh mạch trung tâm và LOS so với đánh giá lâm sàng thông thường có hoặc không có theo dõi tim mạch xâm lấn. Doppler thực quản nên được xem xét để sử dụng cho những bệnh nhân trải qua phẫu thuật lớn hoặc có nguy cơ cao. [44] Nhiều bác sĩ lâm sàng đã mở rộng khuyến nghị này sang các công nghệ khác có thể được sử dụng cho GDFT.
Các nghiên cứu gần đây về GDFT trong chương trình Phục hồi Nâng cao (Enhanced Recovery program)
Trong vài năm qua, một số nghiên cứu đã kiểm tra việc sử dụng GDFT với EDM trong các chương trình Tăng cường phục hồi sau phẫu thuật (ERAS, Enhanced Recovery After Surgery). Các chương trình ERAS bao gồm một loạt các lựa chọn trị liệu được thiết kế để giảm thiểu đáp ứng căng thẳng đối với phẫu thuật và cải thiện khả năng phục hồi (Bảng 2).
Các chương trình ERAS đang trở thành tiêu chuẩn chăm sóc cho phẫu thuật đại trực tràng, và ngày càng được áp dụng cho các phẫu thuật khác.
Một phân tích tổng hợp đã chỉ ra rằng các chương trình ERAS đã giảm LOS cho phẫu thuật đại trực tràng 2,5 ngày và giảm 50% các biến chứng phẫu thuật [45].
Một trong những mục tiêu chính của thành phần trước phẫu thuật của chương trình ERAS là để đưa bệnh nhân đến phòng mổ (OR) ở trạng thái được cho ăn. Tránh chuẩn bị ruột thường quy, cho phép uống nước trong cho đến 2 giờ trước phẫu thuật và uống một thức uống carbohydrate trước phẫu thuật có thể đạt được sự giảm khát, đói, lo lắng và kháng insulin sau phẫu thuật [46- 48]. Bệnh nhân tuân thủ với các thành phần trước phẫu thuật này có nhiều khả năng đạt được thể tích máu bình thường khi đến OR, có khả năng làm cho việc điều trị bằng dịch truyền trong OR dễ dàng hơn.
Các nghiên cứu về GDFT trong một chương trình ERAS đã không tìm thấy lợi ích tương tự đối với kết quả sau phẫu thuật như các nghiên cứu ban đầu. Điều này có lẽ không đáng ngạc nhiên, vì sự quan tâm trong nhóm kiểm soát đã được cải thiện đáng kể khiến việc quan sát sự khác biệt so với GDFT trở nên khó khăn hơn. Srinivasa et al. đưa 85 bệnh nhân đến GDFT hoặc chế độ điều trị bằng dịch truyền cân bằng zero trong chương trình ERAS để phẫu thuật đại trực tràng [49].
| Bảng 2. Chương trình Duke ERAS cho phẫu thuật đại trực tràng [77]. | ||
| Tiền phẫu | Trong phẫu thuật | Hậu phẫu |
| Xác định bệnh nhân | Gây tê dưới màng cứng ngực | Cho ăn sớm |
| Giáo dục về chương trình | Điều trị dịch truyền theo mục tiêu (GDFT) | Cử động sớm |
| Uống nước trong cho đến 2 giờ trước khi phẫu thuật | Giảm đau đa phương thức | Chế độ dịch tối ưu |
| Nước uống có carbohydrate | Kháng sinh trước khi rạch | Chế độ giảm đau tối ưu |
| Chuẩn bị ruột chọn lọc | PONV và huyết khối | Không sonde dạ dày, cũng không thông tiểu |
Tổng dịch truyền được cung cấp trong cả hai nhóm trong phẫu thuật cao hơn về mặt thống kê trong nhóm GDFT (1994 so với 1614 ml; p = 0,010), nhưng nhìn chung, thể tích tương đương, và thấp hơn nhiều so với các nghiên cứu GDFT trước đây ngoài chương trình ERAS. Thật vậy, giao thức GDFT được sử dụng rất giống với giao thức được sử dụng trong Gan et al. nghiên cứu vào năm 2002 khi tổng lượng dịch được đưa vào hoạt động là 5420 ml trong nhóm GDFT và 4775 ml trong nhóm đối chứng [26].
Dân số được nghiên cứu bởi Gan hơi khác nhau ở chỗ nó bao gồm tất cả các ca phẫu thuật bụng, nhưng sự khác biệt về nhu cầu dịch truyền minh họa một cách khéo léo sự thay đổi trong thực tế đã xảy ra trong 10 năm qua, với xu hướng sử dụng ít dịch truyền hơn trong phẫu thuật. Hầu hết các bệnh nhân đều đáp ứng với dịch truyền sau khi dẫn đầu gây mê trong nghiên cứu Gan và việc sử dụng GDFT đã cải thiện đáng kể SV từ đường cơ sở đến khi kết thúc phẫu thuật. So sánh, trong nghiên cứu Srinivasa, bệnh nhân không đáp ứng với dịch truyền; SV không thay đổi, và giống nhau ở cả hai nhóm.
Brandstrup cũng không tìm thấy lợi ích nào với GDFT so với chế độ cân bằng zero trong chương trình Phục hồi nâng cao [12]. Điều quan trọng, trong cả hai nghiên cứu Srinivasa và Brandstrup, GDFT không liên quan đến tác hại khi so sánh với chiến lược cân bằng zero [12,49]. Ngược lại, nghiên cứu OPTIMISE đa trung tâm tập trung vào GDFT trên những bệnh nhân có nguy cơ cao trải qua phẫu thuật bụng lớn [50]. Một tỷ lệ đáng kể trong số những bệnh nhân này được xử trí theo lộ trình ERAS. Trong nhóm dân số có nguy cơ cao này, có một xu hướng biến chứng giảm không đáng kể (36,6% so với 43,4%, p = 0,07) và tử vong 180 ngày (7,7% so với 11,6%, p = 0,08) trong nhóm GDFT so với chăm sóc thông thường.
Do đó, trong khi các chương trình ERAS có thể đã nâng ngưỡng lợi ích, vẫn sẽ có nhiều bệnh nhân, dù được mong đợi hay bất ngờ, việc tối ưu hóa SV sẽ mang lại lợi ích cho ai. Điều này giống như bất kỳ thiết bị giám sát nào khác; không phải tất cả sự chăm sóc của bệnh nhân đều có lợi cho việc đo pulse oximeter, nhưng đó là tiêu chuẩn chăm sóc đúng đắn. Nhiều bệnh nhân đang trải qua cuộc phẫu thuật lớn bên ngoài con đường ERAS (tức là phẫu thuật mạch máu) cũng sẽ có lợi cho GDFT. Các hướng dẫn đã được xuất bản khuyến nghị các loại trường hợp khi GDFT nên được xem xét [51]. Cuối cùng, nhu cầu về GDFT là bệnh nhân, bác sĩ phẫu thuật, thủ thuật và tổ chức cụ thể. Mỗi tổ chức cần xem xét kết quả và dữ liệu điểm chuẩn của mình cho dân số được hưởng lợi so với các tổ chức khác trước khi đưa ra quyết định có căn cứ về việc triển khai GDFT phù hợp. Những dữ liệu này nên bao gồm LOS, tỷ lệ nhập viện, tỷ lệ tử vong và chi phí. Tất cả bệnh nhân nên có một kế hoạch cá nhân để xử trí dịch truyền hơn là cách tiếp cận công thức dựa trên trọng lượng cơ thể và thời gian tiếp xúc phẫu thuật. Đối với những bệnh nhân trải qua phẫu thuật đại trực tràng bị mất máu hạn chế trong một lộ trình ERAS, có thể cần phải truyền dịch tối thiểu và GDFT có thể không mang lại lợi ích bổ sung [17]. Tuy nhiên, bằng chứng hiện tại cho thấy rằng đối với phần lớn bệnh nhân trải qua phẫu thuật lớn, GDFT vẫn là kỹ thuật được lựa chọn để tối ưu hóa dịch phẫu thuật và tối ưu hóa động lực học [52].
Nên sử dụng dịch truyền nào?
Một dung dịch tinh thể cân bằng điện giải như Lactated Ringers (LR), Plasma-LyteTM hoặc NormosolTM nên được sử dụng để đáp ứng các yêu cầu duy trì. Tỷ lệ được khuyến nghị cho truyền dịch nền để thay thế nước mất không nhận biết và lượng nước tiểu nằm trong khoảng 1-3 ml/kg/giờ dựa trên trọng lượng cơ thể gầy [14]. Tuy nhiên, 0,9% NS vẫn là dung dịch tinh thể được sử dụng phổ biến nhất trên thế giới [53]. NS không phải là bình thường, vì nó có chứa nồng độ natri và clorua cao (NS chứa 154 mmol/l clorua, nhiều hơn đáng kể so với nồng độ trong huyết tương là 105 mmol/l). Xử trí NS, hoặc các dung dịch được xây dựng trong NS, chẳng hạn như dung dịch keo trong nước muối, gây ra nhiễm toan chuyển hóa do tăng clorua máu có thể dự đoán được, có liên quan đến tác hại [54- 59]. Trong một phân tích cơ sở dữ liệu hồi cứu lớn được công bố gần đây, so sánh việc sử dụng NS một mình hoặc dung dịch dung dịch tinh thể cân bằng (Plasma-LyteTM, Baxter, IL, USA) đơn thuần vào ngày phẫu thuật, đã tăng việc sử dụng các xét nghiệm đặc biệt (khí máu động mạch và mức độ lactate) và phương pháp điều trị (chất đệm và các sản phẩm máu) trong nhóm NS, có lẽ là để điều tra và xử trí các bất thường toan kiềm gây ra bởi nước muối [60]. Khi so sánh với dung dịch điện giải cân bằng, việc sử dụng NS cũng gây ra nguy cơ nhiễm trùng hậu phẫu cao hơn đáng kể và suy thận cần phải lọc máu.
Được biết, tăng clorua máu có thể ảnh hưởng xấu đến chức năng thận. Ở thận chó bị nhiễm độc, truyền tĩnh mạch các dung dịch chứa clorua tạo ra co mạch thận và giảm tốc độ lọc cầu thận [61]. Gần đây, Chowdhury et al. đã chứng minh tác dụng tương tự ở người bằng cách đo tưới máu vỏ thận trong và sau khi truyền 2 lít nước muối so với Plasma-Lyte TM [62]. Trong ICU, việc thực hiện chiến lược dịch truyền hạn chế clorua cũng có liên quan với việc giảm đáng kể tỷ lệ chấn thương thận cấp tính (AKI) và sử dụng RRT [63]. Trong OR, bệnh nhân trải qua thay khớp háng nguyên phát có base deficit tồi tệ hơn đáng kể khi được chọn ngẫu nhiên với NS so với chế độ điều trị cân bằng dịch truyền [64].
Một lĩnh vực thực hành mà việc sử dụng NS có thể là thận trọng là chấn thương sọ não. Một phân tích tập hợp con sau nghiên cứu SAFE cho bệnh nhân chấn thương sọ não (n = 460) cho thấy tỷ lệ tử vong thấp hơn ở những bệnh nhân được điều trị bằng NS so với albumin (33,2% so với 20,4%) [65]. Điều quan trọng cần lưu ý là chế phẩm albumin được sử dụng trong nghiên cứu SAFE, 4% Albumex® (CSL, Melbourne), tương đối nhược trương (260 mOsmol/l), và chính điều này có thể đã góp phần dẫn đến kết quả tồi tệ hơn trong nhóm albumin [66]. Mặt khác, việc sử dụng các dung dịch tinh thể cân bằng dường như có lợi. Không chính xác, không có nghiên cứu đáng kể so sánh các chế độ cân bằng khác nhau. Cụ thể, không có dữ liệu so sánh các anion khác nhau (lactate, acetate và gluconate) được sử dụng thay thế cho clorua.
Hầu hết các nghiên cứu về GDFT đã sử dụng bolus dung dịch keo, chủ yếu là các dung dịch HES trong dung dịch muối hoặc dung dịch tinh thể cân bằng, để tối ưu hóa SV ngoài chế độ duy trì dung dịch tinh thể. Điều này dựa trên nguyên tắc của Starling rằng dung dịch keo có chứa các đại phân tử sẽ tồn tại trong khoang nội mạch. Ngược lại, khi sử dụng dung dịch tinh thể, chỉ 20% dung dịch sẽ tồn tại trong khoang mạch sau 30 phút [67]. Do đó, khi hàng rào mạch máu còn nguyên vẹn trong phẫu thuật, có vẻ thận trọng theo các nguyên tắc sinh lý để thay thế mất máu và mất huyết tương ra khỏi tuần hoàn bằng các dung dịch keo iso-oncotic [14]. Điều này thường đạt được với một bolus 200-250 ml.
Tuy nhiên, gần đây, việc sử dụng dung dịch keo trong thực hành y tế, đặc biệt là các dung dịch HES, đã được đặt câu hỏi. Hai thử nghiệm lớn (CHEST [68] và 6S [69]) kiểm tra việc sử dụng hydroxyethyl starch (HES) trong ICU đã chỉ ra rằng HES có liên quan đến tác hại. Khi nghiên cứu SAFE kiểm tra việc sử dụng albumin trong ICU được thêm vào danh sách này, hiện có ba thử nghiệm lớn với hơn 15.000 bệnh nhân cho thấy không có lợi ích gì từ việc sử dụng các dung dịch keo đắt tiền hơn trong ICU. Điều này đã khiến nhiều chuyên gia đặt câu hỏi về việc sử dụng các dung dịch keo mỗi lần phẫu thuật.
Mặc dù CHEST và 6S là các thử nghiệm được tiến hành tốt, điều quan trọng cần lưu ý là một thử nghiệm ngẫu nhiên có kiểm soát (RCT) được thiết kế để trả lời một câu hỏi cụ thể trong một hoàn cảnh cụ thể. Ví dụ, trong 6S, đã kiểm tra việc sử dụng HES ở bệnh nhân nhiễm trùng huyết ở ICU, hơn 75% bệnh nhân ở cả hai nhóm đều nhận được dung dịch keo trước khi đăng ký. Việc đăng ký chậm trễ này có thể là do khó khăn trong việc đăng ký bệnh nhân vào nghiên cứu ICU lâm sàng. Do đó, có thể lập luận rằng thử nghiệm đã kiểm tra việc sử dụng dung dịch keo theo cách thông thường (HES và các dung dịch keo khác để hồi sức ban đầu, và sau đó là dung dịch tinh thể trong giai đoạn ổn định của nhóm bệnh dung dịch tinh thể nghiêm trọng) so với cách bất thường (chỉ riêng HES trong thời gian ổn định hồi sức). 6S trả lời một câu hỏi quan trọng: Rõ ràng không nên sử dụng HES trong giai đoạn ổn định bệnh hiểm nghèo, đặc biệt là nhiễm trùng huyết. Khả năng ứng dụng của kết quả này vào các cài đặt khác là mở để giải thích. Việc sử dụng bolus dịch truyền sau hồi sức của bất kỳ loại nào trong nhiễm trùng huyết đã hạn chế thành công và có thể có hại.
Bihari et al. đã nghiên cứu 184 bolus dịch truyền ở 50 bệnh nhân nhiễm trùng huyết sau khi hồi sức ban đầu và tìm thấy sự gia tăng tối thiểu của MAP và lượng nước tiểu sau một bolus dịch truyền trong bối cảnh này, nhưng tỷ lệ PaO2/FiO2 giảm đáng kể [70].
CHEST đã kiểm tra việc sử dụng HES hoặc NS ở 7000 bệnh nhân nhập viện ICU và cho thấy sự gia tăng trong liệu pháp thay thế thận (RRT) khi sử dụng HES. Tuy nhiên, những người đề xuất HES có thể phân tích thử nghiệm khác nhau. Một lần nữa, bệnh nhân thường được hồi sức trước khi đưa vào nghiên cứu, với thời gian đăng ký trung bình 10 giờ sau khi đưa vào ICU. Giá trị p được điều chỉnh theo rủi ro cho sự gia tăng RRT với HES là 0,05. Do đó, có thể kết luận rằng trong một nghiên cứu lớn về các bệnh nhân bị bệnh nghiêm trọng được đưa ra HES không đúng lúc (sau khi hồi sức), đã có sự gia tăng RRT ở nhóm HES và không làm tăng tỷ lệ tử vong. Để cung cấp đủ năng lượng cho một thử nghiệm để điều tra bất kỳ tác hại nào có thể xảy ra từ HES sẽ cần một thử nghiệm đặc biệt lớn và khó có thể xảy ra.
Ngược lại, ấn phẩm gần đây của Colloids Versus Crystalloids for Resusciving of Critical Ill (CRISTAL), một nhãn mở (các bác sĩ lâm sàng không được làm mù với dịch truyền nghiên cứu) so sánh ngẫu nhiên các dung dịch tinh thể với dung dịch keo trong giai đoạn hồi sức sớm (nghĩa là bệnh nhân bị giảm thể tích máu), đã gợi ý một lợi ích có thể có cho dung dịch keo [78]. Tương tự, trong một mô hình động vật, khi sốc xuất huyết được gây ra bằng cách loại bỏ đủ lượng máu để lấy và duy trì áp lực động mạch trung bình (MAP) là 40 mmHg, phục hồi MAP nhanh hơn bốn lần so với HES so với LR (p <0,001) và yêu cầu khối lượng ít hơn gấp bốn lần (p = 0,04) [71].
Những suy luận nào chúng ta có thể thực hiện từ các thử nghiệm này đối với việc sử dụng HES và dung dịch keo trong phẫu thuật nói chung? Bối cảnh có lẽ là chìa khóa: một dung dịch keo chỉ hoạt động giống như một dung dịch keo khi glycocalyx còn nguyên vẹn và bệnh nhân đang cần tăng thể tích nội mạch. Lợi ích của dung dịch keo trong việc bối cảnh glycocalyx nguyên vẹn ở bệnh nhân trải qua tối ưu hóa thể tích trong phẫu thuật lớn hoặc sau khi xuất huyết lớn có thể rất khác với nguy cơ HES trong giai đoạn ổn định nhiễm trùng huyết nặng và vỡ glycocalyx.
Yates et al. gần đây đã tiến hành một RCT so sánh việc sử dụng bolus của dung dịch tinh thể hoặc dung dịch keo cho GDFT trong cuộc phẫu thuật lớn [72]. Họ không tìm thấy sự khác biệt về kết quả mặc dù, tương tự như một nghiên cứu trước đây, cần thêm 60% dịch truyền trong nhóm dung dịch tinh thể [73]. Do đó, trong thực hành lâm sàng không có giảm thể tích máu đáng kể, tỷ lệ keo-dung dịch tinh thể dường như xấp xỉ 1:1,5 [72,73]. Tuy nhiên, hiệu ứng thể tích của dung dịch keo là nhạy cảm theo ngữ cảnh [14] và khi có hiện tượng giảm thể tích máu, tỷ lệ keo-dung dịch tinh thể có thể cao hơn [71].
Điều quan trọng, trong nghiên cứu của Yates, cũng có tỷ lệ thất bại 38% trong nhóm dung dịch tinh thể khi bolus dung dịch keo được đưa ra để đạt được các mục tiêu huyết động. Mất máu ở cả hai nhóm cũng thấp. Từ những kết quả này, có vẻ như một dung dịch tinh thể có thể được sử dụng như là một thay thế cho dung dịch keo để tối ưu hóa SV trong GDFT. Tuy nhiên, trong bối cảnh mất máu cấp tính, vẫn có thể thận trọng khi sử dụng dung dịch keo và tránh quá tải dung dịch tinh thể.
Còn tiểu phẫu thì sao?
Ở những bệnh nhân trải qua phẫu thuật nhỏ hoặc cấp cứu, chế độ dung dịch tinh thể đã được chứng minh là cải thiện kết quả như đau, buồn nôn và chóng mặt, và tạo điều kiện cho xuất viện sớm hơn [74-76]. Mặc dù những nghiên cứu này được thực hiện trong thời đại khi việc nhịn ăn kéo dài vẫn là tiêu chuẩn, nhưng có thể có tác hại hạn chế trong việc truyền 1,5-2 lít dung dịch tinh thể cân bằng ở hầu hết những bệnh nhân này và lợi ích có thể có. Hầu hết bệnh nhân trải qua phẫu thuật cấp cứu sẽ không được truyền IV sau phẫu thuật và đôi khi có thể giảm lượng nước uống trong 24 giờ sau phẫu thuật.
Kết luận
Xử trí dịch truyền quanh phẫu thuật là quan trọng. Ngày càng có nhiều tài liệu cho thấy rằng cả tăng thể tích máu và dư thừa dịch truyền đều có liên quan đến tác hại. Do đó, tất cả bệnh nhân nên có một kế hoạch cá nhân để xử trí dịch truyền và theo dõi huyết động thích hợp. GDFT nên được xem xét dựa trên độ phức tạp của phẫu thuật và các yếu tố nguy cơ của bệnh nhân.
Điểm thực hành
- Mỗi bệnh nhân trải qua phẫu thuật nên có một kế hoạch xử trí dịch truyền cá nhân.
- Một cách tiếp cận cân bằng zero nhằm mục đích tránh tăng cân phẫu thuật là phù hợp với hầu hết bệnh nhân. Tránh nhiều liều bolus và nên sử dụng một lượng nhỏ dung dịch tinh thể cân bằng.
- Đối với những bệnh nhân trải qua phẫu thuật lớn, nên sử dụng GDFT cá nhân bằng cách sử dụng monitor cung lượng tim xâm lấn tối thiểu.
- Các dung dịch tinh thể đơn thuần có thể thích hợp trong các tình huống glycocalyx bị suy yếu (ví dụ, bệnh nhân nhiễm trùng huyết trong phòng mổ).
- Dung dịch keo có thể phù hợp khi bệnh nhân có khả năng có glycocalyx nguyên vẹn và đang nhận GDFT (ví dụ: tối ưu hóa ưu tiên cho các phẫu thuật có mức độ rủi ro cao hoặc trung bình vì điều này sẽ tránh việc sử dụng khối lượng dung dịch tinh thể lớn hơn) và/hoặc hiển thị bằng chứng khách quan của giảm thể tích máu.
- Không rõ liệu các dung dịch keo tổng hợp như dung dịch HES có phù hợp hay không cần thêm dữ liệu.
Chương trình nghiên cứu
Chúng ta cần một nghiên cứu RCT đa trung tâm, mù đôi của dung dịch keo so với dung dịch tinh thể trong phẫu thuật lớn chọn lọc trong đó dịch truyền được đưa ra để điều trị khi có bằng chứng khách quan của giảm thể tích máu. Vì ERAS đang trở thành một tiêu chuẩn chăm sóc, điều này nên được thực hiện trong một giao thức ERAS.
Cần làm thêm để xác định khi nào GDFT hữu ích trong việc cải thiện kết quả trong giao thức ERAS.
NS vẫn là dịch truyền IV được sử dụng phổ biến nhất trên toàn thế giới. Bằng chứng ngày càng tăng rằng NS có liên quan đến tác hại; tuy nhiên, thay đổi thực hành là khó khăn để đạt được. Một thử nghiệm lớn, đa trung tâm của dịch truyền cân bằng so với không cân bằng sẽ giúp xác định xem việc sử dụng NS thường xuyên có hợp lý hay không.