Bài viết ARDS các tiến bộ trong chẩn đoán và điều trị được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Acute Respiratory Distress Syndrome Advances in Diagnosis and Treatment
Mở đầu
Hội chứng suy hô hấp cấp tính (ARDS) lần đầu tiên được mô tả cách đây 50 năm như là một dạng suy hô hấp giống như hội chứng suy hô hấp ở trẻ sơ sinh.[1] Tình trạng đe dọa tính mạng này có thể do nhiều nguyên nhân khác nhau của phổi (ví dụ viêm phổi do hít), hoặc ngoài phổi (như nhiễm khuẩn huyết, viêm tụy, chấn thương), dẫn đến sự xuất hiện phù phổi không do tăng áp lực thủy tĩnh. ARDS được đặc trưng bởi tổn thương phổi viêm, lan tỏa, cấp tính, làm tăng khả năng thẩm thấu mao mạch, tăng trọng lượng phổi, và mất mô phổi có thông khí. Trên lâm sàng, bệnh này có biểu hiện là thiếu oxy máu, với hình ảnh thâm nhiễm 2 phổi trên chụp X quang phổi, liên quan đến sự giảm độ giãn nở phổi và tăng trộn lẫn màu tĩnh mạch và khoảng chết sinh lý. Về mặt hình thái, tổn thương phế nang khuếch tán được thấy trong giai đoạn cấp tính của ARDS. ARDS ảnh hưởng đến khoảng 200000 bệnh nhân hàng năm ở Hoa Kỳ, kết quả là gần 75000 ca tử vong, nhiều hơn ung thư vú hoặc nhiễm HIV.[2] Trên toàn cầu, ARDS ảnh hưởng đến khoảng 3 triệu bệnh nhân mỗi năm, chiếm 10% nhập viện chăm sóc đặc biệt (ICU), và 24% bệnh nhân được thở máy trong ICU.[3] Mặc dù đã có nhiều thập kỷ nghiên cứu, các phương pháp điều trị ARDS còn hạn chế.[4] Tỷ lệ tử vong do ARDS vẫn ở mức cao, dao động từ 35% đến 46%, tỷ lệ tử vong cao hơn có liên quan đến mức độ tổn thương phổi ở mức độ nặng hơn khi bắt đầu.[3] Những người sống sót có thể có bệnh lý thần kinh cơ, thần kinh tâm thần, và nhận thức thần kinh có liên quan đến chất lượng cuộc sống bị suy giảm đáng kể, chừng 5 năm sau khi bệnh nhân hồi phục từ ARDS.[5-7] Do gánh nặng sức khoẻ cộng đồng của ARDS, chúng tôi đã xem xét những tiến bộ trong chẩn đoán và điều trị ARDS có đã được báo cáo trong những năm từ 2012 đến 2017. Chúng tôi cũng nhấn mạnh các lĩnh vực không chắc chắn đang diễn ra liên quan đến định nghĩa và thực tiễn tốt nhất, cũng như nhu cầu nghiên cứu trong tương lai.
Các phương pháp
Tổng quan về MEDLINE, EMBASE, và Cơ sở dữ liệu Cochrane của các Tổng quan Hệ thống đã được tiến hành, bao gồm các ấn phẩm từ năm 2012 đến năm 2017 sử dụng các chiến lược tìm kiếm cụ thể. Tìm kiếm chính của chúng tôi sử dụng thuật ngữ “acute respiratory distress syndrome, adult respiratory distress syndrome, ARDS, acute lung injury, and ALI”. Chúng tôi giới hạn bài viết cho người lớn (≥18 tuổi) dữ liệu của con người chỉ được báo cáo bằng tiếng Anh. Các bài báo được sàng lọc đã được công bố từ ngày 1 tháng 1 năm 2012 đến ngày 1 tháng 12 năm 2017 và loại trừ các bài báo, bình luận, loạt bài luận và nghiên cứu theo nhóm – tập trung vào các thử nghiệm lâm sàng ngẫu nhiên (RCTs), phân tích gộp, tổng quan hệ thống và lâm sàng hướng dẫn thực hành. Sau khi sàng lọc 1662 tiêu đề và tóm tắt, nhiều bài báo đã được xác định để xem lại toàn văn, sau đó việc rà soát lại các tài liệu tham khảo bổ sung bằng tay. Tổng cộng có 114 bài báo văn bản đầy đủ đã được xem xét, trong đó có 31 bài được chọn với nội dung có liên quan. Chỉ những bài báo được xem là có những tiến bộ quan trọng trong chẩn đoán hoặc điều trị ARDS đã được chọn để xem xét.
Các kết quả
Các tiến bộ quan trọng về chẩn đoán
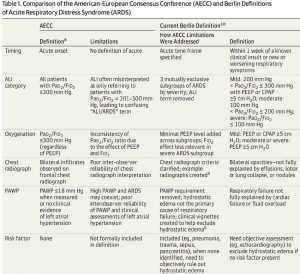
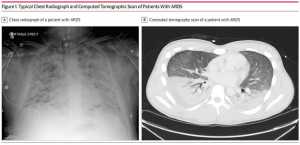
Mô tả đầu tiên của ARDS vào năm 1967, đã mô tả một hội chứng lâm sàng về chứng khó thở nặng, thở nhanh, tím tái kháng trị với liệu pháp oxy, sự mất độ giãn nở phổi, và các thâm nhiễm phế nang lan tỏa trên X quang ngực; tuy nhiên, không có tiêu chí cụ thể nào được nêu ra. Sau năm 1967, một số định nghĩa đã được đề xuất nhưng không được chấp nhận rộng rãi cho đến khi thành lập Hiệp định AECC (AECC, American-European Consensus Conference) năm 1994 (Bảng 1).[9] AECC đã xác định ARDS là khởi phát cấp tính của thiếu oxy với các thâm nhiễm 2 bên trên X quang phổi (Hình 1), không có bằng chứng lâm sàng về cao áp nhĩ trái (hoặc áp lực động mạch phổi bít ≤ 18 mm Hg khi đo). Mức độ giảm oxy máu được đánh giá bởi tỉ lệ PaO2/FIO2. Đối với chẩn đoán ARDS, tỷ lệ PaO2/FIO2 phải ≤ 200 mmHg. Một tổn thương phổi thực thể bao quát toàn thân cũng được đưa ra, sử dụng các tiêu chuẩn tương tự nhưng có ngưỡng thiếu oxy máu ít nghiêm trọng hơn (PaO2/FIO2 ≤ 300 mm Hg). Mặc dù việc sử dụng rộng rãi một định nghĩa đơn giản đã giúp thúc đẩy lĩnh vực này bằng cách tạo điều kiện thuận lợi cho việc so sánh giữa các nghiên cứu khác nhau, một số hạn chế của định nghĩa AECC đã xuất hiện. Bao gồm việc thiếu các tiêu chuẩn rõ ràng về thời điểm khởi phát liên quan đến thương tích hoặc bệnh tật gây ra ARDS, việc sử dụng tỷ lệ PaO2/FIO2 để xác định ARDS nhưng không có đặc điểm cụ thể của việc đo lường này được so sánh với việc sử dụng các cài đặt máy thở nhất định (PEEP có thể làm tăng tỉ lệ PaO2/FIO2), độ tin cậy kém của tiêu chuẩn X quang phổi, và những khó khăn là loại trừ quá tải thể tích hoặc suy tim xung huyết là nguyên nhân chính gây ra suy hô hấp (Bảng 1).[8]
Định nghĩa Berlin của ARDS
Với những hạn chế của định nghĩa AECC, Hiệp hội Y học Chăm sóc Chuyên sâu Châu Âu (ESICM, European Society of Intensive Care Medicine) đã triệu tập một ban chuyên gia quốc tế để sửa đổi định nghĩa ARDS. Định nghĩa Berlin kết quả của ARDS cũng được xác nhận bởi Hiệp hội Lồng ngực Hoa Kỳ (ATS, American Thoracic Society) và Hiệp hội Y tế Chăm sóc Trọng tâm (SCCM, Society of Critical Care Medicine).[10]
Để dễ dàng ước lượng tiên lượng ARDS, định nghĩa Berlin phân loại mức độ nghiêm trọng của ARDS thành 3 loại: nhẹ (200 mm Hg < PaO2/FIO2 ≤ 300 mm Hg), vừa phải (100 mm Hg < PaO2/FIO2 ≤ 200 mm Hg), và nặng (PaO2/FIO2 ≤ 100 mm Hg) (Bảng 1). Các phân nhóm này đã được xác nhận trong phân tích gộp trên bệnh nhân 4188 bệnh nhân ARDS có tỷ lệ tử vong ở bệnh viện là 27% (95% CI, 24% -30%) đối với ARDS nhẹ, 32% (95% CI, 29% -34 %) đối với ARDS vừa phải và 45% (95% CI, 42% -48%) đối với ARDS nặng. Trong số những người sống sót, ARDS nhẹ kết hợp với 5 ngày (khoảng interquartile [IQR], 2-11]) thông khí cơ học, ARDS vừa phải với 7 ngày (IQR, 4-14) và ARDS nặng với 9 ngày (IQR, 5- 17).[10]
Các khu vực không chắc chắn
Mặc dù định nghĩa Berlin đã vượt qua được một số hạn chế của AECC trong việc xác định ARDS, 4 đặc điểm lâm sàng chính cần thiết để chẩn đoán ARDS (thời điểm suy hô hấp liên quan đến sự kiện khởi phát, nguồn không do áp lực thủy tĩnh của phù phổi, các dấu hiệu X quang phổi, và mức độ thiếu oxy máu) tương tự trong tiêu chí AECC và Berlin. Xác định nguyên nhân gây phù phổi và giải thích phim X quang ngực cần thiết để thực hiện các tiêu chuẩn chẩn đoán ARDS là 2 lĩnh vực mà việc giải thích lâm sàng có thể dẫn tới việc không nhận ra ARDS khi nó xuất hiện, dẫn đến việc điều trị bệnh này.[3] Định nghĩa Berlin của ARDS cung cấp một định nghĩa rõ ràng hơn về tiêu chuẩn chụp X quang ngực đối với những vùng thâm nhiễm 2 bên bằng cách chỉ ra rằng chúng phù hợp với phù phổi không giải thích đầy đủ bởi sự tràn dịch, xẹp phổi thùy hay xẹp phổi, hạch hoặc khối u (hình 1). Một tập hợp các chụp X quang phổi đã được đưa vào để minh họa các kết luận có thể nhất quán, không nhất quán hoặc không chính xác cho chẩn đoán ARDS.8 Mặc dù định nghĩa chính xác hơn về những phát hiện X quang mà nên được sử dụng để chẩn đoán ARDS và làm tiêu chẩn của hình ảnh X quang, độ tin cậy của tiêu chuẩn X quang ngực vẫn còn dưới mức tối ưu và không cải thiện được việc đào tạo hoặc giáo dục.[11] Các sửa đổi trong tương lai đối với định nghĩa của ARDS phải xem xét là liệu các thâm nhiễm 2 bên nên vẫn là một thành phần thiết yếu của định nghĩa của hội chứng này (nghĩa là liệu chúng có liên quan đến cơ chế bệnh lý cho sự phát triển của ARDS hoặc đáp ứng với điều trị cụ thể). Nếu không, cần xem xét loại bỏ các tiêu chí này khỏi các định nghĩa ARDS trong tương lai hoặc thay thế nó bằng các phương thức khác (ví dụ, chụp cắt lớp vi tính, siêu âm phổi) nếu chúng được chứng minh là đáng tin cậy hơn trong các nghiên cứu trong tương lai.
Điều thú vị là sự bao gồm các phép đo sinh lý bổ sung mà trước đây có liên quan đến mức độ nghiêm trọng của ARDS và các kết cục tồi tệ hơn (tức là độ giãn nở của hệ thống hô hấp ≤ 40 mL/cm H2O và thông khí phút điều chỉnh ≥ 10 L/phút) không góp phần vào tính hiệu lực dự báo của ARDS nghiêm trọng. Nếu một công cụ đánh giá sinh học làm tăng độ nhạy và độ đặc hiệu để chẩn đoán ARDS hoặc phân loại mức độ nghiêm trọng của nó có thể được xác định, nó sẽ rất hữu ích.[12] Mặc dù là một lĩnh vực nghiên cứu rất tích cực, cho đến nay, không có biomarkers nào đủ thông tin để đưa chúng vào một định nghĩa ARDS. Cần phải có thêm các phương pháp trực tiếp và khả thi để đo tính thấm mạch máu phổi và nước ngoài mạch máu phổi.
Các nghiên cứu lớn và tiến bộ về điều trị
Có tương đối ít phương pháp điều trị dùng được cho ARDS. Xử trí quan trọng là thông khí cơ học, với mục đích giảm thiểu tổn thương phổi do thở máy gây ra (VILI).[13] VILI là một dạng tổn thương phổi thứ phát do thầy thuốc (iatrogenic), có thể làm tăng phản ứng viêm hệ thống, góp phần vào sự phát triển của suy đa tạng và tử vong. Một thuật toán điều trị mẫu cho ARDS bắt đầu với việc tối ưu hóa thông khí bảo vệ phổi và tiến hành thông qua các can thiệp ngày càng xâm lấn dựa trên các mục tiêu sinh lý cho trao đổi khí (Hình 2). Những can thiệp bổ sung có thể khác nhau tùy thuộc vào từng bệnh nhân, nguyên nhân kích động và các biện pháp can thiệp có sẵn tại cơ sở điều trị.[16] Những cải tiến gần đây về liệu pháp tiềm năng cho ARDS được xem xét ngắn gọn trong Bảng 2. Bao gồm việc sử dụng loại bỏ carbon dioxide ngoài cơ thể (ECCO2R), tư thế nằm sấp, statin, thông khí rung tần số cao (HFOV), và các thủ thuật huy động phổi.
Dự phòng
Với tình trạng bệnh tật và tử vong đáng kể liên quan đến ARDS, dự phòng là rất quan trọng. Tiểu cầu có thể góp phần vào việc phát triển và giải quyết các tổn thương phổi, làm cho chúng trở thành một mục tiêu điều trị tiềm ẩn.[29] Hỗ trợ giả thuyết này là dữ liệu quan sát cho thấy liệu pháp chống kết tập tiểu cầu với aspirin có thể ngăn ngừa ARDS ở những bệnh nhân có nguy cơ cao.[30] Để đánh giá tính an toàn và hiệu quả của aspirin để phòng ARDS, một RCT đa trung tâm được thực hiện ở những bệnh nhân có nguy cơ cao về ARDS (điểm dự đoán thương tích phổi ≥431).[17] Các bệnh nhân đủ điều kiện được chọn ngẫu nhiên theo liều nạp (325 mg), tiếp theo là 81 mg mỗi ngày aspirin hoặc giả dược trong vòng 24 giờ sau khi nhập khoa cấp cứu và tiếp tục cho đến khi nằm bệnh viện ngày 7, xuất viện hoặc tử vong. Không có sự khác biệt có ý nghĩa giữa các nhóm trong kết cục chính của tỉ lệ ARDS (tỷ số chênh [OR], 1,24 [95% CI, 0,67-2,31]. Không có sự khác biệt đáng kể về kết cục thứ phát: ngày không thở máy (VFDs), thời gian nằm viện, sống sót 28 ngày, và sống sót 1 năm) hoặc các tác dụng ngoại ý. Những phát hiện này không hỗ trợ việc sử dụng aspirin ở những bệnh nhân có nguy cơ cao.
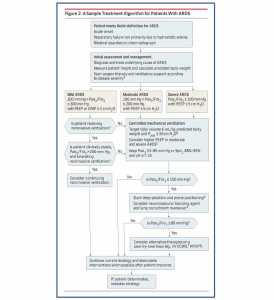
Các điều trị bổ sung
VILI có thể tiến triển mặc dù sử dụng thông khí bảo vệ phổi.[32,33] Giảm thể tích khí lưu thông có thể gây ra VILI ít hơn, kết quả bệnh nhân tốt hơn.[34] Chiến lược này có thể bị giới hạn bởi tăng CO2 và tình trạng toan hô hấp. Việc loại bỏ carbon dioxide bên ngoài (ECCO2R) mất đi CO2 trong máu thông qua một thiết bị trao đổi khí ngoài cơ thể.[35] Do đó, phổi ít phải thải CO2 hơn, nên giảm được cường độ hỗ trợ hô hấp (ví dụ: thể tích khí lưu thông thấp) tạo điều kiện cho ứng dụng thông khí siêu bảo vệ – ultraprotective ventilation (tức là bất kỳ hình thức thông khí thể tích thấp hoặc áp suất thấp nào vượt quá tiêu chuẩn chăm sóc hiện tại). Cách tiếp cận này đã được thử nghiệm trong một RCT nhỏ ECCO2R với thể tích khí lưu thông 3 mL/kg trọng lượng cơ thể dự đoán (PBW) so với một thể tích khí lưu thông bình thường 6 mL/kg PBW.[18] Không có sự khác biệt đáng kể trong kết quả chính của nghiên cứu: số ngày không thở máy (VFD) đến ngày 28 hoặc ngày 60 so sánh giữa các nhóm. Một phân tích post hoc analysis ở bệnh nhân có tỷ số PaO2/FIO2 là 150 mmHg hoặc thấp hơn cho thấy VFD lớn hơn đáng kể đến ngày 28 và ngày 60 ở nhóm ECCO2R so với nhóm chứng (ngày 28: 11.3 ở nhóm ECCO2R vs 5,0 ở nhóm đối chứng, P = 0,03, ngày 60: 40,9 ở nhóm ECCO2R vs 28,2 ở nhóm đối chứng, P = 0,03). Kết quả này tạo ra giả thuyết và ECCO2R vẫn là một liệu pháp thử nghiệm, được hỗ trợ bởi kết quả của một tổng kết hệ thống.[36] Nhiều dữ liệu có sẵn từ 2 thử nghiệm đang thực hiện – Strategy of Ultraprotective Lung Ventilation with Extracorporeal CO2 Removal for New-Onset Moderate to Severe ARDS (SUPERNOVA) và Protective Ventilation With Veno-Venous Lung Assist in Respiratory Failure (REST). Vì ECCO2R tương đối xâm lấn, một câu hỏi quan trọng là làm thế nào để xác định những bệnh nhân có nhiều khả năng được hưởng lợi từ liệu pháp này. Một phân tích sinh lý gần đây cho thấy phương pháp tiếp cận y học chính xác sử dụng các phép đo khoảng chết phổi và độ giãn nở của hệ thống hô hấp của bệnh nhân (tính bằng Crs = Vt/(Pplat – PEEP), trong đó Pplat là áp lực đo được sau khi tạm dừng 0,5 giây đầu cuối thì hít vào khi không có lưu lượng và Vt cài đặt) có thể giúp dự đoán những bệnh nhân ARDS có nhiều khả năng sẽ được hưởng lợi từ điều trị ECCO2R.[37]
VILI cũng có thể được giảm bằng cách đặt bệnh nhân ở tư thế nằm sấp. Tư thế nằm sấp tạo điều kiện cho thông khí phổi đồng nhất hơn, dẫn đến sự phân bố đều lực cơ học trong vùng phổi bị thương.[38] Một loạt các thử nghiệm lâm sàng ngày càng được cải tiến (tức là, lần lượt nhắm mục tiêu những bệnh nhân ARDS nặng hơn và sử dụng thời gian dài hơn ở tư thế nằm sấp) 20 năm gần đây[39] đã có một RCT trung tâm lớn cho thấy việc đặt các bệnh nhân ARDS có tỷ lệ PaO2/FIO2 ≤ 150 mmHg ở tư thế nằm sấp ít nhất 16 giờ/ngày làm giảm đáng kể tỷ lệ tử vong 90 ngày (hazard ratio [HR], 0.44 [95% CI, 0.29-0.67]).[19] Không có sự khác biệt về tác dụng phụ giữa các nhóm, ngoại trừ một số lượng lớn bị ngưng tim trong nhóm nằm ngữa (31 ở nhóm nằm ngữa và 16 ở nhóm nằm sấp, P = .02). Các trung tâm tham gia vào RCT này có nhiều kinh nghiệm với tư thế nằm sấp, cho thấy rằng các cơ sở mong muốn thực hiện phương pháp này nên phát triển chuyên môn với tư thế nằm sấp nếu họ mong đợi có kết quả tương tự với kết quả được quan sát thấy trong RCT.[40,41]
Các điều trị bằng thuốc
Ngập phế nang và tạo thành phù phổi là những thay đổi sinh lý quan trọng ở bệnh nhân ARDS. Dữ liệu thực nghiệm cho thấy các thuốc chủ vận β2 có thể làm tăng vận chuyển natri bằng cách kích hoạt thụ thể β2 trên các tế bào phế nang loại I và tế bào loại II, tăng tốc độ hồi phục phù phổi.[42] Giả thuyết này đã được thử nghiệm trong một nghiên cứu RCT đơn trung tâm, cho thấy rằng 7 ngày truyền salbutamol làm giảm đáng kể lượng nước ngoài mạch máu phổi.[43] Một RCT đa trung tâm dùng salbutamol đường tĩnh mạch 7 ngày đã được ngừng nghiên cứu sớm do tăng tỷ lệ tử vong 28 ngày ở nhóm salbutamol (tỷ số nguy cơ [RR], 1,47 [95% CI, 1,03 đến 2,08).[20] Sự thiếu hiệu quả này phù hợp với 2 RCTs khác sử dụng salbutamol hít ở một nhóm bệnh nhân ARDS (sai biệt trung bình trong VFD đến ngày 28, -2,2 ngày [95% CI, -4,7 đến 0,3]) [44] và nhóm khác ở bệnh nhân sau phẫu thuật để ngăn ngừa sự phát triển của ARDS (OR, 1,25 [95% CI, 0,71 đến 2,22]).[45]
Bởi vì tổn thương biểu mô phế nang là một nguyên nhân quan trọng của ARDS, việc tăng tốc sửa chữa biểu mô phế nang có thể tạo điều kiện giải quyết phù phổi và tổn thương phổi.46 Yếu tố tăng trưởng keratinocyte (KGF) rất quan trọng trong việc sửa chữa biểu mô phế nang và các nghiên cứu thực nghiệm và trên con người [47] hỗ trợ khái niệm rằng KGF có thể có lợi ở bệnh nhân ARDS. Trong giai đoạn 2 RCT, không có sự khác biệt đáng kể về chỉ số oxy hóa trung bình ở ngày thứ 7 (khác biệt trung bình, 19.2 [95% CI, -5,6 đến 44,0]) ở bệnh nhân được phân lập ngẫu nhiên với KGF tái tổ hợp hoặc placebo trong 6 ngày.[21] Tuy nhiên, có bằng chứng nguy hại từ KGF, với những bệnh nhân nhóm KGF có ít hơn ngày không thở máy VFD, thời gian thở máy dài hơn, và tử vong 28 ngày cao hơn.
Viêm là một dấu hiệu bệnh lý của ARDS, và có thể góp phần làm suy cơ quan phổi và suy cơ quan ngoài phổi. Statins có thể làm giảm viêm và sự tiến triển của tổn thương phổi trong các mô hình thực nghiệm [48,49] và được chứng minh là an toàn và giảm rối loạn chức năng của cơ quan ngoài phổi trong giai đoạn 2 RCT.[50] Hai RCTs đa trung tâm lớn được tiến hành để kiểm tra tác dụng của statin ở bệnh nhân ARDS. Trong nghiên cứu Statins for Acutely Injured Lungs from Sepsis (SAILS), tỷ lệ tử vong trong bệnh viện trong 60 ngày (rosuvastatin so với giả dược) là 28,5% đối với rosuvastatin so với 24,9% đối với giả dược, P = .21) hoặc thời gian không thở máy đến ngày 28 (15.1 ngày đối với rosuvastatin và 15.1 ngày đối với giả dược, P = .96).[22] Trong nghiên cứu Hydroxymethylglutaryl-CoA Reductase Inhibition with Simvastatin in Acute Lung Injury to Reduce Pulmonary Dysfunction-2 (HARP-2) không có ý nghĩa (simvastatin so với giả dược) trong VFDs đến ngày 28 (12,6 ngày đối với simvastatin so với 11,5 ngày đối với giả dược, P = .21), ngày không suy cơ quan không phải phổi (19,4 ngày đối với simvastatin so với 17,8 ngày đối với giả dược, P = 0,11 ), hoặc tử vong 28 ngày (22.0% đối với simvastatin so với 26.8% đối với giả dược, P = .23).[23]
Mặc dù cơ sở lý tính sinh lý và dữ liệu tiên lượng mạnh mẽ, hiện nay không có vai trò nào đối với các thuốc chủ vận β2, KGF, và statin trong việc xử trí thường quy bệnh nhân ARDS.
Chiến lược thông khí
Mục đích của thở máy ở bệnh nhân ARDS là để nghỉ ngơi các cơ hô hấp, và duy trì trao đổi khí đầy đủ, đồng thời giảm thiểu những ảnh hưởng có hại của VILI (Bảng 3). Các chiến lược để đạt được các mục tiêu này đã tập trung vào việc hạn chế áp lực căng (stress) trong chu kỳ hô hấp (volutrauma) và việc huy động phổi theo chu kỳ tại giao diện giữa các vùng phổi bị xẹp và vùng phổi thông khí (atelectrauma).[13] Sau này dựa trên “giả thuyết phổi mở”, tập trung vào việc huy động vùng phổi bị xẹp và giữ chúng mở trong suốt chu trình thông khí.51 Hai chiến lược để đạt được những mục tiêu này là chủ đề của các RCTs gần đây: HFOV và các thủ thuật huy động phổi.

Về mặt lý thuyết, HFOV đại diện cho một chiến lược bảo vệ phổi lý tưởng, cung cấp thể tích khí lưu thông rất nhỏ (giới hạn volutrauma) xung quanh áp lực đường thở trung bình tương đối cao (hạn chế atelectrauma).[21] Một số lượng lớn các bằng chứng thực nghiệm và lâm sàng hỗ trợ những lợi ích tiềm năng của HFOV trong ARDS.[52,53] Hai thử nghiệm RCT đa trung tâm lớn được thực hiện để đánh giá hiệu quả của HFOV ở những bệnh nhân ARDS vừa và nặng. Nghiên cứu Oscillation in ARDS (OSCAR) đã phân ngẫu nhiên các bệnh nhân vào nhóm HFOV hoặc thở máy thông thường, với các mục tiêu sinh lý cơ bản.[24] Không có sự khác biệt đáng kể trong kết cục chính của tử vong 30 ngày (41.7 đối với HFOV so với 41.1% đối với thở máy thông thường; p = 0,85). Trong thử nghiệm Oscillation for Acute Respiratory Distress Syndrome Treated Early (OSCILLATE), các bệnh nhân được phân ngẫu nhiên thành HFOV hoặc thông khí thông thường sử dụng PEEP tương đối cao.[25] Thử nghiệm đã được dừng lại sớm vì lý do an toàn sau khi ghi nhận 548 trong số 1200 bệnh nhân được lên kế hoạch. Tỷ lệ tử vong trong bệnh viện cao hơn đáng kể ở nhóm HFOV (RR, 1,33 [95% CI, 1,09-1,64]). Tỷ lệ tử vong tăng lên trong nhóm HFOV có thể là do các hậu quả huyết động âm tính (chứng minh bằng việc sử dụng nhiều thuốc vận mạch trong nhóm này) do áp lực đường thở trung bình cao hơn. Đây là một lời nhắc nhở về tầm quan trọng của sinh lý tổng hợp trong việc chăm sóc bệnh nhân ARDS. Các chiến lược thông khí nên tập trung vào việc giảm thiểu VILI, nhưng các chiến lược này phải xem xét quan điểm rộng hơn của tương tác tim phổi (xem ảnh hưởng của thông khí trên chức năng thất phải).54,55 Nói chung, các thử nghiệm này không hỗ trợ việc sử dụng HFOV thường quy ở bệnh nhân ARDS. Tuy nhiên, phân tích tổng hợp dữ liệu cá nhân cho thấy HFOV có thể cải thiện sự sống còn ở những bệnh nhân bị thiếu oxy máu rất nghiêm trọng trong quá trình thông khí cơ học thông thường (ví dụ PaO2/FiO2 < 64 mm Hg).[15]
Thủ thuật huy động phế nang là can thiệp làm tăng áp lực đường thở để mở các đơn vị phổi bị xẹp. Những thủ thuật này thường liên quan đến việc cải thiện oxy hóa và trong phạm vi áp lực thường được sử dụng trong thực hành lâm sàng, nhìn chung được dung nạp tốt.[56] Mở phổi với thủ thuật huy động phế nang tiếp theo là một thử nghiệm giảm PEEP để xác định PEEP ít nhất cần thiết để duy trì phổi mở đã được đề xuất như là một cách tối ưu để đặt PEEP ở bệnh nhân ARDS.[51,57] Trong một RCT thí điểm đa trung tâm, bệnh nhân ARDS trung bình hoặc nặng kéo dài với các cài đặt thông khí chuẩn hóa (FiO2 ≥ 0,5 và PEEP ≥ 10 cm H2O) ở 12 đến 36 giờ sau khi khởi phát ARDS được phân ngẫu nhiên theo phương pháp phổi mở (thủ thuật huy động phổi tiếp theo là một thử nghiệm giảm PEEP) hoặc nhóm thông khí thể tích khí lưu thông thấp thông thường, chiến lược PEEP tiêu chuẩn.[26] Không có sự khác biệt đáng kể giữa các nhóm trong kết quả chính của tử vong ngày 60 (29% đối với phương pháp phổi mở và 33% đối với chiến lược PEEP tiêu chuẩn, P = .18), hoặc các kết cục thứ phát: tử vong do ICU (25% đối với phổi mở so với 30% đối với chiến lược PEEP tiêu chuẩn; P = .53) hoặc VFD cho đến ngày 28 (8 ngày đối với phương pháp phổi mở và 7 ngày đối với chiến lược PEEP tiêu chuẩn, P = .53). Áp suất đẩy (tính bằng Pplat – PEEP) và oxy hoá cải thiện đáng kể ở nhóm tiếp cận phổi mở ở 24, 48, và 72 giờ. Không có sự khác biệt đáng kể trong tỷ lệ barotrauma giữa các nhóm. Các kết quả này phần lớn phù hợp với báo cáo phân tích gộp gần đây trên 10 thử nghiệm (1658 bệnh nhân), trong đó chiến lược thông khí bao gồm thủ thuật mở phổi làm giảm tử vong của ICU mà không làm tăng nguy cơ barotrauma nhưng không cải thiện tử vong trong 28 ngày và tử vong bệnh viện.[58]
Hiệu quả tiềm ẩn của chiến lược phổi mở được đánh giá trong nghiên cứu được hoàn thành mới đây Alveolar Recruitment for Acute Respiratory Distress Syndrome Trial (ART), trong đó bệnh nhân ARDS vừa hoặc nặng ngẫu nhiên được chọn vào chiến lược thực nghiệm huy động phổi và phương pháp điều chỉnh PEEP theo độ giãn nở hệ hô hấp tốt nhất so với nhóm chiến lược cài đặt PEEP thấp.[27] Có sự gia tăng đáng kể về tử vong 28 ngày với chiến lược thực nghiệm (HR, 1,20 [95% CI, 1,01 đến 1,42]). Hơn nữa, chiến lược thực nghiệm tăng tỷ lệ tử vong trong 6 tháng (HR, 1,18 [95% CI, 1,01 đến 1,38]), làm giảm số lượng VFDs (sai khác trung bình, -1,1 ngày [95% CI, -2,1 đến -0,1]), làm tăng nguy cơ barotrauma (khác biệt, 4,0% [95% CI, 1,5% -6,5%]). Không có sự khác biệt đáng kể về thời gian nằm ICU hoặc thời gian nằm bệnh viện, hoặc tử vong ICU hoặc tử vong trong bệnh viện. Cơ chế dẫn đến những kết quả tiêu cực này không được biết, nhưng có thể liên quan đến hậu quả sinh lý tiêu cực tương đối tinh tế của chiến lược này, có thể đã vô tình dẫn đến tăng VILI. Các bệnh nhân trong nhóm thử nghiệm có nhiều khả năng phát triển một dạng mất đồng bộ bệnh nhân- máy thở được gọi là “breath stacking”, trong đó máy thở cung cấp một nhịp thở thứ hai trước khi thở ra hoàn toàn của nhịp thở thứ nhất. Không cần để ý đến cơ chế chính xác, các kết quả này cho thấy chi phí của phương pháp mở phổi sử dụng chiến lược thông khí áp dụng trong ART cao hơn lợi ích tiềm tàng ở bệnh nhân không được chọn trong ARDS.
Ngoài việc giảm nhẹ VILI ở bệnh nhân ARDS, tránh đặt ống nội khí quản có thể ngăn ngừa các biến chứng liên quan đến máy thở (ví dụ viêm phổi do thở máy), mê sảng và cần thiết dùng thuốc an thần, trong khi có khả năng cho phép bệnh nhân tiếp xúc bằng lời nói và duy trì ăn uống. Thông khí không xâm lấn có thể được xem xét ở những bệnh nhân ARDS và thiếu oxy máu ít nghiêm trọng, nhưng thường không được sử dụng.[59] Cũng như ở những bệnh nhân thông khí xâm nhập, PEEP có thể cần đến liều cao hơn tùy thuộc vào mức độ thiếu oxy máu; tuy nhiên, PEEP cao hơn được áp dụng với giao diện mặt nạ (face mask) có thể liên quan đến sự gia tăng rò rỉ khí, dẫn đến việc cung cấp PEEP không hiệu quả và sự thất bại thông khí không xâm lấn.[60] Một cách khác là sử dụng helmet interface (một loại giao diện toàn bộ đầu bệnh nhân), có thể làm giảm rò rỉ không khí và cho phép PEEP cao với độ dung nạp của bệnh nhân cao hơn. Trong một nghiên cứu RCT đơn lẻ, bệnh nhân ARDS đã nhận được thông khí không xâm nhập qua face mask trong ít nhất 8 giờ được chọn ngẫu nhiên để thở không xâm nhập qua helmet hoặc tiếp tục với face mask.[28] Thử nghiệm đã được dừng lại sớm do có hiệu quả sau 83 trong tổng số 206 bệnh nhân đã được ghi danh. Các bệnh nhân trong nhóm thở không xâm lấn qua helmet có kết cục chính là tỷ lệ đặt nội khí quản thấp hơn đáng kể (khác biệt tuyệt đối, -43,3% [95% CI, -62,4% đến -24,3%]). Kết quả phụ, VFD đến 28 ngày (28 ngày đối với helmet so với 12,5 ngày đối với face mask, P <0,001) và tử vong 90 ngày (khác biệt tuyệt đối, -22,3% [95% CI, -43,3% 1,4%) cũng tốt hơn đáng kể trong nhóm helmet. Không có sự khác biệt đáng kể về các tác dụng ngoại ý giữa các nhóm. Những kết quả đầy hứa hẹn này đòi hỏi phải xác nhận trong một RCT lớn, đa trung tâm, đặc biệt là vì sử dụng thông khí không xâm lấn ở bệnh nhân ARDS và tỷ lệ PaO2/FiO2 dưới 150 mmHg có liên quan đến tỷ lệ tử vong tăng lên.[59]
Clinical Guidelines
ATS, ESICM và SCCM gần đây đã thông báo về hướng dẫn thực tiễn lâm sàng về thở máy ở bệnh nhân ARDS người lớn (Bảng 4).[14] Hướng dẫn cung cấp các khuyến cáo về 6 can thiệp có thể bao gồm các khuyến cáo mạnh về thông khí giới hạn thể tích và thông khí giới hạn áp lực, và tư thế nằm sấp trên 12 giờ/ngày ở bệnh nhân ARDS nặng, khuyến cáo mạnh chống lại việc sử dụng thường quy HFOV; khuyến cáo có điều kiện về thủ thuật huy động phổi và chiến lược sử dụng PEEP cao trong ARDS vừa đến nặng; và dữ liệu chưa đầy đủ để khuyến cáo dùng ECMO TM-TM cho bệnh nhân ARDS nặng.[67] Ghi chú, các khuyến cáo này thông báo trước khi có kết quả nghiên cứu ART cho thấy kết cục âm tính cho chiến lược phổi mở, đòi hỏi khuyến cáo có điều kiện cho thủ thuật mở phổi cần được xem xét lại.
Phù hợp với điều kiện y tế khác biệt nhau, khuyến cáo dực trên y học chứng cớ trên thực tế là dưới mức tối ưu.[3] Chẳng hạn, hơn một phần ba bệnh nhân ARDS không được thông khí bảo vệ phổi có giới hạn áp lực và giới hạn thể tích, một can thiệp đã được chứng minh gần hai thập kỷ trước để giảm tỷ lệ tử vong tuyệt đối gần 9%.[68] Các chiến lược nhằm tăng cường việc thực hiện những khuyến cáo lâm sàng có thể chuyển thành cải thiện đáng kể trong kết cục của bệnh nhân.

Các khu vực không chắc chắn
Các phương pháp mới để giảm thiểu VILI cần được nghiên cứu sâu hơn trước khi áp dụng rộng rãi (Bảng 3). Mặc dù chưa có bằng chứng rõ ràng về lợi ích,[66] nhưng việc sử dụng oxy hóa qua màng ngoài cơ thể ở bệnh nhân ARDS đã tăng đáng kể kể từ khi xảy ra đại dịch cúm A (H1N1) 2009.70,71 Một RCT quốc tế, đa trung tâm áp dụng ECMO ở bệnh nhân ARDS nặng (Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome [EOLIA]) gần đây đã được hoàn thành nhưng chưa được công bố; các kết quả có thể giúp làm rõ vai trò của oxy hóa màng ngoài cơ thể TM-TM trong việc xử trí ARDS.
Áp suất đẩy (driving pressure) được định nghĩa là Pplat – PEEP và cũng bằng Vt/Crs. Một phân tích sau bài học gần đây cho thấy áp suất đẩy có thể quan trọng hơn các thông số khác (ví dụ như thể tích khí lưu thông hoặc áp lực bình nguyên) trong việc xác định kết quả ở bệnh nhân ARDS,[72] và phân tích gộp tiếp theo đã xác nhận mối liên quan giữa áp lực đẩy cao hơn và tăng tỷ lệ tử vong. Lý do sinh lý cho sự kết hợp này là hấp dẫn, vì bình thường hóa thể tích khí lưu thông theo Crs có tính đến tỷ lệ thể tích phổi giảm xuống (ví dụ thể tích của “phổi trẻ em”), chứ không phải là thể tích phổi thông thường theo cân nặng dự đoán. Tuy nhiên, những kết quả này là giả thuyết tạo ra và dữ liệu sẵn có hiện nay không hỗ trợ sử dụng các chiến lược thông khí đặc biệt nhắm đến áp lực đẩy ở bệnh nhân ARDS. Các nghiên cứu trong tương lai cần phải giải quyết vấn đề an toàn và tính khả thi của một phương pháp dựa trên áp lực đẩy, cũng như các thử nghiệm lâm sàng chứng minh hiệu quả của chiến lược như vậy đối với các giao thức thông khí bảo vệ phổi hiện tại.[74]
Ngày càng có nhiều người quan tâm đến việc sử dụng thở oxygen lưu lượng cao qua cannula mũi (high-flow nasal cannula, HFNC) ở những bệnh nhân suy hô hấp giảm oxy máu cấp, nhưng không có RCT nào đánh giá việc sử dụng nó đặc biệt ở những bệnh nhân ARDS.[76] Cần phải thử nghiệm lâm sàng về mô hình để làm rõ vai trò tiềm tàng của nó trong ARDS.
Ngộ độc Oxy là một hình thức tổn thương do sử dụng FiO2 cao mà gần đây đã nhận được sự chú ý mới. Mục tiêu tối ưu cho việc oxy hóa ở bệnh nhân ARDS vẫn còn chưa rõ ràng, chỉ bằng các bằng chứng chất lượng thấp và ý kiến chuyên gia trong một hướng dẫn gần đây về việc sử dụng oxy.[77] Một RCT đơn trung tâm gợi ý một lợi ích về tử vong cho các bệnh nhân ngẫu nhiên được điều trị bằng oxy bảo tồn (PaO2 70 -100 mm Hg hoặc SpO2 94% -98%) so với liệu pháp thông thường (PaO2 lên đến 150 mm Hg hoặc SpO2 97% -100%).[78]
Nhiều loại thuốc đã hứa hẹn với ARDS đang được đánh giá. Một RCT đơn giản đã chứng minh được lợi ích về tử vong ở bệnh nhân ARDS có tỷ lệ PaO2/FiO2 dưới 150 mmHg với việc sử dụng sớm cisatracurium trong 48 giờ + thuốc an thần sâu so với chỉ có thuốc an thần sâu đơn thuần.[79] Cơ chế chính xác mà sự phong tỏa thần kinh cơ tạo ra lợi ích cho bệnh nhân ARDS là không rõ ràng.[80] Tuy nhiên, việc dùng thuốc phong tỏa thần kinh cơ sẽ hạn chế sự xuất hiện của các hiện tượng có thể gây thương tích trong quá trình thông khí cơ học bao gồm sự kích hoạt đảo ngược – reverse triggering (tức là kích hoạt từ các cơn co cơ ở cơ hoành gây ra bởi thở máy thở kiểm soát),[81] pendelluft phổi không phụ thuộc vào các vùng phụ thuộc mà không có sự thay đổi về thể tích khí lưu thông),[82] và sự không đồng bộ của máy thở bệnh nhân (ví dụ, trong đó các nỗ lực thở của bệnh nhân không đồng bộ với nhịp thở máy). Không đồng bộ có thể dẫn đến breath stacking, như được mô tả ở trên cho nghiên cứu ART.[83]
Vì liều điều trị, thời gian và giám sát tối ưu là không chắc chắn,[32] một RCT lớn, đa trung tâm hiện đang được tiến hành so sánh việc dùng phong tỏa thần kinh cơ cộng với an thần sâu so với dùng thuốc an thần nhẹ hơn và không dùng phong tỏa thần kinh cơ (Reevaluation of Systemic Early Neuromuscular Blockade [ROSE] trial).[84] Một cơ chế có khả năng ngăn chặn thần kinh cơ có thể gây ra những lợi ích của nó là bằng cách ngăn ngừa tự phát thở ở những bệnh nhân ARDS vừa và nặng. Khi nào và bao nhiêu để cho phép thở tự phát ở bệnh nhân ARDS vẫn không chắc chắn và là một thách thức quan trọng đối với các bác sĩ lâm sàng, cân nhắc cân bằng các nguy cơ tiềm ẩn (ví dụ như chấn thương phổi tự gây ra do bệnh nhân – patient self-inflicted lung injury)85 và lợi ích (ví dụ, giảm an thần, giảm nguy cơ mê sảng, rối loạn chức năng cơ hoành do thở máy, yếu cơ liên quan ICU).[86]
Bàn luận
ARDS không phải là bệnh; nó là một hội chứng được xác định bởi một nhóm các tiêu chuẩn lâm sàng và sinh lý học. Như vậy, có lẽ không có gì đáng ngạc nhiên khi các liệu pháp duy nhất cho thấy hiệu quả là các chiến lược thông khí bảo vệ phổi dựa trên các nguyên lý sinh lý cơ bản. Đánh giá quan trọng các nguyên tắc này rất quan trọng trong việc chăm sóc cho tất cả các bệnh nhân ARDS, trong việc thiết kế các thử nghiệm lâm sàng cho ARDS và có thể hữu ích trong việc áp dụng phương pháp tiếp cận y học chính xác để xác định bệnh nhân nào có nhiều khả năng được hưởng lợi từ một liệu pháp nhất định.[37,87] Bệnh nhân được chẩn đoán ARDS có các yếu tố nguy cơ tiềm ẩn khác nhau, các tiền sử bệnh tật và bệnh đi kèm phức tạp khác nhau, và có thể có các quá trình bệnh lý sinh lý khác nhau.[88,89] Tầm quan trọng của việc xem xét sự không đồng nhất của các hiệu quả điều trị, có thể được thông báo bằng các mô hình phụ sinh học, cũng có thể để đảm bảo rằng những phương pháp điều trị hiệu quả không bị loại bỏ.[90]
Các giới hạn
Đánh giá này có một số hạn chế. Thứ nhất, chúng tôi đã hạn chế tìm kiếm tài liệu của chúng tôi cho 5 năm qua các bài viết được xuất bản bằng tiếng Anh. Thứ hai, chúng tôi chỉ đề cập đến chiến lược chẩn đoán và điều trị ở người lớn có ARDS, chứ không phải ở trẻ em. Thứ ba, chúng tôi chỉ đánh giá một số can thiệp hạn chế.
Kết luận
Định nghĩa Berlin về hội chứng suy hô hấp cấp tính (ARDS) đã đề cập đến những hạn chế của Định nghĩa của Hiệp hội Mỹ Châu Âu, nhưng độ tin cậy kém của một số tiêu chí có thể góp phần làm cho các bác sĩ lâm sàng không nhận biết được. Không có phương pháp điều trị bằng thuốc nào nhằm mục đích bệnh lý cơ bản đã được chứng minh là có hiệu quả, và xử trí vẫn là hỗ trợ thông khí cơ học phổi. Các hướng dẫn về thở máy ở bệnh nhân có hội chứng suy hô hấp cấp có thể giúp các bác sĩ lâm sàng trong việc can thiệp dựa vào bằng chứng có thể dẫn đến kết quả cải thiện.





