Tác giả: Bác sĩ Đặng Thanh Tuấn
Thông khí cơ học là một can thiệp hỗ trợ sự sống cho một số lượng đáng kể bệnh nhân trong các ICUs. Các tài liệu nhi khoa hiện nay cho thấy bằng chứng về cai máy thở và rút ống NKQ vẫn còn chưa được xác định. Không có phương pháp cai máy thở tối ưu nào được mô tả cho việc rút NKQ nhanh hơn và thành công. Các phương pháp tiếp cận dựa trên các protocol đối với cai máy thở có thể có ợi ích trong việc thúc đẩy sự sẵn sàng rút NKQ , nhưng không có sự khác biệt đáng kể về kết cục. Phân tích các dấu hiệu lâm sàng của việc rút NKQ đã không cho thấy bất kỳ dự đoán cụ thể nào về sự thành công rút NKQ ở trẻ em. Tuy nhiên, một thử nghiệm hàng ngày về sự sẵn sàng rút ống là kỹ thuật hiệu quả nhất để xác định khả năng thành công. Tỉ lệ thất bại từ 16% đến 20% và ít liên quan đến thời gian thở máy. Tắc nghẽn đường thở trên là nguyên nhân chính dẫn đến sự thất bại trong việc rút NKQ ở hầu hết các nghiên cứu ở trẻ em. Do đó, cần xem xét các biện pháp giảm phù nề đường thở trước khi rút ống. Corticosteroid có vẻ có lợi cho trẻ sơ sinh và trẻ nhỏ, nhưng vẫn chưa có bằng chứng rõ ràng về hiệu quả của nó.
Giới thiệu
Thông khí cơ học (MV) thường được sử dụng để điều trị trẻ em bị bệnh nặng ở ICU trẻ em (PICU) và ICU trẻ sơ sinh (NICU). Thời điểm lý tưởng để ngưng MV thường được xác định bằng các thông số lâm sàng và xét nghiệm [1]. Những phép đo này phải cho thấy trẻ có khả năng thở tự nhiên và trao đổi khí đầy đủ.
Cai máy thở hoặc ngưng thở máy là sự ngừng toàn bộ sự hỗ trợ hô hấp, trong khi rút NKQ là việc rút bỏ ống NKQ (đường thở nhân tạo) [2]. Thời gian lý tưởng để ngưng MV và rút NKQ không nên được xác định bằng dấu hiệu lâm sàng đơn thuần. Quyết định này phụ thuộc vào nhiều yếu tố, như [3,4]: dẫn truyền thần kinh cơ, có thể bị ảnh hưởng bởi thuốc an thần; lực cơ hô hấp, có thể bị ảnh hưởng bởi thời gian MV; độ bền của cơ hô hấp; thay đổi thông khí, như tăng thân nhiệt, cung cấp quá nhiều cacbon hydrate, và tăng khoảng chết sinh lý; và sự thay đổi trong cơ học thông khí, phụ thuộc vào tính đàn hồi của phổi và sức cản đường thở.
Thất bại trong việc cai máy có thể cho thấy sự mất cân bằng giữa gánh nặng đặt lên cơ hô hấp và khả năng chịu đựng của chúng với tải trọng này hoặc cung cấp năng lượng không đáp ứng được nhu cầu của các cơ hô hấp này.
Tỷ lệ thất bại của việc rút NKQ dựa trên các tiêu chuẩn lâm sàng và từ 17% đến 19% ở người lớn [5], từ 22% đến 28% ở trẻ non tháng [6], và từ 16% đến 20% ở trẻ em [7,8] . Việc rút NKQ sớm cho bệnh nhân có thể gây nguy cơ tái đặt NKQ như là một thủ thuật cấp cứu. Tuy nhiên, việc sử dụng MV kéo dài không cần thiết làm tăng nguy cơ chấn thương đường thở, nhiễm khuẩn bệnh viện và khó chịu cho bệnh nhân, cũng như tăng chi phí bệnh viện [3].
Một vài chỉ số đo lường sự oxy hóa, chẳng hạn như áp suất thở ra tối đa (PEmax), chức năng phổi, thông khí phút (VE), đã được gợi ý như là những chỉ số dự đoán hữu ích cho kết cục cai máy và rút NKQ thành công hoặc thất bại ở trẻ sơ sinh và trẻ nhỏ [4,9]. Một số chỉ số thường được sử dụng trong PICUs là tần số thở (RR) chia cho thể tích khí lưu thông (VT) được điều chỉnh theo trọng lượng (chỉ số thở nhanh nông, RSBI), độ giãn nở phổi, tần số thở, oxy hóa, chỉ số áp suất (chỉ số CROP) và thử nghiệm tự thở (SBT) [3,10] Tuy nhiên, các tiêu chuẩn khách quan để dự đoán việc rút NKQ thành công hay thất bại trong nhi khoa đã không được xác định. Những yếu tố dự báo này dường như không đủ nhạy cảm hoặc đặc hiệu để dự đoán rút ống thành công hoặc thất bại trong nhi khoa và sơ sinh. Các nghiên cứu với người lớn [11,12] và trẻ sơ sinh [13] đã sử dụng các chỉ số tổng hợp, chẳng hạn như sự kiểm soát thông khí, tải cơ của hô hấp, sức mạnh cơ hô hấp và chất lượng trao đổi khí.
Định nghĩa
- Cai máy thở (weaning) – chuyển tiếp từ thông khí cơ học đến hỗ trợ hoặc tự thở ở bệnh nhân thở máy xâm nhập trong thời gian dài hơn 24 giờ [14].
- Ngưng máy thở (MV discontinuation) – ngưng hỗ trợ hô hấp ở những bệnh nhân dung nạp thử nghiệm tự thở và có thể đủ điều kiện rút NKQ [3].
- Thử nghiệm thở tự nhiên (Spontaneous breathing trial) – SBT (một phương pháp ngưng thở máy) – bệnh nhân được thở tự nhiên thông qua ống NKQ kết nối với một ống T và một nguồn oxy. Bệnh nhân nhận được áp lực đường thở dương liên tục (CPAP) là 5 cmH2O, hoặc thông khí hỗ trợ áp suất (PSV) là 7 cmH2O [15,16]. Trong nhi khoa, PSV sẽ phụ thuộc vào đường kính ống NKQ.
- Rút NKQ (extubation) – Rút NKQ là việc loại bỏ đường thở nhân tạo. Trong trường hợp bệnh nhân bị mở khí quản, từ rút ống mở khí quản (decannulation) được sử dụng [17]. Sự cần thiết phải thiết lập lại đường thở nhân tạo được gọi là tái đặt NKQ (reintubation) hoặc rút NKQ thất bại (extubation failure). Tái đặt NKQ sớm là thủ thuật xảy ra ít hơn 48 giờ sau khi rút NKQ hoặc rút ống mở khí quản [18].
- Cai máy thành công hay thất bại – Cai máy thành công là duy trì sự thông khí tự nhiên ít nhất 48 giờ sau khi ngừng MV. Cai máy thất bại hoặc không thành công khi cần thông khí cơ học trong vòng 48 giờ sau rút NKQ [18]. Ngừng dùng MV được xác định là thành công khi bệnh nhân dung nạp SBT. Những bệnh nhân này cần được đánh giá để chỉ định rút đường thở nhân tạo (rút NKQ) [19]. Khi bệnh nhân thất bại với SBT, gọi là ngưng MV không thành công.
- MV kéo dài – được xác định khi bệnh nhân phụ thuộc vào sự hỗ trợ thông khí xâm lấn hoặc không xâm lấn (NIV) > 6 giờ mỗi ngày trong một tuần, mặc dù có áp dụng các chương trình vật lý trị liệu hô hấp, điều chỉnh các rối loạn chức năng và sử dụng các kỹ thuật mới để hỗ trợ hô hấp [17].
Cai máy
Để xem xét bắt đầu cai máy, bệnh gây ra hoặc góp phần làm mất bù thông khí cần được giải quyết hoặc trên đường giải quyết. Bệnh nhân cần phải ổn định huyết động, tưới máu mô tốt, bất kể sử dụng thuốc vận mạch (liều thấp và ổn định được chấp nhận) và không suy giảm chức năng tim mất bù hoặc rối loạn nhịp tim kèm theo rối loạn huyết động học. Hơn nữa, trao đổi khí phải nằm trong các thông số có thể chấp nhận được (PaO2 ≥ 60 mmHg, FiO2 ≤ 0,40 và PEEP ≤ 5 đến 8 cmH2O), và bệnh nhân có thể bắt đầu nỗ lực hít vào [2].
Nếu SBT thành công, cần xem xét các yếu tố khác trước khi rút NKQ như: tri giác [17,20] và thuốc an thần [21], mức độ hợp tác của bệnh nhân và khả năng thải trừ các chất tiết từ đường thở.
Để giữ nhịp thở tự nhiên, các cơ hô hấp sẽ tạo ra lực lớn hơn sự đàn hồi của phổi và thành ngực (tải đàn hồi của phổi và thành ngực), cũng như sức đề kháng của đường thở và mô (tải trở kháng). Điều này đòi hỏi sự vận hành đầy đủ của các cơ quan thông khí, sự toàn vẹn giải phẫu và chức năng của hệ thống thần kinh trung ương và ngoại biên, bảo toàn dẫn truyền thần kinh cơ, thành ngực nguyên vẹn và sức căng cơ bắp đầy đủ.
Trong điều kiện bình thường, cung cấp năng lượng là đủ để đáp ứng các nhu cầu thông khí. Tuy nhiên, các yếu tố khác, như tăng kháng lực đường thở (co thắt phế quản, phù nề đường thở, dịch bài tiết nhiều) và tăng độ đàn hồi (nhiễm trùng, xẹp phổi, căng phế nang), tăng gánh phổi và lồng ngực (tràn khí màng phổi, béo phì, chướng bụng) cũng như các yếu tố làm giảm khả năng thần kinh cơ (giảm điều khiển hô hấp, suy nhược cơ, sự thay đổi trong truyền dẫn thần kinh cơ) cũng có thể xác định sự thất bại của cai máy và rút ống ở người lớn và trẻ em [7,18,23].
Thử nghiệm tự thở (SBT)
Một số nghiên cứu [3,10,14,15,18,19,24] cho thấy SBT 30 phút đến 2 giờ là hữu ích để chọn bệnh nhân sẵn sàng để rút NKQ. MV có thể được ngưng, oxy được cung cấp để duy trì độ bão hòa oxy (SpO2) > 90%. Chỉ cần FiO2 đến 40%, và không nên tăng khi ngưng MV. Các phương pháp khác cũng có thể được sử dụng trong SBT: áp suất đường thở dương hai pha (BIPAP), bù ống tự động (ATC) hoặc thông khí hỗ trợ tỷ lệ (PAV). Kết quả của các phương pháp này tương tự như khi sử dụng T-piece và PSV [16,25,26].
Theo dõi tại giường liên tục trong SBT là căn bản để phát hiện những dấu hiệu của không dung nạp và thất bại (Bảng 1). Khi phát hiện bất kỳ dấu hiệu nào của không dung nạp, SBT phải ngưng và thông khí cơ học trở lại với các thông số trước đó. Những bệnh nhân không có dấu hiệu không dung nạp đối với SBT nên được xem xét khả năng rút NKQ, và nên được theo dõi tại ICU trong 48 giờ. Nếu thông khí tự nhiên được duy trì trong 48 giờ có nghĩa là việc rút NKQ đã thành công [18,27].
Xử trí bệnh nhân không dung nạp với SBT
Cho cơ hô hấp nghỉ ngơi
Bệnh nhân thất bại trong lần đầu tiên của SBT nên cho thở máy lại và duy trì ít nhất 24 giờ bằng cách sử dụng chế độ thông khí giúp họ cảm thấy thoải mái. Trong thời gian này, cần đánh giá lại và điều trị các nguyên nhân gây không dung nạp SBT. Bằng chứng cho thấy bệnh nhân nên được hỗ trợ hô hấp trong 24 giờ sau khi rút NKQ thất bại và trước khi thử nghiệm cai máy mới. Mục đích của nghỉ ngơi là phục hồi chức năng của hệ thống thông khí và giải quyết các nguyên nhân khác có thể dẫn đến sự mệt mỏi cơ hô hấp (sử dụng thuốc an thần, rối loạn điện giải, nhiễm trùng). Ở những bệnh nhân biểu hiện mỏi cơ, sự hồi phục không xảy ra trong vòng 24 giờ. Đối với bệnh nhân người lớn [10] việc sử dụng SBT bằng ống T hai lần một ngày không có lợi cho bệnh nhân khi so sánh với hiệu quả của nó chỉ một lần một ngày.
Thử nghiệm cai máy thở mới sau 24 giờ
Nếu bệnh nhân vẫn đủ điều kiện rút NKQ, và nếu các nguyên nhân của không dung nạp đã giải quyết, một SBT mới nên thực hiện sau 24 giờ. Bằng chứng cho thấy thực hiện SBT hằng ngày rút ngắn thời gian MV khi so sánh với các phác đồ mà SBT không được thực hiện hàng ngày ở người lớn [10].

Xử trí bệnh nhân dung nạp với SBT
Khi bệnh nhân thành công trong SBT có thể đủ hoặc không đủ tiêu chuẩn rút ống nội khí quản. Các yếu tố sau cần được xác nhận: đảo ngược hoặc giải quyết tình trạng cấp tính dẫn đến MV; PaO2 ≥ 60 mmHg, FiO2 ≤ 0,40% và PEEP ≤ 5 đến 8 cmH2O; đánh giá huyết động cho thấy tưới máu mô tốt, cai các thuốc vận mạch (liều thấp và ổn định có thể chấp nhận được) và không có sự suy tưới máu mạch vành hoặc loạn nhịp với các tác động trên huyết động; khả năng khởi động nỗ lực hô hấp; tình trạng tinh thần tốt; có phản xạ ho; cân bằng axit-bazơ; cân bằng dịch hạn chế; nồng độ chất điện giải trong huyết thanh bình thường (K, Ca, Mg, P); không có phẫu thuật sắp tới.
Protocol cai máy thở
Rất ít nghiên cứu [28-30] phân tích các phương pháp cai máy ở trẻ em, và không nghiên cứu nào trong số đó báo cáo kết quả khả quan khi so sánh với các quy trình cai máy tiêu chuẩn (Bảng 2). Tuy nhiên, một số nghiên cứu [29-32] báo cáo về cải thiện việc chăm sóc bệnh nhân PICU khi thực hiện các protocol rút ống NKQ. Những nghiên cứu này sử dụng các tiêu chuẩn tương tự để đánh giá khả năng rút ống ở trẻ em (Bảng 3).
Cách tiếp cận cai máy phổ biến nhất đối với trẻ nhũ nhi và trẻ em là giảm dần sự hỗ trợ của thở máy [33]. Cai máy bằng IMV hoặc SIMV bằng cách giảm dần tần số thở. Với thông khí hỗ trợ áp lực (PSV), áp suất hỗ trợ (PS) ban đầu được cài đặt theo mức hỗ trợ cần thiết và sau đó giảm dần. PSV cung cấp sự giảm tải của cơ tốt hơn so với SIMV. PSV thường kết hợp với IMV/SIMV trong thời gian cai máy.
Hỗ trợ thể tích (volume support) và hỗ trợ áp suất đảm bảo thể tích (volume-assured pressure support) là những hình thức đặc biệt của PSV, đảm bảo một VT tối thiểu cho mỗi nhịp thở hỗ trợ. Việc cai máy với hỗ trợ thể tích là bán tự động, và mức PSV cần thiết để duy trì một VT nhất định sẽ giảm xuống một cách tự động khi cơ học hô hấp cải thiện.
Sự rút NKQ xảy ra ở hỗ trợ hô hấp mức độ thấp hoặc sau khi thử nghiệm sẳn sàng rút ống (extubation readiness test). Các tác giả khác đề nghị một mức hỗ trợ áp lực vừa phải cung cấp một phần nghỉ ngơi cho cơ hô hấp của bệnh nhân. MV sẽ ngưng nếu SBT được dung nạp tốt [14,34]. Cách tiếp cận này thường được sử dụng rộng rãi hơn đối với bệnh nhân người lớn hơn là trẻ em [33].
Thời gian MV được biết là một yếu tố nguy cơ độc lập ở bệnh nhân cần hỗ trợ hô hấp [35]. Trong một nỗ lực để rút ngắn thời gian MV và giảm tỷ lệ mắc bệnh, các protocol cai máy đã được thực hiện ở ICU người lớn. Một số nghiên cứu với người lớn đã chứng minh rằng việc thực hiện một quy trình cai máy đã được chuẩn hóa rút ngắn thời gian MV mà không ảnh hưởng xấu đến chăm sóc bệnh nhân [35-38].
Kết quả từ các thử nghiệm ở nhi khoa, protocol cai máy thở không có triển vọng. Trong một nghiên cứu đa trung tâm lớn do nhóm PALISI thực hiện, không có sự khác biệt giữa các nhóm ngẫu nhiên hoặc cai máy qua PSV do bác sĩ chỉ định, phương pháp hỗ trợ thể tích được điều chỉnh bởi tự động, hoặc không có protocol [29]. Nghiên cứu này cũng kiểm tra hiệu quả của một bộ tiêu chuẩn sẵn sàng rút NKQ và mối quan hệ giữa sử dụng thuốc an thần và kết quả. Nghiên cứu đã được dừng lại vì không có sự khác biệt rõ ràng giữa ba nhóm sau khi 182 trẻ được đưa vào nghiên cứu (tỷ lệ thất bại rút NKQ là 19% với tiêu chuẩn sẳn sàng rút ống NKQ so với 17% theo đánh giá của bác sỹ). Việc tăng sử dụng an thần trong 24 giờ đầu cai máy là một yếu tố dự báo quan trọng về thời gian cai máy (P <.001) và sự thất bại cai máy (P = .04) trong nghiên cứu đó. Sự tuân thủ hạn chế đối với các quy trình (66% tuân thủ) báo cáo trong nghiên cứu đó có thể đã làm giảm khả năng phát hiện ra một tác dụng có lợi có thể.
Shultz et al. [30] cho thấy thời gian cai máy ngắn hơn khi phân ngẫu nhiên những bệnh nhân nhi từ việc cai máy theo protocol so với cai máy do bác sĩ chỉ định, tuy nhiên, đáng ngạc nhiên thời gian thở máy toàn phần và thời gian cai máy hoàn toàn không có ý nghĩa thống kê (10 so với 0,8 giờ). Restrepo et al. [38] cũng báo cáo hồi cứu thời gian cai máy ngắn hơn và thời gian thở tự nhiên ngắn hơn trong nhóm nghiên cứu so với cai máy theo hướng truyền thống do bác sĩ chỉ định, nhưng lại không có sự khác biệt về thời gian thở máy chung.


Gần đây, một chương trình cai máy thở được tích hợp trong một loại máy thở vòng kín (closed loop) đã được điều chỉnh cho quá trình cai máy [39,40]. Một thử nghiệm ngẫu nhiên đa trung tâm bao gồm 144 người lớn và so sánh protocol vòng kín này với phương pháp cai máy ở tại chỗ cho thấy sự giảm đáng kể 4,5 ngày trong thời gian thở máy toàn bộ [41]. Tuy nhiên, một nghiên cứu trung tâm duy nhất tiếp theo sử dụng cùng một hệ thống trên máy vi tính không thể khẳng định sự vượt trội của cách tiếp cận này [42].
Một nghiên cứu thí điểm được tiến hành ở bệnh nhân nhi khoa cho thấy việc ra quyết định trên máy tính dường như đáng tin cậy ở một dân số nhỏ [43]. Các tác giả cho thấy thời gian thông khí giảm từ 5,1 ± 4,2 ngày ở nhóm vòng kín so sánh với 6,7 ± 11,5 ngày ở nhóm quyết định lâm sàng (p = 0,33). Các protocol vòng kín được thiết kế để đẩy nhanh việc ngưng thở máy bằng cách thay đổi mức độ áp lực hỗ trợ (PS) thường xuyên hơn bác sĩ. Nó điều chỉnh chặt chẽ mức độ hỗ trợ áp lực bằng cách đánh giá tác động của nó đối với kiểu thở của trẻ. Protocol vòng kín sử dụng ba biến số để tự động kiểm soát mức độ hỗ trợ: tần số hô hấp, VT, và PetCO2. Tần số thở, có vẻ như phản ánh tốt các cơ hô hấp thích ứng với khối lượng công việc, là biến chính được sử dụng. VT và PetCO2 là các biến bổ sung được sử dụng để cải thiện sự an toàn [43]. Cần có thêm các nghiên cứu để đánh giá tác động của chiến lược điều trị mới này đối với thời lượng thông khí cơ học.
Để phá vỡ các rào cản đối với việc sử dụng hiệu quả các giao thức (protocol), một số đã thực hiện các thuật toán (algorithm) điều trị độc lập với bác sĩ do các y tá và chuyên gia trị liệu hô hấp điều hành. Bằng chứng hiện tại cho thấy các quy trình cái máy thở do chuyên viên trị liệu hô hấp quản lý so với cai máy truyền thống dưới hướng dẫn của bác sĩ, cho kết quả thời gian thở máy ngắn hơn, giảm chi phí và phân bổ nguồn lực tốt hơn. Trong một nghiên cứu, các protocol do chuyên viên hô hấp quản lý (respiratory therapist- driven protocols) ở những bệnh nhân cần thông khí cơ học kéo dài, làm giảm thời gian cai máy trung bình gần 12 ngày [44].
Ely et al. [35] đã ngẫu nhiên hóa 300 bệnh nhân bệnh nội khoa được chia thành 2 nhóm, chăm sóc tiêu chuẩn hoặc chiến lược can thiệp kết hợp kiểm tra sự sẵn sàng rút NKQ hàng ngày. Chiến lược can thiệp làm giảm đáng kể thời gian cai máy, thời gian thở máy, tỷ lệ biến chứng và chi phí ICU; không có sự khác biệt được ghi nhận trong thời gian nằm ICU hoặc nằm viện, chi phí bệnh viện, hoặc tử vong. Hai thử nghiệm lâm sàng ngẫu nhiên ở các ICU nội khoa và ngoại khoa cho thấy một quy trình hướng dẫn cho chuyên viên chăm sóc hô hấp – y tá ICU cũng rút ngắn thời gian thở máy [36,37].
Các kết quả tốt hơn đạt được với các người không phải là chuyên gia thở máy đã dẫn dắt một nhóm các chuyên gia chăm sóc phổi và chăm sóc đặc biệt, do American College of Chest Physicians (ACCP), the American Association for Respiratory Care, và the American College of Critical Care Medicine, đề nghị các ICUs xây dựng và thực hiện các quy trình chăm sóc hô hấp được thiết kế cho các chuyên gia chăm sóc không chuyên khoa [2,35]. Trong nghiên cứu ở trẻ sơ sinh, Hermeto et al. [45] cho thấy việc thực hiện “respiratory therapist-driven protocol” đã có một tác động tích cực đến kết quả thông khí của trẻ sơ sinh non tháng, mà không có tác dụng phụ. Những phát hiện chính là rút ngắn thời gian cho lần rút NKQ đầu tiên, giảm tỷ lệ thất bại rút NKQ (từ 40% xuống 20%) và giảm thời gian MV (từ 5,0 đến 1,2 ngày).
Sự thành công của thông khí không xâm lấn (NIV) đối với suy hô hấp cấp và sự áp dụng thành công cho cai máy đã dẫn tới sự quan tâm mới để phòng ngừa rút NKQ thất bại. Sau rút NKQ , NIV có thể được sử dụng theo ba cách: (1) như là phụ trợ cho cai máy từ CMV bằng cách rút NKQ sớm và trực tiếp chuyển sang NIV, (2) như là một áp dụng dự phòng của NIV cho bệnh nhân có nguy cơ cao đã được rút NKQ vào thời điểm họ đạt đủ tiêu chuẩn rút ống; hoặc (3) là một ứng dụng chữa bệnh hoặc cứu mạng cho bệnh nhân bị suy hô hấp cấp sau khi đã rút NKQ theo tiêu chuẩn.
Hai thử nghiệm lâm sàng ngẫu nhiên gần đây cho thấy rằng việc sử dụng NIV ngay sau khi rút NKQ ở người lớn có nguy cơ cao bị thất bại rút NKQ, thấy có hiệu quả trong việc phòng ngừa tái đặt NKQ và có thể làm giảm tử vong [46, 47]. Nghiên cứu ở trẻ em về sử dụng NIV sau khi rút NKQ ở bệnh nhân sau phẫu thuật tim [48, 49] cho thấy NIV có hiệu quả và an toàn trong quần thể này. Gần đây, Mayordomo-Colunga et al. [50] cho thấy rằng NIV sau rút NKQ dường như rất hữu ích để tránh tái đặt NKQ ở trẻ có nguy cơ cao khi áp dụng ngay NIV sau khi rút NKQ. NIV có thể bị thất bại khi suy hô hấp cấp đã phát triển, khi tần số hô hấp lúc 6 giờ không giảm và nếu nhu cầu oxy tăng lên.
Các thử nghiệm quan sát và ngẫu nhiên cho thấy rằng các ptotocol nhằm giảm thiểu việc sử dụng thuốc an thần sẽ rút ngắn quá trình cai máy. Cụ thể, các cách tiếp cận nhằm tránh quá tải thuốc an thần bằng cách hạn chế sử dụng truyền liên tục hoặc qua thang điểm đánh giá an thần [51,52] hoặc ngừng truyền tĩnh mạch ban ngày [53] làm giảm thời gian thở máy và thời gian nằm ICU. Ngưng an thần ban ngày (daily sedation interruption, DSI) đã được đề xuất như là một phương pháp để làm giảm liều truyền tĩnh mạch liên tục đến một điểm số hoặc mức độ an thần được xác định [53]. Khi sử dụng DSI truyền tĩnh mạch bị gián đoạn vào ban ngày và bệnh nhân được phép thức dậy. Sau đó bệnh nhân có thể được đánh giá về phục hồi thần kinh và sẵn sàng cho việc rút NKQ, hoặc dùng an thần lại nếu cần. Girard et al. [54] gần đây đã công bố kết quả của một thử nghiệm sử dụng một chiến lược “thức dậy và thở” (wake up and breathe) ở người lớn. Bệnh nhân được phân ngẫu nhiên vào một thử nghiệm đánh thức hàng ngày theo sau là SBT (so với SBT đơn thuần), kết quả là tăng thời gian không thở máy, giảm thời gian hôn mê, giảm ICU và thời gian nằm viện, và cải thiện tỉ lệ sống sót sau 1 năm.
Mặc dù DSI dường như là một kỹ thuật đơn giản và tiết kiệm chi phí, nhưng có những rủi ro cho bệnh nhân. Những nguy cơ này bao gồm sự kích thích (phản ứng dội), đau, tự rút NKQ hoặc rút bỏ các đường động – tĩnh mạch xâm lấn và di chứng tâm lý bất lợi có liên quan đến môi trường ICU và tình trạng đe dọa đến mạng sống của họ [ 55]. Mặc dù đã thừa nhận những rủi ro, DSI đã được đưa vào Hướng dẫn Thực hành thuốc an thần của the Society of Critical Care Medicine [56], và gần đây hơn là trong “ICU Care Bundles” để ngăn ngừa viêm phổi liên quan đến thở máy [57].
Có rất ít bằng chứng về việc sử dụng các protocol an thần trong chăm sóc tích cực nhi khoa (PICU). Một nghiên cứu thang điểm COMFORT gần đây ở bệnh nhân PICU cho thấy có sự giảm đáng kể thời gian thở máy và liều thuốc ngủ ở 21 bệnh nhân được điều trị bằng cách sử dụng thuốc an thần theo protocol so với nhóm chứng [59]. Hiện tại chưa có công cụ xác nhận nào để chẩn đoán và theo dõi tình trạng mê sảng của trẻ em trong các ICU do các bác sỹ lâm sàng không được đào tạo về mặt tâm thần. Việc thiếu các công cụ chẩn đoán phù hợp với tuổi tác ở trẻ em dẫn đến thiếu hụt kiến thức về tần suất, biểu hiện lâm sàng, đáp ứng với điều trị, và kết quả của chứng mê sảng ở trẻ em trong ICU.
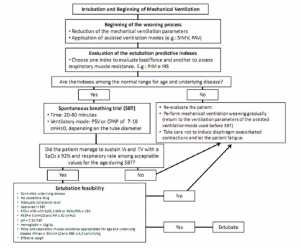
Khả năng thất bại rút NKQ cũng cần được xem xét khi đánh giá cai máy. Nhiều nghiên cứu đã mô tả các hoạt động rút ống NKQ ở khoa nhi, hầu hết chúng được thực hiện trong một PICU đơn lẻ [7-9,32,45,60-66]. Chỉ có hai nghiên cứu được thực hiện ở nhiều trung tâm [29,67]. Hầu hết các nghiên cứu báo cáo các kết cục lâm sàng cho thấy tỷ lệ rút NKQ thất bại < 10% là tiêu chuẩn, như được hỗ trợ bởi nghiên cứu của Kurachek [7, 67]. Tỷ lệ rút NKQ thất bại cao hơn được báo cáo trong các nghiên cứu sử dụng thử nghiệm mức độ sẵn sàng – khoảng 14% -20% theo Randolph [29]. Những khác biệt này có thể là một phần các bệnh nhân rút NKQ trong vòng 24-48 giờ. Fontela et al. [68] cho thấy đối tượng trẻ nhỏ, chỉ số oxy hóa trung bình (OI > 5), sử dụng các thuốc tăng co bóp cơ tim và thời gian của MV (> 15 ngày) là các biến liên quan đến tăng nguy cơ thất bại rút NKQ. Các tác giả cũng gợi ý rằng điều trị kéo dài với thuốc an thần và giảm đau trong khi MV có thể góp phần đáng kể vào tỷ lệ thất bại rút NKQ [68]. Baisch và cộng sự [64] báo cáo tỉ lệ thất bại của rút NKQ 4.1% trong vòng 48 giờ ở 3.193 trẻ sơ sinh và trẻ nhỏ. Sự thất bại rút NKQ xảy ra ở bệnh nhân nhỏ tuổi hơn (trung bình 6,5 tháng tuổi so với 21,3 tháng), với kéo dài thời gian đặt NKQ, thời gian nằm viện, và không có sự khác biệt về tỷ lệ tử vong. Hình 1 mô tả algorithm được sử dụng trong đơn vị đó.
Các yếu tố dự đoán rút NKQ
Thời điểm lý tưởng cho việc rút ống ở trẻ thở máy vẫn còn chủ quan và có thể dựa trên các protocol cai máy, các chỉ số thông khí hoặc cả hai. Đã có nhiều nỗ lực để xác định dự đoán sự thành công rút ống ở nhi khoa [65]. Một số tiêu chí, chẳng hạn như thông khí phút (VE <10 L/phút), áp suất hít vào tối đa (maximal inspiratory pressure, MIP) 50 cmH2O, RSBI, và thăng bằng tải/lực (load/force balance, LFB), đã được sử dụng để đưa ra quyết định về thời điểm lý tưởng để rút NKQ ở người lớn và trẻ em [4,13,69]. Tuy nhiên, các nghiên cứu về việc sử dụng một số các dự đoán rút gọn trong nhi khoa và sơ sinh, đặc biệt là RSBI, cho kết quả không thuyết phục [7-9,65,70]. Các thông số như VT, VE, RSBI, dung tích sống và MIP, thường được sử dụng trong các ICU để hỗ trợ quyết định rút NKQ. Các thông số sau đây có thể được sử dụng để hỗ trợ quyết định rút NKQ: tần số thở theo tuổi (20-60 < 6 tháng, 15-45 < 2 tuổi, 15-40 < 5 tuổi; 10-35 > 5 tuổi), VT 6-8ml/kg, RSBI (RR/VT điều chỉnh theo cân nặng) < 6,5 lần/ml/Kg, dung tích sống > 10-15 ml/kg, MIP 30 cmH2O.
Các thông số khác cũng có thể được sử dụng hỗ trợ cai máy thở và đưa ra quyết định rút NKQ như: áp lực tắc nghẽn (occlusion pressure, P0,1 hoặc P100), công thở (WOB = áp lực x thể tích), áp lực thực quản (esophageal pressure, Pe) và áp lực xuyên cơ hoành (transdiaphragmatic pressure), hoạt động điện của cơ hoành, khoảng chết sinh lý, đo gastric tonometry (PgCO2 – PaCO2 gradient), và các yếu tố khác. Tuy nhiên, các thông số này yêu cầu sử dụng các kỹ thuật đo đặc biệt, thường không được đánh giá thường xuyên, và được chỉ định cho các trường hợp cụ thể (khi cai máy quá phức tạp hoặc trong trường hợp nhiều lần cai máy thất bại).
Các thông số đánh giá khả năng bảo vệ đường thở [71] dễ dàng quan sát và cung cấp, nhanh chóng được đo tại giường để quyết định cai máy và rút NKQ : áp suất thở ra tối đa (MEP), lưu lượng thở ra tối đa, phản xạ ho (phản ứng với kích thích bằng catheter hút đàm); ho hiệu quả; thể tích đàm bài tiết; tần suất hút khí quản và điểm số hôn mê Glasgow.
Một số chỉ số có thể được sử dụng để đánh giá sự tiến triển của cai máy thở và là yếu tố tiên đoán sự thành công rút NKQ . Các chỉ số được liệt kê dưới đây có thể dễ dàng được đo tại giường và được sử dụng thường xuyên ở các bệnh viện người lớn, trẻ em và trẻ sơ sinh tại một số bệnh viện trên thế giới: SBT [3,15]; MIP, P0.1/P100 [2]; IP/MIP [11]; liên kết của IP/MIP và RSBI [11]; RSBI = RR/VT [71,72]; RSBI = (RR/VT/trọng lượng) [4], RSBI x P0.1 [4, 22], CROP = (Cdyn x MIP x (PaO2/PAO2))/RR) [2]; Pressure-time product: PTP = (PTP/thời gian chu trình hô hấp)/MIP [4,12]; Tension-time index 1 (TT1) và chỉ số tension-time index 2 (TT2) [4,12,73,74]; Chỉ số cai máy đơn giản (Simplified weaning index, SWI) [75].
Áp lực hít vào tối đa (MIP), tỉ lệ P0.1/P100, phối hợp PI/MIP và RSBI
Sự tiến triển lâm sàng của bệnh phổi bị ảnh hưởng bởi viêm nhiễm cấp tính hoặc mãn tính ở đường thở và do nhiễm khuẩn bệnh viện mà trẻ em và trẻ sơ sinh đang tiếp nhận MV. Những nhiễm trùng này có xu hướng làm bẫy khí và thay đổi độ giãn nở của hệ thống hô hấp, tăng WOB và giảm sức mạnh của cơ hô hấp [76]. Sức mạnh của cơ hô hấp có thể được đo bằng phương pháp không xâm lấn đơn giản và tại giường. Thử nghiệm này có thể được thực hiện với các bệnh nhân đặt NKQ hoặc mở khí quản và tự thở tự nhiên. Để thực hiện ở bệnh nhân nhi được hỗ trợ hô hấp, cần nối bộ đo với ống NKQ hoặc mở khí quản, và đầu giường phải được nâng lên 30 độ. Người thực hiện nên đợi cho đến khi đứa trẻ thực hiện 3 lần hít vào và 3 lần thở ra gắng sức. Giá trị cao nhất trong ba giá trị này phải được ghi lại cho mỗi thì (hít vào và thở ra). Thử nghiệm nên được thực hiện trong 15 đến 45 giây. Các giá trị được ghi lại phải được so sánh với các thông số bình thường, sử dụng phương trình cho các giá trị dự đoán [77].
Số đầu tiên được thấy trong thanh đo, trong một giây được gọi là áp lực tắc nghẽn (P1.0) và có thể được dùng để tính P1.0/P100. Sự kết hợp của áp suất đường thở trung bình [MAP = (IP-PEEP) x [IT/(ET + IT]} + PEEP], MIP và RSBI được gọi là load/strength ratio [LSR = 15x (3xMAP)/(MIP + 0,03) x RSBI – 5], được tạo ra và lần đầu tiên được sử dụng cho các bệnh nhân người lớn bởi Vassilakopoulos và cộng sự (2006) [11] và cho các bệnh nhi bởi Johnston và cộng sự [13].
Chỉ số thở nhanh nông – Rapid Shallow Breathing Index (RSBI) ở trẻ em và the RSBI-P1.0 Product
Thất bại cai máy là kết quả của sự mất cân bằng giữa khả năng của các cơ hô hấp và nhu cầu thông khí. RR/VT được điều chỉnh theo trọng lượng tính bằng kg, nghĩa là RSBI nhi khoa [4]. RSBI là một trong những chỉ số có thể được sử dụng để xác định bệnh nhân sẽ rút NKQ thành công [4,5,9,13,32].
Các nghiên cứu lâm sàng trước đây [5,72,78-80] ở người lớn cho thấy RSBI có độ nhạy tuyệt vời và độ đặc hiệu vừa phải. Đặc hiệu cho bệnh nhân sau phẫu thuật cũng tương tự như ở bệnh nhân lâm sàng.
Khả năng của RSBI và tích số RSBI-P0.1 để dự đoán sự rút NKQ thành công hay thất bại đã được phân tích cho bệnh nhân người lớn, trẻ em và trẻ sơ sinh [4,23,32,79,81]. Các nghiên cứu được thực hiện với trẻ em và trẻ sơ sinh cho thấy độ nhạy vừa phải và độ đặc hiệu thấp để dự đoán thất bại hoặc thành công bằng RSBI [4,13,23,32,81]. Một số giả thuyết đã được đưa ra để giải thích sự thật này, chẳng hạn như tính không đồng nhất của các mẫu (tuổi tác, cân nặng, dấu hiệu sinh tồn, bệnh cơ bản), kiểu thiết kế nghiên cứu, các đặc điểm của NKQ (thời gian đặt NKQ, đường kính ống NKQ, số lần đặt NKQ, sử dụng ống NKQ có bóng chèn không) và các tính năng của MV (thời gian MV, chế độ thở, không đồng bộ bệnh nhân – máy thở).
Hầu hết các nghiên cứu trên bệnh nhân nhi khoa, cho thấy RSBI không phải là một yếu tố tiên đoán rút NKQ tốt, được tiến hành với bệnh nhân ở các độ tuổi khác nhau, với chẩn đoán khác nhau và thời lượng đặt NKQ khác nhau. Tuy nhiên, khi chứng minh rằng các yếu tố như tuổi thai, tuổi sau sinh, thời gian đặt NKQ, và cân nặng khi sinh kết hợp với việc rút NKQ thành công hay thất bại [3,32,61,82-85], Baumeister et al. [7] điều chỉnh RSBI và độ giãn nở động với trọng lượng trẻ sơ sinh. Trong nghiên cứu của họ, tỷ lệ thất bại rút NKQ là 19% ở 24 giờ. Khan N và cộng sự. (1996) [8] đã nghiên cứu trên 208 trẻ em và sử dụng cùng một phương pháp để tìm tỷ lệ rút NKQ thất bại 10% sau 48 giờ. Kể từ đó, một điểm cắt cho RSBI ≤ 6,5 lần/ml/kg đã được chấp nhận để dự đoán thành công việc rút NKQ ở bệnh nhân nhi, nhưng độ đặc hiệu của nó thấp (70%) [32].
CROP Index
Chỉ mục này sử dụng dữ liệu về độ giãn nở động (Cdyn), RR, gradient oxy phế nang/động mạch (PaO2/PAO2) và MIP [68]. Các giá trị lớn hơn 13 ml/cmH2O/lần thở dự đoán thành công việc rút NKQ ở người lớn (81% độ nhạy và 57% độ đặc hiệu) [71]. Trong khoa nhi, giá trị CROP tính nên được điều chỉnh theo trọng lượng tính bằng kilôgam, và điểm cắt cho sự thành công rút NKQ là 0.15 ml/kg/cmH2O/lần thở [8].
Pressure-Time Product (PTP)
Sau khi xác định được VT và thời gian hít vào, tính chất nội tại (đàn hồi và ma sát) của hệ thống thông khí xác định áp lực tạo ra bởi nỗ lực thông khí, như WOB [85]. Một nghiên cứu cắt ngang [86] đo PTP cho 31 bệnh nhân người lớn mắc bệnh phổi tắc nghẽn mạn tính; 14 bệnh nhân dung nạp SBT và đã rút NKQ có PTP thấp hơn 50 cmH2O/kg/s. Các PTP dự đoán thất bại rút NKQ trong mẫu đó (P = 0.001).
Một nghiên cứu cắt ngang khác với 90 bệnh nhân nhi khoa [13] có chẩn đoán viêm tiểu phế quản do vi rút cấp tính đã phát hiện ra điểm cắt 0,50 cmH2O/kg/s cho PTP như là một yếu tố tiên đoán sự rút NKQ thành công, với độ nhạy 94% và độ đặc hiệu 100% để phân tích ROC. Trong nghiên cứu do Noizet et al. (2005) [4], thành công rút NKQ cho bệnh nhân có PTP 0,08 cmH2O/kg/s. Chỉ số này chưa được nghiên cứu cho trẻ sơ sinh.
Tension-Time Index (TTI)
Hai công thức có thể được sử dụng để tính TTI (TTI1 và TTI2). MIP, thời gian thở máy và thời gian chu trình hô hấp (RCT) được sử dụng để tính TTI1 [73,74]. Trong nhi khoa, điểm cắt để dự đoán sự rút ngắn thành công là 0,02 cmH2O/ml/phút [4]. MAP, MIP, thời gian thở máy và RCT được sử dụng để tính TTI2 [12]. Noizet et al. [4] nhận thấy rằng các giá trị dưới điểm cắt của 0,05 cmH2O/ml/phút đã tiên đoán sự rút NKQ thành công trong một nhóm nhi bình thường.
Simplified Weaning Index (SWI)
Các SWI sẽ tính đến sức đề kháng của cơ hô hấp và khả năng duy trì sự trao đổi khí đầy đủ. Chỉ số này là sự kết hợp của PTP được sửa đổi [MPTP = [(IT/RCT) x (IPxVT)] /(VT tự phát/MIP)] và các thông số đánh giá hiệu quả của việc trao đổi khí [GEE = (VE x PACO2)/(VT tự phát x 40)]. Chỉ số SWI đã được nghiên cứu ở 38 bệnh nhân người lớn bị bệnh phổi tắc nghẽn mãn tính. Kết quả cho thấy xu hướng thất bại rút ống NKQ ở bệnh nhân có các giá trị SWI lớn hơn, nhưng độ nhạy và độ đặc hiệu để dự đoán sự rút NKQ thất bại là thấp [75].
Air Leak Test
Sự tắc nghẽn đường thở trên đã được báo cáo là nguyên nhân của đến 37% số trường hợp rút NKQ thất bại ở trẻ em [33]. Thử nghiệm rò rỉ khí (air leak test, ALT) là áp suất không khí tối thiểu (thường < 20-25 cmH2O) cần thiết để tạo ra một luồng không khí xung quanh ống NKQ khi được nghe bằng ống nghe để trực tiếp trên thanh quản. Nó thường được sử dụng để dự đoán tắc nghẽn đường thở trên sau khi rút NKQ [33]. Thử nghiệm này thường thực hiện để phát hiện phù nề đường thở dẫn đến thở rít sau rút NKQ hoặc tắc nghẽn đường thở trên. Trong một cuộc khảo sát, 76% bác sĩ thường sử dụng thử nghiệm này trước khi rút NKQ, 95% cho biết họ sẽ trì hoãn việc rút ống nếu ALT là 30 cmH2O trở lên, và 60% sẽ trì hoãn việc rút ống để điều trị steroid [ 87].
ALT đã được chứng minh là một yếu tố tiên đoán nhạy cảm các biến chứng sau rút NKQ ở những bệnh nhân có bệnh lý đường hô hấp trên, chẳng hạn như viêm thanh khí phế quản (croup), chấn thương đường thở, hoặc tái tạo đường thở sau phẫu thuật [88]. Tuy nhiên, khả năng tiên đoán của ALT là giới hạn khi áp dụng cho dân số nói chung. Mhanna và cộng sự [89] cho thấy một test rò rỉ < 20 mmHg (27.2 cmH2O) dự đoán stridor tốt hơn ở trẻ em trên 7 tuổi so với ở bệnh nhân nhỏ tuổi hơn, nhưng cả hai trường hợp đều không có độ nhạy cao. Trong một nghiên cứu ngẫu nhiên, mù đôi của 50 bệnh nhân nhi, Wratney et al. [88] đã phân tích sự thay đổi sự rò rỉ đường thở khi đo tại thời điểm đặt NKQ và rút NKQ như là một yếu tố tiên đoán kết quả rút NKQ. Họ đã phát hiện ra rằng việc đo độ rò rỉ theo thời gian là một yếu tố tiên đoán tốt hơn cho rút ống NKQ thành công hơn là tiên đoán thất bại rút NKQ (độ nhạy 76%, độ đặc hiệu 44%, PPV 83%, NPV 33%) [88]. Gần đây, Wratney et al. [90] cho thấy áp lực ALT 30 cmH2O trước khi rút NKQ hoặc trong thời gian MV là phổ biến và không dự đoán được nguy cơ thất bại rút NKQ (NPV 18%). Kết luận: bệnh nhân nhi là ứng cử viên cho thử nghiệm rút NKQ nhưng không rò rỉ khí quanh ống NKQ vẫn có thể dung nạp thành công việc rút ống NKQ .
Dựa trên số liệu sẵn có, nếu nghe thấy tiếng rò rỉ (bằng tai, không phải ống nghe) ở mức áp lực < 25 cmH2O với bệnh nhân có đầu ở vị trí trung gian. Tuy nhiên, việc rút ống không nên trì hoãn nếu test âm tính và nhưng tất cả các điều kiện khác để rút ống NKQ là thuận lợi [33].
Corticosteroid dự phòng thường được dùng trong nỗ lực để giảm thiểu stridor sau rút NKQ. Trong một meta-analysis đã công bố, Markovitz và Randolph [91] cho thấy tỉ lệ stridor sau rút NKQ ở trẻ sơ sinh và trẻ nhỏ được điều trị bằng corticosteroid hệ thống trong giai đoạn rút ngắn thời kỳ trước và sau rút NKQ. Cũng có xu hướng giảm tỷ lệ tái đặt NKQ trong nhóm corticosteroid, nhưng không có ý nghĩa thống kê. Hai thử nghiệm nhi khoa trong meta-analysis này dùng dexamethasone 0,5 mg/kg (đến 10 mg) từ 6 đến 12 giờ trước khi rút NKQ và sau đó 6 giờ một lần cho 6 liều; phát hiện của họ cho thấy sự khác biệt.
Tổng quan hệ thống Cochrane cho thấy sử dụng corticosteroid để phòng ngừa hoặc điều trị stridor sau rút NKQ chưa chứng tỏ có hiệu quả đối với trẻ sơ sinh hoặc trẻ nhỏ. Tuy nhiên, can thiệp này cần được nghiên cứu thêm, đặc biệt đối với trẻ em hoặc trẻ sơ sinh có nguy cơ cao. Ở người lớn, nhiều liều corticosteroid bắt đầu từ 12-24 giờ trước khi rút NKQ dường như có lợi cho những bệnh nhân có khả năng stridor sau rút NKQ cao [92].
Cân bằng dịch
Quá tải thể tích xảy ra thường xuyên trong quá trình điều trị hội chứng đáp ứng viêm toàn thân do nhiễm trùng nặng, viêm tụy, phẫu thuật lớn hoặc các sự kiện khác. Thể tích dư thừa này sẽ làm giảm dung tích cặn chức năng của phổi và gây xẹp phế nang. Điều này có liên quan đến sự bất xứng thông khí/tưới máu, đòi hỏi tăng PEEP để giữ phế nang mở ra và duy trì oxy hóa tốt. Giảm dư dịch bằng cách kiểm soát chặt chẽ dịch nhập và cải thiện thêm nhờ thuốc lợi tiểu. Đối với người lớn ARDS, phù phổi cấp tính hoặc suy tim sung huyết, chiến lược quản lý hạn chế dịch đã chứng minh thành công, dẫn đến cải thiện tỉ lệ sống còn và số ngày không thở máy cao hơn [88]. Chiến lược quản lý dịch phù hợp cho bệnh nhân nhi vẫn còn nhiều tranh cãi.
Randolph et al. [93] đã đánh giá ảnh hưởng của dịch nhập tích lũy trừ đi dịch xuất như là một yếu tố tiên đoán kết quả của thời gian cai cai máy và rút NKQ. Các tác giả nhận thấy rằng hiệu số dịch xuất – nhập không dự đoán được thời gian cai máy hoặc kết cục rút NKQ. Tuy nhiên, các nghiên cứu khác cho thấy sự cân bằng dịch giảm đi có liên quan đến tỉ lệ sống sót cao hơn ở những bệnh nhi có rối loạn chức năng đa cơ quan [88].
Các yếu tố dự đoán khác
Những vấn đề sau đây ở bệnh nhân MV sẽ ảnh hưởng đến khả năng hoặc nhu cầu trên hệ thống hô hấp, bao gồm: mất ổn định huyết động, rối loạn acid-base, rối loạn điện giải, tình trạng tri giác thay đổi, và giảm chức năng cơ hô hấp. Xáo trộn điện giải trong khi cai máy đã được nghiên cứu rộng rãi. Nó đã được chỉ ra rằng giảm phosphate máu, hạ can-xi máu, hạ magne máu, và hạ kali máu làm giảm co thắt cơ và ảnh hưởng đến cai máy. Những rối loạn này phải được điều chỉnh trước khi cai máy [94].
Khiếm khuyết thần kinh thứ phát do chấn thương não có thể gây ra một thách thức về thời gian tối ưu cho việc cai máy và/hoặc rút NKQ. Namem et al. [95] phát hiện ra rằng bệnh nhân rút NKQ thành công có điểm số GCS ≥ 8. Một GCS ≥ 10 gần đây đã được coi là điều kiện tiên quyết để rút NKQ thành công [96].
Các nghiên cứu gần đây với bệnh nhân ở người lớn cho thấy số lượng đàm và ho hiệu quả là những yếu tố tiên đoán quan trọng của kết cục rút ống NKQ [97,98]. Khamiees et al. [97] đánh giá ho hiệu quả theo mức yêu cầu (0-5) và số lượng dịch tiết qua NKQ (không nhiều) ở bệnh nhân qua SBT. Bệnh nhân được yêu cầu ho vào một tờ giấy trắng nhỏ. Bệnh nhân ho yếu (mức 0 đến 2) và tiết nhiều đàm, có nhiều khả năng không rút NKQ. Thử nghiệm này âm tính cũng dự đoán việc rút NKQ thất bại.
Mệt mỏi của bệnh nhân trải qua cai máy là một yếu tố chính yếu trong việc thất bại cai máy. Một số nghiên cứu sử dụng chẩn đoán điện cơ (EMG) cho thấy mệt mỏi cơ hoành xuất hiện vào ngày đầu tiên ở tất cả các bệnh nhân trên MV, và những bệnh nhân hồi phục được rút NKQ thành công [94]. Các bệnh nhân tiếp tục cảm thấy mệt mỏi cần thiết tái đặt NKQ. Người ta không biết cần bao nhiêu sức mạnh cơ hoành để duy trì thở tự nhiên, hoặc khoảng thời gian nghỉ ngơi cần bao lâu để phục hồi từ mỏi cơ hoành. Có thể một ngày nghỉ ngơi, được hỗ trợ bởi MV, đủ để phục hồi cơ hoành [94].
Suy dinh dưỡng làm giảm khối lượng cơ, độ bền, và sức mạnh cơ bắp. Nó cũng làm giảm khả năng miễn dịch, khiến cho bệnh nhân tiếp tục bị nhiễm trùng. Dinh dưỡng đầy đủ ở những bệnh nhân nặng dẫn đến việc tăng cường lực hô hấp và cai máy dễ dàng hơn [94].
KẾT LUẬN
Các tài liệu về nhi khoa hiện nay cho thấy khoa học về cai máy và rút ống vẫn còn chưa được xác định. Thật vậy, không có phương pháp cai máy tối ưu nào dẫn đến việc rút NKQ nhanh và thành công. Các phương pháp tiếp cận dựa trên các protocol đối với cai máy có thể có những lợi ích tiềm tàng trong việc đẩy nhanh sự sẵn sàng cho việc rút NKQ, nhưng đến nay vẫn chưa cho thấy những khác biệt đáng kể. Sau khi phân tích các dấu hiệu lâm sàng của việc rút NKQ thành công, chúng tôi nhận thấy rằng không có chỉ số sinh lý cụ thể nào đã tiên đoán sự rút NKQ thành công ở trẻ em. Tuy nhiên, một thử nghiệm hàng ngày về sự sẵn sàng rút ống là kỹ thuật hiệu quả nhất để xác định khả năng thành công. Sự tắc nghẽn đường thở trên là nguyên nhân chính dẫn đến sự thất bại trong việc rút NKQ ở hầu hết các nghiên cứu ở trẻ em. Do đó, các nỗ lực tập trung vào giảm phù nề đường thở trước khi rút ống. Corticosteroid có vẻ có lợi cho trẻ sơ sinh và trẻ nhỏ, nhưng vẫn chưa có bằng chứng rõ ràng về hiệu quả.





