Bài viết Tổng quan kỹ thuật thông khí để tối ưu hóa thở máy bệnh nhân đợt cấp bệnh phổi tắc nghẽn mãn tính được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Review of ventilatory techniques to optimize mechanical ventilation in acute exacerbation of chronic obstructive pulmonary disease
Tóm tắt
Bệnh phổi tắc nghẽn mạn tính (COPD) là một vấn đề y tế toàn cầu. Các nghiên cứu khác nhau về tần suất thở máy được báo cáo trong các trường hợp cấp tính của COPD. Đặt nội khí quản xâm nhập và thông khí cơ học có thể liên quan đến bệnh suất và tử vong đáng kể. Hiểu biết về sinh lý bệnh hô hấp và cơ học phổi trong COPD là cần thiết để điều trị các trường hợp cấp tính và suy hô hấp. Sinh lý bệnh cơ bản của đợt cấp COPD là giới hạn lưu lượng khí thở ra tới hạn (critical expiratory airflow limitation) với hậu quả là quá căng phổi động (dynamic hyperinflation). Những thay đổi này dẫn đến sự xáo trộn hơn nữa trong cơ học thông khí, chức năng cơ hô hấp và trao đổi khí có thể dẫn đến suy hô hấp. Tổng quan này thảo luận về các cơ học hô hấp bị thay đổi trong COPD, cách để phát hiện những thay đổi này trong một bệnh nhân thông khí và xây dựng các kỹ thuật thông khí để tối ưu hóa việc quản lý suy hô hấp do đợt cấp COPD.
Giới thiệu
Bệnh phổi tắc nghẽn mạn tính (COPD), là nguyên nhân tử vong hàng thứ tư trên thế giới và tại Hoa Kỳ (Báo cáo Y tế Thế giới 1998). COPD là một bệnh tiến triển và có liên quan đến tần suất ngày càng gia tăng và mức độ nghiêm trọng của đợt cấp. Các biểu hiện lâm sàng của đợt kịch phát cấp tính rất khác nhau, từ nhẹ chỉ cần điều trị ngoại trú đến nặng đe dọa tính mạng cần được hỗ trợ thở máy cơ học. Có thể hợp lý để giả định rằng viêm đường dẫn khí tồi tệ hơn là sự kiện khởi đầu của COPD và có thể là do vi khuẩn, vi rút hoặc ô nhiễm môi trường, bao gồm khói thuốc lá (Soler 1998, Bhowmik 2000, Sethi 2000).
Sự bất thường về sinh lý học căn bản trong đợt kịch phát cấp tính của COPD đang làm trầm trọng hơn sự giới hạn luồng khí thở ra và kết quả là quá căng phổi động. Quá căng phổi động làm tăng công thở, đẩy cơ hô hấp vào tình trạng bất lợi (Orozco-Levi 2003), vì họ phải thở với dung tích cặn chức năng cao hơn và có thể gây rối loạn chức năng tim mạch nghiêm trọng (Brochard 1995) dẫn đến tình trạng thiếu oxy máu xấu đi, với mức độ tăng CO2 máu và toan máu khác nhau. Toan hóa mô tiếp theo làm suy yếu chức năng cơ hô hấp dẫn đến vòng xoắn bệnh lý làm suy hô hấp nặng hơn.
Thông khí cơ học, xâm lấn hoặc không xâm lấn, là một biện pháp cứu sống trong việc kiểm soát suy hô hấp cấp do đợt kịch phát cấp tính của COPD. Tuy nhiên, thông khí cơ học có thể liên quan đến bệnh suất và tử vong đáng kể. Sự hiểu biết tốt về các cơ chế bệnh sinh học cơ bản trong đợt kịch phát cấp tính COPD rất quan trọng trong việc tối ưu hóa các chiến lược thông khí. Hầu hết các máy thở hiện đại đều được lập trình để hiển thị các dạng sóng quan trọng như lưu lượng, áp lực, thể tích, các vòng lặplưu lượng-thể tích, vòng lặp thể tích-áp lực và có thể thực hiện nhiều thủ thuật để phát hiện sự thay đổi chức năng hô hấp và cơ học. Những dạng sóng và thủ thuật này là những công cụ rất quan trọng có thể được sử dụng trong việc phát hiện quá căng phổi động, chẩn đoán các biến chứng trước khi các dấu hiệu lâm sàng rõ ràng phát triển và thúc đẩy sự đồng bộ của bệnh nhân và thở máy.
Thông khí không xâm lấn vs xâm lấn – Noninvasive versus invasive ventilation
Có nhiều phương pháp hỗ trợ thở máy cho bệnh nhân bị bệnh bao gồm phương pháp đặt nội khí quản truyền thống và thông khí cơ học và thông khí áp lực dương không xâm lấn (NPPV). Các nghiên cứu khác nhau về tần suất thông khí cơ học trong các đợt cấp phát cấp tính của COPD (Brochard 1995). Trong một nhóm bệnh nhân đa trung tâm lớn được nhận vào 42 đơn vị chăm sóc đặc biệt trên khắp Hoa Kỳ, tần suất thông khí cơ học là 47% (Seneff 1995). Mặc dù các chuyên gia đã gợi ý sử dụng các thông số sinh lý trong việc đưa ra quyết định đặt nội khí quản cho một bệnh nhân nhưng vẫn chưa được thử nghiệm trong các nghiên cứu lâm sàng. Quyết định đặt nội khí quản phần lớn dựa trên sự đánh giá lâm sàng. Chỉ định bao gồm sự trao đổi khí xấu đi mặc dù đã can thiệp điều trị, ngừng tim, ngừng thở, suy hô hấp nghiêm trọng (chứng minh bằng thở nhanh, phập phồng cánh mũi, sử dụng cơ hô hấp phụ, co kéo khí quản, co lõm hỏm trên xương ức và liên sườn, mạch nghịch, vã mồ hôi) và mức độ ý thức thay đổi.
Trong nhiều trường hợp suy hô hấp cấp do COPD, NPPV có thể mang lại những lợi ích tương tự như đặt nội khí quản chuẩn và thông khí cơ học mà không có những biến chứng thường liên quan đến thở máy. Kết quả là bệnh nhân điều trị với NPPV có thời gian nằm viện ngắn hơn, tỷ lệ mắc bệnh thấp hơn và có chi phí thấp hơn (Honrubia 2005). Cơ sở dữ liệu Cochrane của Ram và các đồng nghiệp (2004) kết luận rằng NPPV cải thiện tử vong, giảm nhu cầu đặt nội khí quản và giảm các thất bại điều trị.
Trong tất cả các tham số pH có thể là biến quan trọng nhất trong dự đoán thành công hay thất bại của NPPV. Trong một nghiên cứu quan sát 1033 bệnh nhân liên tiếp được điều trị bằng NPPV vì COPD trầm trọng, điểm số hôn mê Glasgow < 11, điểm số APACHE II ≥ 29, tần số hô hấp ≥ 30 và độ pH < 7.25 khi nhập viện có liên quan đến nguy cơ đặt nội khí quản (70%) (Confalonieri 2005). Trong nghiên cứu này, sau 2 giờ NPPV, yếu tố chính ảnh hưởng đến kết quả là giá trị pH: nếu pH < 7.25, tỉ số chênh (odds ratio) của thất bại là 21. Trong một nghiên cứu tiền cứu khác của Shameem và các đồng nghiệp (2005), pH thấp hơn 7,26 lúc nhập viện dẫn đến tỷ lệ thất bại cao của NPPV (100 trong số 150 bệnh nhân cuối cùng cần đặt nội khí quản). Mặc dù rõ ràng là, làm giảm độ pH, tỷ lệ thất bại của NPPV càng cao, thì không có sự đồng thuận về điểm cắt (cutoff number). Có thể dự đoán rằng giá trị pH dưới 7,2 khi nhập viện sẽ có tỷ lệ thất bại cao của NPPV. Tuy nhiên, một giá trị pH không nên được sử dụng như là yếu tố quyết định duy nhất, nên được sử dụng kết hợp với các yếu tố khác như tình trạng tri giác của bệnh nhân, các bệnh lý kết hợp, tình trạng code của bệnh nhân …
Có thể có những trường hợp bệnh nhân đang ở đường biên. Trong những trường hợp như thế, đặt ống nội khí quản có thể được ưa thích sớm hơn khi không có cơ sở để theo dõi chặt chẽ bệnh nhân NPPV hoặc đặt nội khí quản cấp cứu. Mặt khác, có thể có những tình huống mà một NPPV có thể phải được sử dụng bất kể bệnh nhân nặng, ví dụ như, nếu bệnh nhân bị bệnh rất nặng, bệnh nhân có trạng thái “Do Not Intubate” (không đặt nội khí quản).
Lựa chọn bệnh nhân là một yếu tố quan trọng cho sự thành công của NPPV. Khởi đầu sớm kết hợp với kết cục tốt hơn (Celikel 1998). Nói chung bệnh nhân trẻ, hợp tác, có tăng CO2 máu vừa phải (PCO2 45 đến 90), toan máu vừa phải (từ 7,1 đến 7,3) là những người sẽ được lợi nhiều nhất (Evans 2001). Bệnh nhân đã thất bại hoặc không thể chịu được thông khí không xâm lấn, hoặc có chống chỉ định (Bảng 1) đối với thông khí không xâm lấn nên được đặt nội khí quản và thông khí cơ học.
| Bảng 1: Chống chỉ định của NPPV |
|
Sinh lý hô hấp – Respiratory physiology
Trong các đối tượng bình thường, nếu không có nỗ lực hô hấp, phổi sẽ nằm ở điểm dung tích cặn chức năng (FRC, functional residual capacity) hoặc thể tích thư giãn (Vrel, relaxation volume). Điểm tại đó xảy ra điều này được xác định bởi sự cân bằng giữa sự co lại đàn hồi của phổi vào phía trong và sự đàn hồi ngược lại của khung lồng ngực (chủ yếu là do trương lực cơ). Áp lực trong màng phổi (Ppl) tại thời điểm này là từ -3 đến -5 cm nước. Để tạo ra một cử động hô hấp hai yếu tố phải được vượt qua:
Sức cản đường thở – Resistance
Sức cản đường thở được mô tả như là tắc nghẽn luồng không khí cung cấp bởi đường dẫn khí, chủ yếu từ các đường thở lớn hơn (xuống đến phân nhánh thứ 6-7). Điều này là do tổng diện tích mặt cắt ngang của đường hô hấp trên nhỏ hơn nhiều so với tổng diện tích mặt cắt ngang đường thở nhỏ hơn vì đường thở nhỏ hơn có rất nhiều. Khu vực mặt cắt ngang mở rộng với mỗi bộ phận của đường thở và ở thế hệ 16 khoảng 300 cm2 so với 2,5 cm2 ở khí quản. Điều này dẫn đến giảm cả sức cản đường thở và vận tốc không khí. Chống lại lưu lượng của đường thở có trong cả hít vào lẫn thở ra và năng lượng cần thiết để khắc phục nó phản ánh công thở thực tế (WOB) (Hình 1).
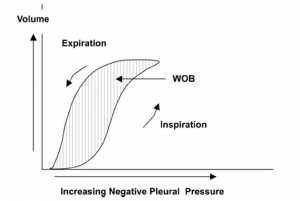
Độ giãn nở – Compliance
Trong một bối cảnh lâm sàng, điều này đề cập đến độ giãn nở kết hợp của phổi và thành ngực. Đó là sự thay đổi thể tích cho mỗi đơn vị áp lực thay đổi. Khi độ giãn nở thấp, cần nhiều nỗ lực hơn để làm phồng phổi lên. Độ giãn nở cũng khác nhau tùy thuộc vào mức độ bơm phồng phổi, thường là đường cong hình sigmoid ở các đối tượng bình thường (hình 1).
Cơ học hô hấp trong COPD – Respiratory mechanics in COPD
Hai thay đổi sinh lý chính dẫn đến rối loạn hô hấp và suy hô hấp cấp ở bệnh nhân mắc bệnh phổi tắc nghẽn là:
1. Tăng sức cản đường thở: Bệnh nhân COPD đã tăng sức cản dòng khí thở ra. Trong COPD, các túi khí phế nang thông thường giữ cho đường thở nhỏ hơn mở qua lực hút hướng tâm, bị mất. Điều này dẫn đến hẹp đường hô hấp và xẹp lại đặc biệt là khi thở ra. Trong người bình thường, trong quá trình thở ra thụ động, áp lực trong màng phổi là âm tính. Trong COPD áp lực trong màng phổi có thể dương tính trong quá trình thở ra do việc huy động các cơ thở ra. Khi xuất hiện thở ra, sức cản đường thở tăng thêm do bị nén từ áp lực trong màng phổi dương tính xung quanh. Điều này làm cho đường dẫn khí bị xẹp xuống. Ngay sau khi sự xẹp đường dẫn khí xảy ra, áp lực trong phế nang được truyền đến đoạn bị xẹp và đường thở lại mở ra vì áp lực phế nang (Palv) vượt quá áp lực màng phổi (Ppl) (Bernasconi 1998, West 2000).
Trong đợt kịch phát cấp tính, các đường hô hấp đã hẹp lại có thể bị tổn thương hơn nữa bởi các chất tiết tăng lên, phù nề niêm mạc và viêm quanh phế quản. Hằng số thời gian để làm rỗng phổi do đó kéo dài và thể tích phổi cuối thì thở ra tăng lên tự động. Hơn nữa, trong cơn kịch phát, bệnh nhân có khuynh hướng thở nhanh, hạn chế hơn nữa thời gian có thể để làm rỗng phổi, do đó càng tăng thêm quá trình căng phổi động (DHI, dynamic hyperinflation) trong một chu kỳ luẩn quẩn. Trên thực tế, bất kỳ sự gia tăng đột ngột nào về thông khí (như xảy ra với lo âu hoặc thiếu oxy máu thoáng qua) có thể liên quan đến DHI ở những bệnh nhân bị giới hạn lưu lượng.
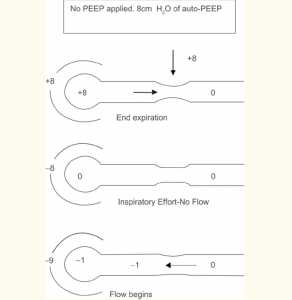
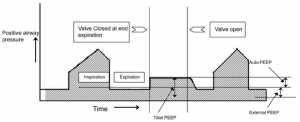
2. Quá căng phổi động (DHI): Khi có sự gia tăng sức cản của luồng khí thở ra, thời gian sẵn có (thời gian thở ra) để làm trống lượng khí hít vào có thể không đủ. Hít vào tiếp theo có thể bắt đầu trước khi hoàn thành thở ra dẫn đến bẫy khí (air trapping). Do đó, hệ thống hô hấp không thể trở lại mức thư giãn như bình thường của nó khi kết thúc thở ra. Điều này dẫn đến một trạng thái nghỉ ngơi mới, nơi FRC lớn hơn Vrel. Điều kiện bẫy khí này được gọi là DHI. Kết quả DHI cho thấy áp lực phế nang dương tính vào cuối thời gian thở ra còn được gọi là auto-PEEP (áp lực dương cuối kỳ thở ra tự động) (Rossi 1995, Ranieri 1996). Ban đầu PEEP tự động có thể có lợi cho việc giữ cho đường thở mở và do đó làm giảm sức cản đường thở. Tuy nhiên, PEEP tự động có nhiều nhược điểm:
- Tăng công thở (WOB): Việc hô hấp trong đợt cấp ở bệnh nhân COPD có thể được nâng thể tích phổi lên gần dung tích phổi toàn phần (TLC, total lung capacity) là do DHI. Mặc dù điều này tối ưu hóa lưu lượng của khí thở ra, nó có tác động gây hại cho việc buộc hệ thống hô hấp phải hoạt động trên phần phẳng của đường cong độ giãn nở, nơi mà áp lực tiến bộ tăng tạo ra sự thay đổi thể tích gia tăng nhỏ hơn. Nói cách khác, để bắt đầu luồng không khí, áp lực trong tử cung phải giảm xuống dưới 0, do đó phổi mở rộng và không khí chảy vào. Với sự có mặt của PEEP tự động, áp lực trong buồng tạo ra phải lớn hơn lượng PEEP tự động luồng không khí bắt đầu gây ra gánh nặng đáng kể cho việc hô hấp (Roussos 1982, Fluery 1985, Tobin 1998) (Hình 2A).
- Với sự hiện diện của DHI, phổi đang hoạt động ở một FRC cao hơn bình thường. Điều này làm cho cơ hô hấp hoạt động ở độ dài ngắn hơn bình thường. Điều này đặt cơ hô hấp, đặc biệt là cơ hoành ở một bất lợi cơ học đáng kể như bây giờ họ phải hoạt động trên phần phẳng của đường cong độ giãn nở (Braun 1982, Smith 1987). Khi cơ hoành ở mức thấp hơn trên thành ngực do quá căng phổi, khả năng hạ xuống trong khi hít vào sẽ bị suy giảm.
- PEEP quá mức có thể làm ảnh hưởng chức năng tim bằng nhiều cách. Tăng áp lực trong lồng ngực có thể dẫn đến giảm máu tĩnh mạch trở về tim và giảm độ giãn nở thất trái (Matthay 1980, Vizza 1998, Scharf 2002). Ngoài ra DHI làm tăng sức cản mao mạch phổi bằng cách nén các mao mạch phế nang dẫn đến gia tăng hậu tải thất phải (Mahler 1984, Oswald-Mammosser 1991). Những thay đổi này có thể dẫn đến hạ huyết áp đặc biệt là ngay sau khi đặt nội khí quản khi các yếu tố khác như thuốc an thần và tình trạng giảm thể tích máu có thể cùng tồn tại.
- Các khu vực của phổi quá căng có thể nén các khu vực phổi lân cận bình thường và gây ảnh hưởng xấu đến mối tương quan thông khí/tưới máu (Brandolese 1993, Rossi 1995)
- DHI và PEEP tự động có thể gây thúc đẩy bệnh nhân bị barotrauma – tràn khí màng phổi, tràn khí trung thất và tràn khí phúc mạc có thể xảy ra (Pepe 1982).
- Không nhận ra PEEP tự động và điều chỉnh nó có thể dẫn đến điều trị không thích hợp:
- Giải thích sai các kết quả đo áp lực tĩnh mạch trung tâm và áp lực động mạch phổi (Pepe 1982).
- Các tính toán không chính xác về độ giãn nở hô hấp tĩnh: giá trị thực sự của độ giãn nở tĩnh sẽ bị đánh giá thấp khi có PEEP tự động (Roussos 1982).
Quá căng phổi động cũng có thể xảy ra khi không có giới hạn luồng khí trong các bệnh nhân đặt nội khí quản thở máy. Nguyên nhân thường do tần số hô hấp nhanh, thể tích khí lưu thông cao, thời gian hít vào nhiều hơn thời gian thở ra, các ống nội khí quản nhỏ và ống bộ dây máy thở nhỏ (Scott 1986, Iotti 1997). Đôi khi PEEP tự động mà không có DHI có thể tồn tại ở những bệnh nhân có hoạt động quá mức của cơ hô hấp (Lessard 1995).
Xử trí – Management
Chiến lược thông khí – Ventilatory strategies Các chiến lược thông khí nhằm mục đích điều chỉnh sự bất thường về trao đổi khí, xác định và ngăn ngừa DHI. Thể tích phút phải được điều chỉnh theo độ pH (chứ không tùy thuộc theo PaCO2) và tránh tình trạng thông khí quá mức gây hậu quả là mất kiềm và giảm sự bù trừ của thận. Hiển thị dạng sóng thở máy liên tục rất hữu ích trong việc phát hiện và giám sát cơ học phổi.
Các dấu hiệu lâm sàng có ý nghĩa quan trọng trong việc phát hiện suy hô hấp, hoặc ở người thở tự nhiên hoặc những người được thông khí hỗ trợ. Chứng thở nhanh, nhịp tim nhanh, cao huyết áp, hoặc hạ huyết áp; giảm độ bão hòa ôxy động mạch; sử dụng các cơ hô hấp phụ; giảm hoặc không có âm thở trên một vùng của phổi; thở khò khè; không đồng bộ ngực-bụng; chuyển động của thành bụng nghịch lý trong khi hít vào; tím tái; không có khả năng kích hoạt máy thở; và ngưng thở có thể chỉ ra sự cần thiết phải can thiệp khẩn cấp hoặc điều chỉnh máy thở (Tobin 1988). Thường thì các dạng sóng có thể phát hiện những bất thường trước khi các dấu hiệu lâm sàng rõ ràng và do đó đóng một vai trò quan trọng trong việc quản lý bệnh nhân đặt nội khí quản.
Cài đặt thông khí ban đầu và chế độ sử dụng thường phụ thuộc vào điều hành và thực tiễn địa phương. Nhìn chung nồng độ khí lưu thông thấp từ 6 đến 10 ml/kg, FiO2 là 1,0, không có PEEP, hô hấp từ 10 đến 14 lần/phút và lưu lượng thở từ 80 đến 100 L/phút với dạng sóng vuông được coi là lý tưởng. Độ nhạy cảm trigger nên thấp nhất vì khi bệnh nhân có PEEP tự động có thể không tạo được áp lực đủ âm hoặc lưu lượng để trigger máy thở (Derenne 1988, Schmidt 1989).
Tác động của thời gian thở ra, thông khí phút và lưu lượng thở ra trên DHI
Các yếu tố quyết định quan trọng của DHI là thông khí tối thiểu, thể tích khí lưu thông, thời gian thở ra (TE), và mức độ nghiêm trọng của tắc nghẽn đường thở. Tuxen and Lane (Tuxen 1987) nghiên cứu các thiết lập khác nhau cho thông khí phút, thể tích khí lưu thông và thời gian thở ra trên DHI. Thông khí phút là yếu tố quyết định quan trọng nhất của DHI. Sự giảm TE (bằng cách giảm lưu lượng đỉnh) trong khi vẫn duy trì thông khí phút và thể tích khí lưu thông không đổi, làm tăng đáng kể thể tích cuối kỳ thở ra (VEE, end expiratory volume) cho thấy sự bẫy khí. Một hiệu ứng tương tự cũng được ghi nhận khi giảm TE bằng cách tăng tần số hô hấp. Tuy nhiên nếu sự suy giảm TE gây ra bởi sự gia tăng thể tích khí lưu thông và giảm tần số hô hấp trong khi giữ thông khí phút bình thường thì gia tăng không đáng kể VEE. Vì vậy, điều quan trọng là phải nhận ra rằng một sự điều chỉnh đơn giản về tỷ lệ hít vào:thở ra (I:E) là không đủ. Việc điều chỉnh thời gian thở ra tuyệt đối và thông khí phút là quan trọng hơn trong việc giảm bớt bẫy khí.
Lưu lượng thở ra cũng rất quan trọng để ngăn ngừa DHI (Hubmayr 1990). Với tốc độ lưu lượng thở ra thấp hơn thì phải mất nhiều thời gian để làm trống thể tích khí lưu thông; nhịp thở tiếp theo diễn ra trước khi phổi quay trở lại trạng thái nghỉ bình thường.
Nói chung, điều chỉnh các biện pháp sau đây có thể làm giảm PEEP tự động:
- Cung cấp thời gian thở ra dài nhất có thể.
- Giảm nhu cầu thông khí của bệnh nhân và thông khí phút.
- Giảm sức cản lưu lượng khí bằng thuốc giãn phế quản và steroid.
Tác động của áp lực đỉnh và áp lực bình nguyên
Áp lực đường thở đỉnh tăng cao dường như làm tăng nguy cơ bị barotrauma. Một số tác giả cho rằng áp lực đỉnh nên được giữ dưới 50 cm nước. Tuy nhiên, áp lực đường thở đỉnh cao không phản ánh áp lực ở cấp phế nang, đặc biệt ở những bệnh nhân bị tắc nghẽn dòng không khí. Nó đã được chỉ ra rằng áp lực đường thở đỉnh không tương quan với các biến chứng (Williams 1992, Slutsky 1993). Áp lực bình nguyên là một phép đo tốt hơn vì nó phản ánh áp lực thực tế của phế nang. Điều này có mối tương quan nhiều hơn với DHI và nguy cơ barotrauma. Ở bệnh nhân COPD, mục tiêu là giữ áp lực cao nguyên dưới 30 cm nước để giảm thiểu barotrauma. Điều này có thể đạt được bằng cách duy trì thể tích khí lưu thông thấp, thông khí phút thấp và sửa chữa PEEP tự động.
Thêm PEEP
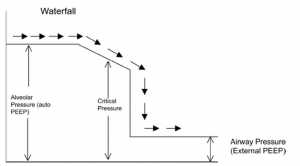
Sự hiện diện của PEEP tự động hoạt động như là một ngưỡng tải cho nỗ lực hô hấp của bệnh nhân (Fernandez 1988) (Hình 2B). Để giảm bớt những nỗ lực thở mà PEEP tự động áp đặt lên các cơ hô hấp, một PEEP bên ngoài có thể được áp dụng. Có vẻ như việc áp dụng PEEP bên ngoài là bất lợi khi đã có áp lực dương khi thở ra. Nghịch lý dường như có thể giải thích bằng cách tương tự như một dòng suối với thác (Tobin và Lodato 1989) (Hình 3). Trong sự tương tự này, dòng nước (luồng không khí) không bị ảnh hưởng cho tới khi dòng nước rơi xuống (PEEP bên ngoài) tăng lên trên áp lực tới hạn để co thắt đường dẫn khí. Ở trên mức này, PEEP bên ngoài có thể làm tăng áp lực thượng nguồn và làm cho DHI trở nên tồi tệ hơn. PEEP bên ngoài nên được giữ dưới 75% đến 85% PEEP tự động để tránh tình trạng quá căng phổi hoặc giảm huyết áp nặng hơn (Petrof 1990, Georgopoulus 1993, Ranieri 1993).
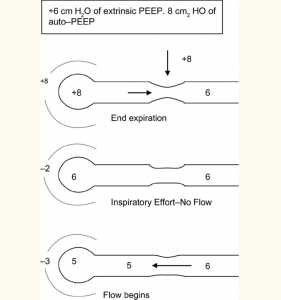
Trong một bệnh nhân có PEEP tự động, nếu máy thở được thiết lập để cung cấp cho bệnh nhân bắt đầu thở ra PEEP bên ngoài có thể giúp theo hai cách. Thứ nhất PEEP bên ngoài làm giảm ngưỡng hít vào do đó làm giảm công thở (Smith 1988). Thứ hai, nó hoạt động như một stent chống lại đường thở đóng, do đó tăng lưu lượng thở ra (Tobin và cộng sự, 1986) (giống như thở miệng trong bệnh nhân không đặt nội khí quản). Tuy nhiên, điều quan trọng cần lưu ý là trong một bệnh nhân an thần tốt, không thiếu oxy được thông khí cơ học có kiểm soát PEEP bên ngoài có thể không có lợi ngay cả khi có PEEP tự động trừ khi được chỉ ra vì các lý do khác ngoài DHI.
Xác định và đo auto-PEEP
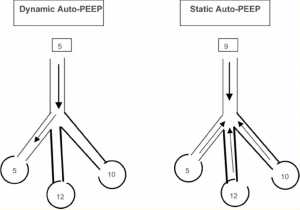
Static auto-PEEP
PEEP tự động tĩnh chỉ có thể được đo ở bệnh nhân mà không có nỗ lực hô hấp hoạt động. Điều này có thể thu được bằng cách sử dụng nút giữ cuối thì thở ra trên máy thở. Cách bố trí này cung cấp thời gian để cân bằng các đơn vị phổi có PEEP tự động khu vực khác nhau với máy thở. PEEP tự động có thể được tính bằng cách trừ PEEP bên ngoài khỏi tổng PEEP (Hình 4).
Dynamic auto-PEEP
Ở bệnh nhân thở tự nhiên, PEEP tự động được xác định bằng việc ghi lại cùng lúc áp lực thực quản và lưu lượng khí. PEEP tự động động được đo tại thời điểm thở ra như là cung lõm âm của áp lực thực quản đến điểm của lưu lượng bằng không. Auto-PEEP động thường thấp hơn auto-PEEP tĩnh vì auto-PEEP động phản ánh áp lực cuối thì thở ra của các đơn vị phổi với các hằng số thời gian ngắn và sự thở ra nhanh chóng, trong khi các đơn vị có hằng số thời gian dài vẫn trống (Haluszka 1990; Hernandez 1994 , Zakynthinos 1997, Younes 2000) (Hình 5). Hoạt động của cơ hô hấp, hoạt động của cơ bụng và đường hô hấp hẹp có thể gây ra các phép đo không chính xác về PEEP (Ninane 1992; Maltais 1994).
Đo resistance và compliance
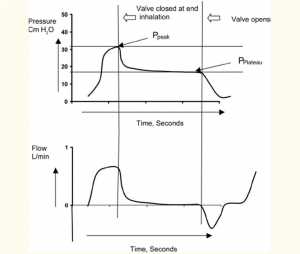
Những giá trị này thu được bằng cách nhanh chóng đóng cổng thở ra khi kết thúc hít vào. Điều này tạo ra sự giảm áp lực đỉnh và sau 3-5 giây áp lực tại máy thở và phế nang cân bằng, đó là áp lực cao nguyên (Hình 6).
Sự khác biệt giữa áp lực đỉnh và áp lực cao nguyên (Pplat) cho tổng sức cản của đường thở. Độ giãn nở được tính bằng cách sử dụng công thức:
Compliance = Tidal Volume/(Pplat − total PEEP)
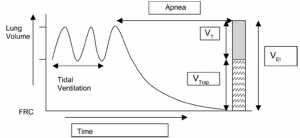
Đo thể tích bị bẫy
Bệnh nhân cần phải dùng thuốc liệt cơ và ngưng thở kéo dài khi đo. Tổng lượng thở ra được đo từ khi kết thúc hít vào cho đến khi không có sự thay đổi về thể tích phát hiện được (Hình 7). Tổng thể lượng khí thoát ra (được gọi là thể tích ở cuối thì hít vào) là tổng thể tích khí lưu thông và bất kỳ khí bị bẫy trên thể tích cặn chức năng. Nhu cầu dùng thuốc liệt cơ bệnh nhân để có được phép đo này là một vấn đề quan trọng đối với việc sử dụng kỹ thuật này thường xuyên. Hơn nữa, để đo chính xác thể tích ở cuối hít vào, thiết bị cần phải được nhạy cảm với tốc độ lưu lượng rất thấp. Tính thiết thực và tính liên quan đến lâm sàng của thủ thuật này là vấn đề gây tranh cãi cho việc xử trí tại giường bệnh nhân.
Cai máy
Khi nào bắt đầu cai máy thở chủ yếu phụ thuộc vào sự đánh giá lâm sàng của bác sĩ. Việc cai máy thở nên bắt đầu khi nguyên nhân của đợt kịch phát được điều trị đầy đủ và bệnh nhân ổn định về huyết động học. Các thông số sinh lý như thông khí phút (< 15 L), tần số hô hấp (< 30), thể tích khí lưu thông (> 325 ml), độ giãn nở động (> 22), độ giãn nở tĩnh (> 33), chỉ số thở nhanh nông (< 105) áp lực hít vào tối đa (<-15) có một số tiện ích để dự đoán khả năng duy trì sự thở tự nhiên của bệnh nhân (Fiastro 1988, Jabour 1991, Yang 1991, Eli 1996). Thử nghiệm thở tự nhiên hằng ngày (SBT) là một cách để xác định bệnh nhân ổn định để cai máy thở và nó có thể làm giảm số ngày ICU (Esteban 1995). Cai máy thở hỗ trợ áp lực (PSV) được sử dụng để giảm dần sự trợ giúp thở máy cơ học. Mặc dù PSV không được đánh giá cao so với SBT (Brochard 1994), nó có ưu điểm hơn là chế độ thông khí bắt buộc ngắt quãng đồng bộ (SIMV) (Brochard 1994, Nava 1998). Cai máy bằng NPPV đã được nghiên cứu trong một số nghiên cứu nhỏ (Girault 1999, Chen 2001, Hill 2000, Ferrer 2003). Phân tích gộp trong năm nghiên cứu này, với tổng số 171 bệnh nhân, được đặt nội khí quản chủ yếu trong COPD, kết luận rằng việc sử dụng NPPV để tạo điều kiện cho cai máy thở có liên quan đến những kết quả hứa hẹn nhưng không đủ để chứng minh lợi ích lâm sàng thực tế hiện nay (Burns 2006).
Các điểm chính của kỹ thuật thông khí tối ưu được tóm tắt trong Bảng 2.
| Bảng 2: Các điểm chính của kỹ thuật thông khí tối ưu trên bệnh nhân COPD |
|
Sedation
An thần là một phần quan trọng của thông khí cơ học. The Society of Critical Care Medicine đã công bố Hướng dẫn Thực hành lâm sàng cho việc sử dụng thuốc giảm đau và an thần (Jacobi 2002). Điều quan trọng là phải phân biệt giữa đau, kích động và mê sảng. Mức độ đau nên được đánh giá thông qua quan sát chủ quan các hành vi liên quan đến đau và báo cáo của bệnh nhân. Nếu cần giảm đau thì nên dùng fentanyl, morphine hoặc hydromorphone. Sự an thần cho bệnh nhân bị kích động phải được cung cấp chỉ sau khi các nhân tố gây bệnh như đau được điều trị đầy đủ. Benzoiazepine (Lorazepam, Midazolam) và propofol là các chất được ưu tiên. Nên chuẩn độ liều thuốc an thần cho một điểm cuối được xác định với việc giảm dần liều hoặc gián đoạn hàng ngày. Tầm quan trọng của việc cai nghiện opioid, benzo-diazepine và propofol nên được xem xét sau khi sử dụng kéo dài. Đối với bệnh nhân li bì haloperidol là chất được ưu tiên.
Chăm sóc tổng quát
Xử trí nội khoa các đợt kịch phát cấp tính bao gồm xác định và điều trị nguyên nhân làm trầm trọng cấp tính, sử dụng kháng sinh để điều trị nhiễm trùng, thuốc giãn phế quản, steroid, duy trì oxy hóa đầy đủ, hỗ trợ giúp làm sạch đàm tiết ra, ngăn ngừa các biến chứng của bất động và dinh dưỡng đầy đủ.
Kháng sinh
Kháng sinh điều trị cho đợt cấp tính vừa phải của viêm phế quản mạn tính và khí phế thũng nên được hướng đến S. pneumoniae, H. influenzae và M. catarrhalis, những mầm bệnh phổ biến nhất. Một phân tích gộp (Saint 1995) của chín thử nghiệm lâm sàng đã chứng minh lợi ích của liệu pháp kháng sinh trong việc xử trí COPD.
Steroids
Các đợt điều trị ngắn hạn của corticosteroid hệ thống có thể mang lại những lợi ích quan trọng cho bệnh nhân bị đợt cấp tính của COPD, FEV1 tăng một cách nhanh chóng, và thời gian nằm viện ngắn hơn đáng kể (Davies 1999; Niewoehner 1999).
Các thuốc giãn phế quản
Việc sử dụng cẩn thận thuốc giãn phế quản đã làm cải thiện triệu chứng và hạn chế luồng không khí (Cooper 2005, Sin 2005). Việc sử dụng các chất chủ vận beta2 kết hợp và các thuốc anticholinergic đã được tìm thấy để cung cấp thuốc giãn phế quản tác dụng phối hợp tốt hơn một ít so với việc sử dụng cả hai loại thuốc một mình (Bone 1994). Hoạt động của máy phun khí dung ngắt quãng hiệu quả hơn cho việc phun khí dung liên tục, bởi vì nó làm giảm tối đa lượng thải của khí dung trong khi thở ra (Dhand 2004).
Kết luận
Đợt cấp của COPD là một thực thể lâm sàng xảy ra. Hỗ trợ thở máy trong một bệnh nhân bị bệnh có thể là một biện pháp cứu mạng; tuy nhiên, thông khí cơ học có thể liên quan đến bệnh suất và tử vong đáng kể. Điều quan trọng là bác sĩ phải làm quen với sinh lý bệnh học và cơ học hô hấp trong COPD và hiểu được sự tắc nghẽn của khí thở ra và quá căng phổi động giúp chọn lựa các thông số thích hợp nhất. Các máy thở hiện đại thường hiển thị một số dạng sóng, áp lực và thể tích cho phép bác sĩ lâm sàng nhận diện được sự thay đổi tình trạng của bệnh nhân tại giường trước khi các dấu hiệu lâm sàng trở nên rõ ràng. Những dạng sóng và hình ảnh này là vô giá và phải được theo dõi thường xuyên để các mô hình bất thường có thể được xác định sớm hơn dẫn đến các can thiệp sớm.





