Bài viết Ảnh hưởng của tăng PaCO2 và nhiễm toan tăng CO2 máu trên tử vong bệnh viện ở bệnh nhân thở máy được dịch từ BS. Đặng Thanh Tuấn 1 từ bài viết gốc: Effects of Hypercapnia and Hypercapnic Acidosis on Hospital Mortality in Mechanically Ventilated Patients
1.Tóm tắt
Mục tiêu: Thông khí bảo vệ phổi được sử dụng để ngăn ngừa tổn thương phổi thêm ở bệnh nhân thở máy xâm lấn. Tuy nhiên, thông khí bảo vệ phổi có thể gây tăng CO2 máu và nhiễm toan tăng CO2 máu. Không có các nghiên cứu lâm sàng lớn đánh giá tác động của tăng CO2 máu và nhiễm toan tăng CO2 máu ở bệnh nhân cần thở máy.
Thiết kế: Nghiên cứu đa trung tâm, 2 quốc gia, hồi cứu nhằm đánh giá tác động của tăng CO2 máu bù trừ trừ và nhiễm toan tăng CO2 máu ở bệnh nhân được thông khí cơ học.
Cài đặt: Dữ liệu được trích xuất từ Australian and New Zealand Intensive Care Society Centre for Outcome and Resource Evaluation Adult Patient Database trong thời gian 14 năm, trong đó 171 ICU đã đóng góp dữ liệu không xác định.
Bệnh nhân: Bệnh nhân được phân loại thành ba nhóm dựa trên sự kết hợp giữa nồng độ pH và carbon dioxide (CO2 máu bình thường và pH bình thường, tăng CO2 máu bù trừ trừ [pH bình thường với carbon dioxide cao] và nhiễm toan tăng CO2 máu) trong 24 giờ đầu tiên ở ICU. Phân tích hồi quy logistic được sử dụng để xác định sự liên quan độc lập của tăng CO2 máu và nhiễm toan tăng CO2 máu với tỷ lệ tử vong tại bệnh viện.
Can thiệp: Không.
Các phép đo và kết quả chính: Tổng số 252.812 bệnh nhân (CO 2 máu bình thường và pH bình thường: 110,104 ca; tăng CO2 máu bù trừ trừ: 20,463 và nhiễm toan tăng CO2 máu: 122,245) được đưa vào phân tích. Bệnh nhân bị tăng CO2 máu bù trừ trừ và nhiễm toan tăng CO2 máu có điểm số APACHE III cao hơn (49,2 so với 53,2 so với 68,6; p <0,01).
Tỷ lệ tử vong cao hơn ở bệnh nhân nhiễm toan tăng CO 2 máu khi so sánh với các nhóm khác, với tỷ lệ tử vong thấp nhất ở bệnh nhân CO 2 máu bình thường và pH bình thường.
Sau khi điều chỉnh mức độ nghiêm trọng của bệnh, OR điều chỉnh tỷ lệ tử vong do bệnh viện tăng cao hơn ở bệnh nhân nhiễm toan tăng CO2 máu (tỷ lệ chênh, 1,74; KTC 95%, 1,62–1,88) và tăng CO2 máu bù trừ (OR, 1,18; KTC 95%, 1,10–1,26) khi so sánh với bệnh nhân bị CO2 máu bình thường và pH bình thường (p <0,001).
Ở những bệnh nhân nhiễm toan tăng CO2 máu, tử vong tăng lên khi tăng PCO2 cho đến 65 mm Hg sau đó tỉ lệ tử vong đạt bình nguyên.
2. Mở đầu
Suy hô hấp cấp tính là một trong những lý do phổ biến khiến bệnh nhân được nhận vào ICU. Việc quản lý suy hô hấp cấp tính thường bao gồm thông khí cơ học. Các tác động có hại của thông khí cơ học với thể tích khí lưu thông cao và áp suất cao được biết rõ (1, 2).
Các khuyến nghị hiện tại trong việc quản lý bệnh nhân suy hô hấp nặng, đặc biệt là với hội chứng suy hô hấp cấp (ARDS), là thực hành thông khí bảo vệ phổi (1). Hơn nữa, một số nghiên cứu đã tuyên bố rằng thông khí “siêu” bảo vệ phổi có thể làm giảm tổn thương phổi hơn là đạt được thông khí bảo vệ phổi (3).
Chiến lược bảo vệ phổi có thể gây ra chứng tăng CO2 máu cấp tính nhẹ đến trung bình và nhiễm toan, nhưng hiện nay nó được chấp nhận là chăm sóc tiêu chuẩn. Tác dụng của tăng CO2 máu và nhiễm toan tăng CO2 máu chưa được biết rõ.
Một số tác giả đã cho rằng tăng CO2 máu và toan máu có thể tự bảo vệ, độc lập với thông khí thể tích thấp và có thể hỗ trợ trong việc giảm tỷ lệ tử vong (4–7). Thật vậy, họ đã đưa ra giả thuyết rằng gây tăng CO2 máu bằng carbon dioxide bổ sung có thể có lợi cho bệnh nhân bị suy hô hấp cấp tính (5).
Ngược lại, các bác sĩ lâm sàng khác xem xét nhiễm toan tăng CO2 máu là có hại (1, 8). Có dữ liệu lâm sàng ít ỏi để đánh giá ảnh hưởng của nhiễm toan tăng CO2 máu và tăng CO2 máu bù trừ vào tỷ lệ tử vong của bệnh viện.
Với sự không chắc chắn, chúng tôi nhằm mục đích xem xét lại sự kết hợp của chứng tăng CO2 máu và nhiễm toan tăng CO2 máu trên tử vong tại bệnh viện ở những bệnh nhân thở máy.
3. Phương pháp
Chúng tôi đã tiến hành đánh giá hồi cứu tất cả bệnh nhân thở máy trong thời gian 14 năm (từ tháng 1 năm 2000 đến tháng 12 năm 2013) đã nhận vào 171 ICU ở Úc và New Zealand. Dữ liệu được thu thập từ ANZICS APD, là cơ sở dữ liệu chất lượng cao do trung tâm ANZICS quản lý để đánh giá kết quả và tài nguyên.
Nó thu thập thông tin bệnh nhân đầy đủ cần thiết để tính toán mức độ nghiêm trọng của bệnh nhân trong 24 giờ đầu tiên nhập viện ICU (9) từ hơn 80% ICU trên khắp nước Úc và New Zealand như một phần của quá trình đảm bảo chất lượng và đánh dấu giữa các ICU tham gia. Phê chuẩn đạo đức được lấy từ Ủy ban Đạo đức Nghiên cứu Đại học Monash.
Ủy ban đạo đức từ bỏ sự đồng ý của bệnh nhân khi dữ liệu được thu thập như là một phần của quá trình đo điểm chuẩn đảm bảo chất lượng thường xuyên cho các ICU tham gia.
Bệnh nhân người lớn bị suy hô hấp, nhận được thông khí cơ học trong 24 giờ đầu tiên nhập viện vào ICU, đã được đưa vào nghiên cứu. Đối với phân tích này, chúng tôi sử dụng khí máu động mạch cung cấp điểm số cao nhất về APACHE II và vì vậy có khả năng biểu hiện sự kết hợp pH/PCO2 tồi tệ nhất trong 24 giờ đầu tiên nhập học ICU.
Bệnh nhân được phân loại thành ba nhóm dựa trên sự kết hợp giữa độ pH động mạch và nồng độ carbon dioxide động mạch (CO2 máu bình thường [PCO2, 35–45 mm Hg] và pH bình thường [7,35-7,45] [nhóm 1], tăng CO2 bù trừ [pH bình thường (7,35– 7,45) với carbon dioxide cao (PCO2> 45 mm Hg)] [nhóm 2], và nhiễm toan tăng CO2 máu [PCO2> 45 mmHg; pH <7,35] [nhóm 3]) trong 24 giờ đầu tiên ở ICU.
Bệnh nhân bị nhiễm toan chuyển hóa, nhiễm kiềm chuyển hóa và nhiễm kiềm đường hô hấp đã được loại trừ. Bệnh nhân ở nhóm 1 được coi là một nhóm đối chứng mà bệnh nhân ở nhóm 2 và 3 được so sánh.
Mô hình tử vong và quản lý tần số thở trên thông khí cơ học (như một dấu hiệu thay thế cho thông khí thể tích khí lưu thông thấp hơn [1]) được nghiên cứu thêm bằng cách phân tầng dữ liệu thành ba khoảng thời gian (2000-2004, 2005– 2009 và 2010– 2013) để cho phép xác định mức độ tử vong và tần số thở đã thay đổi như thế nào theo thời gian.
Tất cả các phân tích được thực hiện bằng cách sử dụng phiên bản SAS 9.4 (SAS Institute, Cary, NC). Dữ liệu ban đầu được đánh giá về tính bình thường. Việc so sánh nhóm được thực hiện bằng cách sử dụng các phép đo chi bình phương cho tỷ lệ bằng nhau, phân tích phương sai cho các biến phân phối bình thường, và các phép thử Kruskal-Wallis nếu không, với kết quả được báo cáo là phần trăm (n), trung bình (sds) và trung vị (khoảnginterquartile), tương ứng.
Để điều tra hiệu ứng độc lập của tăng CO2 máu và nhiễm toan tăng CO2 máu trên tử vong của bệnh viện, mô hình hồi quy logistic đa biến được sử dụng để điều chỉnh cho các biến số được xác định trước (mức độ nghiêm trọng của bệnh nhân, năm nhập viện và vị trí), với những thay đổi hàng năm được xác định bởi các tương tác phù hợp giữa nhóm và năm nghiên cứu, với năm được xử lý ban đầu như là một biến phân loại và sau đó thứ hai là một biến liên tục khi tuyến tính được thiết lập.
Để xác định thêm mối quan hệ với mức độ nghiêm trọng của suy hô hấp, mô hình đa biến 12 loại được sử dụng với mỗi nhóm trong ba nhóm ban đầu được chia thành bốn nhóm tỷ lệ P/F (<100, 100–200, 200–300,> 300 với các loại tham chiếu là CO2 máu bình thường, pH bình thường với tỷ lệ P/F lớn hơn 300.
Thời gian lưu trú (thời gian lưu trú của bệnh viện và ICU) được ghi nhật ký và phân tích bằng các mô hình tuyến tính hỗn hợp một lần nữa điều chỉnh mức độ nghiêm trọng, năm nghiên cứu, và địa điểm có kết quả được trình bày dưới dạng phương tiện hình học (KTC 95%).
Để tạo điều kiện đo lường mức độ nghiêm trọng của bệnh nhân độc lập với tăng CO2 máu, nguy cơ tử vong được dự đoán của từng bệnh nhân được tính toán theo phương pháp nguy cơ tử vong của Úc và New Zealand (9) với các thành phần của pH và oxy được loại bỏ.
ANZROD là mô hình dự báo tử vong được cập nhật cụ thể được hiệu chỉnh để sử dụng trong các ICU của ANZ được lấy từ các thành phần của hệ thống chấm điểm APACHE II và III với các biến chẩn đoán bổ sung và được chứng minh là có hiệu chuẩn và phân biệt đối xử tốt hơn APACHE III.
Với độ lớn của tập dữ liệu, để sắp xếp chặt chẽ hơn ý nghĩa thống kê và lâm sàng, giá trị p hai mặt của 0,01 được sử dụng để cho biết kết quả có ý nghĩa thống kê.
4. Các kết quả
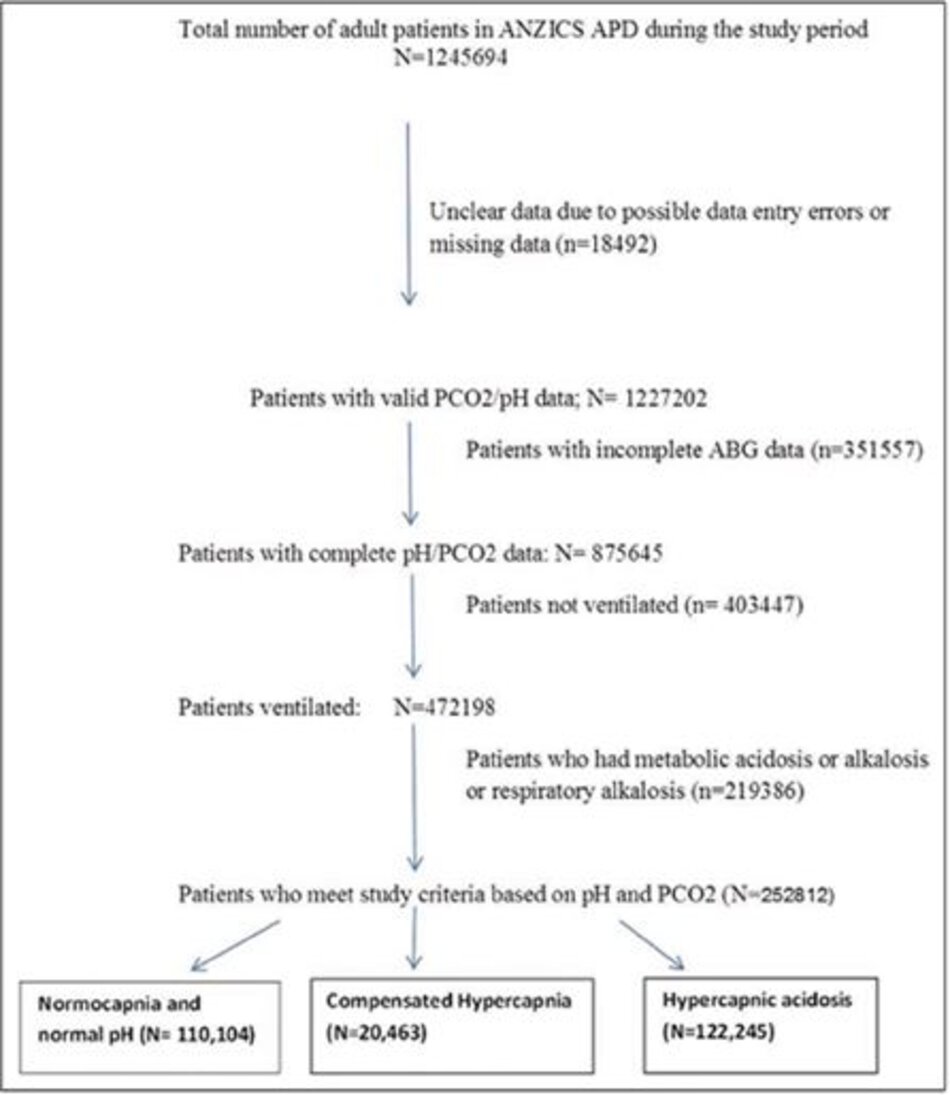
Tổng cộng có 252.812 bệnh nhân được đưa vào phân tích (Hình 1). Khi so sánh với bệnh nhân CO2 máu bình thường và pH bình thường, bệnh nhân bị tăng CO2 máu bù trừ trừ và nhiễm toan tăng CO2 máu lớn tuổi hơn, có tỷ lệ tăng bệnh hô hấp mãn tính, tim mạch và thận. Lý do phổ biến nhất để nhập viện vào ICU là chẩn đoán tim mạch bao gồm phẫu thuật tim sau, ngừng tim và sốc tim.
Bảng bổ sung 1 trình bày so sánh các biến sinh lý và xét nghiệm. Bệnh nhân bị tăng CO2 máu bù trừ và nhiễm toan tăng CO2 máu có sự khác biệt đáng kể về nhịp tim, huyết áp và nhiệt độ cũng như các xét nghiệm chức năng gan, thận được đo trong 24 giờ đầu tiên khi nhập viện ICU.
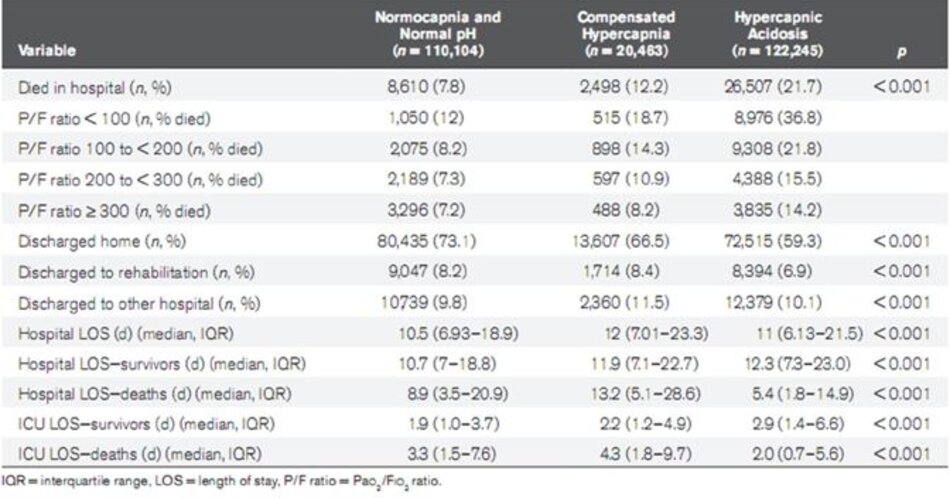
Đáng kể hơn nhiều bệnh nhân với tăng CO2 máu bù trừ và nhiễm toan tăng CO2 máu có tỷ lệ P/F thấp hơn và pH thấp hơn (Bảng bổ sung 2). Tỷ lệ tử vong của bệnh viện cao hơn và xuất viện thấp hơn ở những bệnh nhân bị tăng CO 2 máu bù trừ và nhiễm toan tăng CO2 máu (Bảng 2). Thời gian nằm viện và thời gian ở lại ICU cũng lâu hơn ở những bệnh nhân bị tăng CO2 máu bù trừ và nhiễm toan tăng CO2 máu (Bảng 2).
Phân tích hồi quy logistic đa biến cho thấy tỷ lệ chênh (OR) tăng cho tỷ lệ tử vong bệnh viện ở bệnh nhân tăng CO2 máu bù trừ và nhiễm toan tăng CO2 máu (tăng CO2 máu bù trừ: OR: 1,30, KTC 95%: 1,22–1,38; nhiễm toan tăng CO2 máu: OR: 1,66, KTC 95%: 1,60–1,72).
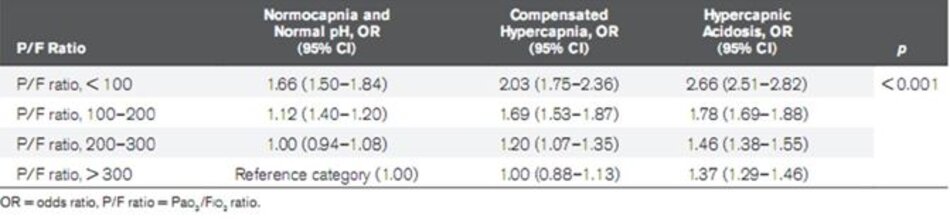
Tỷ lệ chênh điều chỉnh của tỷ lệ tử vong tại bệnh viện vẫn cao hơn đáng kể trong tăng CO2 máu bù trừ và nhiễm toan tăng CO2 máu khi so sánh với bệnh nhân CO2 máu bình thường và pH bình thường bất kể tỷ lệ P/F của họ (Bảng 3).
Tỷ lệ tử vong tăng (không phụ thuộc vào tỷ lệ P/F) được ghi nhận ở bệnh nhân nhiễm toan tăng CO2 máu và tăng CO2 máu bù trừ trong ba giai đoạn phân tầng (2000–2004, 2005–2009 và 2010–2013) (Bảng bổ sung số 3). Trong ba khoảng thời gian phân tầng này, tỷ lệ thông khí cơ học được ghi nhận là đã tăng sau 2000-2004 (Bảng bổ sung 4).
Phân tích phân nhóm được thực hiện thêm dựa trên danh mục chẩn đoán đưa vào. Điều này cho thấy tỷ lệ chênh điều chỉnh tỷ lệ tử vong bệnh viện cao hơn ở bệnh nhân tăng CO2 máu bù trừ và nhiễm toan tăng CO2 máu ở tất cả các hạng mục chẩn đoán ngoại trừ bệnh nhân chấn thương nơi bệnh nhân tử vong thấp hơn được ghi nhận ở bệnh nhân tăng CO2 máu bù trừ (Bảng bổ sung nội dung số 5).
Ở những bệnh nhân bị tăng CO2 máu bù trừ, tử vong dần dần tăng lên khi tăng PCO2 cho đến PCO2 là 65 mm Hg sau đó một xu hướng giảm tỷ lệ tử vong đã được ghi nhận. Ở bệnh nhân nhiễm toan tăng CO2 máu, tỷ lệ tử vong tăng lên khi tăng PCO2 đến 65 mm Hg sau đó tỷ lệ tử vong đạt bình nguyên (Hình 2).
Trong giai đoạn nghiên cứu, giảm tỷ lệ tử vong đã được ghi nhận trong cả ba nhóm từ năm 2000 đến năm 2013 (Nội dung số bổ sung 6; từ năm 2000 đến năm 2013 ở tất cả các nhóm).
Tuy nhiên, không có bằng chứng cho thấy sự sụt giảm về tỷ lệ tử vong theo thời gian khác nhau giữa các nhóm (CO2 máu bình thường và pH bình thường: OR, 0,96 [0,96–0,97], tăng CO2 máu bù trừ: OR, 0,95 [0,94–0,96], nhiễm toan tăng CO2 máu: OR, 0,96 [0,96–0,96]; p = 0,12).
5. Thảo luận
Kết quả chính của nghiên cứu này cho thấy bệnh nhân nhiễm toan tăng CO2 máu và tăng CO2 máu bù trừ lúc nhập viện có tỷ lệ tử vong cao hơn khi so sánh với bệnh nhân có pH bình thường và chứng mất ngủ bình thường.
Tỷ lệ tử vong gia tăng này tiếp tục tồn tại sau khi điều chỉnh các biến đóng góp chủ yếu vào tử vong của bệnh viện như mức độ nghiêm trọng của bệnh, vị trí của ICU và khung thời gian khi bệnh nhân được nhận vào ICU.
Hơn nữa, tỷ lệ tử vong được điều chỉnh vẫn cao đối với bệnh nhân bị tăng CO2 máu bù trừ và nhiễm toan tăng CO2 máu bất kể tỷ lệ P/F của chúng. Sự gia tăng tỷ lệ tử vong ở bệnh nhân nhiễm toan tăng CO2 máu và tăng CO2 máu bù trừ vẫn duy trì cao hơn trong suốt ba giai đoạn phân tầng.
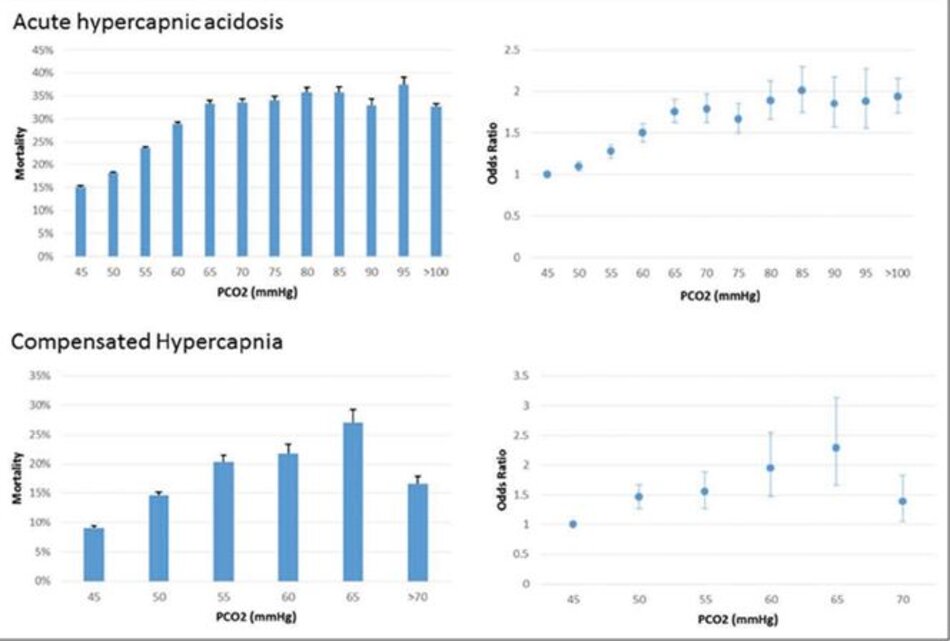
Nhìn chung, tỷ lệ tử vong ở cả ba nhóm đều giảm trong giai đoạn nghiên cứu 14 năm. Ở những bệnh nhân nhiễm toan tăng CO 2 máu, tỷ lệ tử vong tăng lên khi tăng PCO2 đến 65 mm Hg sau đó tỷ lệ tử vong đạt bình nguyên.
Mặc dù có những nghiên cứu đánh giá giảm CO2 máu và tăng CO2 máu cấp tính ở bệnh nhân viêm phổi do cộng đồng (10, 11), theo hiểu biết của chúng tôi, không có nghiên cứu lâm sàng lớn nào đánh giá ảnh hưởng của tăng CO 2 máu cấp tính hoặc tăng CO2 máu bù trừ ở bệnh nhân thở máy.
Các cơ chế đằng sau mối liên quan giữa tỷ lệ tử vong cao hơn ở bệnh nhân tăng CO2 máu và nhiễm toan tăng CO2 máu không rõ ràng và có khả năng khác nhau trong tăng CO2 máu cấp tính (thường được ghi nhận ở những bệnh nhân không mắc bệnh phổi mãn) và toan hô hấp khi so sánh với tăng CO2 máu bù trừ (thường thấy ở bệnh nhân với bệnh phổi mãn tính) không có nhiễm toan.
Dường như tỷ lệ tử vong do bệnh viện tăng lên ở bệnh nhân nhiễm toan tăng CO2 máu và tăng CO2 máu bù trừ không thay đổi trong ba giai đoạn nghiên cứu phân tầng mặc dù tăng tần số hô hấp (một dấu hiệu thay thế cho việc sử dụng thông khí thể tích khí lưu thông thấp) phần sau của giai đoạn nghiên cứu.
Điều này có lẽ là do dữ liệu của chúng tôi bị giới hạn trong 24 giờ đầu tiên của ICU và có thể không phản ánh việc quản lý thông khí vượt quá 24 giờ lưu trú của ICU.
Các tác dụng có lợi của tăng CO2 máu được báo cáo chủ yếu trong các thí nghiệm trên động vật về chấn thương phổi và chưa được xác nhận trong các nghiên cứu lâm sàng (12). Các tác dụng sinh lý bệnh của tăng CO2 máu và nhiễm toan tăng CO2 máu có thể thay đổi trên các hệ thống cơ quan khác nhau (12).
Mặc dù có một số tác dụng sinh lý có lợi liên quan đến tăng CO 2 máu cấp tính (13, 14), có vẻ như từ nghiên cứu của chúng tôi rằng có thể có nhiều tác hại hơn tác dụng có lợi có thể góp phần làm tăng tỷ lệ tử vong của bệnh viện ở bệnh nhân thở máy.
Nó không rõ ràng từ nghiên cứu của chúng tôi là nguyên nhân gây tửvong gia tăng ở bệnh nhân nhiễm toan tăng CO2 máu và tăng CO2 máu bù trừ. Tuy nhiên, trong các thí nghiệm trên động vật, nhiễm toan tăng CO2 máu cho thấy làm tổn thương phổi trầm trọng hơn và gây mất ổn định huyết động, làm tổn thương nặng các tế bào biểu mô phế nang và giảm tổn thương vết thương trong các tế bào biểu mô phế nang (15– 17).
Nhiễm toan tăng CO2 máu cũng cho thấy ức chế cả đáp ứng miễn dịch bẩm sinh và thích ứng. Nó làm giảm sự di chuyển bạch cầu trung tính và đại thực bào ngoài việc ức chế thực bào. Nó cũng cho thấy làm giảm sự tiết của các cytokine tiền viêm như yếu tố hoại tử khối u α, interleukin (IL) -8, và IL-6 (18).
Nhiễm toan có liên quan đến sự gia tăng vi khuẩn ở một số mô hình nhiễm trùng. Axit hóa môi trường nuôi cấy đến pH 7,20 đã được chứng minh để tăng cường sự phát triển của Escherichia coli, và một hiệu ứng tương tự đã được ghi nhận trên một số loại vi khuẩn (19–21).
Trong các nghiên cứu lâm sàng, nhiễm toan tăng CO2 máu cấp tính đã được chứng minh là làm giảm lưu lượng máu thận (22) với tăng nhu cầu chạy thận nhân tạo (8). Những tác động này có thể làm tăng tỷ lệ tử vong và bệnh tật.
Nghiên cứu của chúng tôi cho thấy nhiễm toan tăng CO2 máu cấp tính trong vòng 24 giờ đầu tiên có liên quan đến tỷ lệ tử vong cao hơn.
Các kết quả tương tự cũng được ghi nhận ở những bệnh nhân viêm phổi do mắc phải cộng đồng, trong đó bệnh nhân tăng CO2 máu liên quan đến tử vong bệnh viện gia tăng (11).
Ảnh hưởng của tăng CO2 máu bù trừ được nghiên cứu chủ yếu ở những bệnh nhân bị bệnh phổi tắc nghẽn mãn tính (COPD). Kết quả là mâu thuẫn với một số nghiên cứu cho thấy tăng CO2 máu bù trừ là một yếu tố dự báo độc lập về tỷ lệ tử vong (23,24) và những người khác cho thấy không có sự gia tăng tỷ lệ tử vong như vậy (25).
Ảnh hưởng của tăng CO2 máu bù trừ khi không có COPD không được nghiên cứu kỹ. Trong tăng CO2 máu bù trừ bù bằng thực nghiệm, các tình nguyện viên khỏe mạnh cho thấy sự giảm hấp thụ oxy và khởi phát sớm sự trao đổi chất kỵ khí.
Hơn nữa, những người tham gia với tăng CO2 máu bù trừ cho thấy tình trạng sức khỏe xấu đi và khả năng làm việc với sự phát triển của toan hô hấp được bù (26). Việc ngoại suy những phát hiện này cho những bệnh nhân bị bệnh nặng là khó khăn, và cần nghiên cứu sâu hơn để hiểu được tác động của tăng CO2 mất bù ở những bệnh nhân bị bệnh nặng.
Một trong những phát hiện khác trong nghiên cứu của chúng tôi là OR của tỷ lệ tử vong của bệnh viện ở những bệnh nhân nhiễm toan tăng CO2 máu cấp tính tăng lên khi tăng PCO2 lên đến 65 mm Hg sau đó nó được cân bằng.
Điều này là khác ở bệnh nhân tăng CO2 máu bù trừ, nơi tỷ lệ tử vong do bệnh viện tăng lên khi tăng PCO2 lên đến 65 mm Hg sau đó có xu hướng giảm tỷ lệ tử vong. Những dữ liệu này phải được giải thích một cách thận trọng vì chỉ một tỷ lệ nhỏ bệnh nhân có PCO2 trên 65 mm Hg (13,5% ở nhóm nhiễm toan tăng CO2 máu cấp tính và 4,9% ở nhóm tăng CO2 máu bù trừ). Các tác động lâm sàng của những xu hướng này là không chắc chắn.
Các giải thích tiềm năng cho sự gia tăng tỷ lệ tử vong tiến triển nhưng không tuyến tính với mức tăng carbon dioxide bao gồm tác dụng phụ trực tiếp của tăng CO2 máu cấp tính (22, 27–29) với các hiệu ứng sinh lý khác nhau tùy thuộc vào mức độ cụ thể của PCO 2 (xem bên dưới), tiến trình bệnh lý trong cơ thể có ảnh hưởng trực tiếp đến tỷ lệ tử vong (ví dụ, thông qua thiếu oxy hoặc tiết cytokine viêm) nhưng biểu hiện gián tiếp như những thay đổi trong PCO2 hoặc sự thay đổi trong điều trị những người có mức độ PCO 2 cao hơn (ví dụ: sử dụng các liệu pháp thông khí bảo vệ khác hoặc sử dụng oxy hóa màng ngoài cơ thể trên hoặc dưới ngưỡng PCO2 65 mm Hg).
Giai đoạn bình nguyên của tỷ lệ tử vong với PCO 2 lớn hơn 65 mm Hg có thể là do thay đổi ảnh hưởng của carbon dioxide trên trương lực cơ trơn của động mạch, một bộ điều hòa của vi tuần hoàn.
Nghiên cứu của Nagi và Ward (30) về đáp ứng của cơ động mạch trên các tiểu động mạch cơ hoành theo mức tăng PCO2 cho thấy tăng CO2 máu lên đến 80 mm Hg làm tăng trương lực cơ. Tuy nhiên, với tăng CO 2 máu vượt quá 80 mm Hg, trương lực cơ trơn tiểu động mạch đã bị ức chế, một tác dụng ngược lại với tác dụng của tăng CO2 máu dưới 80 mm Hg.
Tuy nhiên, những phát hiện này chỉ được nghiên cứu trong các tiểu động mạch cơ hoành. Có thể là các tiểu động mạch trong các cơ quan khác có thể phản ứng khác với những ảnh hưởng của việc tăng CO2 máu.
6. Ý nghĩa học tập
Suy hô hấp cấp tính là một trong những nguyên nhân phổ biến cho việc nhập viện của bệnh nhân vào ICU. Mặc dù các tác dụng có lợi của thể tích thấp và thông khí áp suất thấp được biết rõ, tác dụng của chứng tăng CO2 máu do hậu quả của việc thông khí bảo vệ phổi là không rõ ràng.
Kết quả của các thí nghiệm trên động vật mâu thuẫn nhau (16, 17, 31–34). Hơn nữa, kết quả thử nghiệm đối chứng ngẫu nhiên không so sánh và so sánh nhỏ là không thuyết phục (8, 35–37). Nghiên cứu của chúng tôi cho thấy một mối liên hệ chặt chẽ với tỷ lệ tử vong do bệnh viện gia tăng ở bệnh nhân nhiễm toan tăng CO2 máu cấp tính.
Kết quả của chúng tôi tiếp tục hỗ trợ kiểm soát CO2 và pH được khuyến khích bởi các chiến lược thông khí thể tích khí lưu thông thấp được sử dụng trong nghiên cứu ARDSNet (1).
7. Điểm mạnh
Nghiên cứu của chúng tôi có một số điểm mạnh. Đầu tiên, nó liên quan đến hơn
250.000 bệnh nhân thở máy từ 171 ICU (chiếm khoảng 80% ICU) ở hai quốc gia, cho thấy những phát hiện của nó có thể khái quát cao đối với tất cả các ICU ở Úc và New Zealand. Nó cũng có khả năng kết quả có giá trị bên ngoài ở các nước phát triển khác với thực hành chăm sóc đặc biệt tương tự như Úc và New Zealand.
Cỡ mẫu lớn của nghiên cứu của chúng tôi cho phép xác định sự khác biệt nhỏ nhưng có ý nghĩa trong kết quả. ANZICS APD được công nhận là một cơ quan đăng ký lâm sàng chất lượng cao với chất lượng dữ liệu phong phú và được các tạp chí có tác động cao chấp nhận trên phạm vi quốc tế (38, 39).
Thu thập dữ liệu từ các ICU tham gia là mạnh mẽ và kiểm soát chất lượng với một từ điển dữ liệu được thiết lập để đảm bảo tính đồng nhất và chính xác của dữ liệu thu thập được.
8. Hạn chế
Nghiên cứu của chúng tôi là một nghiên cứu hồi cứu với những hạn chế cố hữu. Giá trị thấp nhất của APD-PaCO2 và pH được sử dụng trong phân loại bệnh nhân cho các nhóm so sánh được giới hạn trong 24 giờ sau khi nhập viện ICU.
Do đó, bệnh nhân có thể có nhiều khí máu bị rối loạn hơn (bất thường PaCO2 và pH) trước khi nhập viện ICU hoặc sau 24 giờ sau khi nhập viện ICU. Với cơ sở dữ liệu bao gồm dữ liệu thu thập được trong 24 giờ đầu tiên vào ICU, các tác động của khí máu trước khi tiếp nhận ICU, và sau 24 giờ nhập học ICU không thể được đánh giá trong nghiên cứu của chúng tôi.
Hơn nữa, không thể đánh giá ảnh hưởng của thông khí cơ học đến những thay đổi về pH và PCO2. Chúng tôi cũng không có sẵn dữ liệu trên những bệnh nhân được điều trị bằng hỗ trợ sự sống ngoài cơ thể có thể ảnh hưởng đến thăng bằng acid-base và trao đổi khí của bệnh nhân. Nghiên cứu tiếp tục bao gồm tất cả các bệnh nhân thở máy khi so sánh với các chẩn đoán cụ thể có thể có các kết cục khác nhau.
Tuy nhiên, ngay cả ở những bệnh nhân bị thiếu oxy máu nghiêm trọng (với ARDS có thể), trong đó bệnh tăng CO2 máu cao cho phép có thể được cho là có lợi, nghiên cứu của chúng tôi không cho thấy bất kỳ lợi ích nào của tăng CO2 máu và nhiễm toan tăng CO2 máu.
9. Kết luận
Nhiễm toan tăng CO2 máu và tăng CO2 máu bù trừ liên quan đến tử vong bệnh viện gia tăng, kéo dài thời gian của ICU và thời gian nằm viện. Tỷ lệ tử vong gia tăng đã được ghi nhận ngay cả sau khi điều chỉnh mức độ nghiêm trọng của bệnh, loại ICU và năm mà bệnh nhân được điều trị.
Một sự gia tăng về tỷ lệ tử vong đã được ghi nhận khi tăng PCO2 đến 65 mm Hg sau đó tỷ lệ tử vong không đổi. Với thiết kế được không kiểm soát, hồi cứu của nghiên cứu của chúng tôi, những kết quả này gợi ý một mối liên hệ nhưng không phải là nguyên nhân. Các nghiên cứu được kiểm soát tương lai có thể làm rõ thêm các tác động của nhiễm toan tăng CO2 máu và tăng CO2 máu bù trừ.
10. References
1. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med 2000; 342:1301–1308
2. Amato MB, Meade MO, Slutsky AS, et al: Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med 2015; 372:747–755
3. Terragni PP, Del Sorbo L, Mascia L, et al: Tidal volume lower than 6 ml/kg enhances lung protection: Role of extracorporeal carbon dioxide removal. Anesthesiology 2009; 111:826–835
4. Kavanagh BP, Laffey JG: Hypercapnia: Permissive and therapeutic. Minerva Anestesiol 2006; 72:567–576
5. Laffey JG, Kavanagh BP: Carbon dioxide and the critically ill–too little of a good thing? Lancet 1999; 354:1283–1286
6. Laffey JG, Tanaka M, Engelberts D, et al: Therapeutic hypercapnia reduces pulmonary and systemic injury following in vivo lung reperfusion. Am J Respir Crit Care Med 2000; 162:2287– 2294
7. Laffey JG, Engelberts D, Kavanagh BP: Buffering hypercapnic acidosis worsens acute lung injury. Am J Respir Crit Care Med 2000; 161:141–146
8. Stewart TE, Meade MO, Cook DJ, et al: Evaluation of a ventilation strategy to prevent barotrauma in patients at high risk for acute respiratory distress syndrome. Pressure- and Volume-Limited Ventilation Strategy Group. N Engl J Med 1998; 338:355–361
9. Paul E, Bailey M, Pilcher D: Risk prediction of hospital mortality for adult patients admitted to Australian and New Zealand intensive care units: Development and validation of the Australian and New Zealand Risk of Death model. J Crit Care 2013; 28:935–941
10. Laserna E, Sibila O, Aguilar PR, et al: Hypocapnia and hypercapnia are predictors for ICU admission and mortality in hospitalized patients with community-acquired pneumonia. Chest 2012; 142:1193–1199
11. Sin DD, Man SF, Marrie TJ: Arterial carbon dioxide tension on admission as a marker of in- hospital mortality in community-acquired pneumonia. Am J Med 2005; 118:145–150
12. Tiruvoipati R, Botha JA, Pilcher D, et al: Carbon dioxide clearance in critical care. Anaesth Intensive Care 2013; 41:157–162
13. Cullen DJ, Eger EI 2nd: Cardiovascular effects of carbon dioxide in man. Anesthesiology 1974; 41:345–349
14. Curley G, Laffey JG, Kavanagh BP: Bench-to-bedside review: Carbon dioxide. Crit Care 2010; 14:220
15. Pedoto A, Caruso JE, Nandi J, et al: Acidosis stimulates nitric oxide production and lung damage in rats. Am J Respir Crit Care Med 1999; 159:397–402
16. Lang JD Jr, Chumley P, Eiserich JP, et al: Hypercapnia induces injury to alveolar epithelial cells via a nitric oxide-dependent pathway. Am J Physiol Lung Cell Mol Physiol 2000; 279:L994–1002
17. Doerr CH, Gajic O, Berrios JC, et al: Hypercapnic acidosis impairs plasma membrane wound resealing in ventilator-injured lungs. Am J Respir Crit Care Med 2005; 171:1371–1377
18. Coakley RJ, Taggart C, Greene C, et al: Ambient pCO2 modulates intracellular pH, intracellular oxidant generation, and interleukin-8 secretion in human neutrophils. J Leukoc Biol 2002; 71:603–610
19. Curley G, Contreras MM, Nichol AD, et al: Hypercapnia and acidosis in sepsis: A double- edged sword? Anesthesiology 2010; 112:462–472
20. Pugin J, Dunn-Siegrist I, Dufour J, et al: Cyclic stretch of human lung cells induces an acidification and promotes bacterial growth. Am J Respir Cell Mol Biol 2008; 38:362–370
21. Casalino-Matsuda SM, Nair A, Beitel GJ, et al: Hypercapnia inhibits autophagy and bacterial killing in human macrophages by increasing expression of Bcl-2 and Bcl-xL. J Immunol 2015; 194:5388–5396
22. Bersentes TJ, Simmons DH: Effects of acute acidosis on renal hemo-dynamics. Am J Physiol 1967; 212:633–640
23. Ahmadi Z, Bornefalk-Hermansson A, Franklin KA, et al: Hypo- and hypercapnia predict mortality in oxygen-dependent chronic obstructive pulmonary disease: A population-based prospective study. Respir Res 2014; 15:30
24. Chailleux E, Fauroux B, Binet F, et al: Predictors of survival in patients receiving domiciliary oxygen therapy or mechanical ventilation. A 10-year analysis of ANTADIR Observatory. Chest 1996; 109:741–749
25. Oga T, Taniguchi H, Kita H, et al: Analysis of the relationship between health status and mortality in hypercapnic patients with noninvasive ventilation. Clin Respir J 2015 Nov 25. [Epub ahead of print]
26. Apanasenko GL, Shchegolev VS, Kuleshov VI: [Tolerance for controlled physical loading in chronic hypercapnia in man]. Kosm Biol Aviakosm Med 1978; 12:49–52
27. Beekley MD, Cullom DL, Brechue WF: Hypercapnic impairment of neuromuscular function is related to afferent depression. Eur J Appl Physiol 2004; 91:105–110
28. Juan G, Calverley P, Talamo C, et al: Effect of carbon dioxide on diaphragmatic function in human beings. N Engl J Med 1984; 310:874–879
29. Shiota S, Okada T, Naitoh H, et al: Hypoxia and hypercapnia affect contractile and histological properties of rat diaphragm and hind limb muscles. Pathophysiology 2004; 11:23–30
30. Nagi MM, Ward ME: Modulation of myogenic responsiveness by CO2 in rat diaphragmatic arterioles: Role of the endothelium. Am J Physiol 1997; 272 (3 Pt 2):H1419–H1425
31. Costello J, Higgins B, Contreras M, et al: Hypercapnic acidosis attenuates shock and lung injury in early and prolonged systemic sepsis. Crit Care Med 2009; 37:2412–2420
32. Sinclair SE, Kregenow DA, Lamm WJ, et al: Hypercapnic acidosis is protective in an in vivo model of ventilator-induced lung injury. Am J Respir Crit Care Med 2002; 166:403–408
33. Takeshita K, Suzuki Y, Nishio K, et al: Hypercapnic acidosis attenuates endotoxin-induced nuclear factor-[kappa]B activation. Am J Respir Cell Mol Biol 2003; 29:124–132
34. Vohwinkel CU, Lecuona E, Sun H, et al: Elevated CO(2) levels cause mitochondrial dysfunction and impair cell proliferation. J Biol Chem 2011; 286:37067–37076
35. Brochard L, Roudot-Thoraval F, Roupie E, et al: Tidal volume reduction for prevention of ventilator-induced lung injury in acute respiratory distress syndrome. The Multicenter Trail Group on tidal volume reduction in ARDS. Am J Respir Crit Care Med 1998; 158:1831–1838
36. Brower RG, Shanholtz CB, Fessler HE, et al: Prospective, randomized, controlled clinical trial comparing traditional versus reduced tidal volume ventilation in acute respiratory distress syndrome patients. Crit Care Med 1999; 27:1492–1498
37. Amato MB, Barbas CS, Medeiros DM, et al: Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med 1998; 338:347–354
38. Kaukonen KM, Bailey M, Pilcher D, et al: Systemic inflammatory response syndrome criteria in defining severe sepsis. N Engl J Med 2015; 372:1629–1638
39. Kaukonen KM, Bailey M, Suzuki S, et al: Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000-2012. JAMA 2014; 311:1308– 1316





