Giới thiệu chung
Lịch sử ra đời
Các Macrolide là một nhóm kháng sinh ức chế tổng hợp protein của vi khuẩn được ứng dụng nhiều trên lâm sàng. Kể từ khi phát hiện ra kháng sinh nhóm Macrolide đầu tiên là Erythromycin vào những năm 1950, cho đến nay nhiều loại kháng sinh nhóm Macrolide mới đã được bán tổng hợp, với những sự cải thiện về độ ổn định trong acid dịch vị, sinh khả dụng, các đặc tính dược động học khác cũng như phổ kháng khuẩn, với các đại diện nổi bật là Clarithromycin và Azithromycin. Hiện nay, nhiều kháng sinh nhóm Macrolide thế hệ 3 đã được nghiên cứu và phát triển để chống lại các chủng vi khuẩn đề kháng với các Macrolide thông thường.
Hợp chất đầu tiên được tìm ra có cấu trúc giống các kháng sinh nhóm Macrolide hiện nay là Pikromycin (tiền tố “pikro” trong tiếng Hy Lạp cổ có nghĩa là “đắng”, và quả thực Pikromycin có vị rất đắng). Pikromycin được phân lập từ một chủng xạ khuẩn Streptomyces vào năm 1950. Tuy vậy, hiện nay Pikromycin không được áp dụng trên lâm sàng. Sau đó, vào năm 1952, Erythromycin trở thành kháng sinh nhóm Macrolide đầu tiên được sử dụng trên lâm sàng. Erythromycin có nguồn gốc từ chủng xạ khuẩn Streptomyces erythraeus (sau này đổi tên thành Saccharopolyspora erythraea). Sau đó, do những bất lợi trong dược động học cũng như tác dụng không mong muốn, Erythromycin được cải tiến thành Clarithromycin và Azithromycin vào lần lượt những năm 1970 và 1980, với độ bền trong acid dịch vị cao hơn, sinh khả dụng tốt hơn, tác dụng không mong muốn ít hơn, khả năng thấm mô tốt hơn, thời gian bán thải dài hơn và cả phổ kháng khuẩn cũng có những thay đổi nhưng không nhiều. Ngoài Clarithromycin và Azithromycin, một số kháng sinh nhóm Macrolide khác cũng được phát triển vì những mục tiêu trên, nhưng sự sử dụng của chúng bị hạn chế hơn nhiều (đó là các trường hợp của Dirithromycin, Flurithromycin và Roxithromycin). Còn Tilmicosin thì chỉ được sử dụng trong thú y.
Ngoài chủng xạ khuẩn Streptomyces thì một số vi khuẩn thuộc chủng Micromonospora cũng có khả năng sản xuất một số Macrolide có 14 hoặc 16 nguyên tử trong vòng lactone.
Hiện nay, con đường chính để sản xuất kháng sinh Erythromycin vẫn là theo phương pháp lên men công nghiệp. Từ nguồn nguyên liệu này, người ta có thể bán tổng hợp ra Clarithromycin và Azithromycin.
Cấu trúc hóa học
Các kháng sinh nhóm Macrolide đều có một vòng lactone lớn và các phần đường liên kết với vòng lactone đó qua liên kết glycoside. Các nhóm đường này có thể là đường trung tính hoặc đường amin.
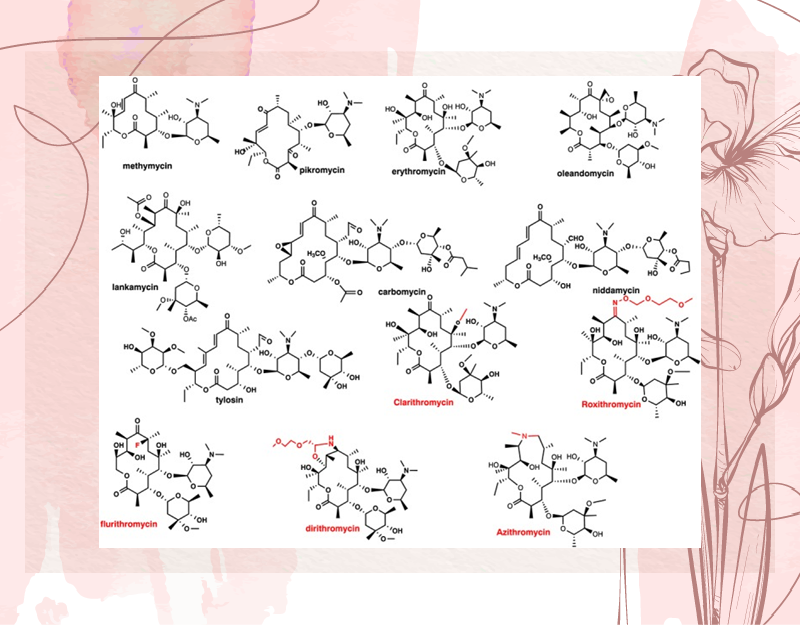
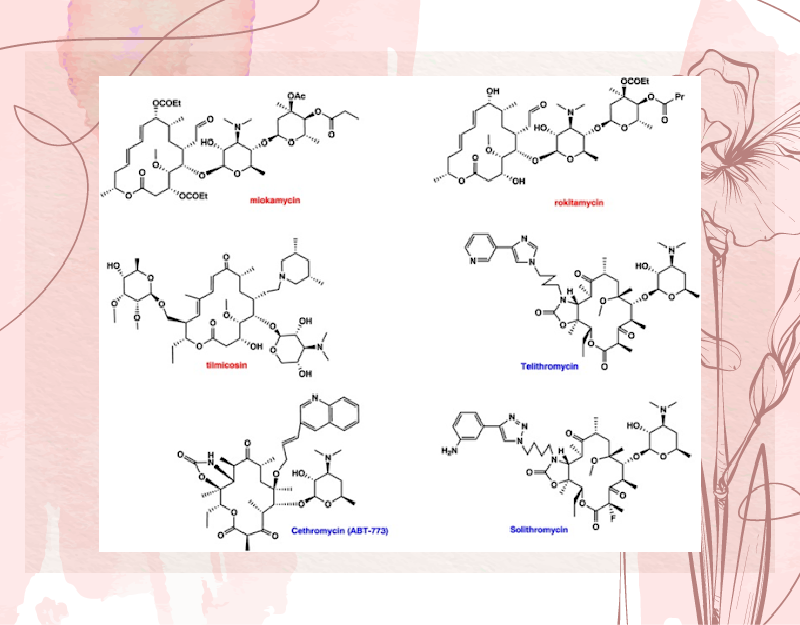
Các kháng sinh nhóm này thường được phân loại theo số nguyên tử trong vòng lactone:
- Macrolide 12 nguyên tử: Methymycin.
- Macrolide 14 nguyên tử: Pikromycin, Lankamycin, Erythromycin, Oleandomycin, Clarithromycin.
- Macrolide 15 nguyên tử: Azithromycin.
- Macrolide 16 nguyên tử: Tylosin, Carbomycin, Niddamycin.
Ngoài ra, hiện nay, cũng cần nói đến các kháng sinh Ketolide, một phân nhóm mới của kháng sinh nhóm Macrolide. Hiện nay phân nhóm này có 3 kháng sinh, bao gồm Telithromycin, Solithromycin và Cethromycin. Đây có thể gọi là nhóm các Macrolide thế hệ thứ 3, với phổ tác dụng rộng và giữ được hoạt tính trên nhiều chủng vi khuẩn đã kháng với các Macrolide thế hệ cũ. Hiện tại chỉ có Telithromycin là được cấp phép tại Hoa Kỳ. Cethromycin đã bị Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) Hoa Kỳ từ chối phê duyệt năm 2009, còn Solithromycin hiện tại vẫn chưa được phê duyệt, mặc dù nó được cho là Ketolide hứa hẹn nhất.
Dược lý học
Dược lực học
Cơ chế tác dụng
Khi nói về các kháng sinh nhóm Macrolide, người ta thường nghĩ ngay đến tác dụng kìm khuẩn của kháng sinh. Tuy nhiên, đó mới chỉ là một mặt của vấn đề. Các kháng sinh nhóm Macrolide không chỉ có tác dụng trên vi khuẩn, mà còn có tác dụng trên tế bào của cơ thể người! Đúng vậy, các kháng sinh nhóm Macrolide này có tác dụng trên tế bào người, nhưng điều này không giống như tác dụng của nó trên vi khuẩn. Nếu như trên vi khuẩn, kháng sinh ức chế sự phát triển của nó thông qua ức chế tiểu đơn vị ribosome 50S, thì ở tế bào người, kháng sinh nhóm Macrolide được sử dụng với mục đích khác, đó là mục đích chống viêm và điều biến miễn dịch.
a. Cơ chế kháng khuẩn
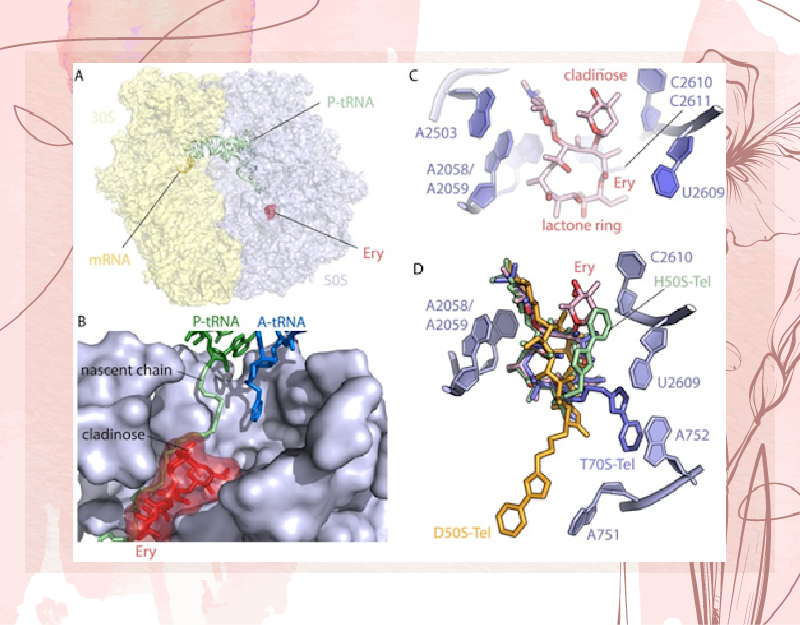
Các kháng sinh nhóm Macrolide ức chế sự phát triển của vi khuẩn thông qua ức chế tổng hợp protein của vi khuẩn. Để làm được điều này, nó ức chế trực tiếp thành phần quan trọng liên quan đến tổng hợp protein, đó là ribosome. Cụ thể, các kháng sinh nhóm Macrolide ức chế tiểu đơn vị ribosome 50S của vi khuẩn. Vị trí liên kết của các kháng sinh nhóm này với tiểu đơn vị ribosome 50S gần với trung tâm peptidyl transferase, ngay trên đường thoát ra của chuỗi peptide đang được tổng hợp. Các phân tử kháng sinh có khả năng liên kết với nucleotide A2058 của rARN 23S trong tiểu đơn vị ribosome 50S thông qua liên kết hydro giữa phần desosamine hydroxyl của kháng sinh và nguyên tử N1 của A2058. Vòng lactone của phân tử kháng sinh chịu trách nhiệm liên kết với các nucleotide số 2611 và 2057 thông qua liên kết kị nước.
b. Cơ chế chống viêm và điều biến miễn dịch
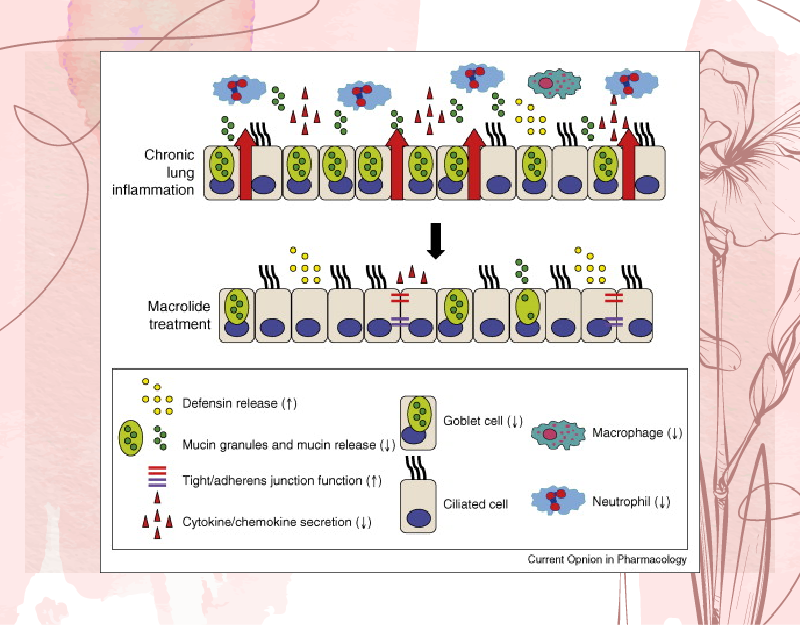
Đây là tác dụng được phát hiện ra sau tác dụng kháng khuẩn của các kháng sinh nhóm Macrolide, nó nhanh chóng được ứng dụng trong những bệnh liên quan đến viêm đường thở mạn tính, chẳng hạn như bệnh phổi tắc nghẽn mạn tính (COPD). So với thời gian sử dụng các Macrolide với vai trò như một kháng sinh thường ngắn, thời gian sử dụng các Macrolide với vai trò như một chất chống viêm và điều biến miễn dịch thường dài hơn, lên đến vài tháng.
Tác dụng trên bài tiết dịch nhầy đường thở
Các kháng sinh nhóm Macrolide đã được chứng minh là làm giảm bài tiết dịch nhầy đường thở, trong cả các thí nghiệm in vitro lẫn in vivo. Tác dụng làm giảm bài tiết nhầy này có hiệu quả ở cả các trường hợp viêm đường thở không phải do vi khuẩn gây ra. Điều này mang đến lợi ích cho những bệnh nhân mắc bệnh viêm đường thở mạn tính như COPD chẳng hạn.
- Tác động lên cơ chế vận chuyển ion: Các kháng sinh nhóm Macrolide làm ức chế kênh vận chuyển ion Cl- liên quan đến tác dụng của acetylcholine. Ức chế kênh ion này làm cho tác dụng của acetylcholine bị ức chế, điều này có nghĩa là tác dụng của hệ thần kinh phó giao cảm trên biểu mô đường thở bị ức chế, hay có nghĩa là tình trạng bài tiết nhầy giảm. Điều này giúp cho đường thở thông thoáng hơn. Tuy nhiên, cơ chế hoạt động này có vẻ không có tác dụng ở bệnh nhân xơ nang.
- Một số cơ chế khác làm giảm bài tiết chất nhầy bao gồm ức chế yếu tố hoại tử khối u α (“Tumor Necrosis Factor α” – thường viết tắt là TNF-α), giảm sự biểu hiện của mARN MUC5AC (quy định tổng hợp chất nhầy đường dẫn khí), ức chế sự phosphoryl hóa kinase 1/2 điều hòa tín hiệu ngoại bào (“Extracellular signal-Regulated Kinase 1/2” – thường gọi tắt là ERK1/2), ức chế tác dụng tự cảm ứng của N-3-oxododecanoyl homoserine lactone (3-oxo-C12-HSL, có nguồn gốc từ trực khuẩn mủ xanh Pseudomonas aeruginosa) thông qua sự phosphoryl hóa ERK1/2 và IκB, ức chế biểu hiện gen MUC5AC được cảm ứng bởi LPS (lipopolysaccharide), làm giảm sự phosphoryl hóa IκBα được cảm ứng bởi LPS và yếu tố tăng trưởng biến đổi α (“Transforming Growth Factor α” – thường được gọi tắt là TGF-α).
Tác dụng trên quá trình viêm:
– Ảnh hưởng trên sự chế tiết các cytokine: Các kháng sinh nhóm Macrolide làm giảm sản xuất các cytokine tiền viêm, mang lại lợi ích cho vật chủ. Cụ thể, chúng làm giảm bài tiết interleukin (IL)-8 và elastase, giảm nồng độ IL-1β và bạch cầu trung tính tại đường thở bị viêm, cho dù nguyên nhân gây viêm có phải do viêm hay không. Ức chế IL-8 giúp ức chế sự hóa ứng động bạch cầu trung tính mạnh. Các kháng sinh nhóm này cũng làm giảm sản xuất IL-6, TNF-α và GM-CSF (viết tắt của “Granulocyte-Macrophage Colony-Stimulating Factor”, thường được biết đến với cái tên “yếu tố kích thích quần thể bạch cầu hạt – đại thực bào”). Đặc biệt, Azithromycin làm giảm biểu hiện mARN TNF-α ở bệnh nhân xơ nang. Trên thực tế, các nhà khoa học thấy rằng lúc đầu, các kháng sinh nhóm Macrolide ban đầu kích thích sự chế tiết các cytokine tiền viêm, nhưng sau đó nhanh chóng bình thường hóa quá trình này. Các kháng sinh nhóm Macrolide cũng ức chế sự bài tiết eotaxin cũng như các cytokine gây hóa ứng động bạch cầu ái toan, giảm biểu hiện mARN eotaxin được cảm ứng bởi TNF-α, giảm giải phóng eotaxin từ nguyên bào sợi phổi. Các kháng sinh nhóm này cũng làm giảm sự bài tiết IL-4 và IL-5 từ tế bào lympho T, nhưng không làm ảnh hưởng đến nồng độ IL-2 và IFN-γ, từ đó làm tăng tỷ lệ nồng độ IFN-γ/IL-4 trong huyết thanh. Tuy nhiên, cũng có những nghiên cứu cho thấy sự mâu thuẫn về vấn đề này. Các thuốc này cũng cho thấy điều chỉnh chức năng tế bào tua, tuy nhiên khá khác nhau giữa các Macrolide khác nhau
– Clarithromycin có thể can thiệp vào chu kỳ tế bào biểu mô đường dẫn khí, cản trở sự chuyển từ pha G1 sang pha S, từ đó làm hạn chế sự tăng sinh tế bào biểu mô phế quản. Tóm lại, dữ liệu cho thấy các kháng sinh nhóm Macrolide mà vòng lactone có 14 hoặc 15 nguyên tử (không phải loại 16 nguyên tử) có thể làm tăng tiết các cytokine ban đầu, nhưng sau đó chúng làm giảm liên tục sự bài tiết các cytokine về mức bình thường.
– Giảm biểu hiện các phân tử kết dính: Các kháng sinh nhóm này làm giảm biểu hiện Mac-1 (CD11b/CD18) trên bạch cầu đa nhân trung tính, từ đó làm giảm tập trung bạch cầu tại đường dẫn khí. Ngoài ra, biểu hiện của L-selectin và ICAM-1 (viết tắt của “InterCellular Adhesion Molecule 1”, tức “phân tử kết dính gian bào 1”, còn có tên gọi khác là CD54) cũng bị giảm. Các Macrolide mà vòng lactone có 14 nguyên tử còn ức chế cảm ứng mARN VCAM-1 (viết tắt của “Vascular Cell Adhesion Molecule 1”, tức “phân tử kết dính tế bào mạch máu 1”) và từ đó ức chế sự di chuyển của bạch cầu đến biểu mô đường dẫn khí. Tóm lại, các kháng sinh nhóm Macrolide cho thấy làm giảm biểu hiện các phân tử kết dính, góp phần làm giảm tình trạng viêm ở đường dẫn khí.
– Tác dụng trên các tế bào tham gia vào quá trình viêm:
- Các kháng sinh nhóm Macrolide làm giảm hóa ứng động bạch cầu, làm giảm khả năng di chuyển của bạch cầu cũng như làm giảm hoạt động của bạch cầu tại vị trí viêm. Nguyên nhân có thể là do các thuốc này ảnh hưởng lên sự chế tiết các cytokine cũng như làm giảm biểu hiện các phân tử kết dính như đã nói ở trên.
- Như đã nói ở trên, các kháng sinh nhóm này có thể làm giảm bài tiết elastase của bạch cầu đa nhân trung tính, ngoài ra chúng cũng làm giảm metalloproteinase 9 (MMP-9) ở ma trận ngoại bào, từ đó làm hạn chế sự phá hủy đường thở. Nồng độ leukotriene B4 (LTB4) cũng giảm đáng kể, góp phần làm giảm số lượng cũng như hoạt động của bạch cầu. Biểu hiện và bài tiết endothelin-1 từ tế bào biểu mô phế quản người cũng bị ức chế khi sử dụng Erythromycin hoặc Clarithromycin. Các Macrolide cũng làm giảm sự co thắt cơ trơn phế quản thông qua ức chế giải phóng các chất dẫn truyền thần kinh, hoặc giảm đáp ứng của hệ thần kinh phó giao cảm trên cơ trơn phế quản.
- Các kháng sinh nhóm này cũng làm giảm sự sản xuất các loại oxy phản ứng (hay ROS, viết tắt của “Reactive Oxygen Species”) từ bạch cầu đa nhân trung tính, từ đó làm giảm tổn thương mô. Nguyên nhân có thể là do chúng làm ổn định màng tế bào bạch cầu, thông qua làm giảm tác dụng của các chất làm mất ổn định màng như lysophosphatidylcholine, yếu tố hoạt hóa tiểu cầu PAF (viết tắt của “Platelet-Activating Factor”) và lyso-PAF, đồng thời đi cùng với ức chế sản xuất các superoxide. Các kháng sinh nhóm này cũng kích thích sản xuất eNOS (NO synthase nội mô), làm giảm khả năng bám dính của bạch cầu vào tế bào nội mô, đồng thời chúng cũng ức chế iNOS (NO synthase cảm ứng).
- Các kháng sinh nhóm Macrolide có thể cảm ứng quá trình apoptosis (chết tế bào theo chương trình) ở các bạch cầu đa nhân trung tính đã hoạt hóa. Một số nghiên cứu khác lại cho thấy các thuốc nhóm này không làm bạch cầu chết, nhưng lại làm rút ngắn tuổi thọ của bạch cầu, thông qua ức chế các tế bào biểu mô đường dẫn khí bài tiết GM-CSF hoặc ức chế bạch cầu đã hoạt hóa giải phóng IL-8. Tuy vậy, các bằng chứng về hoạt hóa quá trình apoptosis trên bạch cầu của các thuốc nhóm này khá hạn chế.
- Các kháng sinh nhóm Macrolide thúc đẩy biệt hóa bạch cầu đơn nhân dòng THP-1 thành đại thực bào, giảm bài tiết các cytokine tiền viêm và tăng bài tiết IL-10 (một cytokine chống viêm).
– Tác dụng trên tế bào biểu mô đường dẫn khí:
- Các kháng sinh nhóm Macrolide ổn định màng tế bào biểu mô thông qua chống lại các phospholipase đã hoạt hóa. Chúng cũng làm tăng đáng kể mARN β-defensin-1 và β-defensin-2 cùng các protein, tuy vậy, kết quả không nhất quán giữa các nghiên cứu.
- Các kháng sinh nhóm này có thể điều hòa lên biểu hiện của P-gp (P-glycoprotein) tế bào biểu mô đường thở, đây có thể là nguyên nhân giúp cải thiện tình trạng phổi ở bệnh nhân xơ nang.
- Thụ thể giống Toll (“Toll-Like Receptor”, thường được viết tắt là TLR, đây là nhóm các thụ thể có khả năng phát hiện ra những phần cấu trúc đặc biệt của vi khuẩn): Các thuốc nhóm này làm giảm nồng độ mARN TLR4, đi kèm với ức chế sản xuất IL-8. Các nhà khoa học cho rằng các kháng sinh nhóm này có thể làm giảm biểu hiện hoặc chức năng của các TLR, nhưng đây không phải là cơ chế chính trong sự điều biến miễn dịch của các Macrolide.
– Tác dụng trên các tế bào khác:
- Các kháng sinh nhóm này có thể ức chế sự tăng sinh và di chuyển của nguyên bào sợi, giảm sự biểu hiện của IL-8 và NF-κB (viết tắt của “Nuclear Factor kappa B”, thường được gọi với các tên “yếu tố nhân kappa B”), giảm mARN eotaxin cảm ứng bởi TNF-α, giảm bài tiết eotaxin, ức chế sản xuất collagen. Các tác dụng này giúp hạn chế tái cấu trúc đường thở bằng các mô xơ (có lợi cho bệnh nhân viêm đường thở mạn tính).
- Các kháng sinh nhóm này cũng có thể ức chế yếu tố tăng trưởng nội mô mạch máu VEGF (viết tắt của “Vascular Endothelial Growth Factor”) được giải phóng từ nguyên bào sợi (do tình trạng thiếu oxy tế bào, hoặc có sự xuất hiện của TNF-α).
- Các kháng sinh nhóm này cũng có thể ức chế sản xuất MMP-2 và MMP-9 (cảm ứng bởi TNF-α) và giảm biểu hiện mARN MMP (nhờ ức chế NF-κB và AP-1 [viết tắt của “Activator Protein 1”, hay còn gọi là protein hoạt hóa 1]). Ức chế MMP làm phản ứng viêm không lan rộng.
- Trên các tế bào nội mô mạch máu, các Macrolide ức chế sự di chuyển của các tế bào này, giảm tân tạo mạch, giảm sản xuất VEGF (do TNF-α cảm ứng) thông qua ức chế NF-κB và AP-1.
Tác dụng trên các con đường truyền tín hiệu:
- Các kháng sinh nhóm Macrolide làm giảm dòng ion Ca2+ đi vào bên trong tế bào biểu mô, từ đó làm ức chế kênh Cl- hoạt hóa bởi Ca2+. Cơ chế hoạt động không rõ, nhưng điều này làm giảm bài tiết nhầy ở đường dẫn khí (đã nói ở trên). Người ta có biết đến một cơ chế làm giảm dòng ion Ca2+ vào bên trong tế bào, đó là giảm giải phóng histamine và giảm sản xuất prostaglandin D2 từ tế bào mast (được kích hoạt bởi β-defensin-2).
- Các protein kinase được hoạt hóa bởi mitogen (“Mitogen-Activated Protein Kinase”, còn gọi tắt với cái tên MAPK): Có 3 phân họ MAPK đã được xác định cụ thể là ERK (viết tắt của “Extracellular signal-Regulated Kinase”, có nghĩa là “kinase điều hòa tín hiệu ngoại bào), JNK (viết tắt của “c-Jun N-terminal Kinase”) và p38 MAPK. Các kháng sinh nhóm Macrolide có thể bình thường hóa hoạt động của nhiều MAPK, làm giảm nồng độ các cytokine tiền viêm và giảm các biểu hiện quá mẫn, điều hòa biểu hiện các gen quy định các cytokine gây viêm, điều hòa quá trình tăng sinh, biệt hóa và apoptosis tế bào… Con đường ERK1/2 có vẻ như là con đường chính mà các kháng sinh nhóm Macrolide tác động vào để điều biến miễn dịch.
- Các yếu tố phiên mã: Các kháng sinh nhóm này ức chế sự hoạt hóa của NF-κB và AP-1, ức chế giải phóng IL-8, ức chế biểu hiện của mARN IL-1, endothelin-1, iNOS và MUC5AC.
Chú ý: không phải tất cả các kháng sinh nhóm Macrolide đều có đầy đủ các cơ chế tác dụng trên. Mỗi loại kháng sinh sẽ có ưu thế trên một số cơ chế nhất định.
Phổ tác dụng
Các kháng sinh nhóm Macrolide có phổ tác dụng ưu thế trên các vi khuẩn gram dương, tác dụng trên các vi khuẩn gram âm hạn chế hơn. Các Macrolide có tác dụng rất tốt trên các chủng tụ cầu (Staphylococcus), liên cầu (Streptococcus) và Diplococcus, đều là các vi khuẩn gram dương. Một số chủng vi khuẩn gram âm mà kháng sinh nhóm này có tác dụng bao gồm lậu cầu (Neisseria gonorrhoeae), Haemophilus influenzae, Bordetella pertussis và não mô cầu (Neisseria meningitidis). Ngoài ra, các kháng sinh nhóm này cũng có phổ tác dụng trên một số chủng vi khuẩn không điển hình như Mycoplasma. Tác dụng của kháng sinh nhóm này lên tế bào nhân thực như cơ thể người là rất hạn chế, do ribosome trong tế bào nhân thực là 2 loại 40S và 60S, chứ không phải 2 loại 30S và 50S như vi khuẩn. Clarithromycin là một Macrolide khá đặc biệt, khi nó được sử dụng trong phác đồ điều trị viêm loét dạ dày – tá tràng có Helicobacter pylori dương tính và nhiễm trùng hô hấp do phức hợp Mycobacterium avium gây ra ở bệnh nhân AIDS.
Các kháng sinh thuộc phân nhóm Ketolide có hoạt tính vượt trội hơn các kháng sinh nhóm Macrolide thông thường về phổ tác dụng trên vi khuẩn gram dương, bao gồm phế cầu (Streptococcus pneumoniae) kháng Macrolide. Ngoài ra, trên các vi khuẩn gram âm, chúng thể hiện hoạt tính tốt trên H.influenzae và Moraxella catarrhalis. Trên các vi khuẩn không điển hình, chúng có hoạt tính tốt trên các chủng Mycoplasma pneumoniae, Chlamydia pneumoniae và Legionella pneumophila. Đây đều là các nhóm vi khuẩn phổ biến gây ra nhiễm trùng đường hô hấp. Sở dĩ các kháng sinh nhóm Ketolide có phổ tác dụng ưu việt hơn các kháng sinh nhóm Macrolide thông thường là do chúng không phải là cơ chất cho các bơm tống thuốc vi khuẩn, thêm vào đó chúng không gây ra hiện tượng cảm ứng đề kháng MLSB (Macrolide – Lincosamide – Streptogramine B). Các chủng tụ cầu và liên cầu tan huyết β nhóm A nếu đã có ribosome được methyl hóa thì sẽ không nhạy cảm với các Ketolide nữa.
Cơ chế đề kháng
Các vi khuẩn khác nhau có những cơ chế đề kháng khác nhau, nhưng nhìn chung thì cơ chế đề kháng với các kháng sinh nhóm Macrolide là vô cùng đa dạng. Có tổng cộng 4 kiểu cơ chế đề kháng của vi khuẩn với kháng sinh đã biết.
– Thay đổi đích tác dụng của kháng sinh: Điều này đồng nghĩa với việc thay đổi cấu trúc của tiểu đơn vị ribosome 50S của vi khuẩn. Để thay đổi được cấu trúc của tiểu đơn vị ribosome 50S của vi khuẩn, nhằm vẫn duy trì được chức năng của nó, đồng thời làm giảm ái lực gắn của nó với phân tử kháng sinh, có một số cách sau đây:
- Methyl hóa rARN 23S: Cách thứ nhất để thay đổi cấu trúc của tiểu đơn vị ribosome 50S của vi khuẩn, đó là methyl hóa rARN 23S thông qua methyl hóa một số nucleotide của nó nhờ enzyme methyltransferase. Vị trí bị methyl hóa trên rARN 23S là nucleotide A2058, cụ thể là nguyên tử N6. Sự methyl hóa có thể gắn thêm vào nguyên tử N này 1 hoặc 2 nhóm methyl (tức là phản ứng N-monomethyl hoặc N,N-dimethyl hóa). Các enzyme có chức năng như thế này được gọi tắt là Erm (viết tắt của “Erythromycin resistance methylase” – methylase kháng Erythromycin), và các gen quy định cho các enzyme cụ thể này được kí hiệu là ermA, ermB… Các gen erm này thường không nằm trên nhiễm sắc thể, mà thay vào đó, chúng nằm trên plasmid của vi khuẩn, cùng với nhiều gen kháng kháng sinh khác. Các gen erm này có thể được truyền từ vi khuẩn này qua vi khuẩn khác thông qua quá trình tiếp hợp. Trong khi các gen ermE và ermC quy định các enzyme xúc tác cho phản ứng methyl hóa 2 lần, thì ermN chỉ quy định các enzyme xúc tác cho phản ứng methyl hóa 1 lần. Có một điều khá thú vị là một trong những gen erm được phát hiện đầu tiên, ermE, có nguồn gốc từ chính chủng xạ khuẩn đã sản xuất Erythromycin là S.erythraea. Cần lưu ý rằng không phải tất các kháng sinh thuộc nhóm Macrolide đều gây ra hiện tượng cảm ứng methyl hóa ribosome. Một ví dụ điển hình cho điều này là trường hợp của các kháng sinh thuộc phân nhóm Ketolide.
- Đột biến thay đổi rARN: Sự đột biến thay đổi một hoặc nhiều nucleotide cũng có thể dẫn đến đề kháng với các kháng sinh nhóm Macrolide. Một số đột biến thay đổi nucleotide trong rARN đã được phát hiện bao gồm: Đột biến A2058G (đề kháng với tất cả các kháng sinh nhóm Macrolide, bao gồm cả phân nhóm Ketolide, trừ phế cầu [S.pneumoniae] mặc dù mang đột biến A2058G đề kháng với Macrolide nhưng vẫn khá nhạy cảm với Ketolide), đột biến ở A2059 (đột biến ở phế cầu, H.pylori và trực khuẩn lao), đột biến U2609C (đột biến ở E.coli gây đề kháng với các Ketolide), đột biến A752C (đột biến ở Deinococcus radiodurans gây đề kháng với các Ketolide), đột biến C2610U và C2611U (đột biến đặc trưng ở phế cầu gây kháng Macrolide), đột biến xóa bỏ A752 (đột biến đặc trưng ở phế cầu gây kháng cả các Macrolide cũng như các Ketolide).
- Đột biến thay đổi protein của ribosome: Những đột biến trong gen L4 và L22 gây ra thay đổi trong cấu trúc của protein ribosome có thể làm vi khuẩn trở nên đề kháng với các kháng sinh nhóm Macrolide thông thường và giảm tính nhạy cảm của nó với các kháng sinh phân nhóm Ketolide. Kiểu đột biến này có thể xuất hiện ở một số chủng vi khuẩn phổ biến như phế cầu, E.coli, liên cầu tan huyết β nhóm A (S.pyogenes), tụ cầu vàng (Staphylococcus aureus) và H.influenzae, M.pneumoniae…
Điều đáng lo ngại là việc nhiều cơ chế đột biến thay đổi cấu trúc của tiểu đơn vị ribosome 50S của vi khuẩn cùng lúc kết hợp với nhau làm cho MIC (nồng độ ức chế tối thiểu) của nhiều vi khuẩn tăng cao, đặc biệt là phế cầu.
– Sản xuất enzyme phá hủy kháng sinh: Có nhiều loại enzyme khác nhau có thể phá hủy, hay nói đúng hơn là bất hoạt kháng sinh nhóm Macrolide. Có 3 loại enzyme chính tham gia vào bất hoạt các Macrolide:
- Các Macrolide esterase: Đây là các enzyme chịu trách nhiệm thủy phân vòng lactone (có bản chất là một ester nội phân tử) của phân tử kháng sinh nhóm Macrolide. Loại Macrolide esterase đầu tiên được tìm thấy là Erythromycin esterase, có nguồn gốc từ một chủng vi khuẩn E.coli. Các gen quy định cho sự mã hóa các enzyme esterase của vi khuẩn được kí hiệu là ere (viết tắt của “Erythromycin resistance esterase” – esterase kháng Erythromycin). Thông thường, mỗi loại esterase sẽ chỉ thủy phân được một loại vòng lactone xác định. Ví dụ: ereA và ereB chỉ thủy phân được các vòng lactone có 14 nguyên tử. Lưu ý: Không phải esterase của vi khuẩn nào cũng bất hoạt được các kháng sinh nhóm Macrolide.
- Các Macrolide phosphotransferase: Đây là một nhóm các enzyme bất hoạt được nhiều kháng sinh nhóm Macrolide thông qua chuyển nhóm phosphate vào phân tử kháng sinh, xuất hiện ở nhiều vi khuẩn khác nhau. Loại enzyme này lần đầu tiên được phát hiện từ một chủng E.coli kháng Erythromycin. Một ví dụ cụ thể về loại enzyme này: Macrolide 2’-phosphotransferase có khả năng chuyển nhóm phosphate từ các nucleotide triphosphate (thường là ATP hoặc GTP) đến nhóm –OH ở vị trí 2’ của đường desosamine trong cấu trúc của các Macrolide mà vòng lactone có 14, 15 hoặc 16 nguyên tử. Điều này làm cản trở sự liên kết của phân tử kháng sinh với nucleotide A2058. Các gen mã hóa cho Macrolide 2’-phosphotransferase I và II ở vi khuẩn E.coli lần lượt là mphA và mphB, thường được tìm thầy trên gen nhảy.
- Các Macrolide glycosyltransferase: Đây không phải là một cơ chế đề kháng phổ biến ở vi khuẩn. Loại enzyme này bất hoạt kháng sinh thông qua chuyển một nhóm đường vào phân tử kháng sinh. Người ta đã quan sát thấy xạ khuẩn sản xuất kháng sinh Oleandomycin cũng đồng thời có khả năng glycosyl hóa ở vị trí 2’ của Oleandomycin, nhờ gốc đường được lấy từ UDP-glucose. Kháng sinh sau khi ở bên trong tế bào vi khuẩn và bị glycosyl hóa ở vị trí 2’, chúng nhanh chóng được bơm ra ngoại bào và tại đây, chúng được trả lại về dạng hoạt động nhờ enzyme glycosidase. Đây là cơ chế của loài xạ khuẩn này để tránh bị tiêu diệt bởi chính kháng sinh do mình sản xuất ra.
– Biểu hiện các bơm tống kháng sinh (Efflux Pump): Các bơm tống kháng sinh này có bản chất là các protein, chúng có nhiệm vụ đẩy phân tử kháng sinh ra khỏi tế bào ngay khi kháng sinh vào được bên trong tế bào, ngăn không cho chúng tiếp cận với mục tiêu là tiểu đơn vị ribosome 50S. Có 2 họ bơm tống kháng sinh chính là họ Mef và họ Msr.
- Họ Mef: Các bơm tống kháng sinh thuộc họ này có 12 domain xuyên màng tế bào. Bơm Mef có khả năng trao đổi một phân tử kháng sinh với một proton ở ngoại bào. Gen mef quy định bơm này được phát hiện thấy ở nhiều vi khuẩn gram dương và một số vi khuẩn gram âm. Có 2 phân lớp mef chính là mefA và mefE. Cả 2 loại này đều quy định tính trạng đề kháng với các kháng sinh nhóm Macrolide mà vòng lactone chứa 14 hoặc 15 nguyên tử, nhưng không quy định tính trạng đề kháng với các kháng sinh nhóm Macrolide mà vòng lactone chứa 16 nguyên tử, Lincosamide hoặc Streptogramine B. Ở phế cầu, người ta đã quan sát thấy có sự đồng biểu hiện mefE và msrD (sẽ được nói ở dưới), dẫn dến tình trạng đề kháng cao với các kháng sinh nhóm Macrolide. Gần đây, một số mef mới được phát hiện bao gồm mefB, mefI và mefO.
- Họ Msr: Họ này được chia ra thành 4 nhóm nhỏ là A, C, D và E. Họ này cho phép vi khuẩn có khả năng đề kháng với các kháng sinh nhóm Macrolide mà vòng lactone có 14 hoặc 15 nguyên tử, nhưng khó có khả năng đề kháng với các kháng sinh thuộc phân nhóm Ketolide. Các gen msr đã được phân lập từ nhiều chủng vi khuẩn phổ biến, bao gồm các vi khuẩn gram dương như tụ cầu (Staphylococcus), liên cầu (Streptococcus), cầu khuẩn ruột (Enterococcus) và Corynebacterium. Trước đây, người ta cho rằng họ Msr này hoạt động theo kiểu bơm tống kháng sinh, nhưng hiện nay có những luồng quan điểm cho rằng, các protein này có khả năng cạnh tranh với các phân tử kháng sinh nhóm Macrolide trong liên kết với tiểu đơn vị ribosome 50S.
– Giảm tính thấm của màng tế bào với kháng sinh: Cơ chế này chỉ xuất hiện ở các vi khuẩn gram âm. Thông thường kháng sinh sẽ được khuếch tán thụ động vào bên trong tế bào vi khuẩn thông qua các kênh porin xuyên màng ngoài, có bản chất là các protein. Vi khuẩn có thể phát triển đề kháng với kháng sinh nhóm này thông qua đột biến làm thay đổi cấu trúc kênh porin, hoặc làm giảm số lượng các kênh porin, cả hai cách này đều làm cho lượng kháng sinh vào được bên trong tế bào vi khuẩn bị hạn chế và không đủ nồng độ để có thể ức chế tổng hợp protein.
Dược động học
Hấp thu: Erythromycin có độ ổn định thấp trong pH dạ dày (chuyển thành dạng bất hoạt), do đó, phải sử dụng thuốc này dưới dạng viên bao tan trong ruột, hoặc sử dụng dạng dược dụng là ester của Erythromycin. Ngược lại, các kháng sinh nhóm Macrolide khác, phổ biến là Clarithromycin và Azithromycin, lại ổn định trong pH thấp của dịch vị. Sinh khả dụng theo đường uống của Erythromycin là 25%, của Clarithromycin là 55%, của Azithromycin là 37%, của Telithromycin là 57%. Erythromycin, Clarithromycin và Azithromycin là cơ chất của bơm tống thuốc ABCB1 (một loại P-gp) ở tế bào niêm mạc ruột. Bơm này làm giảm hấp thu thuốc cũng như chịu trách nhiệm thải trừ thuốc vào mật.
Phân bố: Phân bố tốt vào các mô trong cơ thể. Đặc biệt các kháng sinh nhóm này phân bố tốt trong tế bào bạch cầu và có thể được các bạch cầu vận chuyển đến vị trí nhiễm khuẩn (Nồng độ Clarithromycin và Azithromycin trong đại thực bào cao hơn trong máu tới 400-800 lần). Tuy vậy, khả năng phân bố vào mô vẫn có sự khác biệt giữa các kháng sinh, cụ thể Erythromycin < Clarithromycin < Azithromycin. Erythromycin liên kết với alpha-1-acid glycoprotein tới 70-80%, trong khi Azithromycin thì lại nằm trong mô là chủ yếu chứ không phải máu. Các thuốc này có thể qua được hàng rào nhau thai và sữa mẹ không đáng kể. Khả năng qua hàng rào máu não kém.
Chuyển hóa: Erythromycin và Clarithromycin là cơ chất của SLCO1B1 và SLCO1B3, các protein này chịu trách nhiệm vận chuyển thuốc vào trong gan. Chúng bị chuyển hóa chủ yếu qua CYP3A4 của hệ enzyme gan cytochrome P450 (CYP450), chúng đồng thời cũng ức chế mạnh CYP3A4 do ở trong gan, chúng bị chuyển thành các nitrosoalkane tạo phức không hoạt động với CYP3A4. Azithromycin thì ngược lại, không bị chuyển hóa bởi hệ thống CYP450 của gan, vậy nên nó cũng không ức chế enzyme gan nào cả.
Chất chuyển hóa tại gan của Erythromycin là N-desmethylerythromycin (không hoạt tính). Chất chuyển hóa tại gan của Clarithromycin là N-desmethylclarithromycin (không hoạt tính) và 14-(R)-hydroxyclarithromycin (có hoạt tính). Azithromycin thì rất ít bị chuyển hóa.
Thải trừ: Azithromycin được thải trừ chủ yếu dưới dạng không đổi qua mật. Erythromycin bài xuất qua mật nhiều hơn so với qua nước tiểu (60% vs. 40%), chủ yếu dưới dạng đã chuyển hóa. Clarithromycin thì được bài xuất qua nước tiểu khá nhiều, từ 30-55%.
Tác dụng – Chỉ định của kháng sinh nhóm Macrolide

Các kháng sinh nhóm Macrolide thông thường là kháng sinh kìm khuẩn ở nồng độ thấp nhưng diệt khuẩn ở nồng độ cao. Tác dụng diệt khuẩn của chúng phụ thuộc thời gian. Ngược lại, các kháng sinh thuộc phân nhóm Ketolide lại là các kháng sinh diệt khuẩn phụ thuộc nồng độ.
Ở trên là nếu như ta xét các Macrolide với vai trò của một kháng sinh. Thế còn với vai trò của một chất chống viêm và điều biến miễn dịch thì sao? Lúc này, các Macrolide có vai trò giảm tăng tiết nhầy, cải thiện khả năng vận chuyển các chất được bài tiết, chống viêm (thông qua điều hòa chế tiết các cytokine cũng như một số quá trình khác), giảm tổn thương tế bào…
Kháng sinh nhóm Macrolide được chỉ định cho một số trường hợp như sau:
- Nhiễm trùng hô hấp: Viêm họng, viêm xoang, viêm amidan, viêm phổi do vi khuẩn nhạy cảm.
- Viêm tai giữa ở trẻ em.
- Nhiễm trùng da và mô mềm không biến chứng.
- Viêm loét dạ dày – tá tràng do H.pylori: Clarithromycin.
- Nhiễm trùng đường sinh dục: Lậu, nhiễm trùng Chlamydia.
- Giãn phế quản không xơ nang.
- COPD.
Tham khảo thêm: Aspirin: Công dụng, Chống chỉ định, Tác dụng phụ, Lưu ý khi dùng
Cách dùng – Liều dùng của kháng sinh nhóm Macrolide

Các kháng sinh nhóm này có cả đường uống lẫn đường tiêm truyền tĩnh mạch.
Liều thường dùng tính cho người trưởng thành:
- Erythromycin: Thường sử dụng liều 250-500 mg mỗi 6-12 giờ hoặc 500 mg mỗi 12 giờ hoặc 333 mg mỗi 8 giờ. Với các nhiễm trùng nặng, liều tối đa có thể lên đến 4 g/ngày. Chế độ liều mỗi 6 giờ thường được ưu tiên lựa chọn với kháng sinh này.
- Clarithromycin: Thường sử dụng liều 250-500 mg mỗi 12 giờ. Với dạng bào chế giải phóng kéo dài, có thể chỉ cần dùng 1 lần/ngày với liều 1000 mg.
- Azithromycin: Thường dùng chế độ liều là 500 mg/ngày trong ngày đầu và 250 mg/ngày cho 4 ngày kế tiếp, hoặc 500 mg/ngày x 3 ngày. Do tính hướng mô cao, Azithromycin có thời gian bán thải dài và chỉ cần dùng thuốc trong 3 hoặc 5 ngày là đảm bảo được nồng độ điều trị trong mô từ 7-10 ngày. Đặc biệt, với bệnh lậu, chỉ cần sử dụng thuốc với liều 1 g/lần duy nhất (phối hợp với Ceftriaxone 250 mg/lần duy nhất).
Tác dụng không mong muốn
Các kháng sinh thuộc phân nhóm Ketolide, mà cụ thể là Telithromycin, có độc tính trên gan, hiếm gặp nhưng nghiêm trọng, không hồi phục. Đây là nguyên nhân khiến chỉ định của thuốc bị giới hạn.
Các kháng sinh nhóm Macrolide đều gây kéo dài khoảng QT trên điện tâm đồ (ECG). Khoảng QT kéo dài là yếu tố nguy cơ gây ra xoắn đỉnh, rung thất và ngừng tim. Nguy cơ gây kéo dài khoảng QT của Erythromycin cao hơn Azithromycin.
Viêm gan ứ mật là một tác dụng không mong muốn khác khá ít gặp của các thuốc nhóm này.
Rối loạn tiêu hóa: Buồn nôn, nôn, đau bụng, tiêu chảy.
Mất thính giác: Thường hồi phục khi ngừng thuốc, nhưng cũng có những trường hợp là mất thính giác vĩnh viễn.
Các phản ứng dị ứng nặng như hội chứng Stevens-Johnson hay hội chứng Lyell hiếm gặp, nhưng có thể xảy ra.
Chống chỉ định
Quá mẫn cảm với bất cứ thành phần nào của thuốc.
Tương tác thuốc
Phối hợp các thuốc là cơ chất của CYP3A4: Một số thuốc trong nhóm kháng sinh Macrolide này ức chế mạnh CYP3A4 của gan, cụ thể là Erythromycin và Clarithromycin. CYP3A4 là một enzyme chuyển hóa thuốc trong hệ thống enzyme cytochrome P450 của gan. Nếu phối hợp Erythromycin hoặc Clarithromycin với các thuốc là cơ chất của CYP3A4, nồng độ các thuốc này trong máu sẽ tăng lên, tăng nguy cơ gây ngộ độc cho bệnh nhân. Phối hợp như thế này thường yêu cầu giảm liều thuốc là cơ chất của CYP3A4, nhưng cũng có trường hợp bị chống chỉ định (ví dụ như phối hợp Clarithromycin với Simvastatin). Với các trường hợp chống chỉ định, cần thay thế 1 trong 2 thuốc dùng phối hợp. Nêu ưu tiên thay thế kháng sinh ức chế CYP3A4 bằng kháng sinh khác cùng nhóm không ức chế CYP3A4, ví dụ như thay Clarithromycin bằng Azithromycin trong nhiễm khuẩn hô hấp dưới, hoặc thay cả phác đồ kháng sinh điều trị H.pylori từ phác đồ chứa Clarithromycin sang phác đồ không chứa Clarithromycin.
Phối hợp với các thuốc có khả năng gây kéo dài khoảng QT (Một số kháng sinh nhóm Quinolone như Levofloxacin, Moxifloxacin và Ciprofloxacin, thuốc chống loạn nhịp tim như Amiodarone, Quinidine…): Tăng nguy cơ gặp phải tác dụng không mong muốn kéo dài khoảng QT, tăng nguy cơ xoắn đỉnh, rung thất và ngừng tim.
Phối hợp với các thuốc chống đông đường uống kháng vitamin K như Warfarin: Tác dụng chống đông máu có thể tăng lên. Nguyên nhân là do các kháng sinh nhóm Macrolide có thể làm giảm một phần số lượng vi khuẩn cộng sinh ở ruột già, đây là một nguồn sản xuất vitamin K đáng kể cho cơ thể. Khi quần thể vi khuẩn ở đây giảm, lượng vitamin K cung cấp cho cơ thể cũng giảm đáng kể và điều này dẫn đến tăng tác dụng chống đông của các thuốc có cơ chế kháng vitamin K.
Phối hợp với các thuốc tránh thai hormone đường uống: Tác dụng tránh thai của thuốc giảm, bệnh nhân có thể mang thai ngoài ý muốn. Nguyên nhân cũng giống như trường hợp trên, do số lượng vi khuẩn cộng sinh ở ruột già bị suy giảm đáng kể, mà các vi khuẩn này đóng vai trò quan trọng trong chu kỳ gan – ruột của thuốc. Các vi khuẩn này chịu trách nhiệm cắt đứt các liên kết giữa phân tử thuốc với acid glucuronic, làm cho một phần thuốc sau khi đã được cơ thể thải trừ qua đường mật dưới dạng liên hợp được tái hấp thu trở lại vào tuần hoàn. Như vậy, khi chu kỳ gan – ruột của thuốc bị mất do kháng sinh, lượng thuốc đi vào hệ tuần hoàn giảm đi, có thể làm giảm tác dụng của thuốc tránh thai.
Lưu ý và thận trọng khi sử dụng kháng sinh nhóm Macrolide
Khi sử dụng cùng với các thuốc khác được chuyển hóa nhiều qua CYP3A4: Đọc kỹ thông tin trong tờ hướng dẫn sử dụng sản phẩm, nhiều phối hợp đòi hỏi giảm liều thuốc dùng cùng, một số khác là chống chỉ định.
Thận trọng với nguy cơ gây kéo dài khoảng QT của các Macrolide, đặc biệt khi chúng được phối hợp với các thuốc khác cũng có thể gây kéo dài khoảng QT. Theo dõi điện tâm đồ của bệnh nhân cẩn thận.
Với phối hợp giữa kháng sinh nhóm Macrolide với các thuốc chống đông đường uống kháng vitamin K như Warfarin: Giám sát thời gian prothrombin của bệnh nhân.
Với bệnh nhân đang trong thời kỳ tránh thai mà có dùng thuốc tránh thai đường uống, nên sử dụng các biện pháp tránh thai khác, nhưng đồng thời vẫn duy trì sử dụng thuốc tránh thai.
Sử dụng kháng sinh nhóm Macrolide trên đối tượng đặc biệt
Người già và trẻ em: Có thể cần điều chỉnh liều ở những đối tượng này do chức năng gan thận của họ bị lão hóa hoặc chưa hoàn thiện.
Phụ nữ có thai và đang cho con bú: Nhìn chung các kháng sinh nhóm Macrolide là nhóm kháng sinh lành tính cho cả phụ nữ có thai và đang cho con bú. Tuy nhiên, Erythromycin estolate bị chống chỉ định cho phụ nữ có thai do độc tính trên gan mật.
Bệnh nhân suy giảm chức năng gan thận: Đánh giá mức độ nặng và xem xét giảm liều với từng thuốc cụ thể.
Một số nghiên cứu và thử nghiệm lâm sàng

- Nghiên cứu thuần tập về Azithromycin và nguy cơ tử vong do tim mạch cho thấy: Với liệu pháp điều trị bằng Azithromycin trong 5 ngày, tỷ lệ tử vong do tim mạch tăng, điều này đặc biệt rõ ràng ở những người có nguy cơ nền tim mạch cao.

- Thử nghiệm về việc sử dụng Clarithromycin trong dự phòng nhiễm trùng phức hợp Mycobacterium avium ở bệnh nhân mắc hội chứng suy giảm miễn dịch mắc phải (AIDS) tiến triển cho kết quả: Việc dự phòng bằng Clarithromycin ở những bệnh nhân AIDS tiến triển có dung nạp tốt, dự phòng được nhiễm trùng và làm giảm tỷ lệ tử vong.

Tham khảo thêm: THUỐC KHÁNG SINH: CƠ CHẾ TÁC DỤNG, PHÂN LOẠI 9 NHÓM KHÁNG SINH
Tài liệu tham khảo
George P Dinos, The macrolide antibiotic renaissance:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5573421/
Soichiro Kanoh và Bruce K. Rubin, Mechanisms of Action and Clinical Application of Macrolides as Immunomodulatory Medications:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2901655/
Parth H. Patel; Muhammad F. Hashmi, Macrolides:
https://www.ncbi.nlm.nih.gov/books/NBK551495/
Alison E. Fohner, Alex Sparreboom, Russ B. Altman và Teri E. Klein, PharmGKB summary: macrolide antibiotic pathway, pharmacokinetics/pharmacodynamics:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5346035/
Wayne A. Ray, Ph.D., Katherine T. Murray, M.D., Kathi Hall, B.S., Patrick G. Arbogast, Ph.D. và C. Michael Stein, M.B., Ch.B, Azithromycin and the Risk of Cardiovascular Death:
https://www.nejm.org/doi/full/10.1056/nejmoa1003833
Mark Pierce, M.D., Sheri Crampton, B.A., David Henry, Ph.D., Leonid Heifets, M.D., Anthony LaMarca, M.D., Marisa Montecalvo, M.D., Gary P. Wormser, M.D., Helmut Jablonowski, M.D., Joseph Jemsek, M.D., Michael Cynamon, M.D., Bienvenido G. Yangco, M.D., M.P.H., Gerard Notario, M.D., et al, A Randomized Trial of Clarithromycin as Prophylaxis against Disseminated Mycobacterium avium Complex Infection in Patients with Advanced Acquired Immunodeficiency Syndrome:
https://www.nejm.org/doi/full/10.1056/nejm199608083350603