Bài viết Tiếp cận bệnh nhân ARDS được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: Approach to the patient with the acute respiratory distress syndrome
1. Tóm tắt
Do tỷ lệ mắc và tử vong cao của ARDS ở những bệnh nhân bị bệnh nặng, mỗi BS cần có cách tiếp cận cạnh giường để xác định sớm bệnh nhân có nguy cơ bị ARDS và đánh giá thích hợp bệnh nhân đáp ứng tiêu chuẩn chẩn đoán ARDS. Những tiến bộ gần đây như Điểm dự đoán tổn thương phổi (Lung Injury Prediction Score), Điểm số tổn thương phổi cấp tính sớm (Early Acute Lung Injury score) và xác nhận tỷ lệ SpO2/FiO2 để đánh giá mức độ thiếu oxy máu là tất cả các công cụ thiết thực để hỗ trợ BS trong việc chăm sóc bệnh nhân có nguy cơ ARDS và có khả năng trở nên quan trọng hơn trong tương lai vì việc điều trị phòng ngừa nhiều hơn cho ARDS. Đối với những bệnh nhânđáp ứng tiêu chí chẩnđoán ARDS, BS nên tập trung tìm kiếm một nguyên nhân cơ bản cũng như khả năng đồng thời của một quá trình bệnh lý cơ bản bắt chước (mimics) hội chứng lâm sàng của ARDS.
2. Giới thiệu
Hội chứng suy hô hấp cấp tính (ARDS) là một biến chứng thường gặp của nhiều loại bệnh và có liên quan đến bệnh suất và tỷ lệ tử vong đáng kể [1,2]. Nhận biết sớm bệnh nhân có nguy cơ mắc bệnh ARDS và xác định nguyên nhân cơ bản cho phép áp dụng kịp thời các liệu pháp cứu nguy tiềm năng [3-5]. Tuy nhiên, trong một nghiên cứu của Ferguson và cộng sự [6], hơn 50% bệnh nhân ARDS không được bác sĩ của họ nhận biết và ARDS nhận ra chỉ được công nhận tại thời điểm khám nghiệm tử thi. Sự nhận thức kém này của BS về ARDS có thể liên quan một phần đến sự thiếu độ nhạy trong các định nghĩa lâm sàng của hội chứng này [6,7]; tuy nhiên, bất kể lý do nào, việc nhận thức kém ARDS có thể dẫn đến việc sử dụng quá mức các phương pháp điều trị ARDS cụ thể. Ví dụ, lợi ích của chiến lược thông khí bảo vệ thể tích khí lưu thông thấp đã được thiết lập trong hơn mười năm [3], nhưng khoảng 25% bệnh nhân trên toàn thế giới với ARDS vẫn không nhận được liệu pháp này [8].
Các liệu pháp điều trị ARDS đã được báo cáo nhằm cải thiện tỷ lệ tử vong liên quan đến ARDS 8–16% [3-5]. Việc sử dụng các liệu pháp này phụ thuộc vào BS áp dụng định nghĩa ARDS [7] tại giường để chẩn đoán. Tuy nhiên, định nghĩa lâm sàng của ARDS không xác định bệnh nhân có nguy cơ phát triển ARDS sau này, xem xét các điều kiện khác có thể bắt chước ARDS, cũng như không tính đến rối loạn chức năng hô hấp tồn tại trước khi đáp ứng các tiêu chí ARDS để có thể áp dụng các phương pháp trị liệu sớm hơn. Được minh họa bằng các bài thuyết trình dựa trên trường hợp, tổng quan này nhằm mô tả cách tiếp cận đầu giường để xác định sớm bệnh nhân bị bệnh nặng có nguy cơ phát triển ARDS cũng như cách tiếp cận thực tế để chẩn đoán và đánh giá nguyên nhân cơ bản ở bệnh nhân ARDS.
3. Xác định bệnh nhân có nguy cơ phát triển ARDS
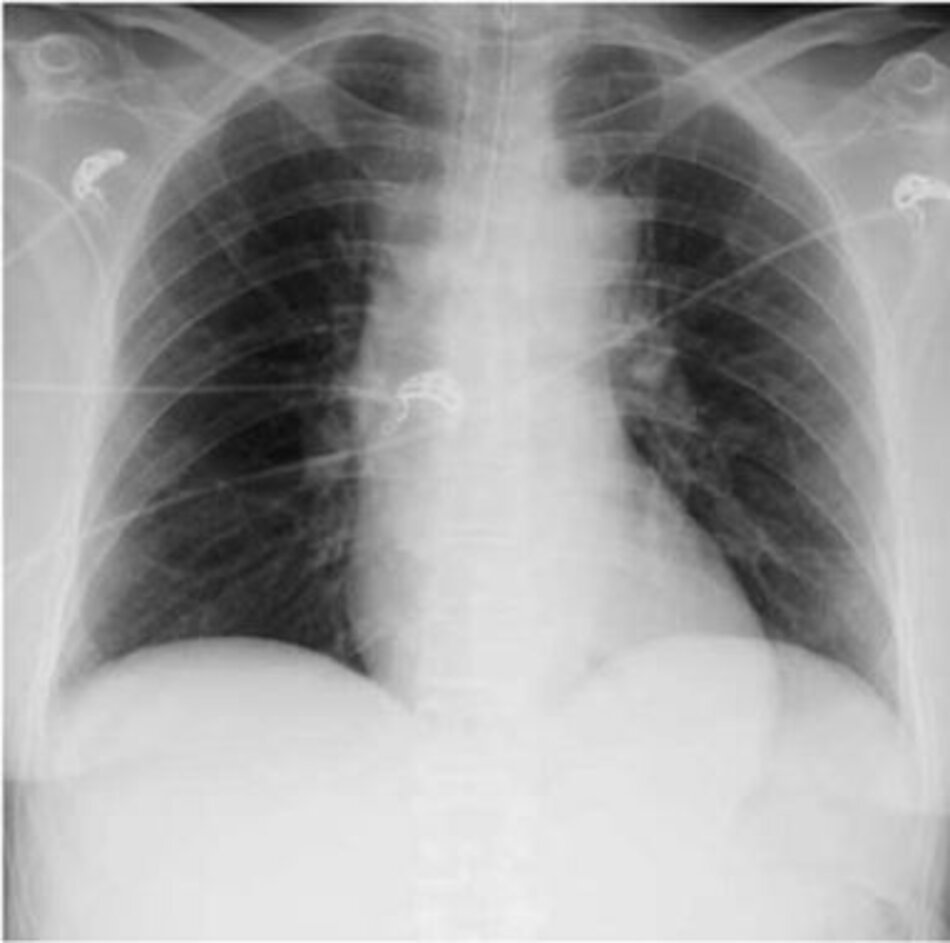
Một phụ nữ 65 tuổi có tiền sử đái tháo đường có biểu hiện ở bụng cấp tính, sốt, nhịp tim nhanh, tăng bạch cầu và hạ huyết áp. Bà được BS chẩn đoán thủng túi thừa với áp xe trong ổ bụng, được dẫn lưu hiệu quả trong phòng mổ. Sau phẫu thuật và bất chấp hồi sức dịch truyền và kháng sinh phổ rộng, bà bị hạ huyết áp trong ICU và thở máy. Các loại thuốc vận mạch được bắt đầu để hỗ trợ huyết áp. Chụp X quang ngực của bà cho thấy không có thâm nhiễm phổi (Hình 1) và bà có độ bão hòa oxy động mạch 95% khi thở máy với FiO2 0,40. Nguy cơ tiếp theo của bệnh nhân này phát triển ARDS trong suốt quá trình bệnh của mình trong ICU là gì?
Gần đây, sự chú ý gia tăng cho bệnh nhân bị bệnh nặng có nguy cơ phát triển ARDS. Với nhiều nghiên cứu cho thấy không có loại thuốc nào để điều trị bệnh nhân với ARDS đã có chẩn đoán [9-12], công việc tập trung chuyển sang xác định bệnh nhân có nguy cơ phát triển ARDS để điều trị dự phòng sớm hơn. Ví dụ, ứng dụng sớm thông khí thể tích khí lưu thông thấp có thể ngăn chặn sự phát triển của ARDS ở bệnh nhân nguy cơ [13,14]. Vì lý do này, sự công nhận lâm sàng của những bệnh nhân có nguy cơ phát triển ARDS là rất quan trọng. Một số chiến lược đã được sử dụng để xác định các yếu tố bệnh nhân liên quan đến sự phát triển của ARDS, bao gồm cả dữ liệu được thu thập cả không xâm lấn và xâm lấn.
4. Các yếu tố nguy cơ lâm sàng truyền thống và điều chỉnh nguy cơ cho ARDS
ARDS thường phát triển trong bối cảnh một số yếu tố nguy cơ lâm sàng thích hợp. Nhận thức về các yếu tố nguy cơ này và các yếu tố lâm sàng khác có thể làm tăng hoặc giảm nguy cơ, có thể giúp chẩn đoán sớm. Phổi bị tổn thương nghiêm trọng là kết quả cuối cùng của một quá trình bệnh lý đặc trưng bởi tổn thương phế nang lan tỏa với luồng tế bào viêm và dịch phù phổi giàu protein vào trong lòng phế nang [15].
Mặc dù các phát hiện bệnh lý là tương tự bất kể nguyên nhân cơ bản, có rất nhiều chẩn đoán cơ bản khác nhau đưa bệnh nhân vào nguy cơ tổn thương phế nang lan tỏa. Các yếu tố nguy cơ cho sự phát triển ARDS có thể được chia thành các nguyên nhân gây tổn thương trực tiếp cho phổi và tổn thương có nguồn gốc ngoài phổi, với viêm hệ thống sau đó gây tổn thương phổi gián tiếp. Trong số các chẩn đoán trực tiếp làm tổn thương phế nang, viêm phổi (46%) và hít sặc dịch dạ dày (11%) là nguyên nhân phổ biến nhất; nhiễm trùng nặng có nguồn gốc không phải phổi (33%) và chấn thương (7%) là nguyên nhân phổ biến nhất gây tổn thương phổi gián tiếp [1].
Khác biệt với yếu tố nguy cơ (risk factor), sự điều chỉnh nguy cơ (risk modifiers) với đặc điểm không được cho là gây ra ARDS, nhưng có thể tạo ra yếu tố nguy cơ, ví dụ nhiễm trùng huyết, ít hoặc nhiều khả năng gây ra ARDS. Những yếu tố điều chỉnh nguy cơ được cho là giảm nguy cơ ARDS bao gồm đái tháo đường [16]; trong khi hút thuốc lá [17], uống rượu [17], hypoalbuminemia [18], oxygen therapy [19], và hóa trị liệu [20] đều được báo cáo là làm tăng nguy cơ ARDS trong bệnh cảnh một yếu tố nguy cơ thích hợp như nhiễm trùng huyết hoặc chấn thương nặng [21] (Bảng 1).
5. Điểm dự đoán tổn thương phổi (Lung Injury Prediction Score)
Ngoài việc công nhận các loại yếu tố nguy cơ lâm sàng rộng, việc tính toán đầu giường của một điểm dự đoán nguy cơ có thể giúp xác định bệnh nhân có nguy cơ cao nhất về ARDS. Trong nghiên cứu ARDS, LIPS đã được công nhận rằng một số biến lâm sàng, chẳng hạn như cài đặt máy thở, truyền máu, và chẩn đoán bệnh căn nguyên kết hợp với sự phát triển tiếp theo của ARDS [1,22-26]. Gần đây [27] việc sử dụng các biến lâm sàng này và các biến lâm sàng dễ dàng khác để dự đoán sự phát triển của ARDS ở những bệnh nhân bị bệnh nặng, để thiết kế thử nghiệm lâm sàng can thiệp nhằm ngăn ngừa ARDS. Điểm dự đoán tổn thương phổi (LIPS), lần đầu tiên được mô tả trong năm 2011 [21] nỗ lực để tính đến các yếu tố nguy cơ cho sự phát triển ARDS tiếp theo, chẳng hạn như nhiễm trùng huyết, cùng với tính toán cho các công cụ điều chỉnh nguy cơ tiềm ẩn.
LIPS được phát triển thông qua một nghiên cứu thuần tập đơn trung tâm, nghiên cứu hồi cứu và tiền cứu quan sát tương đối ban đầu [21] và một nghiên cứu xác thực lớn hơn, đa trung tâm tiếp theo liên quan đến hơn 5.000 bệnh nhân có nguy cơ mắc bệnh [28]. Trong nghiên cứu lớn hơn, đa trung tâm, các biến lâm sàng bao gồm cả hai yếu tố nguy cơ ARDS được biết đến và các điều chỉnh nguy cơ được thu thập trong 6 giờ đầu tiên sau khi nhập cấp cứu.
Trong số 5.584 bệnh nhân có nguy cơ được ghi danh, 277 (6,8%) sau đó đã phát triển ARDS, trung bình 2 ngày sau khi nhập viện. Sau khi phân tích sự liên kết của cả hai yếu tố nguy cơ và điều chỉnh nguy cơ với sự phát triển tương lai của ARDS, các điểm được gán cho từng yếu tố và công cụ sửa đổi dựa trên sức mạnh của sự liên kết trong mô hình hồi quy (Bảng 1). Tính toán LIPS cho phép một tỷ lệ phần trăm mô tả nguy cơ phát triển ARDS trong tương lai được gán cho từng bệnh nhân có nguy cơ. Ví dụ, trong trường hợp ban đầu của một bệnh nhân có tiền sử đái tháo đường, nhiễm trùng huyết, sốc, FiO2 lớn hơn 0,35 và phẫu thuật có nguy cơ cao, điểm LIPS được tính toán là 6, tương ứng với khoảng 23% nguy cơ phát triển trong tương lai của ARDS.
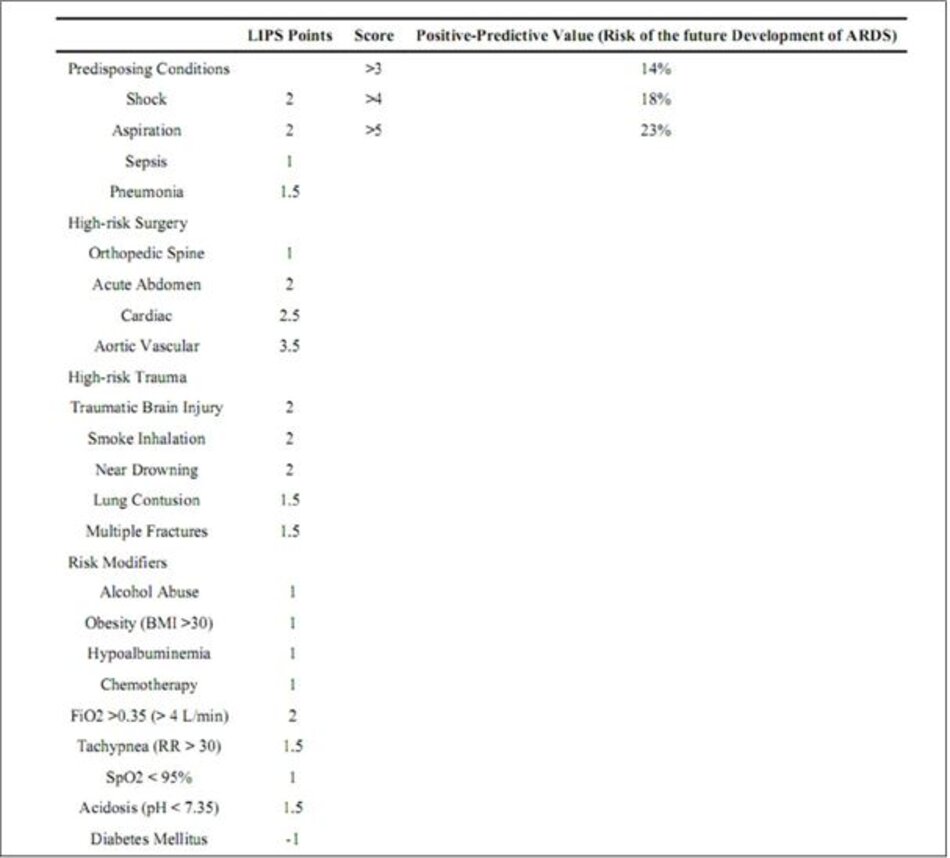
Trong nghiên cứu ban đầu, LIPS >4 được tìm thấy có sức mạnh phân biệt (discriminatory power) tốt, trong đó 97% bệnh nhân có điểm là 4 không tiếp tục phát triển ARDS, trong khi 18% bệnh nhân có điểm > 4 tiếp tục phát triển ARDS. Như vậy, các thử nghiệm lâm sàng [29] nhằm ngăn chặn sự phát triển ARDS ở những bệnh nhân có nguy cơ cao đã sử dụng LIPS ≥ 4 để làm mức điểm dành cho bệnh nhân nhằm mục tiêu can thiệp phòng ngừa. Mặc dù giá trị tiên đoán dương tính thấp của LIPS [28] (Bảng 1) không khuyến khích BS tại giường trong việc dự đoán bệnh nhân nào sẽ phát triển ARDS, LIPS vẫn là hệ thống tính điểm được xác thực duy nhất và hầu như không thử nghiệm xâm lấn.
Trong khi chờ đợi kết quả thử nghiệm phòng ngừa để hướng dẫn quản lý bệnh nhân nguy cơ, bác sĩ bên giường vẫn có thể sử dụng LIPS và các công cụ khác để xác định bệnh nhân có nguy cơ bị ARDS và thực hiện các can thiệp có thể làm giảm nguy cơ như vậy. Ví dụ, một bệnh nhân được xác định là có nguy cơ cao phát triển ARDS có thể hưởng lợi từ việc khởi động hồi sức sớm và kháng sinh cho nhiễm trùng huyết nặng [20], một chiến lược dịch hạn chế sớm hơn trong quá trình nằm ICU [31] và thông khí bảo vệ phổi ngay cả trong không ARDS, một can thiệp có liên quan đến kết quả lâm sàng được cải thiện [13,14,32]. Trong trường hợp được trình bày ở trên, nơi bệnh nhân bị sốc, đã được hồi sức, điều trị bằng kháng sinh sớm và có LIPS là [6], việc bổ sung thông khí bảo vệ phổi có thể làm giảm nguy cơ biến chứng phổi và ngoài phổi và rút ngắn thời gian bệnh nhân ở lại bệnh viện [14].
6. Các xét nghiệm huyết thanh dự đoán nguy cơ ARDS
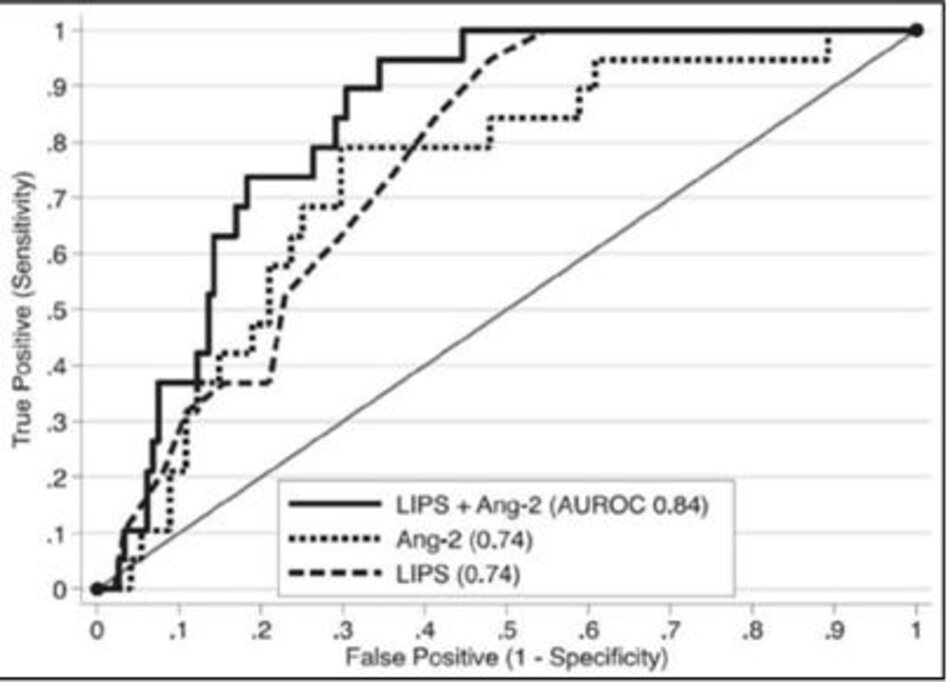
ARDS là đỉnh điểm của nhiều quá trình viêm và đông máu liên quan đến cả nội mô và biểu mô phổi có thể tạo ra dấu ấn sinh học có thể đo lường trước sự phát triển của thâm nhiễm phổi hai bên trên hình ảnh ngực [33]. Là dấu ấn sinh học của chấn thương nội mạc phổi, angiopoietin-2 huyết tương (Ang-2) đã nhận được sự chú ý nhất đối với dự đoán phát triển ARDS ở những bệnh nhân có nguy cơ cao [34-36]. Trong một nghiên cứu gần đây của Agrawal và cộng sự [36], Ang-2 huyết tương được đo trong một nhóm không đồng nhất gồm 230 bệnh nhân trong khoa Cấp cứu được xác định là có nguy cơ phát triển ARDS dựa trên kế hoạch nhập viện vào một ICU. Không chỉ Ang-2 cao hơn đáng kể ở những bệnh nhân tiếp tục phát triển ARDS, nhưng Ang-2 ít nhất là tiên đoán về sựphát triển của ARDS như Điểm dự đoán tổn thương phổi (LIPS) (diện tích khu vực dưới đường cong tương ứng là 0,74 và 0,74). Bổ sung các mức Ang-2 vào LIPS tiếp tục cải thiện sức mạnh phân biệt (AUC 0.84) (Hình 2). Mặc dù ít được nghiên cứu, các dấu ấn sinh học plasma khác như protein tế bào club (club cell protein) (CC-16) [37], IL-8 [36], và yếu tố mô [38], cũng hứa hẹn trong việc xác định bệnh nhân nguy cơ.
Những hạn chế rõ ràng của việc sử dụng dấu ấn sinh học plasma trong dự đoán nguy cơ là chi phí, tốc độ và thời gian đo lường. Không có xét nghiệm nào ở trên hiện có sẵnđể sử dụng lâm sàng cũng như không rõ thời gian tối ưu để đo lường là gì. Nghiên cứu Ang-2 [36] được thực hiện trong khoa Cấp cứu. Tuy nhiên, vẫn chưa rõ liệu các phép đo Ang-2 có hữu ích đối với bệnh nhân đã nhập viện, bệnh nhân sau phẫu thuật hay bệnh nhân bị bệnh nặng do chuyển từ các ICU khác. Khi dữ liệu được thu thập thêm về giá trị dự đoán của dấu ấn sinh học plasma và chi phí và thời gian đo giảm xuống, có lẽ sinh học huyết tương sẽ được kết hợp để cải thiện sức mạnh dự báo của các công cụ khác như LIPS.
7. Chẩn đoán ARDS
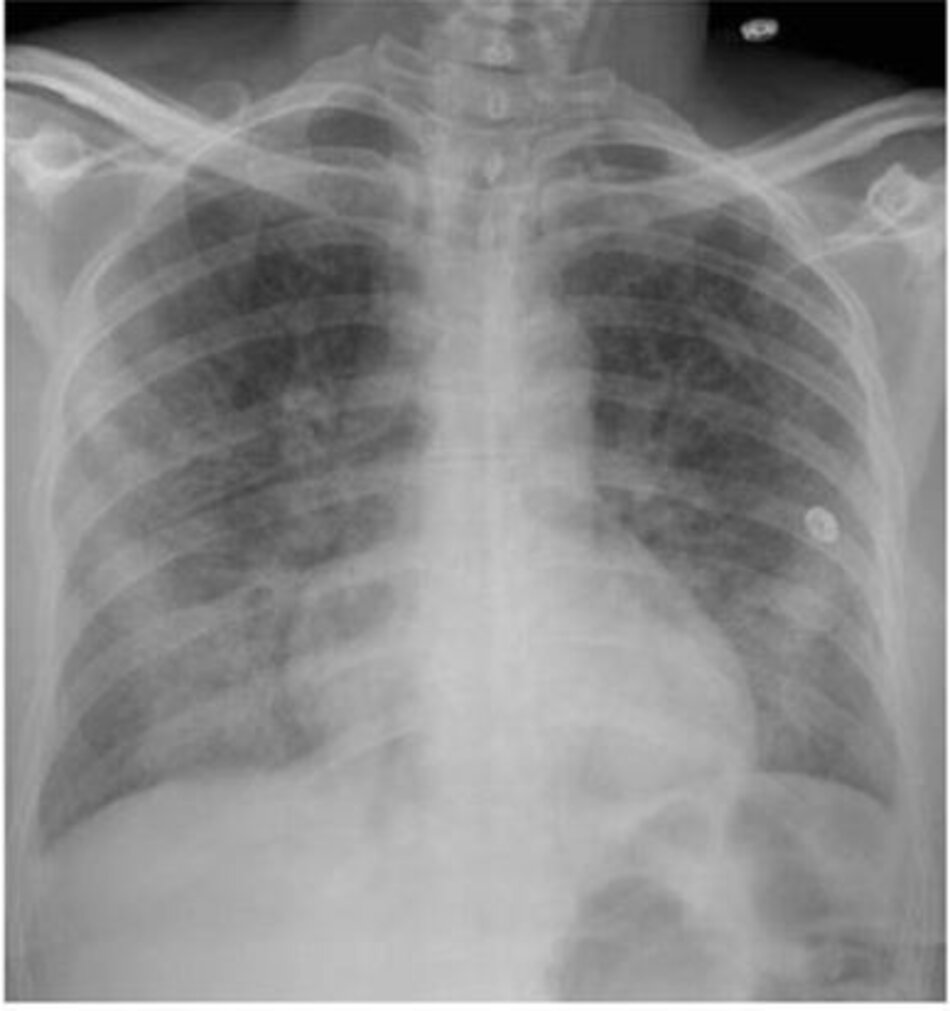
Một phụ nữ 40 tuổi đã được nhận vào đơn vị chăm sóc đặc biệt với viêm phổi mắc phải cộng đồng hiện đang cần 4 lít oxy mỗi phút để duy trì độ bão hòa oxy động mạch (SpO2) bằng 88%, có tần số thở là 32, và có phế nang hai bên thâm nhiễm trên X quang ngực (Hình 3). Bệnh nhân này có ARDS chưa và có nguy cơ tiến triển để cần thông khí cơ học không?
ARDS là một hội chứng lâm sàng được chẩn đoán bằng cách áp dụng các định nghĩa lâm sàng đã được phát triển bởi sự đồng thuận của chuyên gia. Định nghĩa lâm sàng của ARDS đã trải qua sửa đổi gần đây [7] (Bảng 2) từ hình thức ban đầu của nó [39]. Yêu cầu của thông số hiện tại về thông khí áp lực dương, đo khí máu động mạch, và đánh giá chức năng thất trái làm giảm độ nhạy để phát hiện ARDS tại giường ở những bệnh nhân có thể không phù hợp với các tiêu chí này (như trong trường hợp trình bày), nhưng vẫn có nguy cơ suy hô hấp tiến triển. Một số chiến lược gần đây đã được báo cáo để giải quyết những thiếu sót này trong các định nghĩa hiện tại [7] trong chẩn đoán ARDS tại giường.
8. Tổn thương phổi cấp tính sớm (Early Acute Lung Injury)
Trong các nghiên cứu khám nghiệm tử thi, độ nhạy của định nghĩa ARDS [7] hiện tại là khoảng 89% [40] khi các BS nghi ngờ chẩn đoán và áp dụng các tiêu chí ở tại giường. Tuy nhiên, độ nhạy của định nghĩa này có thể bị giảm do yêu cầu thông khí áp lực dương hoặc không xâm lấn và đo các khí máu động mạch, cùng với ARDS phân đôi như có hoặc không thay vì nhận ra rằng hội chứng này bao gồm một dãi của nhiều mức độ nghiêm trọng tổn thương phổi.
Để giải quyết những lo ngại này, Levitt và cộng sự gần đây đã thực hiện một nghiên cứu thuần tập tiền cứu để phát triển định nghĩa chấn thương phổi cấp tính sớm (EALI) nhằm cảnh báo cho bệnh nhân bị chấn thương phổi cấp tính chưa đáp ứng các tiêu chuẩn chẩn đoán ARDS nhưng những người có nguy cơ cao tiến triển ARDS và cần thở máy thông khí xâm lấn. Những bệnh nhân ghi danh trong nghiên cứu này đã có thâm nhiễm hai bên trên X quang ngực, không thở máy, không có nghi ngờ lâm sàng về tăng huyết áp tâm nhĩ trái đơn thuần, và không có khí máu động mạch.
Trong nhóm này, yêu cầu > 2 lít/phút oxy bổ sung, tần số thở ≥ 30 lần/phút, và ức chế miễn dịch được tìm thấy là các yếu tố nguy cơ độc lập cho sự tiến triển tiếp theo với ARDS với nhu cầu thở máy. Bệnh nhân có hai yếu tố này, được gọi là điểm EALI ≥ 2 (như trong trường hợp trình bày) có 53% nguy cơ tiến triển đến ARDS với thở máy, nguy cơ cao hơn so với tính LIPS (33%) đồng thời. Thời gian trung bình từ các tiêu chí đáp ứng cho EALI cần cho thông khí áp lực dương là 20 giờ. Việc tạo ra định nghĩa này của EALI công nhận ARDS là phổbệnh tật và cung cấp cho bác sĩ tại giường với một công cụ chẩn đoán để xác định ARDS sớm trong tiến trình của nó có thể dẫn đến việc áp dụng sớm các can thiệp trị liệu. Ví dụ, nhập viện chăm sóc đặc biệt cho bệnh nhân đến phòng cấp cứu với thâm nhiễm phổi hai bên trên X quang ngực và điểm EALI ≥ 2 nên được xem xét vì nguy cơ tiến triển nhanh chóng của suy hô hấp đòi hỏi phải thở máy.
9. Chẩn đoán ARDS
Sửa đổi gần đây trong định nghĩa của ARDS đáng chú ý, vì chúng có thể ảnh hưởng đến việc áp dụng các định nghĩa tại giường. Định nghĩa Hội nghị Đồng thuận Mỹ-Châu Âu (AECC) ban đầu của ARDS [39] không quy định khung thời gian về những gì thể hiện sự khởi đầu “cấp tính” của ARDS. Định nghĩa mới của Berlin [7] đòi hỏi sự phát triển của ARDS, bao gồm cả thâm nhiễm hai bên trên X quang ngực, xảy ra trong vòng 1 tuần của một bệnh lý thúc đẩy đã biết. Thứ hai, bệnh nhân nhận được ≥ 5 cmH 2O áp lực dương liên tục qua thông khí áp lực dương không xâm lấn có thể được chẩn đoán bằng ARDS nhẹ mà không cần thông khí cơ học xâm lấn. Định nghĩa ARDS của AECC yêu cầu bệnh nhân có áp lực tắc động mạch phổi (PAOP), nếu đo được, ≤ 18 mm Hg, trong khi định nghĩa hiện tại của Berlin nhận ra rằng PAOP và ARDS cao có thể cùng tồn tại [42,43] ở bệnh nhân nhận hồi sức dịch trên bệnh tim có sẳn và áp lực trong lồng ngực cuối thì thở ra cao. Hiện tại, nếu bệnh nhân suy hô hấp không thể được giải thích đầy đủ bởi một yếu tố nguy cơ ARDS, test chức năng tim khách quan là cần thiết, chẳng hạn như siêu âm tim hoặc đặt ống thông động mạch phổi. Cuối cùng, thuật ngữ “chấn thương phổi cấp tính (ALI)” đã bị loại khỏi định nghĩa Berlin và các loại ARDS nhẹ, trung bình và nặng đã được tạo ra dựa trên tỷ lệ PaO 2/FiO2. Định nghĩa lâm sàng này của ARDS hiện là công cụ chẩn đoán chính có sẵn tại giường cho các BS để xác định bệnh nhân có ARDS.
Mặc dù cả hai định nghĩa AECC và Berlin của ARDS đều yêu cầu đo PaO2 động mạch để tính toán tỷ lệ PaO2/FiO2, chiến lược ít xâm lấn để đánh giá oxy hóa máu sử dụng độ bão hòa oxy động mạch (SpO 2) có thể hữu ích chẩn đoán ARDS và liên tục có sẵn. Trong một nghiên cứu [44] của khoảng 1.000 bệnh nhân và hơn 4.000 phép đo đồng thời của PaO 2, SpO2 và FiO2, sử dụng tỷ lệ SpO2/FiO2 được thực hiện rất tốt so với tỷ lệ PaO2/FiO2trong chẩn đoán ARDS. Cụ thể, tỷ lệ SpO2/FiO2 là 315 và 235 tương ứng với tỷ lệ PaO2/FiO2là 300 và 200, tương ứng. Ở những bệnh nhân trẻ em lấy mẫu máu động mạch khó hơn người lớn, tỷ lệ SpO2/FiO2 có thể hữu ích trong chẩn đoán và dự đoán suy hô hấp cần thông khí cơ học xâm lấn ở bệnh nhân ARDS [45]. Mặc dù tỷ lệ SpO2/FiO2 không chính xác ở thái cực của SpO2 và PaO2 cho mối quan hệ phi tuyến ở các mức này (tức là khi SpO2 là ≥ 97%), tỷ lệ SpO2/FiO2 là một thay thế đơn giản, không xâm lấn đối với đo khí máu động mạch trong chẩn đoán bệnh nhân ARDS.
Một thách thức khác trong chẩn đoán ARDS là sự khác biệt giữa ARDS và phù phổi do tim gây ra [46]. Một số chỉ số trên X quang ngực có thể hỗ trợ sự phân biệt này. Các đặc điểm X quang của phù phổi do tim bao gồm tăng kích thước tim, độ rộng cuống mạch máu phổi (vascular pedicle width) (> 70 mm đo từ xuất phát của động mạch dưới đòn bên trái từ động mạch chủ đến giao điểm của phế quản chính bên phải và tĩnh mạch chủ trên) [47], phù trung tâm, và tràn dịch màng phổi [48]. Siêu âm tim xuyên lồng ngực cũng hữu ích trong sự khác biệt này và có 86% nhất trí với catheter động mạch phổi khi chẩn đoán rối loạn chức năng tim [49]. Cuối cùng, nếu chẩn đoán ARDS hoặc phù phổi do tim vẫn còn là câu hỏi sau chụp X quang phổi và siêu âm tim, đặt catheter động mạch phổi có thể cần thiết, trong khi lưu ý rằng tỷ lệ biến chứng với thủ thuật này ở bệnh nặng đã được báo cáo cao tới 9,5% [50–52]. Hơn nữa, một PAOP > 18 mm Hg với chỉ số tim bình thường đã được báo cáo ở 29% bệnh nhân có ARDS [43] đã biết.
Có tính đến định nghĩa EALI [41] và định nghĩa của Berlin về ARDS [7], trường hợp bệnh nhân được trình bày ở trên sẽ được coi là có EALI nhưng vẫn chưa đáp ứng tiêu chuẩn chẩn đoán ARDS. Việc đánh giá chức năng tim sẽ không cần thiết để đáp ứng các tiêu chí chẩn đoán ARDS vì suy hô hấp của bệnh nhân có thể được giải thích bằng sự hiện diện của viêm phổi. Mặc dù bệnh nhân chỉ nhận được một lượng oxy khiêm tốn, bệnh nhân có nguy cơ 53% về sự phát triển ARDS trong tương lai và cần thở máy. Do đó, theo dõi như bệnh nhân ICU là một cách bố trí thích hợp cho bệnh nhân này.
10. Đánh giá bệnh nhân với ARDS
Một phụ nữ 24 tuổi không có tiền sử bệnh sử trong quá khứ nhưng gần đây đã bắt đầu hút thuốc lá được nhận vào ICU với sốt, ho, khó thở và suy hô hấp do thiếu oxy tiến triển nhanh chóng. Cô được yêu cầu thông khí cơ học xâm lấn với một PaO 2/FiO2 ban đầu là 80 mmHg. Chụp X quang ngực cho thấy sự thâm nhiễm phế nang hai bên (Hình 4), và không có dấu hiệu rối loạn chức năng thất trái. Mặc dù điều trị bằng kháng sinh phổ rộng cho viêm phổi mắc phải cộng đồng mà cô không cải thiện trong ba ngày tiếp theo. Vi khuẩn của đờm là âm tính. Có bất kỳ thử nghiệm bổ sung nào có lợi trong việc đánh giá bệnh nhân này với ARDS không?
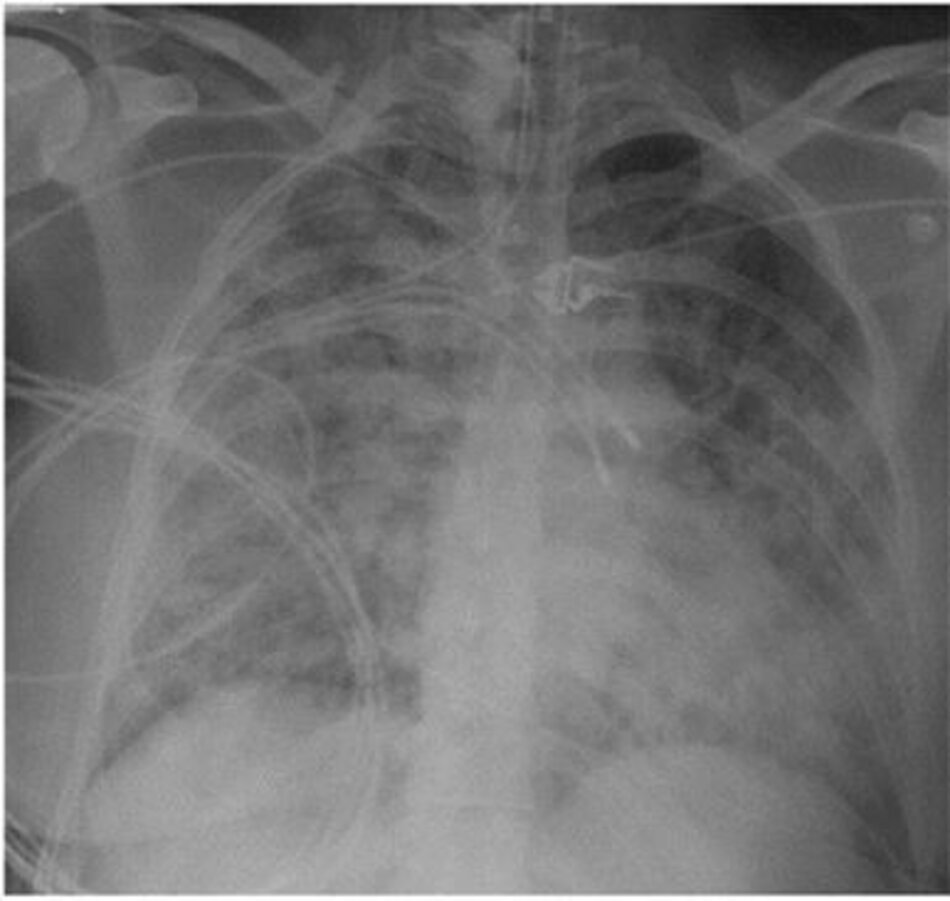
Không thể quá nhấn mạnh rằng ARDS là một hội chứng chỉ định của một chẩn đoán cơ bản. Nếu không được công nhận và điều trị dựa trên chẩn đoán cơ bản, ARDS khó có khảnăng cải thiện. Các chẩn đoán tiềm ẩn có thể không rõ ràng ở bệnh nhân bị bệnh nặng, an thần hoặc hôn mê không thể cung cấp một lịch sử hoàn chỉnh.
Ví dụ, các quá trình trong ổ bụng như viêm tụy, viêm túi mật hoặc thủng tạng rỗng có thể xảy ra trừ khi nghi ngờ lâm sàng dẫn đến xét nghiệm thích hợp. Các quá trình truyền nhiễm không điển hình như viêm phổi do nấm, bệnh vẩy nến hoặc bệnh do côn trùng đốt sinh ra sẽ không đáp ứng với liệu pháp kháng sinh thông thường cho bệnh viêm phổi do mắc phải cộng đồng và có thể bỏ qua nếu không thu được tiền sử và xét nghiệm thích hợp.
Quá liều thuốc cũng có thể dẫn đến ARDS hoặc trực tiếp hoặc do hậu quả của hít sặc và có thể bị bỏ qua trừ khi các xét nghiệm độc chất thích hợp được yêu cầu. Vì lý do này, chẩn đoán ARDS nên được xem như điểm khởi đầu trong đánh giá chẩn đoán chứ không phải điểm cuối, và chẩn đoán cơ bản dẫn đến ARDS [15] phải luôn được nghiên cứu kỹ lưỡng, bao gồm việc xem xét các nguyên nhân bất thường của ARDS [53,54]. Tầm quan trọng của một bệnh sử toàn diện và nếu bệnh nhân không thể cung cấp bệnh sử (thường là vậy), mọi nỗ lực phải được thực hiện để liên hệ với gia đình hoặc bạn bè để có được một mô tả đầy đủ về tiền sử bệnh tật và bất kỳ tiếp xúc nào.
11. Bắt chước ARDS (Mimickers of ARDS)
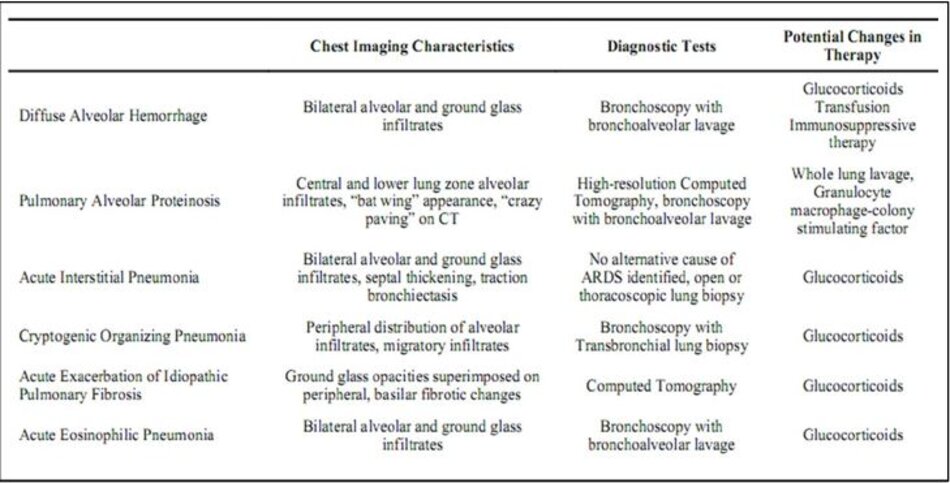
Cách tiếp cận chẩn đoán phân biệt ở bệnh nhân ARDS cũng nên bao gồm các mimickers ARDS. Mặc dù các định nghĩa của ARDS [7,39] bao gồm các thông số làm giảm khả năng phân loại sai giữa phù phổi do tim và các bệnh phổi mãn tính với ARDS, có những điều kiện khác có thể biểu lộ sâu sắc với thiếu oxy máu, thâm nhiễm phế nang hai bên, và không có bằng chứng rối loạn chức năng thất trái . Chẩn đoán như xuất huyết phế nang, proteine phế nang phổi, viêm phổi kẽ cấp tính, viêm phổi tổ chức không đặc hiệu, viêm phổi tăng bạch cầu ái toan cấp tính và đợt cấp của xơ hóa phổi tự phát có thể đáp ứng tiêu chí chẩn đoán ARDS (Bảng 3); tuy nhiên, các hội chứng này không phải là kết quả của các cơ chế viêm giống nhau, điều này cho thấy nguyên nhân trực tiếp và gián tiếp của ARDS và việc điều trị có thể khác nhau tùy theo chẩn đoán. Cần chú ý cẩn thận đến khả năng chẩn đoán thay thế ở bệnh nhân ARDS, đặc biệt là khi không xác định rõ nguyên nhân cơ bản rõ ràng cho ARDS.
12. Đánh giá xâm lấn ARDS
Lấy mẫu xâm lấn của phổi, trong trường hợp không có chẩn đoán sau khi thử nghiệm không xâm lấn, có thể hỗ trợ trong việc xác định nguyên nhân của ARDS. Soi phế quản bằng ống nội soi mềm với rửa phế quản phế nang (BAL, bronchoalveolar lavage) có thể đóng một vai trò trong việc xác định nguyên nhân của ARDS và đánh giá đối với các mimickers ARDS. Trong thiết lập viêm phổi là nguyên nhân gây ra ARDS, rửa phế quản phế nang có thể có độ nhạy cao tới 60% để xác định một mầm bệnh cụ thể [55].
Soi nội soi cũng có thể hữu ích ở bệnh nhân ARDS kéo dài do viêm phổi do thở máy mới được chẩn đoán bằng rửa phế quản phế nang xảy ra ở khoảng 36% bệnh nhân ARDS [56] và có thể kéo dài sự phục hồi của bệnh nhân từ chẩn đoán ban đầu. Trong trường hợp được trình bày ở trên, bệnh nhân trải qua soi phế quản bằng ống nội soi mềm và được tìm thấy có 48% số lượng tế bào là bạch cầu ái toan trong rửa phế quản phế nang và được chẩn đoán là viêm phổi bạch cầu ái toan cấp tính. Sau khi chẩn đoán này được thực hiện, cô được điều trị bằng glucocorticoid dẫn đến rút ống ba ngày sau [57]. Trường hợp viêm phổi bạch cầu ái toan cấp tính mô phỏng ARDS nhấn mạnh rằng nếu nguyên nhân cơ bản của ARDS không được xác định và bệnh nhân không được cải thiện với điều trị theo kinh nghiệm nguyên nhân phổ biến của ARDS, xét nghiệm xâm lấn có thể hữu ích cho chẩnđoán và điều trị cụ thể.
Sinh thiết phổi mở cũng có thể đóng vai trò tương tự ở bệnh nhân ARDS không phân biệt và đã đưa ra một chẩn đoán thay thế và thay đổi điều trị ở 60% bệnh nhân, với vài biến chứng chính [58,59]. Trong một nghiên cứu, ngay cả trong bối cảnh suy hô hấp thiếu oxy được đánh dấu (có nghĩa là PaO2/FiO2 = 145 mmHg, SD ± 61), các biến chứng lớn chỉ xảy ra ở 7% bệnh nhân không có ca tử vong liên quan đến thủ thuật [59]. Thực tế, một nghiên cứu Papazian và cộng sự [58] cho thấy không có sự thay đổi đáng kể về giá trị khí máu động mạch trước và sau phẫu thuật, trong khi tỷ lệ PaO2/FiO2 tăng lên sau thủ thuật. Trong tổng số 93 trường hợp sinh thiết phổi được mô tả trong hai nghiên cứu này, chúng ta có thể kết luận rằng trong một bệnh nhân được lựa chọn có ARDS và không xác định nguyên nhân cơ bản, nguy cơ sinh thiết phổi mở có thể chấp nhận được, thủ thuật này có thể cung cấp thêm những thông tin có thể làm thay đổi điều trị.
13. Kết luận
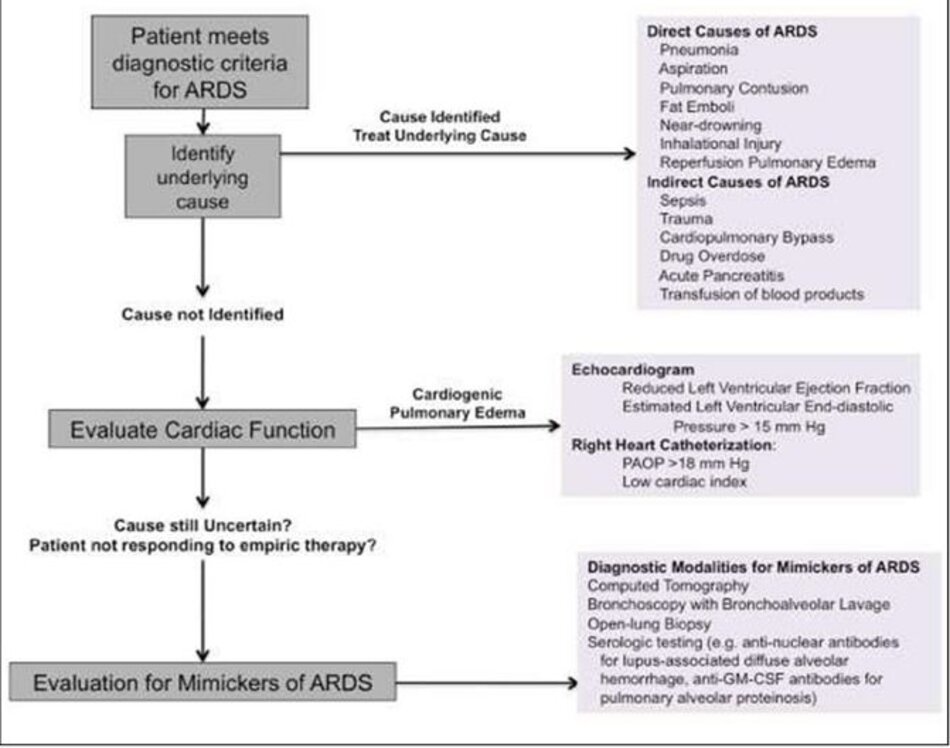
Do tỷ lệ mắc và tử vong cao của ARDS ở những bệnh nhân nặng, mỗi BS cần có phương pháp tiếp cận cạnh giường (Hình 5) để xác định sớm bệnh nhân có nguy cơ bị ARDS và đánh giá thích hợp bệnh nhân đáp ứng tiêu chí chẩn đoán ARDS. Những tiến bộ gần đây như Điểm dự đoán chấn thương phổi, Điểm số chấn thương phổi cấp tính sớm và xác nhận tỷ lệ SpO 2/FiO2 để đánh giá mức độ thiếu oxy là tất cả các công cụ thiết thực để hỗ trợ BS trong việc chăm sóc bệnh nhân có nguy cơ ARDS và có khả năng trở nên quan trọng hơn trong tương lai vì điều trị phòng ngừa nhiều hơn cho ARDS được điều tra. Đối với những bệnh nhân đáp ứng tiêu chí chẩn đoán ARDS, người BS nên tập trung tìm kiếm một nguyên nhân cơ bản cũng như khả năng đồng thời của một quá trình bệnh lý cơ bản bắt chước hội chứng lâm sàng của ARDS.
14. Những điểm chính
1. Trước khi đáp ứng các tiêu chuẩn chính thức để chẩn đoán ARDS, bệnh nhân có thể biểu hiện các dấu hiệu có thể được sử dụng để thông báo cho BS tại giường về nguy cơ phát triển ARDS và suy hô hấp trong tương lai.
2. Sớm thực hiện các liệu pháp, chẳng hạn như thông khí bảo vệ phổi, ở bệnh nhân có nguy cơ có thể ngăn chặn sự phát triển của ARDS.
3. Thử nghiệm không xâm lấn, chẳng hạn như lấy tỉ lệ độ bão hòa oxy động mạch với nồng độ oxy khí hít vào (SpO2/FiO2) và siêu âm tim, có thể có giá trị trong việc đánh giá tại giường bệnh nhân suy hô hấp và thâm nhiễm 2 phổi.
4. Sau khi chẩn đoán ARDS được thực hiện, bác sĩ tại giường nên bắt đầu tìm kiếm kỹ lưỡng nguyên nhân cơ bản của ARDS.
5. Trong trường hợp không có yếu tố nguy cơ trực tiếp hoặc gián tiếp đối với ARDS, BS cũng nên xem xét rối loạn chức năng tim và mimickers ARDS trong chẩn đoán phân biệt của họ về suy hô hấp và thâm nhiễm hai bên trên hình ảnh x quang ngực.
15. References
1. Rubenfeld GD, Caldwell E, Peabody E, et al. Incidence and outcomes of acute lung injury. N Engl J Med. 2005;353(16):1685–1693. doi: 10.1056/NEJMoa050333. [PubMed] [Cross Ref]
2. Herridge MS, Tansey CM, Matté A, et al. Functional disability 5 years after acute respiratory distress syndrome. N Engl J Med. 2011;364(14):1293–1304. doi: 10.1056/NEJMoa1011802. [PubMed] [Cross Ref]
3. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med. 2000;342(18):1301–1308. doi: 10.1056/NEJM200005043421801. [PubMed] [Cross Ref]
4. Guérin C, Reignier J, Richard J-C, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368(23):2159–2168. doi: 10.1056/NEJMoa1214103. [PubMed] [Cross Ref]
5. Papazian L, Forel J-M, Gacouin A, et al. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med. 2010;363(12):1107–1116. doi: 10.1056/NEJMoa1005372. [PubMed] [Cross Ref]
6. Ferguson ND, Frutos-Vivar F, Esteban A, et al. Acute respiratory distress syndrome: underrecognition by clinicians and diagnostic accuracy of three clinical definitions. Crit Care Med. 2005;33(10):2228– 2234. [PubMed]
7. ARDS Definition Task Force. Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition. 2012;307:2526–2533. doi: 10.1001/jama.2012.5669. [PubMed] [Cross Ref]
8. Esteban A, Frutos-Vivar F, Muriel A, et al. Evolution of Mortality over Time in Patients Receiving Mechanical Ventilation. Am J Respir Crit Care Med. 2013;188(2):220–230. doi: 10.1164/rccm.201212- 2169OC. [PubMed] [Cross Ref]
9. Ketoconazole for early treatment of acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. The ARDS Network. JAMA. 2000;283(15):1995–2002. [PubMed]
10. Steinberg KP, Hudson LD, Goodman RB, et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. N Engl J Med. 2006;354(16):1671–1684. doi: 10.1056/NEJMoa051693. [PubMed] [Cross Ref]
11. National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network. Matthay MA, Brower RG, et al. Randomized, placebo-controlled clinical trial of an aerosolized β2-agonist for treatment of acute lung injury. Am J Respir Crit Care Med. 2011;184(5):561–
568. doi: 10.1164/rccm.201012-2090OC. [PMC free article] [PubMed] [Cross Ref]
12. Rice TW, Wheeler AP, Thompson BT, et al. Enteral omega-3 fatty acid, gamma-linolenic acid, and antioxidant supplementation in acute lung injury. JAMA. 2011;306(14):1574–1581. doi: 10.1001/jama.2011.1435. [PMC free article] [PubMed] [Cross Ref]
13. Determann RM, Royakkers A, Wolthuis EK, et al. Ventilation with lower tidal volumes as compared with conventional tidal volumes for patients without acute lung injury: a preventive randomized controlled trial. Crit Care. 2010;14(1):R1. doi: 10.1186/cc8230. [PMC free article] [PubMed] [Cross Ref]
14. Futier E, Constantin J-M, Paugam-Burtz C, et al. A trial of intraoperative low-tidal-volume ventilation in abdominal surgery. N Engl J Med. 2013;369(5):428–437. doi: 10.1056/NEJMoa1301082. [PubMed] [Cross Ref]
15. Ware LB, Matthay MA. The acute respiratory distress syndrome. N Engl J Med. 2000;342(18):1334– 1349. doi: 10.1056/NEJM200005043421806. [PubMed] [Cross Ref]
16. Moss M, Guidot DM, Steinberg KP, et al. Diabetic patients have a decreased incidence of acute respiratory distress syndrome. Crit Care Med. 2000;28(7):2187–2192. [PubMed]
17. Iribarren C, Jacobs DR, Sidney S, Gross MD, Eisner MD. Cigarette smoking, alcohol consumption, and risk of ARDS: a 15-year cohort study in a managed care setting. Chest. 2000;117(1):163–168. [PubMed]
18. Mangialardi RJ, Martin GS, Bernard GR, et al. Hypoproteinemia predicts acute respiratory distress syndrome development, weight gain, and death in patients with sepsis. Ibuprofen in Sepsis Study Group. Crit Care Med. 2000;28(9):3137–3145. [PubMed]
19. Levitt JE, Bedi H, Calfee CS, Gould MK, Matthay MA. Identification of early acute lung injury at initial evaluation in an acute care setting prior to the onset of respiratory failure. Chest. 2009;135(4):936– 943. doi: 10.1378/chest.08-2346. [PMC free article] [PubMed] [Cross Ref]
20. Iscimen R, Cartin-Ceba R, Yilmaz M, et al. Risk factors for the development of acute lung injury in patients with septic shock: an observational cohort study. Crit Care Med. 2008;36(5):1518–1522. doi: 10.1097/CCM.0b013e31816fc2c0. [PubMed] [Cross Ref]
21. Trillo-Alvarez C, Cartin-Ceba R, Kor DJ, et al. Acute lung injury prediction score: derivation and validation in a population-based sample. Eur Respir J. 2011;37(3):604–609. doi: 10.1183/09031936.00036810. [PubMed] [Cross Ref]
22. Matthay MA, Zimmerman GA, Esmon C, et al. Future research directions in acute lung injury: summary of a National Heart, Lung, and Blood Institute working group. Am J Respir Crit Care Med. 2003;167(7):1027–1035. doi: 10.1164/rccm.200208-966WS. [PubMed] [Cross Ref]
23. Gong MN. Genetic epidemiology of acute respiratory distress syndrome: implications for future prevention and treatment. Clin Chest Med. 2006;27(4):705–24. doi: 10.1016/j.ccm.2006.07.001. abstractx. [PMC free article] [PubMed] [Cross Ref]
24. Gajic O, Frutos-Vivar F, Esteban A, Hubmayr RD, Anzueto A. Ventilator settings as a risk factor for acute respiratory distress syndrome in mechanically ventilated patients. Intensive Care Med. 2005;31(7):922–926. doi: 10.1007/s00134-005-2625-1. [PubMed] [Cross Ref]
25. Khan H, Belsher J, Yilmaz M, et al. Fresh-frozen plasma and platelet transfusions are associated with development of acute lung injury in critically ill medical patients. Chest. 2007;131(5):1308–1314. doi: 10.1378/chest.06-3048. [PubMed] [Cross Ref]
26. Janz DR, Zhao Z, Koyama T, et al. Longer storage duration of red blood cells is associated with an increased risk of acute lung injury in patients with sepsis. Ann Intensive Care. 2013;3(1):33. doi: 10.1186/2110-5820-3-33. [PMC free article] [PubMed] [Cross Ref]
27. Spragg RG, Bernard GR, Checkley W, et al. Beyond mortality: future clinical research in acute lung injury. 2010;181:1121–1127. doi: 10.1164/rccm.201001-0024WS. [PMC free article] [PubMed] [Cross Ref]
28. Gajic O, Dabbagh O, Park PK, et al. Early identification of patients at risk of acute lung injury: evaluation of lung injury prediction score in a multicenter cohort study. Am J Respir Crit Care Med. 2011;183(4):462–470. doi: 10.1164/rccm.201004-0549OC. [PMC free article] [PubMed] [Cross Ref]
29. Kor DJ, Talmor DS, Banner-Goodspeed VM, et al. Lung Injury Prevention with Aspirin (LIPS-A): a protocol for a multicentre randomised clinical trial in medical patients at high risk of acute lung injury. BMJ Open. 2012;2(5) doi: 10.1136/bmjopen-2012-001606. [PMC free article] [PubMed] [Cross Ref]
30. Schmickl CNC, Shahjehan KK, Li GG, et al. Decision support tool for early differential diagnosis of acute lung injury and cardiogenic pulmonary edema in medical critically ill patients. Chest. 2012;141(1):43–50. doi: 10.1378/chest.11-1496. [PMC free article] [PubMed] [Cross Ref]
31. Park PK, Birkmeyer NO, Gentile NT, Chang SY, Dabbagh O, Gajic O. Early cumulative fluid balance and development of acute lung injury. Am J Respir Crit Care Med. 2011:A5592.
32. Serpa Neto A, Cardoso SO, Manetta JA, et al. Association between use of lung-protective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome: a meta-analysis. JAMA. 2012;308(16):1651–1659. doi: 10.1001/jama.2012.13730. [PubMed] [Cross Ref]
33. Janz DR, Ware LB. Biomarkers of ALI/ARDS: Pathogenesis, Discovery, and Relevance to Clinical Trials. Semin Respir Crit Care Med. 2013;34(4):537–548. doi: 10.1055/s-0033-1351124. [PubMed] [Cross Ref]
34. van der Heijden M, van Nieuw Amerongen GP, Koolwijk P, van Hinsbergh VWM, Groeneveld ABJ. Angiopoietin-2, permeability oedema, occurrence and severity of ALI/ARDS in septic and non-septic critically ill patients. Thorax. 2008;63(10):903–909. doi: 10.1136/thx.2007.087387. [PubMed] [Cross Ref]
35. Gallagher DC, Parikh SM, Balonov K, et al. Circulating angiopoietin 2 correlates with mortality in a surgical population with acute lung injury/adult respiratory distress syndrome. Shock. 2008;29(6):656– 661. doi: 10.1097/shk.0b013e31815dd92f. [PMC free article] [PubMed] [Cross Ref]
36. Agrawal A, Matthay MA, Kangelaris KN, et al. Plasma angiopoietin-2 predicts the onset of acute lung injury in critically ill patients. Am J Respir Crit Care Med. 2013;187(7):736–742. doi: 10.1164/rccm.201208-1460OC. [PMC free article] [PubMed] [Cross Ref]
37. Determann RM, Millo JL, Waddy S, Lutter R, Garrard CS, Schultz MJ. Plasma CC16 levels are associated with development of ALI/ARDS in patients with ventilator-associated pneumonia: a retrospective observational study. BMC Pulm Med. 2009;9:49. doi: 10.1186/1471-2466-9-49. [PMC free article] [PubMed] [Cross Ref]
38. Fuchs-Buder T, de Moerloose P, Ricou B, et al. Time course of procoagulant activity and D dimer in bronchoalveolar fluid of patients at risk for or with acute respiratory distress syndrome. Am J Respir Crit Care Med. 1996;153(1):163–167. doi: 10.1164/ajrccm.153.1.8542111. [PubMed] [Cross Ref]
39. Bernard GR, Artigas A, Brigham KL, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. 1994;149:818–824. doi: 10.1164/ajrccm.149.3.7509706. [PubMed] [Cross Ref]
40. Thille AW, Esteban A, Fernández-Segoviano P, et al. Comparison of the Berlin definition for acute respiratory distress syndrome with autopsy. Am J Respir Crit Care Med. 2013;187(7):761–767. doi: 10.1164/rccm.201211-1981OC. [PubMed] [Cross Ref]
41. Levitt JE, Calfee CS, Goldstein BA, Vojnik R, Matthay MA. Early Acute Lung Injury: Criteria for Identifying Lung Injury Prior to the Need for Positive Pressure Ventilation. Crit Care Med. 2013 doi: 10.1097/CCM.0b013e31828a3d99. [PMC free article] [PubMed] [Cross Ref]
42. Ferguson ND, Meade MO, Hallett DC, Stewart TE. High values of the pulmonary artery wedge pressure in patients with acute lung injury and acute respiratory distress syndrome. Intensive Care Med. 2002;28(8):1073–1077. doi: 10.1007/s00134-002-1354-y. [PubMed] [Cross Ref]
43. National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network. Wheeler AP, Bernard GR, et al. Pulmonary-artery versus central venous catheter to guide treatment of acute lung injury. N Engl J Med. 2006;354(21):2213–2224. doi: 10.1056/NEJMoa061895. [PubMed] [Cross Ref]
44. Rice TW, Wheeler AP, Bernard GR, et al. Comparison of the SpO2/FIO2 ratio and the PaO2/FIO2 ratio in patients with acute lung injury or ARDS. Chest. 2007;132(2):410–417. doi: 10.1378/chest.07- 0617. [PubMed] [Cross Ref]
45. Mayordomo-Colunga J, Pons M, López Y, et al. Predicting non-invasive ventilation failure in children from the SpO2/FiO2 (SF) ratio. Intensive Care Med. 2013;39(6):1095–1103. doi: 10.1007/s00134-013- 2880-5. [PubMed] [Cross Ref]
46. Ware LB, Matthay MA. Clinical practice. Acute pulmonary edema. N Engl J Med. 2005;353(26):2788–2796. doi: 10.1056/NEJMcp052699. [PubMed] [Cross Ref]
47. Ely EW, Haponik EF. Using the chest radiograph to determine intravascular volume status: the role of vascular pedicle width. Chest. 2002;121(3):942–950. [PubMed]
48. Aberle DR, Wiener-Kronish JP, Webb WR, Matthay MA. Hydrostatic versus increased permeability pulmonary edema: diagnosis based on radiographic criteria in critically ill patients. Radiology. 1988;168(1):73–79. doi: 10.1148/radiology.168.1.3380985. [PubMed] [Cross Ref]
49. Kaul S, Stratienko AA, Pollock SG, Marieb MA, Keller MW, Sabia PJ. Value of two-dimensional echocardiography for determining the basis of hemodynamic compromise in critically ill patients: a prospective study. J Am Soc Echocardiogr. 1994;7(6):598–606. [PubMed]
50. Harvey S, Harrison DA, Singer M, et al. Assessment of the clinical effectiveness of pulmonary artery catheters in management of patients in intensive care (PAC-Man): a randomised controlled trial. Lancet. 2005;366(9484):472–477. doi: 10.1016/S0140-6736(05)67061-4. [PubMed] [Cross Ref]
51. Binanay C, Califf RM, Hasselblad V, et al. Evaluation study of congestive heart failure and pulmonary artery catheterization effectiveness: the ESCAPE trial. JAMA. 2005;294(13):1625–1633. doi: 10.1001/jama.294.13.1625. [PubMed] [Cross Ref]
52. Shah MR, Hasselblad V, Stevenson LW, et al. Impact of the pulmonary artery catheter in critically ill patients: meta-analysis of randomized clinical trials. JAMA. 2005;294(13):1664–1670. doi: 10.1001/jama.294.13.1664. [PubMed] [Cross Ref]
53. Morgan WK. “Zamboni disease.” Pulmonary edema in an ice hockey player. Arch Intern Med. 1995;155(22):2479–2480. [PubMed]
54. Abdulla KA, Davidson NM. A woman who collapsed after painting her soles. Lancet. 1996;348(9028):658. doi: 10.1016/S0140-6736(96)04506-0. [PubMed] [Cross Ref]
55. Meduri GU, Reddy RC, Stanley T, El-Zeky F. Pneumonia in acute respiratory distress syndrome. A prospective evaluation of bilateral bronchoscopic sampling. Am J Respir Crit Care Med. 1998;158(3):870–875. doi: 10.1164/ajrccm.158.3.9706112. [PubMed] [Cross Ref]
56. Markowicz P, Wolff M, Djedaïni K, et al. Multicenter prospective study of ventilator-associated pneumonia during acute respiratory distress syndrome. Incidence, prognosis, and risk factors. ARDS Study Group. Am J Respir Crit Care Med. 2000;161(6):1942–1948. doi: 10.1164/ajrccm.161.6.9909122. [PubMed] [Cross Ref]
57. Janz DR, O’Neal HR, Ely EW. Acute eosinophilic pneumonia: A case report and review of the literature. Crit Care Med. 2009;37(4):1470–1474. doi: 10.1097/CCM.0b013e31819cc502. [PubMed] [Cross Ref]
58. Papazian L, Thomas P, Bregeon F, et al. Open-lung biopsy in patients with acute respiratory distress syndrome. Anesthesiology. 1998;88(4):935–944. [PubMed]
59. Patel SR, Karmpaliotis D, Ayas NT, et al. The role of open-lung biopsy in ARDS. Chest. 2004;125(1):197–202. [PubMed]





