Tác giả: Bác sĩ Đặng Thanh Tuấn – Trưởng khoa hồi sức ngoại Bệnh viện Nhi Đồng 1.
Tóm tắt:
Bối cảnh
Hiệu quả của oxy hóa qua màng ngoài cơ thể (ECMO) ở bệnh nhân với hội chứng suy hô hấp cấp tính nặng (ARDS) vẫn còn gây tranh cãi.
Phương pháp
Trong một thử nghiệm lâm sàng quốc tế, chúng tôi đã chỉ định ngẫu nhiên các bệnh nhân mắc ARDS rất nặng, được chỉ định bởi một trong ba tiêu chí – tỷ lệ PaO2/FiO2 < 50 mm Hg trong hơn 3 giờ; PaO2/FiO2 < 80 mm Hg trong hơn 6 giờ; hoặc pH máu động mạch dưới 7,25 với PaCO2 ít nhất là 60 mm Hg trong hơn 6 giờ – để nhận ECMO (nhóm ECMO) ngay lập tức hoặc tiếp tục điều trị thông thường (nhóm đối chứng). Việc trao đổi chéo với ECMO là có thể đối với những bệnh nhân trong nhóm đối chứng bị thiếu oxy máu kháng trị. Điểm kết thúc chính là tử vong sau 60 ngày.
Kết quả
Sau 60 ngày, 44 trong số 124 bệnh nhân (35%) trong nhóm ECMO và 57 trong số 125 (46%) trong nhóm đối chứng đã chết (RR 0,76; 95% CI, 0,55 đến 1,04; P = 0,09). Sự trao đổi chéo với ECMO xảy ra trung bình (± SD) là 6,5 ± 9,7 ngày sau khi ngẫu nhiên ở 35 bệnh nhân (28%) trong nhóm đối chứng, với 20 trong số những bệnh nhân này (57%) tử vong. Tần suất biến chứng không khác biệt đáng kể giữa các nhóm, ngoại trừ có nhiều biến cố chảy máu dẫn đến truyền máu ở nhóm ECMO so với nhóm đối chứng (46% so với 28% bệnh nhân; chênh lệch nguy cơ tuyệt đối, 18 điểm phần trăm; 95 % CI, 6 đến 30) cũng như nhiều trường hợp giảm tiểu cầu nghiêm trọng (27% so với 16%; chênh lệch nguy cơ tuyệt đối, 11 điểm phần trăm; 95% CI, 0 đến 21) và ít trường hợp đột quỵ do thiếu máu cục bộ (không có bệnh nhân so với 5%; chênh lệch nguy cơ tuyệt đối, −5 điểm phần trăm; KTC 95%, −10 đến −2).
Kết luận
Trong số những bệnh nhân mắc ARDS rất nặng, tỷ lệ tử vong trong 60 ngày không thấp hơn đáng kể với ECMO so với chiến lược thở máy thông thường bao gồm ECMO như một liệu pháp cứu hộ.
Mở đầu:
Hội chứng suy hô hấp cấp tính (ARDS) có liên quan đến tỷ lệ tử vong cao mặc dù sử dụng các chiến lược thông khí áp suất thấp, thể tích thấp nhằm mục đích giảm tổn thương phổi do máy thở. Các dạng ARDS nghiêm trọng nhất có thể liên quan đến tỷ lệ tử vong vượt quá 60%. Trong những tình huống này, một số trung tâm sẽ sử dụng oxy hóa qua màng ngoài cơ thể (ECMO). Đã có những tiến bộ lớn trong vài năm qua về công nghệ ECMO.7 Trong bối cảnh này, bệnh nhân được điều trị bằng ECMO trong đại dịch cúm A (H1N1) năm 2009 dường như có lợi, nhưng các nghiên cứu được kiểm tra không ngẫu nhiên. Cùng thời gian đó, một thử nghiệm ngẫu nhiên đã chỉ định bệnh nhân mắc ARDS cho một trung tâm để xem xét ECMO như là một phần của phác đồ điều trị mang lại kết quả đầy hứa hẹn, mặc dù các vấn đề về phương pháp đã hạn chế các kết luận có thể rút ra từ thử nghiệm. Chúng tôi đã thiết kế Thử nghiệm Rescue Lung Injury in Severe ARDS (EOLIA) để xác định hiệu quả của việc bắt đầu ECMO sớm ở những bệnh nhân có dạng ARDS nặng nhất.
Phương pháp
Thiết kế thử nghiệm
Chúng tôi đã tiến hành một thử nghiệm ngẫu nhiên, quốc tế. Mỗi hội đồng đánh giá đạo đức độc lập địa phương đã phê duyệt giao thức dùng thử, có sẵn với toàn văn của bài viết này tại NEJM.org. Thử nghiệm được tài trợ và thực hiện phần lớn ở Pháp bởi Direction de la Recherche Clinique et du Développement, Assistance Publique–Hôpitaux de Paris, với sự tài trợ của Bộ Y tế Pháp. Các trung tâm quốc tế ghi danh bệnh nhân bên ngoài nước Pháp là nhà tài trợ hợp pháp cho thử nghiệm tại quốc gia của họ. Một ủy ban giám sát an toàn và dữ liệu độc lập định kỳ xem xét kết quả thử nghiệm. Các thành viên của ủy ban viết đã viết tất cả các bản nháp của bản thảo. Tất cả các tác giả đã phê duyệt phiên bản cuối cùng của bản thảo và đưa ra quyết định nộp nó để xuất bản. Họ cũng xác minh dữ liệu và chứng từ về tính đầy đủ của dữ liệu, tính chính xác của các phân tích và tính trung thực của thử nghiệm với giao thức.
Maquet-Getinge cung cấp các công thức HLS ECMO, thiết bị CardioHelp và các mạch (HLS Set Advanced 7.0). Cả Maquet-Getinge và các nhà tài trợ thử nghiệm đều không tham gia thiết kế thử nghiệm; việc thu thập, phân tích hoặc giải thích dữ liệu; hoặc việc viết hoặc đệ trình bản thảo. Thông tin bổ sung được cung cấp trong Phụ lục bổ sung, có sẵn tại NEJM.org.
Bệnh nhân
Bệnh nhân đủ điều kiện đăng ký nếu điều kiện của họ đáp ứng định nghĩa của Hội nghị đồng thuận châu Âu của Mỹ cho ARDS,14 nếu họ đã được đặt nội khí quản và đã được thở máy dưới 7 ngày và nếu họ đáp ứng các tiêu chí về mức độ nghiêm trọng của bệnh như được nêu trong Phần II.1 của Phụ lục bổ sung (bao gồm tỷ lệ PaO2/FiO2 < 50 mm Hg trong hơn 3 giờ; PaO2/FiO2 < 80 mm Hg trong hơn 6 giờ; hoặc pH máu động mạch dưới 7,25 với PaCO2 ít nhất là 60 mm Hg trong hơn 6 giờ, với nhịp thở tăng lên 35 nhịp thở mỗi phút và điều chỉnh thông khí cơ học để điều chỉnh áp suất cao nguyên ≤ 32 cm nước) mặc dù tối ưu hóa máy thở (được định nghĩa là FiO2 ≥0,80, thể tích khí lưu thông 6 ml/kg trọng lượng cơ thể dự đoán và PEEP ≥10 cm nước). Các bác sĩ đã được khuyến khích sử dụng các chất ức chế thần kinh cơ và tư thế nằm sấp trước khi ngẫu nhiên. Các phương pháp điều trị bổ trợ khác, chẳng hạn như hít oxit nitric, thủ thuật huy động phế nang (được sử dụng để phục hồi các đơn vị phổi bị xẹp và bằng cách áp dụng áp lực đường thở duy trì > 35 cm nước),2 thông khí dao động tần số cao hoặc almitrine truyền dịch, được cho phép theo quyết định của các bác sĩ lâm sàng có trách nhiệm.
Tiêu chí loại trừ là độ tuổi dưới 18 tuổi; nhận thở máy trong 7 ngày hoặc lâu hơn; mang thai; trọng lượng hơn 1 kg trên mỗi cm chiều cao hoặc chỉ số khối cơ thể (trọng lượng tính bằng kilôgam chia cho bình phương chiều cao tính bằng mét) là hơn 45; suy hô hấp mãn tính lâu dài được điều trị bằng liệu pháp oxy hoặc thông khí không xâm lấn; suy tim dẫn đến ECMO tĩnh mạch; tiền sử giảm tiểu cầu do heparin; ung thư với tuổi thọ dưới 5 năm; tình trạng bệnh hoặc giá trị Điểm sinh lý cấp tính đơn giản (SAPS-II) trên 90 (theo thang điểm từ 0 đến 163, với điểm số cao hơn cho thấy mức độ nghiêm trọng của bệnh tật cao hơn) vào ngày ngẫu nhiên; tình trạng hôn mê không do thuốc hiện tại sau khi ngừng tim; tổn thương thần kinh không hồi phục; quyết định giữ lại hoặc rút các liệu pháp duy trì sự sống; một khó khăn dự kiến trong việc có thể tiếp cận mạch máu đối với ECMO ở tĩnh mạch đùi hoặc tĩnh mạch cảnh; hoặc một tình huống trong đó thiết bị ECMO không có sẵn ngay lập tức.
Tiến trình thử nghiệm
Ngẫu nhiên được phân tầng theo trung tâm và thời gian thông khí trước khi ngẫu nhiên (<72 giờ so với ≥ 72 giờ). Việc che giấu ngẫu nhiên được đảm bảo bằng hệ thống ngẫu nhiên hóa tập trung, an toàn, dựa trên Web. Các trung tâm không phải ECMO có chuyên môn sâu trong điều trị bệnh nhân mắc ARDS có thể đưa vào bệnh nhân nếu nhóm thực hiện ECMO có thể thiết lập ECMO trong vòng 2 giờ sau khi ngẫu nhiên hóa và chuyển bệnh nhân đến trung tâm ECMO. Một giao thức được chỉ định trước đã được sử dụng để điều trị cho bệnh nhân trong nhóm đối chứng đã trải qua ngẫu nhiên tại các trung tâm ECMO và tại các trung tâm không phải ECMO (xem Phụ lục bổ sung).
Bệnh nhân được chỉ định vào nhóm ECMO đã trải qua thiết lập cannula tĩnh mạch-tĩnh mạch qua da. Chống đông máu đã đạt được với heparin không phân đoạn được điều chỉnh theo thời gian thromboplastin một phần được kích hoạt mục tiêu từ 40 đến 55 giây hoặc hoạt động chống Xa giữa 0,2 và 0,3 IU mỗi ml.
Các bệnh nhân trong nhóm đối chứng được điều trị thở máy theo chiến lược huy động gia tăng từ thử nghiệm Express. Các chất ức chế thần kinh cơ và thời gian nằm sấp kéo dài16 được khuyến khích. Thủ thuật huy động phế nang, oxit nitric hít, prostacyclin hít hoặc almitrine tiêm tĩnh mạch có thể được sử dụng khi không đạt được mục tiêu oxy hóa. Việc trao đổi chéo với ECMO cho bệnh nhân trong nhóm đối chứng được cho phép nếu họ bị thiếu oxy máu kháng trị (SaO2 < 80% trong > 6 giờ, mặc dù đã sử dụng các liệu pháp điều trị có sẵn và khả thi) và nếu bác sĩ điều trị nghĩ rằng bệnh nhân không có suy đa cơ quan không thể đảo ngược và ECMO có thể thay đổi kết quả. Đối với những bệnh nhân được điều trị tại các trung tâm không phải ECMO, nhóm thiết lập ECMO di động đã được cảnh báo.
Điểm kết thúc
Điểm kết thúc chính là tử vong sau 60 ngày. Điểm cuối thứ yếu quan trọng là thất bại điều trị, được xác định là chéo đối với ECMO hoặc tử vong ở bệnh nhân trong nhóm đối chứng và tử vong ở bệnh nhân trong nhóm ECMO. Các điểm cuối khác bao gồm tỷ lệ tử vong ở các thời điểm khác, thời gian tử vong cho đến ngày 60 và phân tích điều trị trong đó tỷ lệ tử vong được so sánh giữa những bệnh nhân sử dụng ECMO và những người không dùng. Điểm cuối an toàn bao gồm tỷ lệ tràn khí màng phổi, đột quỵ, nhiễm trùng tại vị trí đặt ống thông ECMO, huyết khối cannula, thay đổi hệ thống bộ dây ECMO, tan máu nội mạch, viêm phổi do thở máy, biến chứng xuất huyết nặng. Các điểm cuối thứ cấp khác được liệt kê trong Phụ lục bổ sung. Tử vong trực tiếp được quy cho thủ tục ECMO nếu chúng xảy ra trong bối cảnh thiết bị ECMO bị hỏng, thuyên tắc khí lớn, ngừng tim do đông máu hệ thống bộ dây ECMO, sốc nhiễm trùng do nhiễm trùng tại vị trí can thiệp ECMO, xuất huyết nội sọ, tràn khí màng phổi chèn ép, hoặc chảy máu ồ ạt dẫn đến truyền ít nhất 10 đơn vị tế bào hồng cầu.
Phân tích thống kê
Tỷ lệ tử vong dự kiến sau 60 ngày là 60% trong nhóm được thở máy thông thường và ước tính khoảng 40% trong số những người nhận được hỗ trợ ECMO sớm. Chúng tôi đã tính toán rằng, để thử nghiệm có 80% năng lượng, ở mức độ alpha là 5 % và với phân tích tuần tự theo nhóm xảy ra sau khi ngẫu nhiên cứ 60 người tham gia, mẫu tối đa sẽ cần phải là 331 người tham gia. Đối với điểm kết thúc chính, phương pháp thiết kế tuần tự với các quy tắc dừng được xác định theo thử nghiệm hình tam giác hai mặt đã được áp dụng. Thiết kế hình tam giác hai mặt cho phép dừng sớm để có bằng chứng về sự vượt trội của ECMO, một dự đoán thiếu sự khác biệt đáng kể hoặc bằng chứng về tác hại. Thông tin chi tiết về thiết kế được nêu trong Phần II.2 của Phụ lục bổ sung.
Các đặc điểm của bệnh nhân tại đường cơ sở được báo cáo là tỷ lệ phần trăm cho các biến phân loại và phương tiện (với độ lệch chuẩn) hoặc trung vị (với các phạm vi liên dải) cho các biến liên tục, nếu phù hợp. Các phân tích chính được thực hiện theo nguyên tắc cố ý điều trị và không sử dụng thống kê kiểm tra phân tầng. Các biến phân loại được so sánh với các thử nghiệm chính xác chi-square hoặc Fisher, và các biến liên tục được so sánh với thử nghiệm t-Student Student hoặc thử nghiệm Wilcoxon, nếu phù hợp. Các đường cong của Kaplan – Meier về tỷ lệ tử vong cho đến 60 ngày sau khi ngẫu nhiên được so sánh với kiểm tra thứ hạng log. Các thử nghiệm Friedman và các thử nghiệm không theo dõi khác được sử dụng để so sánh các phép đo lặp đi lặp lại theo thời gian. Một phân tích độ nhạy theo kế hoạch đã được thực hiện với việc sử dụng mô hình hồi quy Cox để điều chỉnh các biến số cơ bản được xác định trước: nguyên nhân của ARDS, tình trạng cùng tồn tại, tuổi của bệnh nhân, thời gian thở máy trước khi ngẫu nhiên, mức độ nghiêm trọng của bệnh và trung tâm. Chúng tôi đã tiến hành các phân tích khám phá bài hoc về điểm cuối chính trong các nhóm nhỏ quan tâm. Dựa vào số lượng các thủ tục chéo xảy ra ở những bệnh nhân trong nhóm đối chứng, chúng tôi đã thực hiện phân tích thời gian thất bại cấu trúc bảo tồn sau xếp hạng để điều chỉnh chéo trong ước tính tỷ lệ sống (xem Phụ lục bổ sung). Tất cả các phân tích được tiến hành ở mức độ alpha hai mặt là 5%.
Tất cả các phân tích được thực hiện với việc sử dụng phần mềm R, phiên bản 3.3.3 (Nền tảng R), ngoại trừ phân tích tuần tự của điểm cuối chính, trong đó chúng tôi đã sử dụng phần mềm SAS, phiên bản 9.2 (Viện SAS) và PEST (mô hình phần mềm ước tính tham số phụ thuộc và phân tích độ không đảm bảo), version 4.
Các kết quả:
Bệnh nhân
Sau khi bao gồm 240 bệnh nhân, phân tích tạm thời theo kế hoạch lần thứ tư (vào tháng 4 năm 2017) cho thấy ranh giới dưới của tam giác quy tắc dừng đã được vượt qua (Hình S1 trong Phụ lục bổ sung). Bởi vì không có sự khác biệt đáng kể giữa các nhóm về tỷ lệ tử vong sau 60 ngày đã được tìm thấy, thử nghiệm đã bị dừng lại, theo các quy tắc được quy định trước.
Trong số 1015 bệnh nhân đủ điều kiện tham gia, có 249 bệnh nhân trải qua ngẫu nhiên: 124 được chỉ định cho nhóm ECMO và 125 cho nhóm đối chứng (Hình 1). Tổng cộng có 3 bệnh nhân trong nhóm ECMO không nhận được ECMO (1 bệnh nhân đã cải thiện lâm sàng nhanh chóng và 2 bệnh nhân tử vong ngay sau khi ngẫu nhiên hóa) và 35 bệnh nhân (28%) trong nhóm đối chứng đã chuyển qua thực hiện ECMO do thiếu oxy kháng trị. (± SD) là 6,5 ± 9,7 ngày sau khi ngẫu nhiên hóa.
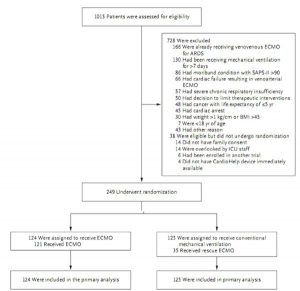
Các đặc điểm của bệnh nhân tại đường cơ sở (ngẫu nhiên) là tương tự nhau trong hai nhóm (Bảng 1 và Bảng S1 trong Phụ lục bổ sung). Nguyên nhân chính của ARDS là viêm phổi do vi khuẩn (ở 45% bệnh nhân) và viêm phổi do virus (ở 18%) và 78% bệnh nhân bị nhiễm trùng huyết nặng hoặc sốc nhiễm trùng. Trước khi ngẫu nhiên, 59% bệnh nhân đã trải qua tư thế nằm sấp, và 74% đã nhận được thuốc vận mạch.
Điều trị thử
Trong số 121 bệnh nhân trong nhóm ECMO đã nhận ECMO ở mức trung bình 3,3 ± 2,8 giờ sau khi ngẫu nhiên, việc đặt cannula được thực hiện ở tĩnh mạch đùi và tĩnh mạch cảnh ở 116 (96%). Tổng cộng 48 trong số 124 bệnh nhân (39%) đã được nhóm cứu hộ ECMO di động (Bảng S2 trong Phụ lục bổ sung) lấy ra từ các trung tâm không phải ECMO. Hỗ trợ ECMO kéo dài trung bình 15 ± 13 ngày (Hình S2 trong Phụ lục bổ sung).
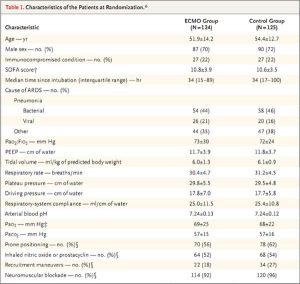
Bệnh nhân trong nhóm ECMO có thể tích khí lưu thông, áp lực cao nguyên, áp lực đẩy (chênh lệch giữa áp suất cao nguyên và PEEP) và nhịp hô hấp giảm từ mức cơ bản đến mức lớn hơn các giá trị tương ứng trong nhóm đối chứng, trong khi mức độ máu động mạch các khí trong nhóm ECMO được bình thường hóa trong những ngày ngay sau khi ngẫu nhiên hóa (Figs. S3 đến S6 trong Phụ lục bổ sung). Bệnh nhân trong nhóm đối chứng, bất kể họ được điều trị tại trung tâm có thực hiện ECMO hay trung tâm không thực hiện ECMO, đều được thở máy với áp suất thấp, thể tích thấp theo tiêu chuẩn chăm sóc hiện tại (Bảng S3 và Hình S7 trong Phụ lục bổ sung). Trong nhóm đối chứng, 113 bệnh nhân (90%) được đặt ở tư thế nằm sấp, 104 (83%) được sử dụng oxit nitric hít hoặc prostacyclin hít và 100% nhận thuốc ức chế thần kinh cơ sau khi ngẫu nhiên hóa (Bảng 2 và Bảng S3 trong Phụ lục bổ sung).
Điểm kết thúc
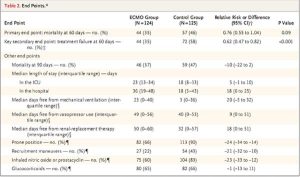
Sau 60 ngày, 44 bệnh nhân (35%) trong nhóm ECMO và 57 (46%) trong nhóm đối chứng đã chết (nguy cơ tương đối, 0,76; khoảng tin cậy 95% [CI], 0,55 đến 1,04; P = 0,09) (Bảng 2). Tỷ lệ nguy hiểm tử vong trong vòng 60 ngày sau khi ngẫu nhiên trong nhóm ECMO, so với nhóm đối chứng, là 0,70 (KTC 95%, 0,47 đến 1,04; P = 0,07) (Hình 2). Điều chỉnh các yếu tố tiên lượng quan trọng không thay đổi kết quả.
Điểm kết thúc thứ hai
Nguy cơ tương đối của thất bại điều trị, được xác định là tử vong vào ngày 60 ở những bệnh nhân thuộc nhóm ECMO và là chéo với ECMO hoặc tử vong ở những bệnh nhân trong nhóm đối chứng, là 0,62 (KTC 95%, 0,47 đến 0,82; P <0,001) (Bảng 2, và Bảng S5 và Hình S8 trong Phụ lục bổ sung). Sau 60 ngày, bệnh nhân trong nhóm ECMO có nhiều ngày hơn đáng kể so với những người trong nhóm đối chứng không có tư thế nằm sấp (59 so với 46 ngày; chênh lệch trung bình, 13 ngày; CI 95%, 5 đến 59) và không cần điều trị thay thế thận (50 so với 32 ngày; chênh lệch trung bình, 18 ngày; KTC 95%, 0 đến 51) (Bảng 2 và Bảng S6 trong Phụ lục bổ sung).
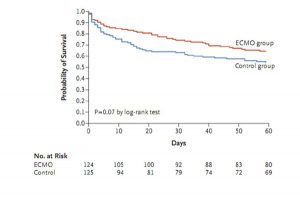
Sau 60 ngày, bệnh nhân trong nhóm ECMO cũng có nhiều ngày hơn đáng kể so với những người trong nhóm đối chứng không bị suy thận (46 so với 21 ngày; chênh lệch trung bình, 25 ngày; 95% CI, 6 đến 53) và suy tim (48 so với 41 ngày; chênh lệch trung bình, 7 ngày; KTC 95%, 0 đến 51), theo các thành phần cơ quan cụ thể về điểm số SOFA (Bảng S6 trong Phụ lục bổ sung). Suy đa cơ quan, suy hô hấp và sốc nhiễm trùng là những nguyên nhân chính gây tử vong ở hai nhóm. Các phân tích phân nhóm cho thấy không có sự tương tác đáng kể về tỷ lệ tử vong trong 60 ngày với các đặc điểm nhân khẩu học, mức độ nghiêm trọng ARDS hoặc ngẫu nhiên tại các trung tâm ECMO so với các trung tâm không phải ECMO (Hình S9 trong Phụ lục bổ sung).
Chuyển chéo sang ECMO
Tổng cộng có 35 bệnh nhân (28%) trong nhóm đối chứng được điều trị ECMO trong điều trị thiếu oxy máu kháng trị ở mức trung bình 6,5 ± 9,7 ngày sau khi ngẫu nhiên (trung bình, 4 ngày; phạm vi liên vùng, 1 đến 7; phạm vi, 0 đến 50). Những bệnh nhân này có giá trị cao hơn đáng kể so với các bệnh nhân khác trong nhóm đối chứng về áp lực cao nguyên đường cơ sở trung bình (31,7 ± 5,5 so với 28,5 ± 4,1 cm nước; chênh lệch trung bình, 3,2 cm nước; 95% CI, 1,2 đến 5,2) và áp lực đẩy (20,2 ± 6,1 so với 16,6 ± 5,3 cm nước; chênh lệch trung bình, 3,6 cm nước; 95% CI, 1,2 đến 6,0), độ giãn nở hệ hô hấp thấp hơn (21,3 ± 9,2 so với 27,1 ± 11,0 ml mỗi centimet nước, chênh lệch trung bình, -5,8 ml mỗi centimet nước, 95% CI, −10,4 đến -1,1) và có nhiều góc phần tư với thâm nhiễm trong X quang lồng ngực (3,7 ± 0,6 so với 3,3 ± 0,9; , 0,5 góc phần tư; KTC 95%, 0,1 đến 0,8) – tất cả các phát hiện cho thấy ARDS nặng hơn ở những bệnh nhân được cứu ECMO (Bảng S7 trong Phụ lục bổ sung). Vào thời điểm họ nhận được ECMO, trung vị PaO2/FiO2 ở những bệnh nhân này là 51 mm Hg (phạm vi liên vùng, 46 đến 61) và SaO2 trung vị là 77% (phạm vi liên vùng, 74 đến 87). Trong suốt 24 giờ trước khi trao đổi chéo với ECMO, các giá trị PaO2/FiO2, SaO2 và pH ở những bệnh nhân này đã giảm đáng kể và PaCO2 tăng đáng kể (Bảng S8 trong Phụ lục bổ sung).
Những bệnh nhân này cũng có dấu hiệu suy tim mạch tiến triển nhanh chóng, được biểu thị bằng sự gia tăng đáng kể trong 24 giờ trước khi vượt qua mức độ trung bình của lactate huyết thanh trung bình, từ 1,7 mmol mỗi lít (khoảng xen kẽ, 1,3 đến 2,2) đến 3,2 mmol mỗi lít (phạm vi liên vùng, 1,5 đến 6,2) và ở điểm vận mạch (inotropic), từ 10 μg mỗi kg trọng lượng cơ thể mỗi phút (phạm vi liên vùng, 0 đến 55) đến 90g mỗi kg mỗi phút (phạm vi liên vùng, 45 đến 215) (Bảng S8 trong Phụ lục bổ sung). Trước khi trao đổi chéo, 9 bệnh nhân bị ngừng tim, 7 bệnh nhân bị suy tim phải nặng và 11 bệnh nhân bị suy thận dẫn đến chạy thận. ECMO tĩnh mạch được áp dụng ở 7 bệnh nhân, trong đó có 6 bệnh nhân đã nhận ECMO trong khi tiến hành hồi sức tim phổi. Tỷ lệ tử vong sau 60 ngày là 57% (20 trong số 35 bệnh nhân) trong số các bệnh nhân trong nhóm đối chứng đã chuyển qua ECMO so với 41% (37 trong số 90 bệnh nhân) trong số các bệnh nhân khác trong nhóm đối chứng (nguy cơ tương đối 1,39; 95% CI, 0,95 đến 2,03). Các kết quả của phân tích thời gian thất bại cấu trúc bảo toàn thứ hạng với sự điều chỉnh cho chéo có chọn lọc được cung cấp trong Phụ lục bổ sung.
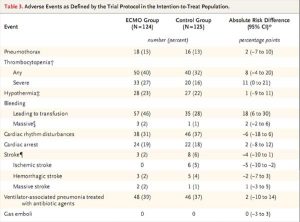
Những sự kiện bất lợi
Một bệnh nhân trong mỗi nhóm đã chết vì các biến chứng liên quan đến việc đặt cannula ECMO. Bệnh nhân trong nhóm ECMO có tỷ lệ cao hơn đáng kể so với những người trong nhóm kiểm soát giảm tiểu cầu nặng (<20.000 tiểu cầu trên một milimét khối; 27% so với 16%; chênh lệch rủi ro tuyệt đối, 11 điểm phần trăm; 95% CI, 0 đến 21) và biến cố chảy máu dẫn đến truyền hồng cầu lắng (46% so với 28%; chênh lệch rủi ro tuyệt đối, 18 điểm phần trăm; KTC 95%, 6 đến 30). Tỷ lệ đột quỵ do thiếu máu cục bộ ở nhóm ECMO thấp hơn so với nhóm đối chứng (không có bệnh nhân so với 5%; chênh lệch rủi ro tuyệt đối, −5 điểm phần trăm; 95% CI, −10 đến −2), nhưng tỷ lệ đột quỵ xuất huyết tương tự ở hai nhóm (Bảng 3 và Bảng S9 trong Phụ lục bổ sung). Tỷ lệ tràn khí màng phổi, viêm phổi do thở máy và chảy máu ồ ạt là tương tự nhau ở hai nhóm. Trong số tất cả các bệnh nhân được điều trị bằng ECMO, tỷ lệ chảy máu là 53%, tỷ lệ khối máu tụ tại vị trí đặt ống thông là 6%, tỷ lệ nhiễm trùng tại vị trí đặt ống thông là 14% và tỷ lệ tan máu nội mạch là 5%.
Thảo luận
Trong thử nghiệm ngẫu nhiên này liên quan đến các bệnh nhân mắc ARDS rất nặng, việc áp dụng ECMO sớm không kết hợp đến tỷ lệ tử vong sau 60 ngày (điểm cuối chính) thấp hơn đáng kể so với nhóm đối chứng. Mặc dù việc sử dụng ECMO cho suy hô hấp nghiêm trọng đã tăng đáng kể trong thập kỷ qua, nhưng việc sử dụng ECMO vẫn còn gây tranh cãi. Kết quả của hai thử nghiệm ngẫu nhiên đầu tiên của ECMO đã gây thất vọng, nhưng các thử nghiệm đã được thực hiện cách đây hàng thập kỷ. Kết quả của thử nghiệm gần đây nhất (Hỗ trợ thông khí thông thường so với ECMO đối với suy hô hấp ở người trưởng thành nặng [CESAR]) rất đáng khích lệ, nhưng không phải tất cả bệnh nhân trong nhóm ECMO đều được sử dụng ECMO và việc sử dụng thở máy trong nhóm đối chứng không được tiêu chuẩn hóa. Trong thử nghiệm hiện tại, 98% bệnh nhân trong nhóm ECMO đã nhận ECMO và được vận chuyển trong khi nhận ECMO đến trung tâm giới thiệu nếu cần. Hơn nữa, 90% bệnh nhân trong nhóm đối chứng trải qua nằm sấp kéo dài16 và tất cả họ đều được dùng thuốc ức chế thần kinh cơ.
Mặc dù sử dụng các chiến lược này, đã được chứng minh là cải thiện kết quả, 28% bệnh nhân trong nhóm kiểm soát trong thử nghiệm của chúng tôi đã chuyển qua ECMO để điều trị thiếu oxy máu kháng trị. Tỷ lệ chéo này gây khó khăn cho việc đưa ra kết luận dứt khoát về tính hữu ích của ECMO đối với các dạng ARDS nghiêm trọng. Chúng tôi đã nhận thức được vấn đề tiềm ẩn này khi chúng tôi bắt đầu thử nghiệm, nhưng nhiều nhà điều tra cảm thấy rằng việc cấm sử dụng ECMO ở những bệnh nhân bị thiếu oxy rất nặng là không hợp lý. Điểm cuối của cái chết tổng hợp thứ cấp được chỉ định trước (trong cả hai nhóm) cộng với sự giao nhau với ECMO (trong nhóm kiểm soát) cho thấy lợi ích của nhóm ECMO, nhưng điều này khó diễn giải theo kết quả tiêu cực cho điểm cuối chính. Phân tích thứ cấp này rõ ràng thể hiện sự thiên vị so với nhóm đối chứng, nhưng điều quan trọng là chỉ ra rằng các bệnh nhân đã qua ECMO bị bệnh nặng (SaO2 < 80% trong > 6 giờ, mặc dù đã điều trị huy động, hít oxit nitric hoặc prostacyclin và tư thế nằm sấp; một số bệnh nhân đã nhận được ECMO trong quá trình hồi sức tim phổi hoặc nhận được hỗ trợ ECMO tĩnh mạch vì suy tim nặng). Trong phân tích độ nhạy, các kết quả liên quan đến điểm cuối thứ cấp này vẫn có ý nghĩa ngay cả với giả định rằng một phần ba trong số những bệnh nhân bị bệnh nặng này sẽ sống sót mà không có ECMO (Bảng S5 trong Phụ lục bổ sung).
Thử nghiệm của chúng tôi có một số hạn chế. Đầu tiên, nó đã bị dừng trên mỗi giao thức sau khi đạt được 75% kích thước mẫu tính toán tối đa. Thứ hai, tỷ lệ chéo 28% ở những bệnh nhân bị thiếu oxy máu kháng trị trong nhóm đối chứng có thể đã làm giảm tác dụng tiềm tàng của ECMO. Thứ ba, chúng tôi bao gồm các bệnh nhân tại các trung tâm ECMO và các trung tâm giới thiệu không phải ECMO. Tuy nhiên, các phương pháp điều trị được xác định nghiêm ngặt theo giao thức trong mỗi nhóm và bệnh nhân trải qua ngẫu nhiên tại các trung tâm không phải ECMO đã nhanh chóng được chuyển đến trung tâm ECMO địa phương trong khi họ đang nhận ECMO. Hơn nữa, các chiến lược thông khí được áp dụng trong các trung tâm ECMO và các trung tâm không phải ECMO không khác nhau giữa các bệnh nhân trong nhóm đối chứng. Việc bao gồm các bệnh nhân tại các trung tâm ECMO và các trung tâm giới thiệu không phải ECMO cũng có thể được coi là một thế mạnh, vì hầu hết bệnh nhân ở các quốc gia nơi có ECMO sẽ được điều trị ban đầu tại các trung tâm không phải ECMO. Thứ tư, thử nghiệm có lẽ không đủ sức mạnh để phát hiện tỷ lệ tử vong thấp hơn 20% trong nhóm ECMO so với nhóm đối chứng (trong đó cho phép chuyển qua ECMO để điều trị thiếu oxy máu kháng trị).
Tóm lại, phân tích điểm cuối chính (tỷ lệ tử vong sau 60 ngày) trong thử nghiệm của chúng tôi liên quan đến các bệnh nhân mắc ARDS rất nặng cho thấy không có lợi ích đáng kể của ECMO sớm, so với chiến lược thở máy thông thường, bao gồm cả chéo với ECMO (được sử dụng bởi 28% bệnh nhân trong nhóm đối chứng).
Bài viết gốc: https://www.nejm.org/doi/full/10.1056/NEJMoa1800385





