Bài viết Viêm phổi liên quan đến máy thở ở người lớn: một tổng quan tường thuật bài dịch của BS. Đặng Thanh Tuấn – BV Nhi đồng 1
1. Tóm tắt
Viêm phổi liên quan đến máy thở ( Ventilator- associated pneumonia, VAP) là một trong những bệnh nhiễm trùng mắc phải ICU thường xuyên nhất. Tỷ lệ mắc được báo cáo rất khác nhau từ 5 đến 40% tùy thuộc vào điều kiện và tiêu chuẩn chẩn đoán. VAP có liên quan đến thời gian thở máy và thời gian nằm ICU kéo dài. Tỷ lệ tử vong do VAP ước tính là khoảng 10%, với tỷ lệ tử vong cao hơn ở bệnh nhân ICU phẫu thuật và ở những bệnh nhân có mức độ nghiêm trọng trung bình khi nhập viện. Việc xác nhận nhiễm trùng bằng vi sinh rất được khuyến khích. Việc sử dụng phương pháp lấy mẫu nào vẫn còn là một vấn đề tranh cãi. Các công cụ vi sinh mới nổi có thể sẽ sửa đổi phương pháp tiếp cận thông thường của chúng ta để chẩn đoán và điều trị VAP trong tương lai tiếp theo. Phòng ngừa VAP dựa trên việc giảm thiểu tiếp xúc với thở máy và khuyến khích giải phóng khỏi máy thở sớm. Các gói kết hợp nhiều chiến lược phòng ngừa có thể cải thiện kết quả, nhưng cần có các thửnghiệm ngẫu nhiên lớn để xác nhận điều này. Điều trị nên được giới hạn trong 7 ngày trong đại đa số các trường hợp. Bệnh nhân nên đượcđánh giá lại hàng ngàyđể xác nhận tình trạng nghi ngờ bệnh vẫn tiếp diễn, nên thu hẹp kháng sinh ngay khi có kết quả về tính nhạy cảm với kháng sinh và bác sĩ lâm sàng nên cân nhắc ngừng kháng sinh nếu kết quả cấy âm tính.
2. Take‑home message
Xác nhận vi sinh được khuyến cáo mạnh mẽ khi xem xét chẩn đoán viêm phổi liên quan đến máy thở (VAP). Điều trị kết hợp được khuyến cáo để điều trị ban đầu cho hầu hết bệnh nhân VAP ngoại trừ những người bị bệnh khởi phát sớm mà không có yếu tố nguy cơ đối với mầm bệnh đa kháng đang được điều trị ở những cơ sở có tỷ lệ kháng thuốc thấp. Từ bỏ chuyển sang đơn trị liệu khi đã có kết quả nuôi cấy và khuyến cáo điều trị tổng cộng 7 ngày cho hầu hết bệnh nhân.
3. Giới thiệu
Viêm phổi liên quan đến máy thở (VAP) được xác định do nhiễm trùng nhu mô phổi ở bệnh nhân thở máy xâm nhập trong ít nhất 48 giờ và là một phần của viêm phổi mắc phải ICU. VAP vẫn là một trong những bệnh nhiễm trùng phổ biến nhất ở những bệnh nhân cần thở máy xâm nhập. Bất chấp những tiến bộ gần đây trong các công cụ vi sinh, các tiêu chuẩn dịch tễ học và chẩn đoán VAP vẫn còn gây tranh cãi, làm phức tạp việc giải thích các nghiên cứu điều trị, phòng ngừa và kết quả. VAP tạo ra gánh nặng kinh tế đáng kể. Một đánh giá chi phí gần đây của Hoa Kỳ ước tính rằng chi phí liên quan của VAP là $ 40.144 (95% CI $ 36.286– $ 44.220) [1]. Chúng tôi sẽ tập trung đánh giá này vào hiểu biết hiện tại về dịch tễ học, chẩn đoán, phòng ngừa và điều trị viêm phổi liên quan đến máy thở. Các tình trạng khác như viêm khí quản liên quan đến máy thở không được nêu chi tiết.
4. Dịch tễ học
4.1 Tỷ lệ mắc bệnh
VAP được báo cáo là ảnh hưởng đến 5–40% bệnh nhân thở máy xâm nhập trong hơn 2 ngày, với sự khác biệt lớn tùy thuộc vào quốc gia, loại ICU và tiêu chí được sử dụng để xác định VAP [ 2,3,4]. Tỷ lệ VAP ở các bệnh viện Bắc Mỹ đã được báo cáo là thấp từ 1–2,5 trường hợp mỗi 1000 ngày thở máy [5]. Tuy nhiên, các trung tâm châu Âu báo cáo tỷ lệ cao hơn nhiều. Ví dụ, nghiên cứu EU-VAP/CAP báo cáo mật độ mắc là 18,3 đợt VAP trên 1000 ngày thở máy [6]. Các nước có thu nhập trung bình thấp hơn cũng báo cáo tỷ lệ cao hơn so với các bệnh viện Hoa Kỳ và các nước có thu nhập cao nói riêng (18,5 so với 9,0 trên 1000 ngày thở máy; P = 0,035) [7]. Sự khác biệt lớn này ít nhất một phần được giải thích bởi sự khác biệt về định nghĩa, sự khác biệt về cách áp dụng định nghĩa, giới hạn chẩn đoán của tất cả các định nghĩa và sự khác biệt về phương pháp lấy mẫu vi sinh [8]. Nguy cơ hàng ngày của VAP đạt đỉnh giữa ngày thứ 5-9 của thở máy, trong khi tỷ lệ tích lũy liên quan chặt chẽ với tổng thời gian thở máy [9, 10].
Mạng lưới An toàn Chăm sóc Sức khỏe Quốc gia của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (NHSN) đã báo cáo tỷ lệ mắc VAP cho cả ICU y tế và phẫu thuật đã giảm đáng kể trong 15 năm qua [11]. Tuy nhiên, những kết quả này đã không được xác nhận bởi một phân tích sử dụng định nghĩa ổn định cho VAP được thực hiện bởi Hệ thống Giám sát An toàn Bệnh nhân Medicare (MPSMS) từ năm 2005đến năm 2013 [ 12]. Tỷ lệ mắc VAP là khoảng 10% trong suốt thời gian nghiên cứu ở một nhóm bệnh nhân được chọn từ 65 tuổi trở lên với các chẩn đoán chính là nhồi máu cơ tim cấp, suy tim, viêm phổi và các thủ thuật phẫu thuật lớn theo chương trình [12]. Những khác biệt này cho thấy khả năng có những thay đổi trong cách áp dụng các tiêu chí giám sát và hỗ trợ việc sử dụng các thông số giám sát khách quan hơn [13]. Nghiên cứu toàn diện để xác định các dấu ấn sinh học chẩn đoán mới có thể được quan tâm trong bối cảnh này.
Tỷ lệ mới mắc rất khác nhau dựa trên dân số được nghiên cứu. Ví dụ, tỷ lệ VAP cao tới 24,5/1000 ngày thở máy đã được báo cáo ở bệnh nhân ung thư [14]. Tỷ lệ mắc bệnh cao cũng được báo cáo ở những bệnh nhân chấn thương (17,8% trong một loạt 511 bệnh nhân) [15], được giải thích ít nhất một phần do sự thay đổi chức năng miễn dịch sau chấn thương nặng, hít sặc do chấn thương não và dập phổi [6]. Tỷ lệ gia tăng quan sát thấy ở bệnh nhân bệnh phổi tắc nghẽn mãn tính (chronic obstructive pulmonary disease, COPD) có thể được giải thích là do thời gian thở máy xâm nhập kéo dài (yếu cơ), tỷ lệ cao của vi hít sặc và sự cư trú của vi khuẩn (sự thanh thải niêm mạc bị khiếm khuyết), và các cơ chế bảo vệ cục bộ và chung của vật chủ bị thay đổi [16]. Hội chứng nguy kịch hô hấp cấp tính (Acute respiratory distress syndrome, ARDS) cũng liên quan đến nguy cơ cao bị VAP. Ngay cả khi sử dụng các chiến lược bảo vệ phổi, tỷ lệ mắc bệnh cao tới 29% đã được báo cáo [ 10] ở bệnh nhân ARDS nói chung và 35% ở bệnh nhân được oxygen hóa qua màng ngoài cơ thể (extra-corporeal membrane oxygenation, ECMO) [17].
Tuổi dường như không liên quan đặc biệt với nguy cơ viêm phổi ở bệnh nhân thở máy. Phân tích thứ cấp của một nghiên cứu thuần tập ở châu Âu [ 18] báo cáo 13,7 VAPs trên 1000 ngày thở máy ở bệnh nhân trung niên (45–64 tuổi), 16,6 ở bệnh nhân già (65–74 tuổi) và 13,0 ở bệnh nhân rất già (≥ 75 tuổi) năm). Phân tích hồi quy logistic không thể xác định nguy cơ VAP cao hơn ở bệnh nhân cao tuổi [ 18]. Ngược lại, giới tính nam thường được công nhận là một yếu tố nguy cơ độc lập của VAP [ 19]. Tuy nhiên, yếu tố nguy cơ quan trọng nhất của VAP có thể là các tình trạng bệnh lý cơ bản của bệnh nhân thở máy bao gồm các bệnh đi kèm và mức độ nghiêm trọng của bệnh tật. Việc tính toán sự khác biệt trong quần thể bệnh nhân và định nghĩa VAP là rất quan trọng để thực hiện các chương trình giám sát phù hợp, phân tích sự khác biệt về tỷ lệ VAP giữa các ICU khác nhau và đánh giá các phương pháp điều trị tiềm năng và các chiến lược phòng ngừa. Việc sử dụng có hệ thống mật độ mắc bệnh như một tham số để đánh giá dịch tễ học VAP cũng sẽ hữu ích để đạt được các mục tiêu sau này.
4.2 Kết cục
Mặc dù tử vong do mọi nguyên nhân liên quan đến VAP đã được báo cáo là cao tới 50%, vẫn còn nhiều tranh cãi về mức độ mà VAP góp phần gây tử vong ở bệnh nhân ICU. Ngược lại, VAP luôn có liên quan đến việc kéo dài thời gian thở máy và thời gian nằm ICU.
Các phương pháp khác nhau đã được sử dụng để đánh giá tỷ lệ tử vong do VAP. Các nghiên cứu thuần tập quan sát được thực hiện vào những năm 90 đã báo cáo các kết quả trái ngược nhau [20, 21]. Tuy nhiên, những nghiên cứu này bao gồm các quần thể không đồng nhất và không phải là tiến cứu [22]. Do nguy cơ mắc phải VAP không thay đổi trong suốt thời gian thở máy (nguy cơ cao hơn trong 10 ngày đầu), có nguy cơ sai lệch do tử vong và xuất viện ICU đóng vai trò là tiêu chí cạnh tranh (những bệnh nhân ốm nhất có thểrất thời gian lưu trú ngắn vì chết sớm). Do đó, các phương pháp thống kê phức tạp hơn đã được sử dụng, chẳng hạn như các mô hình rủi ro đa dạng và cạnh tranh, để ước tính tỷ lệ tử vong do VAP gây ra. Một phân tích nguy cơ sống còn cạnh tranh, coi việc xuất viện ICU là nguy cơ cạnh tranh của tử vong do ICU trong số4479 bệnh nhân đượcđiều trịtại ICU của Pháp, báo cáo rằng tỷ lệ tử vong do ICU do VAP gây ra là rất thấp, khoảng 1% vào ngày 30 và 1,5% vào ngày 60 [23]. Ở bệnh nhân ARDS, tỷ lệ tử vong thô lên đến 41,8% đã được báo cáo ở bệnh nhân VAP so với 30,7% ở bệnh nhân không có VAP (P = 0,05) [10]. Tuy nhiên, sau khi điều chỉnh các yếu tố gây nhiễu, VAP không còn liên quan đến tử vong ICU [10]. Ngay cả sau khi sử dụng phương pháp tiếp cận đa trạng thái kiểm soát các yếu tố nguy cơ giống nhau, sự xuất hiện của VAP do vi khuẩn không liên quan đến nguy cơ tử vong do ICU [10]. Điều này phù hợp với các báo cáo gần đây ở bệnh nhân ung thư [14] và bệnh nhân chấn thương sọ não [24], trong đó VAP không liên quan đến tử vong.
Một cách tiếp cận khác để hạn chế nguy cơ sai lệch liên quan đến sự hiện diện của các yếu tố gây nhiễu là sử dụng các thử nghiệm ngẫu nhiên có đối chứng đánh giá tác dụng phòng ngừa đối với VAP và tỷ lệ tử vong. Dựa trên dữ liệu tổng hợp từ 58 nghiên cứu ngẫu nhiên về phòng ngừa VAP, tỷ lệ tử vong do VAP ước tính là 9% [ 25]. Một cách tiếp cận tương tự sử dụng dữ liệu bệnh nhân riêng lẻ để phân tích tổng hợp, bao gồm 6284 bệnh nhân từ24 thử nghiệm phòng ngừa VAP, ước tính tỷ lệ tử vong do bệnh là 13%, với tỷ lệ tử vong cao hơn ở bệnh nhân ICU phẫu thuật và ở bệnh nhân có điểm mức độ nghiêm trọng trung bình khi nhập viện (tức là, Điểm số đánh giá sức khỏe mãn tính và sinh lý học cấp tính [Acute Physiology and Chronic Health Evaluation scores, APACHE 2] 20–29 và điểm số điểm sinh lý học cấp tính đơn giản hóa [Simplified Acute Physiology Score, SAPS 2] là 35–58 [26] Ngược lại, tỷlệtửvong do nguyên nhân là gần bằng 0 ở bệnh nhân chấn thương, bệnh nhân nội khoa và bệnh nhân với mức độ nghiêm trọng của bệnh thấp hoặc cao [26]. Các mầm bệnh kháng thuốc kháng sinh có thểlàm tăng tỷ lệ tử vong liên quan đến VAP mặc dù điều này còn gây tranh cãi [18, 27]. Tóm lại, VAP có liên quan đến thời gian thởmáy kéo dài và thời gian nằm ICU kéo dài, trong khi tỷ lệ tử vong chủ yếu do tình trạng cơ bản của bệnh nhân và mức độ nghiêm trọng của bệnh. Các nghiên cứu trong tương lai nên tập trung vào các nhóm bệnh nhân đồng nhất hơn để làm sáng tỏ tốt hơn e là những đóng góp khác nhau của bệnh cơ bản, loại, và số lượng cơ quan bị suy và đặc điểm nhận dạng mầm bệnh và kháng thuốc đối với nguy cơ tử vong liên quan đến VAP.
4.3 Vi sinh vật liên quan đến VAP
Các sinh vật liên quan đến VAP thay đổi tùy theo nhiều yếu tố bao gồm thời gian thở máy, thời gian nằm viện và thời gian nằm ICU trước khi có VAP, thời gian và mức độ tiếp xúc tích lũy với thuốc kháng sinh, môi trường sinh thái địa phương và sự xuất hiện của bất kỳ hiện tượng dịch bệnh tiềm ẩn nào trong một ICU nhất định. Các vi sinh vật Gram âm thông thường liên quan đến VAP là Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, và các loài Acinetobacter; Staphylococcus aureus là vi sinh vật Gram dương chủ yếu [28,29,30,31,32,33]. Người ta thường thừa nhận rằng VAP khởi phát sớm (trong vòng 4 ngày đầu tiên nhập viện) ở những bệnh nhân khỏe mạnh trước đó không dùng kháng sinh thường liên quan đến hệ vi khuẩn hầu họng bình thường, trong khi VAP khởi phát muộn (xảy ra sau ít nhất 5 ngày nhập viện) và VAP ở bệnh nhân với các yếu tố nguy cơ của mầm bệnh đa kháng thuốc ( multidrug resistant, MDR) có nhiều khả năng là do tác nhân gây bệnh MDR [34]. Tuy nhiên, mầm bệnh MDR có thể được phân lập trong VAP khởi phát sớm, chủ yếu khi có một số yếu tố nguy cơ như tiếp xúc với thuốc kháng sinh trong vòng 90 ngày trướcđó [34,35,36]. Một số báo cáo cho thấy tỷ lệ mầm bệnh MDR tương đương ở bệnh nhân VAP khởi phát sớm và muộn [27, 36, 37]. Các yếu tố nguy cơ khác đối với tác nhân gây bệnh MDR thường được nhận biết bao gồm sự cư trú hoặc nhiễm mầm bệnh MDR trước đó, ARDS trước VAP, điều trị thay thế thận cấp tính trước VAP và sựhiện diện của sốc nhiễm trùng tại thời điểm VAP [ 34]. Hướng dẫn Quốc tế gần đây của Hiệp hội Hô hấp Châu Âu, Hiệp hội Y học Chăm sóc Chuyên sâu Châu Âu, Hiệp hội Vi sinh Lâm sàng và Bệnh Truyền nhiễm Châu Âu và Hiệp hội Mỹ la tinh del Tórax cho rằng cần tính đến các yếu tố nguy cơ bổ sung như tỷ lệ mầm bệnh MDR tại chỗ cao, gần đây thời gian nằm viện kéo dài (> 5 ngày nhập viện) và đã từng có cưu trú mầm bệnh MDR [38]. Đề kháng với cephalosporin thế hệ thứ ba và thứ tư ở các chủng Enterobacteriaceae do sự biểu hiện của các β-lactamase phổ mở rộng (extended-spectrum β-lactamases, ESBLs) mắc phải và/hoặc AmpC β-lactamase là một mối lo ngại lớn [39]. Sự lây lan của các chủng sản xuất carbapenemase cũng là một mối quan tâm ngày càng tăng. Pseudomonas aeruginosa MDR được phân lập ngày càng phổ biến [40]; một nửa đến hai phần ba số chủng Acinetobacter baumannii gây VAP hiện đang kháng carbapenem [ 41]. Sự đề kháng colistin đã tăng lên sau khi tỷ lệ tiêu thụ colistin tăng lên để điều trị các vi sinh vật kháng thuốc trên diện rộng (extensively drug-resistant, XDR) [42]. VAP có thể do nhiều mầm bệnh gây ra, điều này có thể làm phức tạp phương pháp điều trị [32, 43, 44]. Nấm hiếm khi gây ra VAP [45]. Nấm Candida spp. là loại nấm men phổ biến nhất được phân lập trong các mẫu hô hấp [46]. Cưtrú ở đường hô hấp dưới bởi Candida spp. ảnh hưởng đến 27% bệnh nhân thở máy và có thể liên quan đến tăng nguy cơ VAP do vi khuẩn, đáng chú ý nhất là do Pseudomonas aeruginosa [47]. Tuy nhiên, dữ liệu hiện có không hỗ trợ vai trò trực tiếp của Candida spp. như một tác nhân gây bệnh VAP [45]. Trong một báo cáo gần đây, mối quan hệgiữa sự cư trú của Candida spp. và VAP do vi khuẩn đã được đánh giá tiền cứu ở 213 bệnh nhân có biểu hiện suy đa tạng [48]. Trong khi đó 146 bệnh nhân (68,5%) có cư trú của Candida spp. ở khí quản, không tìm thấy mối liên hệ với VAP của vi khuẩn [48]. Aspergillus spp. (chủ yếu là Aspergillus fumigatus) có thểliên quan đến một sốbệnh VAP khởi phát muộn, đặc biệt ở những bệnh nhân có tiền sử cúm gần đây [49]. Một thuật toán lâm sàng được đề xuất gần đây đã đánh giá mức độ liên quan của các mẫu cấy dương tính và có thể hữu ích cho các bác sĩ lâm sàng để quyết định có nên điều trị hay không [ 50]. Cuối cùng, vi rút đường hô hấp bao gồm cúm, vi rút hợp bào hô hấp, và những vi rút khác có thể là nguyên nhân gây ra VAP [51,52,53,54]. Virus Herpesviridae Herpes simplex (HSV) và Cytomegalovirus (CMV) có thể gây viêm phổi tái hoạt do virus ở những bệnh nhân thở máy cơ học bị suy giảm miễn dịch và không bị suy giảm miễn dịch. Bằng chứng mô bệnh học của viêm phế quản phổi do HSV đãđược báo cáo ở 21% bệnh nhân thở máy có tình trạng hô hấp xấu đi [ 55]. Sự tái hoạt của CMV được quan sát thấy ở 20–30% bệnh nhân nặng, đặc biệt ở những người bị suy đa cơ quan và nằm ICU kéo dài [56, 57]. Viêm phổi do CMV đã được chứng minh về mặt mô học đã được báo cáo ở những bệnh nhân ARDS với tình trạng lâm sàng xấu đi dai dẳng và cấy vi khuẩn rửa phế quản phế nang âm tính [58,59,60,61]. Các vi rút khác đã được xác định ở những bệnh nhân thở máy, nhưng khả năng gây bệnh của chúng cần được xác nhận [ 62, 63].
4.4 Chẩn đoán VAP
Chẩn đoán VAP theo truyền thống được xác định bởi sự hiện diện đồng thời của ba tiêu chí sau: nghi ngờ lâm sàng, thâm nhiễm X quang mới hoặc tiến triển và kéo dài, và cấy vi sinh dương tính từ bệnh phẩm đường hô hấp dưới [34, 38, 64, 65].
Chẩn đoán lâm sàng
Bước đầu tiên để chẩn đoán VAP là nghi ngờ lâm sàng. Có nhiều tiêu chuẩn để nghi ngờ VAP (sốt, tăng bạch cầu, giảm oxygen hóa …), nhưng tính hữu ích của chúng, đơn lẻ hoặc kết hợp, không đủ để chẩn đoán VAP [ 66]. Điểm số đã được đề xuất để giúp cải thiện độ chính xác chẩn đoán, được sử dụng nhiều nhất là Điểm số nhiễm trùng phổi lâm sàng (Clinical Pulmonary Infection Score, CPIS) do Pugin và cộng sự [67]: mô tả ban đầu của điểm này dựa trên 6 biến số (nhiệt độ, bạch cầu trong máu, dạng chất tiết khí quản, oxygen hóa, thâm nhiễm X quang và nuôi cấy bán định lượng dịch hút khí quản có nhuộm Gram), và những bệnh nhân có điểm trên 6 là ở nguy cơ mắc VAP. Một nghiên cứu ngẫu nhiên cho thấy rằng việc sử dụng CPIS để xác định thời điểm ngừng kháng sinh dẫn đến việc tiêu thụ kháng sinh ít hơn so với chiến lược lâm sàng về thời lượng kháng sinh cố định [ 68]. Tuy nhiên, việc sử dụng CPIS để xác định thời điểm bắt đầu sử dụng kháng sinh có thể liên quan đến việc sử dụng kháng sinh quá mức do tính đặc hiệu thấp, đặc biệt là so với việc lấy bệnh phẩm đường hô hấp dưới để nuôi cấy [69]. Do đó, các hướng dẫn gần đây không khuyến cáo CPIS để chẩn đoán VAP [34, 65]. VAP nên được nghi ngờ ở những bệnh nhân có dấu hiệu lâm sàng của nhiễm trùng, chẳng hạn như ít nhất hai trong số các tiêu chuẩn sau: sốt mới khởi phát, dịch nội khí quản có mủ, tăng bạch cầu hoặc giảm bạch cầu, tăng thông khí phút, giảm oxygen hóa, và/hoặc tăng nhu cầu cho thuốc vận mạch để duy trì huyết áp. Tuy nhiên, những dấu hiệu này không đặc hiệu cho VAP, và thường có thể được quan sát thấy trong nhiều tình trạng bắt chước VAP (ví dụ, phù phổi, dập phổi, xuất huyết phổi, tắc nút nhày, xẹp phổi, bệnh huyết khối, v.v.).
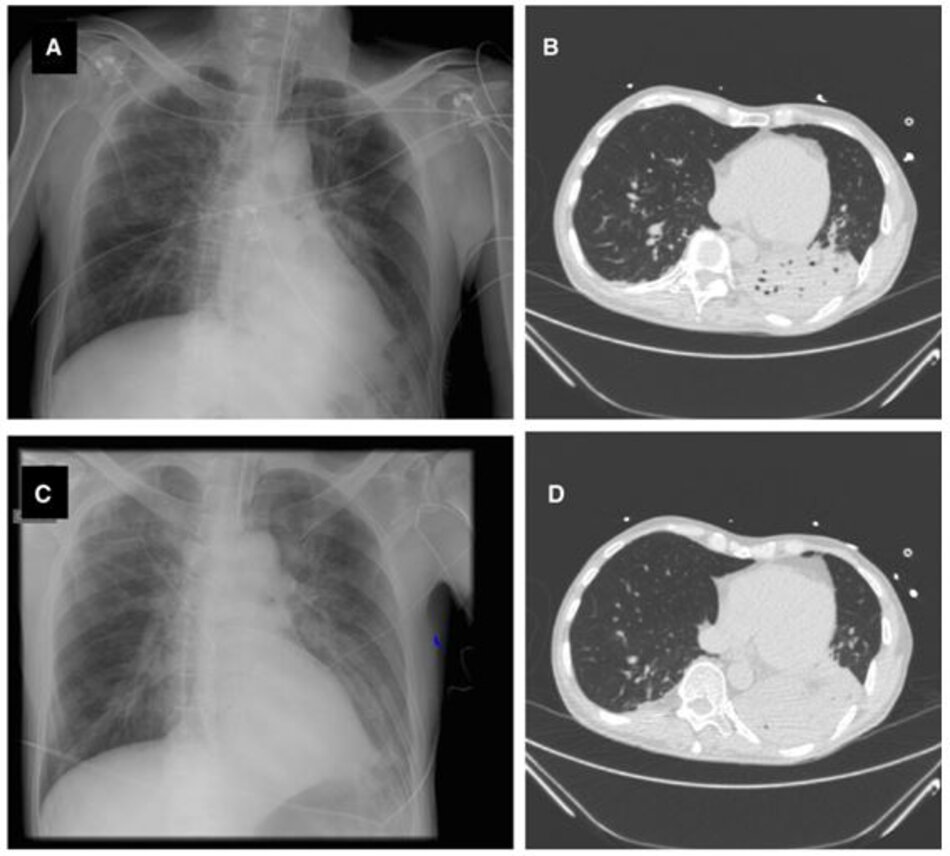
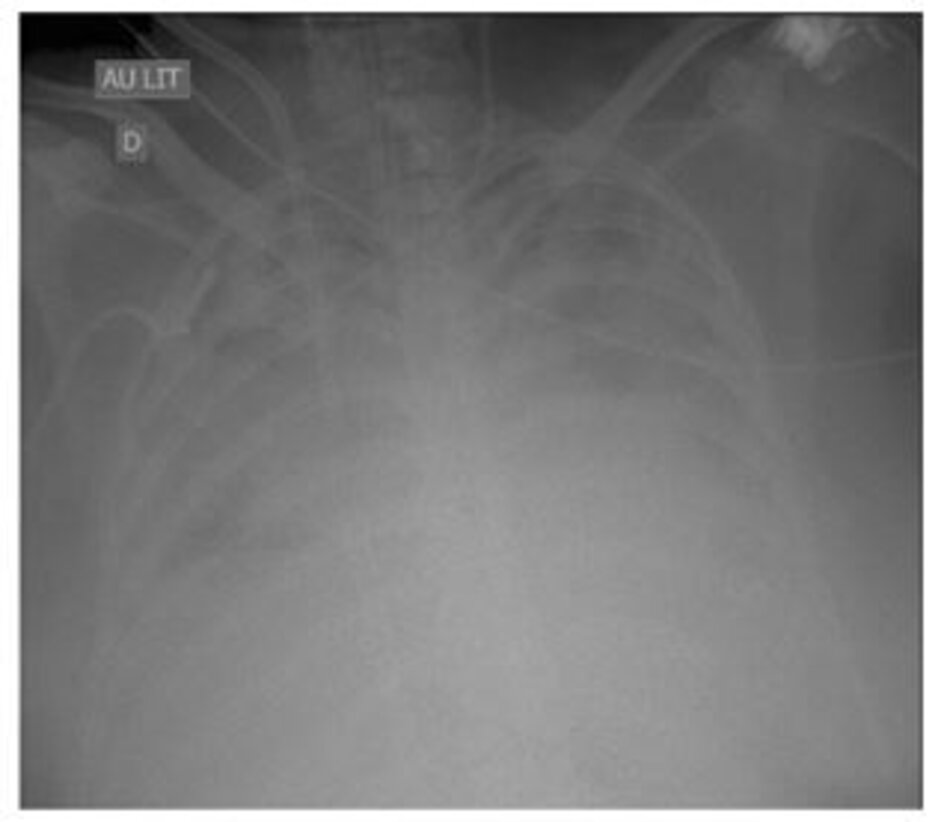
Mặc dù hầu hết tất cả các định nghĩa để nghi ngờ (và chẩn đoán) VAP đều bao gồm các tiêu chuẩn chụp X quang (thâm nhiễm mới hoặc tiến triển và kéo dài), người ta biết rõ rằng X-quang ngực không nhạy và không đặc hiệu đối với VAP [ 64, 66, 70]. Hình 1 và 2 hiển thị hai bệnh nhân có tiêu chuẩn X quang là âm tính giả (Hình 1) hoặc không hữu ích (Hình 2). Chụp cắt lớp vi tính (Computed tomography, CT) có thể là một giải pháp thay thế tốt vì nó nhạy hơn; tuy nhiên, một chiến lược dựa trên CT-scan phổi có hệ thống có những hạn chế rõ ràng, các vấn đề chính là tính khả thi, duy trì sự an toàn của bệnh nhân trong quá trình vận chuyển và tính khả dụng. Siêu âm phổi gần đây đã được đề xuất như một phương pháp hỗ trợ chẩn đoán VAP; tuy nhiên, dữ liệu về độ nhạy và độ đặc hiệu của nó còn thiếu [71].
Các dấu ấn sinh học như protein phản ứng C, procalcitonin hoặc thụ thể kích hoạt hòa tan biểu hiện trên tế bào dòng tủy (sTREM-1) đã được đề xuất làm dấu hiệu chẩn đoán VAP; tuy nhiên, chúng thiếu độ chính xác và cho đến nay, việc sử dụng chúng không được khuyến cáo để chẩn đoán VAP [34, 65, 72,73,74,75].
Cần nghiên cứu thêm để xác định các dấu ấn sinh học nhạy cảm và cụ thể có thể giúp bác sĩ lâm sàng chẩn đoán VAP, xác định tác nhân gây bệnh và hướng dẫn liệu pháp kháng sinh. Một phương pháp tiếp cận tịnh tiến, với việc áp dụng các phương pháp luận vềgen, protein và chuyển hóa, có thểhữu ích trong việc nâng cao hiểu biết của chúng ta về sinh lý bệnh của VAP và giúp xác định các dấu ấn sinh học hoặc hồ sơ hợp lý có thể giúp các bác sĩ lâm sàng [76].
Tóm lại, không có tiêu chí lâm sàng, dấu ấn sinh học hoặc điểm số nào đủ chính xác để chẩn đoán VAP. Dođó, VAP nên được xem xét bất cứ khi nào có dấu hiệu suy giảm hô hấp mới có khả năng do nhiễm trùng (ví dụ, sốt, đờm mủ, tăng bạch cầu, tình trạng thiếu oxy nặng hơn, hạ huyết áp không rõ nguyên nhân, hoặc tăng nhu cầu thuốc vận mạch), có hoặc không có thâm nhiễm phổi mới hoặc tiến triển. Khi nghi ngờ VAP, bước thứ hai của công việc chẩn đoán là thực hiện lấy mẫu vi sinh ( Hình 3).
Chẩn đoán vi sinh
Gần đây, các Hiệp hội khoa học từ Bắc Mỹ và Châu Âu đã đề xuất các khuyến cáo để chẩn đoán VAP [34, 38] (Bảng 1). Các hướng dẫn của Châu Âu [38] đề nghị lấy mẫu định lượng phần xa trước khi điều trị bằng kháng sinh, vì người ta biết rằng, nếu mẫu được lấy sau khi bắt đầu điều trị bằng kháng sinh, kết quả có thể bị thay đổi hoặc âm tính. Việc sử dụng các mẫu cấy định lượng phần xa, có thể cụ thể hơn các kỹ thuật lấy mẫu mù (không trực tiếp), có thể giúp giảm việc sử dụng quá mức kháng sinh, đặc biệt nếu bác sĩ lâm sàng chỉ bắt đầu dùng kháng sinh ở những bệnh nhân có vi khuẩn gram dương, cấy dương tính hoặc nghi ngờ sốc nhiễm trùng [77].
Việc kiểm tra trực tiếp và sửdụng phương pháp nhuộm Gram còn nhiều tranh cãi. Các hướng dẫn của Mỹ [34] đề xuất rằng nhuộm Gram chất lượng cao từ bệnh phẩm đường hô hấp với nhiều sinh vật chiếm ưu thế sẽ hỗ trợ thêm cho việc chẩn đoán VAP. Tuy nhiên, không có vi sinh vật trên nhuộm Gram không loại trừ VAP một cách đáng tin cậy, và điều quan trọng là phải xem xét lại kết quả nuôi cấy. Độ nhạy và độ đặc hiệu hạn chế của nhuộm Gram là một lý do khác để chúng ta cần có các chiến lược chẩn đoán nhanh bổ sung bao gồm các dấu ấn sinh học và xác định vi sinh vật nhanh chóng và các xét nghiệm độ nhạy cảm.
![Hình 3 Biểu diễn sơ đồ chẩn đoán và điều trị VAP. Nghi ngờ lâm sàng của VAP đề cập đến sự kết hợp của một số tiêu chuẩn sau: sốt, đờm mủ, tăng bạch cầu, suy giảm oxygen hóa, hạ huyết áp hoặc sốc không rõ nguyên nhân, thâm nhiễm phổi mới (hoặc tiến triển) trên X-quang phổi (không phải lúc nào cũng quan sát được). Điều trị theo kinh nghiệm có tính đến bệnh cơ bản và mức độnghiêm trọng của nó, sự hiện diện của các yếu tố nguy cơ gây bệnh đa kháng thuốc (điều trị kháng sinh trong 90 ngày trước, nằm viện > 5 ngày, sốc nhiễm trùng khi khởi phát VAP, ARDS trước khi khởi phát VAP, điều trị thay thế thận cấp tính trước khi khởi phát VAP, cư trú mầm bệnh MDR trước đó) và mô hình nhạy cảm với kháng sinh tại chỗ. Bệnh nhân suy giảm miễn dịch, bệnh nhân bị viêm mủ màng phổi, áp xe phổi hoặc viêm phổi hoại tử nên điều trị kháng sinh kéo dài [38]](https://www.healcentral.org/wp-content/uploads/2021/05/b25_anh_3.jpg)
Các “kỹ thuật xâm lấn” này cũng có một số nhược điểm: cần nhân viên có trình độ chuyên môn để thực hiện các thủ thuật này (mặc dù hiện nay đây là kỹ năng có điều kiện để trở thành bác sĩ chuyên khoa ở nhiều nước), các nguy cơ tiềm ẩn cho bệnh nhân (giảm oxy máu, chấn thương khí áp, chảy máu), và các chi phí liên quan, đặc biệt là khi sử dụng ống nội soi phế quản dùng một lần. Tuy nhiên, việc sử dụng BAL qua nội soi phế quản kết hợp với nuôi cấy định lượng có thể giúp xác định đáng tin cậy hơn các tác nhân gây bệnh với độ đặc hiệu cao hơn so với phương pháp lấy mẫu định tính và cho phép lượng dịch hút trở lại đủ để thực hiện các phân tích bổsung (ví dụ: tếbào học, nồngđộalbumin, xác định virus, xác định galactomannan, procollagen III ở bệnh nhân ARDS). Việc nuôi cấy định tính thu được bằng phương pháp lấy mẫu gần như hút nội khí quản có thể đánh giá quá cao sự hiện diện của vi khuẩn có khả năng dẫn đến việc sử dụng kháng sinh không cần thiết và thúc đẩy tình trạng đề kháng kháng sinh. Tuy nhiên, chúng có thể được thực hiện nhanh chóng và đơn giản hơn so với nội soi phế quản, với ít biến chứng và nguồn lực hơn (Hình 3). Một phân tích tổng hợp gồm 5 thử nghiệm ngẫu nhiên so sánh kỹ thuật lấy mẫu vi sinh xâm lấn với nuôi cấyđịnh lượng so với phương pháp lấy mẫu không xâm lấn với nuôi cấy định lượng hoặc bán định lượng không tìm thấy bất kỳ sự khác biệt nào trong kết quả của bệnh nhân [78, 79].
![Bảng 1 Chẩn đoán vi sinh đối với VAP theo các hướng dẫn gần đây [34, 38]](https://www.healcentral.org/wp-content/uploads/2021/05/b25_anh_4.jpg)
Mặc dù không được khuyến cáo bởi các hướng dẫn gần đây, một số bệnh nhân có thể nhận được thuốc kháng sinh trước khi lấy mẫu vi sinh, do đó kết quả sau đó âm tính nhiều lần. Trong những trường hợp như vậy, việc sử dụng đủ liệu trình (7 ngày, xem bên dưới) có thể khiến bệnh nhân tiếp xúc với kháng sinh quá hạn kéo dài và có thể thúc đẩy tình trạng đề kháng kháng sinh. Do đó, khuyến cáo của chúng tôi là đánh giá lại bệnh nhân ở 48–72 h; nếu diễn biến lâm sàng thuận lợi và khả năng nhiễm trùng thấp, có thể ngừng dùng kháng sinh. Một giải pháp khác là sử dụng procalcitonin để dừng kháng sinh ở 48-72 giờ nếu mức procalcitonin < 0,5 ng/mL hoặc giảm hơn 80% so với giá trị đỉnh [ 34, 80, 81]. Một tình huống phổbiến khác là một bệnh nhân dùng kháng sinh trong hơn 48 giờ tại thời điểm lấy mẫu vi sinh (bất kể chỉ định nào, chẳng hạn đối với nhiễm trùng ngoài phổi). Nếu kết quả vi sinh là âm tính, điều đó cho thấy bệnh nhân không bị VAP. Do đó, không nên bắt đầu sử dụng kháng sinh mới và quyết định phải làm gì với phương pháp điều trị kháng sinh hiện tại phải dựa trên chỉ định ban đầu.
4.5 Chẩn đoán vi sinh trong tương lai gần
Một trong những thách thức trong chẩn đoán VAP, bất kể kỹ thuật nào được sử dụng (hút nội khí quản hoặc BAL có hướng dẫn qua nội soi), là giảm thời gian từ khi lấy mẫu đến khi xác định mầm bệnh. Thật vậy, hiện phải mất ít nhất 24-48 giờ sử dụng các phương pháp vi sinh thông thườngđểxácđịnh (các) tác nhân gây bệnh gây nhiễm trùng và độ nhạy cảm của chúng đối với điều trị kháng sinh (Hình 4). Trong thời gian đó, kháng sinh phổ rộng theo kinh nghiệm thường được đưa ra [ 34, 38, 82]. Một trong những vấn đề quan trọng trong quản lý kháng sinh là giảm tiêu thụ kháng sinh phổ rộng [82] bằng cách hạn chếkê đơn và rút ngắn thời gian sửdụng. Trong vài năm qua, các phương pháp phân tử đã được phát triển để giảm thời gian giữa việc lấy mẫu xác định sinh vật và xác định tính nhạy cảm với kháng sinh. Ví dụ, việc sử dụng phản ứng chuỗi polymerase (polymerase chain reaction, PCR) để phát hiện DNA của vi khuẩn có thể rút ngắn thời gian xác định và tính nhạy cảm của sinh vật, nhưng nó bị hạn chế đối với các mầm bệnh và cơ chế kháng cụ thể, ví dụ mecA để phát hiện kháng methicillin ở các chủng Staphyloccocus aureus [83]. Mặc dù kỹ thuật này không có sẵn để xác định các dạng đề kháng đối với các mầm bệnh thường gây ra VAP như Pseudomonas aeruginosa [84] hoặc nó yêu cầu nuôi cấy dương tính để phát hiện các cơ chế kháng thuốc [83], nó thường được sửdụng ở nhiều nơi để cho phép điều trị rất sớm – tăng phạm vi điều trị và thu hẹp điều trị kháng sinh trong các tình huống cụ thể, ví dụ như thu hồi hoặc ngừng sử dụng thuốc kháng sinh chống MRSA (Hình 4).
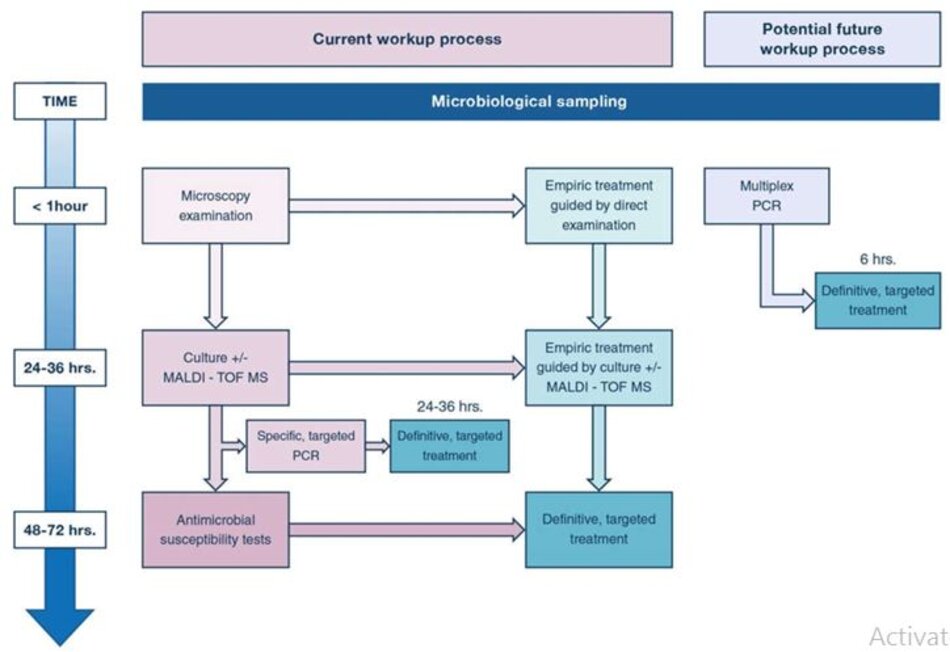
Gần đây, các công cụmới sử dụng multiplex PCR áp dụng trực tiếp cho các mẫu tươi (nội soi phế quản) đã được phát triển để xác định mầm bệnh. Một số xét nghiệm chỉ sàng lọc các mầm bệnh chính gây ra VAP và một số xét nghiệm cũng sàng lọc các cơ chế đề kháng đã chọn. Ứng dụng trong viêm phổi của hệ thống Unyvero (Curetis AG,Holzgerlingen, Đức) cho phép thử nghiệm 20 vi khuẩn và một loại nấm khác nhau, bao gồm cả những vi khuẩn thường gây ra VAP, cũng như 19 dấu hiệu đề kháng, trực tiếp trong bệnh phẩm lâm sàng, với thời gian quay vòng là 4 đến 5 giờ [ 85]. Các nghiên cứu gần đây đã đánh giá kỹ thuật mới này so với các phương pháp vi sinh thông thường và nhận thấy tỷ lệ phù hợp giữa hai kỹ thuật là 50- 60% để xác định mầm bệnh và 70–75% để xác định kháng thuốc [85,86,87,88]. Tuy nhiên, loại kỹ thuật này bị hạn chế bởi rủi ro phát hiện quá mức, tức là phát hiện DNA của các sinh vật không còn tồn tại, phát hiện mầm bệnh ở ngưỡng không gây bệnh và phát hiện các sinh vật không gây bệnh (tức là, các loài thực khuẩn thay vì vi khuẩn xâm lấn). Loại kỹ thuật này có thể sẽ tạo điều kiện thuận lợi cho những tiến bộ lớn trong quản lý VAP trong tương lai gần, cho phép các bác sĩ lâm sàng điều chỉnh kháng sinh trong vòng vài giờ (Hình 4). Tuy nhiên, cần cải thiện độ rộng và độ nhạy của kỹ thuật cũng như các nghiên cứu đánh giá tính an toàn và hiệu quảcủa chẩn đoán nhanh đểcải thiện tính phù hợp và thời gian điều trị kháng sinh cũng như tác động đến kết quả của bệnh nhân trước khi có thể được khuyến cáo thường quy.
4.6 Giám sát
Các dấu hiệu lâm sàng được sửdụngđểchẩn đoán VAP không nhạy và không đặc hiệu, đơn lẻ hoặc kết hợp. Ngay cả sinh thiết phổi cũng không chắc chắn vì sự phân bố không đồng đều của các tổn thương phổi và sự thay đổi trong cách giải thích của các nhà giải phẫu bệnh. Do đó, rất khó có khả năng có được sự đồng thuận trên toàn thế giới về cách xác định và tiến hành giám sát tốt nhất. Điều này nói lên nhu cầu quan trọng về nghiên cứu sâu hơn để phát triển và xác nhận các công cụ chẩn đoán mới để hỗ trợ các nghiên cứu giám sát, phòng ngừa và điều trị cũng như các sáng kiến cải tiến chất lượng. Nhu cầu này đặc biệt nghiêm trọng ở Hoa Kỳ, nơi các cơ quan quản lý và lập pháp đã xem xét đưa tỷ lệ VAP của bệnh viện vào các chính sách điểm chuẩn và bồi hoàn. Trong bối cảnh này, Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ đã phát triển khái niệm vềcác biến cố liên quan đến máy thở (VAE), một chiến lược giám sát được thiết kế để mở rộng trọng tâm giám sát nhằm bao gồm nhiều nguyên nhân gây suy giảm hô hấp ở bệnh nhân thở máy, không chỉ viêm phổi, để làm cho việc giám sát khách quan hơn và cho phép khả năng giám sát tự động bằng cách sử dụng dữ liệu lâm sàng điện tử. Định nghĩa này bao gồm các tiêu chí phụ để cố gắng xác định tập hợp con các VAE có thể liên quan đến nhiễm trùng và đặc biệt có thể là do viêm phổi, nhưng không có dữ liệu nào cho thấy rằng cácđịnh nghĩa VAE chính xác hơn (hoặc ít hơn) so với các định nghĩa giám sát truyền thống [13].
Trong khi nuôi cấy giám sát đường hô hấp dưới có thể giúp dự đoán sự tham gia của vi sinh vật MDR ở những bệnh nhân phát triển VAP và do đó làm giảm việc sử dụng kháng sinh phổ rộng không cần thiết, không có dữ liệu rõ ràng rằng chiến lược này cải thiện kết quả lâm sàng hoặc giảm chi phí [89, 90].
Các tiêu chí chẩn đoán thống nhất có thể được áp dụng một cách khách quan là cần thiết để so sánh tỷ lệ mắc bệnh giữa các bệnh viện và các quốc gia nhằm mục đích lập kế hoạch và bồi hoàn sức khỏe cộng đồng.
4.7 Phòng chống VAP
Nhiều giả thiết của chúng tôi về cách tốt nhất để ngăn ngừa VAP gần đây đã bị thách thức. Chăm sóc răng miệng bằng chlorhexidine và dự phòng loét do stress có thể có hại, dữ liệu mới khẳng định mối lo ngại lâu nay rằng việc khử nhiễm (decontamination) đường miệng và tiêu hóa có chọn lọc có thểkhông hiệu quả ở các ICU có tỷ lệ kháng kháng sinh ban đầu cao và dẫn lưu chất bài tiết dưới thanh môn có thể không rút ngắn thời gian điều trị thông khí cơ học hoặc thời gian lưu trú ICU như đã từng nghĩ [91,92,93,94,95]. Các thực hành nhất quán liên quan đến rút nội khí quản sớm hơn và/hoặc tỷ lệ tử vong thấp hơn là những thực hành tập trung vào việc hạn chế tiếp xúc với thở máy xâm lấn bằng cách tránh đặt nội khí quản và tăng tốc độ rút nội khí quản [96].
Việc diễn giải các tài liệu về phòng ngừa VAP là một thách thức vì nhiều sáng kiến đã được báo cáo là làm giảm tỷ lệ VAP, nhưng những hạn chế của các công cụ và tiêu chí chẩn đoán VAP gây khó khăn cho việc phân biệt hiệu quả thực sự của các chiến lược phòng ngừa [97].
Trừ khi và cho đến khi chúng tôi phát triển các dấu hiệu nhạy cảm và cụ thể cho sự hiện diện hoặc không có VAP, các nhà cung cấp nên xem xét các kết quả khách quan hơn khi đánh giá giá trị tiềm năng của các chiến lược phòng ngừa được đề xuất [98]. Chúng bao gồm thời gian thở máy, thời gian nằm ICU, các biến cố liên quan đến máy thở, sử dụng kháng sinh và tỷ lệ tử vong. So sánh tác động của các biện pháp phòng ngừa đối với tỷ lệ VAP với các kết quả khách quan hơn đôi khi có thể dẫn đến sự khác biệt đáng ngạc nhiên. Ví dụ, phân tích tổng hợp các thử nghiệm ngẫu nhiên về chăm sóc răng miệng với chlorhexidine cho thấy can thiệp này có thể làm giảm tỷ lệ VAP nhưng làm tăng tỷ lệ tử vong [99, 100]. Chúng tôi sẽ sử dụng ống kính này để xem xét ngắn gọn các chiến lược phòng chống VAP phổ biến.
Một số thử nghiệm gần đây đã đánh giá những lợi ích tiềm năng của việc thay đổi hình dạng và/hoặc vật liệu bóng chèn ống nội khí quản để giảm thiểu sự thấm của chất lỏng chứa đầy vi khuẩn qua bóng chèn và vào phổi. Thật không may, cả bóng chèn hình côn hay polyurethane siêu mỏng đều không được chứng minh là tốt hơn so với bóng chèn hình trụ thông thường hoặc polyvinyl clorua trong việc ngăn ngừa VAP hoặc cải thiện các kết quả khách quan [101,102,103,104]. Tương tự như vậy, theo dõi thủ công áp lực bóng chèn cứ 8 giờ một lần để giảm thiểu áp lực bóng chèn ống nội khí quản giảm vô tình không tốt hơn trong việc ngăn ngừa VAP, giảm thời gian nằm viện hoặc giảm tỷ lệ tử vong trong một nghiên cứu trung tâm gần đây so với việc chỉ kiểm tra áp lực bóng chèn khi đặt nội khí quản, sau khi di chuyển ống, hoặc phát hiện rò rỉ áp lực bóng chèn [105]. Một phân tích tổng hợp của ba thử nghiệm ngẫu nhiên về theo dõi áp lực bóng chèn tự động đã báo cáo tỷ lệ VAP thấp hơn đáng kể với hệ thống áp lực bóng chèn tự động, nhưng phân tích bị giới hạn bởi số lượng nhỏ, tính không đồng nhất đáng kể và đánh giá hạn chế về kết quả thứ cấp [106].
Dẫn lưu chất bài tiết dưới thanh môn nhiều lần có liên quan đến tỷ lệ VAP thấp hơn trong cả các thử nghiệm ngẫu nhiên riêng lẻ và phân tích tổng hợp nhưng dường như không giúp rút ngắn thời gian rút nội khí quản, thời gian lưu lại ICU, ngăn ngừa các biến cố liên quan đến thở máy, hoặc tỷ lệ tử vong thấp hơn [94]. Các phân tích tổng hợp trước đó đã gợi ý về tác động có thể xảy ra đối với thời gian rút nội khí quản và xuất viện ICU nhưng bị nhầm lẫn bởi kết quả nghiên cứu không rõ ràng và mức độ không đồng nhất cao [ 94, 107]. Hai nghiên cứu đã báo cáo mối liên quan giữa sự dẫn lưu dịch tiết dưới thanh môn và việc sử dụng ít kháng sinh hơn, nhưng nghiên cứu thứ ba thì không [108,109,110].
Các nghiên cứu gần đây cũng đặt ra câu hỏi về tính hiệu quảvà an toàn của oral chlorhexidine. Không có mối liên quan giữa chăm sóc răng miệng với chlorhexidine và tỷ lệ VAP thấp hơn trên phân tích tổng hợp các thử nghiệm ngẫu nhiên mù đôi [ 99]. Đáng quan tâm hơn, một số phân tích tổng hợp và nghiên cứu quan sát đã báo cáo rằng chăm sóc răng miệng bằng chlorhexidine có thể làm tăng tỷ lệ tử vong, có lẽvì một sốbệnh nhân có thểhít sặc một số chất sát trùng gây tổn thương phổi cấp tính [91, 95, 99, 100, 111, 112]. Một nghiên cứu ngừng sử dụng ngẫu nhiên theo cụm hiện đang được tiến hành để mô tả rõ hơn tính an toàn và hiệu quả của oral chlorhexidine cho bệnh nhân thở máy [113].
Nâng cao đầu giường để ngăn trào ngược dịch vị vào phổi là biện pháp can thiệp được thực hành phổ biến nhất để ngăn ngừa VAP [ 114, 115] nhưng được hỗ trợ bởi một số thử nghiệm ngẫu nhiên đáng ngạc nhiên. Một đánh giá của Cochrane về 8 thử nghiệm ngẫu nhiên thu nhận 759 bệnh nhân đã báo cáo rằng ít hơn về mặt lâm sàng nghi ngờchung về VAP ở những bệnh nhân được ngẫu nhiên kê cao đầu giường, nhưng không ảnh hưởng đến VAP đã được xác nhận về mặt vi sinh và không ảnh hưởng đến kết quả khách quan [116]. Một số nhà điều tra đãđưa ra giảthuyết rằngđưa bệnh nhân vào tư thế Trendelenburg nghiêng bên có thể là cách tốt hơn để ngăn ngừa VAP bằng cách dùng trọng lực để đưa chất tiết ra khỏi phổi qua miệng. Một nghiên cứu gần đây đã xác nhận giả thuyết này, nhưng thử nghiệm đã bị kết thúc sớm do có rất nhiều tác dụng ngoại ý giữa các bệnh nhân ngẫu nhiên để ở tư thế Trendelenburg nghiêng bên [117].
Khử nhiễm có chọn lọc qua đường miệng và đường tiêu hóa là một trong số rất ít các chiến lược phòng ngừa trong chăm sóc quan trọng liên tục có liên quan đến tỷ lệ tử vong thấp hơn [118, 119]. Chiến lược này được thực hành rộng rãi ở Hà Lan, nhưng ở những nơi khác đã không thích áp dụng khử nhiễm kháng sinh vì sợ rằng nó có thể thúc đẩy tình trạng đề kháng kháng sinh, đặc biệt là ở các ICU có tỷ lệ vi khuẩn đề kháng kháng sinh và sửdụng kháng sinh cơ bản cao. Trớ trêu thay, việc khử nhiễm qua đường miệng và đường tiêu hóa thực sự có thể làm giảm việc sử dụng kháng sinh tổng thể có lẽ là do giảm tỷ lệ nhiễm trùng cần điều trị [120]. Tuy nhiên, một thử nghiệm ngẫu nhiên theo cụm gần đây về khử nhiễm qua đường miệng và đường tiêu hóa ở các ICU với tỷ lệ đề kháng kháng sinh và sử dụng kháng sinh cơ bản cao cho thấy không có tác động đáng kể đến tỷ lệ nhiễm trùng theo đường máu hoặc tử vong [93].
Probiotics có thể bảo vệ bệnh nhân khỏi VAP bằng cách điều chỉnh hệ vi sinh vật và ức chế sự cư trú của các mầm bệnh xâm nhập. Một số thử nghiệm ngẫu nhiên đã báo cáo tỷ lệ VAP thấp hơn, nhưng tín hiệu này không xuất hiện trong phân tích tổng hợp chỉ giới hạn trong các nghiên cứu mù đôi [121]. Một nghiên cứu đa trung tâm lớn hiện đang được tiến hành [122].
Dự phòng loét do stress có liên quan đến tỷ lệ VAP cao hơn trong một sốnghiên cứu quan sát và trong một phân tích tổng hợp gần đây của các thử nghiệm ngẫu nhiên [92, 123, 124]. Tuy nhiên, một thử nghiệm ngẫu nhiên lớn giữa pantoprazole và giả dược đã báo cáo không có sự khác biệt giữa các nhóm về tỷ lệ viêm phổi [125]. Đồng thời, dự phòng loét do stress có tác dụng tương đối khiêm tốn đối với tỷ lệ xuất huyết tiêu hóa (2,5% so với 4,2%) và không ảnh hưởng đến nhu cầu truyền máu hoặc tỷ lệ tử vong. Các thửnghiệm ngẫu nhiên lớn bổ sung đang được tiến hành.
Các phương pháp phòng ngừa liên quan đến việc cải thiện kết quả khách quan nhất cho bệnh nhân thở máy là tập trung vào việc tránh đặt nội khí quản và giảm thiểu tiếp xúc với thông khí xâm lấn bằng cách sử dụng thở oxy lưu lượng cao qua cannula mũi hoặc thông khí không xâm lấn như các biện pháp thay thếcho đặt nội khí quản, giảm nhẹthuốc an thần, sử dụng các thử nghiệm thở tự phát để nhanh chóng rút nội khí quản sớm, và vận động sớm [126, 127]. Những can thiệp này dường như có tác dụng hiệp đồng trong chừng mực giảm thiểu an thần tạo điều kiện cho vận động và rút nội khí quản sớm. Các nghiên cứu quan sát về các cộng tác viên cải tiến chất lượng đã báo cáo rằng việc kết hợp các thực hành này lại với nhau có liên quan đến rút nội khí quản sớm hơn và tỷ lệ tử vong thấp hơn [128,129,130,131]. Tuy nhiên, điều quan trọng là phải xác nhận những phát hiện này trong các thử nghiệm ngẫu nhiên do có nhiều nguồn sai lệch tiềm ẩn trong các nghiên cứu quan sát [132]. Bảng 2 tóm tắt kiến thức hiện tại về phòng chống VAP.
| Sự can thiệp | Tác động có thể xảy ra đối với tỷ lệ VAP | Bình luận |
| Độ cao đầu giường [116] | Có thể giảm tỷ lệ | Các thử nghiệm ngẫu nhiên được nghiên cứu kỹ lưỡng, ít và mâu thuẫn |
| Bóng chèn ống nội khí quản hình cone và polyurethane siêu mỏng [102, 104] |
Không có tác động
|
Các nghiên cứu in vivo ghi lại tỷ lệ hít sặc dưới mức lâm sàng cao liên tục bất chấp những ưu điểm lý thuyết của các thiết kế này |
| Theo dõi áp lực bóng chèn ống nội khí quản tự động [106] | Có thể giảm tỷ lệ | Được nghiên cứu kỹ lưỡng, đáng được đánh giá thêm |
| Dẫn lưu chất bài tiết dưới thanh môn [94] | Có thể giảm giá | Được nghiên cứu rộng rãi nhưng mặc dù tỷ lệ VAP thấp hơn nhưng không ảnh hưởng đến thời gian thở máy, thời gian nằm viện ICU, các biến cố liên quan đến máy thở hoặc tử vong. Tác động không rõ ràng đến việc sử dụng kháng sinh |
| Chăm sóc răng miệng bằng chlorhexidine [99, 100, 112] |
Không rõ | Được nghiên cứu sâu rộng. Hầu hết các nghiên cứu cá nhân đều tiêu cực. Phân tích tổng hợp các nghiên cứu nhãn mở cho thấy tỷ lệ VAP thấp hơn nhưng phân tích tổng hợp các nghiên cứu mù đôi không tìm thấy tác động nào. Có thể làm tăng tỷ lệ tử vong. Chăm sóc răng miệng bằng nước vô trùng được ưu tiên |
| Khử nhiễm có chọn lọc qua đường miệng và đường tiêu hóa [93, 119] |
Có khả năng làm giảm tỷ lệ VAP |
Được nghiên cứu sâu rộng. Sử dụng kháng sinh ròng ít hơn và tỷ lệ tử vong thấp hơn trong các nghiên cứu của Hà Lan. Không ảnh hưởng đến tỷ lệ tử vong ở các đơn vị có tỷ lệ kháng kháng sinh và sử dụng kháng sinh cơ bản cao |
| Chế phẩm sinh học [163] | Không rõ | Nhiều nghiên cứu nhưng hầu hết chất lượng hạn chế, kết quả trái chiều. Giảm tỷ lệVAP trên phân tích tổng hợp nhưng không có tín hiệu khi giới hạn trong các nghiên cứu mù đôi |
| Dự phòng loét do stress [92, 123, 125] | Có thể tăng tỷ lệ VAP | Các nghiên cứu quan sát và một số phân tích tổng hợp cho thấy tỷ lệ VAP cao hơn nhưng một thử nghiệm ngẫu nhiên lớn gần đây không tìm thấy tác động |
| Các gói phòng chống VAP [128] | Tỷ lệ VAP có thể thấp hơn | Được nghiên cứu sâu rộng, hầu như chỉ trong các phân tích trước sau và theo chuỗi thời gian. Có thể liên quan đến tỷ lệ tử vong thấp hơn. Có nhiều lợi ích nhất từ việc giảm thiểu an thần và khuyến khích rút nội khí quản sớm |
Bảng 2 Tóm tắt kiến thức hiện tại về phòng chống VAP [162]
4.8 Điều trị VAP
Liệu pháp kháng khuẩn đường tĩnh mạch (IV) là nền tảng của điều trị VAP. Tuy nhiên, các bác sĩ phải đối mặt với một tình huống khó xử, giữa việc tránh điều trị không hiệu quả, điều trị kháng sinh ban đầu không phù hợp có thể làm tăng tỷ lệ tử vong [133]; và mặt khác, giảm tiêu thụ thuốc kháng sinh phổ rộng, thuốc kháng sinh phổ rộng có liên quan đến việc gia tăng sự đề kháng của vi khuẩn [134]. Do đó, điều trị VAP nên là một quá trình gồm hai bước: bước đầu tiên là điều trị theo kinh nghiệm, việc lựa chọn và điều trị tức thời phụ thuộc vào mứcđộbệnh (tức là nguy cơ tửvong) và các yếu tố nguy cơ của mầm bệnh MDR; và bước thứ hai là điều trị dứt điểm, mà bác sĩ lâm sàng nên cố gắng tránh lạm dụng kháng sinh.
Điều trị theo kinh nghiệm
Việc lựa chọn và thời điểm sử dụng các chất kháng sinh cần tính đến bốn thông số: mức độ nghiêm trọng của bệnh hiện tại, loại và số lượng các bệnh tiềm ẩn và mức độ nghiêm trọng của chúng, các yếu tố nguy cơ đối với mầm bệnh MDR và mô hình kháng thuốc tại địa phương. Các yếu tố nguy cơ đối với mầm bệnh MDR bao gồm tỷ lệ kháng mầm bệnh tại chỗcao (> 25%), điều trị kháng sinh trong 90 ngày trước, nằm viện > 5 ngày, sốc nhiễm trùng khi khởi phát VAP, ARDS trước khi khởi phát VAP, điều trị thay thế thận cấp tính trước khi khởi phát VAP và sự xâm nhập của các mầm bệnh MDR trước đó [34, 65]. Ở những bệnh nhân không bị suy giảm miễn dịch với VAP khởi phát sớm và không có yếu tố nguy cơ đối với mầm bệnh MDR (như đã định nghĩa ở trên), có thể sử dụng đơn trị liệu với kháng sinh phổhẹp (cephalosporin thế hệ thứ ba không chống Pseudomonas) ( Bảng 3) [38] (tình huống này không được đề cập trong hướng dẫn IDSA/ATS [34]). Trong các tình huống khác, điều trị theo kinh nghiệm ban đầu nên bao gồm β-lactam phổ rộng nhắm mục tiêu Pseudomonas aeruginosa và/hoặc Enterobacteriaceae sản xuất ESBL (ceftazidime, cefepime, piperacillin – tazobactam hoặc carbapenem) cộng với tác nhân kháng Pseudomonas không β-lactam, chẳng hạn như aminoglycosid (amikacin hoặc tobramycin) hoặc fluoroquinolon (ciprofloxacin hoặc levofloxacin) (Bảng 3). Việc lựa chọn tác nhân β-lactam nên tính đến các kháng sinh đã sửdụng trướcđó, tính nhạy cảm tại chỗ và sự cư trú trên bệnh nhân với mầm bệnh MDR. Ví dụ, một carbapenem nên được ưu tiên ở những bệnh nhân đã có vi khuẩn xâm nhập thuộc họ Enterobacteriaceae sản xuất ESBL. Thật vậy, mặc dù carbapenem được kê đơn quá mức ở người mang ESBL, 7–10% các đợt VAP ở những bệnh nhân này là do Enterobacteriaceaesản xuất ESBL, và dường như khó có thể không tính đến mầm bệnh này trong điều trị kháng sinh theo kinh nghiệm [135, 136]. Hơn nữa, nó đã được chứng minh rằng 63% các biến chứng liên quan đến máy thở liên quan đến nhiễm trùng không phải là VAP hoặc không phải do nhiễm trùng ICU đã được ghi nhận [136], cho thấy rằng các nỗ lực cần được tập trung vào chiến lược chẩn đoán, chỉsử dụng carbapenems ở những bệnh nhân bị nhiễm trùng, và để ngưng carbapenems khi khả năng nhiễm trùng thấp.
Việc sử dụng các tác nhân beta-lactam mới (ceftazidime – avibactam, ceftolozane – tazobactam, meropenem – vaborbactam, imipenem – desbactam) trong điều trị VAP theo kinh nghiệm có lẽ nên được dành cho những bệnh nhân mang mầm bệnh MDR/XDR, chẳng hạn như Enterobacteriaceae kháng carbapenem hoặc XDR Pseudomonas aeruginosa chỉ nhạy cảm với những loại thuốc này.
Các hướng dẫn IDSA/ATS năm 2017 khuyến cáo mức độ bao phủ theo kinh nghiệm đối với Staphylococcus aureus kháng methicillin (MRSA) ở những bệnh nhân đã dùng kháng sinh trong 90 ngày trước đó hoặc những bệnh nhân nhập viện tại các đơn vị có tỷ lệ lưu hành MRSA cao (> 20%) hoặc không rõ trong số bệnh nhân VAP [34]. Các hướng dẫn của Châu Âu nêu rõ rằng nên xem xét phạm vi bảo hiểm MRSA nếu đơn vị có > 25% chủng vi khuẩn Staphylococcus aureus đường hô hấp là MRSA [38]. Một nghiên cứu gần đây được thực hiện tại Hoa Kỳ cho thấy trong số 3562 bệnh nhân bịviêm phổi mắc phải tại bệnh viện (khôngđặc biệt là VAP) tại các bệnh viện có tỷ lệ nhiễm MRSA > 20%, chỉ có 5% tăng MRSA khi nuôi cấy bệnh phẩm đường hô hấp, cho thấy có khả năng 95% đã khỏi khi được điều trị bằng cách sử dụng tỷ lệ phổ biến MRSA trong toàn bệnh viện thay vì tỷ lệ phổ biến MRSA cụ thể theo VAP [34, 137]. Hơn nữa, tỷ lệ lưu hành MRSA VAP thấp ở một số quốc gia [65]. Do đó, việc sử dụng thuốc chống MRSA theo kinh nghiệm nên được hạn chế ở những đơn vị có tỷ lệVAP thứphát sau MRSA cao (> 20%), hoặc ở những bệnh nhân đã bị MRSA cư trú.
Bảng 3 Đề xuất điều trị kháng khuẩn ban đầu theo kinh nghiệm đối với viêm phổi do thở máy.
| Tình huống | Phân nhóm điều trị | Thuốc |
| VAP sớm (< 5 ngày), không có yếu tố nguy cơ vi khuẩn MDR * | β-lactam không chống Pseudomonas | Amoxicillin/clavulanic acid† HOẶC cephalosporin thế hệ III |
| VAP muộn (≥ 5 ngày), HOẶC Yếu tố nguy cơ vi khuẩn MDR | β-lactam có hoạt tính chống Pseudomonas aeruginosa VÀ Thuốc chống Pseudomonas không phải β-lactam |
Cefepime 2 g q 8 h HOẶC Ceftazidime 2 g q 8 h HOẶC Piperacillin–tazobactam 4 g q6h HOẶC Meropenem 2 g q8h Amikacin 25 mg/kg/day HOẶC Ciprofloxacin 1200 mg/day |
| Cư trú đã biết với MRSA, hoặc tỷ lệ nhiễm MRSA cao (> 20%) trong đơn vị | Thuốc có hoạt tính chống MRSA | Vancomycin 30–45 mg/kg/day HOẶC Linezolid 600 mg/12 h |
| Vancomycin 30–45 mg/kg/day HOẶC Linezolid 600 mg/12 h |
Thuốc β-lactam thế hệ mới | Ceftolozane–tazobactam 3 g q 8 h‡ HOẶC Ceftazidime–avibactam 2.5 g q 8 h‡ HOẶC Meropenem vaborbactam 4 g q 8 h‡ HOẶC Imipenem–relebactam 1.5 g q 6 h‡ |
Các yếu tố nguy cơ MDR bao gồm điều trị kháng sinh trong 90 ngày trước, thời gian nằm viện > 5 ngày, sốc nhiễm trùng khi khởi phát VAP, hội chứng suy hô hấp cấp tính trước khi khởi phát VAP, điều trị thay thế thận cấp tính trước khi khởi phát VAP, cư trú bởi mầm bệnh MDR trước đó
VAP: Viêm phổi liên quan đến thở máy, MDR: kháng đa thuốc, MRSA: tụ cầu vàng kháng methicillin
* Tình huống này và các chất kháng khuẩn tương ứng không được đề cập trong hướng dẫn IDSA/ATS [34]
†Theo Ref [65]
‡Việc sử dụng theo kinh nghiệm của các thuốc này nên được hạn chế đối với những bệnh nhân bị nhiễm mầm bệnh cụ thể (Enterobacteriaceae kháng carbapenem hoặc Pseudomonas aeruginosa kháng thuốc rộng rãi), theo thử nghiệm tính nhạy cảm trước đây cho thấy mầm bệnh nhạy cảm với tác nhân này.
Điều trị đặc hiệu theo mầm bệnh
Một trong những mục tiêu của bác sĩ lâm sàng là tránh lạm dụng kháng sinh. Đầu tiên, nên ngừng dùng kháng sinh nếu không tìm thấy mầm bệnh. Thật vậy, nhiều đợt nghi ngờ VAP không phải là VAP [64]. Thứ hai, ở những bệnh nhân VAP đã được chứng minh về mặt vi khuẩn học, nên thu hẹp kháng sinh khi có kết quả nuôi cấy và xét nghiệm tính nhạy cảm, bao gồm các biện pháp sau: rút kháng sinh chống MRSA nếu không cấy ra MRSA; hạn chế carbapenem cho các mầm bệnh chỉ nhạy cảm với carbapenem (nhiễm Enterobacteriaceae sản sinh ESBL, Pseudomonas aeruginosa hoặc Acinetobacter spp.); và sử dụng các tác nhân phổ hẹp ở bệnh nhân bị nhiễm các chủng nhạy cảm [82]. Ở những bệnh nhân có VAP do Enterobacteriaceae sản xuất ESBL nhạy cảm với piperacillin- tazobactam, việc sử dụng thuốc này có thể được thảo luận như một giải pháp thay thế cho carbapenem vì kết quả của thử nghiệm Merino có thể gây tranh cãi [138,139,140,141]. Hơn nữa, vị trí của các tác nhân beta-lactam mới (ceftolozane – tazobactam, ceftazidime – avibactam) như là tác nhân tiết kiệm carbapenem vẫn còn được xác định, vì tác động của chúng đến sự xuất hiện của kháng thuốc so với carbapenem vẫn chưa được biết đến. Việc sử dụng chúng nên được dành để làm tác nhân cuối cùng trong MDR/XDR các mầm bệnh khó xử lý (Enterobacteriaceae kháng carbapenem, XDR Pseudomonas aeruginosa…). Cuối cùng, liệu pháp kháng sinh có thể được chuyển sang đơn trị liệu một cách an toàn sau khi xác định được tác nhân gây nhiễm trùng và thu được kết quả về tính nhạy cảm, ngay cả đối với trực khuẩn Gram âm không lên men như Pseudomonas aeruginosa [142]. Thật vậy, tính hữu ích của liệu pháp phối hợp hầu hết là để tăng khả năng thích hợp của điều trị hơn là cải thiện tiên lượng của bệnh nhân. Do đó, nên tránh tăng gấp đôi mức độ bao phủ kháng Pseudomonas ở bệnh nhân VAP do Pseudomonas aeruginosa với liệu trình không biến chứng khi đã có các xét nghiệm về độ nhạy cảm [143, 144].
4.9 Thời gian điều trị
Cả hướng dẫn của Châu Âu và Hoa Kỳ đều khuyến cáo rằng thời gian điều trị kháng sinh đối với VAP không nên vượt quá 7 ngày ở hầu hết bệnh nhân, kể cả những người bị nhiễm trực khuẩn Gram âm không lên men (Pseudomonas aeruginosa, Acinetobacter spp….) [34, 38, 65, 145]. Liệu trình dài hơn có thể thích hợp cho những bệnh nhân suy giảm miễn dịch và có thể cần thiết cho những bệnh nhân bị viêm mủ màng phổi, áp xe phổi, hoặc viêm phổi hoại tử[ 38]. Việc rút ngắn thời gian sửdụng kháng sinh dưới 7 ngày hiện không được khuyến cáo [34, 38, 65, 145], nhưng một số tác giả đã chứng minh rằng thời gian điều trị có thể được tùy chỉnh dựa trên động học của procalcitonin và đã có thể điều trị cho một số bệnh nhân <7 ngày bằng chiến lược này [80, 81, 146].
4.10 Phun khí dung
Việc sử dụng thuốc kháng sinh đã phát triển trong những năm gần đây, nhưng các ứng cử viên lý tưởng để nhận được phương pháp điều trị này vẫn chưa được xác định rõ ràng [ 147]. Cho đến nay, kháng sinh khí dung không thể được khuyến cáo thay thế cho đường tiêm tĩnh mạch, một phần vì thiếu dữ liệu về chỉ định này, một phần do 10–20% bệnh nhân VAP có đồng thời nhiễm khuẩn huyết, và một phần do việc sử dụng khí dung nhiều lần và lặp đi lặp lại hàng ngày có thể kéo dài thời gian thở máy [148, 149]. Việc sử dụng kháng sinh khí dung như một phương pháp điều trị bổ trợ (tức là ngoài liệu pháp tiêm tĩnh mạch hiệu quả) cũng không được khuyến khích; hai thử nghiệm ngẫu nhiên có đối chứng gần đây không chứng minh được tính ưu việt của kháng sinh dạng khí dung (amikacin đơn độc hoặc kết hợp với fosfomycin) so với giả dược ở bệnh nhân VAP do “mầm bệnh truyền thống” [150, 151]. Do đó, nên hạn chế việc sử dụng kháng sinh dạng khí dung đối với bệnh nhân VAP với các tác nhân gây bệnh Gram âm XDR chỉ nhạy cảm với colistin hoặc aminoglycosid [149]. Thật vậy, ba phân tích tổng hợp cho thấy rằng ở những bệnh nhân bị nhiễm các mầm bệnh như vậy, việc sử dụng colistin khí dung kết hợp với colistin tiêm tĩnh mạch dẫn đến kết quả tốt hơn so với chỉ dùng colistin tiêm tĩnh mạch [152,153,154]. Liệu kháng sinh khí dung có thể làm giảm sự kháng thuốc của vi khuẩn hay không, theo đề xuất của hai nghiên cứu được thực hiện ở bệnh nhân viêm khí quản liên quan đến thở máy, vẫn còn được xác định [155, 156].
4.11 Phương pháp điều trị trong tương lai
Việc sử dụng các kháng thể đặc hiệu với mầm bệnh như một phương pháp điều trị bổ trợ hoặc phòng ngừa hiện đang được nghiên cứu. Aerucin (Aridis®) là mAb IgG liên kết với exopolysaccharide Pseudomonas alginate liên quan đến quá trình kết dính tế bào. Một nghiên cứu mù đôi, đối chứng với giảdược, giai đoạn 2 để đánh giá tính an toàn và hiệu quả của nó như là liệu pháp bổ trợ cho kháng sinh tiêu chuẩn ở bệnh nhân HAP/VAP do P. aeruginosa (NCT00851435) đã được thực hiện gần đây, nhưng vẫn chưa có kết quả.
Các nghiên cứu gần đây đã đánh giá tính hữu ích của các kháng thể để vô hiệu hóa hoặc ức chế các yếu tố độc lực cụ thể của S. aureus hoặc P. aeruginosa [157]. Mục đích của loại chiến lược này là giảm nguy cơ phát triển VAP ở những bệnh nhân bị các mầm bệnh này xâm chiếm. Kết quả của những nghiên cứu này đầy hứa hẹn, vì thử nghiệm giai đoạn 2 nhắm vào các yếu tố độc lực của Pseudomonas aeruginosa cho thấy xu hướng giảm tỷ lệ nhiễm trùng do tác nhân gây bệnh này [158], và các kết quả được công bố gần đây của nghiên cứu SAATELITE, đã đánh giá một kháng thể chống lại độc lực của Staphylococcus aureus cũng có xu hướng giảm tỷ lệ mắc bệnh viêm phổi do Staphylococcus aureus [159]. Mặc dù chiến lược này mang tính phòng ngừa hơn chữa bệnh, nhưng tính hữu ích của các chất chống độc lực này như một chất bổ trợ cho kháng sinh vẫn còn phải được đánh giá.
4.12 Có nên điều trị sự tái hoạt hóa của vi rút không?
Không có câu trả lời dứt khoát cho câu hỏi này. Thử nghiệm PTH gần đây cho thấy rằng acyclovir không làm thay đổi số ngày không thở máy ở những bệnh nhân có biểu hiện của bệnh tái hoạt hóa hầu họng do HSV [160]. Tuy nhiên, thật thú vị, cùng một nghiên cứu đã báo cáo tỷ lệ tử vong gần như giảm đáng kể ở những bệnh nhân được ngẫu nhiên dùng acyclovir [160]. Dự phòng kháng vi-rút bằng valganciclovir hoặc valacyclovir có thể làm giảm sự tái hoạt hóa trong máu trong một nghiên cứu ngẫu nhiên trên 124 bệnh nhân [161]. Tuy nhiên, nhánh valacyclovir đã bịngừng hoạt động sớm vì tỷlệtử vong cao hơn sau 28 ngày mà không có lời giải thích rõ ràng [161]. Trong một thử nghiệm can thiệp khác, điều trị dự phòng bằng ganciclovir không làm giảm nồng độ interleukin 6 trong huyết tương ở người lớn có huyết thanh dương tính với CMV bị bệnh nặng [57]. Tuy nhiên, nhóm ganciclovir đã có nhiều ngày không thở máy hơn ở cả nhóm dân số có ý định điều trị và nhóm nhiễm trùng huyết [57]. Cần có nhiều nghiên cứu hơn để đánh giá hậu quả lâm sàng chính xác của các phản ứng tái hoạt hóa của virus và liệu chúng có nên được xử trí hay không.
5. Kết luận
Mặc dù đã có nhiều nghiên cứu, VAP vẫn là một trong những bệnh nhiễm trùng mắc phải ICU thường xuyên nhất và có liên quan đến việc gia tăng tỷ lệ tử vong. Việc sử dụng phương pháp lấy mẫu nào vẫn còn là một vấn đề tranh cãi. Các công cụ vi sinh mới nổi có thể sẽ sửa đổi phương pháp tiếp cận thông thường của chúng ta đểchẩn đoán vàđiều trị VAP trong tương lai tiếp theo. Các thử nghiệm ngẫu nhiên lớn là cần thiết để xác nhận rằng các gói kết hợp nhiều chiến lược phòng ngừa có thể cải thiện kết quả. Điều trị nên được giới hạn trong 7 ngày trong đại đa số các trường hợp. Nghiên cứu sâu hơn là cần thiết để xác định và đánh giá các phương pháp điều trị mới.
6. Tài liệu tham khảo
1. Zimlichman E, Henderson D, Tamir O, Franz C, Song P, Yamin CK, Keohane C, Denham CR, Bates DW (2013) Health care- associated infections: a meta-analysis of costs and financial impact on the US health care system. JAMA Intern Med 173:2039– 2046
2. American Thoracic Society, Infectious Diseases Society of America (2005) Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 171:388–416
3. Reignier J, Mercier E, Le Gouge A, Boulain T, Desachy A, Bellec F, Clavel M, Frat JP, Plantefeve G, Quenot JP, Lascarrou JB, Clinical Research in Intensive C, Sepsis G (2013) Effect of not monitoring residual gastric volume on risk of ventilator-associated pneumonia in adults receiving mechanical ventilation and early enteral feeding: a randomized controlled trial. JAMA 309: 249– 256
4. Seguin P, Laviolle B, Dahyot-Fizelier C, Dumont R, Veber B, Gergaud S, Asehnoune K, Mimoz O, Donnio PY, Bellissant E, Malledant Y, Study of Povidone Iodine to Reduce Pulmonary Infection in Head T, Cerebral Hemorrhage Patients ICUSG, AtlanRea G (2014) Effect of oropharyngeal povidone-iodine preventive oral care on ventilator-associated pneumonia in severely brain-injured or cerebral hemorrhage patients: a multicenter, randomized controlled trial. Crit Care Med 42: 1–8
5. Dudeck MA, Horan TC, Peterson KD, Allen-Bridson K, Morrell G, Anttila A, Pollock DA, Edwards JR (2013) National healthcare safety network report, data summary for 2011, device-associated module. Am J Infect Control 41:286–300
6. Koulenti D, Tsigou E, Rello J (2017) Nosocomial pneumonia in 27 ICUs in Europe: perspectives from the EU-VAP/CAP study. Eur J Clin Microbiol Infect Dis 36:1999–2006
7. Bonell A, Azarrafiy R, Huong VTL, Viet TL, Phu VD, Dat VQ, Wertheim H, van Doorn HR, Lewycka S, Nadjm B (2019) A systematic review and meta-analysis of ventilator-associated pneumonia in adults in Asia: an analysis of national income level on incidence and etiology. Clin Infect Dis 68:511–518
8. Ego A, Preiser JC, Vincent JL (2015) Impact of diagnostic criteria on the incidence of ventilator-associated pneumonia. Chest 147:347–355
9. Cook D, Walter S, Cook R, Griffith L, Guyatt G, Leasa D, Jaeschke R, Brun -BC (1998) Incidence of and risk factors for ventilator-associated pneumonia in critically ill patients. Ann Intern Med 129:433–440
10. Forel JM, Voillet F, Pulina D, Gacouin A, Perrin G, Barrau K, Jaber S, Arnal JM, Fathallah M, Auquier P, Roch A, Azoulay E, Papazian L (2012) Ventilator-associated pneumonia and ICU mortality in severe ARDS patients ventilated according to a lung- protective strategy. Crit Care 16:R65
11. Dudeck MA, Edwards JR, Allen-Bridson K, Gross C, Malpiedi PJ, Peterson KD, Pollock DA, Weiner LM, Sievert DM (2015) National healthcare safety network report, data summary for 2013, device-associated module. Am J Infect Control 43:206–221
12. Metersky ML, Wang Y, Klompas M, Eckenrode S, Bakullari A, Eldridge N (2016) Trend in ventilator-associated pneumonia rates between 2005 and 2013. JAMA 316:2427–2429
13. Magill SS, Klompas M, Balk R, Burns SM, Deutschman CS, Diekema D, Fridkin S, Greene L, Guh A, Gutterman D, Hammer B, Henderson D, Hess D, Hill NS, Horan T, Kollef M, Levy M, Septimus E, Vanantwerpen C, Wright D, Lipsett P (2013) Developing a new, national approach to surveillance for ventilator-associated events: executive summary. Clin Infect Dis 57:1742–1746
14. Stoclin A, Rotolo F, Hicheri Y, Mons M, Chachaty E, Gachot B, Pignon JP, Wartelle M, Blot F (2020) Ventilator-associated pneumonia and bloodstream infections in intensive care unit cancer patients: a retrospective 12-year study on 3388 prospectively monitored patients. Support Care Cancer 28:193–200
15. Cook A, Norwood S, Berne J (2010) Ventilator-associated pneumonia is more common and of less consequence in trauma patients compared with other critically ill patients. J Trauma 69:1083–1091
16. Rouze A, Cottereau A, Nseir S (2014) Chronic obstructive pulmonary disease and the risk for ventilator-associated pneumonia. Curr Opin Crit Care 20:525–531
17. Grasselli G, Scaravilli V, Di Bella S, Biffi S, Bombino M, Patroniti N, Bisi L, Peri AM, Pesenti A, Gori A, Alagna L (2017) Nosocomial infections during extracorporeal membrane oxygenation: incidence, etiology, and impact on patients’ outcome. Crit Care Med 45:1726–1733
18. Blot S, Koulenti D, Dimopoulos G, Martin C, Komnos A, Krueger WA, Spina G, Armaganidis A, Rello J, Investigators E-VS (2014) Prevalence, risk factors, and mortality for ventilator-associated pneumonia in middle-aged, old, and very old critically ill patients. Crit Care Med 42:601–609
19. Dananche C, Vanhems P, Machut A, Aupee M, Bervas C, L’Heriteau F, Lepape A, Lucet JC, Stoeckel V, Timsit JF, Berger- Carbonne A, Savey A, Benet T, Healthcare-Associated Infections Surveillance Network of I (2018) Trends of incidence and risk factors of ventilator-associated pneumonia in elderly patients admitted to French ICUs between 2007 and 2014. Crit Care Med 46:869–877
20. Fagon J, Chastre J, Hance A, Montravers P, Novara A, Gibert C (1993) Nosocomial pneumonia in ventilated patients: a cohort study evaluating attributable mortality and hospital stay. Am J Med 94:281–288
21. Papazian L, Bregeon F, Thirion X, Gregoire R, Saux P, Denis J, Perin G, Charrel J, Dumon J, Affray J, Gouin F (1996) Effect of ventilator-associated pneumonia on mortality and morbidity. Am J Respir Crit Care Med 154:91–97
22. Melsen WG, Rovers MM, Bonten MJ (2009) Ventilator-associated pneumonia and mortality: a systematic review of observational studies. Crit Care Med 37:2709–2718
23. Bekaert M, Timsit JF, Vansteelandt S, Depuydt P, Vesin A, Garrouste-Orgeas M, Decruyenaere J, Clec’h C, Azoulay E, Benoit
D, Outcomerea Study G (2011) Attributable mortality of ventilator-associated pneumonia: a reappraisal using causal analysis. Am J Respir Crit Care Med 184: 1133–1139
24. Li Y, Liu C, Xiao W, Song T, Wang S (2019) Incidence, risk factors, and outcomes of ventilator-associated pneumonia in traumatic brain injury: a meta-analysis. Neurocrit Care. https://doi.org/10.1007/s12028-019-00773-w
25. Melsen WG, Rovers MM, Koeman M, Bonten MJ (2011) Estimating the attributable mortality of ventilator-associated pneumonia from randomized prevention studies. Crit Care Med 39:2736–2742
26. Melsen WG, Rovers MM, Groenwold RH, Bergmans DC, Camus C, Bauer TT, Hanisch EW, Klarin B, Koeman M, Krueger WA, Lacherade JC, Lorente L, Memish ZA, Morrow LE, Nardi G, van Nieuwenhoven CA, O’Keefe GE, Nakos G, Scannapieco FA, Seguin P, Staudinger T, Topeli A, Ferrer M, Bonten MJ (2013) Attributable mortality of ventilator-associated pneumonia: a meta- analysis of individual patient data from randomised prevention studies. Lancet Infect Dis 13:665–671
27. Martin-Loeches I, Torres A, Rinaudo M, Terraneo S, de Rosa F, Ramirez P, Diaz E, Fernandez-Barat L, Li Bassi GL, Ferrer M (2015) Resistance patterns and outcomes in intensive care unit (ICU)-acquired pneumonia. Validation of European Centre for Disease Prevention and Control (ECDC) and the Centers for Disease Control and Prevention (CDC) classification of multidrug resistant organisms. J Infect 70:213–222
28. Di Pasquale M, Ferrer M, Esperatti M, Crisafulli E, Giunta V, Li Bassi G, Rinaudo M, Blasi F, Niederman M, Torres A (2014) Assessment of severity of ICU-acquired pneumonia and association with etiology. Crit Care Med 42:303–312
29. Esperatti M, Ferrer M, Theessen A, Liapikou A, Valencia M, Saucedo LM, Zavala E, Welte T, Torres A (2010) Nosocomial pneumonia in the intensive care unit acquired during mechanical ventilation or not. Am J Respir Crit Care Med 182:1533–1539
30. Rello J, Ollendorf DA, Oster G, Vera-Llonch M, Bellm L, Redman R, Kollef MH (2002) Epidemiology and outcomes of ventilator-associated pneumonia in a large US database. Chest 122:2115–2121
31. Bailey KL, Kalil AC (2015) Ventilator-associated pneumonia (VAP) with multidrug-resistant (MDR) pathogens: optimal treatment? Curr Infect Dis Rep 17:494
32. Luyt CE, Hekimian G, Koulenti D, Chastre J (2018) Microbial cause of ICU-acquired pneumonia: hospital-acquired pneumonia versus ventilator-associated pneumonia. Curr Opin Crit Care 24:332–338
33. Huang Y, Jiao Y, Zhang J, Xu J, Cheng Q, Li Y, Liang S, Li H, Gong J, Zhu Y, Song L, Rong Z, Liu B, Jie Z, Sun S, Li P, Wang G, Qu J, Infection Assembly of Shanghai Respiratory S (2018) Microbial etiology and prognostic factors of ventilator-associated pneumonia: a multicenter retrospective study in Shanghai. Clin Infect Dis 67:S146–S152
34. Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, Napolitano LM, O’Grady NP, Bartlett JG, Carratala J, El Solh AA, Ewig S, Fey PD, File TM Jr, Restrepo MI, Roberts JA, Waterer GW, Cruse P, Knight SL, Brozek JL (2016) Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the infectious diseases society of America and the American thoracic society. Clin Infect Dis 63:e61–e111
35. Khan R, Al-Dorzi HM, Tamim HM, Rishu AH, Balkhy H, El-Saed A, Arabi YM (2016) The impact of onset time on the isolated pathogens and outcomes in ventilator associated pneumonia. J Infect Public Health 9:161–171
36. Martin-Loeches I, Deja M, Koulenti D, Dimopoulos G, Marsh B, Torres A, Niederman MS, Rello J, Investigators E-VS (2013) Potentially resistant microorganisms in intubated patients with hospital-acquired pneumonia: the interaction of ecology, shock and risk factors. Intensive Care Med 39:672–681
37. Restrepo MI, Peterson J, Fernandez JF, Qin Z, Fisher AC, Nicholson SC (2013) Comparison of the bacterial etiology of early- onset and late-onset ventilator-associated pneumonia in subjects enrolled in 2 large clinical studies. Respir Care 58:1220–1225
38. Torres A, Niederman, Chastre J, Ewig S, Fernandez-Vandellos P, Hanberger H, Kollef M, Li Bassi G, Luna CM, Martin-Loeches I, Paiva JA, Read RC, Rigau D, Timsit JF, Welte T, Wunderink R (2017) International ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital-acquired pneumonia and ventilator-associated pneumonia: Guidelines for the management of hospital-acquired pneumonia (HAP)/ventilator-associated pneumonia (VAP) of the European Respiratory Society (ERS), European Society of Intensive Care Medicine (ESICM), European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and Asociacion Latinoamericana del Torax (ALAT). Eur Respir J. https://doi.org/10.1183/13993003.00582-2017
39. Russo A, Giuliano S, Ceccarelli G, Alessandri F, Giordano A, Brunetti G, Venditti M (2018) Comparison of septic shock due to multidrug-resistant Acinetobacter baumannii or Klebsiella pneumoniae carbapenemase-producing K. pneumoniae in Intensive Care Unit Patients. Antimicrob Agents Chemother. https://doi.org/10.1128/AAC.02562-17
40. Denis JB, Lehingue S, Pauly V, Cassir N, Gainnier M, Leone M, Daviet F, Coiffard B, Baron S, Guervilly C, Forel JM, Roch A, Papazian L (2019) Multidrug-resistant Pseudomonas aeruginosa and mortality in mechanically ventilated ICU patients. Am J Infect Control 47:1059–1064
41. Chung DR, Song JH, Kim SH, Thamlikitkul V, Huang SG, Wang H, So TM, Yasin RM, Hsueh PR, Carlos CC, Hsu LY, Buntaran L, Lalitha MK, Kim MJ, Choi JY, Kim SI, Ko KS, Kang CI, Peck KR, Asian Network for Surveillance of Resistant Pathogens Study G (2011) High prevalence of multidrug-resistant nonfermenters in hospital-acquired pneumonia in Asia. Am J Respir Crit Care Med 184:1409–1417
42. Perez A, Gato E, Perez-Llarena J, Fernandez-Cuenca F, Gude MJ, Oviano M, Pachon ME, Garnacho J, Gonzalez V, Pascual A, Cisneros JM, Bou G (2019) High incidence of MDR and XDR Pseudomonas aeruginosa isolates obtained from patients with ventilator-associated pneumonia in Greece, Italy and Spain as part of the MagicBullet clinical trial. J Antimicrob Chemother 74:1244–1252
43. Combes A, Figliolini C, Trouillet JL, Kassis N, Wolff M, Gibert C, Chastre J (2002) Incidence and outcome of polymicrobial ventilator-associated pneumonia. Chest 121:1618–1623
44. Niederman MS (2018) Antibiotic treatment of hospital-acquired pneumonia: is it different from ventilator-associated pneumonia? Curr Opin Crit Care 24:353–360
45. Fabregas N, Torres A, El-Ebiary M, Ramirez J, Hernandez C, Gonzalez J, de la Bellacasa J, de Anta J, Rodriguez R-R (1996) Histopathologic and microbiologic aspects of ventilator-associated pneumonia. Anesthesiology 84:760–771
46. Delisle MS, Williamson DR, Albert M, Perreault MM, Jiang X, Day AG, Heyland DK (2011) Impact of Candida species on clinical outcomes in patients with suspected ventilator-associated pneumonia. Can Respir J 18:131–136
47. Azoulay E, Timsit JF, Tafflet M, de Lassence A, Darmon M, Zahar JR, Adrie C, Garrouste-Orgeas M, Cohen Y, Mourvillier B, Schlemmer B, Outcomerea Study G (2006) Candida colonization of the respiratory tract and subsequent pseudomonas ventilator- associated pneumonia. Chest 129:110–117
48. Timsit JF, Schwebel C, Styfalova L, Cornet M, Poirier P, Forrestier C, Ruckly S, Jacob MC, Souweine B (2019) Impact of bronchial colonization with Candida spp. on the risk of bacterial ventilator-associated pneumonia in the ICU: the FUNGIBACT prospective cohort study. Intensive Care Med 45:834–843
49. Schauwvlieghe A, Rijnders BJA, Philips N, Verwijs R, Vanderbeke L, Van Tienen C, Lagrou K, Verweij PE, Van de Veerdonk FL, Gommers D, Spronk P, Bergmans D, Hoedemaekers A, Andrinopoulou ER, van den Berg C, Juffermans NP, Hodiamont CJ, Vonk AG, Depuydt P, Boelens J, Wauters J, Dutch-Belgian Mycosis study group (2018) Invasive aspergillosis in patients admitted to the intensive care unit with severe influenza: a retrospective cohort study. Lancet Respir Med 6:782–792
50. Blot SI, Taccone FS, Van den Abeele AM, Bulpa P, Meersseman W, Brusselaers N, Dimopoulos G, Paiva JA, Misset B, Rello J, Vandewoude K, Vogelaers D, Asp ICUSI (2012) A clinical algorithm to diagnose invasive pulmonary aspergillosis in critically ill patients. Am J Respir Crit Care Med 186:56–64
51. Cassir N, Hraiech S, Nougairede A, Zandotti C, Fournier PE, Papazian L (2014) Outbreak of adenovirus type 1 severe pneumonia in a French intensive care unit, September–October 2012. Euro Surveill. https://doi.org/10.2807/1560-7917.es2014.19.39.20914
52. Hong HL, Hong SB, Ko GB, Huh JW, Sung H, Do KH, Kim SH, Lee SO, Kim MN, Jeong JY, Lim CM, Kim YS, Woo JH, Koh Y, Choi SH (2014) Viral infection is not uncommon in adult patients with severe hospital-acquired pneumonia. PLoS ONE 9:e95865
53. Loubet P, Voiriot G, Houhou-Fidouh N, Neuville M, Bouadma L, Lescure FX, Descamps D, Timsit JF, Yazdanpanah Y, Visseaux B (2017) Impact of respiratory viruses in hospital-acquired pneumonia in the intensive care unit: a single-center retrospective study. J Clin Virol 91:52–57
54. van Someren Greve F, Juffermans NP, Bos LDJ, Binnekade JM, Braber A, Cremer OL, de Jonge E, Molenkamp R, Ong DSY, Rebers SPH, Spoelstra-de Man AME, van der Sluijs KF, Spronk PE, Verheul KD, de Waard MC, de Wilde RBP, Winters T, de Jong MD, Schultz MJ (2018) Respiratory viruses in invasively ventilated critically ill patients-a prospective multicenter observational study. Crit Care Med 46:29–36
55. Luyt CE, Combes A, Deback C, Aubriot-Lorton MH, Nieszkowska A, Trouillet JL, Capron F, Agut H, Gibert C, Chastre J (2007) Herpes simplex virus lung infection in patients undergoing prolonged mechanical ventilation. Am J Respir Crit Care Med 175:935–942
56. Limaye AP, Kirby KA, Rubenfeld GD, Leisenring WM, Bulger EM, Neff MJ, Gibran NS, Huang ML, Santo Hayes TK, Corey L, Boeckh M (2008) Cytomegalovirus reactivation in critically ill immunocompetent patients. JAMA 300:413–422
57. Limaye AP, Stapleton RD, Peng L, Gunn SR, Kimball LE, Hyzy R, Exline MC, Files DC, Morris PE, Frankel SK, Mikkelsen ME, Hite D, Enfield KB, Steingrub J, O’Brien J, Parsons PE, Cuschieri J, Wunderink RG, Hotchkin DL, Chen YQ, Rubenfeld GD, Boeckh M (2017) Effect of ganciclovir on IL-6 levels among cytomegalovirus-seropositive adults with critical illness: a randomized clinical trial. JAMA 318:731–740
58. Papazian L, Doddoli C, Chetaille B, Gernez Y, Thirion X, Roch A, Donati Y, Bonnety M, Zandotti C, Thomas P (2007) A contributive result of open-lung biopsy improves survival in acute respiratory distress syndrome patients. Crit Care Med 35:755– 762
59. Papazian L, Fraisse A, Garbe L, Zandotti C, Thomas P, Saux P, Pierrin G, Gouin F (1996) Cytomegalovirus. An unexpected cause of ventilator-associated pneumonia. Anesthesiology 84:280–287
60. Papazian L, Hraiech S, Lehingue S, Roch A, Chiche L, Wiramus S, Forel JM (2016) Cytomegalovirus reactivation in ICU patients. Intensive Care Med 42:28–37
61. Papazian L, Thomas P, Bregeon F, Garbe L, Zandotti C, Saux P, Gaillat F, Drancourt M, Auffray J, Gouin F (1998) Open-lung biopsy in patients with acute respiratory distress syndrome. Anesthesiology 88:935–944
62. Ong DSY, Bonten MJM, Spitoni C, Verduyn Lunel FM, Frencken JF, Horn J, Schultz MJ, van der Poll T, Klein Klouwenberg PMC, Cremer OL, Molecular D, Stratification Risk, Risk Stratification of Sepsis C (2017) Epidemiology of multiple herpes viremia in previously immunocompetent patients with septic shock. Clin Infect Dis 64:1204–1210
63. Walton AH, Muenzer JT, Rasche D, Boomer JS, Sato B, Brownstein BH, Pachot A, Brooks TL, Deych E, Shannon WD, Green JM, Storch GA, Hotchkiss RS (2014) Reactivation of multiple viruses in patients with sepsis. PLoS ONE 9:e98819
64. Chastre J, Luyt CE (2016) Does this patient have VAP? Intensive Care Med 42:1159–1163
65. Leone M, Bouadma L, Bouhemad B, Brissaud O, Dauger S, Gibot S, Hraiech S, Jung B, Kipnis E, Launey Y, Luyt CE, Margetis D, Michel F, Mokart D, Montravers P, Monsel A, Nseir S, Pugin J, Roquilly A, Velly L, Zahar JR, Bruyere R, Chanques G, Adarpef Gfrup (2018) Brief summary of French guidelines for the prevention, diagnosis and treatment of hospital-acquired pneumonia in ICU. Ann Intensive Care 8:104
66. Klompas M (2007) Does this patient have ventilator-associated pneumonia? JAMA 297:1583–1593
67. Pugin J, Auckenthaler R, Mili N, Janssens J, Lew P, Suter P (1991) Diagnosis of ventilator-associated pneumonia by bacteriologic analysis of bronchoscopic and nonbronchoscopic “blind” bronchoalveolar lavage fluid. Am Rev Respir Dis 143:1121–1129
68. Singh N, Rogers P, Atwood C, Wagener M, Yu V (2000) Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit. A proposed solution for indiscriminate antibiotic prescription. Am J Respir Crit Care Med 162:505–511
69. Luyt CE, Chastre J, Fagon JY (2004) Value of the clinical pulmonary infection score for the identification and management of ventilator-associated pneumonia. Intensive Care Med 30:844–852
70. Wunderink R, Woldenberg L, Zeiss J, Day C, Ciemins J, Lacher D (1992) The radiologic diagnosis of autopsy-proven ventilator- associated pneumonia. Chest 101:458–463
71. Bouhemad B, Dransart-Raye O, Mojoli F, Mongodi S (2018) Lung ultrasound for diagnosis and monitoring of ventilator- associated pneumonia. Ann Transl Med 6:418
72. Gibot S, Cravoisy A, Levy B, Bene MC, Faure G, Bollaert PE (2004) Soluble triggering receptor expressed on myeloid cells and the diagnosis of pneumonia. N Engl J Med 350:451–458
73. Labenne M, Poyart C, Rambaud C, Goldfarb B, Pron B, Jouvet P, Delamare C, Sebag G, Hubert P (1999) Blind protected specimen brush and bronchoalveolar lavage in ventilated children. Crit Care Med 27:2537–2543
74. Luyt CE, Combes A, Reynaud C, Hekimian G, Nieszkowska A, Tonnellier M, Aubry A, Trouillet JL, Bernard M, Chastre J (2008) Usefulness of procalcitonin for the diagnosis of ventilator-associated pneumonia. Intensive Care Med 34:1434–1440
75. Povoa P, Martin-Loeches I, Ramirez P, Bos LD, Esperatti M, Silvestre J, Gili G, Goma G, Berlanga E, Espasa M, Goncalves E, Torres A, Artigas A (2016) Biomarker kinetics in the prediction of VAP diagnosis: results from the BioVAP study. Ann Intensive Care 6:32
76. Salluh JIF, Souza-Dantas VC, Povoa P (2017) The current status of biomarkers for the diagnosis of nosocomial pneumonias. Curr Opin Crit Care 23:391–397
77. Fagon J, Chastre J, Wolff M, Gervais C, Parer -AS, Stephan F, Similowski T, Mercat A, Diehl J, Sollet J, Tenaillon A (2000) Invasive and noninvasive strategies for management of suspected ventilator-associated pneumonia. A randomized trial. Ann Intern Med 132:621–630
78. Berton DC, Kalil AC, Teixeira PJ (2014) Quantitative versus qualitative cultures of respiratory secretions for clinical outcomes in patients with ventilator-associated pneumonia. Cochrane Database Syst Rev. https://doi.org/10.1002/14651858.CD006482.pub4
79. Berton DC, Kalil AC, Teixeira PJ (2012) Quantitative versus qualitative cultures of respiratory secretions for clinical outcomes in patients with ventilator-associated pneumonia. Cochrane Database Syst Rev 1:Cd006482
80. Schuetz P, Wirz Y, Sager R, Christ-Crain M, Stolz D, Tamm M, Bouadma L, Luyt CE, Wolff M, Chastre J, Tubach F, Kristoffersen KB, Burkhardt O, Welte T, Schroeder S, Nobre V, Wei L, Bucher HC, Annane D, Reinhart K, Falsey AR, Branche A, Damas P, Nijsten M, de Lange DW, Deliberato RO, Oliveira CF, Maravic-Stojkovic V, Verduri A, Beghe B, Cao B, Shehabi Y, Jensen JS, Corti C, van Oers JAH, Beishuizen A, Girbes ARJ, de Jong E, Briel M, Mueller B (2018) Effect of procalcitonin- guided antibiotic treatment on mortality in acute respiratory infections: a patient level meta-analysis. Lancet Infect Dis 18:95–107
81. Schuetz P, Beishuizen A, Broyles M, Ferrer R, Gavazzi G, Gluck EH, Gonzalez Del Castillo J, Jensen JU, Kanizsai PL, Kwa ALH, Krueger S, Luyt CE, Oppert M, Plebani M, Shlyapnikov SA, Toccafondi G, Townsend J, Welte T, Saeed K (2019) Procalcitonin (PCT)-guided antibiotic stewardship: an international experts consensus on optimized clinical use. Clin Chem Lab Med 57:1308–1318
82. Luyt CE, Brechot N, Trouillet JL, Chastre J (2014) Antibiotic stewardship in the intensive care unit. Crit Care 18:480
83. Thomas LC, Gidding HF, Ginn AN, Olma T, Iredell J (2007) Development of a real-time Staphylococcus aureus and MRSA (SAM-) PCR for routine blood culture. J Microbiol Methods 68:296–302
84. Fullston EF, Doyle MJ, Higgins MF, Knowles SJ (2019) Clinical impact of rapid polymerase chain reaction (PCR) test for group B Streptococcus (GBS) in term women with ruptured membranes. Ir J Med Sci 188:1269–1274
85. Jamal W, Al Roomi E, AbdulAziz LR, Rotimi VO (2014) Evaluation of curetis unyvero, a multiplex PCR-based testing system, for rapid detection of bacteria and antibiotic resistance and impact of the assay on management of severe nosocomial pneumonia. J Clin Microbiol 52:2487–2492
86. Gadsby NJ, McHugh MP, Forbes C, MacKenzie L, Hamilton SKD, Griffith DM, Templeton KE (2019) Comparison of Unyvero P55 Pneumonia Cartridge, in-house PCR and culture for the identification of respiratory pathogens and antibiotic resistance in bronchoalveolar lavage fluids in the critical care setting. Eur J Clin Microbiol Infect Dis 38:1171–1178
87. Kunze N, Moerer O, Steinmetz N, Schulze MH, Quintel M, Perl T (2015) Point-of-care multiplex PCR promises short turnaround times for microbial testing in hospital-acquired pneumonia—an observational pilot study in critical ill patients. Ann Clin Microbiol Antimicrob 14:33
88. Papan C, Meyer-Buehn M, Laniado G, Nicolai T, Griese M, Huebner J (2018) Assessment of the multiplex PCR-based assay Unyvero pneumonia application for detection of bacterial pathogens and antibiotic resistance genes in children and neonates. Infection 46:189–196
89. Brusselaers N, Labeau S, Vogelaers D, Blot S (2013) Value of lower respiratory tract surveillance cultures to predict bacterial pathogens in ventilator-associated pneumonia: systematic review and diagnostic test accuracy meta-analysis. Intensive Care Med 39:365–375
90. Michel F, Franceschini B, Berger P, Arnal JM, Gainnier M, Sainty JM, Papazian L (2005) Early antibiotic treatment for BAL- confirmed ventilator-associated pneumonia: a role for routine endotracheal aspirate cultures. Chest 127:589–597
91. Klompas M (2017) Oropharyngeal decontamination with antiseptics to prevent ventilator-associated pneumonia: rethinking the benefits of chlorhexidine. Semin Respir Crit Care Med 38:381–390
92. Huang HB, Jiang W, Wang CY, Qin HY, Du B (2018) Stress ulcer prophylaxis in intensive care unit patients receiving enteral nutrition: a systematic review and meta-analysis. Crit Care 22:20
93. Wittekamp BH, Plantinga NL, Cooper BS, Lopez-Contreras J, Coll P, Mancebo J, Wise MP, Morgan MPG, Depuydt P, Boelens J, Dugernier T, Verbelen V, Jorens PG, Verbrugghe W, Malhotra-Kumar S, Damas P, Meex C, Leleu K, van den Abeele AM, Pimenta Gomes, de Matos AF, Fernandez Mendez S, Vergara Gomez A, Tomic V, Sifrer F, Villarreal Tello E, Ruiz Ramos J, Aragao I, Santos C, Sperning RHM, Coppadoro P, Nardi G, Brun-Buisson C, Bonten MJM (2018) Decontamination strategies and bloodstream infections with antibiotic-resistant microorganisms in ventilated patients: a randomized clinical trial. JAMA 320:2087–2098
94. Caroff DA, Li L, Muscedere J, Klompas M (2016) Subglottic secretion drainage and objective outcomes: a systematic review and meta-analysis. Crit Care Med 44:830–840
95. Harris BD, Thomas GA, Greene MH, Spires SS, Talbot TR (2018) Ventilator bundle compliance and risk of ventilator-associated events. Infect Control Hosp Epidemiol 39:637–643
96. Legoff J, Zucman N, Lemiale V, Mokart D, Pene F, Lambert J, Kouatchet A, Demoule A, Vincent F, Nyunga M, Bruneel F, Contejean A, Mercier-Delarue S, Rabbat A, Lebert C, Perez P, Meert AP, Benoit D, Schwebel C, Jourdain M, Darmon M, Resche-Rigon M, Azoulay E (2019) Clinical significance of upper airway virus detection in critically ill hematology patients. Am J Respir Crit Care Med 199:518–528
97. Klompas M (2012) Eight initiatives that misleadingly lower ventilator-associated pneumonia rates. Am J Infect Control 40:408– 410
98. Klompas M, Branson R, Eichenwald EC, Greene LR, Howell MD, Lee G, Magill SS, Maragakis LL, Priebe GP, Speck K, Yokoe DS, Berenholtz SM (2014) Strategies to prevent ventilator-associated pneumonia in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol 35(Suppl 2):S133–S154
99. Klompas M, Speck K, Howell MD, Greene LR, Berenholtz SM (2014) Reappraisal of routine oral care with chlorhexidine gluconate for patients receiving mechanical ventilation: systematic review and meta-analysis. JAMA Intern Med 174:751–761
100. Price R, MacLennan G, Glen J, Su DC (2014) Selective digestive or oropharyngeal decontamination and topical oropharyngeal chlorhexidine for prevention of death in general intensive care: systematic review and network meta-analysis. BMJ 348:g2197
101. Philippart F, Gaudry S, Quinquis L, Lau N, Ouanes I, Touati S, Nguyen JC, Branger C, Faibis F, Mastouri M, Forceville X, Abroug F, Ricard JD, Grabar S, Misset B, Group TO-CS (2015) Randomized intubation with polyurethane or conical cuffs to prevent pneumonia in ventilated patients. Am J Respir Crit Care Med 191:637–645
102. Jaillette E, Girault C, Brunin G, Zerimech F, Behal H, Chiche A, Broucqsault-Dedrie C, Fayolle C, Minacori F, Alves I, Barrailler S, Labreuche J, Robriquet L, Tamion F, Delaporte E, Thellier D, Delcourte C, Duhamel A, Nseir S, BestCuff Study G, the BoReal N (2017) Impact of tapered-cuff tracheal tube on microaspiration of gastric contents in intubated critically ill patients: a multicenter cluster-randomized cross-over controlled trial. Intensive Care Med 43: 1562–1571
103. Deem S, Yanez D, Sissons-Ross L, Broeckel JA, Daniel S, Treggiari M (2016) Randomized pilot trial of two modified endotracheal tubes to prevent ventilator-associated pneumonia. Ann Am Thorac Soc 13:72–80
104. Maertens B, Blot K, Blot S (2018) Prevention of ventilator-associated and early postoperative pneumonia through tapered endotracheal tube cuffs: a systematic review and meta-analysis of randomized controlled trials. Crit Care Med 46:316–323
105. Letvin A, Kremer P, Silver PC, Samih N, Reed-Watts P, Kollef MH (2018) Frequent versus infrequent monitoring of endotracheal tube cuff pressures. Respir Care 63:495–501
106. Nseir S, Lorente L, Ferrer M, Rouze A, Gonzalez O, Bassi GL, Duhamel A, Torres A (2015) Continuous control of tracheal cuff pressure for VAP prevention: a collaborative meta-analysis of individual participant data. Ann Intensive Care 5:43
107. Muscedere J, Rewa O, McKechnie K, Jiang X, Laporta D, Heyland DK (2011) Subglottic secretion drainage for the prevention of ventilator-associated pneumonia: a systematic review and meta-analysis. Crit Care Med 39:1985–1991
108. Bouza E, Perez MJ, Munoz P, Rincon C, Barrio JM, Hortal J (2008) Continuous aspiration of subglottic secretions in the prevention of ventilator-associated pneumonia in the postoperative period of major heart surgery. Chest 134:938–946
109. Damas P, Frippiat F, Ancion A, Canivet JL, Lambermont B, Layios N, Massion P, Morimont P, Nys M, Piret S, Lancellotti P, Wiesen P, D’Orio V, Samalea N, Ledoux D (2015) Prevention of ventilator-associated pneumonia and ventilator-associated conditions: a randomized controlled trial with subglottic secretion suctioning. Crit Care Med 43:22–30
110. Lacherade JC, De Jonghe B, Guezennec P, Debbat K, Hayon J, Monsel A, Fangio P, Appere de Vecchi C, Ramaut C, Outin H, Bastuji-Garin S (2010) Intermittent subglottic secretion drainage and ventilator-associated pneumonia: a multicenter trial. Am J Respir Crit Care Med 182:910–917
111. Klompas M, Li L, Kleinman K, Szumita PM, Massaro AF (2016) Associations between ventilator bundle components and outcomes. JAMA Intern Med 176:1277–1283
112. Deschepper M, Waegeman W, Eeckloo K, Vogelaers D, Blot S (2018) Effects of chlorhexidine gluconate oral care on hospital mortality: a hospital-wide, observational cohort study. Intensive Care Med 44:1017–1026
113. Dale CM, Rose L, Carbone S, Smith OM, Burry L, Fan E, Amaral ACK, McCredie VA, Pinto R, Quinonez CR, Sutherland S, Scales DC, Cuthbertson BH (2019) Protocol for a multi-centered, stepped wedge, cluster randomized controlled trial of the de- adoption of oral chlorhexidine prophylaxis and implementation of an oral care bundle for mechanically ventilated critically ill patients: the CHORAL study. Trials 20:603
114. Saint S, Greene MT, Fowler KE, Ratz D, Patel PK, Meddings J, Krein SL (2019) What US hospitals are currently doing to prevent common device-associated infections: results from a national survey. BMJ Qual Saf 28:741–749
115. Krein SL, Greene MT, Apisarnthanarak A, Sakamoto F, Tokuda Y, Sakihama T, Fowler KE, Ratz D, Saint S (2017) Infection prevention practices in Japan, Thailand, and the United States: results from national surveys. Clin Infect Dis 64:S105–S111
116. Wang L, Li X, Yang Z, Tang X, Yuan Q, Deng L, Sun X, (2016) Semi-recumbent position versus supine position for the prevention of ventilator-associated pneumonia in adults requiring mechanical ventilation. Cochrane Database Syst Rev. https://doi.org/10.1002/14651858.CD009946.pub2
117. Li Bassi G, Panigada M, Ranzani OT, Zanella A, Berra L, Cressoni M, Parrini V, Kandil H, Salati G, Selvaggi P, Amatu A, Sanz- Moncosi M, Biagioni E, Tagliaferri F, Furia M, Mercurio G, Costa A, Manca T, Lindau S, Babel J, Cavana M, Chiurazzi C, Marti JD, Consonni D, Gattinoni L, Pesenti A, Wiener-Kronish J, Bruschi C, Ballotta A, Salsi P, Livigni S, Iotti G, Fernandez J, Girardis M, Barbagallo M, Moise G, Antonelli M, Caspani ML, Vezzani A, Meybohm P, Gasparovic V, Geat E, Amato M, Niederman M, Kolobow T, Torres A, Gravity VAPN (2017) Randomized, multicenter trial of lateral Trendelenburg versus semirecumbent body position for the prevention of ventilator-associated pneumonia. Intensive Care Med 43:1572–1584
118. Santacruz CA, Pereira AJ, Celis E, Vincent JL (2019) Which multicenter randomized controlled trials in critical care medicine have shown reduced mortality? A systematic review. Crit Care Med 47:1680–1691
119. Plantinga NL, de Smet A, Oostdijk EAN, de Jonge E, Camus C, Krueger WA, Bergmans D, Reitsma JB, Bonten MJM (2018) Selective digestive and oropharyngeal decontamination in medical and surgical ICU patients: individual patient data meta- analysis. Clin Microbiol Infect 24:505–513
120. Daneman N, Sarwar S, Fowler RA, Cuthbertson BH, Su DCSG (2013) Effect of selective decontamination on antimicrobial resistance in intensive care units: a systematic review and meta-analysis. Lancet Infect Dis 13:328–341
121. Su M, Jia Y, Li Y, Zhou D, Jia J (2020) Probiotics for the prevention of ventilator-associated pneumonia: a meta-analysis of randomized controlled trials. Respir Care. https://doi.org/10.4187/respcare.07097
122. Cook DJ, Johnstone J, Marshall JC, Lauzier F, Thabane L, Mehta S, Dodek PM, McIntyre L, Pagliarello J, Henderson W, Taylor RW, Cartin-Ceba R, Golan E, Herridge M, Wood G, Ovakim D, Karachi T, Surette MG, Bowdish DM, Lamarche D, Verschoor CP, Duan EH, Heels-Ansdell D, Arabi Y, Meade M, Investigators P, the Canadian Critical Care Trials G (2016) Probiotics: prevention of severe pneumonia and endotracheal colonization Trial-PROSPECT: a pilot trial. Trials 17:377
123. Alhazzani W, Alshamsi F, Belley-Cote E, Heels-Ansdell D, Brignardello-Petersen R, Alquraini M, Perner A, Moller MH, Krag M, Almenawer S, Rochwerg B, Dionne J, Jaeschke R, Alshahrani M, Deane A, Perri D, Thebane L, Al-Omari A, Finfer S, Cook
D, Guyatt G (2018) Efficacy and safety of stress ulcer prophylaxis in critically ill patients: a network meta-analysis of randomized trials. Intensive Care Med 44:1–11
124. Sasabuchi Y, Matsui H, Lefor AK, Fushimi K, Yasunaga H (2016) Risks and benefits of stress ulcer prophylaxis for patients with severe sepsis. Crit Care Med 44:e464–e469
125. Krag M, Marker S, Perner A, Wetterslev J, Wise MP, Schefold JC, Keus F, Guttormsen AB, Bendel S, Borthwick M, Lange T, Rasmussen BS, Siegemund M, Bundgaard H, Elkmann T, Jensen JV, Nielsen RD, Liboriussen L, Bestle MH, Elkjaer JM, Palmqvist DF, Backlund M, Laake JH, Badstolokken PM, Gronlund J, Breum O, Walli A, Winding R, Iversen S, Jarnvig IL, White JO, Brand B, Madsen MB, Quist L, Thornberg KJ, Moller A, Wiis J, Granholm A, Anthon CT, Meyhoff TS, Hjortrup PB, Aagaard SR, Andreasen JB, Sorensen CA, Haure P, Hauge J, Hollinger A, Scheuzger J, Tuchscherer D, Vuilliomenet T, Takala J, Jakob SM, Vang ML, Paelestik KB, Andersen KLD, van der Horst ICC, Dieperink W, Fjolner J, Kjer CKW, Solling C, Solling CG, Karttunen J, Morgan MPG, Sjobo B, Engstrom J, Agerholm-Larsen B, Moller MH, group S-It (2018) Pantoprazole in Patients at Risk for Gastrointestinal Bleeding in the ICU. N Engl J Med 379:2199–2208
126. Devlin JW, Skrobik Y, Gelinas C, Needham DM, Slooter AJC, Pandharipande PP, Watson PL, Weinhouse GL, Nunnally ME, Rochwerg B, Balas MC, van den Boogaard M, Bosma KJ, Brummel NE, Chanques G, Denehy L, Drouot X, Fraser GL, Harris JE, Joffe AM, Kho ME, Kress JP, Lanphere JA, McKinley S, Neufeld KJ, Pisani MA, Payen JF, Pun BT, Puntillo KA, Riker RR, Robinson BRH, Shehabi Y, Szumita PM, Winkelman C, Centofanti JE, Price C, Nikayin S, Misak CJ, Flood PD, Kiedrowski K, Alhazzani W (2018) Executive summary: clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med 46:1532–1548
127. Tipping CJ, Harrold M, Holland A, Romero L, Nisbet T, Hodgson CL (2017) The effects of active mobilisation and rehabilitation in ICU on mortality and function: a systematic review. Intensive Care Med 43:171–183
128. Pileggi C, Mascaro V, Bianco A, Nobile CGA, Pavia M (2018) Ventilator bundle and its effects on mortality among ICU patients: a meta-analysis. Crit Care Med 46:1167–1174
129. Barnes-Daly MA, Phillips G, Ely EW (2017) Improving hospital survival and reducing brain dysfunction at Seven California Community Hospitals: implementing PAD guidelines via the ABCDEF bundle in 6,064 patients. Crit Care Med 45:171–178
130. Pun BT, Balas MC, Barnes-Daly MA, Thompson JL, Aldrich JM, Barr J, Byrum D, Carson SS, Devlin JW, Engel HJ, Esbrook CL, Hargett KD, Harmon L, Hielsberg C, Jackson JC, Kelly TL, Kumar V, Millner L, Morse A, Perme CS, Posa PJ, Puntillo KA, Schweickert WD, Stollings JL, Tan A, D’Agostino McGowan L, Ely EW (2019) Caring for critically ill patients with the ABCDEF bundle: results of the ICU liberation collaborative in over 15,000 adults. Crit Care Med 47:3–14
131. Hsieh SJ, Otusanya O, Gershengorn HB, Hope AA, Dayton C, Levi D, Garcia M, Prince D, Mills M, Fein D, Colman S, Gong MN (2019) Staged implementation of awakening and breathing, coordination, delirium monitoring and management, and early mobilization bundle improves patient outcomes and reduces hospital costs. Crit Care Med 47:885–893
132. Klompas M, Kalil AC (2018) Rethinking ventilator bundles. Crit Care Med 46:1201–1203
133. Iregui M, Ward S, Sherman G, Fraser VJ, Kollef MH (2002) Clinical importance of delays in the initiation of appropriate antibiotic treatment for ventilator-associated pneumonia. Chest 122:262–268
134. Barbier F, Luyt CE (2016) Understanding resistance. Intensive Care Med 42:2080–2083
135. Razazi K, Mekontso Dessap A, Carteaux G, Jansen C, Decousser JW, de Prost N, Brun-Buisson C (2017) Frequency, associated factors and outcome of multi-drug-resistant intensive care unit-acquired pneumonia among patients colonized with extended- spectrum beta-lactamase-producing Enterobacteriaceae. Ann Intensive Care 7:61
136. Barbier F, Bailly S, Schwebel C, Papazian L, Azoulay E, Kallel H, Siami S, Argaud L, Marcotte G, Misset B, Reignier J, Darmon M, Zahar JR, Goldgran-Toledano D, de Montmollin E, Souweine B, Mourvillier B, Timsit JF, Group OS (2018) Infection-related ventilator-associated complications in ICU patients colonised with extended-spectrum beta-lactamase-producing Enterobacteriaceae. Intensive Care Med 44:616–626
137. Bostwick AD, Jones BE, Paine R, Goetz MB, Samore M, Jones M (2019) Potential Impact of Hospital-acquired Pneumonia Guidelines on Empiric Antibiotics. An Evaluation of 113 Veterans Affairs Medical Centers. Ann Am Thorac Soc 16:1392–1398
138. Harris PNA, Tambyah PA, Lye DC, Mo Y, Lee TH, Yilmaz M, Alenazi TH, Arabi Y, Falcone M, Bassetti M, Righi E, Rogers BA, Kanj S, Bhally H, Iredell J, Mendelson M, Boyles TH, Looke D, Miyakis S, Walls G, Al Khamis M, Zikri A, Crowe A, Ingram P, Daneman N, Griffin P, Athan E, Lorenc P, Baker P, Roberts L, Beatson SA, Peleg AY, Harris-Brown T, Paterson DL, Investigators MT, the Australasian Society for Infectious Disease Clinical Research N (2018) Effect of Piperacillin-Tazobactam vs Meropenem on 30-day mortality for patients with E. coli or Klebsiella pneumoniae bloodstream infection and ceftriaxone resistance: a randomized clinical trial. JAMA 320:984–994
139. Rodriguez-Bano J, Gutierrez-Gutierrez B, Kahlmeter G (2019) Antibiotics for ceftriaxone-resistant gram-negative bacterial bloodstream infections. JAMA 321:612–613
140. Luyt CE, Faure M, Bonnet I, Besset S, Huang F, Junot H, Hekimian G, Schmidt M, Brechot N, Combes A, Aubry A, Mayaux J, Chastre J (2019) Use of non-carbapenem antibiotics to treat severe extended-spectrum beta-lactamase-producing Enterobacteriaceae infections in intensive care unit patients. Int J Antimicrob Agents 53:547–552
141. Gutierrez-Gutierrez B, Perez-Galera S, Salamanca E, de Cueto M, Calbo E, Almirante B, Viale P, Oliver A, Pintado V, Gasch O, Martinez-Martinez L, Pitout J, Akova M, Pena C, Molina J, Hernandez A, Venditti M, Prim N, Origuen J, Bou G, Tacconelli E,Tumbarello M, Hamprecht A, Giamarellou H, Almela M, Perez F, Schwaber MJ, Bermejo J, Lowman W, Hsueh PR, Mora-Rillo M, Natera C, Souli M, Bonomo RA, Carmeli Y, Paterson DL, Pascual A, Rodriguez-Bano J (2016) A multinational, preregistered cohort study of beta-lactam/beta-lactamase inhibitor combinations for treatment of bloodstream infections due to extended- spectrum-beta-lactamase-producing enterobacteriaceae. Antimicrob Agents Chemother 60:4159–4169
142. Pena C, Suarez C, Ocampo-Sosa A, Murillas J, Almirante B, Pomar V, Aguilar M, Granados A, Calbo E, Rodriguez-Bano J, Rodriguez F, Tubau F, Oliver A, Martinez-Martinez L, Spanish Network for Research in Infectious D (2013) Effect of adequate single-drug vs combination antimicrobial therapy on mortality in Pseudomonas aeruginosa bloodstream infections: a post Hoc analysis of a prospective cohort. Clin Infect Dis 57:208–216
143. Martinez JA, Cobos-Trigueros N, Soriano A, Almela M, Ortega M, Marco F, Pitart C, Sterzik H, Lopez J, Mensa J (2010) Influence of empiric therapy with a beta-lactam alone or combined with an aminoglycoside on prognosis of bacteremia due to gram-negative microorganisms. Antimicrob Agents Chemother 54:3590–3596
144. Brunkhorst FM, Oppert M, Marx G, Bloos F, Ludewig K, Putensen C, Nierhaus A, Jaschinski U, Meier-Hellmann A, Weyland A, Grundling M, Moerer O, Riessen R, Seibel A, Ragaller M, Buchler MW, John S, Bach F, Spies C, Reill L, Fritz H, Kiehntopf M, Kuhnt E, Bogatsch H, Engel C, Loeffler M, Kollef MH, Reinhart K, Welte T, German Study Group Competence Network S (2012) Effect of empirical treatment with moxifloxacin and meropenem vs meropenem on sepsis-related organ dysfunction in patients with severe sepsis: a randomized trial. JAMA 307:2390–2399
145. Chastre J, Wolff M, Fagon JY, Chevret S, Thomas F, Wermert D, Clementi E, Gonzalez J, Jusserand D, Asfar P, Perrin D, Fieux F, Aubas S, Pneum ATG (2003) Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA 290:2588–2598
146. Bouadma L, Luyt CE, Tubach F, Cracco C, Alvarez A, Schwebel C, Schortgen F, Lasocki S, Veber B, Dehoux M, Bernard M, Pasquet B, Regnier B, Brun-Buisson C, Chastre J, Wolff M, group Pt (2010) Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet 375:463–474
147. Rello J, Sole-Lleonart C, Rouby JJ, Chastre J, Blot S, Poulakou G, Luyt CE, Riera J, Palmer LB, Pereira JM, Felton T, Dhanani J, Bassetti M, Welte T, Roberts JA (2017) Use of nebulized antimicrobials for the treatment of respiratory infections in invasively mechanically ventilated adults: a position paper from the European Society of clinical microbiology and infectious diseases. Clin Microbiol Infect 23:629–639
148. Lu Q, Yang J, Liu Z, Gutierrez C, Aymard G, Rouby JJ, Nebulized Antibiotics Study G (2011) Nebulized ceftazidime and amikacin in ventilator-associated pneumonia caused by Pseudomonas aeruginosa. Am J Respir Crit Care Med 184:106–115
149. Luyt CE, Hekimian G, Brechot N, Chastre J (2018) Aerosol therapy for pneumonia in the intensive care unit. Clin Chest Med 39:823–836
150. Kollef MH, Ricard JD, Roux D, Francois B, Ischaki E, Rozgonyi Z, Boulain T, Ivanyi Z, Janos G, Garot D, Koura F, Zakynthinos E, Dimopoulos G, Torres A, Danker W, Montgomery AB (2017) A randomized trial of the amikacin fosfomycin inhalation system for the adjunctive therapy of Gram-Negative ventilator-associated pneumonia: IASIS trial. Chest 151:1239–1246
151. Niederman, Alder J, Bassetti M, Boateng F, Cao B, Corkery K, Dhand R, Kaye KS, Lawatscheck R, McLeroth P, Nicolau DP, Wang C, Wood GC, Wunderink RG, Chastre J (2019) Inhaled amikacin adjunctive to intravenous standard-of-care antibiotics in mechanically ventilated patients with Gram-negative pneumonia (INHALE): a double-blind, randomised, placebo-controlled, phase 3, superiority trial. Lancet Infect Dis Dec. https://doi.org/10.1016/S1473-3099(19)30574-2
152. Zampieri FG, Nassar AP Jr, Gusmao-Flores D, Taniguchi LU, Torres A, Ranzani OT (2015) Nebulized antibiotics for ventilator- associated pneumonia: a systematic review and meta-analysis. Crit Care 19:150
153. Liu D, Zhang J, Liu HX, Zhu YG, Qu JM (2015) Intravenous combined with aerosolised polymyxin versus intravenous polymyxin alone in the treatment of pneumonia caused by multidrug-resistant pathogens: a systematic review and meta-analysis. Int J Antimicrob Agents 46:603–609
154. Valachis A, Samonis G, Kofteridis DP (2015) The role of aerosolized colistin in the treatment of ventilator-associated pneumonia: a systematic review and metaanalysis. Crit Care Med 43:527–533
155. Palmer LB, Smaldone GC, Chen JJ, Baram D, Duan T, Monteforte M, Varela M, Tempone AK, O’Riordan T, Daroowalla F, Richman P (2008) Aerosolized antibiotics and ventilator-associated tracheobronchitis in the intensive care unit. Crit Care Med 36:2008–2013
156. Palmer LB, Smaldone GC (2014) Reduction of bacterial resistance with inhaled antibiotics in the intensive care unit. Am J Respir Crit Care Med 189:1225–1233
157. Francois B, Luyt CE, Stover CK, Brubaker JO, Chastre J, Jafri HS (2017) New strategies targeting virulence factors of staphylococcus aureus and Pseudomonas aeruginosa. Semin Respir Crit Care Med 38:346–358
158. Francois B, Luyt CE, Dugard A, Wolff M, Diehl JL, Jaber S, Forel JM, Garot D, Kipnis E, Mebazaa A, Misset B, Andremont A, Ploy MC, Jacobs A, Yarranton G, Pearce T, Fagon JY, Chastre J (2012) Safety and pharmacokinetics of an anti-PcrV PEGylated monoclonal antibody fragment in mechanically ventilated patients colonized with Pseudomonas aeruginosa: a randomized, double-blind, placebo-controlled trial. Crit Care Med 40:2320–2326
159. François B, Sanchez MG, Eggimann P, Dequin P-F, Laterre P-F, Huberlant V, Escudero D, Boulain T, Bretonniere C, Pugin J, Alvarez JT, Ali O, Shoemaker K, Ruzin A, Vandamme D, Colbert S, Bellamy T, Dubovsky F, Jafri H, Group SS (2019) Suvratoxumab Reduces Staphylococcus Aureus Pneumonia in high-risk ICU patients: results of the SAATELLITE study. Am J Respir Crit Care Med 199:A7358–A7358
160. Luyt CE, Forel JM, Hajage D, Jaber S, Cayot-Constantin S, Rimmele T, Coupez E, Lu Q, Diallo MH, Penot-Ragon C, Clavel M, Schwebel C, Timsit JF, Bedos JP, Hauw-Berlemont C, Bourenne J, Mayaux J, Lefrant JY, Mira JP, Combes A, Wolff M, Chastre J, Papazian L (2019) Acyclovir for mechanically ventilated patients with herpes simplex virus oropharyngeal reactivation: a randomized clinical trial. JAMA Intern Med Dec 16:pii: 2757496. https://doi.org/10.1001/jamainternmed.2019.5713
161. Cowley NJ, Owen A, Shiels SC, Millar J, Woolley R, Ives N, Osman H, Moss P, Bion JF (2017) Safety and efficacy of antiviral therapy for prevention of cytomegalovirus reactivation in immunocompetent critically ill patients: a randomized clinical trial. JAMA Intern Med 177:774–783
162. Klompas M (2019) Prevention of intensive care unit-acquired pneumonia. Semin Respir Crit Care Med 40:548–557
163. Weng H, Li JG, Mao Z, Feng Y, Wang CY, Ren XQ, Zeng XT (2017) Probiotics for preventing ventilator-associated pneumonia in mechanically ventilated patients: a meta-analysis with trial sequential analysis. Front Pharmacol 8:717