Bài viết Tiêu chuẩn chăm sóc bệnh nhân ARDS: các cài đặt thông khí và các liệu pháp cứu hộ cho tình trạng thiếu oxy máu kháng trị được BS. Đặng Thanh Tuấn dịch từ bài viết gốc: The standard of care of patients with ARDS: ventilatory settings and rescue therapies for refractory hypoxemia
1. Tóm tắt
Mục đích: ARDS nặng thường có liên quan đến tình trạng thiếu oxy máu kháng trị, và phải xác định sớm và điều trị thiếu oxy máu. Quản lý ARDS nặng bằng các cài đặt thông khí, tư thế nằm sấp, kiểm soát nhiễm trùng và các biện pháp hỗ trợ là cần thiết để cải thiện sự sống còn.
Phương pháp và kết quả: Định nghĩa chính xác của thiếu oxy máu đe dọa tính mạng không được xác định. Các trị số lâm sàng điển hình là PaO 2 < 60mmHg và/hoặc SpO2
< 88% và/hoặc tỉ lệ PaO2/FIO2 < 100. Các cài đặt thông khí cơ học được khuyến cáo là: giới hạn thể tích khí lưu thông (6ml/kg trọng lượng cơ thể dự đoán), PEEP đủ cao (> 12 cmH2O), thủ thuật huy động trong những tình huống đặc biệt, và tần số hô hấp “cân bằng” (20-30 lần/phút). Các phương pháp tại giường dùng để hướng dẫn PEEP/huy động (ví dụ: áp lực xuyên phổi) vẫn chưa có. Tư thế nằm sấp [sớm (≤ 48 giờ sau khi bắt đầu ARDS nặng) và kéo dài (lặp lại 16 giờ) cải thiện sự sống còn. Quản lý và kiểm soát nhiễm trùng tiến bộ bao gồm chẩn đoán sớm các mẫu vi khuẩn, không điển hình, virut và nấm bệnh (cấy máu, dịch rửa phế quản phế nang), và các nguồn nhiễm trùng bằng CT scan, tiếp theo là sử dụng thuốc kháng sinh phổ rộng. Thuốc chẹn thần kinh cơ (Cisatracurium ≤ 48 giờ sau khi bắt đầu ARDS), cũng như một chiến lược an thần thích hợp (hướng dẫn theo bảng điểm) là một liệu pháp hỗ trợ quan trọng. Sự cân bằng dịch âm tính có liên quan đến chức năng phổi cải thiện và việc sử dụng lọc máu có thể được chỉ định cho các tình trạng cụ thể.
Kết luận: Một tiêu chuẩn chăm sóc đặc biệt là cần thiết để quản lý ARDS nặng với tình trạng thiếu oxy máu kháng trị.
2. Giảm oxy máu trong ARDS: định nghĩa, theo dõi, và cạm bẫy
Hội chứng suy hô hấp cấp tính (ARDS) được đặc trưng bởi suy giảm chức năng trao đổi khí phổi đe dọa tính mạng, dẫn đến tình trạng thiếu oxy máu, tăng CO2 máu, và nhiễm toan hô hấp và cần các biện pháp cứu cấp. Việc cung cấp oxy đến các mô là cần thiết, và tình trạng thiếu oxy trong mô sẽ gây ra các tác động có hại khác nhau bao gồm phản ứng mạch máu thay đổi, viêm, apoptosis tế bào và rối loạn chức năng hoặc suy cơ quan [1]. Thiếu oxy mô là kết quả của thiếu oxy máu, và thiếu oxy máu là kết quả của sự hỗ trợ không đầy đủ của hệ hô hấp và/hoặc hệ thống cung cấp oxy (cung lượng tim, mức hemoglobin [2]). Thật không may, không xác định được giới hạn chính xác và “giản đơn” đối với tình trạng thiếu oxy máu và mức độ “nguy hiểm” mà nguy cơ xuất hiện có thể khác nhau giữa các cơ quan và giữa bệnh nhân. Hơn nữa, không rõ liệu những bệnh nhân bị bệnh nặng có cùng một cơ chế bù trừ với thiếu oxy máu như là cơ thể con người “bình thường” hay không, và khởi phát nhanh, mức độ nặng và thời gian thiếu oxy máu là bao nhiêu để có thể quyết định sự khởi phát thiếu oxy mô.
Xác định lâm sàng của thiếu oxy máu thay đổi, nhưng các giá trị điển hình là:
- Áp lực riêng phần của oxy (PaO2) < 60 mmHg.
- Tỷ lệ PaO2 và FIO2 < 100.
- Độ bão hòa oxy máu động mạch (SaO 2) < 88%.
Trong những năm gần đây, một chiến lược giảm oxy máu cho phép (permissive hypoxemia) ở những bệnh nhân ARDS nặng đã được đề xuất nhằm giảm thiểu tác hại của nồng độ oxy cao bằng cách chấp nhận một SaO 2 thấp và tối ưu hóa cung lượng tim để duy trì sự cung cấp oxy đầy đủ [3]. Lưu ý rằng khái niệm “cổ điển” về sự phân phối/tiêu thụ oxy phụ thuộc vào nhauđang gây tranh cãi [4]. Một tổng quan Cochrane gần đây đã không xác định được bất kỳ nghiên cứu nào có liên quan về đánh giá tình trạng thiếu oxy máu so với mức oxy máu bình thường ở những bệnh nhân ARDS có thông khí [5]. Hơn nữa, trong phân tích hồi cứu các bệnh nhân ARDS, PaO2 thấp hơn trong quá trình thở máy (trung bình < 72 mmHg) có tỷ lệ suy giảm nhận thức về dài hạn và rối loạn tâm thần cao hơn so với PaO2 cao hơn (86 mmHg, p < 0,02) [6].
Thiếu oxy máu và thiếu oxy mô có thể được phát hiện bởi PaO 2, SaO2, lactate huyết thanh và độ bão hòa oxy tĩnh mạch trung ương (SvO 2), đó là các phép đo toàn phần và trị số lưu lượng/thể tích trung bình theo cân nặng phản ánh tình trạng thiếu oxy trong cơ thể vẫn chưa được biết. Trong thực tiễn lâm sàng, định nghĩa “thiếu oxy máu” thường dựa trên một hoặc nhiều giá trị toàn phần này, và hiện tại không có thông số nào cho việc đánh giá chính xác tình trạng thiếu oxy trong mô ở từng bệnh nhân. Vì sự ôxy hóa mô không thích hợp cũng như việc cho dùng oxy quá mức (với biểu hiện của các loại phản ứng oxy) có thể gây hại [7], sự cân bằng cẩn thận dựa trên việc kiểm soát chính xác lượng oxy hóa động mạch bao gồm cả việc chấp nhận ngưỡng “an toàn” có thể tránh tình trạng giảm oxy máu cũng như tổn thương liên quan đến tăng oxy máu. Nó vẫn được đánh giá trong các nghiên cứu tiếp theo liệu các công thức sinh học đã chọn có thể giúp xác định tình trạng thiếu oxy trong mô ở từng bệnh nhân.
Tóm lại, các thông số “đơn giản” và toàn phần (PaO2, SaO2, SvO2, lactate) là các đại diện không chính xác cho tình trạng giảm oxy máu ở bệnh nhân ARDS. Tuy nhiên, một phương pháp tiếp cận đặc hiệu cá nhân, theo cơ chế để theo dõi tình trạng thiếu oxy máu hiện nay không có. Do đó cần phải có một mục tiêu cho việc oxy hóa động mạch bảo tồn (PaO2 = 65-75 mmHg, SaO2 = 90-95%), nên được đưa vào chiến lược phòng ngừa suy giảm cơ quan nói chung.
3. Cài đặt máy thở 1: thể tích khí lưu thông/tần số thở
3.1 Thể tích khí lưu thông thấp trong ARDS thiếu oxy máu
Thông khí VT thấp (6 ml/kg PBW) làm giảm tử vong 28 ngày và tử vong trong bệnh viện [8], nhưng VT dựa trên PBW bỏ qua thể tích phổi thực sự có sẵn để thông khí. Thể tích áp dụng chỉ phân bố cho các khu vực có thông khí (aerated regions), và vùng không thông khí (non-aerated regions) càng lớn hơn, thì vùng còn thông khí càng bị quá căng (hyperinlation) (strain) nhiều hơn. Áp lực đẩy cho một VT nhất định có trách nhiệm mở các khu vực phổi bị xẹp cuối thì thở ra. Áp lực thấp sẽ không mở lại các khu vực này và tình trạng thiếu oxy máu sẽ xấu đi. Giải pháp là tăng PEEP nhằm thu được những lợi ích tiềm tàng của cách tiếp cận bảo vệ như vậy, đặc biệt là trong ARDS nặng. Điều này cũng sẽ làm giảm áp lực đẩy cần thiết [9, 10]. Nó sẽ cho phép cài đặt cá nhân hóa nhiều hơn dựa trên các phép đo sinh lý và các cân nhắc [11-13].
3.2 Phương thức kiểm soát thể tích hoặc áp lực
Cho dù thông khí kiểm soát áp lực (PCV) có thể làm giảm tổn thương phổi do thở máy (VALI) so với thông khí kiểm soát thể tích (VCV) là vấn đề tranh luận. Một phân tích gộp trong ba thử nghiệm ngẫu nhiên có đối chứng [14] đã kết luận rằng PCV không tốt hơn VCV, với nguy cơ tương đối về tỷ lệ tử vong ở bệnh viện và tử vong do ICU đối với PCV so với VCV là 0,83 (KTC 95% 0.67-1.02, p = 0.08) và 0,84 (KTC 95% 0,71-0,99, p = 0,04), tương ứng. Một nghiên cứu có hệ thống khác bao gồm 34 nghiên cứu kết luận rằng kết cục “không hề bị ảnh hưởng bởi việc sử dụng một loại nhịp thở so với tất cả các bệnh nhân” [15]. Do lưu lượng, áp lực đẩy, và tần số xác định năng lượng (power), và yếu tố làm cho thông khí gây tổn thương phổi, có vẻ như không có phương thức thở mà năng lượng này được cung cấp (tức là kiểu lưu lượng) đóng một vai trò quan trọng. APRV dẫn đến việc huy động tiềm năng bằng cách tăng áp lực đường thở và cho phép thở tự nhiên, với một số lợi ích tiềm ẩn (giảm sự an thần, thời gian thở máy ngắn hơn và cải thiện hoạt động của tim). HFOV cho phép thể tích khí lưu thông rất nhỏ, để ngăn chặn volutrauma, với áp lực đường thở trung bình (tương đối cao). Mặc dù lợi ích lý thuyết của họ, bằng chứng lâm sàng của cả hai kỹ thuật vẫn chưa được chứng minh và gây tranh cãi đối với bệnh nhân ARDS [16].
3.3 Tần số thở
Tác động của tần số thở (RR) đối với sự xuất hiện của VALI hoặc kết cục trong ARDS chưa được nghiên cứu độc lập. Tổn thương phổi có thể liên quan đến tần suất xẹp và mở lặp đi lặp lại [17], nghĩa là tần suất phổi tiếp xúc với stress và strain nhất định. Mức độ tổn thương mô có thể phụ thuộc vào biên độ áp lực và ở mức độ thấp hơn về tần số mà nó được áp dụng [18, 19]. Tuy nhiên, tần số thở cao hơn có thể ngăn ngừa sự mất huy động (tái xẹp) ở thì thở ra bằng cách giảm thời gian thở ra và gây ra PEEP nội sinh [20]. Trong một mô hình động vật của VALI, RR cao hơn có liên quan đến viêm phổi ít hơn, nhưng tăng phù phổi [21]. Theo đó, RR cao có thể ảnh hưởng đến lượng PEEP ngoại sinh, và tình trạng hiện tại của phổi về huy động (mất huy động), compliance khu vực, và resistance.
3.4 Tỉ lệ thời gian hít vào:thở ra (inspiratory/expiratory ratio)
Gia tăng thời gian hít vào đã được đề xuất để cải thiện oxy hóa. Ảnh hưởng của tỉ lệ I:E cao trong bệnh nhân ARDS thiếu oxy máu có liên quan đến sự gia tăng PEEP nội sinh, cải thiện thông khí của các đơn vị có hằng số thời gian dài và huy động phế nang thứ phát làm tăng áp lực đường thở trung bình (MPAW) [22]. Các kết quả liên quan đến hiệu quả của các tỷ lệ khác nhau I:E là mâu thuẫn [22, 23]. Các tác động tích cực đã được báo cáođã được cho là rút ngắn thời gian thở ra, tăng M PAW và PEEPi [24]. Sử dụng PEEP bên ngoài có lẽ là cách tiếp cận sinh lý học hơn vì nó duy trì mức độ kiểm soát và hằng định. Hơn nữa, tác động của một PEEPi không ổn định đến “stress/strain × time product” đối với sinh lý bệnh của VALI, đòi hỏi sự thận trọng [25].
3.5 Phương pháp làm ẩm: heat and moisture exchangers/humidifier
Việc làm ấm và làm ẩm khí thở vào bằng máy làm ẩm bằng nhiệt (HH) hoặc bộ trao đổi nhiệt và độ ẩm (HME) sẽ bù đắp cho các cơ chế giữ ẩm/ấm khí thở của cơ thể bị nối tắt và ngăn ngừa các biến chứng liên quan [26]. HME được sử dụng rộng rãi vì giá thấp, việc xử dụng đơn giản, và không gây ngưng tụ nước trong bộ dây thở. Tuy nhiên, chúng làm tăng khoảng chết và sức cản đường thở, cũng như công thở trong quá trình thở có trợ giúp, với nguy cơ tăng CO2 máu [27]. Ở bệnh nhân ARDS, nên dùng HH, mà không nên dùng HME có thể giảm PaCO2 một cách an toàn mà không thay đổi cài đặt thông khí [28]. Trong 17 bệnh nhân bị tổn thương phổi cấp ALI/ARDS VT giảm đáng kể khi sử dụng HH [29]. Những phát hiện này đặt câu hỏi về việc sử dụng HME ở bệnh nhân ARDS, nơi mà mục tiêu chính là cung cấp thông khí bảo vệ phổi tối ưu.
4. Cài đặt máy thở 2: PEEP/huy động phế nang
Việc huy động phế nang, có được thông qua áp lực dương cuối thì thở ra (PEEP) và/hoặc thủ thuật huy động phổi (LRM) đã được sử dụng để cải thiện tình trạng thiếu oxy máu ở bệnh nhân ARDS kểtừ đầu những năm 1970, ngay sau khi mô tả lần đầu tiên của hội chứng [30]. Hiện tại, mục đích của việc huy động phế nang không chỉ để cải thiện việc oxy hóa mà còn ngăn ngừa VALI bằng cách giảm thiểu sự mở và xẹp của phế nang theo chu kỳ hô hấp (atelectrauma) [31]. Tuy nhiên, mặc dù vô số các nghiên cứu lâm sàng và ba nghiên cứu lâm sàng lớn, hiệu quả của việc huy động phế nang vẫn còn đang gây tranh cãi [32-35]. Một lý do “đơn giản” là các bác sĩ lâm sàng thiếu phương pháp để định lượng việc huy động phế nang và ảnh hưởng của nó đối với VILI tại giường. Do đó, các quyết định dựa trên các đại diện, ví dụ như oxy hóa động mạch, áp lực bình nguyên cuối thì hít vào hoặc áp lực đẩy. Chụp cắt lớp trở kháng điện (EIT), siêu âm phổi, và chỉ số căng thẳng (stress index) đã được đề xuất để theo dõi việc huy động phế nang, nhưng hiếm khi được sử dụng trong thực hành lâm sàng [11, 36].
Hiện tại, chỉ có protocol dựa trên bằng chứng để cài đặt PEEP là một trong những đề xuất bởi ARDS Network (ARDSNet) trong một nghiên cứu quan trọng [8]. Tuy nhiên trong nghiên cứu đó, kết hợp PEEP và FiO 2 giống nhau đối với nhóm kiểm soát và nhóm nghiên cứu và LRM không được thực hiện. Nói chung, protocol ARDSNet chỉ “dung nạp” sự xẹp phổi bằng cách áp dụng PEEP và FiO 2 tối thiểu để phù hợp với mục tiêu oxy hoá chấp nhận được (nhưng khá thấp) (giữa 55 và 80 mmHg). Tuy nhiên, hai vấn đề chính vẫn còn đang phải bàn cãi: ngăn ngừa các cơ chế chính của VILI (cân nhắc giữa xẹp/mở có chu kỳ và quá căng phế nang) [9], và tốt nhất là “cứu hộ” được chấp nhận nếu protocol ARDSNet thất bại (nghĩa là nếu mục tiêu oxy hóa không đạt được với bảng PEEP/FiO2 và/hoặc áp lực bình nguyên đạt giới hạn do protocol quy định). Các tác dụng phụ tổng thể và các biến chứng liên quan đến thông khí cơ học được tóm tắt trong bảng 1.
Một phân tích gộp trong ba nghiên cứu lâm sàng chính [37] đánh giá vấn đề đầu tiên và đề xuất rằng việc áp dụng LRMs và PEEP cao hơn những gì được gợi ý bởi protocol của ARDSNet có thể cải thiện việc thông khí phổi và kết quả lâm sàng.
Table 1: Tần suất của tác dụng phụ và biến chứng của thở máy trong ARDS
| Tác dụng phụ/biến chứng | Tần suất | Vấn đề |
| Tổn thương phổi do máy thở (VALI) | Không rõ | Tỉ lệ và cường độ phụ thuộc vào sự xâm lấn/thời gian thở máy |
| Viêm phổi do thở máy (VAP) | 14 28 % | Vấn đề: Tỷ lệ phụ thuộc ào định nghĩa VAP; tỷ lệ mắc tăng cùng với thời gian và sự xâm lấn của thông khí cơ học |
| Rối loạn chức năng thất phải tâm phế cấp | đến 50 % | Thường kết hợp với hypercapnia /acidosis nặng |
| Tràn dịch màng phổi | đến 80 % | Thường gặp liên quan đến tình trạng quá tải dịch, giảm áp lực keo, rối loạn chức năng tim, và áp lực màng phổi bị thay đổi |
| Barotrauma/tràn khí màng phổi | 6 12 % | Phụ thuộc vào sự xâm lấn (Pplat) của thông khí cơ học |
| Tổn thương hệ thống cơ quan khác thông qua tác động chéo | Không biết chính xác | Phổi, não, và thận tác động nhau qua các con đường viêm |
| An thần kéo dài và bất động | Không biết | Tỉ lệ và cường độ phụ thuộc vào chiến lược an thần, (cho tỉnh dậy sớm), và thử nghiệm thở tự nhiên |
| Phản ứng tăng sinh sợi của nhu mô phổi | đến 50 % trong “Kỷ nguyên bảo vệ phổi” | Sự suy giảm chức năng phổi (dung tích sống, thể tích thở ra gắng sức) lên đến 5 năm sau khi xuất viện |
Vấn đề thứ hai là một thách thức lâm sàng lớn trong một nhóm nhỏ bệnh nhân. Phương pháp tiếp cận đầu tiên đối với tình trạng thiếu oxy máu nặng kéo dài nên là tư thế nằm sấp [38] và thuốc phong tỏa thần kinh cơ [39]. Nếu những phương pháp này không cải thiện được oxy hóa, bệnh nhân là ứng cử viên cho việc huy động phổi tối đa “cứu hộ”. Phương pháp tiếp cận mở phổi đơn giản, mặc dù thông minh, là phương pháp được đề xuất bởi nghiên cứu Express [33], không chỉ dành riêng cho các bệnh nhân “cứu hộ”. Nói một cách ngắn gọn, nó bao gồm PEEP tăng lên từng bậc đến áp lực bình nguyên cuối thì hít vào ở 30-32 cmH2O (35 cmH2O nếu khả năng đàn hồi ngực giảm), trong khi thông khí với thể tích khí lưu thông thấp (VT, tức 4-6 ml/kg PBW). LRM không bắt buộc trong protocol Express; tuy nhiên, ở những bệnh nhân “khó thông khí” thủ thuật này được khuyến cáo trước khi chuẩn độ PEEP.
Một cách tiếp cận quan trọng, mặc dù hiếm khi áp dụng trong thực hành lâm sàng, là tối ưu hóa áp lực xuyên phổi (P L). Thật vậy trong quá trình PEEP và LRM, áp lực đẩy của máy thở bao gồm hai thành phần: một để bơm phồng phổi (P L) và một để mở rộng thành ngực. Đồng thời đo việc áp lực mở đường thở và áp lực thực quản cho phép phân chia các tính chất cơ học của phổi và thành ngực. Theo đó PEEP và LRM có thể được điều chỉnh an toàn đến mục tiêu P L “tối ưu”. Những bằng chứng gần đây cho thấy điều này có thể cải thiện tình trạng thiếu oxy máu “kháng trị” [40]. Cách tiếp cận phổi tích cực nhất đã được Barbas và cộng sự đề xuất [41] và dựa trên bằng chứng sinh lý học rằng huy động phế nang là một hiện tượng nhiều thì hít vào (multi- inspiratory phenomenon) và “áp lực mở” tới hạn của các đơn vị phổi xẹp là cao hơn áp lực cần thiết để giữ cho chúng mở. Barbas et al. [41] đã đề xuấtđể chuẩn độ PEEP trên đường thở ra của đường cong áp lực – thể tích (để phù hợp với compliance tốt nhất hoặc oxy hóa tốt nhất) ngay sau một LRM “tối đa”. LRM thực hiện bằng tăng PEEP từng bậc lên đến 45 cmH 2O, trong khi thông khí cho bệnh nhân với áp lực đẩy 10-15 cmH2O.
Cách tiếp cận phổi mở có thể cải thiện đáng kể việc oxy hóa, đồng thời giảm thiểu VALI. Khả năng huy động phế nang trong cá nhân bệnh nhân thay đổi rất nhiều và rất khó tiên đoán [42]. Theo nguyên tắc chung, những bệnh nhân ARDS sớm, lan tỏa, là những người có thể huy động tốt, trong khi những bệnh nhân ARDS muộn (> 1 tuần) hoặc ARDS khu trú không phải là người có thể huy động [35, 43]. Ở các người khó huy động, phương pháp phổi mở có thể gây căng phế nang quá mức và do đó gây VALI [31]. Chỉ số căng thẳng – stress index (xác định được thông khí cơ học gây tổn thương từ hình dạng của đường cong áp lực và thể tích) có thể là một công cụ có giá trị để theo dõi căng phồng phổi quá mức do tiếp cận phổi mở [11]. Một tác dụng bất lợi tiềm tàng khác của phương pháp tiếp cận phổi mở là suy giảm huyết động do giảm tiền tải hoặc tăng hậu tải thất phải [44].
5. Tư thế
5.1 Chỉ định của tư thế nằm sấp
Thông khí tư thế nằm sấp là thông khí cơ học cho bệnh nhân nằm quay mặt xuống giường. Phương pháp này thường xuyên và đôi khi cải thiện rõ rệt oxy hóa ở bệnh nhân ARDS [45]. Là một phương pháp điều trị, thông khí tư thế năm sấp dễ dẫn đến sự oxy hóa tốt hơn đáng kể so với thông khí cơ học được áp dụng ở vị trí nằm ngửa ở bệnh nhân ARDS [46]. Tư thế nằm sấp được sử dụng như một chiến lược quan trọng trong tình trạng thiếu oxy đe doạ đến mạng sống để tránh các phản ứng phụ nặng hoặc tửvong do tình trạng thiếu oxy máu trầm trọng. Trong phân tích dữ liệu bệnh nhân của bốn RCTs lớn, tư thế nằm sấp có tỷ lệ sống sót tốt hơn đáng kể ở bệnh nhân ARDS với PaO2/FiO2 < 100 mmHg [47]. Tuy nhiên, trong một thử nghiệm gần đây cho thấy sự sống sót tốt hơn đáng kể ở nhóm tư thế nằm sấp so với vị trí nằm ngửa ở bệnh nhân ARDS ở mức độ trung bình và nặng, lợi ích của nằm sấp được thấy ở bất kỳ mức độ thiếu oxy máu nào tại thời điểm ngẫu nhiên và không tương quan đã được tìm thấy giữa mức độ đáp ứng oxy hóa của phiên đầu tiên và của bệnh nhân còn sống [49]. Do đó, tác dụng có lợi của nằm sấp có thể được giải thích bởi các yếu tố khác hơn là cải thiện oxy hóa. Trong số đó, việc phòng ngừa VALI [50, 51] có thể là một yếu tố góp phần lớn vào lợi ích của việc nằm sấp. Như vậy, nó nên được áp dụng như là điều trị đầu tiên cho bất kỳ bệnh nhân ARDS vừa hoặc nặng.
5.2 Thời điểm và thời gian kéo dài
Nên nhấn mạnh rằng tác động của nằm sấp đối với phòng chống VILI khác với hiệu quả của việc oxy hóa. Từ đó trở đi, nằm sấp nên được sử dụng sớm nhất có thể sau khi xác định ARDS giảm oxy máu để làm cho phổi đồng nhất hơn và giảm stress và strain lên toàn bộ phổi trong thông khí cơ học. Tuy nhiên, trong thử nghiệm Proseva, bệnh nhân được ghi danh tham gia sau giai đoạn ổn định 12 đến 24 giờ được sử dụng để xác nhận ARDS. Có khả năng chiến lược này đã dẫn đến việc lựa chọn bệnh nhân với khả năng huy động nhiều hơn và không đồng nhất hơn [53], điều này có lợi cho tư thế nằm sấp. Tuy nhiên, nhóm đối chứng không bị mất cân bằng vì tỷ lệ tử vong của nó cũng chính xác như trong một thử nghiệm khác trên những bệnh nhân tương tự [54].
Các thử nghiệm ban đầu được dùng tư thế nằm sấp trong các phiên kéo dài 7-8 giờ [55, 56]. Nó cho thấy rằng sử dụng lâu hơn, phiên kéo dài hơn 12 giờ là khả thi [57, 58]. Trong thử nghiệm Proseva, thời gian trung bình của phiên là 17 giờ và trung bình 4 ngày điều trị bằng tư thế nằm sấp. Trong thử nghiệm PSII [57], các giá trị này lần lượt là 18 giờ và 8 ngày. Tiêu chuẩn để ngừng tư thế nằm sấp được xác định trong thử nghiệm Proseva như là một sự cải thiện oxy hóa cho trong 4 giờ cuối ở vị trí nằm ngửa (PaO2/FIO2 > 150 mm Hg với PEEP < 10 cm H2O và FiO2 < 0,6). Trong thử nghiệm PSII, tư thế nằm sấp chỉ được ngưng lại khi suy hô hấp cấp đã hồi phục (PaO2/FIO2 ở nằm sấp tương tự như ở nằm ngữa). Hai chiến lược này cho kết quả liều tư thế nằm sấp khác nhau, tương ứng là 73 và 50% thời gian của ngày.
5.3 Xử trí nguy cơ/an toàn bệnh nhân
Điều thú vị cần lưu ý là ở nhiều trung tâm đã sử dụng tư thế nằm sấp trong nhiều năm, thủ thuật đơn giản và được thực hiện thường xuyên bởi 3-4 người chăm sóc. Ở các trung tâm khác không thường xuyên cho bệnh nhân nằm sấp, thủ thuật được mô tả là phức tạp, rườm rà và nguy hiểm. Cần nhấn mạnh rằng thủ thuật thực sự cần một chương trình thực hiện cụ thể trong ICU và có thể là, tác động về thể tích là vấn đề quan trọng. Trong phân tích gộp cuối cùng của các thử nghiệm trên tư thế nằm sấp và vị trí nằm ngửa [58, 59], vết loét áp lực và tắc nghẽn khí quản vẫn thường gặp hơn đáng kể khi tư thế nằm sấp. Cũng cần nhấn mạnh rằng không có thử nghiệm nào cho thấy những ảnh hưởng có hại của tư thế nằm sấp như một nhóm.
5.4 Các chống chỉ định
Chống chỉ định đặc biệt đối với nằm sấp đã được xác định trong các thử nghiệm. Chống chỉ định đơn tuyệt đối duy nhất là gãy cột sống không ổn định. Tất cả các chống chỉ định khác (Bảng 2) đều tương đối và sự cân bằng giữa lợi ích và nguy cơ nên được khuyến khích. Cần lưu ý từ Bảng 2 rằng bụng cấp tính không phải là chống chỉ định đối với tư thế nằm sấp.
Bảng 2: Các chống chỉ định của tư thế nằm sấp trong các nghiên cứu
| Gattinoni [55] | Guérin [48 54] | Mancebo [56] | Taccone [57] |
| Phù não hoặc tăng áp lực nội sọ | ICP > 30 mmHg hoặc CPP < 60 mmHg Ho ra máu nặng cần can thiệp thủ thuật hoặc phẫu thuật Phẫu thuật khí quản hoặc xương ức trong vòng 15 ngày ngoại trừ đường thở đã được tiếp cận Chấn thương mặt nghiêm trọng hoặc phẫu thuật mặt trong 15 ngày trước Huyết khối tĩnh mạch sâu được điều trị ít hơn 2 ngày Máy tạo nhịp tim được đặt trong 2 ngày qua |
Chấn thương sọ não hoặc nghi ngờ tăng ALNS | Tăng ALNS |
| Gãy cột sống | Gãy không ổn định cột sống, ương đùi, xương chậu | Gãy ương chậu và/hoặc cột sống | Gãy ương chậu và/hoặc cột sống |
| Bất ổn huyết động học |
MAP < 65 mmHg Thai kỳ Đặt ống dẫn lưu ngực với rò khí |
6. Xử trí nhiễm khuẩn tiến bộ trong ARDS sớm
Trong giai đoạn đầu của ARDS, vào thời điểm nhập viện vào trung tâm ARDS, chụp cắt lớp (CT) phổi và toàn thân có thể được thực hiện đặc biệt ở sự kết hợp của nhiễm trùng huyết và ARDS để chẩn đoán (a) ổ nhiễm trùng là nguyên nhân chính của ARDS; (b) các biến chứng điển hình của ARDS; (c) rối loạn đồng thời cần can thiệp điều trị; và (d) các yếu tố nguy cơ cho việc hỗ trợ phổi ngoài cơ thể. CT được thực hiện để phát hiện một số tác nhân gây bệnh nhiễm trùng (hình ảnh thâm nhiễm phổi, hình ảnh kính mờ, tràn dịch màng phổi, tràn mủ màng phổi, áp xe phổi, hạch lympho, áp xe não, thuyên tắc huyết khối não, áp xe hoặc nhiễm trùng trong ổ bụng). Siêu âm tim thực quản rất hữu ích để loại trừ viêm nội tâm mạc và tràn dịch màng ngoài tim vàđánh giá chức năng tâm thất trái và phải. Nội soi mềm khí phế quản được sử dụng như là một thủ thuật chẩn đoán/điều trị những bệnh lý có thể gây thiếu oxy máu và tăng CO2 máu, và tình trạng thiếu oxy máu trầm trọng (PaO2/FiO2 <100) có thể được coi là chống chỉ định rửa phế quản phế nang (BAL, bronchoalveolar lavage). Lấy mẫu bằng bàn chải có bảo vệ (PSB, protected specimen brush) hiếm khi được sử dụng, vì nó tốn kém và dùng một lần.
Các xét nghiệm chẩn đoán nhiễm trùng
Các nguyên nhân chính của ARDS là nhiễm trùng. Nuôi cấy máu (Cấy máu: 2 x 2 cặp, ≥ 30 ml thể tích máu, điều kiện vô trùng, trước khi điều trị kháng sinh) là những chẩn đoán lâm sàng thiết yếu. Một chiến lược kháng sinh cụ thể dựa trên kết quả cấy hiệu quả hơn so với điều trị phổ rộng bằng kinh nghiệm [60]. Các kỹ thuật mới (polymerase chain reaction [PCR] and deoxyribonucleic acid [DNA] ampliication, microarray and/or matrix-assisted) rút ngắn thời gian xét nghiệm xuống còn dưới 8 giờ [61, 62].
Lấy dịch hút phế quản bằng cách sử dụng BAL định lượng (100-120 ml 0,9% NaCl) hoặc mini-BAL không nội soi phế quản (20-40 ml 0,9% NaCl), đặc biệt là ở các tình huống (thiếu oxy) BAL dùng qua nội soi phế quản có thể là quá xâm lấn [63]. Trị số cut-off đối với một số lượng đáng kể các đơn vị hình thành thuộc địa để phân biệt giữa tình trạng xâm chiếm và nhiễm khuẩn phụ thuộc vào loại xét nghiệm chẩn đoán: dịch tiết khí phế quản 105 CFU/ml; BAL 104 CFU/ml; và PSB 103 CFU/ml [64].
Việc nhuộm Gram vẫn được khuyến cáo, vì ở bệnh nhân không điều trị kháng sinh được đánh giá có giá trị tiên đoán âm tính cao. Đối với loại trừ viêm phổi không điển hình, cần đánh giá kháng nguyên Legionella (nước tiểu, đờm) với hai xét nghiệm âm tính. Các thử nghiệm phân tử mới như là một phần của viêm phổi do virus (cúm A với hai phân typ, parainfluenza 1-4) và các mầm bệnh không điển hình với một thời gian ngắn. Ở bệnh nhân ICU có viêm phổi liên quan đến cúm có nguy cơ bị đồng trùng hợp do vi khuẩn, một sự chậm trễ trong 5 ngày để điều trị cúm theo mùa và nhiễm trùng liên quan đến cúm được báo cáo (Bảng 3) [65]. Lưu ý, kiểm tra cẩn thận có thể giúp loại trừ một số bệnh cảnh lâm sàng bị nhầm lẫn với ARDS (ví dụ như xơ phổi tự phát, viêm phổi do tổ chức cryptogenic, viêm phổi kẽ phổi không điển hình, u hạt Wegener hoặc viêm phổi tăng bạch cầu ái toan cấp tính).
Các bệnh này cần tất nhiên là một chiến lược bảo vệ phổi (giới hạn VT), nhưng một số biện pháp đặc hiệu ARDS khác như được đề cập trong bài báo này không được chứng minh và có thể không được “tự động” hữu ích [66, 67]. Các công cụ chẩn đoán khác nhau của phân tích BAL (hemogram, cytology, và flow cytometric analysis) đã được mô tả như là một quá trình chẩn đoán hoàn chỉnh [68]. Ở những bệnh nhân suy giảm miễn dịch, các thủ thuật chẩn đoán và điều trị cụ thể là rất cần thiết. Việc điều trị trước với thuốc kháng sinh, sự kháng thuốc tại địa phương và mức độ nặng của bệnh với suy giảm cơ quan phải được xem xét để tính toán sử dụng các kháng sinh phổ rộng [69]. Điều trị mục tiêu sau khi phát hiện thành công mầm bệnh gây bệnh có hiệu quả hơn và giảm tỷ lệ tử vong. Hơn thế nữa, điều trị giảm ho và điều trị viêm phổi có mục đích phòng chống nhiễm trùng với các mầm bệnh đa kháng.
Để chẩn đoán nhiễm khuẩn do nấm candida xâm lấn, nên dùng cấy máu sớm và xét nghiệm (ví dụ, β-d-Glucan). Không nên thực hiện sinh thiết phổi để chứng minh sự có mặt của tổn thương phế nang lan tỏa, nhưng chỉ được xem xét nếu có nghi ngờ lâm sàng cao về kết quả đóng góp cho liệu pháp thực nghiệm (nguy hiểm) hoặc khi điều trị theo kinh nghiệm không thành công [70]. Những bệnh nhân suy giảm miễn dịch có nguy cơ cao về nấm aspergillosis phổi xâm lấn. Ở những bệnh nhân này, nồng độ galactomannan trong dịch BAL ở những vùng nghi ngờ trên CT là nhạy và cụ thể hơn so với thử nghiệm huyết thanh [71]. Các phương pháp chẩn đoán mới sử dụng thiết bị dòng chảy bên (lateral flow devices) có thể cho phép chẩn đoán tại giường trong tương lai [72].


Trong phần kết luận, các bệnh nhân ARDS có nghi ngờ nhiễm trùng là những ứng cử viên cho các kháng sinh phổ rộng sau khi lấy mẫu cấy máu và kết quả soi phế quản nội soi, và đánh giá lại hàng ngày về sự leo thang cũng như chiến lược ngăn ngừa nhiễm trùng nghiêm ngặt bao gồm tất cả các khía cạnh của các yếu tố can thiệp vào VAP [73].
7. Các điều trị nâng đỡ
7.1 Thuốc chẹn thần kinh cơ
Ở bệnh nhân ARDS có tỷ lệ PaO2/FiO2 thấp hơn 150 mmHg, điều trị sớm với truyền cisatracurium liên tục trong 48 giờ làm giảm tử vong 90 ngày và barotrauma và tăng số ngày không thở máy và số ngày không nằm ICU mà không tăng nguy cơ bị yếu cơ do dùng ICU [74]. Cơ chế chính xác dẫn đến kết quả cải thiện không rõ ràng. Về mặt cơ học phổi, sự đồng bộ tốt hơn có thể dẫn đến việc huy động phổi nhiều hơn và cải thiện độ giãn nở, trao đổi khí và oxy hóa hệ thống. Đối với viêm phổi, có thể hợp lý là việc kiểm soát được tốt hơn thể tích và áp lực hít vào sẽ làm giảm volutrauma, trong khi việc kiểm soát tốt hơn thể tích và áp lực thở ra làm giảm atelectrauma; kết quả là phản ứng viêm ở phổi và hệ thống ít hơn [75]. Theo phương pháp nghiên cứu, các bác sĩ lâm sàng đã không theo dõi độ sâu của liệt cơ bằng kích thích thần kinh ngoại vi, nhưng khi áp lực cao nguyên vượt quá 32 cmH2O (trong hơn 10 phút, bất chấp sự an thần tăng lên) thì tiêm tĩnh mạch cisatracurium. Lợi ích kết quả của điều trị cứu hộ bằng thuốc chẹn thần kinh cơ chỉ áp dụng cho cisatracurium besylate và không phải cho tất cả các thuốc chẹn thần kinh cơ. Các chiến lược liều lượng và giám sát tối ưu sẽ cần được nghiên cứu sâu hơn.
7.2 An thần
Quản lý an thần trong giai đoạn đầu ARDS được quản lý theo nhu cầu các thuốc chẹn thần kinh cơ và thúc đẩy thông khí phổi. Không có thử nghiệm ngẫu nhiên cho thấy lợi ích lâm sàng của bất kỳ thuốc an thần đặc biệt nào. Tuy nhiên, phân tích tỷ số thuận lợi của một cơ sở dữ liệu ICU đa trung tâm lớn cho thấy rằng truyền thuốc benzodiazepine đã liên quan độc lập với tỷ lệ tử vong cao hơn và thời gian lưu giữ ICU và hỗ trợ thở máy lâu hơn so với propofol [76].
Nếu bệnh nhân ARDS không đáp ứng các tiêu chuẩn về dùng thuốc liệt cơ liên tục hoặc khi các thuốc chẹn thần kinh cơ không còn cần thiết nữa, bác sĩ lâm sàng nên nhắm mục tiêu thuốc an thần nhẹ, thường xuyên đánh giá đau và an thần, sử dụng thang đo đã được kiểm chứng. An thần nên được quản lý theo cách tiếp cận đề xuất trong các hướng dẫn năm 2013 về quản lý đau, kích động, và mê sảng [77].
Một thử nghiệm ngẫu nhiên của Mehta và các đồng nghiệp đã cho thấy rằng sự ngưng thuốc an thần hàng ngày (DSI, daily sedation interruption) không mang lại lợi ích bổ sung khi sử dụng một phương pháp an thần theo hướng dẫn của điều dưỡng (nurse-directed sedation protocol) [78]; một tổng quan hệ thống của 9 thử nghiệm và 1282 bệnh nhân cũng kết luận rằng không có bằng chứng rõ ràng rằng DSI làm thay đổi thời gian thở máy, tử vong, hoặc thời gian nằm ICU hoặc thời gian nằm bệnh viện [79]. Mặc dù các bằng chứng cho thấy an thần nhẹ hoặc không có thuốc an thần ở những bệnh nhân bị thở máy có thể sẽ được tăng cường trong tương lai, nhưng không có dữ liệu về quản lý an thần ở những bệnh nhân bị thiếu oxy máu trầm trọng, nhưng trong những trường hợp nặng này sẽ an thần sâu trong vòng 48 giờ sau khi khởi phát cho thấy kết quả thuận lợi.
7.3 Thuốc giãn mạch phổi (Pulmonary vasodilators)
Mặc dù có sự cải thiện đáng kể về oxy hóa, oxít nitơ dạng hít (iNO) không làm giảm tỷ lệ tử vong ở bệnh nhân ARDS bất kể mức độ nặng của thiếu oxy máu, và nó có thể làm tăng nguy cơ suy thận [80]. Một phân tích gộp gần đây bao gồm 9 thử nghiệm ngẫu nhiên (n = 1142 bệnh nhân) không có sự không đồng nhất giữa các thử nghiệm (I
= 0%) cho thấy iNO không làm giảm tử vong ở những bệnh nhân ARDS nặng (RR 1,01; 95% CI 0.78- 1,32) cũng như ARDS nhẹ và vừa (RR 1,12, 95% CI 0.89-1.42) [81]. Hơn
nữa, phân tích các phân nhóm tỷ lệ PaO2/FiO2 dao động từ 70 đến 200 mmHg không xác định được ngưỡng mà iNO làm giảm tỷ lệ tử vong [80]. Một nghiên cứu so sánh hiệu quả, độ an toàn và chi phí của Epoprostenol dạng hít (iEPO) so với iNO, hồi cứu đơn trung tâm ở 105 bệnh nhân [82], cho thấy không có sự khác nhau giữa các nhóm về một số thông số lâm sàng và kết cục.
7.4 Kiểm soát thăng bằng dịch/hemofiltration
Quản lý dịch bảo thủ (hạn chế) trong ARDS với việc sử dụng furosemide có liên quan đến chức năng phổi được cải thiện và giảm thời gian thở máy mà không làm tăng suy của cơ quan ngoài phổi [83] mặc dù không có sự khác biệt đáng kể về kết cục chính của tử vong 60 ngày. Hơn nữa, một nghiên cứu đơn trung tâm cho thấy rằng điều trị sớm bằng hemofiltration như là một phương pháp điều trị cứu hộ cho bệnh nhân ARDS có thể làm giảm mức cytokine và đáp ứng viêm hệ thống, cải thiện chức năng tim, và giảm chỉ số nước ngoài mạch máu phổi, tất cả đều kết hợp với kết quả cải thiện [84]; tuy nhiên, các thử nghiệm lớn hơn là cần thiết. Một thử nghiệm đơn trung tâm 65 bệnh nhân được xuất bản bằng tiếng Trung Quốc cho thấy bệnh nhân được lọc máu liên tục với lưu lượng cao có lượng oxy hóa tốt hơn, giảm thời gian thông khí cơ học và cải thiện sự sống còn so với chăm sóc chuẩn [85].
7.5 Các điều trị nâng đỡ khác
Tỷ lệ xuất huyết đường tiêu hóa do stress ở những bệnh nhân ICU thì thấp, tầm quan trọng tiên lượng thì mơ hồ, nhưng việc dự phòng chảy máu dạ dày-ruột được sử dụng rộng rãi trong các ICU trên toàn thế giới. Trong một tổng quan có hệ thống, nó đã chứng minh rằng bằng chứng đầy đủ cho việc sử dụng dự phòng như vậy là thấp [86].
Sử dụng sớm và liều thấp Glucocorticoid (methylprednisolone 1 mg/kg/ngày, sau đó giảm liều) có thể làm tăng tỉ lệ hồi phục của ARDS và có thể góp phần làm giảm tử vong mà không có nguy cơ gia tăng nhiễm trùng [87], nhưng vẫn còn tranh cãi.
7.6 Kết luận
ARDS nặng thường có liên quan đến tình trạng thiếu oxy máu, và nhận dạng và điều trị sớm là bắt buộc [90]; tuy nhiên, một định Điều trị dự phòng thuyên tắc huyết khối tĩnh mạch sâu (DVE) là một biện pháp thường quy ở bệnh nhân ICU bất động, và trong các bệnh nhân ARDS cũng tương tự như các nhóm bệnh nhân khác [60]: heparin không phân đoạn hoặc heparin trọng lượng thấp nên được dùng để dự phòng DVE theo phác đồ của bệnh viện (tiêm dưới da hoặc truyền liên tục qua đường tĩnh mạch). Ở bệnh nhân ECMO, một chiến lược cụ thể về chống đông máu là bắt buộc [88]. Nằm đầu cao (20-45°) ở bệnh nhân ARDS, có thể góp phần cải thiện oxy hóa và cơ học hô hấp [89] so với “nằm ngửa” phẳng, nhưng những hạn chế về tư thế này (ảnh hưởng huyết động) cần được xem xét.
nghĩa “đơn giản” về sự giảm oxy máu vẫn chưa được xác định. Các cài đặt thông khí cụ thể bao gồm giới hạn về thể tích khí lưu thông, PEEP cao phù hợp, thủ thuật mở phổi (chiến lược phổi mở), tỷ lệ I:E = 1:1 kết hợp với tần số thở cân bằng, cũng như tư thế nằm sấp (sớn và đủ dài) được đề nghị trong một “thời khóa biểu” cụ thể (Hình 1).
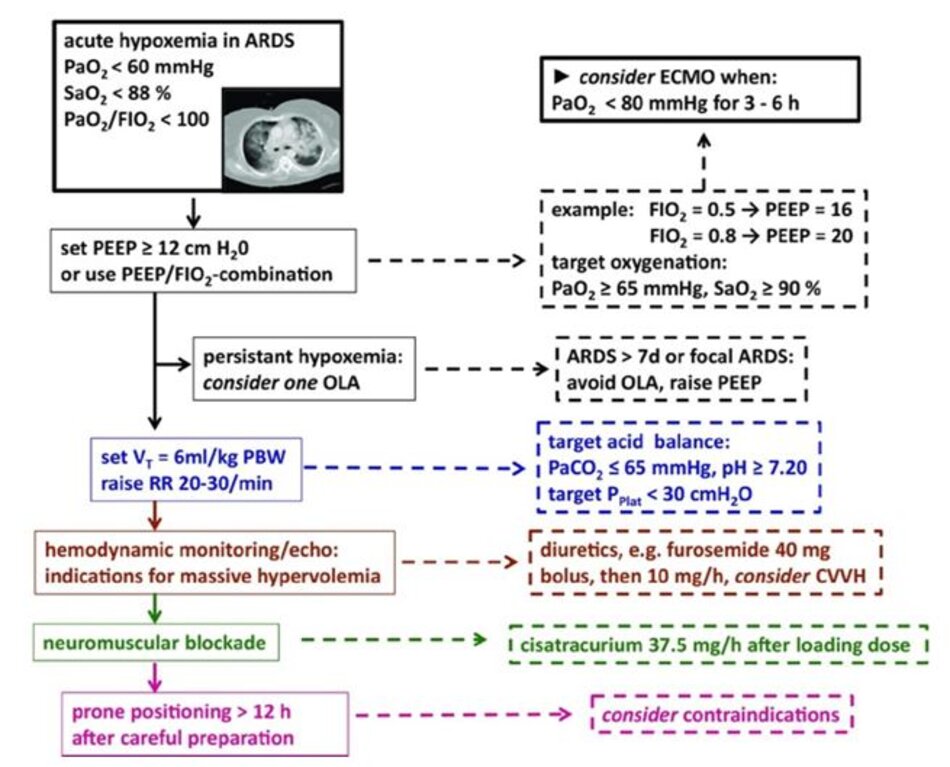
Ngoài ra, việc sử dụng thuốc phong tỏa thần kinh cơ (trong vòng 48 giờ sau khi bắt đầu ARDS) và một chiến lược an thần thích hợp là những liệu pháp hỗ trợ quan trọng (Hình 2).
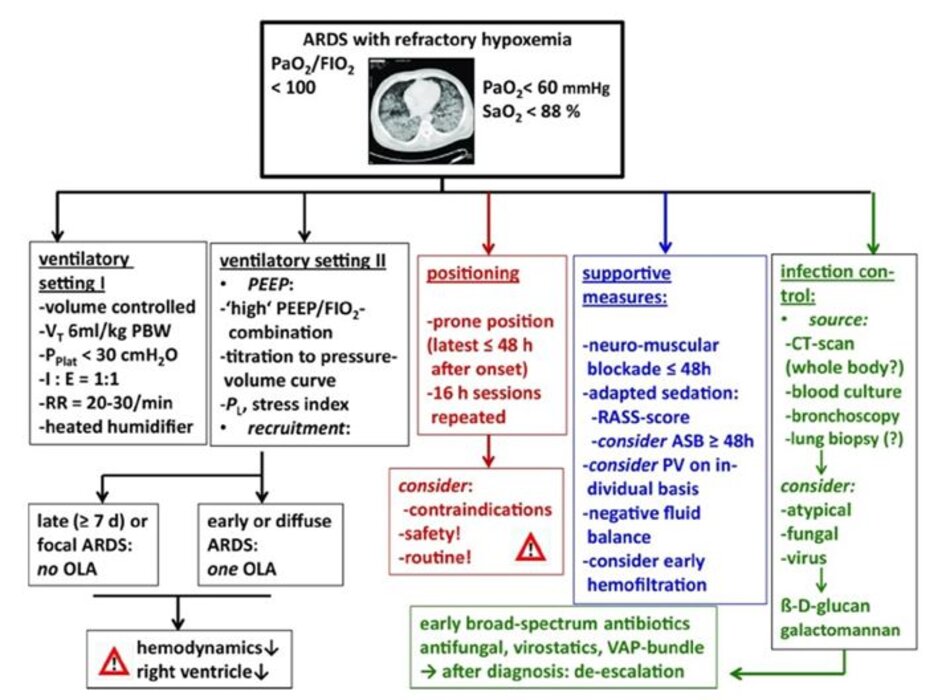
Việc hít thuốc giãn mạch phổi và/ hoặc việc sử dụng hemofiltration để cân bằng dịch âm tính có thể được chỉ định cho các chỉ định cụ thể. Quản lý/kiểm soát nhiễm trùng tiên tiến bao gồm chẩn đoán sớm các mẫu vi khuẩn, không điển hình, virut, nấm (cấy máu, BAL) và các nguồn lây nhiễm bằng CT scan, tiếp theo là kháng sinh phổ rộng.
Nhiều kỹ thuật hỗ trợ phổi ngoài cơ thể được thảo luận trong những năm gần đây như là các biện pháp cứu hộ ARDS như hỗ trợ tính mạng ngoài cơ thể nhưng các biện pháp cụ thể này không nằm trong phạm vi của bài báo này và chúng được mô tả rộng rãi ở nơi khác. Tỷ lệ tử vong thực tế ở bệnh nhân ARDS được trình bày trong Bảng 4. Một cơ sở dữ liệu lớn gần đây của 2377 bệnh nhân ARDS từ 50 quốc gia [91] cho thấy tỷ lệ tử vong khác nhau về mức độ nặng với tỷ lệ tử vong cao nhất là 46,1% đối với những bệnh nhân ARDS nặng.
| Nghiên cứu | Dữ liệu | Tỷ lệ tử vong |
| Bru Bruisson, ghiên ứu ALIVE 10 nước Châu Âu, 1999 | 401 bệnh nhân ARDS | 57.9 % (BV) |
| Villar, nghiên ứu ALIEN, Spain, 2008/2009 | 255 bệnh nhân ARDS | 47.8 % (BV) |
| Bellani, ghiên ứu LUNG SAFE , 50 quốc gia ở 5 châu lục, 2014 | 2377 bệnh nhân ARDS | ARDS hẹ: 34.9 % ARDS vừa: 40.3 % ARDS nặng: 46.1 % |
| Howard, USA, 2005 2013 | 183 bệnh nhân ARDS do chấn thương | 35 % (BV) |
| Barbier, France 2009 | 43 bệnh nhân HIV có suy hô hấp cấp | 19.7 % (BV) |
| Davies, Australia, New Zealand, 2009 | 68 bệnh nhân cú A (H1N1) kết hợp với ARDS điều trị bằng ECMO | 21 % (BV) |
| Blum, USA, 2004 | 93 bệnh nhân ARDS hậu phẫu | 22 % (28 ngày) |
8. References
1. Richard C. Tissue hypoxia. How to detect, how to correct, how to prevent? Intensive Care Med. 1996;22:1250–1257. doi: 10.1007/BF01709344. [PubMed] [Cross Ref]
2. MacIntyre NR. Supporting oxygenation in acute respiratory failure. Respir Care. 2013;58:142–150. doi: 10.4187/respcare.02087. [PubMed] [Cross Ref]
3. Abdelsalam M, Cheifetz IM. Goal-directed therapy for severely hypoxic patients with acute respiratory distress syndrome: permissive hypoxemia. Respir Care. 2010;55:1483–1490. [PubMed]
4. Vincent JL, De Backer D. Oxygen transport—the oxygen delivery controversy. Intensive Care Med. 2004;30:1990–1996. doi: 10.1007/s00134-004-2384-4. [PubMed] [Cross Ref]
5. Gilbert-Kawai ET, Mitchell K, Martin D, Carlisle J, Grocott MP. Permissive hypoxaemia versus normoxaemia for mechanically ventilated critically ill patients. Cochrane Database Syst Rev. 2014;5:CD009931. [PubMed]
6. Mikkelsen ME, Christie JD, Lanken PN, Biester RC, Thompson BT, Bellamy SL, Localio AR, Demissie E, Hopkins RO, Angus DC. The adult respiratory distress syndrome cognitive outcomes study: long-term neuropsychological function in survivors of acute lung injury. Am J Respir Crit Care Med. 2012;185:1307–1315. doi: 10.1164/rccm.201111-2025OC. [PMC free article] [PubMed] [Cross Ref]
7. Martin DS, Grocott MP. Oxygen therapy in critical illness: precise control of arterial oxygenation and permissive hypoxemia. Crit Care Med. 2013;41:423–432. doi: 10.1097/CCM.0b013e31826a44f6. [PubMed] [Cross Ref]
8. Network TA. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med. 2000;342:1301–1308. doi: 10.1056/NEJM200005043421801. [PubMed] [Cross Ref]
9. Terragni PP, Rosboch G, Tealdi A, Corno E, Menaldo E, Davini O, et al. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2007;175:160–166. doi: 10.1164/rccm.200607-915OC. [PubMed] [Cross Ref]
10. Gattinoni L, Marini JJ, Pesenti A, Quintel M, Mancebo J, Brochard L (2016) The “baby lung” became an adult. Intensive Care Med. doi:10.1007/s00134-015-4200-8 [PubMed]
11. Terragni PP, Filippini C, Slutsky AS, Birocco A, Tenaglia T, Grasso S, Stripoli T, Pasero D, Urbino R, Fanelli V, Faggiano C, Mascia L, Ranieri VM. Accuracy of plateau pressure and stress index to identify injurious ventilation in patients with acute respiratory distress syndrome. Anesthesiology. 2013;119:880–889. doi: 10.1097/ALN.0b013e3182a05bb8. [PubMed] [Cross Ref]
12. Amato MB, Meade MO, Slutsky AS, Brochard L, Costa EL, Schoenfeld DA, Stewart TE, Briel M, Talmor D, Mercat A, Richard JC, Carvalho CR, Brower RG. Driving pressure and survival in the acute respiratory distress syndrome. New Engl J Med. 2015;372:747–755. doi: 10.1056/NEJMsa1410639. [PubMed] [Cross Ref]
13. Ferrando C, Suárez-Sipmann F, Gutierrez A, Tusman G, Carbonell J, García M, Piqueras L, Compañ D, Flores S, Soro M, Llombart A, Belda FJ. Adjusting tidal volume to stress index in an open lung condition optimizes ventilation and prevents overdistension in an experimental model of lung injury and reduced chest wall compliance. Crit Care. 2015;19:R9. doi: 10.1186/s13054- 014-0726-3. [PMC free article] [PubMed] [Cross Ref]
14. Chacko B, Peter JV, Tharyan P, John G, Jeyaseelan L. Pressure-controlled versus volume- controlled ventilation for acute respiratory failure due to acute lung injury (ALI) or acute respiratory distress syndrome (ARDS) Cochrane Database Syst Rev. 2015;14:CD008807. [PubMed]
15. Rittayamai N, Katsios CM, Beloncle F, Friedrich JO, Mancebo J, Brochard L. Pressure- controlled vs volume-controlled ventilation in acute respiratory failure: a physiology-based narrative and systematic review. Chest. 2015;148:340–355. doi: 10.1378/chest.14-3169. [PubMed] [Cross Ref]
16. Facchin F, Fan E. Airway pressure release ventilation and high-frequency oscillatory ventilation: potential strategies to treat severe hypoxemia and prevent ventilator-induced lung injury. Respir Care. 2015;60:1509–1521. doi: 10.4187/respcare.04255. [PubMed] [Cross Ref]
17. Protti A, Andreis DT, Monti M, Santini A, Sparacino CC, Langer T, Votta E, Gatti S, Lombardi L, Leopardi O, Masson S, Cressoni M, Gattinoni L. Lung stress and strain during mechanical ventilation: any difference between statics and dynamics? Crit Care Med. 2013;41:1046–1055. doi: 10.1097/CCM.0b013e31827417a6. [PubMed] [Cross Ref]
18. Tschumperlin DJ, Oswari J, Margulies AS. Deformation-induced injury of alveolar epithelial cells: effect of frequency, duration, and amplitude. Am J Respir Crit Care Med. 2000;162:357– 362. doi: 10.1164/ajrccm.162.2.9807003. [PubMed] [Cross Ref]
19. Conrad SA, Zhang S, Arnold TC, Scott LK, Carden DL. Protective effects of low respiratory frequency in experimental ventilator-associated lung injury. Crit Care Med. 2005;33:835–840. doi: 10.1097/01.CCM.0000159532.56865.8A. [PubMed] [Cross Ref]
20. Baumgardner JE, Markstaller K, Pfeiffer B, Doebrich M, Otto CM. Effects of respiratory rate, plateau pressure, and positive end-expiratory pressure on PaO2 oscillations after saline lavage. Am J Respir Crit Care Med. 2002;166:1556–1562. doi: 10.1164/rccm.200207-717OC. [PubMed] [Cross Ref]
21. Neumann P, Berglund JE, Mondejar EF, Magnusson A, Hedenstierna G. Effect of different pressure levels on the dynamics of lung collapse and recruitment in oleic-acid-induced lung injury. Am J Respir Crit Care Med. 1998;158:1636–1643. doi: 10.1164/ajrccm.158.5.9711095. [PubMed] [Cross Ref]
22. Mercat A, Titiriga M, Anguel N, Richard C, Teboul JL. Inverse ratio ventilation (I/E = 2/1) in acute respiratory distress syndrome: a six-hour controlled study. Am J Respir Crit Care Med. 2001;155:1637–1642. doi: 10.1164/ajrccm.155.5.9154869. [PubMed] [Cross Ref]
23. Boehme S, Bentley AH, Hartmann EK, Chang S, Erdoes G, Prinzing A, Hagmann M, Baumgardner JE, Ullrich R, Markstaller K, David M. Influence of inspiration to expiration ratio on cyclic recruitment and derecruitment of atelectasis in a saline lavage model of acute respiratory distress syndrome. Crit Care Med. 2015;43:e65–e74. doi: 10.1097/CCM.0000000000000788. [PubMed] [Cross Ref]
24. Lee SM, Kim WH, Ahn HJ, Kim JA, Yang MK, Lee CH, Lee JH, Kim YR, Choi JW. The effects of prolonged inspiratory time during one-lung ventilation: a randomized controlled trial. Anaesthesia. 2013;68:908–916. doi: 10.1111/anae.12318. [PubMed] [Cross Ref]
25. Casetti AV, Bartlett RH, Hirschl RB. Increasing inspiratory time exacerbates ventilator- induced lung injury during high-pressure/high-volume mechanical ventilation. Crit Care Med. 2002;30:2295–2299. doi: 10.1097/00003246-200210000-00018. [PubMed] [Cross Ref]
26. American Association for Respiratory Care. Restrepo RD, Walsh BK. Humidification during invasive and noninvasive mechanical ventilation. Respir Care. 2012;57:782–788. doi: 10.4187/respcare.01766. [PubMed] [Cross Ref]
27. Prat G, Renault A, Tonnelier JM, Goetghebeur D, Oger E, Boles JM, L’Her E. Influence of the humidification device during acute respiratory distress syndrome. Intensive Care Med. 2003;29:2211–2215. doi: 10.1007/s00134-003-1926-5. [PubMed] [Cross Ref]
28. Prin S, Chergui K, Augarde R, Page B, Jardin F, Vieillard-Baron A. Ability and safety of a heated humidifier to control hypercapnic acidosis in severe ARDS. Intensive Care Med. 2002;28:1756–1760. doi: 10.1007/s00134-002-1520-2. [PubMed] [Cross Ref]
29. Morán I, Bellapart J, Vari A, Mancebo J. Heat and moisture exchangers and heated humidifiers in acute lung injury/acute respiratory distress syndrome patients. Effects on respiratory mechanics and gas exchange. Intensive Care Med. 2006;32:524–531. doi: 10.1007/s00134-006-0073-1. [PubMed] [Cross Ref]
30. Petty TL, Ashbaugh DG. The adult respiratory distress syndrome. Clinical features, factors influencing prognosis and principles of management. Chest. 1971;60:233–239. doi: 10.1378/chest.60.3.233. [PubMed] [Cross Ref]
31. Tremblay LN, Slutsky AS. Ventilator-induced lung injury: from the bench to the bedside. Intensive Care Med. 2006;32:24–33. doi: 10.1007/s00134-005-2817-8. [PubMed] [Cross Ref]
32. Meade MO, Cook DJ, Guyatt GH, Slutsky AS, Arabi YM, Cooper DJ, Davies AR, LE Hand, Zhou Q, Thabane L, Austin P, Lapinsky S, Baxter A, Russell J, Skrobik Y, Ronco JJ, Stewart TE, Lung Open Ventilation Study Investigators Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2008;299:637–645. doi: 10.1001/jama.299.6.637. [PubMed] [Cross Ref]
33. Mercat A, Richard JC, Vielle B, Jaber S, Osman D, Diehl JL, et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2008;299:646–655. doi: 10.1001/jama.299.6.646. [PubMed] [Cross Ref]
34. Brower RG, Lanken PN, MacIntyre N, Matthay MA, Morris A, Ancukiewicz M, Schoenfeld D, Thompson BT, National Heart Lung, and Blood Institute ARDS Clinical Trials Network Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome. N Engl J Med. 2004;351:327–336. doi: 10.1056/NEJMoa032193. [PubMed] [Cross Ref]
35. Suzumura EA, Figueiró M, Normilio-Silva K, Laranjeira L, Oliveira C, Buehler AM, Bugano D, Passos Amato MB, Ribeiro Carvalho CR, Berwanger O, Cavalcanti AB. Effects of alveolar recruitment maneuvers on clinical outcomes in patients with acute respiratory distress syndrome: a systematic review and gộp-analysis. Intensive Care Med. 2014;40:1227–1240. doi: 10.1007/s00134-014-3413-6. [PubMed] [Cross Ref]
36. Cinnella G, Grasso S, Raimondo P, D’Antini D, Mirabella L, Dambrosio RM. Physiological effects of the open lung approach in patients with early, mild, diffuse acute respiratory distress syndrome: an electrical impedance tomography study. Anesthesiology. 2015;123:1113–1121. doi: 10.1097/ALN.0000000000000862. [PubMed] [Cross Ref]
37. Briel M, Meade M, Mercat A, Brower RG, Talmor D, Walter SD, et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and gộp-analysis. JAMA. 2010;303:865–873. doi: 10.1001/jama.2010.218. [PubMed] [Cross Ref]
38. Kacmarek RM, Villar J. Management of refractory hypoxemia in ARDS. Minerva Anestesiol. 2013;79:1173–1179. [PubMed]
39. Papazian L, Forel JM, Gacouin A, Penot-Ragon C, Perrin G, Loundou A, Jaber S, Arnal JM, Perez D, Seghboyan JM, Constantin JM, Courant P, Lefrant JY, Guérin C, Prat G, Morange S, Roch A, ACURASYS Study Investigators Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med. 2010;363:1107–1116. doi: 10.1056/NEJMoa1005372. [PubMed] [Cross Ref]
40. Grasso S, Terragni P, Birocco A, Urbino R, Del Sorbo L, Mascia FCL, Pesenti A, Zangrillo A, Gattinoni L, Ranieri VM. ECMO criteria for influenza A (H1N1)-associated ARDS: role of transpulmonary pressure. Intensive Care Med. 2012;38:395–403. doi: 10.1007/s00134-012- 2490-7. [PubMed] [Cross Ref]
41. de Matos GF, Stanzani F, Passos RH, Fontana MF, Albaladejo R, Caserta RE, Santos DC, Borges JB, Amato MB, Barbas CS. How large is the lung recruitability in early acute respiratory distress syndrome: a prospective case series of patients monitored by computed tomography. Crit Care. 2012;16:R4. doi: 10.1186/cc10602. [PMC free article] [PubMed] [Cross Ref]
42. Gattinoni L, Caironi P, Cressoni M, Chiumello D, Ranieri VM, Russo QMS, Patroniti N, Cornejo R, Bugedo G. Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med. 2006;354:1775–1786. doi: 10.1056/NEJMoa052052. [PubMed] [Cross Ref]
43. Constantin JM, Grasso S, Chanques G, Aufort S, Futier E, Sebbane M, Jung B, Gallix B, Bazin JE, Rouby JJ, Jaber S. Lung morphology predicts response to recruitment maneuver in patients with acute respiratory distress syndrome. Crit Care Med. 2010;38:1108–1117. doi: 10.1097/CCM.0b013e3181d451ec. [PubMed] [Cross Ref]
44. Rehberg S, Ertmer C, Westphal M. Mechanical ventilation in patients with ARDS: is the lung’s fortune the right ventricle’s poison? Intensive Care Med. 2009;35:1825–1826. doi: 10.1007/s00134-009-1571-8. [PubMed] [Cross Ref]
45. Mure M, Martling CR, Lindahl SG. Dramatic effect on oxygenation in patients with severe acute lung insufficiency treated in the prone position. Crit Care Med. 1997;25:1539–1544. doi: 10.1097/00003246-199709000-00022. [PubMed] [Cross Ref]
46. Sud S, Friedrich JO, Taccone P, Polli F, Adhikari NK, Latini R, Pesenti A, Guerin C, Mancebo J, Curley MA, Fernandez R, Chan MC, Beuret P, Voggenreiter G, Sud M, Tognoni G, Gattinoni L. Prone ventilation reduces mortality in patients with acute respiratory failure and severe hypoxemia: systematic review and gộp-analysis. Intensive Care Med. 2010;36:585–599. doi: 10.1007/s00134-009-1748-1. [PubMed] [Cross Ref]
47. Gattinoni L, Carlesso E, Taccone P, Polli F, Guerin C, Mancebo J. Prone positioning improves survival in severe ARDS: a pathophysiologic review and individual patient gộp- analysis. Minerva Anestesiol. 2010;76:448–454. [PubMed]
48. Guérin C, Reignier J, Richard JC, Beuret P, Gacouin A, Boulain T, Mercier E, Badet M, Mercat A, Baudin O, Clavel M, Chatellier D, Jaber S, Rosselli S, Mancebo J, Sirodot M, Hilbert G, Bengler C, Richecoeur J, Gainnier M, Bayle F, Bourdin G, Leray V, Girard R, Baboi L, Ayzac L, PROSEVA Study Group Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368:2159–2168. doi: 10.1056/NEJMoa1214103. [PubMed] [Cross Ref]
49. Albert RK, Keniston A, Baboi L, Ayzac L, Guerin C, Proseva I. Prone position-induced improvement in gas exchange does not predict improved survival in the acute respiratory distress syndrome. Am J Respir Crit Care Med. 2014;189:494–496. doi: 10.1164/rccm.201311-2056LE. [PubMed] [Cross Ref]
50. Cornejo RA, Diaz JC, Tobar EA, Bruhn AR, Ramos CA, Gonzalez RA, Repetto CA, Romero CM, Galvez LR, Llanos O, Arellano DH, Neira WR, Diaz GA, Zamorano AJ, Pereira GL. Effects of prone positioning on lung protection in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2013;188:440–448. doi: 10.1164/rccm.201207-1279OC. [PubMed] [Cross Ref]
51. Guerin C, Baboi L, Richard JC. Mechanisms of the effects of prone positioning in acute respiratory distress syndrome. Intensive Care Med. 2014;40:1634–1642. doi: 10.1007/s00134- 014-3500-8. [PubMed] [Cross Ref]
52. Mentzelopoulos SD, Roussos C, Zakynthinos SG. Prone position reduces lung stress and strain in severe acute respiratory distress syndrome. Eur Respir J. 2005;25:534–544. doi: 10.1183/09031936.05.00105804. [PubMed] [Cross Ref]
53. Villar J, Pérez-Méndez L, Blanco J, Añón JM, Blanch L, Belda J, Santos-Bouza A, Fernández RL, Kacmarek RM, Spanish Initiative for Epidemiology, Stratification, and Therapies for ARDS (SIESTA) Network A universal definition of ARDS: the PaO2/FiO2 ratio under a standard ventilatory setting—a prospective, multicenter validation study. Intensive Care Med. 2013;39:583–592. doi: 10.1007/s00134-012-2803-x. [PubMed] [Cross Ref]
54. Guérin C, Gaillard S, Lemasson S, Ayzac L, Girard R, Beuret P, Palmier B, Le QV, Sirodot M, Rosselli S, Cadiergue V, Sainty JM, Barbe P, Combourieu E, Debatty D, Rouffineau J, Ezingeard E, Millet O, Guelon D, Rodriguez L, Martin O, Renault A, Sibille JP, Kaidomar M. Effects of systematic prone positioning in hypoxemic acute respiratory failure: a randomized controlled trial. JAMA. 2004;292:2379–2387. doi: 10.1001/jama.292.19.2379. [PubMed] [Cross Ref]
55. Gattinoni L, Tognoni G, Pesenti A, Taccone P, Mascheroni D, Labarta V, Malacrida R, Di Giulio P, Fumagalli R, Pelosi P, Brazzi L, Latini R. Effect of prone positioning on the survival of patients with acute respiratory failure. N Engl J Med. 2001;345:568–573. doi: 10.1056/NEJMoa010043. [PubMed] [Cross Ref]
56. Mancebo J, Fernandez R, Blanch L, Rialp G, Gordo F, Ferrer M, Rodriguez F, Garro P, Ricart P, Vallverdu I, Gich I, Castano J, Saura P, Dominguez G, Bonet A, Albert RK. A multicenter trial of prolonged prone ventilation in severe acute respiratory distress syndrome. Am J Respir Crit Care Med. 2006;173:1233–1239. doi: 10.1164/rccm.200503-353OC. [PubMed] [Cross Ref]
57. Taccone P, Pesenti A, Latini R, Polli F, Vagginelli F, Mietto C, Caspani L, Raimondi F, Bordone G, Iapichino G, Mancebo J, Guerin C, Ayzac L, Blanch L, Fumagalli R, Tognoni G, Gattinoni L. Prone positioning in patients with moderate and severe acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2009;302:1977–1984. doi: 10.1001/jama.2009.1614. [PubMed] [Cross Ref]
58. Sud S, Friedrich JO, Adhikari NK, Taccone P, Mancebo J, Polli F, Latini R, Pesenti A, Curley MA, Fernandez R, Chan MC, Beuret P, Voggenreiter G, Sud M, Tognoni G, Gattinoni L, Guerin C. Effect of prone positioning during mechanical ventilation on mortality among patients with acute respiratory distress syndrome: a systematic review and gộp-analysis. CMAJ. 2014;186:E381–E390. doi: 10.1503/cmaj.140081. [PMC free article] [PubMed] [Cross Ref]
59. Bloomfield R, Noble DW, Sudlow A. Prone position for acute respiratory failure in adults. Cochrane Database Syst Rev. 2015;11:CD008095. [PubMed]
60. Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, Sevransky JE, Sprung CL, Douglas IS, Jaeschke R, Osborn TM, Nunnally ME, Townsend SR, Reinhart K, Kleinpell RM, Angus DC, Deutschman CS, Machado FR, Rubenfeld GD, Webb S, Beale RJ, Vincent JL, Moreno R, Surviving Sepsis Campaign Guidelines Committee including The Pediatric Subgroup. Surviving Sepsis Campaign International guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med. 2013;39:165–228. doi: 10.1007/s00134-012-2769-8. [PubMed] [Cross Ref]
61. Liesenfeld O, Lehman L, Hunfeld K-P, Kost K. Molecular diagnosis of sepsis: new aspects and recent developments. Eur J Microbiol Immun. 2014;4:1–25. doi: 10.1556/EuJMI.4.2014.1.1. [PMC free article] [PubMed] [Cross Ref]
62. Douglas IS (2016) New diagnostic methods for pneumonia in the ICU. Curr Opin Infect Dis 29:197–204 [PubMed]
63. Flanagan PG, Findlay GP, Magee JT, Ionescu A, Barnes RA, Smithies M. The diagnosis of ventilator-associated pneumonia using non-bronchoscopic, non-directed lung lavages. Intensive Care Med. 2000;26:20–30. doi: 10.1007/s001340050007. [PubMed] [Cross Ref]
64. Vélez Lázaro, Correa Luz Teresita, Maya Maria Angélica, Mejía Patricia, Ortega Jorge, Bedoya Victoria, Ortega Héctor. Diagnostic accuracy of bronchoalveolar lavage samples in immunosuppressed patients with suspected pneumonia: analysis of a protocol. Respir Med. 2007;101:2160–2167. doi: 10.1016/j.rmed.2007.05.017. [PubMed] [Cross Ref]
65. Jain S, Benoit SR, Skarbinski J, Bramley AM, Finelli L, Pandemic Influenza A (H1N1) Virus Hospitalizations Investigation Team Influenza-associated pneumonia among hospitalized patients with 2009 pandemic influenza A (H1N1) virus–United States, 2009. Clin Infect Dis. 2012;54:1221–1229. doi: 10.1093/cid/cis197. [PubMed] [Cross Ref]
66. Guérin C, Thompson T, Brower R. The ten diseases that look like ARDS. Intensive Care Med. 2015;41:1099–1102. doi: 10.1007/s00134-014-3608-x. [PubMed] [Cross Ref]
67. Gibelin A, Parrot A, Maitre B, Brun-Buisson C, Mekontso Dessap A, Fartoukh M, de Prost
N. Acute respiratory distress syndrome mimickers lacking common risk factors of the Berlin definition. Intensive Care Med. 2016;42:164–172. doi: 10.1007/s00134-015-4064-y. [PubMed] [Cross Ref]
68. Poletti V, Ravaglia C, Gurioli C, et al. Invasive diagnostic techniques in idiopathic interstitial pneumonias. Respirology. 2016;21:44–50. doi: 10.1111/resp.12694. [PubMed] [Cross Ref]
69. Martin-Loeches I, Deja M, Koulenti D, Dimopoulos G, Marsh B, Torres A, Niederman MS, Rello J, EU-VAP Study Investigators Potentially resistant microorganisms in intubated patients with hospital-acquired pneumonia: the interaction of ecology, shock and risk factors. Intensive Care Med. 2013;39:672–681. doi: 10.1007/s00134-012-2808-5. [PubMed] [Cross Ref]
70. Palakshappa JA, Meyer NJ. Which patients with ARDS benefit from lung biopsy? Chest. 2015;148:1073–1082. doi: 10.1378/chest.15-0076. [PubMed] [Cross Ref]
71. Taccone FS, den Abeele Van, et al. Epidemiology of invasive aspergillosis in critically ill patients: clinical presentation, underlying condition, and outcome. Crit Care. 2015;19:7. doi: 10.1186/s13054-014-0722-7. [PMC free article] [PubMed] [Cross Ref]
72. Eigl S, Prattes J, Lackner M, et al. Multicenter evaluation of a lateral-flow device test diagnosing invasive pulmonary aspergillosis in ICU patients. Crit Care. 2015;19:178. doi: 10.1186/s13054-015-0905-x. [PMC free article] [PubMed] [Cross Ref]
73. Deja M, Spies C. Prevention measures of ventilator-associated pneumonia. Crit Care Med. 2009;37:330–332. doi: 10.1097/CCM.0b013e3181932483. [PubMed] [Cross Ref]
74. Alhazzani W, Alshahrani M, Jaeschke R, Forel JM, Papazian L, Sevransky J, Meade MO. Neuromuscular blocking agents in acute respiratory distress syndrome: a systematic review and gộp-analysis of randomized controlled trials. Crit Care. 2013;17:R43. doi: 10.1186/cc12557. [PMC free article] [PubMed] [Cross Ref]
75. Forel JM, Roch A, Marin V, Michelet P, Demory D, Blache JL, Perrin G, Gainnier M, Bongrand P, Papazian L. Neuromuscular blocking agents decrease inflammatory response in patients presenting with acute respiratory distress syndrome. Crit Care Med. 2006;34:2749– 2757. doi: 10.1097/01.CCM.0000239435.87433.0D. [PubMed] [Cross Ref]
76. Lonardo NW, Mone MC, Nirula R, Kimball EJ, Ludwig K, Zhou X, Sauer BC, Nechodom K, Teng C, Barton RG. Propofol is associated with favorable outcomes compared with benzodiazepines in ventilated intensive care unit patients. Am J Resp Crit Care Med. 2014;189(11):1383–1394. doi: 10.1164/rccm.201312-2291OC. [PubMed] [Cross Ref]
77. Barr J, Fraser GL, Puntillo K, Ely EW, Gelinas C, Dasta JF, Davidson JE, Devlin JW, Kress JP, Joffe AM, Coursin DB, Herr DL, Tung A, Robinson BRH, Fontaine DK, Ramsay MA, Riker RR, Sessler CN, Pun B, Skrobik Y, Jaeschke R. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med. 2013;41:263–306. doi: 10.1097/CCM.0b013e3182783b72. [PubMed] [Cross Ref]
78. Mehta S, Burry L, Cook D, Fergusson D, Steinberg M, Granton J, Herridge M, Ferguson N, Devlin J, Tanios M, Dodek P, Fowler R, Burns K, Jacka M, Olafson K, Skrobik Y, Hebert P, Sabri E, Meade M, For the SLEAP Investigators and the Canadian Critical Care Trials Group Daily sedation interruption in mechanically ventilated critically ill patients cared for with a sedation protocol: a randomized controlled trial. JAMA. 2012;308(19):1985–1992. doi: 10.1001/jama.2012.13872. [PubMed] [Cross Ref]
79. Burry L, Rose L, McCullagh IJ, Fergusson DA, Ferguson ND, Mehta S. Daily sedation interruption versus no daily sedation interruption for critically ill adult patients requiring invasive mechanical ventilation. Cochrane Database Syst Rev. 2014;9:CD009176. [PubMed]
80. Afshari A, Brok J, Moller AM, Etterslev J. Inhaled nitric oxide for acute respiratory distress syndrome (ARDS) and acute lung injury in children and adults. Cochrane Database Syst Rev. 2010;7:002787. [PubMed]
81. Adhikari NKJ, Dellinger RP, Lundin S, Payen D, Vallet B, Gerlach H, Park KJ, Mehta S, Slutsky AS, Friedrich JO. Inhaled nitric oxide does not reduce mortality in patients with acute respiratory distress syndrome regardless of severity: systematic review and gộp-analysis. Crit Care Med. 2014;42:404–412. doi: 10.1097/CCM.0b013e3182a27909. [PubMed] [Cross Ref]
82. Torbic H, Szumita PM, Anger KE, Nuccio P, LaGambina S, Weinhouse G. Inhaled epoprostenol vs inhaled nitric oxide for refractory hypoxemia in critically ill patients. J Crit Care. 2013;28:844–848. doi: 10.1016/j.jcrc.2013.03.006. [PubMed] [Cross Ref]
83. The National Heart Lung and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network Comparison of two fluid-management strategies in acute lung injury. N Engl J Med. 2006;354:2564–2575. doi: 10.1056/NEJMoa062200. [PubMed] [Cross Ref]
84. Kuzolev A, Tishkov E, Bukaev O. Effect of continuous high-volume hemofiltration on patients with acute respiratory distress syndrome. Crit Care. 2013;17(Suppl 2):P431. doi: 10.1186/cc12369. [Cross Ref]
85. Zhang JC, Chu YF, Zeng J, Ren HS, Meng M, Jiang JJ, Wang CT. Effect of continuous high- volume hemofiltration in patients with severe acute respiratory distress syndrome. Chin Crit Care Med. 2013;25(3):145–148. [PubMed]
86. Krag M, Perner A, Wetterslev J, Wise MP, Hylander Møller M. Stress ulcer prophylaxis versus placebo or no prophylaxis in critically ill patients. A systematic review of randomised clinical trials with gộp-analysis and trial sequential analysis. Intensive Care Med. 2014;40:11– 22. doi: 10.1007/s00134-013-3125-3. [PubMed] [Cross Ref]
87. Bein T, Briegel J, Annane D (2016) Steroids are part of rescue therapy in ARDS patients with refractory hypoxemia: yes. Intensive Care Med. doi:10.1007/s00134-015-4162-x [PubMed]
88. Richard C, Argaud L, Blet A, Boulain T, Contentin L, Dechartres A, Dejode JM, Donetti L, Fartoukh M, Fletcher D, Kuteifan K, Lasocki S, Liet JM, Lukaszewicz AC, Mal H, Maury E, Osman D, Outin H, Richard JC, Schneider F, Tamion F. Extracorporeal life support for patients with acute respiratory distress syndrome: report of a consensus conference. Ann Intensive Care. 2014;24(4):15. doi: 10.1186/2110-5820-4-15. [PMC free article] [PubMed] [Cross Ref]
89. Bein T, Bischoff M, Brückner U, Gebhardt K, Henzler D, Hermes C, Lewandowski K, Max M, Nothacker M, Staudinger T, Tryba M, Weber-Carstens S, Wrigge H. S2e guideline: positioning and early mobilisation in prophylaxis or therapy of pulmonary disorders: revision 2015: S2e guideline of the German Society of Anaesthesiology and Intensive Care Medicine (DGAI) Anaesthesist. 2015;64(Suppl 1):1–26. doi: 10.1007/s00101-015-0071-1. [PMC free article] [PubMed] [Cross Ref]
90. Combes A, Ranieri M. Rescue therapy for refractory ARDS should be offered early: yes. Intensive Care Med. 2015;41:923–925. doi: 10.1007/s00134-015-3721-5. [PubMed] [Cross Ref]
91. Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF, Ranieri M, Rubenfeld G, Thompson BT, Wrigge H, Slutsky AS, Pesenti A, LUNG SAFE Investigators. The ESICM Trials Group Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:788–800. doi: 10.1001/jama.2016.0291. [PubMed] [Cross Ref]