Bài viết Hỗ trợ lọc máu ngoài cơ thể và hỗ trợ cơ quan ở bệnh nhân mắc bệnh nặng trong đại dịch COVID- 19: Đánh giá và khuyến nghị của chuyên gia được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Extracorporeal Blood Purification and Organ Support in the Critically Ill Patient during COVID-19 Pandemic: Expert Review and Recommendation
Tóm tắt
Các bệnh nhân COVID-19 bị bệnh nặng thường được nhận vào ICU vì suy hô hấp, có thể tiến triển thành hội chứng rối loạn chức năng đa cơ quan cần hỗ trợ cơ quan ngoài cơ thể. Những tiến bộ liên tục trong công nghệ và khoa học, và tiến bộ trong công nghệ thông tin hỗ trợ phát triển các nền tảng hỗ trợ đa cơ quan tích hợp để điều trị cá nhân theo nhu cầu thay đổi của bệnh nhân. Dựa trên sự thay đổi sinh lý bệnh được quan sát thấy ở bệnh nhân COVID-19, cơ sở lý luận xuất hiện cho các liệu pháp điều trị ngoài cơ thể tuần tự được thiết kế để loại bỏ các chất trung gian gây viêm và hỗ trợ các hệ thống cơ quan khác nhau. Trong trường hợp không có vắc-xin hoặc trị liệu trực tiếp cho COVID-19, các liệu pháp ngoài cơ thể có thể là một lựa chọn để ngăn ngừa suy cơ quan và cải thiện khả năng sống sót. Nhu cầu lớn trong việc chăm sóc bệnh nhân COVID-19 đòi hỏi sự đáp ứng ngay lập tức từ cộng đồng khoa học. Do đó, các chuyên gia sẽ đưa ra đánh giá chi tiết về công nghệ hiện có, sau đó là một loạt khuyến nghị dựa trên kinh nghiệm và ý kiến hiện tại, trong khi chờ đợi tạo ra bằng chứng mạnh mẽ từ các thử nghiệm.
Đại dịch COVID-19
Tổ chức Y tế Thế giới tuyên bố COVID-19 là một đại dịch. Mặc dù đại đa số bệnh nhân dương tính với COVID bị nhẹ hoặc không có triệu chứng, một phần trong số họ phải nhập viện hoặc thậm chí nhập viện chăm sóc đặc biệt (ICU, intensive care units). Những bệnh nhân này có thể bị tổn thương thận cấp tính (AKI, acute kidney injury) và suy đa cơ quan (MOF, multiple organ failure) và có thể cần hỗ trợ cơ quan ngoài cơ thể (ECOS, extracorporeal organ support) [1]. Sự thương tổn của thận đối với bệnh nhân COVID-19 có thể đi trước, theo sau hoặc đồng thời với suy hệ thống cơ quan khác và tình huống này có thể yêu cầu nhân viên có đủ năng lực và được đào tạo để thực hiện tất cả các phương án điều trị có thể cho những bệnh nhân bị bệnh nặng.
Sự phát triển của các liệu pháp thay thế thận liên tục (CRRT, continuous renal replacement thera- pies) từ mô tả ban đầu sang công nghệ hiện tại [2-6,8] đã cho phép sử dụng các liệu pháp ngoài cơ thể trên toàn thế giới ở những bệnh nhân bị bệnh nặng (Hình 1). Trong chăm sóc đặc biệt, AKI nặng xảy ra hầu hết trong bối cảnh của MOF. Thuật ngữ liệu pháp hỗ trợ đa cơ quan (MOST, multiple organ support therapy), hiện được gọi là “Hỗ trợ cơ quan ngoài cơ thể” (ECOS), bao gồm tất cả các hình thức hỗ trợ cơ quan bằng mạch ngoài cơ thể (ví dụ: liệu pháp thay thế thận [RRTs, renal replacement therapies], loại bỏ CO2 ngoài cơ thể [ECCO2R, extracorporeal CO2 removal], oxy hóa màng ngoài cơ thể [ECMO, extracorporeal membrane oxygenation] tĩnh mạch – động mạch hoặc tĩnh mạch – tĩnh mạch, hệ thống hỗ trợ gan, lọc máu và các thiết bị lọc máu khác nhau) [9].
![Hình 1. Tổng quan đầy đủ về 40 năm phát triển của công nghệ trị liệu ngoài cơ thể ở bệnh nhân nặng (sửa đổi từ Tham khảo [3]).](https://www.healcentral.org/wp-content/uploads/2020/08/ho_tro_loc_mau_ngoai_co_the_va_ho_tro_co_quan_o_benh_nhan_mac_benh_nang_trong_dai_dich_covid_19_1-300x170.jpg)
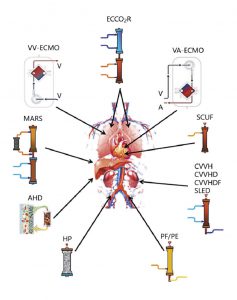
”ECOS, hỗ trợ cơ quan ngoài cơ thể; CVVH, lọc máu tĩnh mạch – tĩnh mạch liên tục; CVVHD, thẩm tách máu tĩnh mạch – tĩnh mạch liên tục; CVVHDF, lọc – thẩm tách máu tĩnh mạch – tĩnh mạch liên tục; CRRT, liệu pháp thay thế thận liên tục; SLED, lọc máu chậm kéo dài; SCUF, siêu lọc chậm liên tục; CPFA, hấp phụ lọc huyết tương kết hợp; ECCO2R, loại bỏ CO2 ngoài cơ thể; VA- ECMO, oxy hóa màng ngoài cơ thể tĩnh mạch – động mạch; VV-ECMO, oxy hóa màng ngoài cơ thể tĩnh mạch – tĩnh mạch; AHD, thẩm phân hấp phụ; HP, lọc máu; PF, lọc huyết tương; PE, trao đổi huyết tương.”
Những tiến bộ đáng kể trong công nghệ và khoa học dẫn đến sự phát triển của vật liệu sinh học, thiết kế màng và kỹ thuật chống đông máu mới [10], cho phép tối ưu hóa liều lượng và phương thức điều trị [11, 12]. Vai trò có thể của các kỹ thuật ngoài cơ thể trong việc khôi phục một phản ứng miễn dịch cân bằng bằng cách loại bỏ/vô hiệu hóa các chất trung gian gây viêm đã được khám phá [13]. Các chiến lược bao gồm lọc máu liều cao (HVHF, high-volume hemofiltration), lọc máu hấp phụ (hemoperfusion), trao đổi huyết tương (plasma exchange), hấp phụ lọc huyết tương kết hợp (CPFA, coupled plasma filtration adsorption), và sử dụng màng có độ phân giải cao (HCO, high cut-off) và màng có đặc tính hấp phụ tăng cường (enhanced adsorption). Song song đó, các dạng ECOS khác cũng được phát triển, bao gồm ECCO2R, ECMO, thiết bị hỗ trợ tâm thất và hệ thống hỗ trợ gan ngoài cơ thể [9] (Hình 1). Dần dần, tình trạng của RRT đã được nâng lên từ hỗ trợ thận đơn giản thành một nền tảng tạo điều kiện hỗ trợ nhiều cơ quan cá nhân (Hình 2).
Cơ sở lý luận của ECOS ở bệnh nhân COVID-19
Bệnh nhân COVID-19 nhập viện ICU có một loạt các triệu chứng và rối loạn chức năng cơ quan ở các mức độ nghiêm trọng khác nhau. Trong khi đa số bị viêm phổi kèm theo suy đơn tạng, những người khác bị suy giảm hệ thống miễn dịch đáng kể, tạo ra cơn bão cytokine và tổn thương cơ quan do tổn thương tế bào. Hơn nữa, các rối loạn đông máu nặng đôi khi bắt chước đông máu lan tỏa trong lòng mạch. Các phương thức liên tục và ngắt quãng không phải là cách tiếp cận “tất cả hoặc không” đối với việc cung cấp RRT [12]. Thay vào đó, một phương thức được chọn của RRT đòi hỏi ứng dụng chu đáo để đưa ra liệu pháp phù hợp cho đúng bệnh nhân vào đúng thời điểm. Điều quan trọng là phải nhận ra rằng bệnh nhân có thể cần phải chuyển đổi giữa các phương thức. Đã có nhiều tranh luận về sự thiếu khác biệt rõ ràng về hiệu lực và hiệu quả của các phương thức liên tục và ngắt quãng trong các thử nghiệm lâm sàng, và không có bằng chứng cụ thể nào được cung cấp cho bệnh nhân COVID-19. Tuy nhiên, sự tin tưởng vào các suy luận từ những dữ liệu này cho việc chăm sóc bệnh nhân bị hạn chế do những thách thức trong thiết kế thử nghiệm (ví dụ, đánh giá quá cao hiệu quả điều trị), hiệu suất thử nghiệm (ví dụ, chất lượng RRT được áp dụng qua các thử nghiệm), thiên vị lựa chọn của bệnh nhân tham gia (ví dụ, thiếu trang bị để thu nhận bệnh nhân rất nặng), và các thành kiến không liên quan đến bệnh nhân hướng dẫn thực hành (tức là dịch vụ và chi phí lâm sàng). Do đó, các hình thức trị liệu ngắt quãng và liên tục khác nhau nên được coi là bổ sung cho nhau, nhận ra rằng không có phương thức nào có thể cho thấy bằng chứng rõ ràng về lợi thế sống sót trên tất cả các bệnh nhân [7,14,15]. Ngoài ra, tất cả các phương thức RRT đều có tác dụng phụ quan trọng. Chúng không được chọn lọc, dẫn đến việc mất không nhận biết các chất điện giải, chất dinh dưỡng và thuốc, bao gồm cả thuốc kháng sinh. Nếu có sẵn, việc theo dõi nồng độ thuốc điều trị nên được xem xét. Các tác dụng ngoại ý khác bao gồm các biến chứng liên quan đến đặt đường cannula và tác dụng phụ do kháng đông. Cuối cùng, RRT không cung cấp bất kỳ chức năng nội tiết và chuyển hóa nào của thận. Bất chấp những cân nhắc ở trên, có những trường hợp lâm sàng cụ thể mà một phương thức RRT cụ thể sẽ được ưu tiên hơn [7,16]. Ở những bệnh nhân COVID- 19 có huyết động không ổn định rõ rệt và/hoặc quá tải dịch kháng trị, quá trình siêu lọc tích cực ngoài cơ thể có thể thúc đẩy hoặc làm trầm trọng thêm tình trạng hạ huyết áp hoặc giảm cung lượng tim hoặc cả hai, và làm chậm quá trình hồi phục. Sự thay đổi nhanh chóng về độ thẩm thấu của máu có thể dẫn đến các biến chứng nguy hiểm gây ra do điều trị [17]. Trong những trường hợp này, có một cơ sở sinh lý mạnh mẽ để hỗ trợ ban đầu với CRRT để cung cấp khả năng dung nạp huyết động cao hơn, tính nhất quán trong siêu lọc, và ít dao động về chuyển hóa và thẩm thấu hơn [7,16]. Điều này mở rộng cho những bệnh nhân được hỗ trợ bởi ECOS đồng thời (tức là VV-ECMO đối với suy hô hấp nặng), nơi liệu pháp ban đầu với CRRT được dung nạp tốt hơn [16,18]. Ngoài ra, các dạng RRT gián đoạn thông thường và kéo dài (prolonged and conventional intermittent) có vai trò bổ sung quan trọng trong việc hỗ trợ những bệnh nhân bị bệnh nặng do nhiễm COVID-19. Những bệnh nhân này có thể thường xuyên phải vận động và nằm sấp để cải thiện trao đổi khí ở phổi, và trong những trường hợp này, phương pháp điều trị 8–12 giờ có thể thể hiện sự dung hòa tốt giữa phương thức liên tục và ngắt quãng. Tương tự, trong số những bệnh nhân đang hồi phục sau cơn bệnh nặng, việc chuyển đổi từ CRRT sang RRT ngắt quãng kéo dài có thể có lợi, mặc dù không có dữ liệu về khả năng sống sót, phục hồi thận, hoặc sự phụ thuộc vào lọc máu lâu dài [19-23]. Bệnh nhân COVID-19 có xu hướng phát triển trạng thái viêm nặng và có thể là hội chứng giải phóng cytokine có thể ảnh hưởng đến chức năng thận ở cuối dòng trong thời gian của hội chứng. Mặc dù thời gian tối ưu để bắt đầu RRT vẫn chưa chắc chắn, việc quan sát các đợt thiểu niệu thường xuyên và tình trạng thừa dịch nguy hiểm trong thời gian nằm ICU cho thấy nên áp dụng sớm, đặc biệt trong trường hợp không thể duy trì cân bằng dịch đầy đủ. Đôi khi RRT và ECMO được chạy đồng thời và do đó, cần nỗ lực trong tương lai để hợp nhất các liệu pháp này thành một nền tảng thống nhất [24] nhằm giảm thể tích công việc của y tá và rủi ro sai sót do khả năng tương thích kém hoặc tích hợp các hệ thống khác nhau.
Sự biến thể của ECOS liên quan đến yêu cầu COVID-19
Ở bệnh nhân COVID-19, các nền tảng gần đây cho phép điều chỉnh hệ thống mạch để thực hiện các kỹ thuật ECOS khác nhau ngoài RRT. Mặc dù chỉ có một số báo cáo về rối loạn chức năng gan ở bệnh nhân COVID-19, các liệu pháp điều trị ngoài cơ thể đặc biệt có sẵn để hỗ trợ gan, nếu cần [25- 28]. Bilirubin liên hợp hoặc không liên hợp, axit mật, phenol, axit béo, cytokine, amoniac, hoặc axit amin có thể được loại bỏ một cách hiệu quả bằng phương pháp lọc huyết tương liều cao, (high-volume plasmapheresis) cải thiện chức năng gan thông qua cải thiện phản ứng viêm [29]. Với mục đích tương tự, hệ thống hấp phụ phân tử huyết tương kép (double plasma molecular adsorption system) và trao đổi huyết tương nửa liều tuần tự (sequential half-dose plasma exchange) đã được sử dụng [30]. Việc sử dụng lọc máu hấp phụ ngày càng được mở rộng nhờ vào các màng lọc hấp thụ tương thích sinh học (biocompatible sorbent cartridges) mới. Loại bỏ các chất trung gian dịch thể và các cytokine bằng các cột khác nhau (CytoSorb®, Cytosorbents, NJ, USA, và HA380, Jafron, China) đã có lợi và cải thiện tỷ lệ sống sót trong các điều kiện khác nhau [31, 32].
Điều trị hỗ trợ và thông khí bảo vệ phổi là tiêu chuẩn chăm sóc hiện tại cho bệnh nhân COVID- 19 bị suy hô hấp nặng và hội chứng suy hô hấp cấp (ARDS). Cách tiếp cận này có thể hạn chế tổn thương phổi do thông khí, nhưng nó có thể liên quan đến việc điều chỉnh không đủ tình trạng tăng CO2 và toan hô hấp [33].
Kỹ thuật ECCO2R đã được áp dụng cho trường hợp suy hô hấp do tăng CO2 máu mà không cần hỗ trợ oxy đáng kể. Nói chung, CO2 được tạo ra với tốc độ 3–6 mL/kg/phút (1 L máu động mạch với áp lực riêng phần CO2 là 40 mm Hg chứa 500 mL CO2) và có đường cong phân ly tuyến tính dốc không bão hòa. Như vậy, CO2 khuếch tán từ máu hiệu quả hơn O2 [34,35]. Lượng CO2 thải ra ngoài cơ thể hiệu quả từ bệnh nhân phụ thuộc vào lưu lượng máu. Các nghiên cứu đã chỉ ra rằng loại bỏ CO2 tiến triển cho đến khi lưu lượng máu 800– 1.000 mL/phút đạt đến mức trần. Thiết bị ECCO2R lưu lượng máu thấp (< 0,5 L/phút) giúp loại bỏ CO2 một phần. Trong nghiên cứu SUPERNOVA, ECCO2R tạo điều kiện cho thông khí siêu bảo vệ [36]. ECCO2R kết hợp với RRT có khả năng hạn chế stress hô hấp hơn nữa bằng cách loại bỏ CO2 dư thừa và bù lại tình trạng nhiễm toan hô hấp, do đó tạo điều kiện giảm thể tích khí lưu thông (< 6 mL/kg) trong các chiến lược thông khí bảo vệ phổi [37,38]. Điều này có thể đặc biệt hấp dẫn ở những bệnh nhân mắc ARDS và AKI đồng thời, nơi các cơ chế bù trừ của thận kém hiệu quả hơn trong việc điều chỉnh cân bằng nội môi axit-bazơ trong quá trình nhiễm toan tăng CO2. Cho đến nay, một số thiết bị ECCO2R có sẵn có thể được sử dụng cùng với phần cứng RRT sử dụng lưu lượng máu thay đổi [34, 39-52]. Các kỹ thuật để cải thiện việc loại bỏ CO2 bằng các thiết bị lưu lượng máu thấp bao gồm (i) RRT sử dụng dịch lọc ít bicarbonat (lên đến 65% CO2 được vận chuyển dưới dạng các ion bicarbonat hòa tan trong huyết tương và được đào thải với tốc độ gần bằng urê); (ii) axit hóa máu trong RRT (để tăng thải CO2) và kiềm hóa máu sau đó để điều chỉnh tình trạng nhiễm toan [53]; (iii) lớp phủ của chất tạo oxy màng bằng anhydrase cacbonic (để chuyển bicacbonat và axit cacbonic thành CO2 và nước) [54]; và (iv) thẩm phân điện kết hợp (electrodialysis coupled) với màng trao đổi oxy (membrane oxygenator) (để điều chỉnh nồng độ chất điện giải trong máu và thúc đẩy chuyển đổi bicarbonate thành CO2) [51]. Một số thử nghiệm lâm sàng đang được tiến hành để xác định xem liệu loại bỏ CO2 ngoài cơ thể do VV (VV- ECCO2R) và thở máy thể tích khí lưu thông thấp hơn có cải thiện kết quả và tiết kiệm chi phí hay không, so với chăm sóc tiêu chuẩn ở bệnh nhân thở máy do suy hô hấp cấp giảm oxy máu.
Liệu pháp điều trị ngoài cơ thể trong hội chứng giải phóng Cytokine
Mặc dù nhiễm trùng huyết do vi khuẩn không phải là một đặc điểm phổ biến ở bệnh nhân COVID-19, nhưng phản ứng miễn dịch với vi rút có thể dẫn đến một số bệnh nhân đến tình trạng sinh lý bệnh tương tự của “cơn bão cytokine”, tức là hội chứng giải phóng cytokine (CRS, cytokine release syndrome) nghiêm trọng kèm theo rối loạn chức năng cơ quan. Tổn thương các cơ quan khác có thể do đông máu nội mạch hoặc huyết khối vi mô/vĩ mô gây ra. Do đó, rối loạn chức năng cơ quan đe dọa tính mạng do phản ứng của vật chủ bị rối loạn điều hòa đối với nhiễm trùng không chỉ phụ thuộc vào tình trạng viêm toàn thân do miễn dịch bẩm sinh mà còn phụ thuộc vào khả năng ức chế miễn dịch nghiêm trọng do miễn dịch thích ứng. Cơ sở lý luận sinh lý bệnh cho các liệu pháp ngoài cơ thể để khôi phục “cân bằng nội môi miễn dịch” trong CRS có nguồn gốc khác nhau đã được mô tả [55]. Lọc máu theo tầng (cascade hemofiltration), HVHF, lọc huyết tương, lọc máu hấp phụ, CPFA, lọc máu hấp phụ cao và màng lọc HCO/MCO đã được đề xuất dựa trên cơ sở lý luận sinh lý bệnh của cytokine và loại bỏ/điều chỉnh chất trung gian hóa học. Điều thú vị là vào tháng 4 năm 2020, FDA đã tạm thời cho phép sử dụng khẩn cấp thiết bị CytoSorb 300 mL để quản lý CRS ở bệnh nhân COVID-19 [56]. Dựa trên thử nghiệm hiệu suất thực nghiệm và kinh nghiệm lâm sàng được báo cáo, FDA đã kết luận rằng thiết bị CytoSorb có thể hiệu quả trong việc điều trị một số bệnh nhân có COVID-19 đã được xác nhận bằng cách loại bỏ các cytokine gây viêm khác nhau khỏi máu của họ. Do đó, các liệu pháp này, mặc dù được coi là can thiệp “đang được điều tra khoa học”, “cứu cánh” hoặc “sử dụng từ bi”, vẫn là một lựa chọn cho CRS nặng và đặc biệt, cho bệnh nhân COVID-19 thiếu các biện pháp thay thế. Cơ chế mà các kỹ thuật này có thể tạo ra các tác dụng có lợi vẫn còn chưa được hiểu rõ. Việc loại bỏ không đặc hiệu hoặc đặc hiệu một số dạng phân tử liên quan đến tổn thương và/hoặc dạng phân tử liên quan đến mầm bệnh rất có thể đóng một vai trò quan trọng trong việc điều chỉnh phản ứng viêm đối với nhiễm trùng huyết. Việc loại bỏ này có thể làm giảm các đỉnh của nồng độ cytokine và/hoặc thay đổi tỷ lệ cytokine/chemokine từ các mô vào máu, tác động tích cực đến việc vận chuyển bạch cầu [57, 58]. Tuy nhiên, các bệnh nhân không đồng nhất về kiểu hình viêm của họ và có nhiều mức độ khác nhau của cytokine trong máu của họ (ví dụ, IL-6 có thể dao động từ < 10 đến > 1 triệu pg/mL) [59]. Áp dụng phương pháp lọc máu cho tất cả các bệnh nhân có thể có lợi cho một số người và không có tác dụng hoặc thậm chí gây tổn thương cho người khác. Do đó, các tiêu chí cụ thể cần được xác định. Các cơ chế khác như hấp phụ trực tiếp bạch cầu đã hoạt hóa và các tế bào khác tham gia vào phản ứng miễn dịch cũng có thể tham gia [60]. Sự biểu hiện CD14 trên bạch cầu đơn nhân, sự bùng phát oxy hóa và khả năng thực bào của bạch cầu hạt có thể đại diện cho một cơ chế khác. Trong khi HVHF có thể ngăn ngừa tình trạng giảm đáp ứng nội độc tố gây ra nhiễm trùng huyết in vitro ở động vật [61], ở người, HVHF và hệ thống thác HVHF không mang lại lợi ích sống sót [62, 63]. CPFA cũng đã được sử dụng để can thiệp vào phản ứng miễn dịch của vật chủ bằng cách loại bỏ các chất trung gian và/hoặc bằng cách sửa đổi kiểu hình và chức năng của tế bào miễn dịch. Trong một nghiên cứu thí điểm ở bệnh nhân nhiễm trùng huyết, CPFA hiệu quả hơn HVHF trong việc đảo ngược tình trạng tiêu miễn dịch do nhiễm trùng huyết [64]. Nó làm tăng sự biểu hiện của HLA-DR trên bạch cầu đơn nhân và khôi phục sản xuất TNF do lipopolysaccharide gây ra. Tuy nhiên, gần đây, thử nghiệm COMPACT-2, đánh giá CPFA trong sốc nhiễm trùng, đã bị dừng sớm do tăng tỷ lệ tử vong sớm ở bệnh nhân dùng CPFA so với nhóm chứng. Điện di, trao đổi huyết tương và các kỹ thuật liên quan chưa được đánh giá rộng rãi cho chỉ định này. Tuy nhiên, người ta cho rằng những liệu pháp này có thể có lợi ở những bệnh nhân nhiễm trùng huyết Gram âm và khi bắt đầu sớm [65]. Tuy nhiên, không có RCT nào có thể chứng minh tác dụng có lợi. Gần đây, việc sử dụng hệ thống hấp phụ phân tử lọc huyết tương kép đã được mô tả cho các chỉ định nêu trên trong một thử nghiệm nhỏ [30]. Lọc máu hấp phụ là một phương pháp lọc máu dựa trên sự tương tác giữa chất hấp thụ và các phân tử đích. Một số loại màng lọc hấp phụ, nhắm mục tiêu nội độc tố hoặc cytokine, có sẵn và hiện đang được đánh giá trên toàn thế giới. Zhou và cộng sự. [66] đã báo cáo trong một phân tích tổng hợp rằng tác dụng có lợi của việc lọc máu đối với tỷ lệ tử vong chủ yếu là do kết quả của các nghiên cứu đánh giá lọc máu hấp phụ với polymyxin-B (PMX-HP, Toraymyxin®, Nhật Bản). Ngoài những cải thiện về huyết động và hô hấp, thử nghiệm EUPHAS còn gợi ý về lợi ích sống sót cho bệnh nhân nhiễm trùng huyết khi điều trị bằng liệu pháp này [67]. Thật không may, các thử nghiệm ABDOMIX và EUPHRATES tiếp theo đã không xác nhận những phát hiện đầy hứa hẹn này [68, 69]. Tuy nhiên, trong một phân tích hậu kỳ về EUPHRATES, những bệnh nhân bị sốc nhiễm trùng và xét nghiệm hoạt tính nội độc tố ≥ 0,6 đến 0,89 có lợi ích đáng kể khi điều trị PMX-HP dưới dạng áp lực động mạch trung bình, ngày không thở máy và tử vong [70]. Một RCT lớn với CytoSorb® (Cytosorbents, NJ, USA) liên quan đến 100 bệnh nhân bị nhiễm trùng huyết/sốc nhiễm trùng và tổn thương phổi cấp tính cho thấy loại bỏ IL-6 một lần từ 5-18%, nhưng không làm giảm nồng độ IL-6 khi điều trị [71]. Một nghiên cứu khác trên 30 bệnh nhân so sánh CytoSorb® với chăm sóc tiêu chuẩn trong quá trình phẫu thuật bắc cầu tim phổi cho thấy không có sự giảm cytokine tiền viêm hoặc chống viêm cũng như không cải thiện kết quả lâm sàng liên quan [72]. Phép đo in vitro của 27 chất trung gian gây viêm đã so sánh CytoSorb® với thiết bị PMX-HPng và màng lọc hấp phụ (oXiris®) được phát triển gần đây [73]. Nghiên cứu cho thấy oXiris® là thiết bị duy nhất loại bỏ cả nội độc tố và cytokine có khả năng loại bỏ nội độc tố tương tự như PMX-HP và loại bỏ cytokine tương tự như CytoSorb®. Tuy nhiên, cho đến nay, không có RCT nào khám phá màng oXiris® được thực hiện. Các bộ lọc với kích thước lỗ lớn hơn cho phép loại bỏ tốt hơn các phân tử giữa trong ống nghiệm cũng đã được đề xuất để lọc máu trong nhiễm trùng huyết [74]. Tuy nhiên, một RCT mù đôi gần đây không tìm thấy tác dụng có lợi ở bệnh nhân ICU với MOF [75]. Một loạt các báo cáo cũng đã được công bố về công dụng của lọc máu hấp phụ với thiết bị nhựa trung tính lỗ lớn (neutro-macroporous resin device) (HA-330/ 380, Jafron, Trung Quốc) ở bệnh nhân nhiễm trùng huyết [76, 77]. Các tác dụng có lợi dường như liên quan đến việc loại bỏ đáng kể các cytokine đang lưu hành. Bệnh nhân COVID-19 có thể bị nhiễm trùng huyết bội nhiễm; tuy nhiên, cơ chế tổn thương cơ quan dường như khá giống với rối loạn điều hòa miễn dịch và hội chứng giải phóng cytokine được quan sát thấy ở bệnh nhân nhiễm trùng huyết. Vì lý do này, các kỹ thuật như PMX-HP, CytoSorb, và màng lọc HA380 được sử dụng cho bệnh nhân COVID-19 như là liệu pháp đã xác nhận. Các báo cáo của một trung tâm về tác dụng có lợi và giảm tiến triển của bệnh đối với rối loạn chức năng đa cơ quan đã được trình bày trong các cuộc họp, nhưng bằng chứng chắc chắn vẫn còn thiếu. Ngoài ra còn thiếu bằng chứng về việc sử dụng bất kỳ loại can thiệp nào đối với bệnh nhiễm vi rút. Hiện tại, cơ sở lý luận sinh lý bệnh là lý do duy nhất để đề xuất áp dụng các phương pháp này và nên đánh giá theo từng trường hợp cụ thể, mặc dù nếu các phương pháp điều trị như vậy đang được xem xét, thì việc áp dụng chúng sớm có vẻ hợp lý [55].
Tương tác cơ quan tự nhiên và nhân tạo ở bệnh nhân COVID-19
Nhiễm COVID-19 có thể dẫn đến một đợt rối loạn chức năng đa cơ quan qua trung gian CTS. Mặc dù tương tác xuyên cơ quan (organ cross-talk) đã được mô tả rõ ràng trong tài liệu, nhưng tác động của các loại ECOS khác nhau lên hệ cơ quan bản địa lại ít được biết đến [9]. Ví dụ, hơn 70% bệnh nhân được điều trị ECMO phát triển AKI, và phần lớn được điều trị bằng RRT [18]. Mặc dù có nhiều lý do gây ra AKI ở những bệnh nhân cần ECMO, đóng góp chính xác từ hỗ trợ ECMO cho mỗi bệnh nhân vẫn chưa được biết. Các yếu tố góp phần tiềm tàng có thể là tán huyết, sự sai lệch của cannula dẫn đến sung huyết thận, vỡ mảng xơ vữa trong quá trình đặt cannula động mạch và phản ứng viêm khi máu tiếp xúc với màng nhân tạo. Cũng có thể có những tác động gián tiếp khác; ví dụ, dược động học của thuốc kháng sinh và thuốc an thần có thể bị thay đổi trong ECOS, dẫn đến dưới liều và quá liều [9]. Tương tác giữa các loại hỗ trợ cơ quan nhân tạo khác nhau cũng cần được xem xét. Ví dụ, dòng chảy ECMO thường khó duy trì trong quá trình loại bỏ thể tích nhanh chóng, vì vậy loại bỏ dịch chậm bằng CRRT thường được cả bệnh nhân và hệ thống mạch ECMO dung nạp tốt hơn. Kiến thức chi tiết về những ưu điểm và nhược điểm của việc kết hợp các loại ECOS khác nhau cũng như rủi ro và lợi ích của chúng là rất cần thiết [18].
Cơ sở lý luận cho các liệu pháp ngoài cơ thể ở bệnh nhân COVID-19
Trong đại dịch COVID-19, một số bệnh nhân nhập viện ICU có thể bị MOF nghiêm trọng ở giai đoạn sau của bệnh. Tổn thương thận trực tiếp ở bệnh nhân nhiễm COVID-19 có tần suất thấp [78], nhưng khi có mặt, nó cần thận hỗ trợ cụ thể và phục hồi các mục tiêu sinh lý, cho phép phục hồi và sửa chữa. Một số con đường có thể đã được xác định, có thể dẫn đến tổn thương thận. Những điều này đã gợi ý việc sử dụng hỗ trợ ngoài cơ thể và các chiến lược lọc máu khác nhau để ngăn ngừa tổn thương cơ quan, bảo vệ khỏi tổn thương thêm, và hỗ trợ rối loạn chức năng cơ quan [1]. Một tỷ lệ đáng kể bệnh nhân COVID-19 được nhận vào ICU phát triển CRS còn được gọi là “cơn bão cytokine”, với hội chứng rò rỉ mao mạch và rối loạn chức năng phổi, tim và thận. Trong số các chất trung gian khác, interleukin-6 thường tăng cùng với ferritin và protein phản ứng C, và đây cũng được coi là một yếu tố nguy cơ phát triển ARDS [79]. Hơn nữa, bệnh cảnh lâm sàng được đặc trưng bởi tình trạng tăng đông nghiêm trọng. Có ý kiến cho rằng việc sử dụng thở máy xâm nhập và ECMO có thể kích thích thêm phản ứng viêm. Sản xuất quá mức cytokine có liên quan đến tương tác hai chiều phổi-thận và tim-thận. Trên thực tế, bệnh cơ tim do virus cấp tính có thể góp phần vào tắc nghẽn thận và giảm tưới máu, trong khi tình trạng thiếu oxy tủy thận trong ARDS thể hiện thêm tổn thương đối với các tế bào ống thận [80-82].
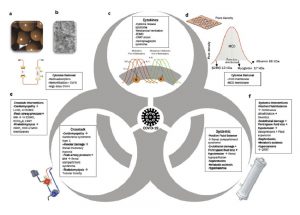
”Về cơ bản, 3 khía cạnh rộng có liên quan đến AKI liên quan đến COVID-19. Sự tham gia hai chiều của mỗi phần tử xảy ra, được đại diện bởi lý thuyết tập hợp và sự hiện diện của các giao điểm. Các chiến lược điều trị cũng ảnh hưởng đồng thời đến các yếu tố khác nhau. a: Một hình ảnh phóng đại hạt hấp phụ nhựa trung tính macroporous. b: Hạt trên kính hiển vi điện tử. c: Hội chứng giải phóng cytokine và các yếu tố khởi phát khác để tạo cytokine. d: MCO có sự đồng đều hơn về phân bố kích thước lỗ và mật độ lỗ; những đặc điểm này cho phép màng loại bỏ hiệu quả các phân tử trung gian trong phạm vi của hầu hết các cytokine bị mất albumin có thể chấp nhận được. e: hệ thống mạch ECMO. f: Bộ lọc được sử dụng trong CRRT để kiểm soát cân bằng dịch, loại bỏ độc tố thận, điều chỉnh tăng kali máu và nhiễm toan chuyển hóa. AKI, chấn thương thận cấp tính; AV ECMO, ECMO tĩnh mạch – động mạch; β2MG, β2 microglobulin; CRRT, liệu pháp thay thế thận liên tục; CVVH, lọc máu tĩnh mạch liên tục; ECCO2R, loại bỏ carbon dioxide bên ngoài cơ thể; ECMO, oxy hóa màng ngoài cơ thể; HCO, màng lọc điểm cắt cao; MCO, màng lọc điểm cắt trung bình; IAH, tăng huyết áp trong ổ bụng; IL, interleukin; kDa, kilodalton; LVAD, thiết bị trợ giúp thất trái; TNF, yếu tố hoại tử khối u; VV ECMO, ECMO tĩnh mạch – tĩnh mạch.”
Sự quá tải dịch có thể dẫn đến sự cân bằng dịch dương tính ở bệnh nhân COVID-19 với những tác động bất lợi đến trao đổi khí ở phổi, chức năng tim và cuối cùng là chức năng thận. Cuối cùng, nhiễm trùng chồng chất có thể xảy ra trong thời gian ở ICU. Trong trường hợp nhiễm COVID-19 và CRS, nghi ngờ hoặc đã xác nhận nhiễm vi khuẩn Gram âm chồng chất, việc sử dụng PMX- HP được chỉ định trong giai đoạn đầu để cung cấp sự hấp phụ nội độc tố [10]. PMX-HP nên được sử dụng trong 2 ngày tiếp theo. Nếu có CRS, việc điều trị này nên được thực hiện theo các phương pháp hấp phụ cytokine (CytoSorb, Cytosorbents, NJ, USA; HA-380, Jafron, China; và oXiris, Baxter, Deerfield, IL, USA), và nếu cần hỗ trợ cơ quan , CRRT nên được thực hiện kết hợp hoặc sau đó. Điều trị như vậy để loại bỏ nội độc tố, loại bỏ cytokine và hỗ trợ cơ quan trong suốt quá trình điều trị ICU được gọi là liệu pháp ngoài cơ thể tuần tự (sequential extracorporeal therapy). Do đó, ECOS đại diện cho sự kết hợp hoàn hảo của các kỹ thuật để cung cấp khả năng lọc máu ở bệnh nhân COVID-19 [1, 83] (Hình 3). Cụ thể, để loại bỏ cytokine, các phương pháp khác nhau đã được đề xuất: (a) tưới máu trực tiếp bằng cách sử dụng chất hấp thụ tương thích sinh học; (b) sự hấp phụ huyết tương trên nhựa sau khi tách huyết tương khỏi máu toàn phần; (c) CRRT với bộ lọc sợi rỗng có đặc tính hấp phụ; (d) CRRT liều cao với màng MCO hoặc HCO. Các liệu pháp này tìm thấy cơ sở lý luận trong việc ngăn ngừa tổn thương cơ quan do CRS gây ra liên quan đến nhiễm trùng COVID-19 nghiêm trọng [1, 79-83].
Khuyến nghị thực tế cho bệnh nhân COVID-19 bị bệnh nặng
Khi các liệu pháp điều trị ngoài cơ thể được chỉ định ở bệnh nhân COVID-19, chúng tôi khuyên bạn nên sử dụng các ống thông (cannula) hai nòng (double lumen) có kích thước phù hợp để cho phép lưu lượng máu đủ bất kể loại điều trị nào. Điều cơ bản là phải cố định ống thông một cách chắc chắn để tránh tình trạng vô tình ngắt kết nối trong quá trình vận động và quay đầu như thường xuyên được yêu cầu ở những bệnh nhân này. Tình trạng tăng huyết khối đòi hỏi phải tăng liều lượng thuốc chống đông máu vừa để duy trì mạch ổn định vừa để kiểm soát tình trạng tăng huyết khối của bệnh nhân. Trong trường hợp heparin không phân đoạn, chúng tôi bắt đầu với 10 IU/kg/h, nhưng ở một số bệnh nhân, có thể cần liều cao hơn lên đến 15 và 20 IU/kg/h để đảm bảo tính ổn định của mạch. Không phụ thuộc vào liệu pháp điều trị ngoài cơ thể, bệnh nhân có thể được điều trị bằng heparin trọng lượng phân tử thấp để ngăn ngừa các đợt thuyên tắc vi mô hoặc vĩ mô thường được quan sát thấy như một biến chứng của nhiễm COVID-19. Máu chảy trên 150 mL/phút và việc sử dụng các kỹ thuật khuếch tán (CVVHD) với phần lọc tối thiểu giúp tránh đông máu hơn nữa. Nếu có kế hoạch điều trị lâu dài, có thể chỉ định kháng đông citrate khu vực, mặc dù chưa có bằng chứng về kết quả vượt trội. Hơn nữa, một số trung tâm nhận thấy kỹ thuật này quá phức tạp hoặc đòi hỏi quá nhiều can thiệp tại giường bệnh. Các khu vực COVID-19 thường đã bị quá tải bởi các thủ tục và cần tránh quá tải thêm y tá. Nếu có thể, nên sử dụng máy CRRT thế hệ sau với khả năng thay đổi các đặc tính của mạch trong quá trình điều trị hoặc dẫn dịch lọc đã qua sử dụng trực tiếp vào ống dẫn lưu, tránh thay túi thường xuyên [84]. Theo kinh nghiệm hiện tại và trong trường hợp không có bất kỳ liệu pháp cụ thể nào ngoài các biện pháp hỗ trợ, chúng tôi đề nghị rằng các chiến lược loại bỏ cytokine nên dành cho những bệnh nhân COVID-19 có bằng chứng về các cytokine lưu hành cao như IL-6 và IL-8, một chứng viêm được xác định về mặt sinh hóa, tình trạng viêm, điểm SOFA cao, các triệu chứng lâm sàng về huyết động không ổn định cần dùng thuốc vận mạch, và các dấu hiệu ban đầu của rối loạn điều hòa miễn dịch hoặc rối loạn đông máu. Các chất đánh dấu như ferritin huyết tương hoặc dấu ấn sinh học tiết niệu của stress thận cũng có thể hữu ích để xác định các trường hợp tăng viêm. Chỉ riêng tiêu chí lâm sàng có thể thay thế cho tình trạng tăng viêm, nhưng chúng nên được đánh giá theo từng trường hợp. Trong tương lai, hồ sơ di truyền có thể hướng dẫn việc bắt đầu chiến lược điều trị này cho những bệnh nhân cụ thể. Nếu PMX-HP được chỉ định cho trường hợp nghi ngờ nhiễm trùng huyết (procalcitonin cao và/hoặc cấy vi khuẩn dương tính) hoặc được xác nhận bằng xét nghiệm hoạt tính nội độc tố cao, nên sử dụng đợt điều trị 2 giờ trong 2 ngày liên tiếp. Một phiên thứ ba có thể được yêu cầu ở một số bệnh nhân. Các phiên này có thể được theo sau bằng cách lọc máu hấp phụ với CytoSorb hoặc HA-380. Nếu lọc máu hấp phụ được chỉ định để loại bỏ các cytokine, nhiều phiên có thể được lên lịch vào những ngày tiếp theo. Trong mọi trường hợp, nên cung cấp thuốc chống đông máu để duy trì sự thông suốt của hệ thống mạch, và nên chỉ định tốc độ dòng máu cao hơn 120 mL/phút. Ngoài ra, màng oXiris hoặc polymethylmetacrylate cũng có thể được sử dụng trong chế độ CRRT với mục đích loại bỏ cytokine. Khi RRT được chỉ định, điều này có thể được thực hiện với màng hiện tại, với màng HCO hoặc MCO theo cả phương thức liên tục hoặc gián đoạn [1,13,79-89]. Do phải vận động thường xuyên và theo dõi, bệnh nhân có thể được điều trị bằng các đợt kéo dài ngắt quãng (PIRRT) để cho phép thực hiện các kỹ thuật điều dưỡng. Do tình trạng huyết động không ổn định nghiêm trọng và cần phải kiểm soát cân bằng dịch của bệnh nhân, việc loại bỏ dịch cần được lên lịch cẩn thận để tránh tụt huyết áp có thể làm trầm trọng thêm tình trạng tổn thương thận hoặc chậm hồi phục. Trong trường hợp không có thuốc hoặc vắc-xin COVID-19 được thiết lập, lý do sinh lý bệnh ngoài các liệu pháp hỗ trợ điển hình, chẳng hạn như thông khí, có thể gợi ý áp dụng các kỹ thuật ECOS ở những bệnh nhân đáp ứng các tiêu chí lâm sàng hoặc sinh hóa đủ điều kiện. Chúng tôi hoàn toàn biết rằng những khuyến nghị này chưa dựa trên bằng chứng chắc chắn mà dựa trên kinh nghiệm lâm sàng đã trưởng thành trên thực địa. Các biện pháp phòng ngừa và bảo vệ cụ thể để tránh sự phát triển của suy cơ quan do cơn bão cytokine hoặc các liệu pháp hỗ trợ cơ quan được nhắm mục tiêu có thể giúp những bệnh nhân bị bệnh nặng với COVID-19 mà không có hoặc không có gì ngoại trừ điều trị hỗ trợ. Tình trạng lâm sàng (hội chứng giống sốc với nhu cầu dùng thuốc vận mạch, hội chứng rò rỉ mao mạch, viêm cơ tim và ARDS) và tiêu chí phòng thí nghiệm (IL-6 và dấu hiệu viêm) và dấu ấn sinh học AKI có thể đại diện cho các yếu tố kích hoạt để thực hiện các phương pháp điều trị ngoài cơ thể đơn lẻ hoặc khác nhau theo trình tự. Ở bệnh nhân COVID-19, tất cả các tính năng và tiến bộ mới này có thể đại diện cho một lựa chọn thực sự tại thời điểm các lựa chọn về dược phẩm và vắc xin gần bằng không.





