Giới thiệu chung về kháng sinh nhóm Quinolone
Lịch sử ra đời

Quinolone là một trong những nhóm kháng sinh quan trọng và được sử dụng nhiều trên lâm sàng. Nhóm thuốc này đã bắt đầu phát triển từ khoảng 6 thập kỷ trước, khi đó chúng mới chỉ được sử dụng trong điều trị nhiễm trùng đường tiết niệu, cho đến hiện tại, Quinolone đã đóng góp một vai trò quan trọng và không thể phủ nhận trong điều trị nhiều loại nhiễm trùng khác nhau, trong đó có nhiều nhiễm trùng nặng và đe dọa tính mạng.
Tuy vậy, vấn đề thực tiễn đặt ra hiện nay là do việc sử dụng quá mức (lạm dụng) nhóm thuốc này, tỷ lệ đề kháng của vi khuẩn với nhóm kháng sinh này đang ngày càng tăng cao kể từ thập niên 1990. Việc sử dụng lâm sàng nhóm kháng sinh này trên lâm sàng đang ngày càng bị đe dọa.
Quinolone là một nhóm kháng sinh được tổng hợp hóa học hoàn toàn, khác với nhiều nhóm kháng sinh khác có nguồn gốc từ tự nhiên hoặc bán tổng hợp từ các kháng sinh tự nhiên. Điều này làm cho nhiều nhà khoa học cho rằng Quinolone là thuốc “kháng khuẩn” chứ không phải “kháng sinh”. Tuy vậy, phân loại chúng là thuốc “kháng khuẩn” hay “kháng sinh” cũng không quan trọng, vì đó chỉ là tên gọi chứ không ảnh hưởng đến việc sử dụng thuốc trên lâm sàng. Thành viên đầu tiên được sử dụng trên lâm sàng của nhóm kháng sinh này là Nalidixic acid. Chất này được điều chế lần đầu năm 1962 tại Viện Nghiên cứu Sterling-Winthrop, nó được coi là một phần của các 1-alkyl-1,8-naphthyridine. Năm 2015, khi hồi cứu lại lịch sử phát triển của các kháng sinh nhóm này, người ta đã phát hiện ra George Lesher đã mô tả sự phân lập -chloro-1-ethyl-1,4-dihydro-4-oxo-3-quinolinecarboxylic acid trong một ấn phẩm được xuất bản năm 1962. Chất này được ông tổng hợp vào cuối những năm 1950, là một sản phẩm phụ trong quá trình tổng hợp thuốc điều trị sốt rét Chloroquine, với hoạt tính kháng khuẩn yếu. Do vậy, George Lesher được coi là cha đẻ của kháng sinh nhóm Quinolone.
Trở lại với Nalidixic acid, thuốc này sau đó nhận được chỉ định cho điều trị nhiễm trùng đường tiết niệu không biến chứng do các trực khuẩn gram âm đường ruột gây ra. Nalidixic acid được phân loại vào nhóm Quinolone thế hệ 1. Tiếp sau đó, đến đầu những năm 1970, một số Quinlone thế hệ 1 khác cũng được tổng hợp và đưa vào sử dụng trên lâm sàng, với đại diện đáng chú ý nhất là Oxolinic acid.
Do sự hạn chế về chỉ định, các kháng sinh nhóm Quinolone vẫn chưa được sử dụng nhiều trên lâm sàng vào thời điểm đó. Phải đến đầu những năm 1980, với sự ra đời của các Quinolone thế hệ 2, việc sử dụng các kháng sinh nhóm này trên lâm sàng mới bắt đầu bùng nổ. Ba loại thuốc thế hệ 2 được giới thiệu đầu tiên là Norfloxacin, Ciprofloxacin và Ofloxacin. Các kháng sinh nhóm này có đặc tính dược động học và dược lực học được cải thiện đáng kể so với thế hệ 1. Thay đổi trong cấu trúc quan trọng nhất với các kháng sinh nhóm này là sự gắn thêm một nguyên tử Fluor (F) vào vị trí carbon số 6 (C6), vì vậy mà từ đó trở về sau, các kháng sinh mới hơn này còn được gọi là các “Fluoroquinolones” (FQs). Ngoài ra, nhóm thế piperazine hoặc methylpiperazine ở vị trí C7 cũng đóng một vai trò quan trọng.
Norfloxacin là Quinolone phổ rộng đầu tiên được sử dụng trên lâm sàng, với tần suất sử dụng nhiều hơn Nalidixic acid. Tuy vậy, đặc tính dược động học của Norfloxacin vẫn còn kém nên chỉ định vẫn bị giới hạn ở nhiễm trùng tiết niệu – sinh dục. Quinolone đầu tiên thể hiện được hoạt tính tốt cho các nhiễm khuẩn ngoài khu vực tiết niệu – sinh dục là Ciprofloxacin. Cho đến thời điểm hiện tại, Ciprofloxacin vẫn là một kháng sinh được kê đơn khá phổ biến và quan trọng trên lâm sàng.
Các Quinolone thế hệ 3 và 4 được ra đời sau đó không lâu, với các đại diện là Levofloxacin, Moxifloxacin và Sparfloxacin. Các kháng sinh này thể hiện hoạt tính tốt hơn trên vi khuẩn gram dương, đồng thời có dược động học cực kỳ thuận lợi. Do có thể được chỉ định cho điều trị các nhiễm khuẩn hô hấp, các kháng sinh này còn được gọi là “Quinolone hô hấp”.
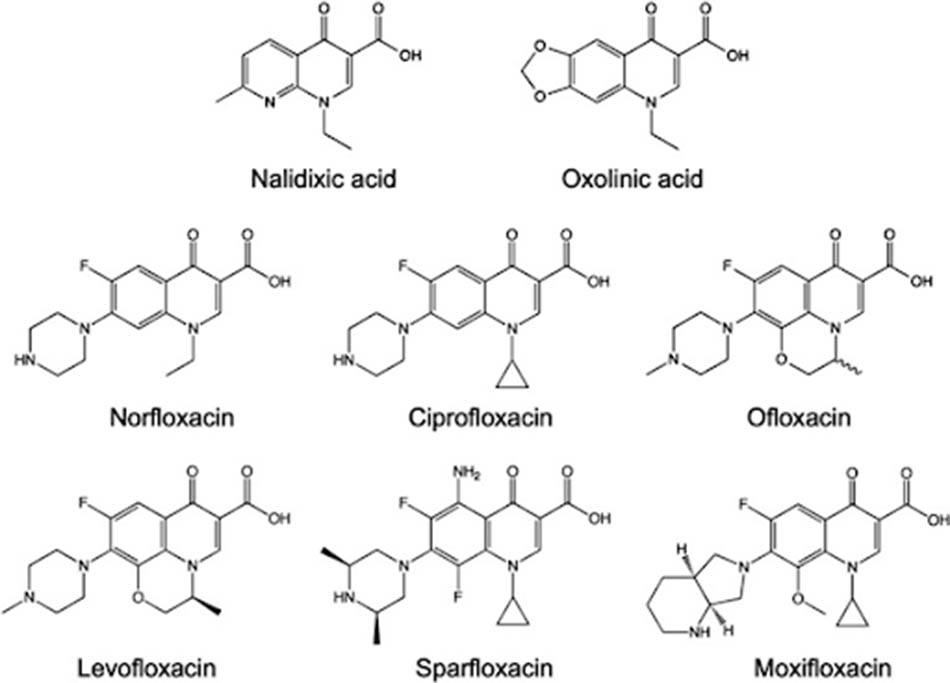
Cấu trúc hóa học
Cấu trúc hóa học đặc trưng của các Quinolone được trình bày ở hình dưới:
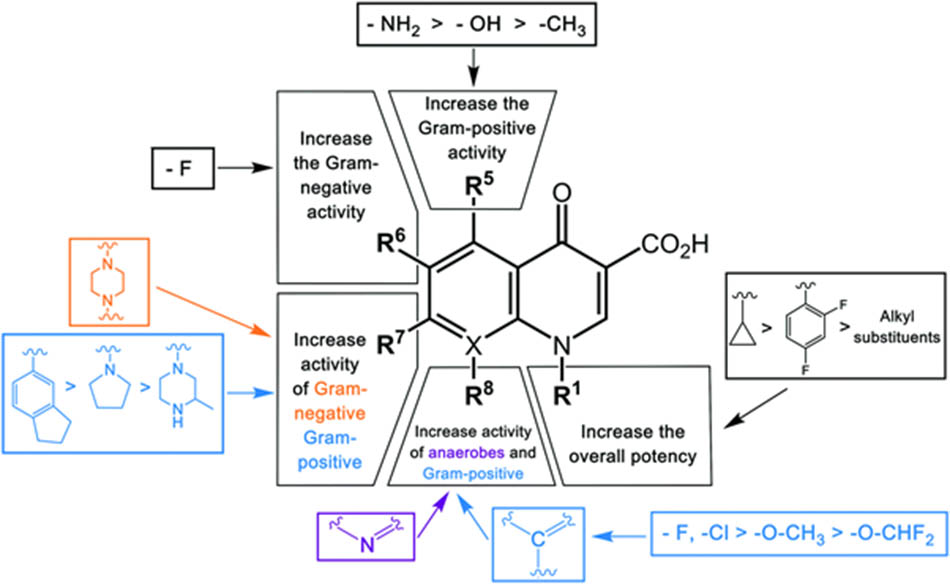
Mô tả: Nhóm thế R1: Ảnh hưởng đến hiệu lực kháng khuẩn tổng thể, trong đó nhóm cyclopropyl có hiệu lực tốt nhất; Nhóm thế R5: Cải thiện hoạt tính trên vi khuẩn gram dương, trong đó nhóm amino có hiệu lực lớn nhất; Nhóm thế R6: Tăng hiệu lực trên vi khuẩn gram âm, hiện chỉ dùng nhóm thế fluoro; Nhóm thể R7: Tăng hiệu lực trên vi khuẩn gram âm hoặc gram dương (các mức độ được sắp xếp như trên hình vẽ); Nhóm thế R8: Tăng hoạt tính trên vi khuẩn gram dương (X là C, các mức độ được sắp xếp như trên hình vẽ) hoặc vi khuẩn kỵ khí (X là N).
Dược lực học
Cơ chế tác dụng
Các kháng sinh nhóm Quinolone có cơ chế tác dụng chính là ức chế hai enzyme quan trọng của vi khuẩn, đó là DNA gyrase (DNA topoisomerase II) và DNA topoisomerase IV. Hai enzyme này đóng vai trò quan trọng trong sự nhân lên của DNA: Kiểm soát quá trình tháo xoắn DNA mẹ cũng như tháo nút thắt giữa hai DNA con sau khi đã nhân đôi. Quá trình xúc tác của hai loại enzyme này có sự tham gia của ATP. Khi hai enzyme này bị ức chế, DNA của vi khuẩn bị phân mảnh và đứt gãy.
Ngoài tác dụng ức chế hai enzyme này, các Quinolone cũng có thể được coi là một “chất độc topoisomerase” vì chúng biến hai enzyme trên thành một chất độc với DNA của tế bào vi khuẩn.
Cơ chế ức chế DNA gyrase vi khuẩn của Quinolone được phát hiện năm 1977. Ban đầu người ta cho rằng ở các vi khuẩn gram âm, đích tác dụng chính của các Quinolone là DNA gyrase, còn ở các vi khuẩn gram dương, đích tác dụng chính của các Quinolone lại là DNA topoisomerase IV (tất nhiên trong các trường hợp này, enzyme còn lại vẫn bị ức chế, nhưng chỉ là đích tác dụng phụ). Tuy vậy, sau này quan điểm này đã không còn đúng nữa. Với một loài vi khuẩn nhất định, mỗi loại Quinolone khác nhau sẽ có đích tác dụng chính khác nhau.
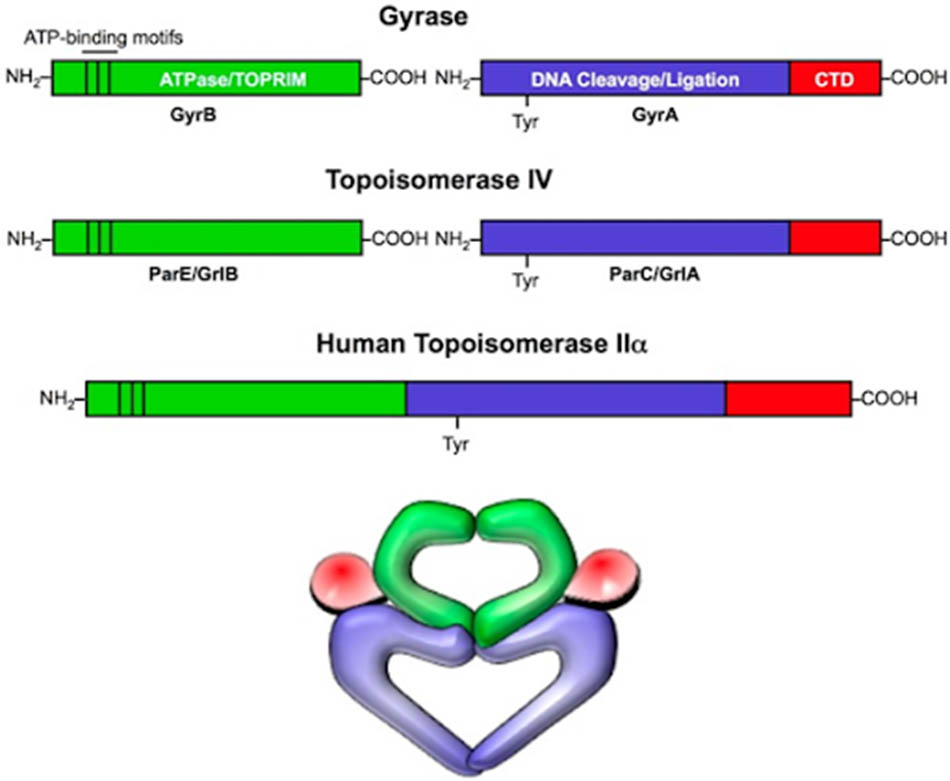
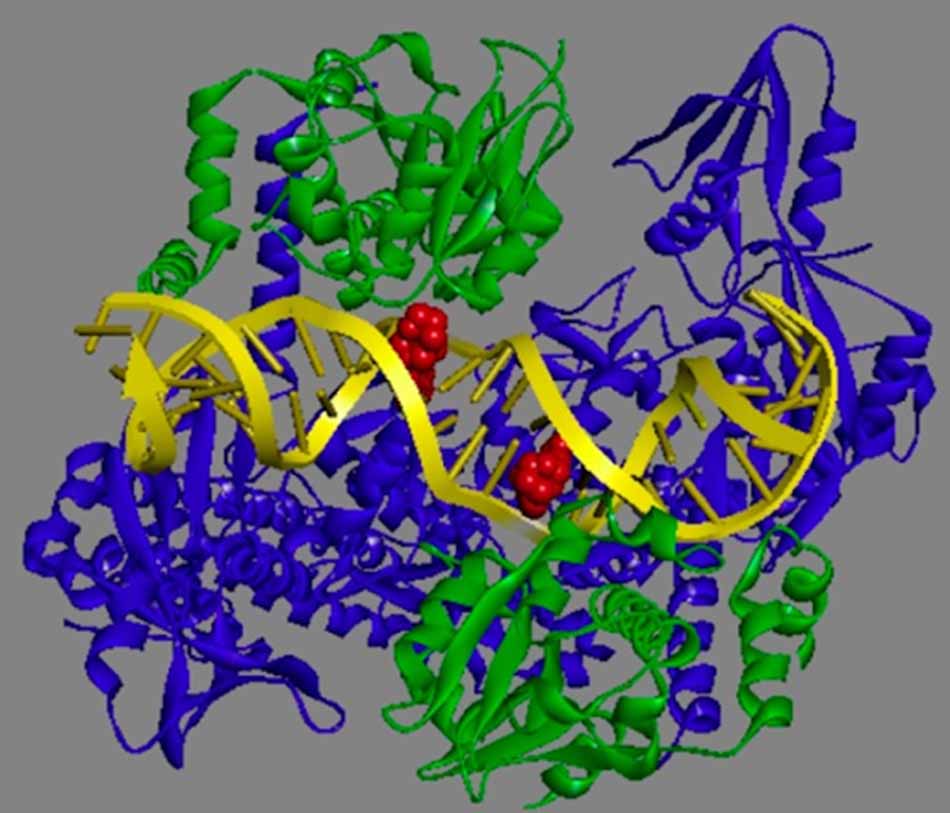
Mô tả: DNA gyrase và DNA topoisomerase IV bao gồm hai tiểu đơn vị A và hai tiểu đơn vị B. Các tiểu đơn vị A có màu xanh dương và đỏ, đó là phần GyrA ở DNA gyrase và phần ParC (vi khuẩn gram âm) hoặc GrlA (vi khuẩn gram dương) ở DNA topoisomerase IV. Chúng chứa gốc tyrosine ở vị trí hoạt động có khả năng liên kết cộng hóa trị với đầu 5’ mới được sinh ra sau phản ứng cắt DNA. Các tiểu đơn vị B có màu xanh lá cây, đó là phần GyrB ở DNA gyrase và ParE (vi khuẩn gram âm) hoặc GrlB (vi khuẩn gram dương) ở DNA topoisomerase IV. Chúng chứa ATPase và các domain TOPRIM (gắn với ion kim loại hóa trị II, cần thiết cho hoạt tính xúc tác của enzyme). Cấu trúc của DNA topoisomerase IIα ở người khá tương đồng với DNA gyrase của vi khuẩn về trình tự các amino acid, tuy nhiên ở người thì hai tiểu đơn vị A và B được nối liền với nhau tạo thành một chuỗi peptide duy nhất, vì vậy các kháng sinh nhóm Quinolone ít tác động lên enzyme này của người.
Phổ tác dụng
Phổ tác dụng của các kháng sinh nhóm Quinolone là tương tự nhau trong cùng một thế hệ. Các Quinolone được chia thành tổng cộng 4 thế hệ:
– Thế hệ 1: Đại diện là Nalidixic acid. Thế hệ này chỉ có tác dụng trên các vi khuẩn gram âm, trừ các loài Pseudomonas. Tuy nhiên, hiện tại tỷ lệ đề kháng của các kháng sinh nhóm này rất cao, vậy nên chúng rất ít được sử dụng trên lâm sàng.
– Thế hệ 2: Bắt đầu từ thế hệ này trở đi, các phân tử kháng sinh Quinolone có thêm một nguyên tử F ở vị trí C6, từ đó phổ tác dụng của chúng được mở rộng đáng kể, đồng thời hoạt tính cũng được tăng cường. Các đại diện của thế hệ này là Norfloxacin, Ofloxacin và Ciprofloxacin, tất cả đều có khả năng ức chế vi khuẩn gram âm, kể cả các loài Pseudomonas. Trong đó, Ciprofloxacin là kháng sinh nhóm Quinolone có hoạt tính mạnh nhất trên trực khuẩn mủ xanh P.aeruginosa. Hoạt tính của các kháng sinh thế hệ này trên cầu khuẩn gram dương cũng khá tốt, đặc biệt là tụ cầu Staphylococcus, nhưng hiệu lực không chắc chắn trên phế cầu Streptococcus pneumoniae.
– Thế hệ 3: Với đại diện là Levofloxacin, các kháng sinh nhóm Quinolone từ thế hệ 3 trở đi còn được gọi là “Quinolone hô hấp” bởi chúng có tác dụng tốt trên các vi khuẩn thường gây nhiễm trùng hô hấp: Liên cầu tan huyết β nhóm A S.pyogenes, S.pneumoniae (bao gồm cả các chủng đã kháng Penicillin), Haemophilus influenzae, Moraxella catarrhalis và các vi khuẩn không điển hình Mycoplasma pneumoniae, Chlamydia pneumoniae, Legionella pneumophila (thực chất là vi khuẩn gram âm nhưng có những tính chất như vi khuẩn không điển hình). Chúng có hoạt tính trên các vi khuẩn gram dương tốt hơn thế hệ 2 nhưng hoạt tính trên các vi khuẩn gram âm lại giảm đi. Hoạt tính trên Pseudomonas vẫn còn nhưng không mạnh bằng Ciprofloxacin.
– Thế hệ 4: Với các đại diện là Gatifloxacin, Moxifloxacin và Delafloxacin. Các kháng sinh thế hệ 4 có hoạt tính trên vi khuẩn gram dương mạnh hơn thế hệ 3, đặc biệt Delafloxacin còn có tác dụng trên tụ cầu vàng kháng Methicillin (MRSA: Methicillin-Resistant Staphylococcus aureus), cộng với đó, chúng còn có thêm tác dụng trên các vi khuẩn kỵ khí. Chúng không chỉ được kê đơn trong các nhiễm khuẩn hô hấp, mà còn được sử dụng trong các nhiễm trùng ở vị trí có nguy cơ cao nhiễm vi khuẩn kỵ khí như nhiễm trùng ổ bụng, bệnh viêm vùng chậu… Tuy nhiên, hoạt tính của các kháng sinh nhóm này trên vi khuẩn gram âm lại kém đi so với thế hệ 3 và chúng không có tác dụng trên Pseudomonas.
Một số tài liệu khác có thể xếp Gatifloxacin và Moxifloxacin vào Quinolone thế hệ 3, còn thế hệ 4 bao gồm hai kháng sinh là Trovafloxacin và Alatrofloxacin. Đây là hai Quinolone phổ rộng có hoạt lực mạnh, có khả năng chống lại nhiều chủng vi khuẩn đã đề kháng với các Quinolone thế hệ trước. Tuy nhiên, cả hai kháng sinh này đều đã bị rút khỏi thị trường tháng 6/2006, vậy nên chúng sẽ không được tính trong bài viết này.
Cơ chế đề kháng
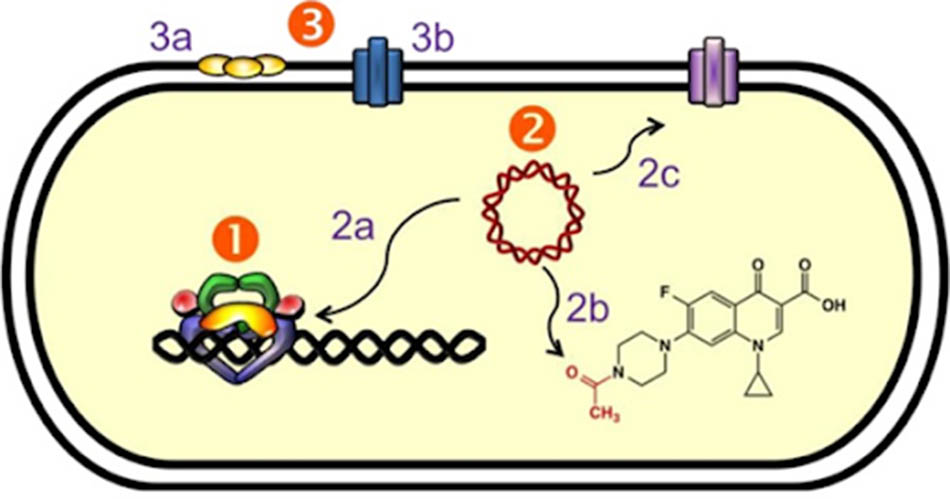
Mô tả: (1) Đề kháng qua trung gian đích tác dụng do đột biến làm thay đổi cấu trúc của DNA gyrase hoặc DNA topoisomerase IV. (2) Đề kháng qua trung gian plasmid: (2a) Protein Qnr bảo vệ phức hợp DNA – topoisomerase khỏi sự tấn công của Quinolone, (2b) Một biến thể của Aminoglycoside acetyltransferase có tên gọi Aac(6′)-Ib-cr có khả năng acetyl hóa nguyên tử N tự do trên vòng piperazine gắn vào C7 của Norfloxacin và Ciprofloxacin, (2c) Bơm tống thuốc đẩy phân tử kháng sinh ra khỏi bào tương trước khi nó kịp ức chế hai enzyme của vi khuẩn. (3) Đề kháng qua trung gian nhiễm sắc thể: (3a) Giảm biểu hiện các kênh porin ở màng ngoài tế bào vi khuẩn gram âm, (3b) Biểu hiện quá mức các bơm tống thuốc.
– Thay đổi đích tác dụng: Có hai cách để vi khuẩn thực hiện điều này. Cách 1 là đột biến gen ở DNA quy định tổng hợp hai enzyme đích mà kháng sinh tấn công. Điều này làm giảm ái lực gắn của phân tử kháng sinh với hai enzyme đích này. Nếu một enzyme bị đột biến, mức độ đề kháng tăng lên không quá 10 lần, nếu hai enzyme bị đột biến, mức độ đề kháng tăng lên 10-100 lần. Vị trí đột biến phổ biến nhất là vị trí mà kháng sinh tương tác trực tiếp với đích tác dụng. Đột biến ở gốc amino acid Ser phổ biến hơn so với đột biến vị trí còn lại do đột biến này ít ảnh hưởng đến hoạt tính enzyme của vi khuẩn (trong khi đột biến ở phần còn lại làm giảm hoạt tính enzyme 5-10 lần). Cách 2 là thông qua bảo vệ hai enzyme đích mà kháng sinh tấn công bằng protein (Qnr). Protein này được mã hóa trên plasmid của vi khuẩn và gen mã hóa có khả năng truyền từ vi khuẩn này cho vi khuẩn khác.
– Enzyme bất hoạt thuốc: Nhìn chung phân tử kháng sinh Quinolone khá bền vững về mặt hóa học. Hiện tại chưa phát hiện ra một enzyme chính thức nào do vi khuẩn tạo ra để chống lại chỉ riêng Quinolone, nhưng một số enzyme được tạo ra để bất hoạt kháng sinh nhóm khác, mà cụ thể ở đây là một biến thể của Aminoglycoside acetyltransferase (chứa hai đột biến điểm W102R và D179Y) có tên gọi Aac(6′)-Ib-cr được tạo ra để bất hoạt Aminoglycoside, nhưng lại “vô tình” có cả khả năng làm giảm hoạt tính của Norfloxacin và Ciprofloxacin thông qua acetyl hóa nguyên tử N tự do trên vòng piperazine gắn vào C7. Enzyme này được mã hóa trên plasmid và gen mã hóa cũng có khả năng truyền từ vi khuẩn này cho vi khuẩn khác.
– Bơm tống thuốc (Efflux Pump): Đây là các protein xuyên màng hoạt động như một bơm tống, hoạt động nhờ ATP. Vai trò của các bơm này là đảm bảo đẩy kháng sinh ra khỏi tế bào chất trước khi kháng sinh kịp thực hiện tác dụng của nó. Các bơm tống thuốc có thể được mã hóa qua trung gian plasmid hoặc nhiễm sắc thể. Ba loại bơm đã được phát hiện mã hóa qua trung gian plasmid là OqxAB (chủ yếu tìm thấy trong các vi khuẩn gây bệnh ở động vật), QepA1 và QepA2 (chủ yếu tìm thấy trong các vi khuẩn gây bệnh ở người). Gen mã hóa trên plasmid có thể được truyền cho vi khuẩn khác.
– Giảm tính thấm màng tế bào với kháng sinh: Thông qua sự điều hòa xuống biểu hiện các kênh porin (thậm chí là xóa bỏ hoàn toàn) trên màng ngoài của tế bào vi khuẩn gram âm – đường đi vào trong tế bào của kháng sinh Quinolone, nồng độ kháng sinh trong bào tương không đủ để ức chế hai enzyme đích của chúng. Cơ chế này do gen trên nhiễm sắc thể quy định.
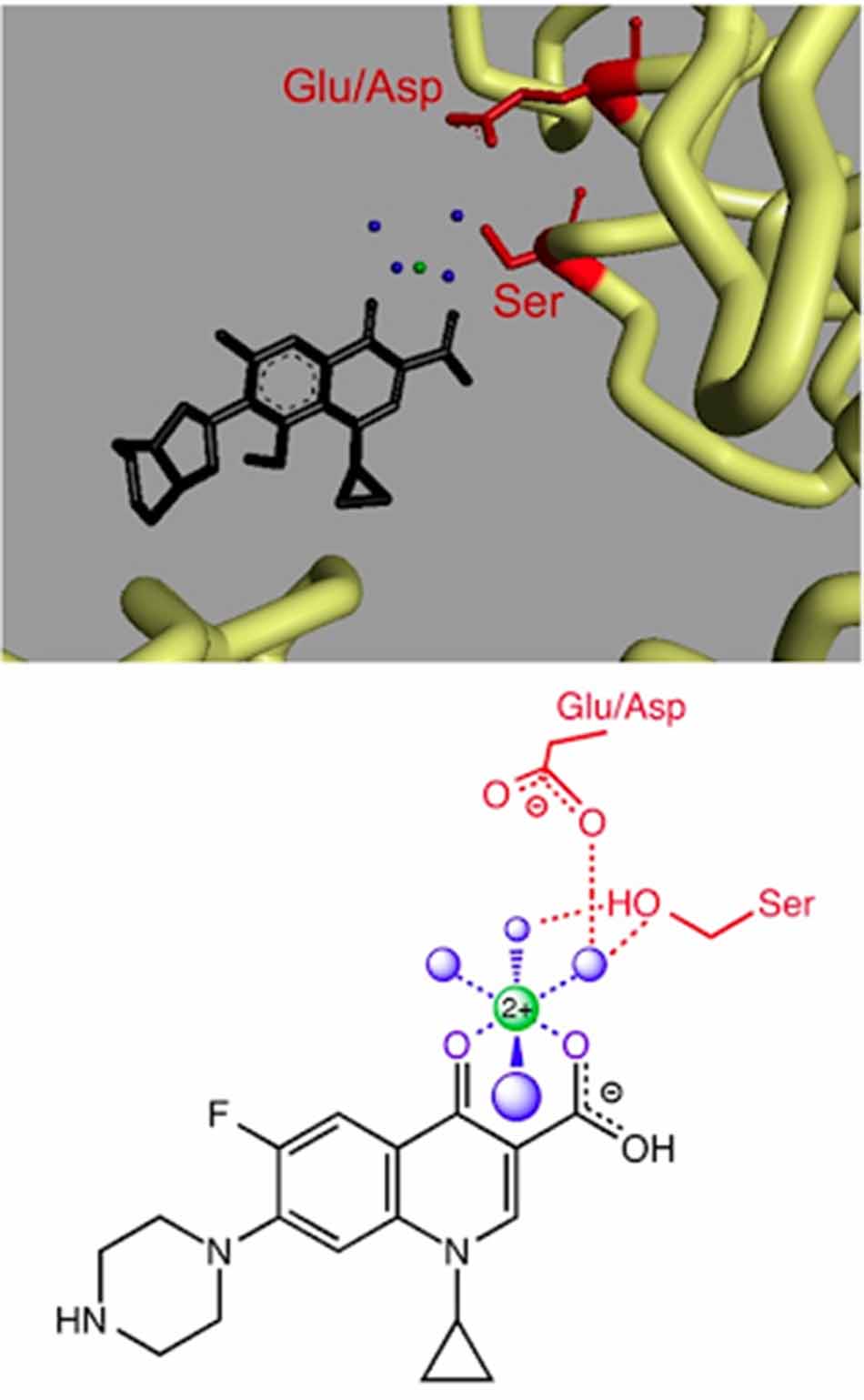
Hầu hết các cơ chế đề kháng kháng sinh nhóm Quinolone quan trọng nhất của vi khuẩn trên lâm sàng là thông qua cơ chế phá vỡ liên kết phối trí giữa ion kim loại và nước. Hiện tại các nhà khoa học đang nỗ lực tìm ra các loại thuốc mới có cấu trúc hóa học tương tự như Quinolone, cũng có khả năng ức chế DNA gyrase và DNA topoisomerase IV tương tự như Quinolone nhưng không phụ thuộc vào liên kết phối trí giữa ion kim loại với nước. Một nhóm hợp chất tiềm năng như vậy đang được nghiên cứu, đó là các Quinazolinedione. Quinazolinedione có cấu trúc hóa học khá tương đồng với các Quinolone, nhưng thiếu nhóm keto acid nên không có khả năng tạo phức với ion kim loại. Hoạt tính của chúng trên các enzyme DNA gyrase và DNA topoisomerase IV thường giữ nguyên hoặc thậm chí có thể tăng lên, với khả năng chống lại các vi khuẩn đề kháng Quinolone theo cơ chế đột biến thay đổi vị trí tương tác giữa đích tác dụng với kháng sinh.
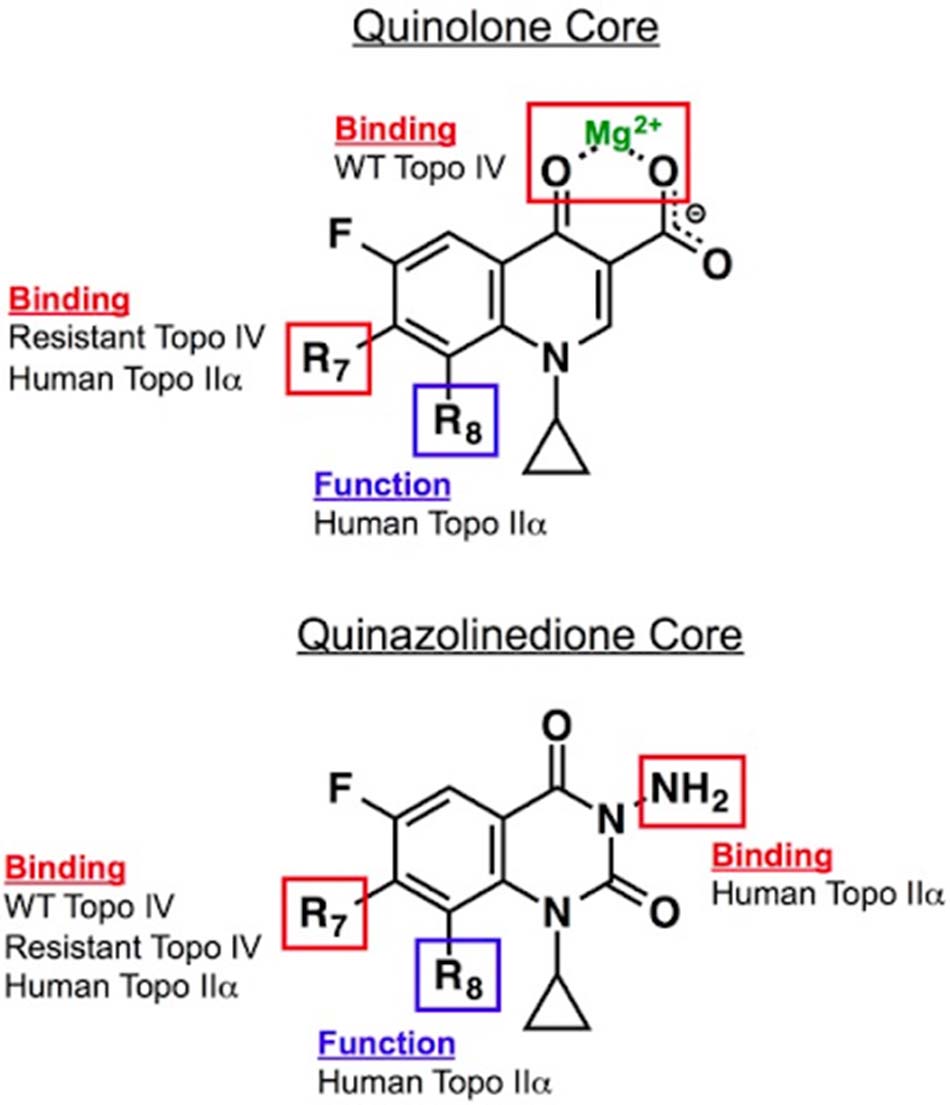
Mô tả: Một số nghiên cứu gần đây đã chỉ ra một số Quinazolinedione có hoạt tính ức chế DNA gyrase cao là nhờ nhóm thế 3′-(aminomethyl)pyrrolidinyl (hoặc một số nhóm thế liên quan khác) trên C7. Tuy nhiên, cũng chính nhóm thế này tạo ra tác dụng ức chế DNA topoisomerase IIα của người.
Dược động học
Hấp thu: Các kháng sinh Quinolone thế hệ 3 và 4 có sinh khả dụng đường uống tốt, nhiều thuốc có liều dùng đường tiêm và uống tương đương. Ciprofloxacin (Quinolone thế hệ 2) có sinh khả dụng thấp hơn một chút so với các thế hệ sau. Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) thường chỉ nằm trong khoảng 1-2 giờ.
Phân bố: Thể tích phân bố (Vd) của các thuốc thế hệ 3 và 4 thường cao hơn các thế hệ 1 và 2. Các kháng sinh nhóm này phân bố tốt vào mô và các dịch trong cơ thể. Đặc biệt thuốc thấm tốt vào tuyến tiền liệt, đây vốn là vị trí khó thấm với nhiều kháng sinh khác. Các Quinolone qua được hàng rào máu não với tỷ lệ nhỏ và tỷ lệ này tăng lên khi màng não bị viêm. Chúng cũng qua được hàng rào nhau thai và sữa mẹ.
Chuyển hóa: Nhiều kháng sinh trong nhóm không bị chuyển hóa, một số trường hợp khác đặc biệt hơn như Ciprofloxacin được chuyển hóa qua CYP1A2 (đồng thời cũng ức chế enzyme này), Moxifloxacin được chuyển hóa thông qua liên hợp glucuronide và sulfate ở gan.
Thải trừ: Các kháng sinh trong nhóm này có những con đường thải trừ khác nhau. Levofloxacin được thải trừ qua phân rất ít, trong khi Ciprofloxacin và Moxifloxacin có tỷ lệ thải trừ qua phân cao hơn.
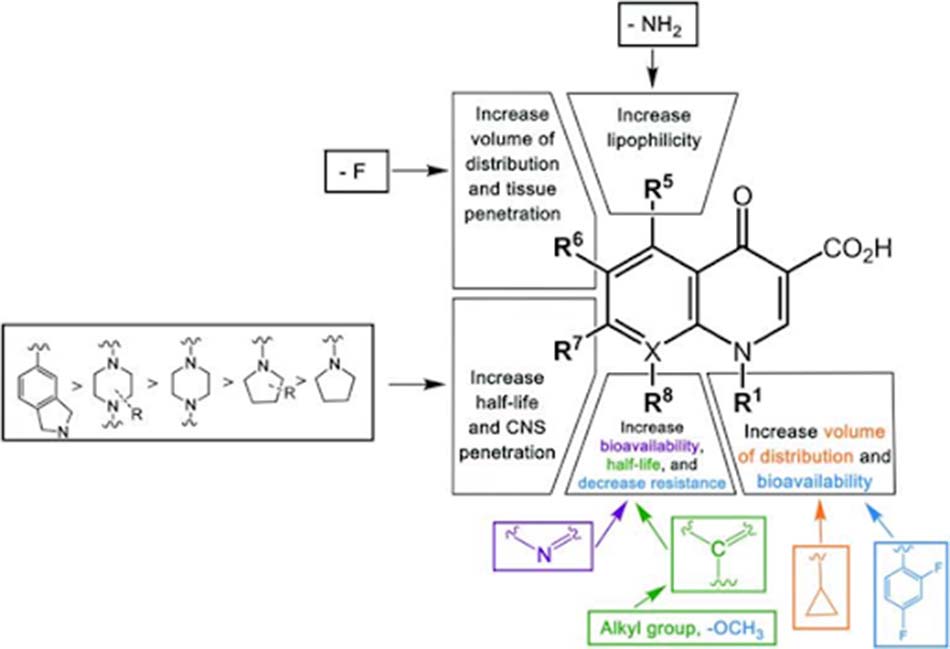
Nhóm thế R1: Nhóm cyclopropyl làm tăng thể tích phân bố, trong khi nhóm 2,4-difluorophenyl làm tăng sinh khả dụng đường uống; Nhóm thế R5: Nhóm amino làm tăng tính thân dầu của phân tử kháng sinh; Nhóm thể R6: Nhóm fluoro làm tăng thể tích phân bố và khả năng thâm nhập mô cũng như tế bào vi khuẩn; Nhóm thế R7: Tăng thời gian bán thải và khả năng thâm nhập vào hệ thần kinh trung ương, trong đó nhóm isoindoline-4-yl thể hiện đặc tính dược động học thuận lợi nhất, nhóm piperazine tốt hơn nhóm pyrrolidine và vòng có thế nhóm alkyl tốt hơn vòng không thế; Nhóm thế R8: X là N làm tăng sinh khả dụng, alkyl hóa ở vị trí R8 làm tăng thời gian bán thải và khả năng thấm vào mô. Đặc biệt nhóm methoxy ở vị trí này làm hạn chế khả năng xuất hiện các chủng vi khuẩn đề kháng.
Ứng dụng dược động học/dược lực học (PK/PD) trong tối ưu hóa sử dụng thuốc
Quinolone là nhóm kháng sinh có tác dụng diệt khuẩn phụ thuộc nồng độ. Hai giá trị PK/PD được sử dụng nhiều nhất để áp dụng trên lâm sàng là AUC/MIC và Cmax/MIC (AUC: diện tích dưới đường cong, MIC: nồng độ ức chế tối thiểu, Cmax: nồng độ đỉnh trong huyết tương). Ngoài ra, chúng cũng đồng thời có tác dụng hậu kháng sinh (PAE) kéo dài.
Để đạt được hiệu quả điều trị tốt, chúng ta cần tìm chế độ liều phù hợp để tăng giá trị AUC và Cmax (giá trị MIC phụ thuộc vào từng loại vi khuẩn và thường có xu hướng tăng dần theo thời gian). Trong hàng thập kỷ qua, các nhà khoa học đã tranh luận rất nhiều rằng tỷ lệ của các giá trị AUC/MIC và Cmax/MIC bằng bao nhiêu thì tối ưu. Trong một số nghiên cứu, với các Quinolone thế hệ 2, giá trị AUC/MIC sẽ phản ánh chính xác hiệu lực của kháng sinh hơn so với giá trị Cmax/MIC. Tỷ lệ AUC/MIC > 125 cho thấy sự tối ưu, và nếu tỷ lệ Cmax/MIC < 4 sẽ cho kết quả không tối ưu. Tuy nhiên, các nhà khoa học vẫn chưa thể trả lời được câu hỏi tỷ lệ AUC/MIC tối thiểu có thể chấp nhận được là bao nhiêu. Một số nhà khoa học đề xuất giá trị AUC/MIC ≥ 25 cho những bệnh nhân nhiễm trùng nhẹ và có miễn dịch bình thường, AUC/MIC ≥ 100 cho những bệnh nhân nhiễm trùng nặng và/hoặc có suy giảm miễn dịch.
Giá trị AUC/MIC sẽ quyết định kết quả vi sinh, còn giá trị Cmax/MIC lại có vai trò quyết định trong ngăn chặn sự đề kháng kháng sinh (Cmax càng cao thì khả năng xuất hiện đề kháng càng thấp). Tuy vậy, bản thân giá trị AUC/MIC cũng có thể ảnh hưởng đến khả năng xuất hiện đề kháng (AUC/MIC thấp có thể gây ra chọn lọc các chủng vi khuẩn đề kháng, ngay cả khi nó đem lại đáp ứng vi sinh tốt). Từ đây, chúng ta có khái niệm “nồng độ ngăn chặn đột biến” MPC. MPC là nồng độ kháng sinh có thể ngăn chặn sự phát triển đột biến một bước của vi khuẩn ít nhạy cảm nhất. 1010 vi khuẩn được ủ với kháng sinh ở các nồng độ tăng dần. MPC là nồng độ tối thiểu mà ở đó ức chế sự phát triển của vi khuẩn. Nếu nồng độ thuốc tối thiểu trong huyết thanh đạt được giá trị MPC, sự kháng thuốc trong quá trình điều trị sẽ không xảy ra. Giá trị MPC của các kháng sinh nhóm Quinolone thế hệ 3 và 4 trên phế cầu S.pneumoniae thấp hơn các kháng sinh thế hệ 2. Trong khi đó, trên trực khuẩn mủ xanh P.aeruginosa, MPC của Ciprofloxacin lại thấp hơn Levofloxacin.
Tác dụng và Chỉ định của kháng sinh nhóm Quinolone
Quinolone là nhóm kháng sinh có tác dụng diệt khuẩn mạnh.
Do hoạt phổ rộng, cộng với các đặc tính dược động học thuận lợi, kháng sinh nhóm này có chỉ định rất đa dạng.
Quinolone thế hệ 1: Nhiễm trùng tiết niệu không biến chứng.
Quinolone thế hệ 2: Nhiễm trùng tiết niệu, nhiễm trùng hô hấp trên và dưới (không ưu tiên bằng thế hệ 3, trừ khi đã có kết quả vi sinh xác định độ nhạy cảm của vi khuẩn), nhiễm trùng đường tiêu hóa, nhiễm trùng xương khớp, nhiễm trùng tiền liệt tuyến, nhiễm trùng ổ bụng, sốt giảm bạch cầu, nhiễm trùng da và cấu trúc da, lậu ở niệu đạo hoặc cổ tử cung, bệnh than, dịch hạch, giãn phế quản (không xơ nang)…
Quinolone thế hệ 3: Nhiễm trùng hô hấp trên và dưới, nhiễm trùng tiết niệu, bệnh than, nhiễm trùng da và cấu trúc da, nhiễm trùng tiền liệt tuyến, dịch hạch, mụn trứng cá, viêm mào tinh hoàn, nhiễm trùng phổi ở bệnh nhân xơ nang.
Quinolone thế hệ 4: Nhiễm trùng hô hấp trên và dưới, nhiễm trùng da và cấu trúc da, nhiễm trùng ổ bụng, dịch hạch gây viêm phổi và nhiễm trùng huyết.
Cách dùng – Liều dùng của kháng sinh nhóm Quinolone
Phần này sẽ giới thiệu một số Quinolone đại diện của từng thế hệ.
Thế hệ 1: Nalidixic acid.
– Nhiễm trùng tiết niệu không biến chứng: 1 g/lần PO (đường uống) mỗi 6 giờ trong ít nhất 7 ngày.
Thế hệ 2: Ciprofloxacin.
– Liều thông thường áp dụng cho nhiều trường hợp: 500 mg PO hoặc 400 mg IV (tĩnh mạch) mỗi 12 giờ.
– Các trường hợp nặng hơn hoặc vi khuẩn giảm nhạy cảm, liều sẽ được tăng lên thành 750 mg PO mỗi 12 giờ hoặc 400 mg IV mỗi 8 giờ.
– Một số trường hợp nhẹ có thể chỉ cần mức liều thấp: 250 mg PO mỗi 12 giờ hoặc 200 mg IV mỗi 12 giờ.
Thời gian điều trị tùy từng loại nhiễm trùng, phổ biến là 7-14 ngày với các nhiễm trùng thông thường, 4-6 tuần với nhiễm trùng xương – khớp, 28 ngày với nhiễm trùng tiền liệt tuyến, 60 ngày với bệnh than, chỉ 3 ngày với nhiễm trùng tiết niệu dưới không biến chứng và 1 lần duy nhất với bệnh lậu.
Thế hệ 3: Levofloxacin.
– Liều thông thường áp dụng cho nhiều trường hợp: 750 mg PO/IV mỗi 24 giờ hoặc 500 mg PO/IV mỗi 12 giờ (liều phổ biến trước đây 500 mg PO/IV mỗi 24 giờ đã trở nên kém hiệu quả và chỉ sử dụng trong các trường hợp khá nhẹ).
– Một số trường hợp nhẹ có thể chỉ cần mức liều thấp: 250 mg PO/IV mỗi 24 giờ.
Thời gian điều trị tương tự như Ciprofloxacin.
Thế hệ 4: Moxifloxacin.
– Liều thông thường áp dụng cho nhiều trường hợp: 400 mg PO/IV mỗi 24 giờ.
Thời gian điều trị tương tự như Ciprofloxacin.
Tác dụng không mong muốn
Rối loạn tiêu hóa: Buồn nôn và nôn, tiêu chảy, viêm đại tràng giả mạc do Clostridium difficile.
Cơ – xương – khớp: Đau khớp, đau cơ, yếu cơ, viêm gân, đứt gân, đặc biệt là gân Achilles, hủy sụn.
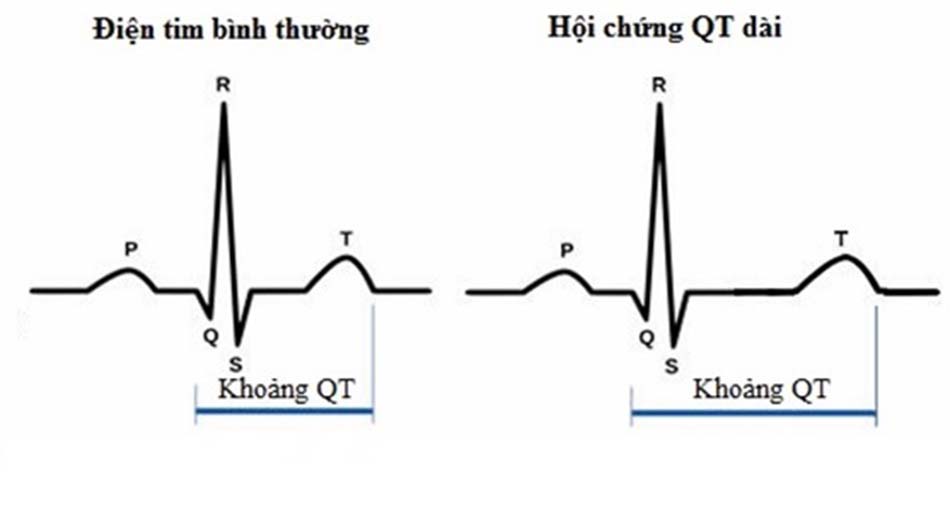
Tim mạch: Kéo dài khoảng QT trên điện tâm đồ (ECG), tăng nguy cơ xoắn đỉnh, rung thất và ngừng tim. Đặc biệt là phình tách động mạch chủ là tác dụng bất lợi mới đây được Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) Hoa Kỳ đưa vào hồ sơ an toàn của Quinolone năm 2018.
Quang độc tính: Tổn thương da khi tiếp xúc với ánh sáng mặt trời.
Thần kinh trung ương: Đau đầu, chóng mặt, lú lẫn, căng thẳng, mất ngủ, hoang tưởng, ảo giác, co giật, tăng áp lực nội sọ, rối loạn tâm thần nhiễm độc, có ý nghĩ tự sát, nhìn thấy người đã chết.
Bệnh lý thần kinh ngoại biên.
Huyết học: Giảm tiểu cầu, thiếu máu tan máu ở bệnh nhân thiếu G6PD.
Hạ đường huyết. Đây cũng là tác dụng bất lợi mới được FDA Hoa Kỳ đưa vào hồ sơ an toàn của Quinolone năm 2018.
Phản ứng phản vệ.
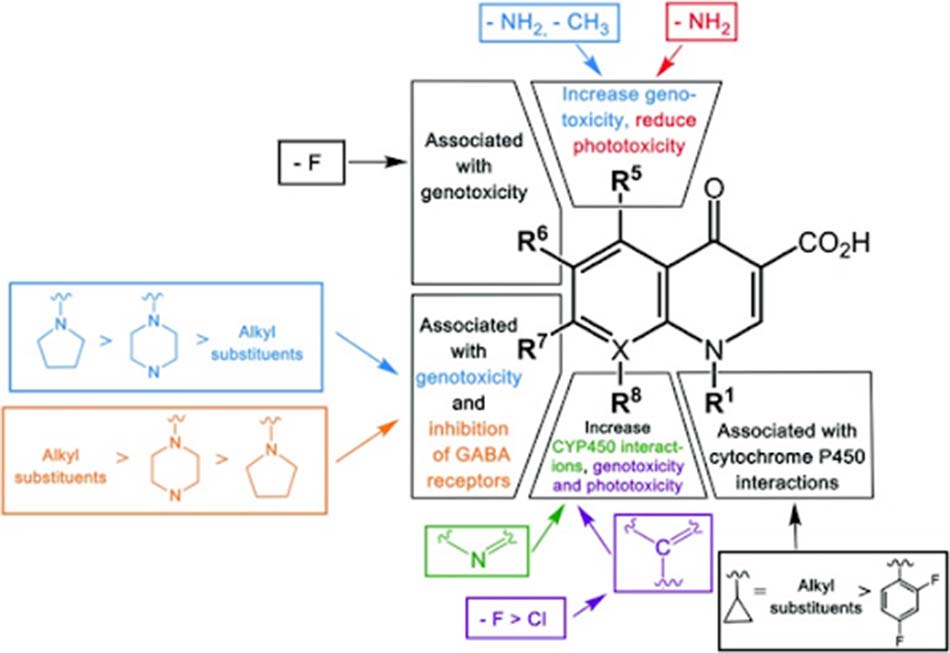
Mô tả: Nhóm thế R1: Liên quan đến khả năng ức chế CYP450 của gan, trong đố nhóm alkyl hoặc cyclopropyl tạo ra tác dụng ức chế CYP450 mạnh hơn nhóm 2,4-difluorophenyl; Nhóm thế R5: Nhóm amino làm tăng độc tính trên hệ gen nhưng làm giảm quang độc tính, nhóm methyl làm tăng độc tính trên hệ gen; Nhóm thế R6: Fluoro liên quan đến độc tính trên hệ gen; Nhóm thế R7: Liên quan đến độc tính trên hệ gen và ức chế thụ thể GABA (các mức độ được sắp xếp như trên hình vẽ); Nhóm thế R8: X là N làm tăng tương tác với CYP450 của gan, X là C làm tăng độc tính trên hệ gen và quang độc tính (F > Cl).
Chống chỉ định sử dụng kháng sinh nhóm Quinolone
Quá mẫn cảm với bất cứ thành phần nào của thuốc.
Chống chỉ định tương đối cho trẻ em < 16 tuổi, phụ nữ có thai và đang cho con bú.
Tương tác thuốc
Phối hợp với các thuốc có khả năng gây kéo dài khoảng QT (Amiodarone, Loperamide, Azithromycin…): Tăng nguy cơ gặp phải kéo dài khoảng QT. Những phối hợp như thế này nhìn chung nên tránh trên lâm sàng, trừ trường hợp bắt buộc.
Phối hợp với các thuốc chứa ion kim loại hóa trị II, III (các thuốc kháng acid dạ dày, chế phẩm bổ sung sắt…) hoặc sữa (chứa calci): Sử dụng các Quinolone đường uống đồng thời với các chế phẩm này làm giảm nghiêm trọng hấp thu của thuốc do sự hình thành phức chelate với các ion kim loại. Cần sử dụng kháng sinh Quinolone cách xa các chế phẩm này, thông thường là trước 2 giờ hoặc sau 4-6 giờ sau khi sử dụng chúng.
Phối hợp với thuốc cảm ứng hoặc ức chế CYP1A2: Điều này có thể làm giảm hoặc tăng nồng độ Ciprofloxacin trong huyết tương, tương ứng làm giảm tác dụng hoặc tăng độc tính của thuốc. Ngoài ra, nếu phối hợp với thuốc khác cũng là cơ chất của CYP1A2, Ciprofloxacin có thể ức chế chuyển hóa thuốc phối hợp cùng, làm tăng nồng độ thuốc đó trong huyết tương và tăng nguy cơ gặp độc tính của thuốc đó.
Phối hợp với một số vaccin sống giảm độc như vaccin phòng lao BCG, vaccin tả và vaccin thương hàn: Tránh phối hợp này do đối kháng về dược lực học.
Lưu ý và thận trọng khi sử dụng thuốc
Các tác dụng không mong muốn sau đây có thể không hồi phục: Viêm gân, đứt gân, bệnh lý thần kinh ngoại biên và rối loạn thần kinh trung ương. Nếu bệnh nhân gặp phải bất kỳ tác dụng không mong muốn nào trong số này trong quá trình điều trị bằng Fluoroquinolone, nên ngừng thuốc ngay lập tức và tránh sử dụng lại.
Các Fluoroquinolone có thể làm nặng thêm tình trạng yếu cơ ở bệnh nhân nhược cơ, vậy nên không sử dụng kháng sinh nhóm này cho những bệnh nhân nhược cơ hoặc có tiền sử nhược cơ.
Do có khả năng gây ra các tác dụng không mong muốn nghiêm trọng, các chỉ định sau đây của Fluoroquinolone chỉ áp dụng khi không có kháng sinh nhóm nào khác tốt hơn: Viêm mũi xoang cấp và đợt cấp của viêm phế quản mạn tính (có nguyên nhân là vi khuẩn).
Đánh giá định ký chức năng một số hệ cơ quan khi phải sử dụng kháng sinh nhóm này kéo dài (chức năng gan, thận, hệ tạo máu…).
Cũng như bất kỳ nhóm kháng sinh nào khác, việc sử dụng các kháng sinh nhóm này thường xuyên và kéo dài có thể gây ra bội nhiễm vi khuẩn hoặc nấm.
Tránh tiếp xúc với ánh sáng mặt trời quá nhiều trong quá trình dùng kháng sinh.
Hạ đường huyết có thể xảy ra ở cả những bệnh nhân không có tiền sử hạ đường huyết, thậm chí có thể gây tử vong. Tác dụng không mong muốn này gặp nhiều ở Gatifloxacin đường toàn thân. Cần theo dõi thận trọng nồng độ glucose huyết ở bệnh nhân đái tháo đường. Nếu có hạ đường huyết, cần ngừng kháng sinh ngay lập tức và điều trị thích hợp.
Tránh sử dụng các kháng sinh nhóm này ở những bệnh nhân bị kéo dài khoảng QT hoặc đang sử dụng thuốc khác cũng có nguy cơ gây kéo dài khoảng QT.
Các Fluoroquinolone cho thấy khả năng phá hủy sụn ở động vật còn non.
Viêm đại tràng giả mạc do C.difficile: Đây là một tình trạng nguy hiểm và có thể đe dọa tính mạng, cần ngừng các kháng sinh đang sử dụng ngay khi phát hiện ra tình trạng này và điều trị bằng kháng sinh khác thích hợp (Metronidazole, Vancomycin đường uống hoặc Fidaxomicin), kết hợp với bổ sung nước và điện giải, phẫu thuật nếu cần.
Phản ứng phản vệ với các kháng sinh nhóm này tuy hiếm gặp nhưng nguy hiểm, cần ngừng thuốc ngay lập tức khi phát hiện phát ban da hoặc bất cứ dấu hiệu nào của phản ứng quá mẫn.
Thận trọng khi sử dụng các kháng sinh nhóm này cho những bệnh nhân động kinh hoặc rối loạn thần kinh trung ương có thể gây co giật hoặc làm giảm ngưỡng co giật, hoặc khi bệnh nhân có các yếu tố nguy cơ có thể gây co giật hoặc làm giảm ngưỡng co giật.
Chỉ sử dụng các kháng sinh nhóm này theo đường toàn thân cho những bệnh nhân phình động mạch chủ hoặc có nguy cơ phình động mạch chủ khi không có kháng sinh nào tốt hơn. Ngừng điều trị bằng kháng sinh nhóm này ngay lập tức nếu bệnh nhân gặp phải tác dụng phụ nghi ngờ là phình tách động mạch chủ, đồng thời đánh giá và điều trị kịp thời nếu cần.
Sử dụng thuốc trên đối tượng đặc biệt
Người suy giảm chức năng gan thận: Cần thận trọng do đây là các con đường thải trừ chính của kháng sinh. Tùy mức độ thải trừ của từng loại kháng sinh qua các cơ quan khác nhau cũng như mức độ nặng của bệnh mà cần có hiệu chỉnh liều cho phù hợp.
Người già và trẻ em: Cần thận trọng do đây là các đối tượng có chức năng gan thận suy giảm hoặc chưa hoàn chỉnh, đồng thời lại có nguy cơ tổn thương cao do nhiều tác dụng không mong muốn của nhóm Quinolone, cần hiệu chỉnh liều cho phù hợp với chức năng tạng của bệnh nhân cũng như phù hợp với từng loại thuốc.
Phụ nữ có thai và cho con bú: Chỉ sử dụng khi thật sự cần thiết và không còn lựa chọn nào khác tốt hơn.
Một số nghiên cứu và thử nghiệm lâm sàng
Thử nghiệm lâm sàng đối chứng ngẫu nhiên pha III mù đôi, đa trung tâm so sánh hiệu lực và an toàn của Delafloxacin với Vancomycin kết hợp Aztreonam trong điều trị nhiễm trùng da và cấu trúc da cấp tính do vi khuẩn cho kết luận: Ở những đối tượng bệnh nhân này, Delafloxacin IV/PO đơn trị liệu không thua kém Vancomycin kết hợp với Aztreonam IV về cả đáp ứng mục tiêu cũng như đáp ứng được đánh giá bởi điều tra viên ở thời điểm tái khám và tái khám muộn, đồng thời được dung nạp tốt hơn.
Thử nghiệm lâm sàng pha III DEFINE-CABP so sánh Delafloxacin với Moxifloxacin trong điều trị viêm phổi cộng đồng ở người trưởng thành cho kết luận: Delafloxacin IV/PO đơn trị liệu có hiệu quả và dung nạp tốt trong điều trị viêm phổi cộng đồng ở người trưởng thành.
Tài liệu tham khảo
Aldred, K. J., Kerns, R. J., & Osheroff, N. (2014). “Mechanism of Quinolone Action and Resistance”. Biochemistry, 53(10), 1565–1574.
Link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3985860/
Pham, T. D. M., Ziora, Z., & Blaskovich, M. (2019). “Quinolone Antibiotics”. MedChemComm, 10(10), 1719–1739.
Link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6836748/
O’Riordan W, McManus A, Teras J, Poromanski I, Cruz-Saldariagga M, Quintas M, Lawrence L, Liang S, Cammarata S; PROCEED Study Group. “A Comparison of the Efficacy and Safety of Intravenous Followed by Oral Delafloxacin With Vancomycin Plus Aztreonam for the Treatment of Acute Bacterial Skin and Skin Structure Infections: A Phase 3, Multinational, Double-Blind, Randomized Study”. Clin Infect Dis. 2018 Aug 16; 67(5): 657-666.
Link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6093995/
Juan P Horcajada, Robert A Salata, Rodolfo Álvarez-Sala, Floarea Mimi Nitu, Laura Lawrence, Megan Quintas, Chun-Yen Cheng, Sue Cammarata, “A Phase 3 Study to Compare Delafloxacin With Moxifloxacin for the Treatment of Adults With Community-Acquired Bacterial Pneumonia (DEFINE-CABP)”, Open Forum Infectious Diseases, Volume 7, Issue 1, January 2020, ofz514.
Link: https://academic.oup.com/ofid/article/7/1/ofz514/5658592
Tham khảo thêm: