Tác giả: Bác sĩ Hồ Hoàng Kim – ICU bệnh viện Nguyễn Tri Phương.
Tóm tắt các điểm chính:
1. Bệnh nguy kịch có thể kích hoạt phản ứng căng thẳng chuyển hóa quá mức, dẫn đến dị hóa không kiểm soát được, đỉnh điểm là thiếu hụt calo, ly giải protein và kháng đồng hóa.
2. Hỗ trợ dinh dưỡng đã phát triển thành “liệu pháp” dinh dưỡng, trong đó một loại thuốc tăng nhu động được cung cấp qua đường ruột để duy trì tính toàn vẹn của ruột, giảm viêm và bảo vệ miễn dịch đường ruột.
3. Do thiếu định nghĩa đồng thuận về suy dinh dưỡng, số lượng và thời điểm của liệu pháp hỗ trợ dinh dưỡng có thể được hướng dẫn bằng cách xác định “nguy cơ dinh dưỡng”, nguy cơ này có thể dẫn đến kết cục kém do không đủ dinh dưỡng.
4. Điểm NUTRIC và NRS-2002 có thể được sử dụng để xác định nguy cơ dinh dưỡng ở bệnh nhân nặng người lớn.
5. Bệnh nhân người lớn mắc bệnh nguy kịch được xem là có nguy cơ dinh dưỡng cao có thể được hưởng lợi từ liệu pháp hỗ trợ dinh dưỡng sớm và tích cực.
6. Trong trường hợp không có chống chỉ định, dinh dưỡng đường ruột được ưu tiên hơn so với đường tĩnh mạch.
7. Làm thế nào để nhanh chóng nâng cao dinh dưỡng đường ruột sau khi bắt đầu liệu pháp dinh dưỡng là chưa được biết rõ. Sự đóng góp của dinh dưỡng đường ruột vào tăng đường huyết, dung nạp, và nguy cơ hội chứng sau nuôi dưỡng lại nên được xem xét khi điều chỉnh dinh dưỡng đường ruột hướng tới đạt mục tiêu.
8. Dữ liệu gần đây cho thấy dinh dưỡng tĩnh mạch là một sự thay thế an toàn và khả thi khi dinh dưỡng sớm đường ruột bị chống chỉ định hoặc không dung nạp.
9. Sống sót của chăm sóc tích cực đã được cải thiện trong 30 năm qua. Hậu quả là những người sống sót bị mất khối cơ dẫn đến giảm chức năng thể chất và chất lượng cuộc sống. Do đó, tối ưu hóa protein có thể có giá trị lớn hơn so với tổng lượng calo. Dữ liệu quan sát cho thấy protein ở liều ≥1.2 g/kg/ngày có liên quan đến cải thiện kết cục ICU.
10. Các bác sĩ nên biết về những rào cản liên quan đến từng bệnh nhân, nhà cung cấp dịch vụ, quy trình của nơi điều trị trong việc cung cấp và tối ưu hóa liệu pháp hỗ trợ dinh dưỡng.
Nghiên cứu trường hợp
Một bệnh nhân nam 75 tuổi có tiền sử đái tháo đường, tăng huyết áp và nghiện rượu được vợ đưa đến khoa cấp cứu vì 3 ngày qua bị khó thở, khạc đàm và sốt. Lần sử dụng rượu cuối cùng là 3 ngày trước.
Đánh giá toàn thân phát hiện giảm 9 kg cân nặng trong 2 tháng qua do ăn uống kém. Tiền sử phẫu thuật và gia đình không đáng kể. Tiền sử xã hội, uống tới mười chai bia mỗi ngày. Không có tiền sử dùng thuốc kích thích, không đi du lịch gần đây và không bị phơi nhiễm nghề nghiệp.
Dấu hiệu sinh tồn: nhiệt độ 39°C, huyết áp 90/40 mmHg, nhịp thở 28, nhịp tim 110/phút và đều, độ bão hòa oxy 82% với khí phòng. Chỉ số khối cơ thể (BMI) là 19.8 (cao 183 cm và nặng 68 kg).
Bệnh nhân tỏ vẻ lo lắng, vả mồ hôi. Không thấy tĩnh mạch cảnh nổi. Lõm cơ hai bên thái dương. Da ấm và đỏ ửng. Mạch đập không mạnh lắm. Có ran ngáy và tiếng thở thanh quản trên nách phải. Còn lại không có gì đặc biệt.
Các xét nghiệm huyết học có ý nghĩa gồm bạch cầu tăng lên tới 20,000/μL. Sinh hóa máu có kali 2.9 mmol/L (phạm vi bình thường 3.4- 5.1 mmol/L), phosphate 1.5 mg/dL (2.5-4.5 mg/dL), magne 1.0 mg/dL (1.6-2.6 mg/dL), bicarbonate 18 mmol/L (22-29 mmol/L). Nồng độ albumin huyết thanh là 2 g/dL (3.8-5.0 g/dL).
Khí máu động mạch (ABG): pH 7.32, PCO2 40 mmHg, PO2 80 mmHg và SaO2 90% với O2 10 lít.
X-quang ngực cho thấy mờ thùy giữa phổi phải.
Chẩn đoán và quản lý ban đầu của chúng tôi
1. Suy hô hấp thiếu oxy cấp thứ phát sau viêm phổi mắc phải tại cộng đồng
a. Đặt nội khí quản cho suy hô hấp thiếu oxy cấp
2. Nhiễm khuẩn huyết thứ phát do viêm phổi mắc phải tại cộng đồng
a. Bolus dịch 30 mL/kg cho hạ huyết áp liên quan đến nhiễm khuẩn huyết
b. Nuôi cấy máu và hô hấp
c. Điều trị kháng sinh theo kinh nghiệm cho viêm phổi
3. Tổn thương thận cấp, có khả năng trước thận do hạ huyết áp
a. Điện giải niệu, creatinine, đánh giá hoại tử ống thận cấp dưới kính hiển vi
4. Nhiễm acid lactic, có thể là sự kết hợp của loại A (do hạ huyết áp) và nhiễm acid lactic loại B (do nhiễm khuẩn huyết và thiếu thiamin)
a. Hồi sức dịch
b. Thiamine tiêm tĩnh mạch
5. Lạm dụng rượu mạn tính với thiếu hụt nhiều chất điện giải
a. Theo dõi vấn đề cai rượu
b. Bổ sung magne, phosphate và kali
c. Bổ sung thiamine và acid folic
Vai trò của dinh dưỡng trong bệnh cảnh nặng là gì?
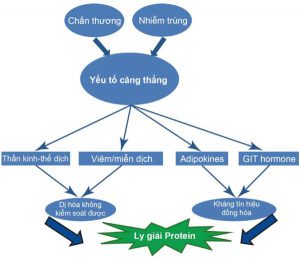
Trường hợp này nêu bật các tình trạng phổ biến (nhiễm khuẩn huyết và suy hô hấp) gây ra bệnh cảnh nguy kịch. Những tình trạng này, cùng với sốc tuần hoàn, chấn thương, bỏng, hậu phẫu, dẫn đến căng thẳng chuyển hóa [1]. Căng thẳng chuyển hóa có thể làm tăng kích hoạt thần kinh-thể dịch, miễn dịch, viêm, adipokine (hormone có nguồn gốc chất béo) và các quá trình dạ dày-ruột, có thể dẫn đến việc sử dụng cơ chất năng lượng, ly giải protein và kháng đồng hóa (Hình 1.1) [2].
Đầu tiên, quá trình dị hóa không kiểm soát được dẫn đến tích lũy thâm hụt năng lượng (calo). Sự cân bằng âm về năng lượng này có liên quan đến sự phát triển của hội chứng suy hô hấp cấp tiến triển, suy thận và loét áp lực. Thiếu hụt calo từ 4000 đến 10,000 kcal có liên quan đến suy cơ quan và thời gian nằm viện kéo dài [1, 3]. Thứ hai, các quá trình căng thẳng chuyển hóa làm tăng ly giải protein và tăng lưu hành các acid amin (AA) có nguồn gốc từ cơ. Trong một nghiên cứu, diện tích cắt ngang trực tràng-xương đùi giảm 12.5% vào ngày thứ 7 và 17% vào ngày thứ 10 ở những bệnh nhân nguy kịch [4]. Hơn nữa, bệnh nhân nguy kịch thường là bất động và cơ thường không hoạt động. Sự kết hợp của ly giải protein, kháng đồng hóa qua trung gian căng thẳng, bất động và không sử dụng cơ bắp làm tăng tốc độ mất khối cơ. Mất khối cơ nạc có liên quan đến yếu cơ, lành vết thương kém, phụ thuộc máy thở và tăng nguy cơ nhiễm khuẩn bệnh viện [5, 6]. Trong số những người sống sót sau bệnh nguy kịch, mất khối cơ có liên quan đến giảm chức năng thể chất và khả năng vận động, giảm chất lượng cuộc sống [7].
Theo truyền thống, dinh dưỡng được xem là một dạng “hỗ trợ” để giảm thiểu thiếu hụt calo. Cung cấp chất dinh dưỡng ngoại sinh qua đường ruột hoặc tĩnh mạch có thể cung cấp đủ lượng calo, vi chất dinh dưỡng, chất chống oxy hóa để phục hồi cơ chất năng lượng và duy trì cân bằng calo hàng ngày. Ngày nay, dinh dưỡng, đặc biệt là dinh dưỡng qua đường ruột (EN), được coi là một hình thức của “liệu pháp” tăng nhu động và được kê đơn [8]. Bất chấp sự thay đổi mô hình, vẫn còn rất nhiều câu hỏi xung quanh sự tối ưu về thời điểm và số lượng, đường dùng (đường ruột, đường tĩnh mạch, hoặc cả hai), và thành phần của dinh dưỡng.
Tôi nên bắt đầu bao nhiêu dinh dưỡng (nếu có)?
Bao nhiêu dinh dưỡng nên được cung cấp trong bệnh nguy kịch? Lượng dinh dưỡng sớm vẫn là một điểm gây tranh cãi. Một số chuyên gia bảo vệ quan điểm “ít hơn là nhiều hơn”, thậm chí còn đề xuất một khoảng thời gian ngắn không nuôi dưỡng trong tuần đầu tiên của bệnh nguy kịch [9]. Các chiến lược “ít hơn là nhiều hơn” khác nhau được khuyến cáo: nuôi dưỡng calo thấp là làm giảm lượng calo không protein và duy trì liều protein tối ưu (hiện được khuyến cáo ở mức 1.2-2.0 g/kg/ngày), nuôi dưỡng dưới mức chấp nhận được là cung cấp 40-60% lượng calo theo nhu cầu, và nuôi dưỡng theo dinh dưỡng là cung cấp 10-20 mL/giờ EN để đạt được các lợi ích không thuộc về dinh dưỡng [7]. Nuôi dưỡng calo thấp và dưới mức chấp nhận được đã được nghiên cứu trong quần thể bệnh nhân chăm sóc đặc biệt nói chung, trong khi nuôi dưỡng theo dinh dưỡng đã được nghiên cứu chủ yếu ở những bệnh nhân mắc hội chứng suy hô hấp cấp tiến triển.
Lập luận của việc không nuôi dưỡng là mấu chốt trong khái niệm bảo tồn chứng tự thực, phục vụ hai chức năng quan trọng. Đầu tiên là một hệ thống “giữ nhà” đối với các tế bào bị căng thẳng oxy hóa để “làm sạch” các protein mở, virus, và vi khuẩn [7]. Thứ hai là cung cấp một cơ chế sinh tồn trong đó acid amin được tái chế để tạo ra adenosine triphosphate (ATP) dành cho việc tạo năng lượng và tổng hợp protein [7]. Nuôi dưỡng được cho là để ngăn chặn chứng tự thực, tuy vậy, một số chuyên gia ủng hộ việc không nuôi dưỡng [10]. Những người phản đối cho rằng lợi ích của chứng tự thực có thể là trong phẫu thuật sớm, tối đa 24 giờ, và do đó bị hạn chế trong bối cảnh bệnh nguy kịch. Hơn nữa, trong bệnh nguy kịch nhẹ, chứng tự thực có thể có lợi. Tuy nhiên, tự thực quá mức, được quan sát thấy khi bệnh ngày càng nặng, có thể gây bất lợi, dẫn đến thoái hóa thành phần tế bào và chết tế bào [11]. Xác định điểm chuyển tiếp mà trong đó tự thực chuyển đổi từ cơ chế cân bằng nội môi sang cơ chế bệnh lý vẫn còn là vấn đề.
Năm nghiên cứu quan sát [12-16] và ba thử nghiệm ngẫu nhiên có đối chứng (RCT) nhỏ [17-19] cho thấy kết cục lâm sàng khác nhau khi nuôi dưỡng dưới mức được so sánh với nuôi dưỡng đầy đủ ở bệnh nhân nguy kịch. Trong số này, hai RCT cho thấy việc nuôi dưỡng dưới mức có tỷ lệ tử vong thấp hơn nuôi dưỡng đầy đủ [17, 18]. Một RCT cho thấy kết cục tệ hơn (nhiễm khuẩn bệnh viện nhiều hơn) khi nuôi dưỡng dưới mức [19]. Những nghiên cứu này bị giới hạn về phương pháp và những suy luận rút ra từ các nghiên cứu (đa số là quan sát) nên được thực hiện một cách thận trọng.
Bốn RCT đã cho thấy không có sự khác biệt về kết cục giữa EN theo dinh dưỡng so với EN đầy đủ, EN calo thấp so với EN đầy đủ, và nuôi dưỡng dưới mức so với EN đầy đủ [20-23].
Rõ ràng, không có hai bệnh nhân ICU giống nhau. Ví dụ, trực giác cho thấy một bệnh nhân cao tuổi bị suy dinh dưỡng từ trước do nhiều bệnh đi kèm nhập vào vì suy hô hấp phải thở máy sẽ cần dinh dưỡng cao hơn so với một vận động viên trẻ nhập vào sau tai nạn ô tô. Xác định bệnh nhân nào sẽ được hưởng lợi từ một chế độ dinh dưỡng tích cực là rất quan trọng. Tất cả các nghiên cứu đã nói ở trên không xác định bệnh nhân nào sẽ được hưởng lợi từ việc cung cấp dinh dưỡng lớn hơn. Dựa trên sự đồng thuận của chuyên gia, hướng dẫn hỗ trợ dinh dưỡng năm 2016 của ASPEN và SCCM khuyến cáo xác định bệnh nhân ICU nào sẽ được hưởng lợi từ liệu pháp dinh dưỡng bằng cách xác định nguy cơ dinh dưỡng [8].
Nguy cơ dinh dưỡng là gì?
Suy dinh dưỡng ở bệnh nhân nguy kịch là rất khó xác định, điều này dẫn đến việc tập trung vào bệnh nhân nào có nguy cơ dinh dưỡng. Nguy cơ dinh dưỡng là xác suất mắc phải các biến chứng và các dạng kết cục bất lợi khác có thể được ngăn ngừa bằng cách hỗ trợ dinh dưỡng kịp thời và đầy đủ [24]. Một cách lý tưởng, nguy cơ dinh dưỡng đánh giá cả suy dinh dưỡng từ trước và mức độ nghiêm trọng của bệnh cấp tính. Xác định nguy cơ dinh dưỡng (thấp hoặc cao) có thể giúp hướng dẫn thời điểm và sự tích cực của liệu pháp dinh dưỡng.
Làm thế nào có thể xác định các thành phần của nguy cơ dinh dưỡng? Các biến số nhân trắc học, chẳng hạn như sụt cân gần đây, lượng thức ăn gần đây, chỉ số khối cơ thể (BMI) chỉ tính đến tình trạng dinh dưỡng có từ trước và không xác định mức độ nghiêm trọng của bệnh cấp tính. Ngoài ra, các phép đo này có thể không có sẵn (ví dụ: bệnh nhân thở máy và an thần) hoặc không chính xác do sai lệch thu thập vì họ có thể tự báo cáo. Hơn nữa, “béo phì nghịch lý trong chăm sóc tích cực” có thể khiến các bác sĩ tin rằng bệnh nhân có BMI >30 kg/m2 đã cải thiện kết cục chăm sóc tích cực, so với những người có BMI <30 kg/m2 [25]. Tuy nhiên, chỉ số BMI không xác định được thành phần cơ thể, cũng không phân biệt được các kiểu hình béo phì, chẳng hạn như sarcopenic (mất khối cơ và sức mạnh cơ), có thể dự đoán nhiều hơn về kết cục. Các dấu ấn sinh học, chẳng hạn như albumin, prealbumin và transferrin, đã được sử dụng làm đại diện cho suy dinh dưỡng; tuy nhiên, quan niệm sai lầm này bắt nguồn từ những mô tả không đúng về một kiểu hình suy dinh dưỡng gọi là kwashiorkor [26]. Albumin và prealbumin không được xác nhận trong bệnh nguy kịch để dự đoán nguy cơ dinh dưỡng và nói chung, là phép đo kém của việc cung cấp đủ chất dinh dưỡng, cũng là dấu hiệu rất không đặc hiệu của suy dinh dưỡng do các đặc tính giảm trong bệnh cảnh cấp tính của chúng. Các công cụ sàng lọc, như Công cụ sàng lọc suy dinh dưỡng toàn cầu, Câu hỏi đánh giá dinh dưỡng ngắn, và Công cụ sàng lọc suy dinh dưỡng, chỉ đánh giá tình trạng dinh dưỡng mà không tính đến mức độ nghiêm trọng của bệnh cấp tính.
Trong thập kỷ qua, các hệ thống tính điểm kết hợp các biến số liên quan đến tình trạng dinh dưỡng có từ trước và bệnh cấp tính đã được phát triển để xác định nguy cơ dinh dưỡng ở bệnh nhân nguy kịch. Sàng lọc Nguy cơ Dinh dưỡng (NRS) 2002 là một trong những hệ thống tính điểm được xác nhận như vậy và xác định các thành phần của cả hai tình trạng dinh dưỡng (0-3 điểm) và mức độ nghiêm trọng của bệnh (0-3 điểm). Ngoài ra, 1 điểm được thêm vào nếu bệnh nhân lớn hơn 70 tuổi. Các điểm số này được cộng lại với nhau và nếu điểm ≥3 thì bệnh nhân có nguy cơ dinh dưỡng [27].
Gần đây hơn, Heyland và cs đã phát triển và xác nhận (trong nhiều đoàn hệ) thang điểm Nguy cơ dinh dưỡng trong Bệnh nguy kịch (NUTRIC) (Bảng 8.1) [28]. NUTRIC xác định sáu biến số, cho điểm 0 đến 2, liên quan đến nguy cơ dinh dưỡng, bao gồm tuổi tác, điểm APACHE II, điểm SOFA, số lượng bệnh đồng mắc, thời gian nằm viện trước nhập ICU, và nồng độ interleukin-6. Nhận thấy không phải tất cả các trung tâm y khoa đều có thể đo lường hoặc tiếp cận để đo lượng nồng độ interleukin-6, một NUTRIC sửa đổi đã được phát triển và xác nhận. Điểm NUTRIC sửa đổi ≥5 có liên quan đến kết cục lâm sàng tệ hơn, bao gồm tử vong và thời gian thở máy, những bệnh nhân này có thể được hưởng lợi từ một chế độ dinh dưỡng tích cực sớm [29].
| Bảng 1.1 Điểm NUTRIC sửa đổi không bao gồm interleukin-6 | ||
| Biến số | Phạm vi | Điểm |
| Tuổi tính bằng năm | <50
50-75 >75 |
0
1 2 |
| Điểm APACHE II | <15
15-19 ≥20 |
0
1 2 |
| Điểm SOFA | <6
6-9 ≥9 |
0
1 2 |
| Số bệnh đồng mắc | 0-1
2+ |
0
1 |
| Số ngày nằm viện trước khi nhập ICU | 0-1
1+ |
0
1 |
Tổng điểm ≥5 xác định nguy cơ dinh dưỡng cao
Trên thực tế, hai nghiên cứu quan sát tiến cứu cho thấy bệnh nhân có nguy cơ dinh dưỡng cao, như được xác định bằng điểm NUTRIC, được EN sớm có kết cục tốt hơn so với những người có nguy cơ dinh dưỡng thấp [30, 31]. Gần đây, các nghiên cứu quan sát sử dụng dữ liệu từ các nghiên cứu đăng ký đa quốc gia cho thấy bệnh nhân có nguy cơ dinh dưỡng cao (NUTRIC ≥5) đã cải thiện kết cục với việc cung cấp lượng calo và protein lớn hơn [32, 33].
Sử dụng các hệ thống tính điểm được xác nhận, xác định nguy cơ dinh dưỡng cần thận trọng trong việc nhận ra bệnh nhân nào có thể có lợi từ liệu pháp hỗ trợ dinh dưỡng sớm và tích cực. Một khi bệnh nhân được phân tầng nguy cơ thì làm thế nào để thiết lập cách tối ưu để cung cấp dinh dưỡng?
Tôi nên bắt đầu dinh dưỡng đường ruột hay tĩnh mạch (hoặc cả hai)?
Khi một bệnh nhân được xem là có nguy cơ dinh dưỡng cao và do đó có thể được hưởng lợi từ việc bắt đầu dinh dưỡng sớm, họ nên được nhận dinh dưỡng qua đường ruột, đường tĩnh mạch, hay cả hai?
| Bảng 1.2 Khuyến cáo EN và PN từ các Hướng dẫn hỗ trợ dinh dưỡng chính | ||
| Hướng dẫn | Năm | Khuyến cáo EN vs. PN |
| Canada¹ | 2013 | Khi xem xét hỗ trợ dinh dưỡng cho bệnh nhân nguy kịch, chúng tôi khuyến cáo mạnh việc sử dụng EN so với PN. |
| ASPEN² | 2016 | Chúng tôi khuyến cáo liệu pháp hỗ trợ dinh dưỡng dưới dạng EN sớm nên được bắt đầu trong vòng 24- 48 giờ ở bệnh nhân nguy kịch không thể duy trì việc tự ăn uống. |
| ESPEN³ | 2006 | Tất cả bệnh nhân không dinh dưỡng đường miệng đầy đủ trong vòng 3 ngày nên nhận EN. Mặc dù không có dữ liệu cho thấy sự cải thiện các thông số kết cục liên quan với việc sử dụng EN sớm, nhưng ủy ban chuyên gia khuyến cáo bệnh nhân nguy kịch có huyết động ổn định, đường tiêu hóa hoạt động nên được cho ăn sớm với lượng EN thích hợp. |
EN = enteral nutrition (dinh dưỡng đường ruột).
PN = parenteral nutrition (dinh dưỡng đường tĩnh mạch).
¹Canadian Critical Care Practice Guidelines.
²Society of Critical Care Medicine and American Society of Parenteral and Enteral Nutrition (ASPEN) Guidelines.
³European Society of Enteral and Parenteral Nutrition (ESPEN) Guidelines.
EN sớm được định nghĩa là cho ăn trong vòng 24-48 giờ, nếu không có bất kỳ chống chỉ định nào đối với dinh dưỡng qua đường ruột, thì nó được khuyến cáo hơn so với đường tĩnh mạch (PN) sớm (Bảng 1.2) [8].
Các phân tích gộp so sánh EN với PN cho thấy giảm các biến chứng nhiễm khuẩn và giảm thời gian nằm viện với EN [8]. EN, trái ngược với PN, cung cấp lợi ích không về mặt dinh dưỡng. EN duy trì tính toàn vẹn chức năng của ruột và các chức năng bao gồm duy trì khối lượng và chức năng của tế bào ruột, bảo tồn các mối nối chặt và chiều cao lông nhung của ruột non, hỗ trợ miễn dịch sản xuất IgA [34]. Xem xét hậu quả của việc thiếu chất dinh dưỡng trong lòng ruột: nhu dộng ruột sẽ giảm và vi khuẩn sẽ có nhiều khả năng bám vào các tế bào ruột gây ra chết tế bào theo chu trình qua trung gian tiếp xúc và do đó làm tăng tính thấm của tế bào ruột. Vi khuẩn cộng sinh cảm nhận các hợp chất hòa tan, chẳng hạn như catecholamine và adenosine, kích hoạt các gen độc lực của vi khuẩn để thúc đẩy sinh tồn. Lúc này, vi khuẩn bị rối loạn sinh học sẽ chặn các tín hiệu của ký chủ (thông qua cảm nhận từ xa) đến các đại thực bào hoạt động và tăng cường tình trạng viêm, thúc đẩy rối loạn chức năng cơ quan và kéo dài tình trạng suy đa tạng [35]. Hơn nữa, dinh dưỡng đường ruột cung cấp kênh dẫn cho các tác nhân điều hòa miễn dịch tiềm năng và là phương tiện để dự phòng loét do căng thẳng (Bảng 1.3) [34, 36].
Vai trò của PN là gì? Ba câu hỏi chính được trả lời ở đây: (1) Khi nào nên bắt đầu PN đơn độc ở bệnh nhân nguy kịch có nguy cơ dinh dưỡng thấp? (2) Khi nào nên bắt đầu PN đơn độc cho nguy cơ dinh dưỡng cao? (3) Khi nào nên sử dụng PN như liệu pháp bổ sung? [37].
Theo hướng dẫn của ASPEN/SCCM 2016, ở những bệnh nhân có nguy cơ dinh dưỡng thấp, PN đơn độc nên được giữ lại trong 7 ngày đầu sau khi nhập ICU, đặc biệt nếu EN sớm không khả thi [8]. Trong một RCT, PN sớm đơn độc ở bệnh nhân ICU người lớn có chống chỉ định với EN cho thấy không có lợi ích gì [38].
Ở những bệnh nhân có nguy cơ dinh dưỡng cao và chống chỉ định EN, hướng dẫn ASPEN/SCCM 2016 khuyến cáo bắt đầu PN càng sớm càng tốt sau khi nhập ICU [8]. Hai phân tích gộp so sánh PN với liệu pháp tiêu chuẩn (không có dinh dưỡng) ở bệnh nhân suy dinh dưỡng cho thấy PN làm giảm biến chứng [39, 40].
Ở những bệnh nhân có nguy cơ dinh dưỡng cao mà EN không thể đạt được ˃60% mục tiêu năng lượng, bổ sung thêm PN được khuyến cáo sau 7-10 ngày. Bắt đầu bổ sung PN trước 7-10 ngày đã được chứng minh là có kết cục xấu hơn (thử nghiệm EPANIC). Casaer và cs cho thấy các biến chứng nhiễm khuẩn gia tăng ở những bệnh nhân được chọn ngẫu nhiên để nhận bổ sung PN vào ICU ngày 3, so với ICU ngày 8 [41].
| Bảng 1.3 Lợi ích dinh dưỡng và không về mặt dinh dưỡng của nuôi ăn đường ruột sớm [24] |
1. Cung cấp vi chất/chất dinh dưỡng và chất chống oxy hóa
2. Duy trì tính toàn vẹn của ruột
3. Giảm tiến trình viêm
4 .Bảo tồn và tăng cường khả năng miễn dịch
|
IgA = immunoglobulin A, MALT = mô bạch huyết liên quan niêm mạc, Th-2 = tế bào trợ giúp loại 2
Kể từ khi công bố hướng dẫn ASPEN/SCCM 2016, nhiều RCT đã thách thức khuyến cáo này cho thấy sự vượt trội của EN sớm so với PN trong bệnh nguy kịch [42, 43]. Harvey và cs đã tiến hành một thử nghiệm ngẫu nhiên đối chứng đa trung tâm (CALORIES) ở người lớn so sánh EN sớm với PN sớm trong tối đa 5 ngày và không tìm thấy sự khác biệt đáng kể nào về kết cục chính là tử vong 30 ngày do mọi nguyên nhân hoặc kết cục phụ là biến chứng nhiễm khuẩn [42]. Gần đây hơn, Reignier và cs đã tiến hành một thử nghiệm ngẫu nhiên có đối chứng đa trung tâm (NUTRICEA-2) trên người lớn so sánh EN sớm với PN sớm ở bệnh nhân ICU nội khoa là chính, chủ yếu bị sốc nhiễm khuẩn và không thấy sự khác biệt về kết cục chính là tử vong 28 ngày. Nhóm EN, so với nhóm PN, có tỷ lệ mắc mới tích lũy cao hơn về nôn ói, tiêu chảy, thiếu máu cục bộ ruột và giả tắc đại tràng cấp tính [43].
Mặc dù CALORIES và NUTRICEA-2 không đủ sức mạnh khẳng định sự không vượt trội, nhưng kết quả của các thử nghiệm này rất hấp dẫn và cho thấy PN sớm có thể được sử dụng một cách an toàn, ngay cả khi EN không bị chống chỉ định như trong CALORIES, hay có thể bị chống chỉ định (do sốc) như trong NUTRICEA-2. Hơn nữa, NUTRICEA-2 thách thức niềm tin rằng EN cung cấp lợi ích không về mặt dinh dưỡng. Tuy nhiên, đó là do EN liều đầy đủ có liên quan đến tác hại, và lợi ích của liều EN dinh dưỡng trong sốc vẫn chưa được biết.
Khi dinh dưỡng được bắt đầu, nó nên nhanh như thế nào? Với EN, nhiều yếu tố phải được xem xét, bao gồm cả dung nạp EN ban đầu, tăng đường huyết do sản xuất glucose nội sinh và nguy cơ mắc hội chứng sau nuôi dưỡng lại [7]. Đầu tiên, bệnh nhân có nguy cơ dinh dưỡng cao cũng có thể có nguy cơ không dung nạp EN cao hơn, bao gồm nôn ói và thiếu máu cục bộ mạc treo. Thứ hai, căng thẳng chuyển hóa dẫn đến tăng đường huyết thông qua quá trình tân tạo glucose và glycogen. Thêm glucose ngoại sinh (thông qua EN hoặc PN) vào sản xuất glucose nội sinh làm tăng đường huyết. Hội chứng sau nuôi dưỡng lại có thể phổ biến hơn so với suy nghĩ trước đây. Theo hướng dẫn của NICE – Anh quốc, các yếu tố nguy cơ chính của hội chứng sau nuôi dưỡng lại bao gồm ăn uống đường miệng kém hơn 10 ngày trước đó, BMI thấp (<16 kg/m2 ), sụt cân không chủ ý hơn 15% trong 3-6 tháng trước, hoặc nồng độ kali, phosphate, magne thấp trước khi nuôi dưỡng [44]. Những yếu tố này nên được xem xét khi nâng cao dinh dưỡng để đạt mục tiêu [7].
Dinh dưỡng đại thể tối ưu là gì?
Trong 30 năm qua, sự hiểu biết tốt hơn về các quá trình bệnh lý liên quan đến bệnh nguy kịch, cải thiện các chiến lược quản lý và hệ thống hỗ trợ đã tăng tỷ lệ sống còn sau bệnh nguy kịch [45]. Tỷ lệ sống tăng lên có liên quan đến chứng thiểu cơ mắc phải, giảm chức năng thể chất, giảm chất lượng cuộc sống nói chung [4, 46-49]. Các yếu tố nguy cơ liên quan đến ICU đối với chứng thiểu cơ mắc phải bao gồm căng thẳng chuyển hóa với kháng đồng hóa, an thần và bất động, dinh dưỡng không đầy đủ. Dữ liệu gần đây cho thấy protein có thể là thành phần quan trọng nhất của hỗ trợ dinh dưỡng, chứ không phải là tổng lượng calo [29, 32, 33, 50, 51].
Hướng dẫn ASPEN/SCCM 2016 và tài liệu tóm tắt của hội nghị thượng đỉnh về protein quốc tế gần đây gợi ý cung cấp protein 1.2-2.0 g/kg/ngày cho bệnh nhân chăm sóc đặc biệt nói chung [8, 52]. Khuyến cáo dựa trên dữ liệu quan sát cho thấy cải thiện cân bằng nitrogen với ít nhất protein 1.2 g/kg ngày [53]. Gần đây, nhiều dữ liệu quan sát cho thấy rằng việc đạt được mục tiêu protein trong thời gian bệnh nặng có liên quan đến cải thiện tử vong ICU [32, 33, 54-57]. Trong một nghiên cứu, Compher và cs chứng minh rằng với việc tăng mỗi 10% lượng protein cung cấp cho bệnh nhân nguy cơ dinh dưỡng cao (được xác định bởi NUTRIC ≥5), sẽ làm giảm 6.6% nguy cơ tử vong ở những người nằm ICU ít nhất 4 ngày và 10.1% ở những người nằm ICU ít nhất 12 ngày [32].
Năm thử nghiệm ngẫu nhiên có đối chứng đã so sánh protein cao và thấp ở bệnh nhân nguy kịch [58, 62]. Đây là những nghiên cứu nhỏ với chất lượng phương pháp nghiên cứu thấp, có dân số không đồng nhất và báo cáo kết cục khác nhau (chẳng hạn thay đổi điểm SOFA). Không có nghiên cứu nào báo cáo tử vong là kết cục chính. Trước khi áp dụng rộng rãi các khuyến cáo dựa trên hướng dẫn về liều protein, cần phải có một cơ sở bằng chứng mạnh mẽ hơn dưới dạng các thử nghiệm ngẫu nhiên có đối chứng được thiết kế tốt so sánh protein cao và thấp.
Thật không may, một cuộc khảo sát quốc tế lớn trên toàn thế giới cho thấy các bệnh nhân nguy kịch trên toàn cầu nhận được khoảng 55% protein theo quy định (0.7 g/kg/ngày) [29]. Vô số lý do tồn tại ở bệnh nhân không đạt được mục tiêu protein. Đầu tiên là các yếu tố liên quan đến bệnh nhân, chẳng hạn như buồn nôn và nôn làm hạn chế việc nuôi ăn đường ruột. Thứ hai, các yếu tố liên quan đến nhà lâm sàng như nhận thức về sự không dung nạp (ví dụ, điều gì làm cho dịch tồn lưu dạ dày cao), niềm tin rằng protein lớn hơn là có hại trong các tình trạng liên quan đến ICU khác nhau như tổn thương thận cấp và các khuyến cáo hiện tại về dinh dưỡng dưới mức chấp nhận được có thể vô tình hạn chế việc cung cấp protein. Thứ ba, các yếu tố liên quan đến quy trình như sự chậm trễ trong việc bắt đầu và nâng cao dinh dưỡng, các rào cản đặc thù của ICU như tạm ngưng hoặc gián đoạn dinh dưỡng cho các thủ thuật, có thể hạn chế việc đạt được mục tiêu protein [63].
Chiến lược tăng cường cung cấp protein bao gồm cung cấp protein bổ sung (gói) qua đường ruột, sử dụng công thức đường ruột giàu protein (công thức mới hơn chứa 35-37% calo từ protein), thực hiện các chiến lược dinh dưỡng đường ruột mới (như cho ăn theo thể tích) và sử dụng acid amin đường tĩnh mạch [29].
Đánh giá của chúng tôi về nguy cơ dinh dưỡng ở bệnh nhân này
Bệnh nhân nam 75 tuổi, có tiền sử đái tháo đường, tăng huyết áp, nghiện rượu nhập viện vì suy hô hấp và nhiễm khuẩn huyết thứ phát do viêm phổi mắc phải tại cộng đồng.
Tiền sử ăn uống kém và sụt cân cho thấy suy dinh dưỡng trước nhập viện. Tuổi tác, bệnh đi kèm, và mức độ nặng của bệnh hiện tại dẫn đến bệnh nguy kịch khiến bệnh nhân này có nguy cơ dinh dưỡng cao (điểm NUTRIC ≥5), cho thấy anh ta có thể có kết cục kém do thiếu dinh dưỡng hoặc không đủ dinh dưỡng. Bệnh nhân cũng có các yếu tố nguy cơ chính cho hội chứng sau nuôi dưỡng lại.
Chiến lược quản lý của chúng tôi về dinh dưỡng ở bệnh nhân này
Nguy cơ dinh dưỡng cao cho thấy bệnh nhân sẽ được hưởng lợi từ việc dinh dưỡng sớm. Tuy nhiên, bệnh nhân suy dinh dưỡng từ trước (tiền sử ăn uống kém và sụt cân) và thiếu hụt chất điện giải đáng kể khiến bệnh nhân có nguy cơ mắc hội chứng sau nuôi dưỡng lại, điều này có thể hạn chế dinh dưỡng tích cực sớm.
Bệnh nhân không có chống chỉ định đối với EN, bao gồm mất ổn định huyết động cần hỗ trợ vận mạch leo thang, nôn, tắc ruột, đang chảy máu đường tiêu hóa, thiếu máu cục bộ ruột. Do đó, EN được khuyến cáo sử dụng công thức tiêu chuẩn (lượng calo bình thường) với calo mục tiêu là 25 kcal/kg/ngày và ít nhất protein 1.2 g/kg/ngày. EN sẽ được bắt đầu qua ống thông mũi dạ dày với tốc độ ban đầu là 10-20 mL/giờ và được điều chỉnh cho mục tiêu chậm trong khi theo dõi hội chứng sau nuôi dưỡng lại. Phosphate, kali và magne huyết thanh nên được kiểm tra thường xuyên để bổ sung. Vì mục tiêu protein sẽ không đạt được bằng cách sử dụng tốc độ EN theo bậc dinh dưỡng, nên có thể thêm protein bổ sung (gói) được cung cấp qua đường ruột.
Nếu bệnh nhân không dung nạp EN, PN đơn độc sớm đã được chứng minh là an toàn và hiệu quả cho việc cung cấp calo.