Bài viết Thở máy ở bệnh nhân đột quỵ do thiếu máu cục bộ cấp: Từ sinh lý bệnh đến lâm sàng được dịch bởi Bác sĩ Hồ Hoàng Kim từ bài viết gốc: Mechanical ventilation in patients with acute ischaemic stroke: from pathophysiology to clinical practice
Tóm tắt
Hầu hết bệnh nhân đột quỵ do thiếu máu cục bộ được quản lý điều trị tại khoa hoặc tại các đơn vị chuyên khoa đột quỵ, nhưng một số lượng đáng kể có yêu cầu chăm sóc cao hơn và do đó, phải nhập viện chăm sóc đặc biệt. Thở máy thường được thực hiện ở những bệnh nhân này do rối loạn chức năng nuốt và tổn thương đường thở hoặc hệ hô hấp. Các nghiên cứu thực nghiệm đã tập trung vào ức chế miễn dịch do đột quỵ và mối tương tác não-phổi, dẫn đến tăng tổn thương phổi và viêm, cũng như giảm khả năng thực bào của đại thực bào phế nang, có thể làm tăng nguy cơ nhiễm trùng. Các biến chứng về phổi, như suy hô hấp, viêm phổi, tràn dịch màng phổi, hội chứng suy hô hấp cấp, phù phổi và thuyên tắc phổi do huyết khối tĩnh mạch, thường gặp và được coi là một trong những nguyên nhân chính gây tử vong ở nhóm bệnh nhân này. Hơn nữa, trong hai thập kỷ qua, việc sử dụng phẫu thuật mở khí quản đã tăng lên ở bệnh nhân đột quỵ, những người có thể có chỉ định riêng cho thủ thuật này – tùy thuộc vào vị trí và loại đột quỵ – khi so sánh với dân số chung. Tuy nhiên, chiến lược thở máy tối ưu vẫn chưa rõ ràng trong dân số này. Mặc dù chiến lược thể tích thông khí (VT) đã được sử dụng trong nhiều năm, bằng chứng mới nhất cho thấy rằng chiến lược thông khí bảo vệ (VT = 6–8 mL / kg trọng lượng cơ thể dự đoán, áp lực dương cuối kỳ thở ra và diễn tập cấp cứu) cũng có thể có vai trò đối với bệnh nhân bị tổn thương não, kể cả những người bị đột quỵ. Mục đích của tổng quan tường thuật này là khám phá sinh lý bệnh của tương tác não-phổi sau đột quỵ thiếu máu cục bộ cấp tính và xử trí thở máy ở những bệnh nhân này.
Đại cương
Đột quỵ thiếu máu cục bộ cấp tính (AIS) là một trong những nguyên nhân chính gây ra bệnh tật và tử vong trên toàn thế giới [1] và là một trong những nguyên nhân hàng đầu để nhập viện chăm sóc đặc biệt về thần kinh (NICU) [2]. Trong những thập kỷ qua, tỷ lệ đột quỵ ngày càng gia tăng, và mặc dù tỷ lệ tử vong nói chung đã giảm, nó vẫn là nguyên nhân hàng đầu gây ra tàn tật nặng ở người trưởng thành [1]. Khoảng 80% trường hợp đột quỵ là do thiếu máu cục bộ; các loại chính khác bao gồm xuất huyết trong não (ICH) và não thất (IVH), huyết khối tĩnh mạch não và xoang, và xuất huyết dưới nhện (SAH) thứ phát sau rò hoặc vỡ túi phình [3]. Vị trí của đột quỵ có lẽ là yếu tố phù hợp nhất liên quan đến nhu cầu thở máy (MV), hơn là loại bệnh lý mạch máu não cụ thể. Trong bối cảnh này, suy giảm các vùng não điều chỉnh mức độ ý thức (đồi thị, hệ viền, sự hệ thống lưới trong thân não), thở (trung tâm hô hấp ở vỏ não, cầu não và tủy sống), và nuốt (tủy và thân não kết nối) làm tăng nguy cơ suy hô hấp [4].
Các biến chứng phổi — chẳng hạn như suy hô hấp, viêm phổi, tràn dịch màng phổi, hội chứng suy hô hấp cấp tính (ARDS), phù phổi và thuyên tắc phổi do huyết khối tĩnh mạch — có thể xảy ra ở nhóm bệnh nhân này và có nguy cơ tử vong cao [5, 6]. Đặc biệt, viêm phổi liên quan đến đột quỵ (SAP) được mô tả như một yếu tố nguy cơ độc lập dẫn đến kết cục không thuận lợi và tử vong [7, 8]. Vì biến chứng ngoài não thường gặp nhất ở bệnh nhân ICU thần kinh là suy hô hấp [5], việc phát triển các chiến lược thở máy mới có thể cải thiện kết quả của họ [4]. Cho đến nay, rất ít nghiên cứu đề cập đến việc quản lý hô hấp tốt nhất ở bệnh nhân AIS. Mục đích của bản thảo này là xem xét và mô tả sinh lý bệnh cơ bản sự phát triển của các biến chứng phổi và suy hô hấp sau AIS và các chiến lược thở máy khác nhau ở đối tượng này, tập trung vào nguy cơ liên quan đến liệu pháp oxy (O2) và áp dụng thông khí bảo vệ phổi . Với mục đích này, chúng tôi đã thực hiện tìm kiếm tài liệu về bốn cơ sở dữ liệu điện tử (PubMED, Scopus, ScienceDirect, Web of Science), sử dụng các thuật ngữ sau: “thở máy” và “đột quỵ”. Các tiêu đề và phần tóm tắt đã được hai tác giả truy xuất và đánh giá độc lập về tính hợp lệ (CR, GB). Các bất đồng đã được giải quyết bằng thảo luận và thỏa thuận đồng thuận và nếu được yêu cầu, đóng góp ý kiến từ tác giả thứ ba (DB).
Tổng quan tường thuật này tập trung vào thông tin dành riêng cho bệnh nhân đột quỵ không bị chấn thương sọ não hoặc các vấn đề về áp lực nội sọ, bao gồm mối quan tâm về sự cần thiết phải mở khí quản như một biện pháp can thiệp để ngăn ngừa viêm phổi hít thay vì các vấn đề chủ yếu về phổi. Chúng tôi cũng nhằm mục đích làm nổi bật các nhu cầu khác nhau của một nhóm nhỏ bệnh nhân đột quỵ cụ thể có cấu hình suy giảm thần kinh riêng biệt – chẳng hạn như giảm mức độ ý thức, thiếu hụt dây thần kinh sọ và các mối lo ngại về trung tâm nuốt – để cung cấp một lộ trình tốt để hướng dẫn bác sĩ chuyên khoa tổng quát.
Sinh lý bệnh của đột quỵ và nguy cơ biến chứng phổi
Tương tác não – phổi
Khái niệm về tương tác não – phổi đã được nghiên cứu rộng rãi [9, 10]. Những bệnh nhân bị tổn thương não nặng thường không thể bảo vệ đường thở của họ và do đó thường được đưa vào NICU để thở máy. MV kéo dài có liên quan đến tăng nguy cơ phát triển tổn thương phổi do thở máy, ARDS, viêm phổi và phù phổi do thần kinh [11]. Hơn nữa, ARDS có những tác động bất lợi cho não, hiệp đồng với tăng áp nội sọ để gây tổn thương đồi thị. Một nghiên cứu trên chuột cho thấy đột quỵ do thiếu máu cục bộ khu trú làm thay đổi mô hình hô hấp, gây phù và viêm, đồng thời giảm khả năng thực bào của đại thực bào phế nang [6]. Đáng chú ý, tất cả những thay đổi này xảy ra trong vòng 24 giờ sau khi bắt đầu gây thiếu máu não, điều này đồng nghĩa với sự khởi phát nhanh chóng của suy hô hấp ở bệnh nhân đột quỵ [12].
Cơ chế tổn thương phổi sau chấn thương não được mô tả thông qua một “mô hình tác động kép”: cơn bão catecholamine và sự sản sinh hệ thống của các chất trung gian gây viêm (tác động đầu tiên) tạo ra một môi trường viêm hệ thống làm tăng áp lực thủy tĩnh mạch phổi và kích hoạt các cơ chế sinh học làm phổi dễ bị tổn thương cơ học và phi cơ học hơn (đòn đánh thứ hai), kể cả thở máy [13]. Mặt khác, tổn thương phổi có thể gây tổn thương não thông qua sự tương tác phức tạp giữa các con đường tự trị, viêm thần kinh, nội tiết thần kinh và miễn dịch [14]. Fries et al. [15] so sánh lợn bị giảm oxy máu do mô hình rửa phổi cấp tính gây ra so với lợn có cùng mức độ giảm oxy máu do giảm một phần oxy truyền vào (FiO2). Tổn thương não nhiều hơn ở nhóm đầu tiên, cho thấy rằng tổn thương phổi cấp tính dẫn đến những thay đổi bệnh lý thần kinh bất kể sự xuất hiện của giảm oxy máu. Phổi có thể giao tiếp với não thông qua hệ thống thần kinh tự chủ và giao cảm, dẫn đến quá trình viêm thần kinh gây kích hoạt các thác cytokine và bổ thể [16], do đó góp phần phát triển phù não và chết tế bào theo chương trình
Immunological response after stroke
AIS tạo ra các phản ứng miễn dịch toàn thân và cục bộ sâu sắc, tham gia vào tất cả các con đường miễn dịch bẩm sinh và thích ứng chính. Sau đột quỵ, tổn thương hàng rào máu não (BBB) dẫn đến việc huy động các tế bào miễn dịch thường trú (tế bào hình sao và microglia) và ngoại vi (chủ yếu là bạch cầu trung tính và bạch cầu đơn nhân) đến khu vực bị ảnh hưởng [17]. Kết quả là làm giảm các tế bào miễn dịch tuần hoàn và suy giảm miễn dịch ngoại vi làm tăng tính nhạy cảm với các bệnh nhiễm trùng [8]. Một lượng lớn các bằng chứng thực nghiệm và lâm sàng ủng hộ giả thuyết về sự giảm điều hòa các phản ứng miễn dịch tế bào hệ thống, với sự giảm số lượng nhanh chóng các tiểu quần thể tế bào lympho máu ngoại vi và vô hiệu hóa chức năng của bạch cầu đơn nhân [18]. Những thay đổi này nổi bật nhất ở những bệnh nhân có đột quỵ lớn hơn và có nhiều khả năng xảy ra sau đột quỵ ở vùng vỏ não [8]. Các nghiên cứu thực nghiệm và lâm sàng ở AIS cũng đã báo cáo mức độ catecholamine lưu hành tăng lên và mối tương quan của chúng với chứng giảm bạch cầu máu. Tuy nhiên, các cơ chế của ức chế miễn dịch dịch thể và nhiễm trùng do vi khuẩn vẫn còn nhiều tranh cãi [10, 19]. Ở chuột sau đột quỵ, việc sử dụng thuốc đối kháng thụ thể βadrenergic làm giảm các biến chứng do vi khuẩn và tỷ lệ tử vong, điều này có thể cho thấy tầm quan trọng của con đường catecholamine và đáp ứng phế vị trong quá trình ức chế miễn dịch [19] (Hình 1 và 2).
Stroke-associated pneumonia
Viêm phổi do hít là một trong những nguyên nhân chính gây suy hô hấp sau đột quỵ và có thể liên quan đến giảm mức độ ý thức, làm giảm khả năng nuốt và khó nuốt [8]. Tuy nhiên, tỷ lệ mắc bệnh viêm phổi ở bệnh nhân đột quỵ cao hơn khi so sánh với các nhóm bệnh nhân khác bị chứng khó nuốt hoặc mức độ ý thức bị tổn thương, do đó cho thấy rằng các cơ chế khác có liên quan, chẳng hạn như kích hoạt miễn dịch và thay đổi cơ chế bệnh sinh tổn thương phổi [20].
PREDICT, một nghiên cứu đa trung tâm quan sát tiền cứu, khẳng định rằng cả chứng khó nuốt và hội chứng suy giảm miễn dịch do đột quỵ đều là những yếu tố nguy cơ độc lập của viêm phổi hít [20]. Tỷ lệ mắc SAP dao động trong khoảng 3,9 – 56,6%, với tỷ lệ mắc cao hơn trong ICU so với các đơn vị hoặc khu đột quỵ [8]. Một số nghiên cứu đã phát triển điểm số lâm sàng để dự đoán SAP với mục đích cải thiện phân tầng nguy cơ ở bệnh nhân đột quỵ cấp tính [21, 22], nhưng việc sử dụng chúng trong môi trường lâm sàng là không phổ biến. Trong thực tế hiện tại, các dấu ấn sinh học như protein phản ứng C, mức độ nghiêm trọng của đột quỵ, chứng khó nuốt và các tiêu chí của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh [22] được sử dụng thường xuyên hơn. Biện pháp được công nhận rộng rãi nhất khi bệnh nhân đột quỵ cấp nhập viện là “tình trạng miệng bằng không” cho đến khi hoàn thành đánh giá nuốt [8]. Khuyến cáo vận động sớm vì nó làm giảm nguy cơ SAP, trong khi lợi ích của việc sử dụng kháng sinh trong giai đoạn cấp tính vẫn chưa được chứng minh [23].
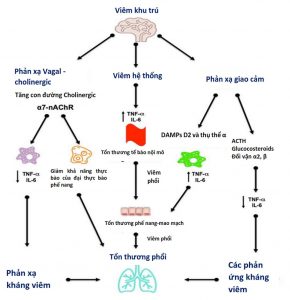
”Sau đột quỵ, sự kích thích dây thần kinh phế vị thông qua thụ thể nicotinic acetylcholine α7 (nAChRα7) gây ra hoạt hóa microglial, gây giảm khả năng thực bào của đại thực bào phế nang và giảm mức lưu hành của interleukin IL-6 và yếu tố hoại tử khối u TNF-α, do đó dẫn đến phản xạ chống viêm và tổn thương phổi. Mặt khác, viêm toàn thân do đột quỵ dẫn đến tăng giải phóng các chất trung gian gây viêm như IL-6 và TNF-α, dẫn đến viêm phổi và tổn thương mao mạch phế nang. Cuối cùng, đáp ứng giao cảm với sự gia tăng biểu hiện của các chất trung gian gây viêm và sự hoạt hóa trục dưới đồi-tuyến yên-thượng thận gây tăng tiết glucocorticoid, có thể liên quan đến nhiễm trùng thứ phát và kết cục kém.”
Stroke-associated dysphagia
Dự đoán về thành công của rút nội khí quản và rút nội khí quản an toàn là quan trọng ở bệnh nhân đột quỵ. Một nghiên cứu quan sát tiền cứu [24] tập trung vào sự sẵn sàng rút nội khí quản ở bệnh nhân đột quỵ cho thấy những bệnh nhân thất bại trong các thử nghiệm nuốt là những người sau đó bị thất bại khi rút nội khí quản. Tỷ lệ đặt lại ống nội khí quản là 24,1%, và yếu tố quyết định chính của việc đặt lại ống nội khí quản (ở một nửa số bệnh nhân này) là chứng khó nuốt, sau đó là các biến chứng hô hấp [24]. Đặt nội khí quản kéo dài là nguyên nhân chính gây ra rối loạn chức năng nuốt, và việc xác định mức độ sẵn sàng rút nội khí quản là một thách thức ở đối tượng này. Tiêu chuẩn được sử dụng trong dân số chung để dự đoán thất bại rút ống dựa trên các thông số đường thở và cơ học phổi, trong khi ở bệnh nhân đột quỵ, tình trạng thần kinh có vai trò nổi bật trong sự phát triển của chứng khó nuốt và là nguyên nhân hàng đầu dẫn đến kết cục xấu [25]. Tỷ lệ khó nuốt sau rút nội khí quản từ 12 đến 69% trong dân số ICU chung, đạt 93% ở bệnh nhân thần kinh [24]. Nguyên nhân chính của chứng khó nuốt sau rút nội khí quản là bệnh lý mạch máu não do tổn thương mạng lưới nuốt trung ương, tổn thương hầu họng, bệnh lý thần kinh và bệnh cơ cũng như do thuốc an thần và tổn thương niêm mạc [24]. Mặc dù một số kỹ thuật đã được phát triển để chẩn đoán chứng khó nuốt, nhưng chỉ có phương pháp nội soi qua video được coi là tiêu chuẩn mục tiêu cho rối loạn chức năng nuốt. Một nghiên cứu can thiệp sử dụng nội soi ống mềm và bao gồm cả những bệnh nhân ICU nói chung trong vòng 48 giờ kể từ khi rút nội khí quản cho thấy rằng chứng khó nuốt sau rút nội khí quản có thể được chẩn đoán ở 50% bệnh nhân và tỷ lệ chung của các biến cố hít sặc là 56%, trong đó 25% im lặng [25 ]. Kỹ thuật này đã chứng tỏ tiện ích của nó trong chẩn đoán chứng khó nuốt sau rút nội khí quản ở 69,3% bệnh nhân [26]. Tóm lại, các bằng chứng hiện tại đồng ý về tiện ích và tính khả thi của thăm dò chức năng nuốt với ống nội soi mềm tại giường để đánh giá chứng khó nuốt sau rút nội khí quản ở những bệnh nhân có nguy cơ rối loạn chức năn nuốt và nguy cơ hít sặc.
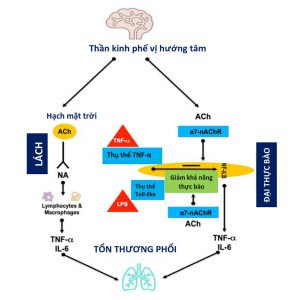
”Não khỏe mạnh có thể kiểm soát việc sản xuất cytokine quá mức thông qua một phản xạ viêm của dây thần kinh phế vị (bằng cách kích hoạt phế vị hướng tâm qua hạch celiac – mặt trời). Kích thích dây thần kinh phế vị thông qua thụ thể nicotinic acetylcholine α7 (nAChRα7) điều chỉnh sự hoạt hóa microglial trong não, bảo vệ các tế bào thần kinh khỏi stress oxy hóa và cải thiện phục hồi chức năng, góp phần ức chế miễn dịch. Sự biểu hiện của nAChRα7 trên các đại thực bào và tế bào biểu mô phế nang làm giảm viêm ở phổi, và bằng cách ức chế sản xuất các cytokine gây viêm (IL-6, TNF-α) qua lipopolysaccharides (LPS) và yếu tố nhân kappa-light- chất tăng cường chuỗi của các tế bào B hoạt hóa (NFK-B), làm suy yếu khả năng bảo vệ của vật chủ trong các tình trạng viêm. Nhìn chung, kích thích phế vị trong khi đột quỵ làm suy yếu khả năng của đại thực bào, làm tăng nguy cơ nhiễm trùng và tổn thương phổi, trong khi nghịch lý là gây ra phản ứng chống viêm cao hơn và do đó làm giảm nguy cơ tổn thương phổi. Sự cân bằng giữa hai con đường này giải thích cho sự xuất hiện hoặc không, của chấn thương phổi. Ach, acetylcholin; NA, noradrenaline”
Cài đặt máy thở
Do tỷ lệ cao các biến chứng hô hấp ở bệnh nhân đột quỵ, quản lý máy thở tối ưu là bắt buộc [5]. Mục tiêu chính của MV phải là duy trì mức oxy thích hợp và kiểm soát chặt chẽ tình trạng căng thẳng carbon dioxide (PaCO2), mà không gây tổn thương phổi liên quan đến máy thở.
Oxy liệu pháp
Tình trạng thiếu oxy thường gặp ở bệnh nhân đột quỵ, và độ bão hòa oxy (SaO2) dưới 90% trong vài giờ đầu sau khi nhập viện có liên quan đến nguy cơ tử vong gấp đôi [27]. Bổ sung oxy có thể ngăn ngừa tình trạng thiếu oxy và suy giảm thêm về thần kinh, nhưng nó cũng có thể dẫn đến các tác dụng phụ; trên thực tế, tăng oxy máu có liên quan độc lập với tỷ lệ tử vong ở bệnh nhân chấn thương não, với nguy cơ cao bị chậm thiếu máu não và kết cục xấu [28]. Oxy có thể làm tăng nguy cơ nhiễm trùng đường hô hấp do ô nhiễm, có ảnh hưởng trực tiếp đến trương lực mạch và huyết áp [29], ở nồng độ cao gây co mạch và nhiễm độc phổi do hình thành các gốc tự do độc hại. Stress oxy hóa cũng là nguyên nhân kích hoạt các con đường truyền tín hiệu tế bào, gây ra quá trình chết theo chương trình và chết tế bào thần kinh [28, 29]. Bằng chứng từ các thử nghiệm được thiết kế tốt về việc bổ sung oxy sau đột quỵ cấp tính là mâu thuẫn và không đủ để hướng dẫn thực hành lâm sàng (Bảng 1). Một nghiên cứu bán ngẫu nhiên về việc bổ sung oxy cho đột quỵ cấp đã chỉ ra rằng liệu pháp oxy thường quy ở bệnh nhân đột quỵ không làm giảm tỷ lệ mắc và tử vong [30]. Nghiên cứu thí điểm oxy đột quỵ (SO2S), một thử nghiệm ngẫu nhiên có đối chứng đa trung tâm về liệu pháp oxy trong 3 ngày đầu tiên ở bệnh nhân đột quỵ cấp tính, so sánh liệu pháp oxy liều thấp liên tục với ống thông mũi ở 2–3 L / phút so với liều thấp ban đêm so với chăm sóc thông thường (chỉ thở oxy khi cần thiết) [31]. Các tác giả quan sát thấy rằng việc bổ sung oxy liều thấp dự phòng thường quy không cải thiện kết quả sau 3 tháng [32]. Ở những bệnh nhân đột quỵ có mức oxy động mạch thấp, điều trị oxy bổ trợ được đảm bảo, trong khi ở những bệnh nhân không thiếu oxy, điều trị oxy dự phòng không được khuyến khích [32] (Bảng 2). Các hướng dẫn gần đây về quản lý chấn thương sọ não khuyến nghị đặt áp suất riêng phần của oxy (PaO2) cũng như xem xét độ áp suất riêng phần của oxy tại mô não (PbtO2) hoặc giá trị bão hòa tĩnh mạch cảnh (SjvO2) và để duy trì trạng thái mức oxi bình thường [33]. Đối với bệnh nhân đột quỵ, các khuyến cáo tương tự có thể được chấp nhận, nhưng cần phải có các nghiên cứu cụ thể. Ngoài ra, bệnh nhân đột quỵ đặc biệt dễ bị rối loạn nhịp thở khi ngủ, với tỷ lệ mắc chứng ngưng thở khi ngủ do tắc nghẽn từ 30 đến 80%. Một phân tích tổng hợp của 29 nghiên cứu cho thấy rằng rối loạn nhịp thở khi ngủ có ở 72% bệnh nhân đột quỵ, dù là xuất huyết hay thiếu máu cục bộ, mà không có sự khác biệt đáng kể giữa các quần thể đột quỵ. Chỉ có 7% bệnh nhân bị ngưng thở khi ngủ trung ương, do đó cho thấy bệnh nhân đột quỵ trẻ tuổi dễ bị tắc nghẽn thở khi ngủ hơn so với các bạn cùng tuổi chưa bị đột quỵ [34]. Do đó, việc sử dụng polysomnography, thiết bị kênh giới hạn và áp lực đường thở dương tự động liên tục nên được thực hiện để kiểm soát chứng ngưng thở khi ngủ ở bệnh nhân sau đột quỵ hoặc cơn thiếu máu não thoáng qua [34].
Thông khí xâm lấn
Nội khí quản
Có một số chỉ định đặt nội khí quản cho bệnh nhân thần kinh thường được chấp nhận (Bảng 3) [45]. Nói chung, quyết định đặt nội khí quản thường do các thiếu hụt thần kinh, chẳng hạn như Điểm hôn mê Glasgow (GCS) <9, các dấu hiệu tăng áp lực nội sọ, co giật toàn thân (tonic-clonic), kích thước nhồi máu > 2/3 não thuộc động mạch não giữa, và sự dịch chuyển đường giữa trên hình ảnh [23]. Bệnh nhân bị chấn thương sọ não cấp tính, kể cả đột quỵ, có thể có nguy cơ khó đặt nội khí quản, đặc biệt nếu nghi ngờ có chấn thương kèm theo. Dự đoán một đường thở khó là rất quan trọng để lựa chọn các kỹ thuật thích hợp (tức là đặt nội soi bệnh nhân tỉnh so với gây mê chuỗi nhanh) và dụng cụ (video so với nội soi thanh quản trực tiếp) [46, 47]. Trong các cơ sở không cấp cứu, đặt nội khí quản khi tỉnh là thủ thuật được lựa chọn trong trường hợp dự đoán có khó thở hoặc thông khí, ngoại trừ bệnh nhân tăng áp lực nội sọ (ICP). Trong trường hợp này, đặt nội khí quản theo trình tự chuỗi nhanh được ưu tiên hơn, vì nó hạn chế sự tăng ICP do soi thanh quản [45]. Cung cấp đủ oxy trong khi đặt nội khí quản là điều cần thiết cho bệnh nhân đột quỵ, để ngăn ngừa tổn thương thứ phát trong tình trạng não dễ bị tổn thương và tăng ICP hơn nữa [45–47]. Ở những bệnh nhân bị bệnh nặng, 3 phút thở oxy trước với thông khí áp lực dương không xâm lấn [48] hoặc một ống thông mũi lưu lượng cao được sưởi ấm (HHFNC) ở 60–70 L / phút [49] có thể hiệu quả hơn so với thở oxy trước với mặt nạ có lưu lượng cao (không thở lại). Tuy nhiên, một số bằng chứng cho thấy việc sử dụng oxy hóa khi ngưng thở (với HHFNC ở 60–70 L/ phút hoặc ống thông mũi ở 15 L / phút) trong quá trình soi thanh quản [45, 49]. Thật vậy, HHFNC có liên quan đến việc giảm bão hòa ít hơn ở những bệnh nhân giảm oxy máu nhiều hơn khi so sánh với thông khí áp lực dương [50].
| Bảng 2: Quản lý hô hấp của bệnh nhân đột quỵ theo hướng dẫn của AHA/ ASA năm 2018 [23]. |
|
Vì quá trình oxy hóa trước bằng oxy 100% dễ thực hiện và không có tác dụng phụ nghiêm trọng nên việc sử dụng nó được khuyến khích trong quá trình đặt nội khí quản cho bệnh nhân đột quỵ. Sau khi đặt nội khí quản, nồng độ oxy phải được giảm ngay lập tức xuống mức FiO2 thấp nhất để đạt được SatO2 ≥ 95% [50].
Cài đặt máy thở
Cần tránh hạ oxy máu và tăng/ giảm CO2 máu để giảm nguy cơ tổn thương não thứ phát. PaCO2 là yếu tố quyết định mạnh đến lưu lượng máu não [33]; tuy nhiên, tăng CO2 không chỉ nguy hiểm ở bệnh nhân đột quỵ mà còn tăng thông khí, vì co mạch não có thể gây thiếu oxy mô não và ảnh hưởng đến sự tuân thủ và lưu lượng máu của não [51]. Không có sự nhất trí nào về tần số hô hấp và thể tích thông khí (VT) tối ưu để đạt được mục tiêu PaCO2, với VT cao hơn thường được áp dụng ở nhóm bệnh nhân này [11]. Tuy nhiên, sau chấn thương sọ não nặng, VT cao hơn có liên quan đến tăng nguy cơ tổn thương phổi cấp và tăng áp nội sọ cấp tính [9, 52]. Tương tự, áp lực đẩy (driving pressure) cao hơn có liên quan đến nguy cơ ARDS cao hơn [52]. Hơn nữa, ở những bệnh nhân đã hồi phục sau tổn thương phổi cấp tính, rise time thở máy càng ngắn thì thời gian cho công thở máy càng ngắn; ngoài ra, ở 15 cmH2O của thông khí hỗ trợ áp lực, tiêu chuẩn ngắt dòng thấp nhất gây giảm tần số thở và gia tăng Vt.
| Bảng 3 Nguyên nhân đặt nội khí quản ở bệnh nhân đột quỵ |
|
Ở những bệnh nhân nặng cần MV, thông khí bảo vệ với VT 6 mL / kg, mức áp lực dương cuối kỳ thở ra (PEEP) thích hợp và giới hạn áp lực bình nguyên dưới 30 cmH2O đã cho thấy làm giảm tỷ lệ tử vong tuyệt đối 10% [54]. Tuy nhiên, các thử nghiệm lâm sàng kiểm tra các chiến lược thông khí được thiết kế để bảo vệ phổi thường loại trừ những bệnh nhân bị chấn thương não; do đó, quản lý máy thở hiếm khi được đánh giá trong các cơ sở khoa học thần kinh. Thật vậy, ở những bệnh nhân nặng bị chấn thương sọ não cấp, việc sử dụng hệ thống thông khí bảo vệ phổi còn gây tranh cãi và thậm chí có thể bị chống chỉ định, vì nó có thể làm tăng ICP do tăng CO2 máu cho phép và sử dụng áp lực đường thở cao trong các đợt huy động phế nang [55]. Trong một mô hình heo con bị tổn thương phổi cấp, sự cải thiện đáng kể về oxy hóa não đã được quan sát thấy ở những con vật được thở máy với VT thấp khi so sánh với VT cao [56]. Một thử nghiệm đa trung tâm với 749 bệnh nhân bị chấn thương não (36% ở nhóm trước can thiệp và 46% trong nhóm can thiệp là bệnh nhân đột quỵ) [57] cho rằng thông khí bảo vệ (VT≤ 7 mL/ kg PBW lý tưởng và PEEP 6– 8 cmH2O) có thể cải thiện đáng kể số ngày không thở máy ở ngày thứ 90, cũng như giảm tỷ lệ tử vong. Không có nghiên cứu cụ thể tập trung vào cài đặt máy thở tối ưu ở bệnh nhân đột quỵ, và chỉ một số ít bệnh nhân tham gia vào các thử nghiệm lớn khám phá vai trò của thông khí bảo vệ đối đối với kết cục là có bị đột quỵ; chúng tôi khuyên bạn nên giữ Pplat từ 18 đến 25 cmH2O và giảm thiểu tần số hô hấp để giảm công cơ học. Các nghiên cứu trong tương lai là cần thiết để xác định rõ hơn VT tối ưu ở bệnh nhân đột quỵ cần MV.
PEEP
Ứng dụng PEEP cải thiện oxy động mạch. Tuy nhiên, ở những bệnh nhân bị chấn thương não, cần thận trọng vì PEEP có thể làm trầm trọng thêm hoặc gây tăng áp lực nội sọ [51, 58]. Mascia và cộng sự. gợi ý rằng ICP tăng đáng kể khi PEEP được áp dụng, nhưng chỉ ở những bệnh nhân mà PEEP gây ra hiện tượng bơm tăng động quá mức phế nang với sự gia tăng PaCO2 do đó, trong khi ICP không đổi khi PEEP tạo ra được sự huy động phế nang mà không thay đổi PaCO2 [58]. Trong một nghiên cứu thử nghiệm ở cả lợn khỏe mạnh và lợn đột quỵ, mức PEEP cao (lên đến 25 cmH2O) không làm giảm ICP, oxy hóa não hoặc lưu lượng máu não khu vực [59]. Áp dụng PEEP cao (lên đến 20 cmH20) ở bệnh nhân đột quỵ xuất huyết làm giảm đáng kể áp lực động mạch trung bình (MAP) và lưu lượng máu não khu vực, nhưng các phân tích sâu hơn cho thấy rằng những thay đổi trong lưu lượng máu não khu vực phụ thuộc vào sự thay đổi MAP là kết quả của suy giảm tự điều hòa mạch máu não [59]. Georgiadis và cộng sự. cho thấy PEEP có thể an toàn ở những bệnh nhân bị đột quỵ cấp, ngay cả sau khi tăng mức PEEP lên đến 12 mmHg, miễn là MAP được duy trì [60]. Ngoài ra, một thử nghiệm gần đây trên bệnh nhân không ARDS đã chứng minh sự không thua kém của chiến lược VT thấp, PEEP thấp so với VT cao [61]. Do đó, PEEP được coi là an toàn nếu (1) tình trạng huyết động và lưu lượng máu được duy trì để giảm thiểu tác động của PEEP lên áp lực tưới máu não và (2) giá trị của PEEP thấp hơn ICP, để tránh giảm dòng chảy trở về của tĩnh mạch [55], do đó, có tác dụng hữu ích đối với quá trình oxy hóa não [62] trong khi (3) tránh tình trạng căng quá mức và giữ cho phổi được nghỉ ngơi [63].
Recruitment manoeuvres
Huy động phế nang (RM) có thể cải thiện trao đổi khí ở phổi và cơ hô hấp [64]. Tuy nhiên, chúng cũng có thể gây ra tăng áp lực nội sọ bằng cách làm suy giảm dòng chảy hồi lưu tĩnh mạch và cản trở tĩnh mạch não trở về tâm nhĩ phải [64]. Trong một nghiên cứu của Bein và các đồng nghiệp về bệnh nhân tổn thương não (6/11 là bệnh nhân đột quỵ) và tổn thương phổi cấp tính, RM thể tích (bao gồm sự gia tăng dần dần trong 30 giây áp lực đỉnh lên đến 60 cmH2O và áp lực duy trì ở mức tương tự trong 30 giây tiếp theo) dẫn đến suy giảm oxy trong não, đồng thời, giảm MAP và tăng ICP, với giảm áp lực tưới máu não nghiêm trọng. Ở 9 bệnh nhân bị tổn thương não (trong đó 6 bệnh nhân đột quỵ), RM từng bước với mức tăng và giảm không liên tục 3 cmH2O của PEEP đã được áp dụng [65], dẫn đến mối tương quan thuận giữa PEEP và ICP và tương quan nghịch giữa PEEP và áp lực tưới máu não (CPP). Những dữ liệu này cho thấy tác động của PEEP đối với huyết áp và áp lực tưới máu não rất khác nhau ở những bệnh nhân bị tổn thương não cấp tính và việc theo dõi MAP và ICP nghiêm ngặt sẽ có lợi khi áp dụng PEEP. Do đó, RM có thể được thực hiện một cách an toàn khi được chỉ định ở những bệnh nhân bị cả đột quỵ và tổn thương phổi, đặc biệt nếu đặt mức PEEP thấp hơn ICP và duy trì MAP hiệu quả [66].
Tư thế nằm sấp
Tương tự như RM, tư thế nằm sấp đã được chứng minh là một kỹ thuật hiệu quả để cải thiện oxy hóa nhưng nên được sử dụng thận trọng ở những bệnh nhân bị đột quỵ và giảm độ chung giãn nội sọ, vì nó có thể làm tăng áp lực trong lồng ngực và tăng ICP [67]. Chỉ có một nghiên cứu khảo sát ảnh hưởng của tư thế nằm sấp đối với suy hô hấp cung cấp dữ liệu về huyết động não ở bệnh nhân đột quỵ, với kết quả trái ngược nhau [68]. Do đó, lợi ích và nguy cơ của việc nằm sấp ở bệnh nhân đột quỵ vẫn chưa rõ ràng. Nekludov và cộng sự nhận thấy sự cải thiện đáng kể về oxy phổi, nhưng sự gia tăng ICP trong một nhóm 8 bệnh nhân có GCS ≤ 8 (3 trong số là bị đột quỵ) và tổn thương phổi [67]. Thelandersson và cộng sự đã điều tra 11 bệnh nhân thần kinh (5 trong số họ bị đột quỵ) với FiO2> 0,4 ở tư thế nằm sấp chỉ trong 3 giờ, và cũng phát hiện thấy sự gia tăng oxy toàn thân, nhưng không giống như nghiên cứu trước, không có thay đổi đáng kể trong ICP hoặc MAP [69 ]. Nhìn chung, tư thế nằm sấp có thể gây ra thách thức ở bệnh nhân đột quỵ vì nguy cơ phát triển tăng áp lực nội sọ và dịch chuyển các công cụ theo dõi thần kinh. Tuy nhiên, nó có thể được xem xét ở những bệnh nhân bị giảm oxy máu nặng, kháng trị và đang được theo dõi thần kinh đa phương thức nghiêm ngặt.
Các chiến lược thông khí khác
Chưa có đầy đủ các nghiên cứu để đánh giá vai trò và tính an toàn của thông khí dao động tần số cao (HFOV) trong dân số đột quỵ. Về mặt lý thuyết, việc áp dụng áp lực đường thở trung bình cao hơn có thể làm giảm dẫn lưu tĩnh mạch não, và độ thanh thải PCO2 có thể không đủ; cả hai khía cạnh đều không thể xuất hiện ở những bệnh nhân bị chấn thương sọ não nặng. Rất ít nghiên cứu quan sát đánh giá việc sử dụng HFOV ở người lớn bị tổn thương não cấp tính, thậm chí ít tập trung vào đột quỵ hơn [70]. Trong một tổng quan hệ thống về ảnh hưởng của HFOV đối với áp lực tưới máu não và áp lực nội sọ, các tác giả kết luận rằng đối với bệnh nhân chấn thương sọ não và ARDS, HFOV có thể cải thiện quá trình oxy hóa và tăng PaCO2. Do đó, nếu HFOV được xem xét, việc theo dõi liên tục độ bão hòa oxy, MAP, PaCO2 và ICP là điều tối quan trọng [70].
Trong trường hợp thiếu oxy đe dọa tính mạng không thể chữa cứu vãn với MV thông thường, việc sử dụng các liệu pháp cứu hộ đã được khuyến khích để thiết lập lại mức oxy đầy đủ trong khi giảm thiểu chấn thương liên quan đến máy thở. Trong một số trường hợp được chọn, các kỹ thuật hỗ trợ phổi ngoài cơ thể đã được xem xét [71].
Tóm lại, ở bệnh nhân đột quỵ cần MV, thông khí bảo vệ với sự theo dõi chặt chẽ các biến số thần kinh và hô hấp là điều cần thiết để đảm bảo an toàn cho phổi và tránh tổng thương sọ não thứ phát. Hơn nữa, việc theo dõi oxy máu não nên được sử dụng khi có thể để bác sĩ lâm sàng phân biệt giữa oxy mô bình thường và suy giảm nghiêm trọng và giúp điều chỉnh cài đặt máy thở [9, 55]. Trong tương lai, việc giám sát não không xâm lấn có thể được thực hiện đối với các cơ sở máy thở riêng [72].
Rút nội khí quản
Các bệnh nhân thần kinh trải qua thời gian nằm ICU và thở máy kéo dài, tỷ lệ mở khí quản sớm cao hơn, và tỷ lệ viêm phổi do thở máy cao hơn so với bệnh nhân không thần kinh [5]. Mặc dù thường cần thiết và có thể cứu sống, MV phụ thuộc vào thời gian liên quan đến các biến chứng khác nhau và có thể làm tăng tỷ lệ mắc bệnh và tử vong [73]. Do đó, cai thở máy đã được đề nghị tiến hành càng sớm càng tốt và an toàn. Hơn nữa, có bằng chứng cho thấy bệnh nhân thần kinh đặc biệt dễ bị thất bại khi rút nội khí quản, với tỷ lệ đặt lại nội khí quản cao, dao động từ 20 đến 40% [74]. Dự đoán rút nội khí quản thành công là rất quan trọng, vì cả rút nội khí quản chậm và sớm đều làm tăng tỷ lệ biến chứng cần phải mở khí quản, thời gian nằm ICU và tỷ lệ tử vong [75]. Thật không may, các yếu tố dự báo hô hấp cổ điển để rút nội khí quản thành công trong chăm sóc hồi sức chung (như VT, nhịp hô hấp, lực hít âm, khả năng sống cưỡng bức, chỉ số thở nông nhanh và PaO2/ FiO2) không đáng tin cậy ở những bệnh nhân bị tổn thương não [76]. Mức độ ý thức tại thời điểm rút nội khí quản có thể được coi là một yếu tố nguy cơ dẫn đến thất bại khi rút nội khí quản [77], nhưng một nghiên cứu gần đây [73] cho thấy kết quả gây tranh cãi. Trong một phân tích tổng hợp [74] đặc biệt tìm kiếm các yếu tố dự báo thất bại rút ống ở bệnh nhân chăm sóc thần kinh, chỉ số GCS thấp (7-9) được xác định là một yếu tố nguy cơ, tăng gần gấp 5 lần nguy cơ đặt lại ống nội khí quản. Các yếu tố khác bao gồm khả năng tuân theo mệnh lệnh, kết cấu khả năng bài tiết đàm nhớt và sự hiện diện của phản xạ hầu họng. Trong một nghiên cứu hồi cứu nhỏ trên bệnh nhân đột quỵ động mạch não giữa, điểm GCS tổng hợp là 8 với điểm mắt là 4 có liên quan đến rút nội khí quản thành công [78]. Tuy nhiên, chỉ số GCS không thể được coi là một yếu tố tiên đoán cho sự thành công của rút nội khí quản, vì nó chưa bao giờ được xác nhận ở những bệnh nhân được đặt nội khí quản mà thành phần lời nói của họ không thể đánh giá và thường được cho điểm một cách tùy tiện [79]. Gần đây hơn, Godet et al. [73] đã phát triển một điểm số lâm sàng để dự đoán thất bại khi rút nội khí quản ở dân số bị tổn thương não nói chung với GCS <12 trước khi đặt nội khí quản, được đặt nội khí quản vì lý do thần kinh và thở máy trong hơn 48 giờ; nó bao gồm các chức năng của đường hô hấp trên (ví dụ như phản xạ hầu họng, ho và tiêu đàm) và tình trạng thần kinh (được đánh giá thông qua điểm thị giác của Thang điểm phục hồi hôn mê). Tuy nhiên, cần xác nhận bên ngoài của điểm số này và không có dữ liệu cụ thể cho bệnh nhân đột quỵ. Dữ liệu gần đây đã đánh giá các đặc điểm thực thể mới ở những bệnh nhân bị tổn thương não nặng. Trong một nghiên cứu đa trung tâm, tuổi <40, theo dõi thị giác, cố gắng nuốt và GCS > 10 được phát hiện là những yếu tố dự báo rút nội khí quản thành công [80]. Trên cơ sở các mục này, điểm VISAGE đã được xây dựng. Nếu ba mục trở lên là dương tính, tỷ lệ rút nội khí quản thành công có thể là 90%. Theo dõi bằng thị giác và phản xạ đường thở trên được bảo tồn [73], tuổi trẻ hơn [81], cân bằng dịch âm tính và sự hiện diện của ho đã được mô tả là những dấu hiệu thuận lợi của việc rút nội khí quản thành công bởi các nghiên cứu quan sát khác. Các nghiên cứu sâu hơn được đảm bảo để xác nhận kết quả của các nghiên cứu mới nhất trên bệnh nhân thần kinh nói chung và đột quỵ nói riêng.
Mở khí quản
Có tới 45% bệnh nhân nhập viện ICU do đột quỵ cần phải mở khí quản (TT) [81] so với 10–15% trong dân số ICU nói chung [5]. Các ưu điểm đã được công nhận của việc mở khí quản so với đặt nội khí quản kéo dài là giảm các tổn thương ở hầu họng và thanh quản, vệ sinh răng miệng và chăm sóc điều dưỡng tốt hơn, bệnh nhân dễ chịu hơn [4]. Các yếu tố tiên đoán có thể gợi ý quyết định thực hiện mở khí quản ở bệnh nhân đột quỵ đã được mô tả trong một vài nghiên cứu [82, 83]. Các loại đột quỵ khác nhau có liên quan đến nhu cầu mở khí quản, bao gồm đột quỵ bán cầu lớn, huyết khối nền, nhồi máu thân não và đột quỵ tiểu não[82]. Thật vậy, vị trí và phần mở rộng của tổn thương não và các tác động phụ của nó (bao gồm phù não và thiếu máu cục bộ thứ phát) có thể ảnh hưởng đến nhu cầu hỗ trợ MV. Đặc biệt, sự tổn thương của các vùng não điều hòa nhịp thở (trung tâm hô hấp ở cầu não, hoặc tủy), mức độ ý thức (hệ thống lưới, đồi thị), và nuốt (tủy và thân não) có thể dẫn đến suy hô hấp và cần phải mở khí quản [ 82]. Có hai kịch bản lâm sàng chính trong đó thở máy và mở khí quản thường được xem xét sau đột quỵ. Đầu tiên là ở những bệnh nhân bị đột quỵ rộng đến mức phải nhập viện ICU và MV. Trong những trường hợp này, thông khí lâu dài và kéo dài không đủ bảo vệ đường thở nếu rút nội khí quản thất bại hoặc được coi là không khả thi là những chỉ định chính để mở khí quản [82, 83]. Tình huống thứ hai là ở những bệnh nhân bị đột quỵ với mức độ tổng thể chỉ ở mức độ trung bình, nhưng ảnh hưởng đến các trung tâm nuốt của não (chẳng hạn như nhồi máu thân não hoặc tủy sống), gây ra chứng khó nuốt. Trong trường hợp này, quyết định thực hiện mở khí quản có thể liên quan đến chứng khó nuốt nặng gây nguy cơ hít sặc [84].
Trong một nghiên cứu hồi cứu của Szeder et al. [85] trên bệnh nhân xuất huyết nội sọ, các đặc điểm liên quan đến nhu cầu KKQ là GCS <9 ở ngày thứ 3 cũng như các phát hiện X quang như não úng thủy, dịch chuyển đường giữa và xuất huyết não thất. Schonenberger và cộng sự. [83] đề xuất thang điểm mở khí quản sớm liên quan đến đột quỵ (SET) để sàng lọc bệnh nhân đặt nội khí quản kéo dài và cần KKQ bằng cách kết hợp các thông số thần kinh (ví dụ như khó nuốt và GCS <10), các đặc điểm hình ảnh thần kinh (ví dụ tổn thương thân não, não úng thủy, thể tích xuất huyết nội sọ > 25 mL), chức năng cơ quan chung và các thủ tục phẫu thuật. Hơn nữa, Steidl et al. thực hiện một nghiên cứu quan sát tiến cứu, hai trung tâm trên cả bệnh nhân đột quỵ do thiếu máu cục bộ và xuất huyết để đánh giá tỷ lệ rút nội khí quản so với phẫu thuật mở khí quản. Nhìn chung, 47% bệnh nhân được rút khai khí quản mà không có bất kỳ nỗ lực rút nội khí quản nào, trong khi 53% được rút nội khí quản chủ yếu. Trong số những bệnh nhân chủ yếu được khai khí quản, hầu hết đều bị đột quỵ xuất huyết, Thang điểm đột quỵ của Viện Y tế Quốc gia cao hơn (NIHS) và điểm Glasgow Hôn mê khi nhập viện thấp hơn. Ngoài ra, họ được điều trị phẫu thuật thần kinh nhiều hơn so với những người rút nội khí quản [86]. Như y văn có thể suy luận, thời điểm KKQ tối ưu ở bệnh nhân đột quỵ vẫn chưa rõ ràng. Các lợi ích tiềm năng của KKQ sớm (như thời gian thở máy và thời gian nằm, cai thở máy, an toàn đường thở, tỷ lệ viêm phổi, kết cục và tử vong) vẫn chưa được chứng minh [4]. McCann và cộng sự đã chứng minh thời gian nằm viện giảm ở những bệnh nhân được khai khí quản sớm hơn (trong vòng 1 tuần) và nội soi mở dạ dày qua da (PEG) ở bệnh nhân đột quỵ xuất huyết [87]. Một phân tích tổng hợp gần đây của McCredie et al. đánh giá hiệu quả của KKQ sớm so với muộn hoặc kéo dài ở bệnh nhân tổn thương não cấp tính. Mười thử nghiệm đáp ứng các tiêu chí lựa chọn. KKQ sớm làm giảm tỷ lệ tử vong lâu dài và thời gian thở máy, nhưng không đủ thử nghiệm để thực hiện phân tích phân nhóm; do đó, nghiên cứu đề cập đến dân số ICU thần kinh nói chung, và không có dữ liệu cụ thể nào được báo cáo về bệnh nhân đột quỵ [88]. Nhìn chung, vì nguy cơ thủ thuật thấp và việc mở khí quản sớm dường như không ảnh hưởng đến diễn biến lâm sàng của bệnh nhân đột quỵ thở máy, nên đánh giá thông khí sau tuần đầu tiên của chăm sóc tích cực và xem xét mở khí quản nếu nỗ lực rút nội khí quản thất bại hoặc được đánh giá không khả thi [4].

Kết luận
Mặc dù không có dữ liệu cụ thể về tác động của quản lý hô hấp đối với kết cục của bệnh nhân đột quỵ, nhưng các chiến lược thở máy cụ thể trong nhóm đối tượng này có thể cải thiện kết quả thần kinh và ngăn ngừa suy hô hấp bằng cách điều chỉnh các yếu tố nguy cơ có thể thay đổi được hoặc kiểm soát tình trạng viêm do não gây ra ở các cơ quan xa, chủ yếu là phổi. Thông khí bảo vệ phải được xem xét trong nhóm dân số này để đạt được mục tiêu là mức oxy và CO2 bình thường tránh VT cao. Do thiếu bằng chứng rõ ràng và chất lượng kém của các nghiên cứu có sẵn, các quyết định lâm sàng liên quan đến chiến lược thở máy ở bệnh nhân đột quỵ nên được thực hiện trên cơ sở từng trường hợp cụ thể, xem xét các đặc điểm, nguy cơ và lợi ích của bệnh nhân cũng như tiên lượng và tình trạng thần kinh, sử dụng theo dõi não đa phương thức để đánh giá huyết động và oxy máu não và đánh giá tác dụng của thông khí bảo vệ (đặc biệt của PaCO2 và PEEP). Do đó, chúng tôi đề xuất một danh sách các khuyến nghị dựa trên các tài liệu hiện có (Hình 3). Cần có các thử nghiệm tiếp theo để hướng dẫn xử trí thông khí trong đột quỵ do thiếu máu cục bộ cấp và đánh giá sự khác biệt có thể có giữa các căn nguyên khác nhau của đột quỵ





