Bài viết Cơn bão thượng thận được bác sĩ Triệu Ngân biên dịch lại từ bài gốc Adrenal Crisis trên tạp chí của R. Louise Rushworth, M.B., B.S., Ph.D., David J. Torpy, M.B., B.S., Ph.D., and Henrik Falhammar, M.D., Ph.D.
August 29, 2019
N Engl J Med 2019; 381:852-861
DOI: 10.1056/NEJMra1807486
Liệu pháp thay thế Glucocorticoid, có từ những năm 1950
Liệu pháp thay thế glucocorticoid, có từ những năm 1950, đã kéo dài sự sống sót của nhiều bệnh nhân suy tuyến thượng thận.[1] Tuy nhiên, cơn bão thượng thận (adrenal crisis) là những tình trạng khẩn cấp đe dọa đến tính mạng, vẫn xảy ra làm ảnh hưởng nhiều mặt đến bệnh nhân. Cơn bão thượng thận dường như đang tăng lên về tần suất, mặc dù có sẵn các chiến lược phòng ngừa hiệu quả.[2-4] Bài đánh giá này nói về định nghĩa, sinh lý bệnh, dịch tễ học và điều trị cơn bão thượng thận.
Cơn bão thượng thận là gì?
Không có định nghĩa nào được chấp nhận về cơn bão thượng thận, còn được gọi là suy tuyến thượng thận cấp (acute adrenal insufficiency) hoặc cơn bệnh Addison (addisonian crisis) .[5] Nói chung, rối loạn sinh lý cấp tính ở bệnh nhân bị suy giảm hormon vỏ thượng thận được xem là cơn bão thượng thận trên cơ sở đánh giá lâm sàng.[2,5,6] Chẩn đoán phân loại sai có thể không thay đổi quản lý ngay, nhưng ở cấp độ dịch tễ học, có thể cản trở sự hiểu biết về bản chất của các cơn bão thượng thận.
Do thiếu phân loại dựa trên nghiên cứu và xác nhận những thay đổi sinh lý phân biệt cơn bão thượng thận với giai đoạn nhẹ hơn là thiếu hormon thượng thận, [5-11] định nghĩa thực tế thường được áp dụng, cơn bão thượng thận ở người trưởng thành được xác định là tình trạng suy giảm cấp tính về tình trạng sức khỏe liên quan đến hạ huyết áp tuyệt đối (huyết áp tâm thu <100 mm Hg) hoặc hạ huyết áp tương đối (huyết áp tâm thu thấp hơn bình thường ≥ 20 mm Hg), với các biểu hiện lâm sàng biến mất trong vòng 1 đến 2 vài giờ sau khi dùng glucocorticoid đường tĩnh mạch (nghĩa là dấu hiệu hạ huyết áp rõ rệt trong vòng 1 giờ và cải thiện các triệu chứng lâm sàng trong khoảng thời gian 2 giờ).
Do việc xác định hạ huyết áp ở trẻ sơ sinh và trẻ nhỏ trong trường hợp khẩn cấp có thể khó khăn, cơn bão thượng thận ở lứa tuổi này được xác định là tình trạng suy giảm cấp tính về tình trạng sức khỏe liên quan đến rối loạn huyết động cấp (hạ huyết áp hoặc nhịp nhanh xoang so với mức dữ liệu theo tuổi ) hoặc bất thường điện giải rõ rệt (ví dụ, hạ natri máu, tăng kali máu hoặc hạ đường huyết không liên quan đến bệnh khác). Sau khi tiêm glucocorticoid đường tĩnh mạch, các đặc điểm được cho là của cơn bão thượng thận giải quyết đáng kể.[12-16]
Các biểu hiện đồng thời ở bệnh nhân ở mọi lứa tuổi bao gồm các triệu chứng ở bụng cấp tính; mê sảng, thờ ơ, hoặc cả hai; và hạ natri máu, tăng kali máu, hạ đường huyết và tăng thân nhiệt (pyrexia) .[5-11] Khi hạ huyết áp do cơn bão thượng thận không đáp ứng hoặc đáp ứng kém với glucocorticoid tĩnh mạch, xem xét bệnh khác cùng tồn tại liên quan đến hạ huyết áp như là nhiễm trùng huyết.
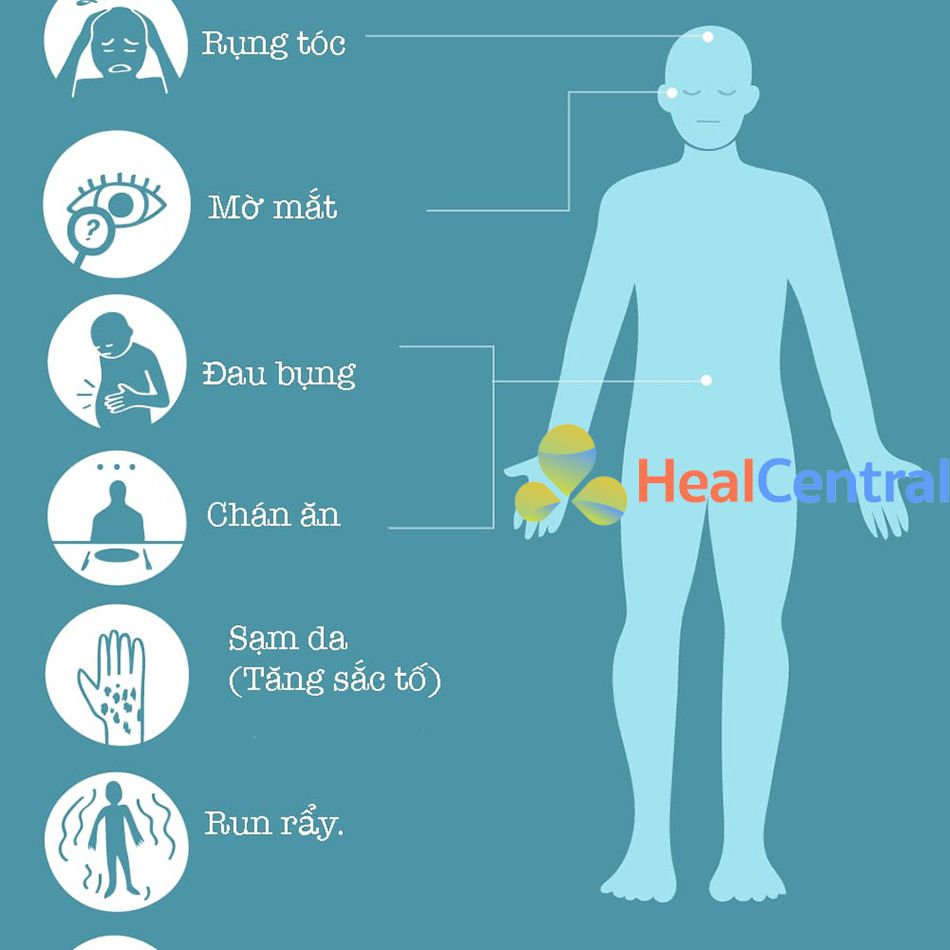
Cơn bão thượng thận là biểu hiện nghiêm trọng nhất của suy thượng thận, nhưng đều có các triệu chứng tương tự là tình trạng giảm hormon thượng thận. Những triệu chứng này bao gồm chán ăn, buồn nôn, nôn, mệt mỏi, chóng mặt tư thế, đau bụng, chân tay, đau lưng và suy giảm ý thức. Các rối loạn sinh hóa được biết đến bao gồm hạ natri máu, tăng kali máu (trong suy tuyến thượng thận nguyên phát [Bệnh Addison và tăng sản tuyến thượng thận bẩm sinh]) và hạ đường huyết (thường gặp ở trẻ em hơn ở người lớn) (Bảng 1) .[5-8,11].
| Bảng 1. Triệu chứng, dấu hiệu và đặc điểm sinh hóa của cơn bão thượng thận.* |
Triệu chứng:
Dấu hiệu:
Bất thường sinh hóa trong xét nghiệm máu thường quy:
|
* Cơn bão thượng thận được định nghĩa là sự suy giảm cấp về tình trạng sức khỏe liên quan đến hạ huyết áp (tuyệt đối hoặc tương đối), với các biểu hiện được giải quyết trong vòng 1 đến 2 giờ sau khi dùng glucocorticoid đường tĩnh mạch (nghĩa là tăng huyết áp trở lại rõ rệt trong vòng 1 giờ và cải thiện lâm sàng triệu chứng trong khoảng thời gian 2 giờ). Vì hạ huyết áp có thể khó xác định ở trẻ sơ sinh và trẻ nhỏ hơn ở người lớn, rối loạn huyết động cấp, hay bất thường rõ rệt ở một hoặc nhiều chất điện giải, hoặc hạ đường huyết không thể quy cho một bệnh khác có thể được sử dụng để xác định.
† Tăng sắc tố phát triển chậm và có thể là một dấu hiệu đặc trưng của suy thượng thận nguyên phát không được chẩn đoán (bệnh Addison hay bệnh tăng sản tuyến thượng thận bẩm sinh) hoặc do không đủ liều thay thế glucocorticoid trong một thời gian dài ở bệnh nhân bị suy tuyến thượng thận nguyên phát.
Tuy nhiên, bệnh cấp tính ở bệnh nhân trước đây đã được chẩn đoán suy thượng thận nguyên phát mà không có bằng chứng về rối loạn huyết động hoặc hạ huyết áp (hoặc ở trẻ nhỏ, chậm đổ đầy mao mạch hoặc nhịp tim nhanh cũng như các biểu hiện thực thể khác) nên được coi là khác biệt về mặt sinh lý và thay vào đó là phân loại là triệu chứng suy thượng thận, tiền thân của cơn bão thượng thận hoặc cơn bão thượng thận khởi đầu (incipient adrenal crisis) .[2,5,7,8] Các triệu chứng rõ rệt khi không bị tụt huyết áp có thể báo hiệu cơn bão thượng thận khởi đầu, và điều trị bằng hydrocortisone và dịch truyền tĩnh mạch có thể ngăn phát triển của cơn bão thượng thận thực sự .
Đặc điểm sinh lý bệnh
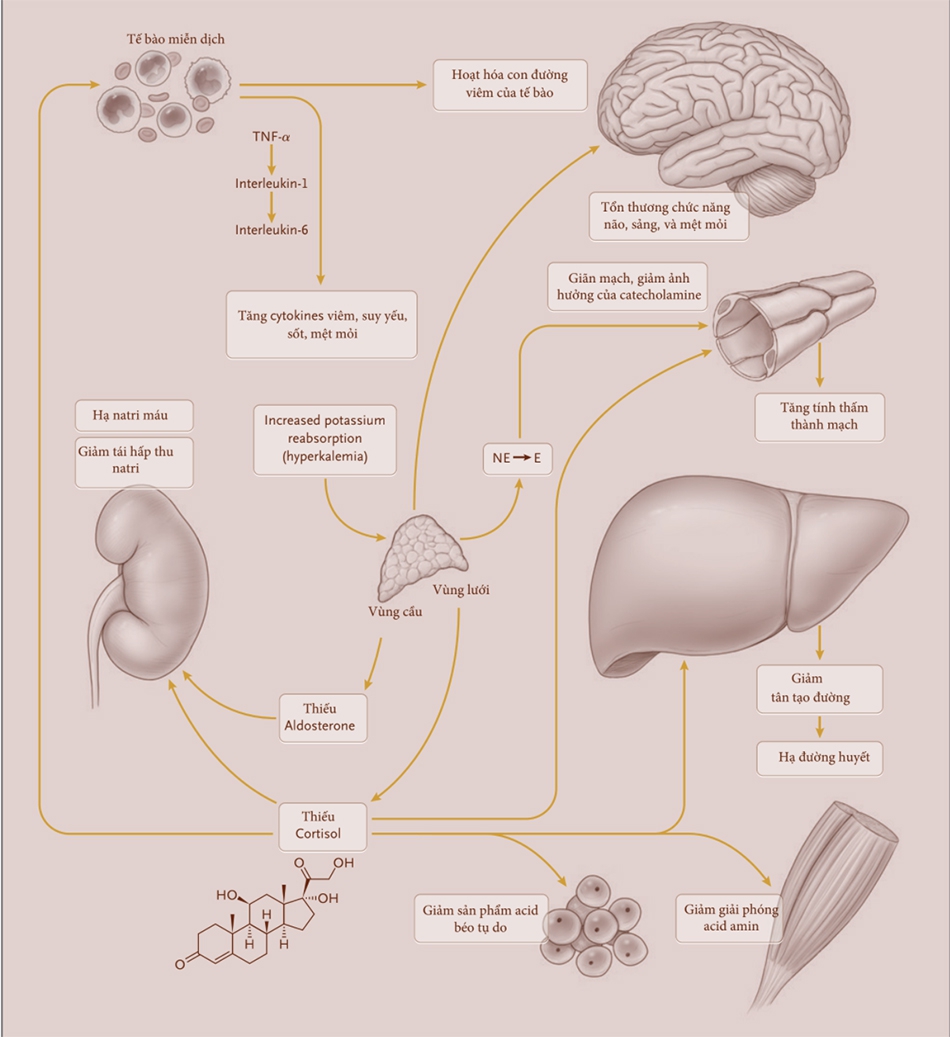
Cơn bão thượng thận phát sinh từ sự thiếu hụt tuyệt đối hoặc tương đối của cortisol, một glucocorticoid nội sinh; trong trường hợp đó, không có đủ glucocorticoid hoạt hóa mô để duy trì cân bằng nội môi. Các quá trình sinh lý bệnh được mô tả trong Hình 1.
Cortisol có thời gian bán hủy trong tuần hoàn là 90 phút; do đó, các mô trở nên thiếu trong vòng vài giờ sau khi thiếu cortisol. Cortisol có tác dụng đa hướng (pleiotropic effect) cao là do điều hòa phiên mã các gen mang yếu tố đáp ứng glucocorticoid (29% ở tất cả các gen) .[17] Hậu quả sinh lý của việc thiếu cortisol là lan rộng và bắt đầu mất tác dụng ức chế bình thường của glucocorticoid nội sinh trên các cytokine viêm dẫn đến sự gia tăng nhanh chóng nồng độ cytokine gây ra sốt, khó chịu, chán ăn và đau khắp cơ thể. Do đó, thiếu hụt cortisol dẫn đến thay đổi hệ thống tế bào miễn dịch (giảm bạch cầu trung tính, tăng bạch cầu ái toan và tăng lympho bào); mất tác dụng hiệp đồng của cortisol với catecholamine trên hoạt động tại mạch máu, dẫn đến giãn mạch và hạ huyết áp; ảnh hưởng gan đến chuyển hóa trung gian, với giảm tân tạo đường, hạ đường huyết hoặc cả hai; và giảm axit béo tự do và axit amin trong tuần hoàn.[18-21]
Ở cấp độ tế bào, mất cortisol làm suy yếu hoạt động của protein hoạt hóa 1 (AP-1) và yếu tố nhân κB (NF-kB), dẫn đến tác động giải phóng các gen sản xuất protein gây viêm, do bị bất hoạt sự ức chế cortisol bình thường giữa gắn kết của NF-κB với thụ thể glucocorticoid.[17,18] Ngoài ra, thiếu hụt mineralocorticoid nổi bật ở bệnh suy tuyến thượng thận nguyên phát nhưng không gặp thứ phát, [3,22, 23 ] tình trạng này có khả năng làm nặng thêm các cơn bão thượng thận thông qua mất natri và nước và tăng giữ kali.
Đặc điểm dịch tễ
Mỗi năm, có khoảng 6 đến 8% bệnh nhân bị suy tuyến thượng thận có cơn bão thượng thận.[2.3] Các cơn bão thượng thận xảy ra thường xuyên hơn ở những bệnh nhân bị suy thượng thận nguyên phát so với những người bị suy tuyến thượng thận thứ phát, có thể là do còn bảo tồn một phần bài tiết cortisol ở một số bệnh nhân suy thượng thận thứ phát, [3] cũng như không có sự bài tiết mineralocorticoid ở những bệnh nhân bị suy thượng thận nguyên phát. [22-24] Các cơn bão thượng thận không phổ biến ở những bệnh nhân suy thượng thận do điều trị bằng glucocorticoid lâu dài. [25]
Sự nhạy cảm với cơn bão thượng thận khác nhau ở những bệnh nhân bị thiếu hormon vỏ thượng thận. Các yếu tố nguy cơ bao gồm tuổi già, tiền sử bị cơn bão thượng thận trước đó, sự hiện diện của hội chứng tự miễn đa tuyến (autoimmune polyglandular syndromes), đái tháo đường týp 1 và các tình trạng cùng tồn tại như hen và bệnh tim. Tuy nhiên, cơ chế tác động của các yếu tố khác nhau trong cơn bão thượng thận không rõ ràng và có thể cụ thể đối với các tình trạng tồn tại.[22,23,26,27] Ngoài ra, các yếu tố chưa biết có thể làm tăng nguy cơ cơn bão thượng thận, vì một số bệnh nhân có nhiều đợt, trong khi những người khác có rất ít, nếu có chỉ vài cơn.[28] Một mối liên quan giữa sự xuất hiện của cơn bão thượng thận và suy nhược mãn tính (chronic asthenia) là đặc trưng của thiếu hormon vỏ thượng thận nhưng chưa được thiết lập. Tuy nhiên, một nghiên cứu gần đây, đa trung tâm sử dụng bảng câu hỏi để lấy dữ liệu từ 110 bệnh nhân bị suy tuyến thượng thận nguyên phát cho thấy mối liên hệ tích cực giữa các giai đoạn cơn bão thượng thận và chất lượng cuộc sống kém. [29]
Trên cơ sở dữ liệu dịch tễ học đã đề xuất rằng tỷ lệ cơn bão thượng thận gia tăng có thể là do sử dụng thuốc glucocorticoid liều thấp, ngắn (hydrocortisone hoặc cortisone acetate) ở bệnh nhân bị thiểu hormon vỏ thượng thận .[2,4,30,31] Giả thuyết này được hỗ trợ bởi bằng chứng từ một phân tích theo chiều dọc liên quan đến 156 bệnh nhân bị tăng sản tuyến thượng thận bẩm sinh đã được chăm sóc tại trung tâm. Nghiên cứu cho thấy rằng liều thay thế hydrocortisone cơ bản thấp có liên quan đến tần suất các cơn mắc suy tuyến thượng thận khác nhau, cần dùng liều bổ sung (“liều stress”) của glucocorticoids.[30]
Tỷ lệ tử vong
Cơn bão thượng thận góp phần vào tỷ lệ tử vong ở những bệnh nhân bị thiếu hormon vỏ thượng thận;Cơn bão thượng thận – liên quan tỷ lệ tử vong có thể lên tới 6% trong các cơn. Cơn bão thượng thận có thể góp phần làm tăng tỷ lệ tử vong bị đổ cho là bệnh nhiễm trùng khi thiếu hormon vỏ thượng thận. Các cơn bão thượng thận gây tử vong đã xảy ra ở những bệnh nhân không được chẩn đoán trước đó về tình trạng giảm hormon vỏ thượng thận, do các triệu chứng có thể bị bỏ sót trước giai đoạn gây tử vong.
Yếu tố thúc đẩy cơn bão thượng thận
Nhiễm trùng đóng vai trò là tác nhân gây viêm, thường làm giảm cơn bão thượng thận. [2,3,22,26-28] Viêm dạ dày ruột thường được xem là yếu tố thúc đẩy và có thể đặc biệt nguy hiểm, vì nôn và tiêu chảy làm giảm hấp thu thuốc uống và cũng có thể làm trầm trọng thêm tình trạng mất nước . Tuy nhiên, các triệu chứng ở bụng của cơn bão thượng thận có thể dẫn đến chẩn đoán sai do viêm dạ dày ruột.[2,5,22] Nhiễm trùng do vi khuẩn chiếm ưu thế trong các yếu tố thúc đẩy liên quan đến nhiễm trùng ở bệnh nhân lớn tuổi, trong khi đó nhiễm virut là yếu tố thúc đẩy phổ biến hơn ở trẻ em. [12,22,27,28,41,42]
Các trạng thái sinh lý bệnh khác có thể thúc đẩy cơn bão thượng thận nếu cơ thể không thể tăng cortisol nội sinh và nếu liều điều trị thay thế không tăng đủ. Các điều kiện như vậy bao gồm chấn thương nặng và phẫu thuật lớn, nhưng các bệnh cảnh thường liên quan đến nhu cầu tăng cortisol nhẹ hơn (tập thể dục và cảm xúc buồn bã) đã được báo cáo là thúc đẩy lên đến 10% các cơn, theo đó kết quả khảo sát bệnh nhân có các cơn mà không có yếu tố thúc đẩy cụ thể nào được xác định. [3,22,24,27,28] Các cơn bão thượng thận đã được báo cáo liên quan đến việc giải phóng các cytokine pha cấp và các chất khác sau một số thủ thuật y tế tương đối nhỏ như tiêm chủng và truyền axit zoledronic.[43, 44]
Một số loại liệu pháp miễn dịch hoặc hóa trị liệu có thể thúc đẩy các cơn bão thượng thận. Ví dụ, liệu pháp ức chế miễn dịch điểm kiểm soát (immune-checkpoint inhibitor therapy), thường được sử dụng trong điều trị melanoma và một số bệnh ung thư khác, có thể gây ra suy tuyến thượng thận (nguy cơ <1%) do khởi phát từ viêm tuyến yên (và thiếu hụt hormon tuyến yên) hoặc viêm tuyến thượng thận.
[45] Nếu những tác dụng phụ nghiêm trọng này xảy ra, cần phải điều trị glucocorticoid thay thế nhanh chóng. [45,46]
Việc không tuân thủ điều trị thay thế glucocorticoid cũng có thể thúc đẩy cơn bão thượng thận.[22,28] Bệnh nhân cần được giáo dục về sự nguy hiểm của việc bỏ liều hoặc ngừng thuốc, đặc biệt là trong giai đoạn phẫu thuật và trong khi điều trị bằng glucocorticoid dài hạn, tăng cao hơn liều thay thế (3 đến 5 mg thuốc prednisone hoặc tương đương mỗi ngày), do ngừng thuốc đột ngột có thể đóng vai trò là yếu tố thúc đẩy.[22,47]. Bác sĩ lâm sàng ngừng điều trị glucocorticoid đột ngột cũng được báo cáo là nguyên nhân gây ra cơn bão thượng thận. [48]
Nhiễm độc giáp (thyrotoxicosis) cùng tồn tại không được chẩn đoán, hoặc bắt đầu điều trị bằng thyroxine khi bệnh nhân thiếu hormon vỏ thượng thận mà bỏ sót chẩn đoán có thể thúc đẩy cơn bão thượng thận.[2,49,50] . Thêm nữa, do cytochrom P-450 3A4 (CYP3A4) như avasimibe, carbamazepine, rifampicin, phenytoin và chiết suất từ cây ban âu (St.John’s wort) có thể làm tăng chuyển hóa hydrocortison, cần phải tăng liều glucocorticoid ở những bệnh nhân đang điều trị suy tuyến thượng thận, hoặc có thể gây ra cơn bão thượng thận ở bệnh nhân bị suy tuyến thượng thận mà không được chẩn đoán trước đó.[51] Ngược lại, thuốc ức chế men CYP3A4 vorico- nazole, grapefruit juice, itraconazole, ketoconazole ,clarithromycin,lopinavir, nefazodone, posacona- zole, ritonavir, saquinavir, telaprevir, telithro- mycin, and conivaptan có thể ức chế chuyển hóa hydrocortisone, tăng nồng độ hydrocortisone và do đó tăng cường hiệu quả ức chế tuyến thượng thận của liệu pháp glucocorticoid đang diễn ra [51,52] Nhưng nguy cơ mắc cơn bão thượng thận có thể tăng lên khi thuốc không còn hiệu quả.
Điều trị
Điều trị cơn bão thượng thận có hiệu quả nếu được điều trị kịp thời, trước khi hạ huyết áp kéo dài dẫn đến các ảnh hưởng không thể phục hồi. [6,27,41] Điều trị bao gồm sử dụng hydrocortisone đường tĩnh mạch, được tiêm bolus 100 mg, sau đó dùng 200 mg mỗi 24 giờ truyền liên tục hoặc tiêm tĩnh mạch (hoặc tiêm bắp) 50 mg mỗi 6 giờ, với các liều tiếp theo phù hợp theo đáp ứng lâm sàng (Bảng 2).Nếu hydrocortison không có sẵn, dùng glucocorticoid tiêm tĩnh mạch khác[7] như dexamethasone(4 mg mỗi 24 giờ), methylprednisolone (40 mg mỗi 24 giờ), hoặc prednison (25 mg bolus, duy trì là hai liều 25 mg, tổng là 75 mg trong 24 giờ đầu tiên, sau đó 50 mg mỗi 24 giờ) có thể được sử dụng. Ở trẻ em, hydrocortisone nên được dùng dưới dạng tiêm tĩnh mạch 50 mg trên một mét vuông diện tích da, sau đó là 50 đến 100 mg mỗi mét vuông da mỗi 24 giờ (dùng dưới dạng truyền tĩnh mạch liên tục hoặc tiêm tĩnh mạch hoặc tiêm bắp mỗi 6 giờ). Hydrocortison (cortisol) là thuốc ưu tiên để điều trị cơn bão thượng thận vì dược động học phù hợp với sinh lý, gắn với protein huyết tương, phân phối đến mô và tác dụng cân bằng glucocorticoid-mineralocorticoid.
Các liều được đề xuất cho prednisolone và dexamethasone dựa trên hiệu lực tương ứng của chúng so với hydrocortison, phù hợp với hướng dẫn điều trị hiện tại đối với suy thượng thận nguyên phát.[7] Fludrocortisone không cần thiết nếu liều hydrocortisone vượt quá 50 mg mỗi 24 giờ. Một vấn đề thực tế là ở những bệnh nhân bị suy tuyến thượng thận nguyên phát, liệu pháp fludrocortison thường được dùng tiếp khi cơn bão thượng thận đã được giải quyết và thay thế hydrocortison bằng miệng.
Khi cơn bão thượng thận ở người lớn đang xảy ra, nên dùng nước muối đẳng trương truyền tĩnh mạch (1000 ml trong vòng một giờ đầu tiên), với dịch tinh thể (ví dụ, natri clorid 0,9%) được thực hiện theo hướng dẫn hồi sức tiêu chuẩn và điều chỉnh theo tình trạng tuần hoàn của bệnh nhân , trọng lượng cơ thể và các điều kiện cùng tồn tại có liên quan.[2,5,6] Dextrose 5% đường tĩnh mạch pha với nước muối đẳng trương được dùng cho trường hợp hạ đường huyết (nghĩa là khi giá trị glucose dưới 3,9 mmol / lít [70 mg/dl ]). Ở trẻ em, một lượng normal saline được cho với liều 20 ml / kg trọng lượng cơ thể, và với liều lặp lại lên đến 60 ml/kg trong giờ đầu tiên. Nếu có hạ đường huyết, dextrose với liều 0,5 đến 1g/kg được dùng.
Trong những trường hợp hiếm, bệnh nhân bị cả suy tuyến thượng thận và bệnh đái tháo nhạt, thường gặp nhất ở những người bị viêm tuyến yên lympho bào (lymphocytic hypophysitis). Dịch nên được sử dụng thận trọng ở những bệnh nhân bị bệnh đái tháo nhạt, dù họ có đang điều trị hay không, vì nước quá nhiều có thể gây hạ natri máu và quá ít có thể gây tăng natri máu. Theo dõi cẩn thận lượng nước tiểu và truyền nước muối đẳng trương thường để duy trì tình trạng natri máu bình thường.[2].
Chẩn đoán đồng thời và điều trị yếu tố thúc đẩy được thực hiện ở tất cả các bệnh nhân có cơn bão thượng thận. Sốc kéo dài mặc dù đã điều trị đặc hiệu cơn tuyến thượng thận nên xem xét nguyên nhân khác gây hạ huyết áp.
| Bảng 2. Điều trị cơn bão thượng thận | |
| Điều trị | Liều và thủ thuật |
| Người lớn | |
| Hydrocortisone* | Cung cấp khẩn cấp với liều 100 mg tiêm tĩnh mạch (hoặc tiêm bắp nếu tiêm tĩnh mạch là không thực hiện được), theo sau là 200 mg mỗi 24 giờ, được truyền dưới dạng tiêm truyền liên tục hoặc tiêm tĩnh mạch (hoặc tiêm bắp) (50 mg) mỗi 6 giờ; nếu điều trị ban đầu thành công (thường sau 24 giờ), hydrocortisone uống với liều gấp 2 đến 3 lần liều thông thường có thể được dùng, giảm dần xuống liều thường ngày trong 2 đến 3 ngày tiếp theo† |
| Dịch | Chất lỏng Cung cấp đường tĩnh mạch 1000 ml nước muối đẳng trương (0,9% natri clorid đẳng trương) trong giờ đầu tiên, với dextrose tĩnh mạch với nồng độ 5% trong nước muối đẳng trương được thêm vào nếu bệnh nhân bị hạ đường huyết; sau đó, truyền dịch tinh thể theo hướng dẫn hồi sức tiêu chuẩn‡ |
| Trẻ em | |
| Hydrocortisone | Cung cấp khẩn cấp với liều 50 mg mỗi mét vuông diện tích bề mặt cơ thể (hoặc tiêm bắp nếu không thể thực hiện đường tĩnh mạch), sau đó là 50 -100 mg mỗi mét vuông da mỗi 24 giờ, được tiêm truyền liên tục hoặc tiêm tĩnh mạch (hoặc tiêm bắp) (12,5- 25 mg mỗi mét vuông da) mỗi 6 giờ ; nếu điều trị ban đầu thành công (thường sau 24 giờ), hydrocortisone uống với liều gấp 2 đến 3 lần liều thông thường có thể được dùng, giảm dần xuống liều thường ngày trong 2 đến 3 ngày tiếp theo† |
| Dịch | Cho lượng nước muối đẳng trương với liều 20 ml cho mỗi kg trọng lượng cơ thể, với liều lặp lại lên đến tối đa 60 ml mỗi kg trong giờ đầu tiên, cùng với dextrose tiêm tĩnh mạch, 0,5 -1 g mỗi kg nếu bệnh nhân bị hạ đường huyết; cung cấp dịch truyền tiếp theo là dịch tinh thể theo hướng dẫn hồi sức tiêu chuẩn‡ |
| Người lớn và trẻ em | |
| Các yếu tố bổ sung khác | Điều trị kháng sinh, nhập viện khoa điều trị tích cực hoặc đơn vị theo dõi cao, tiêm liều thấp heparin.
Điều tra kịp thời các nguyên nhân khác khi hạ huyết áp vẫn còn mặc dù điều trị ban đầu đầy đủ. Xem xét các yếu tố thúc đẩy ( ví dụ :nhiễm trùng huyết, viêm dạ dày ruột). |
* Nếu hydrocortison không có sẵn, một glucocorticoid đường tĩnh mạch khác, chẳng hạn như dexamethasone (4 mg mỗi 24 giờ), methylprednisolone (40 mg mỗi 24 giờ), hoặc prednison (25 mg bolus sau hai liều 25 mg, tổng cộng là 75 mg trong 24 giờ đầu tiên, sau đó 50 mg mỗi 24 giờ), có thể được sử dụng.
† Không cần thay thế Fludrocortison nếu liều hydrocortison vượt quá 50 mg mỗi 24 giờ nhưng thường được dùng ở người lớn và trẻ em bị suy thượng thận nguyên phát khi bắt đầu uống hydrocortison.
‡ Cần lưu ý đến tình trạng tuần hoàn, trọng lượng cơ thể và các tình trạng tồn tại có liên quan.
Sau khi xử trí thành công cơn bão thượng thận, nên giảm liều hydrocortison, thường là trong khoảng thời gian 3 ngày, với liều duy trì thông thường của bệnh nhân. Chiến lược dự phòng cac yếu tố thúc đẩy nên được thực hiện và các chiến lược này nên giải thích cho bệnh nhân, bao gồm cả việc tự điều trị hydrocortisone đường tĩnh mạch. [2,6]
Vấn đề quản lý
Chăm sóc sức khỏe theo hoàn cảnh xã hội
Dự phòng cơn bão thượng thận phụ thuộc vào các chuyên gia chăm sóc sức khỏe đáp ứng và thông báo (xe cứu thương, điều dưỡng và nhân viên y tế) và giáo dục bệnh nhân hiệu quả, để bệnh nhân có thể bắt đầu tăng liều glucocorticoid nếu cần. Tuy nhiên, báo cáo trường hợp (xem trường hợp minh họa trong Phụ lục bổ sung, có sẵn ở bài viết này tại NEJM.org) và gần đây các hệ thống nghiên cứu kịp thời hỗ trợ do các chuyên gia chăm sóc sức khỏe đưa ra một loạt sự chậm trễ tiềm ẩn và những khó khăn có thể ảnh hưởng đến tỷ lệ mắc và kết cục của cơn bão thượng thận.[5,48,53] Một số yếu tố môi trường, chẳng hạn như xe cứu thương đến chậm, có thể không thể tránh khỏi nhưng vẫn rất quan trọng để giải quyết.[54] Ví dụ, đảm bảo rằng xe cứu thương có sẵn hydrocortisone để tiêm, chính sách được áp dụng bởi các dịch vụ khẩn cấp ở một số vùng, có thể rất hữu ích trong việc kiểm soát cơn bão thượng thận.
Mối quan tâm lớn được các nhân viên y tế từ chối sử dụng hydrocortisone vì cho rằng tác dụng ngoại ý của glucocorticoids lớn hơn nguy cơ không dùng hydrocortisone ở bệnh nhân thiếu hormon vỏ thượng thận.[2,5,48,53,54] , Thực tế là bằng chứng gần đây về mức độ hiểu biết không thỏa đáng về suy thượng thận và cơn bão thượng thận giữa các loại bác sĩ lâm sàng nhấn mạnh tầm quan trọng của việc đào tạo liên tục.[55-58].
Đánh giá của bệnh viện về các sự việc quan trọng trong điều trị bệnh nhân suy tuyến thượng thận, đặc biệt là thời gian sử dụng hydrocortisone đường tĩnh mạch, có thể được sử dụng cho đúng mục đích và liều chuẩn.[54,59] Kiểm toán điều trị tại bệnh viện (nhập viện, nhập viện cho khoa chăm sóc đặc biệt [sử dụng thông khí cơ học], di chứng bất lợi và tử vong) có thể giúp đảm bảo kết quả đầy đủ. Trong bệnh viện, sử dụng hệ thống “cờ đỏ” của Nhật Bản để biểu thị thiếu hormon vỏ thượng thận nên khuyến khích sử dụng liệu pháp thay thế glucocorticoid và liều glucocorticoids thích hợp cho các thủ thuật, phẫu thuật.[25,58] Trên cơ sở quốc gia, đánh giá thường xuyên nhập viện và dữ liệu về kê đơn thuốc có thể xác định các vấn đề khác, chẳng hạn như sự thay đổi của tỷ lệ mắc cơn bão thượng thận [4,31,60] do đó trong số các vấn đề khác, sự gián đoạn trong việc cung cấp viên glucocorticoid. [60]
Yếu tố bệnh nhân
Bệnh nhân thiếu hormon vỏ thượng thận thường báo cáo là không hài lòng với chăm sóc y tế; Những lý do cho sự không hài lòng của họ bao gồm yêu cầu thay thế lịch sử dụng glucocorticoid, sự chậm trễ trong chẩn đoán ban đầu, suy giảm sức khỏe sau điều trị (lên đến 40% bệnh nhân) và Lo lắng liên quan đến cơn bão thượng thận [26,54,61]. Tổn thương chức năng ở bệnh nhân suy thượng thận, biểu hiện là mệt mỏi và giảm sự tham gia vào công việc do nghỉ vì bệnh và suy nhược [68] có thể liên quan đến dùng glucocorticoid thay thế không theo nhịp sinh học hoặc không cá thể hóa. Hơn nữa, có sự khác biệt rõ rệt giữa các dược động học hydrocortison [70] và điều trị hydrocortison ảnh hưởng đến sức khỏe tinh thần và thể chất thông qua chuyển hóa tryptophan bị thay đổi.[71] Ngoài ra, chất lượng cuộc sống giảm có thể dẫn đến nguy cơ cơn bão thượng thận tăng cao,đặc biệt ở những người bị ảnh hưởng nặng nề nhất. [29]
Dự phòng
Các chiến lược chính có thể dự phòng cơn bão thượng thận bao gồm đơn thuốc và kế hoạch cá nhân cho việc sử dụng glucocorticoid cho căng thẳng sinh lý; sử dụng hydrocortisone đường tĩnh mạch khi không thể uống glucocorticoids đường uống, tốt nhất là tại nhà; và việc cung cấp các thiết bị, chẳng hạn như vòng đeo tay hoặc vòng cổ của MedicAlert (được thảo luận dưới đây), có thể cảnh báo những người chăm sóc về nguy cơ cơn bão thượng thận khi bệnh nhân không thể giao tiếp bằng lời nói.
Liều dùng glucocorticoids khi có stress, được thiết lập để tạo đáp ứng cortisol với stress, bao gồm tăng gấp đôi hoặc gấp ba liều thay thế, tùy thuộc vào cường độ của stress (ví dụ, liều gấp đôi khi sốt nhẹ [nhiệt độ <38,5 ° C] và liều gấp ba đối với sốt cao hơn [nhiệt độ ≥38,5 ° C]), cho đến khi bệnh giảm. Liều dùng khi stress dựa trên việc tương tự đáp ứng ứng sinh lý đối với bệnh, nhưng dược động học hydrocortisone đường uống rất khác nhau và bệnh nhân chuyển hóa nhanh có thể có phản ứng ít rõ ràng hơn so với bệnh nhân chuyển hóa chậm. Liều cao hơn đường tĩnh mạch có thể cần thiết trong các trường hợp stress nghiêm trọng như phẫu thuật lớn và có thể đạt đến mức tuyến thượng thận bài tiết tối đa (khoảng 200 mg hydrocortison mỗi 24 giờ [gấp 8,5 lần mức bài tiết bình thường], như được sử dụng trong các nghiên cứu can thiệp về sốc nhiễm trùng) .[72-74]
Ở những bệnh nhân bị nôn hoặc tiêu chảy, hydrocortisone tiêm (100 mg ở người lớn) được khuyến cáo.[2,5,6] Bệnh nhân và người nhà của họ nên được dạy cách thực hiện tiêm hydrocortisone tiêm bắp và nên được cung cấp với lọ, kim tiêm và ống tiêm. [2,5,12] Bỏ sót liều stress có thể dẫn đến tiến triển thành cơn bão thượng thận và có thể góp phần vào sự thiếu hiệu quả của các biện pháp dự phòng hiện tại.[41,48] Sử dụng hydrocortisone đường tĩnh mạch tại nhà có thể dự phòng tiến triển của cơn bão thượng thận sớm.[3, 5]
Tuy nhiên, hydrocortisone tiêm không được cung cấp cho hoặc có thể không sử dụng bởi tất cả các bệnh nhân.[54,57] Rào cản đối với việc sử dụng hydrocortisone của bệnh nhân bao gồm miễn cưỡng dùng đường tiêm bắp [26,41] ,không có thể khéo léo để tiêm,[48] và tuổi cao. Tiêm dưới da hydrocortison là một phương pháp thay thế cho đường tiêm bắp, và mặc dù đây là một phương pháp dùng ngoài chỉ dẫn, nhưng nó có thể được chấp nhận hơn đối với bệnh nhân.2,75] Dữ liệu dược động học chỉ ra rằng tiêm dưới da và tiêm bắp ở bệnh nhân không béo phì bị suy tuyến thượng thận,khi không có sốc thì có tác dụng tương tự [75] Tọa dược hydrocortisone đặt trực tràng có thể là một lựa chọn thay thế trong một số trường hợp.
Các biện pháp tăng cường giao tiếp có thể đơn giản nhưng rất quan trọng. Ví dụ: “thẻ steroid”, thẻ MedicAlert hoặc thẻ tương đương (Hình S1 trong Phụ lục bổ sung) và dịch vụ thuê bao sử dụng trang sức y tế có ghi chẩn đoán của bệnh nhân và được liên kết bằng số nhận dạng với trung tâm cuộc gọi để biết thêm thông tin khuyến cáo.[76,77] Sử dụng các biện pháp này là không phổ biến, [57,77] nhưng việc sử dụng có thể được cải thiện thông qua giáo dục bệnh nhân.[77].
Mặc dù có những cố găng nhằm khuyến khích bệnh nhân quản lý điều trị glucocorticoid để dự phòng cơn bão thượng thận, nhưng chỉ một số bệnh nhân bắt đầu tăng liều hiệu quả. [41,48,57,78] Kết quả của các chương trình giáo dục bệnh nhân chuyên sâu là thất vọng và góp phần vào tăng tỷ lệ cơn tuyến thượng thận kéo dài [4,31,79].
Giảm tỷ lệ mắc cơn bão thượng thận
Tiếp cận có sẵn
Áp dụng rộng rãi hơn các chiến lược phòng ngừa có thể làm giảm tỷ lệ mắc cơn bão thượng thận và điều trị kịp thời tại nhà và dịch vụ y tế có thể làm giảm mức độ nghiêm trọng và di chứng của họ. Tiêm bắp hydrocortisone khẩn cấp hoặc tiêm dưới da có thể ngăn chặn nhiều giai đoạn cơn bão thượng thận. Chấp nhận chính thức cho hydrocortisone tiêm dưới da có thể làm tăng sử dụng hydrocordisone tại nhà.
Tiếp cận trong tương lai
Một ống tiêm hydrocortisone được tải sẵn, tương tự như tự động tiêm epinephrine, đã được khuyến cáo [2 ] nhưng thường không có sẵn. Có thể nghĩ ra các sản phẩm hoặc đường dùng khác để sử dụng hydrocortison đơn giản hơn cho bệnh nhân sử dụng trong trường hợp khẩn cấp, chẳng hạn như thuốc xịt hoặc thuốc hít. Cuối cùng, các hệ thống vận chuyển thay đổi để thay thế hormone tuyến thượng thận, chẳng hạn như “vỏ thượng thận nhân tạo sinh học” là một giải pháp dựa trên tế bào, rất hấp dẫn. Các cấu trúc như vậy có thể sử dụng các tế bào tuyến thượng thận dị ghép ( allogeneic) hoặc ghép khác loài ( xenogene) trong hộp cấy ghép như một viên nang alginate; cách khác là phương pháp trong đó các tế bào tránh khỏi hệ thống miễn dịch của bệnh nhân có thể trở nên khả thi. Nếu thành công, những phương pháp này sẽ cải thiện chất lượng cuộc sống cho bệnh nhân suy thượng thận và loại bỏ cơn bão thượng thận.[80, 81]
Tóm lại
Cơn bão thượng thận là các cơn đe dọa tính mạng trên bệnh nhân suy tuyến thượng thận, vẫn tiếp tục xảy ra mặc dù có các biện pháp can thiệp phòng ngừa. Giáo dục bệnh nhân trong việc sử dụng liều stress bằng đường uống, sử dụng hydrocortisone đường tĩnh mạch khi cần thiết , các thiết bị liên lạc để thông báo cho nhân viên y tế về nguy cơ cơn bão thượng thận và yêu cầu điều trị là tiếp cận hiện tại để dự phòng cơn bão thượng thận. Cần có giải pháp mới cho vấn đề dai dẳng này.
Tài liệu tham khảo
1. Gidlöf S, Falhammar H, Thilén A, et al. One hundred years of congenital adrenal hyperplasia in Sweden: a retrospective, population-based cohort study. Lancet Diabetes Endocrinol 2013;1:35-42.
2. Rushworth RL, Torpy DJ, Falhammar H. Adrenal crises: perspectives and research directions. Endocrine 2017;55:336-45.
3. Hahner S, Loeffler M, Bleicken B, et al. Epidemiology of adrenal crisis in chronic adrenal insufficiency: the need for new prevention strategies. Eur J Endocrinol 2010;162:597-602.
4. Rushworth RL, Torpy DJ. Adrenal in- sufficiency in Australia: is it possible that the use of lower dose, short-acting gluco- corticoids has increased the risk of adre- nal crises? Horm Metab Res 2015;47:427- 32.
5. Allolio B. Extensive expertise in endo- crinology: adrenal crisis. Eur J Endocrinol 2015;172:R115-24.
6. Puar TH, Stikkelbroeck NM, Smans LC, Zelissen PM, Hermus AR. Adrenal cri- sis: still a deadly event in the 21st century. Am J Med 2016;129(3):339.e1-339.e9.
7. Bornstein SR, Allolio B, Arlt W, et al. Diagnosis and treatment of primary adre- nal insufficiency: an Endocrine Society clinical practice guideline. J Clin Endocri- nol Metab 2016;101:364-89.
8. Charmandari E, Nicolaides NC, Chrou- sos GP. Adrenal insufficiency. Lancet 2014; 383:2152-67.
9. Oelkers W. Adrenal insufficiency. N Engl J Med 1996;335:1206-12.
10. Bancos I, Hahner S, Tomlinson J, Arlt W. Diagnosis and management of adrenal insufficiency. Lancet Diabetes Endocrinol 2015;3:216-26.
11. Arlt W, Allolio B. Adrenal insufficiency. Lancet 2003;361:1881-93.
14. Cortet C, Barat P, Zenaty D, Guignat L, Chanson P. Group 5: acute adrenal in- sufficiency in adults and pediatric pa- tients. Ann Endocrinol (Paris) 2017;78: 535-43.
15. Odenwald B, Nennstiel-Ratzel U, Dörr HG, Schmidt H, Wildner M, Bonfig W. Children with classic congenital adrenal hyperplasia experience salt loss and hypo- glycemia: evaluation of adrenal crises dur-ing the first 6 years of life. Eur J Endocri- nol 2016;174:177-86.
16. Bowden SA, Henry R. Pediatric adre- nal insufficiency: diagnosis, management, and new therapies. Int J Pediatr 2018; 2018:1739831.
17. Ramamoorthy S, Cidlowski JA. Corti- costeroids: mechanisms of action in health and disease. Rheum Dis Clin North Am 2016;42:15-31.
18. Coutinho AE, Chapman KE. The anti- inflammatory and immunosuppressive effects of glucocorticoids, recent develop- ments and mechanistic insights. Mol Cell Endocrinol 2011;335:2-13.
19. Annane D, Bellissant E, Sebille V, et al. Impaired pressor sensitivity to noradren- aline in septic shock patients with and without impaired adrenal function re- serve. Br J Clin Pharmacol 1998;46:589- 97.
20. Dinneen S, Alzaid A, Miles J, Rizza R. Metabolic effects of the nocturnal rise in cortisol on carbohydrate metabolism in normal humans. J Clin Invest 1993;92: 2283-90.
21. Macfarlane DP, Forbes S, Walker BR. Glucocorticoids and fatty acid metabo- lism in humans: fuelling fat redistribu- tion in the metabolic syndrome. J Endo- crinol 2008;197:189-204.
22. Smans LC, Van der Valk ES, Hermus AR, Zelissen PM. Incidence of adrenal cri- sis in patients with adrenal insufficiency. Clin Endocrinol (Oxf) 2016;84:17-22.
23. Falhammar H, Frisén L, Norrby C, et al. Increased mortality in patients with congenital adrenal hyperplasia due to 21-hydroxylase deficiency. J Clin Endocri- nol Metab 2014;99(12):E2715-E2721.
24. Iwasaku M, Shinzawa M, Tanaka S, Kimachi K, Kawakami K. Clinical charac- teristics of adrenal crisis in adult popu- lation with and without predisposing chronic adrenal insufficiency: a retro- spective cohort study. BMC Endocr Disord 2017;17:58.
25. Rushworth RL, Chrisp GL, Torpy DJ. Glucocorticoid-induced adrenal insuffi- ciency: a study of the incidence in hospital patients and a review of peri-operative management. Endocr Pract 2018;24:437- 45.
26. White K, Arlt W. Adrenal crisis in treated Addison’s disease: a predictable but under-managed event. Eur J Endocri- nol 2010;162:115-20.
27. Rushworth RL, Torpy DJ. A descrip- tive study of adrenal crises in adults with adrenal insufficiency: increased risk with age and in those with bacterial infections. BMC Endocr Disord 2014;14:79.
28. Hahner S, Spinnler C, Fassnacht M, et al. High incidence of adrenal crisis in educated patients with chronic adrenal insufficiency: a prospective study. J Clin Endocrinol Metab 2015;100:407-16.
29. Meyer G, Koch M, Herrmann E, Bojun- ga J, Badenhoop K. Longitudinal AddiQoL scores may identify higher risk for adre- nal crises in Addison’s disease. Endocrine 2018;60:355-61.
30. El-Maouche D, Hargreaves CJ, Sinaii N, Mallappa A, Veeraraghavan P, Merke DP. Longitudinal assessment of illnesses, stress dosing, and illness sequelae in pa- tients with congenital adrenal hyperpla- sia. J Clin Endocrinol Metab 2018;103: 2336-45.
31. Rushworth RL, Torpy DJ. Modern hy- drocortisone replacement regimens in ad- renal insufficiency patients and the risk of adrenal crisis. Horm Metab Res 2015;47: 637-42.
32. Tomlinson JW, Holden N, Hills RK, et al. Association between premature mor- tality and hypopituitarism. Lancet 2001; 357:425-31.
33. Bergthorsdottir R, Leonsson-Zachris- son M, Odén A, Johannsson G. Premature mortality in patients with Addison’s dis- ease: a population-based study. J Clin En- docrinol Metab 2006;91:4849-53.
34. Bensing S, Brandt L, Tabaroj F, et al. Increased death risk and altered cancer incidence pattern in patients with isolated or combined autoimmune primary adre- nocortical insufficiency. Clin Endocrinol (Oxf) 2008;69:697-704.
35. Erichsen MM, Løvås K, Fougner KJ, et al. Normal overall mortality rate in Ad- dison’s disease, but young patients are at risk of premature death. Eur J Endocrinol 2009;160:233-7.
36. Burman P, Mattsson AF, Johannsson G, et al. Deaths among adult patients with hypopituitarism: hypocortisolism during acute stress, and de novo malignant brain tumors contribute to an increased mor- tality. J Clin Endocrinol Metab 2013;98: 1466-75.
37. Molander N. Sudden natural death in later childhood and adolescence. Arch Dis Child 1982;57:572-6.
38. Hajsheikholeslami F, Yazdani S. Sud- den cardiac death as a result of neglected hypopituitarism. Int J Endocrinol Metab 2013;11:117-9.
39. Saevik AB, Åkerman AK, Grønning K, et al. Clues for early detection of autoim- mune Addison’s disease — myths and realities. J Intern Med 2018;283:190-9.
40. Bird S. Failure to diagnose: Addison disease. Aust Fam Physician 2007;36:859- 61.
41. Chrisp GL, Maguire AM, Quartararo M, et al. Variations in the management of acute illness in children with congenital adrenal hyperplasia: an audit of three pae- diatric hospitals. Clin Endocrinol (Oxf) 2018;89:577-85.
42. Rushworth RL, Falhammar H, Munns CF, Maguire AM, Torpy DJ. Hospital ad- mission patterns in children with CAH: admission rates and adrenal crises de- cline with age. Int J Endocrinol 2016; 2016:5748264.
43. Major A, Chacko K. Routine vaccina- tions as a precipitant of adrenal crisis in adrenal insufficiency. Intern Med J 2018; 48:360-1.
44. Smrecnik M, Kavcic Trsinar Z, Kocjan T. Adrenal crisis after first infusion of zoledronic acid: a case report. Osteoporos Int 2018;29:1675-8.
45. Barroso-Sousa R, Barry WT, Garrido- Castro AC, et al. Incidence of endocrine dysfunction following the use of different immune checkpoint inhibitor regimens: a systematic review and meta-analysis. JAMA Oncol 2018;4:173-82.
46. Akarca FK, Can O, Yalcinli S, Altunci YA. Nivolumab, a new immunomodula- tory drug, a new adverse effect; adrenal crisis. Turk J Emerg Med 2017;17:157-9.
47. Falhammar H, Nordenström A. Non- classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency: clinical pre- sentation, diagnosis, treatment, and out- come. Endocrine 2015;50:32-50.
48. Burger-Stritt S, Kardonski P, Pulzer A, Meyer G, Quinkler M, Hahner S. Manage- ment of adrenal emergencies in educated patients with adrenal insufficiency — a prospective study. Clin Endocrinol (Oxf) 2018;89:22-9.
49. Lewandowski KC, Marcinkowska M, Skowrońska-Jóźwiak E, Makarewicz J, Lewiński A. New onset Graves’ disease as a cause of an adrenal crisis in an individ- ual with panhypopituitarism: brief report. Thyroid Res 2008;1:7.
50. Roque C, Fonseca R, Bello CT, Vascon- celos C, Galzerano A, Ramos S. Thyro- toxicosis leading to adrenal crises reveals primary bilateral adrenal lymphoma. Endo- crinol Diabetes Metab Case Rep 2017;2017: 17-0002.
51. Sychev DA, Ashraf GM, Svistunov AA, et al. The cytochrome P450 isoenzyme and some new opportunities for the pre- diction of negative drug interaction in vivo. Drug Des Devel Ther 2018;12:1147- 56.
52. Bornstein SR. Predisposing factors for adrenal insufficiency. N Engl J Med 2009; 360:2328-39.
53. Gargya A, Chua E, Hetherington J, Sommer K, Cooper M. Acute adrenal in- sufficiency: an aide-memoire of the criti- cal importance of its recognition and pre- vention. Intern Med J 2016;46:356-9.
54. Hahner S, Hemmelmann N, Quinkler M, Beuschlein F, Spinnler C, Allolio B. Timelines in the management of adrenal crisis — targets, limits and reality. Clin Endocrinol (Oxf) 2015;82:497-502.
55. Kampmeyer D, Lehnert H, Moenig H, Haas CS, Harbeck B. A strong need for improving the education of physicians on glucocorticoid replacement treatment in adrenal insufficiency: an interdisciplinary and multicentre evaluation. Eur J Intern Med 2016;33:e13-e15.
56. Kampmeyer D, Lehnert H, Moenig H, Haas CS, Harbeck B. Experience pays off! Endocrine centres are essential in the care of patients with adrenal insufficiency. Eur J Intern Med 2016;35:e27-e28.
57. Shepherd LM, Tahrani AA, Inman C, Arlt W, Carrick-Sen DM. Exploration of knowledge and understanding in patients with primary adrenal insufficiency: a mixed methods study. BMC Endocr Disord 2017; 17:47.
58. Nour MA, Gill H, Mondal P, Inman M, Urmson K. Perioperative care of congeni- tal adrenal hyperplasia — a disparity of physician practices in Canada. Int J Pedi- atr Endocrinol 2018;2018:8.
59. Leblicq C, Rottembourg D, Deladoëy J, Van Vliet G, Deal C. Are guidelines for glucocorticoid coverage in adrenal insuf- ficiency currently followed? J Pediatr 2011; 158(3):492.e1-498.e1.
60. Rushworth RL, Slobodian P, Torpy DJ. Interruptions to supply of high-dose hy- drocortisone tablets and the incidence of adrenal crises. Clin Endocrinol (Oxf) 2015;83:999-1000.
61. Forss M, Batcheller G, Skrtic S, Johann- sson G. Current practice of glucocorticoid replacement therapy and patient-perceived health outcomes in adrenal insufficiency — a worldwide patient survey. BMC En- docr Disord 2012;12:8.
62. Chapman SC, Llahana S, Carroll P, Horne R. Glucocorticoid therapy for adre- nal insufficiency: nonadherence, concerns and dissatisfaction with information. Clin Endocrinol (Oxf) 2016;84:664-71.
63. Burger-Stritt S, Pulzer A, Hahner S. Quality of life and life expectancy in pa- tients with adrenal insufficiency: what is true and what is urban myth? Front Horm Res 2016;46:171-83.
64. Løvås K, Loge JH, Husebye ES. Subjec- tive health status in Norwegian patients with Addison’s disease. Clin Endocrinol (Oxf) 2002;56:581-8.
65. Hahner S, Loeffler M, Fassnacht M, et al. Impaired subjective health status in 256 patients with adrenal insufficiency on standard therapy based on cross-sec- tional analysis. J Clin Endocrinol Metab 2007;92:3912-22.
66. Bleicken B, Hahner S, Loeffler M, Ventz M, Allolio B, Quinkler M. Impaired subjective health status in chronic adre- nal insufficiency: impact of different glu- cocorticoid replacement regimens. Eur J Endocrinol 2008;159:811-7.
67. Daae E, Feragen KB, Nermoen I, Fal- hammar H. Psychological adjustment, quality of life, and self-perceptions of re- productive health in males with congeni- tal adrenal hyperplasia: a systematic re- view. Endocrine 2018;62:3-13.
68. Strandqvist A, Falhammar H, Lichten- stein P, et al. Suboptimal psychosocial outcomes in patients with congenital ad- renal hyperplasia: epidemiological stud- ies in a nonbiased national cohort in Swe- den. J Clin Endocrinol Metab 2014;99: 1425-32.
69. Mallappa A, Debono M. Recent ad- vances in hydrocortisone replacement treatment. Endocr Dev 2016;30:42-53.
70. Werumeus Buning J, Touw DJ, Brum- melman P, et al. Pharmacokinetics of oral hydrocortisone — results and implica- tions from a randomized controlled trial. Metabolism 2017;71:7-16.
71. Sorgdrager FJH, Werumeus Buning J, Bos EH, Van Beek AP, Kema IP. Hydrocor- tisone affects fatigue and physical func- tioning through metabolism of trypto- phan: a randomized controlled trial. J Clin Endocrinol Metab 2018;103:3411-9.
72. Keenan DM, Roelfsema F, Carroll BJ, Iranmanesh A, Veldhuis JD. Sex defines the age dependence of endogenous ACTH- cortisol dose responsiveness. Am J Physiol Regul Integr Comp Physiol 2009;297: R515-R523.
73. Remmelts HH, Meijvis SC, Kovaleva A, Biesma DH, Rijkers GT, Heijligenberg R. Changes in serum cortisol levels during community-acquired pneumonia: the in- fluence of dexamethasone. Respir Med 2012;106:905-8.
74. Venkatesh B, Finfer S, Cohen J, et al. Adjunctive glucocorticoid therapy in pa- tients with septic shock. N Engl J Med 2018;378:797-808. 75. Hahner S, Burger-Stritt S, Allolio B. Subcutaneous hydrocortisone administra- tion for emergency use in adrenal insuf- ficiency. Eur J Endocrinol 2013;169:147- 54.
76. Quinkler M, Dahlqvist P, Husebye ES, Kämpe O. A European Emergency Card for adrenal insufficiency can save lives. Eur J Intern Med 2015;26:75-6.
77. Vidmar AP, Weber JF, Monzavi R, Koppin CM, Kim MS. Improved medical- alert ID ownership and utilization in youth with congenital adrenal hyperpla- sia following a parent educational inter- vention. J Pediatr Endocrinol Metab 2018; 31:213-9.
78. Repping-Wuts HJ, Stikkelbroeck NM, Noordzij A, Kerstens M, Hermus AR. A glucocorticoid education group meeting: an effective strategy for improving self- management to prevent adrenal crisis. Eur J Endocrinol 2013;169:17-22.
79. Hahner S. Acute adrenal crisis and mortality in adrenal insufficiency: still a concern in 2018! Ann Endocrinol (Paris) 2018;79:164-6.
80. Balyura M, Gelfgat E, Ehrhart-Born- stein M, et al. Transplantation of bovine adrenocortical cells encapsulated in algi- nate. Proc Natl Acad Sci U S A 2015;112: 2527-32.
81. Balyura M, Gelfgat E, Steenblock C, et al. Expression of progenitor markers is associated with the functionality of a bio- artificial adrenal cortex. PLoS One 2018; 13(3):e0194643.

![[ VẠCH TRẦN ] Cao Dây thìa canh chuẩn hóa Mamigo có tốt không? Sự thật ít ai chia sẻ. Cao Dây thìa canh chuẩn hóa Mamigo](https://www.healcentral.org/wp-content/uploads/2022/03/anh-ava-di-bao-2-218x150.jpg)
![[CHIA SẺ] Cách bấm huyệt chữa trĩ tại nhà an toàn – đơn giản – hiệu quả Bấm huyệt chữa trĩ](https://www.healcentral.org/wp-content/uploads/2020/10/bam_huyet_chua_tri-218x150.jpg)