Bài viết Trạng thái tăng đông trong Covid-19: Tỷ lệ mắc, sinh lý bệnh và quản lý được dịch bởi Bác sĩ Nguyễn Thành Luân – ICU bệnh viện Hoàn Mỹ Cửu Long từ bài viết gốc The hypercoagulable state in COVID-19: Incidence, pathophysiology, and management.
TÓM TẮT
Bệnh coronavirus 2019 (COVID-19) có rất nhiều biểu hiện lâm sàng khác nhau, từ trạng thái mang mầm bệnh không triệu chứng đến suy hô hấp nặng, rối loạn chức năng đa cơ quan và tử vong. Mặc dù ban đầu COVID-19 được xem là bệnh lý đường hô hấp, nhưng dữ liệu tích lũy nhanh chóng cho thấy nó gây ra tình trạng tăng đông độc đáo và nặng nề dẫn đến huyết khối cả động mạch và tĩnh mạch. Nồng độ D-dimer tăng cao là yếu tố nguy cơ độc lập cho kết cục xấu một cách nhất quán, bao gồm cả tử vong. Một số dấu ấn khác về mặt xét nghiệm và công thức máu cũng liên quan đến tiên lượng xấu, có thể là do mối liên hệ của chúng với huyết khối. Hiện tại người ta chưa hiểu rõ sinh lý bệnh nền tảng của trạng thái tăng đông. Tuy nhiên, dữ liệu ngày càng nhiều cho thấy các sự kiện ban đầu xảy ra tại phổi. Một đáp ứng viêm mạnh mẽ, bắt nguồn từ phế nang, kích hoạt một dòng thác huyết khối do viêm bởi rối loạn chức năng mạch máu phổi, dẫn đến tình trạng rối loạn đông máu cục bộ. Điều này được thấy rõ ở những bệnh nhân mắc bệnh nặng hơn, do tình trạng tăng đông toàn thân dẫn đến huyết khối cả mạch máu lớn và nhỏ. Đáng lo ngại là người ta quan sát thấy rằng thuốc chống đông máu có thể không đầy đủ trong nhiều trường hợp, làm nổi bật sự cần thiết phải điều trị thay thế hoặc điều trị bổ sung. Nhiều nghiên cứu đang tiến hành về sinh lý bệnh của rối loạn đông máu liên quan đến COVID-19 có thể cung cấp những hiểu biết về mặt cơ chế, từ đó định hướng các chiến lược can thiệp thích hợp.
1. Giới thiệu
Loại coronavirus mới, hội chứng hô hấp cấp tính nặng do coronavirus 2 (SARS- CoV-2), xuất hiện ở Vũ Hán, Trung Quốc vào cuối năm 2019 và hiện đang là đại dịch. Căn bệnh mà nó gây ra, bệnh coronavirus 2019 (COVID-19), đã ảnh hưởng đến hơn 7 triệu người trên toàn thế giới và cướp đi hơn 400,000 sinh mạng tính đến tháng 6 năm 2020. Bệnh có phạm vi từ không triệu chứng, hoặc bệnh nhẹ đến nặng với suy đa cơ quan và tử vong. Bệnh lý rối loạn đông máu, ở dạng thuyên tắc huyết khối tĩnh mạch và động mạch, đang nổi lên như một trong những biến chứng nặng nề nhất của COVID-19, và cho phép tiên lượng về kết cục kém. Các báo cáo về tỷ lệ mắc huyết khối khá cao mặc dù đã sử dụng thuốc chống đông cho cả mục đích điều trị và dự phòng, đặt ra câu hỏi về sinh lý bệnh độc đáo của COVID-19. Các giả thuyết được đề xuất bao gồm phản ứng viêm mạnh mẽ dẫn đến huyết khối do viêm, thông qua các cơ chế như bão cytokine, kích hoạt bổ thể và viêm nội mạc. Có bằng chứng cho thấy bản thân virus có thể kích hoạt dòng thác đông máu. Mặc dù nhiều tổ chức chuyên nghiệp đã phát triển các hướng dẫn và quy trình sử dụng thuốc chống đông máu dự phòng và điều trị, nhưng việc quản lý tối ưu đang phát triển nhanh chóng khi chúng tôi tiếp tục thu thập những hiểu biết mới về sinh lý bệnh của COVID-19.
Các nghiên cứu hồi cứu đã xác định các thông số lâm sàng có khả năng tiên lượng xấu. Ngoài các dấu ấn của rối loạn đông máu như D- dimer, thì các thông số huyết học khác đã được nghiên cứu. Số lượng bạch cầu trung tính, số lượng tế bào lympho, tỷ lệ bạch cầu trung tính/tế bào lympho và số lượng tiểu cầu có tương quan với mức độ nghiêm trọng của bệnh. Hiện tại, rõ ràng là bệnh nhân COVID-19 có nguy cơ huyết khối tăng đáng kể, khá thường gặp mặc dù có dùng chống đông máu. Hiểu rõ hơn về sinh lý bệnh cùng với nhận ra các dấu ấn sinh học có khả năng dự đoán kết cục của bệnh là rất quan trọng để phát triển các chiến lược can thiệp thích hợp cho căn bệnh tàn khốc này. Trong tổng quan này, chúng tôi tóm tắt kết quả của các nghiên cứu chính và thảo luận những hiểu biết hiện tại về rối loạn đông máu và các thông số huyết học ở bệnh nhân COVID-19, cũng như sinh bệnh học và điều trị huyết khối.
2. Trạng thái tăng đông trong COVID- 19
Các đợt bùng phát coronavirus trước đây, bao gồm SARS-CoV-1 và hội chứng hô hấp Trung Đông (MERS-CoV) có liên quan đến tăng nguy cơ huyết khối. Tương tự, SARS-CoV-2 mới này dường như tạo ra một trạng thái gây tăng đông mạnh mẽ, với nhiều báo cáo rộng rãi về huyết khối động mạch, tĩnh mạch và liên quan đến catheter.
2.1. Huyết khối tĩnh mạch
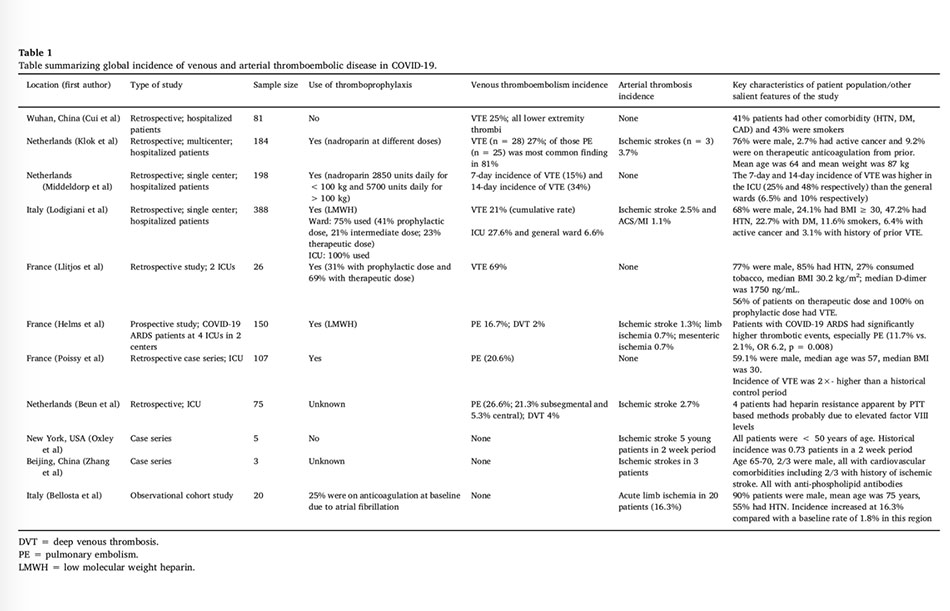
Thuyên tắc phổi là biểu hiện huyết khối thường gặp nhất của COVID-19. Một trong những bộ dữ liệu quan trọng đầu tiên về nguy cơ thuyên tắc huyết khối tĩnh mạch (VTE) ở bệnh nhân COVID-19 nặng đã báo cáo tỷ lệ mắc VTE là 25%. Trong một nghiên cứu lớn hơn ở Hà Lan trên 184 bệnh nhân ICU mắc COVID-19, những người ít nhất được dự phòng huyết khối tiêu chuẩn có tỷ lệ mắc VTE tích lũy là 27%, với thuyên tắc phổi (PE) là thường xuyên nhất (81%). Middeldorp báo cáo tỷ lệ biến chứng huyết khối cao hơn trong dân số bệnh nhân ICU của họ (tỷ lệ tích lũy 7 ngày và 14 ngày lần lượt là 25% và 48%) so với bệnh nhân nhập viện ở các khoa phòng. Tất cả bệnh nhân ban đầu đều được điều trị dự phòng huyết khối tiêu chuẩn rồi sau đó tăng liều. Một bộ dữ liệu khác từ Pháp bao gồm 150 bệnh nhân mắc hội chứng suy hô hấp cấp tiến triển (ARDS) liên quan đến COVID-19 cho thấy tỷ lệ VTE là 18%, trong đó PE là phổ biến nhất. Khi so sánh với một đoàn hệ tiến cứu trước đó về ARDS không COVID-19 sau khi bắt cặp tương đồng, bệnh nhân ARDS COVID-19 có tỷ lệ biến cố huyết khối cao hơn đáng kể, chủ yếu là PE (11.7% so với 2.1%, OR 6.2, p = 0.008). Dữ liệu hiện tại quá ít để xác định các đặc điểm nhân khẩu học của bệnh nhân COVID-19 có nhiều khả năng phát triển huyết khối. Tuy nhiên, có ý kiến cho rằng khả năng tăng đông này có thể rõ rệt hơn ở người già, giới tính nam, người da trắng và người Mỹ gốc Phi.
2.2. Huyết khối động mạch
So với huyết khối tĩnh mạch, tỷ lệ mắc huyết khối động mạch trong COVID-19 dường như không nhiều. Nó vẫn là mối quan tâm đáng kể và cần nghiên cứu thêm.
2.2.1. Nhồi máu cơ tim
Nhồi máu cơ tim (MI) được báo cáo là không thường gặp với COVID-19. Trong nghiên cứu ở Italia bởi Lodigiani bao gồm 388 bệnh nhân COVID-19, tỷ lệ mắc MI hoặc hội chứng mạch vành cấp tính là 1,1%. Nồng độ troponin đã được ghi nhận là cao hơn đáng kể ở những người không sống sót và có thể cung cấp giá trị tiên lượng. Mặc dù có nhiều giải thích cho việc sự gia tăng troponin (tổn thương thận, viêm cơ tim), nhưng tổn thương thiếu máu cục bộ do vỡ mảng bám và hậu quả là nhồi máu hoặc thứ phát do mất cung – cầu đã được báo cáo, và được cho là một nguyên nhân khác của tổn thương cơ tim.
2.2.2. Đột quỵ
Đột quỵ thiếu máu cục bộ được báo cáo đầu tiên bởi nghiên cứu ở Hà Lan. Nghiên cứu khác ở New York City (New York) của Oxley báo cáo sự gia tăng đáng báo động, gấp 7 lần, về đột quỵ mạch máu lớn ở nhóm <50 tuổi (5 bệnh nhân trong khoảng thời gian 2 tuần trong đại dịch COVID-19 so với 0.7 bệnh nhân trong khoảng thời gian tiền COVID). Báo cáo loạt trường hợp khác về ba bệnh nhân COVID-19 biểu hiện đột quỵ và thiếu máu cục bộ chi. Biểu hiện lâm sàng với đột quỵ thiếu máu cục bộ cũng được ghi nhận bởi Klok (3.7%) và Lodigiani (2.5%).
2.2.3. Huyết khối vi mạch máu
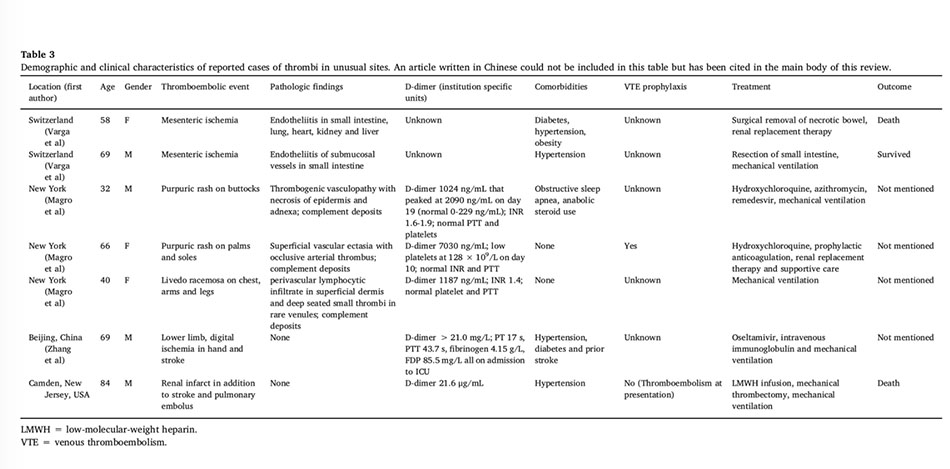
Một số báo cáo lâm sàng cho thấy bằng chứng về bệnh lý vi mạch huyết khối (TMA) ở bệnh nhân COVID-19, đáng chú ý nhất là tử thiết phổi. Trong một nghiên cứu của Menter, năm trong số mười một bệnh nhân có bằng chứng vi huyết khối trong tử thiết phổi, và báo cáo loạt ca khác của Ackermann cho thấy huyết khối lan rộng với bệnh lý vi mạch trong tử thiết phổi của bảy bệnh nhân COVID-19. Các tác giả đã so sánh những phát hiện này với những người mắc bệnh cúm nặng và phát hiện rằng vi huyết khối phế nang phổ biến gấp 9 lần ở bệnh nhân COVID-19 (p <0.001). Thật thú vị, một báo cáo từ Trung Quốc đã mô tả sự hiện diện của huyết khối vi mạch máu lan rộng ở các cơ quan ngoài phổi nơi coronavirus không được phát hiện, cho thấy một cơ chế khác ngoài nhiễm virus đang hoạt động. Tian đã cung cấp bằng chứng về vi huyết khối trong các mẫu bệnh phẩm thu được từ hai bệnh nhân không có triệu chứng đã trải qua phẫu thuật cắt bỏ khối u phổi và sau đó được phát hiện dương tính với COVID-19. Xét nghiệm bệnh học cho thấy thâm nhiễm tế bào viêm loang lổ với các khu vực tập trung của cặn lắng fibrin, cho thấy trạng thái tăng đông tại chổ trong mô phổi có thể xảy ra sớm. Hơn nữa, TMA có thể góp phần vào các phát hiện về nhiều biểu hiện và vị trí bất thường của huyết khối đã được mô tả trong một số báo cáo lâm sàng. Phát ban dạng chilblain do COVID-19 đã được báo cáo, sinh thiết mô bệnh học cho thấy bệnh lý vi mạch được cho là gây ra bởi một phản ứng interferon mạnh mẽ đối với virus. Các tổn thương dạng chilblain cũng đã được báo cáo ở thanh thiếu niên không có triệu chứng. Viêm mạch dạng lưới thoáng (transient livedo reticularis) qua đã được báo cáo ở hai bệnh nhân và được cho là thứ phát sau rối loạn đông máu. Một số báo cáo đã đề cập đến các trường hợp thiếu máu cục bộ ruột, thiếu máu cục bộ chi hoặc ngọn chi và thiếu máu cục bộ da. Tổn thương thận được thấy trong COVID-19 có liên quan đến độc tính trực tiếp của virus hoặc tổn thương nội mô/vi mạch máu chưa được thiết lập. Một tổng quan của 26 báo cáo tử thiết không tìm thấy bằng chứng về vật chất xơ hóa trong hệ mạch máu thận, trong khi điều này được tìm thấy ở 3 trong số 18 bệnh nhân trong một tổng quan tử thiết khác.
3. Sinh lý bệnh của rối loạn đông máu trong COVID-19: huyết khối viêm
Ngoài bằng chứng tại giường về tình trạng tăng đông trong COVID-19, các xét nghiệm cũng phù hợp với trạng thái tăng huyết khối như tăng D-dimer, fibrinogen, yếu tố VIII (FVIII), yếu tố von Willebrand (vWF), giảm antithombin và TEG. Mặc dù bệnh nặng được biết là gây ra tình trạng tăng đông do bất động, thở máy, thiết bị xân lấn tĩnh mạch trung tâm và thiếu hụt dinh dưỡng, nhưng COVID-19 dường như gây ra trạng thái tăng đông thông qua các cơ chế độc đáo của SARS-CoV-2 và vấn đề chủ yếu nằm ở tương tác qua lại giữa huyết khối và tình trạng viêm [45,46].
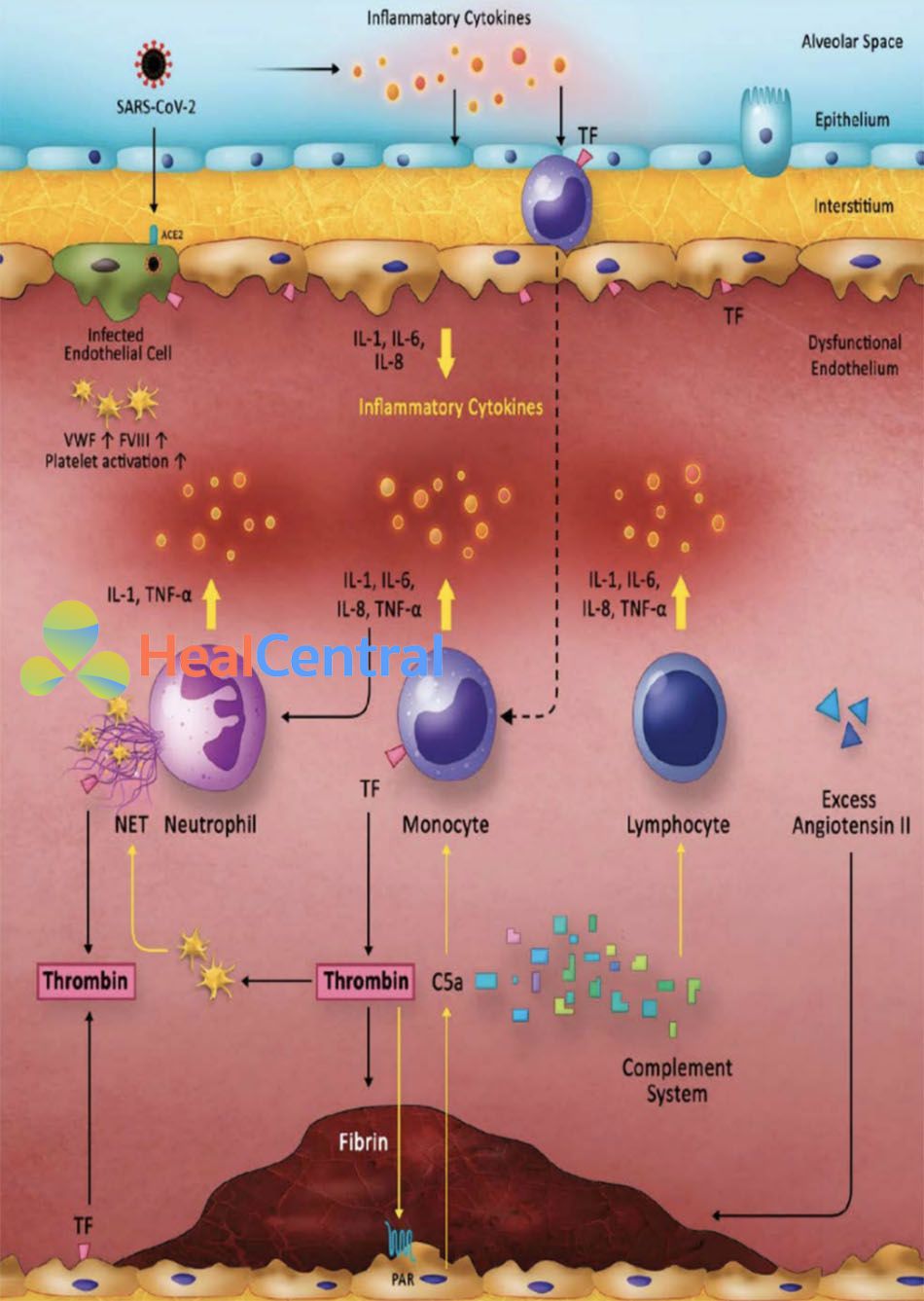
Mối quan hệ nhân quả, hai chiều giữa viêm và huyết khối đã được thiết lập tốt. COVID-19 gây ra tình trạng viêm nặng nề, rõ ràng từ nhiều báo cáo về nồng độ cao của CRP, lactate dehydrogenase, ferritin, interleukin-6 và D-dimer. Nồng độ IL-6 và fibrinogen cho thấy là tương quan với nhau ở bệnh nhân COVID-19, cung cấp sự tin cậy về ý tưởng về huyết khối do viêm [46]. Các nhà nghiên cứu hiện tin rằng sự kiện kích gợi gây ra vòng xoắn viêm và huyết khối bắt nguồn từ phế nang phổi, nơi SARS-CoV-2 đi vào biểu mô phế nang thông qua thụ thể ACE2. Hậu quả là một phản ứng viêm nghiêm trọng được bắt đầu tạo tiền đề cho huyết khối thông qua một số cơ chế. Chúng tôi đề xuất các cơ chế sau đây tập trung vào khía cạnh sinh lý bệnh của huyết khối viêm do COVID-19, được tóm tắt trực quan trong Hình 1.
3.1. Rối loạn đông máu nội mạch cục bộ
Báo cáo của Tang đã mô tả một tỷ lệ khá cao (71.4%) bệnh nhân COVID-19 đáp ứng tiêu chí ISTH của rối loạn đông máu nội mạch lan tỏa (DIC). Tuy nhiên, cho đến nay, bằng chứng rõ ràng về DIC trên lâm sàng trong COVID-19 vẫn còn thiếu. Có thể các bất thường về xét nghiệm được ghi nhận là sự phản ánh của rối loạn đông máu cục bộ trong mạch máu phổi, do tình trạng viêm phế nang nặng. Quá trình này tiến triển vào tuần hoàn hệ thống có thể giải thích các biến chứng vi huyết khối và dẫn đến suy đa cơ quan. Trên thực tế, Ciceri đề xuất gọi tên sinh lý bệnh học này là hội chứng huyết khối viêm gây tắc nghẽn vi mạch máu phổi mạch phổi do COVID-19 hoặc MicroCLOTS. Nhóm nghiên cứu cho rằng, ở những cá nhân được dự báo kết cục nặng, tổn thương virus ban đầu xảy ra trong phế nang tạo ra tình trạng viêm và huyết khối vi mạch phổi cục bộ. Điều này được gây ra bởi rối loạn chức năng nội mô lan lỏa hơn và huyết khối viêm trong hệ vi mạch não, thận và các cơ quan khác dẫn đến tình trạng tăng đông và suy đa cơ quan.
3.2. Các cytokine viêm
Sự phóng thích cytokine quá mức tạo tiền đề để gây ra tình trạng bệnh nguy kịch được ghi nhận ở những bệnh nhân trẻ tuổi mà không có bệnh lý nền. Nồng độ cao hơn của một số cytokine và chemokine viêm có liên quan đến mức độ nặng của bệnh và tử vong trong nhiều nghiên cứu. Các thành phần cytokine ở những bệnh nhân COVID- 19 nặng bao gồm sự gia tăng sản xuất IL- 6, IL-7, TNF và các chemokine viêm như CCL2, CCL3 và thụ thể IL-2 hòa tan, một thành phần tương tự đã được thấy trong các hội chứng phóng thích cytokine, chẳng hạn như hội chứng kích hoạt đại thực bào. Sự phóng thích cytokine quá mức góp phần gây huyết khối thông qua nhiều cơ chế, bao gồm kích hoạt các tế bào đơn nhân, bạch cầu trung tính và nội mô, tất cả đều tạo ra trạng thái tăng tạo huyết khối.
3.3. Kích hoạt & rối loạn chức năng nội mô
Varga lần đầu tiên báo cáo rối loạn chức năng nội mô ở nhiều giường mạch máu trên mẫu bệnh phẩm thu được từ ba bệnh nhân sau khi tử vong. Trong loạt 7 bệnh nhân của Ackerman, tử thiết phổi ở bệnh nhân COVID-19 cho thấy tổn thương nội mô nghiêm trọng với sự hiện diện của virus nội bào, cũng như huyết khối lan rộng với bệnh lý vi mạch máu. Hơn nữa, nồng độ VWF và FVIII tăng đáng kể ở bệnh nhân COVID-19 gợi ý tình trạng kích hoạt nội mô ở những bệnh nhân này. Kích hoạt hoặc rối loạn chức năng nội mô với COVID-19 có thể xảy ra thông qua nhiều cơ chế. Điều này bao gồm các cytokine viêm được tạo ra trong mô kẽ phổi, kích hoạt các thành phần bổ thể trong máu, hoặc có thể, là kết quả trực tiếp từ nhiễm SARS-CoV-2 của các tế bào nội mô thông qua thụ thể ACE2. Ngược lại, viêm nội mạc là tiền thân chủ yếu của huyết khối. Quan sát cho thấy giới tính nam, béo phì, tăng huyết áp và đái tháo đường là những yếu tố tiên lượng kém đối với bệnh COVID-19 nặng hỗ trợ thêm cho giả thuyết này do sự hiện diện của rối loạn điều hòa nội mô ngay từ đầu do bệnh lý nền ở những bệnh nhân này. Liệu các kháng thể kháng phospholipid (aPL) có góp phần gây rối loạn chức năng và kích hoạt nội mô trong COVID-19 hay không vẫn còn chưa rõ ràng. Kháng thể anticardiolipin, kháng thể β2 glycoprotein và chất chống đông lupus dương tính, tất cả chúng đã được báo cáo trong một vài nghiên cứu. Sự hiện diện của kháng thể aPL trong dân số nói chung, đặc biệt là trong tình trạng nhiễm khuẩn, là thường gặp. Ngoài ra, Zhang báo cáo kháng thể IgA aPL cũng góp phần vào tình trạng huyết khối, nhưng còn gây tranh cãi. Nhiều xét nghiệm chất chống đông lupus rất nhạy cảm với CRP và dẫn đến kết quả dương tính giả trong những tình trạng bệnh lý mà CRP tăng cao rõ rệt như COVID-19. Do đó, mối liên quan lâm sàng của những phát hiện này vẫn chưa được xác định.
3.4. Tế bào thực bào đơn nhân (Mononuclear phagocytes: MNPs)
Các tế bào đơn nhân và đại thực bào được giả thuyết rằng đóng một vai trò quan trọng trong viêm và huyết khối trong COVID-19. Liao đã chứng minh rằng MNPs chiếm 80% tổng lượng dịch phế quản-phế nang từ bệnh nhân COVID-19 nặng, so với 60% và 40% lần lượt trong trường hợp nhẹ và nhóm chứng khỏe mạnh. Hơn nữa, thành phần của các tế bào được đặc trưng bởi sự phong phú của đại thực bào có nguồn gốc tế bào đơn nhân viêm ở những bệnh nhân nặng. Dịch phế quản-phế nang ở bệnh nhân nặng được làm giàu bằng các chemokine huy động bạch cầu đơn nhân. Bệnh nhân COVID-19 cần nhập ICU được ghi nhận có sự gia tăng đáng kể các quần thể đơn nhân CD14+, CD16+ sản xuất IL-6 trong máu ngoại vi. Trong một nghiên cứu khác cho thấy bạch cầu đơn nhân lưu hành sản xuất kéo dài TNF-a và IL-6, một mẫu hình khác với nhiễm khuẩn huyết do vi khuẩn hoặc cúm. Tương tự như vậy, những phân tích sau tử vong của bệnh nhân dương tính với COVID-19 cho thấy các đại thực bào mô bạch huyết bị nhiễm các hạt virus SARS- CoV-2 biểu hiện IL-6. Hơn nữa, sự hiện diện của đại thực bào IL-6+ có liên quan đến giảm trầm trọng lympho bào từ mô bạch huyết. Những phát hiện này cho thấy COVID-19 có liên quan đến hình ảnh lâm sàng và xét nghiệm tương tự như hội chứng kích hoạt đại thực bào (macrophage- activation syndrome: MAS). Tuy nhiên, có một số đặc điểm phân biệt hiện diện trong COVID-19, chẳng hạn như nồng độ fibrinogen cao hơn, rối loạn chức năng gan và tăng ferritin ít rõ rệt như trong MAS cổ điển. Hiện tại, các cơ chế chính xác mà thông qua đó COVID-19 gây kích hoạt các tế bào đơn nhân và đại thực bào vẫn chưa rõ ràng. Tuy nhiên, dữ liệu tích lũy cho thấy vai trò của MNPs trong việc gây ra tình trạng bệnh nặng, bao gồm cả biến chứng tăng tạo huyết khối. Điều này không có gì đáng ngạc nhiên khi hiểu rằng các tế bào đơn nhân được kích hoạt nhanh chóng điều hòa tăng biểu hiện yếu tố mô (tissue factor: TF). Nó kích hoạt dòng thác đông máu dẫn đến sản xuất thrombin, từ đó tạo huyết khối, kích hoạt tiểu cầu và khuếch đại các con đường gây viêm, chủ yếu thông qua tín hiệu PAR.
3.5. Bẫy ngoại bào bạch cầu trung tính (neutrophil extracellular traps: NETs)
Trong khi tăng bạch cầu trung tính và tỷ số bạch cầu trung tính/lympho (neutrophil- lymphocyteratio: NLR) tăng cao đã được báo cáo bởi nhiều nghiên cứu, là dự đoán về kết cục bệnh tồi tề hơn hiện nay, thì sự đóng góp của bẫy ngoại bào bạch cầu trung tính vào sinh lý bệnh COVID-19 chỉ được báo cáo gần đây. NETs có liên quan đến nhiều loại rối loạn bao gồm ARDS liên quan đến cúm và viêm huyết khối. Yu báo cáo nồng độ NETs huyết thanh tăng ở bệnh nhân dương tính COVID-19 nhập viện dựa trên phát hiện sự gia tăng của cell-free DNA, myeloperoxidase-DNA và citrullinated histone ở 50 bệnh nhân COVID-19. Điều này đặc biệt được ghi nhận ở bệnh nhân nhập viện và thở máy. Hơn nữa, huyết thanh thu được từ những bệnh nhân này đã kích thích tạo ra NET trong bạch cầu trung tính kiểm chứng. Kết hợp với tài liệu liên kết NETs với các bệnh lý phổi và viêm huyết khối, những dữ liệu này bắt đầu cho thấy NETs là nguyên nhân gây tổn thương cơ quan, huyết khối lan rộng và tử vong được ghi nhận trong nhiễm COVID-19. Cuối cùng, một bản thảo gần đây của Barnes đã mô tả rất nhiều sự thâm nhiễm bạch cầu trung tính ở mao mạch phổi của ba bệnh nhân COVID-19 tử vong và cho thấy việc kích hoạt bạch cầu trung tính bất thường và tạo ra NET có thể gây ra cơn bão cytokine và kết cục bệnh nặng trong bệnh cảnh này.
3.6. Bệnh lý vi mạch qua trung gian bổ thể
Các nghiên cứu trước đây trên mô hình động vật cung cấp bằng chứng về việc kích hoạt bổ thể trong huyết thanh và mô phổi. Ngày càng có nhiều bằng chứng cho thấy vai trò chính của rối loạn điều hòa kích hoạt bổ thể trong COVID-19 nặng. Một số báo cáo về khám nghiệm tử thi đã cung cấp bằng chứng về TMA, bao gồm huyết khối hyaline trong các mạch máu nhỏ của phổi và các cơ quan khác. Một trong những báo cáo đó là kết quả sinh thiết phổi và da cho thấy một bệnh lý mạch máu nghèo huyết khối viêm với sự lắng động bổ thể. Một nghiên cứu ở Trung Quốc đã quan sát thấy sự tăng cường kích hoạt bổ thể ở bệnh nhân COVID-19, cũng như làm tăng đáng kể nồng độ C5a trong huyết tương trong các trường hợp nặng. Rối loạn điều hòa kích hoạt hệ thống bổ thể có thể là một yếu tố góp phần lớn vào bão cytokine, đặc biệt thông qua các tác dụng gây viêm của anaphylatoxin C3a và C5a. Những tác dụng này dường như trở nên bất lợi hơn ở những bệnh nhân có khuynh hướng di truyền về giảm điều hòa bổ thể, có thể góp phần vào các phát hiện TMA và rối loạn chức năng cơ quan sau đó.
3.7. Rối loạn điều hòa hệ thống renin angiotensin (renin angiotensin system: RAS)
Mặc dù rối loạn chức năng RAS được biết là có vai trò quan trọng trong ARDS nói chung, nhưng hệ thống này đặc biệt quan trọng trong nhiễm COVID-19 vì nhiều lý do. SARS-CoV-2 sử dụng protein Spike (S) của nó và hợp nhất với enzyme Angiotensin-Converting Enzyme 2 (ACE2) nằm trên màng tế bào của tế bào người để xâm nhập vào tế bào. ACE2 tương đồng với ACE, chia tách angiotensin I (ANGI) để tạo ra ANGII. ANGII liên kết với thụ thể Angiotensin type I (AT1R) dẫn đến co mạch và tăng huyết áp. Bất hoạt ANGII bởi ACE2 gây giãn mạch. Ngược lại, ANGII cũng điều hòa âm ACE2, nằm trên các tế bào biểu mô phế nang phổi, tế bào biểu mô ống thận, tế bào ruột của ruột non, tế bào nội mô, tế bào cơ tim, nguyên bào sợi và tế bào quanh mạch trong tim. SARS-CoV-2 có ái lực cao với ACE2 và sự gắn kết của SARS-CoV-2 dẫn đến mất ACE2 do virus xâm nhập và ACE2 rụng đi. ACE2 giảm làm ức chế sự giáng hóa ANGII dẫn đến ANGII dư thừa liên kết với AT1R và làm tăng tổn thương phổi. Cuối cùng, các nghiên cứu cho thấy ANGII liên kết với AT1R có thể kích thích giải phóng IL-6, góp phần thêm vào hội chứng bão cytokine điển hình của nhiễm COVID-19 nặng. Hỗ trợ giả thuyết này là bằng chứng cho thấy tăng nguy cơ mắc bệnh nặng ở bệnh nhân SARS-CoV hoặc cúm H7N5 có nồng độ ANGII cao hơn. Hơn nữa, trong các nghiên cứu gần đây trên bệnh nhân dương tính COVID-19, tải lượng virus và tổn thương phổi tương quan trực tiếp với nồng độ ANGII huyết tương. Ngoài ra, COVID-19 dường như gây ra kết cục tồi tệ hơn ở những bệnh nhân bị tăng huyết áp, bệnh tim mạch và đái tháo đường, tất cả đều liên quan đến việc giảm biểu hiện ACE2 ngay từ đầu cho thấy sự mất cân bằng mức ACE/ACE2. Người ta đã chứng minh rằng ANGII làm tăng biểu hiện TF và PAI-1 (plasminogen activator inhibitor 1) bởi các tế bào nội mô thông qua AT1R, dẫn đến trạng thái tăng đông. Do đó, dường như những gián đoạn này trong các con đường RAS, ngoài nhiều con đường được mô tả ở trên, có khả năng góp phần vào tình trạng tăng đông của COVID-19, và từ đó làm tăng tỷ lệ mắc bệnh và tử vong của bệnh cảnh này. Hiện nay, việc nghiên cứu nhanh chóng các cơ chế phân tử có liên quan là rất cần thiết để đạt được sự hiểu biết tốt hơn về sinh lý bệnh và có các biện pháp điều trị thích hợp, kịp thời.
4. Ảnh hưởng của bất thường công thức máu
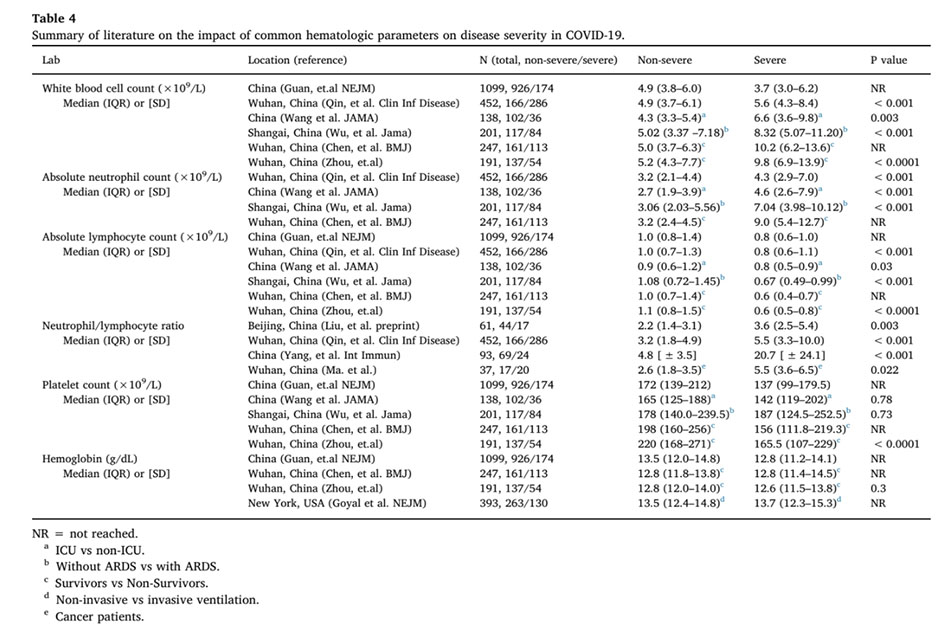
COVID-19 có liên quan đến ảnh hưởng đáng kể đến hệ huyết học và đông cầm máu. Trong phần này, chúng tôi sẽ xem xét dữ liệu hiện có về các thông số huyết học thường gặp và ý nghĩa tiên lượng của chúng. Bảng 4 tóm tắt về các thông số huyết học từ các nghiên cứu khác nhau.
4.1. Số lượng bạch cầu trung tính
Mặc dù các nghiên cứu ban đầu từ Vũ Hán đã báo cáo giảm bạch cầu ở bệnh nhân nhập viện dương tính COVID-19, nhưng các báo cáo tiếp theo cho thấy xu hướng số lượng bạch cầu trung tính cao hơn ở những bệnh nhân cần nhập ICU (ANC 4.2 so với 2.6 × 109 /L, p = 0.17). Do đó, những bệnh nhân cần chăm sóc ICU đã phát triển tăng bạch cầu trung tính trong quá trình nằm viện, với số lượng bạch cầu trung tính tuyệt đối (Absolute Neutrophil Count: ANC) có trung vị tối đa là 11.6 × 109 /L, so với 3.5 × 109 /L trong nhóm không ICU (p <0.001). Hơn nữa, hồi cứu 25 bệnh nhân COVID- 19 tử vong tại Vũ Hán cho thấy số lượng bạch cầu trung tính có xu hướng tăng lên trước khi chết trong 87.5% bệnh nhân có dữ liệu có thể đánh giá được.
4.2. Số lượng tế bào lympho
Số lượng tế bào lympho đã thu hút nhiều sự chú ý ở bệnh nhân COVID-19 và các nghiên cứu liên tục báo cáo sự hiện diện của giảm lympho trong bối cảnh này. Trong báo cáo từ Trung Quốc, có đến 83.2% bệnh nhân bị giảm lympho bào khi nhập viện. Điều quan trọng, giảm lympho là một dấu hiệu đồng nhất của tiên lượng xấu. Do đó, khi so sánh 109 bệnh nhân tử vong ở Vũ Hán với 116 bệnh nhân đã hồi phục, thì những bệnh nhân tử vong có số lượng tế bào lympho giảm hơn (0.63 so với 1.0 × 109 /L) và giảm tỷ lệ phần trăm lympho bào. Trong một nghiên cứu đoàn hệ hồi cứu trên 191 bệnh nhân với 54 tử vong, số lượng tế bào lympho thấp nhất vào ngày thứ 7 từ khi khởi bệnh ở những người sống sót và sau đó được cải thiện, trong khi giảm lympho nghiêm trọng được quan sát thấy cho đến khi tử vong ở những người không sống sót. Wang báo cáo rằng những người không sống sót đã phát triển giảm lympho nghiêm trọng hơn theo thời gian. Lympho bào máu ngoại biên (bằng kỹ thuật đếm tế bào dòng chảy) của bệnh nhân COVID-19 cần chăm sóc ICU cho thấy số lượng CD45+, CD3+, CD4+, CD8+, CD16+ và CD16/56+ thấp hơn đáng kể, mà không đảo ngược tỷ số CD4/CD8. Điều thú vị là, trong khi số lượng tế bào T CD4+ và CD8+ đều giảm, thì cả tỷ lệ và số lượng tế bào B đều không bị ảnh hưởng hoặc thậm chí tăng lên ở hầu hết bệnh nhân. Hơn nữa, sự sản xuất IFN-γ bởi các tế bào T CD4+ chứ không phải các tế bào T CD8+ hoặc các tế bào NK có xu hướng thấp hơn trong các trường hợp nặng. Cuối cùng, các tế bào T CD8+ lưu hành có chứa nồng độ cao của các hạt gây độc tế bào bao gồm perforin và granulysin. Tất cả các dữ liệu này cho thấy một hệ thống miễn dịch bị rối loạn điều hòa với sự hoạt động quá mức của tế bào T CD8+ gây độc tế bào. Các cơ chế tiềm năng của giảm bạch cầu lympho có thể bao gồm lympho bào nhiễm trực tiếp virus, mặc dù tỷ lệ tế bào lympho dương tính với ACE2 là khá nhỏ. Tế bào lympho biểu hiện thụ thể enzyme ACE2 của coronavirus và có thể được nhắm mục tiêu trực tiếp. Trong một so sánh hồi cứu 42 bệnh nhân COVID-19 và tăng huyết áp, 17 bệnh nhân được điều trị bằng thuốc ức chế men chuyển/ARB có số lượng tế bào T CD3+ và CD8+ tuyệt đối cao hơn đáng kể so với nhóm không ACEI/ARB, nhưng không sự khác biệt về tế bào T CD4+.
4.3. Tỷ số bạch cầu trung tính/lympho (neutrophil to lymphocyte ratio:NRL)
NLR đã được chứng minh là có ý nghĩa tiên lượng trong sốc nhiễm khuẩn, viêm tụy, ung thư tuyến tụy, nhiễm khuẩn huyết, và trong số nhiều bệnh khác. Số lượng bạch cầu trung tính tăng trong khi lympho giảm dường như là một dấu hiệu nhạy cảm của tình trạng viêm sớm và căng thẳng sinh lý. Trong một nghiên cứu trên 413 tình nguyện viên khỏe mạnh, NLR trung bình là 1.65 (± 1.96 SD: 0.78-3.53). Một số nghiên cứu đã chỉ ra mối quan hệ giữa tăng NLR và nhiễm COVID-19 nặng hơn. Tăng NLR khi nhập viện có mối liên hệ chặt chẽ với tăng mức độ nghiêm trọng của bệnh khi so sánh với bệnh nhân không bệnh nặng khi nhập viện. Hơn nữa, khi phân tầng theo NLR cao (> 3.13) và tuổi ≥ 50, thì 50% bệnh nhân bị bệnh nặng. Tương tự, trong một phân tích khác gồm 96 bệnh nhân, Yang xác định rằng 46.1% bệnh nhân không nặng có NLR >3.3 và tuổi> 49.5 sẽ chuyển thành các trường hợp nặng trong vòng trung bình 6.3 ngày. Trong một nghiên cứu trên 301 bệnh nhân, NLR là 2.973 (AUC 0.7338, độ nhạy 75.8%, độ đặc hiệu 66.8%) có liên quan đến tiến triển xấu của bệnh. Cuối cùng, một phân tích tổng hợp của 5 nghiên cứu từ Trung Quốc với 828 bệnh nhân, NLR tăng đáng kể ở những bệnh nhân nặng (khác biệt trung bình tiêu chuẩn = 2.404, CI 95% – 0.98-3.82). NLR tăng cũng liên quan đến VTE với NLR trung bình là 9.5 (5.9-13) ở 33 bệnh nhân phát triển VTE so với 5 (3.5-7.9) ở 165 bệnh nhân không có VTE.
4.4. Tiểu cầu
Mặc dù số lượng tiểu cầu giảm đáng kể không phải là một đặc điểm nổi bật của bệnh, nhưng có một số tình huống mà sự hiện diện của giảm tiểu cầu nặng đang được công nhận là một dấu hiệu của kết cục kém. Giảm tiểu cầu rõ rệt hơn ở những bệnh nhân bị nhiễm nặng với số lượng tiểu cầu trung bình là 137 × 109 /L so với 172 × 109 /L ở bệnh nhân không nặng. Xem Bảng 4 về sự khác biệt số lượng tiểu cầu giữa các bệnh nhân mắc bệnh nhẹ và nặng. Trong một nghiên cứu hồi cứu định hướng khảo sát mối quan hệ giữa giảm tiểu cầu và tỷ lệ tử vong trên 1476 bệnh nhân liên tiếp tại Bệnh viện Jinyintan – Vũ Hán, giảm tiểu cầu đã được báo cáo ở 20.7% bệnh nhân, sử dụng ngưỡng cắt 125 × 109 /L. 72.7% số người không sống sót có tiểu cầu <125 × 10^9 /L so với chỉ 10.7% ở người sống sót, p <0.001. 76 bệnh nhân (5.1%) có đáy tiểu cầu <50 × 109 /L với tỷ lệ tử vong là 92.1%. Tỷ lệ tử vong là 61.2% trong nhóm bệnh nhân có số lượng đáy tiểu cầu trong khoảng từ 50 đến 100 × 109 /L. Nhìn chung, phần lớn bệnh nhân dường như bị giảm tiểu cầu nhẹ, rõ rệt hơn trong trường hợp nặng. Hiện tại, vẫn chưa rõ liệu số lượng tiểu cầu giảm phản ánh DIC nghiêm trọng hơn và tăng tiêu thụ hay do tương tác trực tiếp giữa virus và tiểu cầu. Nhiều cơ chế tiềm năng gây ra giảm tiểu cầu do nhiễm virus, bao gồm sự phát triển của tự kháng thể và sự loại bỏ qua trung gian phức hợp miễn dịch; nhiễm trực tiếp vào các tế bào gốc/tế bào tạo máu và dòng tế bào nhân khổng lồ qua CD13 hoặc CD66a dẫn đến giảm sản xuất tiểu cầu; và kích hoạt con đường đông máu và tiêu thụ tiểu cầu bệnh lý.
4.5. Hemoglobin
Không có bất thường đáng kể đã được mô tả liên quan đến hồng cầu và thiếu máu. Có xu hướng thiếu máu nặng hơn ở những bệnh nhân mắc bệnh nặng hơn, với huyết sắc tố (Hgb) trung bình là 13.2 g/dL ở những bệnh nhân cần nhập ICU so với 14.2 g/dL ở bệnh nhân không ICU (p = 0.07), và phần lớn bệnh nhân có số lượng Hgb bình thường. Trong số 1099 bệnh nhân được xác nhận COVID-19 tại Trung Quốc, Hgb trung bình là 13.5 g/dL ở những bệnh nhân không nặng và 12.8 g/dL ở bệnh nhân nặng. Tuy nhiên, xu hướng này không được đánh giá cao trong tổng quan 393 bệnh nhân cần hoặc không cần thông khí xâm nhập ở New York City. Xem Bảng 4 về tổng hợp nồng độ Hgb trung bình được báo cáo trong các nghiên cứu khác nhau.
5. Quản lý
Nguyên tắc chung đầu tiên trong quản lý rối loạn đông máu là điều trị nguyên nhân nền. Tuy nhiên, với COVID-19, các phương pháp điều trị nhiễm virus vẫn còn trong giai đoạn thử nghiệm. Vì vậy, cho đến khi có một lựa chọn điều trị hiệu quả, điều quan trọng là quản lý một cách thích hợp các biến chứng rối loạn đông máu liên quan đến COVID-19.
5.1. Theo dõi các thông số xét nghiệm
Như là kết quả tương tác qua lại giữa các con đường viêm và huyết khối, nhiễm khuẩn hầu như luôn luôn liên quan đến sự kích hoạt đồng thời hệ thống đông máu, được chứng minh bằng sự gia tăng các dấu ấn của hệ thống đông máu bị kích hoạt. D- dimer thường xuyên tăng ở bệnh nhân COVID-19. Tăng fibrinogen, sản phẩm của thoái hóa fibrin, thời gian prothrombin (PT), thời gian thromboplastin hoạt hóa một phần (aPTT) và rút ngắn thời gian thrombin (TT) đã được mô tả ở bệnh nhân COVID-19 so với nhóm chứng khỏe mạnh.
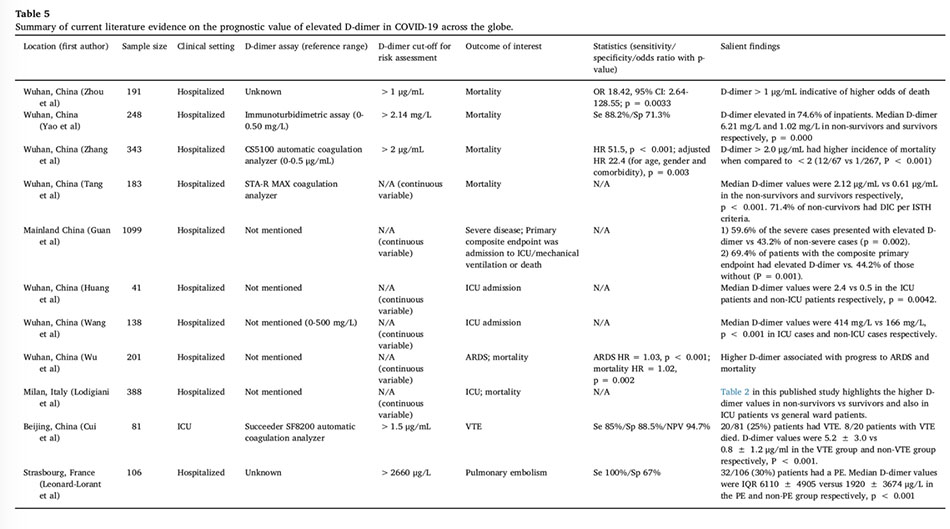
5.1.1. D-Dimer
Nhiều nghiên cứu ở bệnh nhân COVID- 19 nêu bật giá trị tiên lượng của tăng D- dimer (Bảng 5). Dữ liệu tích lũy rõ ràng gợi ý rằng D-dimer tăng và sự hiện diện của rối loạn đông máu đóng vai trò là chỉ số tiên lượng về tỷ lệ mắc bệnh và tử vong tệ hơn ở bệnh nhân nhập viện vì COVID-19. Nói chung, D-dimer là một dấu ấn về sự hình thành và thoái hóa fibrin, và đặc biệt là sự thoái hóa chuỗi polymer fibrin được plasmin xúc tác và do đó, trong trường hợp nhiễm COVID-19, phản ánh sự kích hoạt con đường đông cầm máu bệnh lý. Trong tổng quan này, chúng tôi mô tả các đơn vị D-dimer như được báo cáo trong những nghiên cứu ban đầu. Trong nghiên cứu của Lodigiani, D-dimer trung vị của những người sống sót khi nhập viện là 353 ng/mL (g/L), và có xu hướng tăng lên 529 ng/mL một tuần sau đó, so với lần lượt 869 ng/mL và 1494 ng/mL cho người không sống sót. Một cách nhất quán, dữ liệu của Tang cho thấy những người không sống sót sau khi nhiễm COVID-19 có nồng độ D-dimer cao hơn, số lượng tiểu cầu, nồng độ fibrinogen và antithrombin thấp hơn, tất cả đều gợi ý cao về DIC đang diễn ra. Theo dõi các thông số đông cầm máu như số lượng tiểu cầu, xét nghiệm đông máu, D-dimer và fibrinogen là thực hành phổ biến trong chăm sóc tích cực, đặc biệt là trong DIC. Những dữ liệu như vậy hiện cung cấp bằng chứng về tầm quan trọng của những xét nghiệm này, đặc biệt ở bệnh nhân COVID- 19 và đưa ra những hiểu biết tiên lượng quan trọng có khả năng sẽ hướng dẫn những thay đổi về quản lý.
Hội đồng chuyên gia ASH khuyến cáo theo dõi nối tiếp số lượng tiểu cầu, PT, aPTT, D-dimer và fibrinogen ở bệnh nhân COVID-19 nhập viện. Hội đồng đề nghị rằng khi các thông số này xấu đi, cụ thể là D-dimer, cho thấy bệnh nặng hơn, điều này dự đoán nhu cầu chăm sóc tích cực hoặc các liệu pháp theo kinh nghiệm. Tương tự như vậy, việc cải thiện các thông số này cùng với tình trạng lâm sàng ổn định hoặc cải thiện có thể hỗ trợ cho quyết định từ bỏ liệu pháp chống đông máu tích cực. ISTH cung cấp các khuyến cáo tương tự. Mặt khác, truyền các sản phẩm máu có thể được xem xét trong những tình huống chảy máu như chảy máu trong DIC, mặc dù chảy máu rõ rệt trên lâm sàng được cho là không phổ biến trong bối cảnh COVID-19.
Để theo dõi liệu pháp chống đông ở bệnh nhân đang được điều trị bằng các chế phẩm heparin, nên theo dõi anti-Xa hơn là aPTT vì aPTT có thể tăng cao trong COVID-19. Hơn nữa, điều này cho phép ít lần đến thăm phòng bệnh nhân hơn.
5.2. Thuốc chống đông máu
5.2.1. Sử dụng thuốc chống đông máu dự phòng hoặc điều trị
Theo sự hiểu biết ngày càng nhiều của chúng tôi về rối loạn đông máu liên quan đến COVID-19 thì cách tiếp cận tốt nhất để quản lý vẫn đang tiếp tục được khám phá. Do dữ liệu ít ỏi về sinh lý bệnh của rối loạn này, các bác sĩ trên toàn cầu buộc phải chuẩn bị các hướng dẫn để quản lý trạng thái tăng đông này dựa trên những hiểu biết đã được thiết lập về tương tác qua lại giữa viêm và huyết khối. Vì vậy, các bác sĩ lâm sàng đang sử dụng liều chống đông máu cho mục đích dự phòng, điều trị hoặc liều trung gian (nửa dự phòng-nửa điều trị), dựa trên các thông số đông máu và tình huống lâm sàng.
Trong một nghiên cứu ở Trung Quốc, mặc dù liều tối ưu vẫn chưa rõ ràng để mang lại lợi ích chống đông bằng các chế phẩm heparin (chủ yếu là LMWH liều dự phòng) ở bệnh nhân COVID-19. Nhưng điều quan trọng là trong phân tích dưới nhóm, những người có điểm rối loạn đông máu do nhiễm khuẩn huyết (sepsis-induced coagulopathy: SIC) lớn hơn 3 (n = 97) đã giảm tỷ lệ tử vong 28 ngày (40.0% so với 64.2%, p = 0.029), cũng như 161 bệnh nhân có D-dimer lớn hơn 6 lần giới hạn bình thường (32.8% so với 52.4%, p = 0.017). Đáng lo ngại, một nghiên cứu tại Hà Lan của Klok báo cáo tỷ lệ biến chứng huyết khối 31% vẫn xảy ra mặc dù có dùng ít nhất một thuốc chống đông (LMWH) dự phòng ở bệnh nhân nhập viện vì viêm phổi do COVID-19. Một cách nhất quán, một nghiên cứu khác, mặc dù nhỏ hơn, được thực hiện ở Pháp đã cho thấy khả năng tăng đông đáng kể hiện diện ở bệnh nhân COVID-19. Trong nghiên cứu này, Llitjos báo cáo rằng tất cả các bệnh nhân COVID- 19 nặng được điều trị chống đông dự phòng (n = 8) đã phát triển VTE, cũng như 56% những người được dùng thuốc chống đông liều điều trị (n = 18).
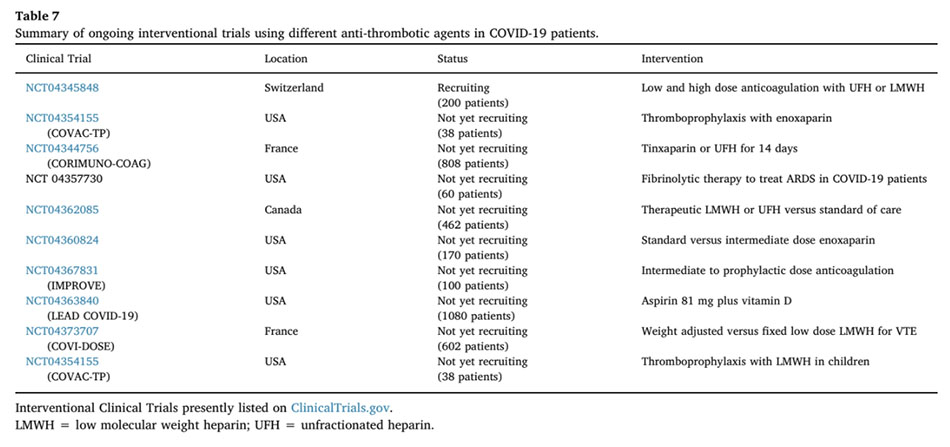
Những phát hiện này hỗ trợ một lập luận mạnh mẽ để xem xét liều cao hơn (trung gian hoặc điều trị) của thuốc chống đông trong quản lý bệnh nhân COVID-19 nặng, đặc biệt là trong trường hợp không có chống chỉ định rõ ràng như chảy máu hoạt động. Tuy nhiên, chúng cũng mang đến lo ngại rằng bản thân thuốc chống đông có thể không đủ để ngăn ngừa các biến chứng huyết khối. Trong khi chúng tôi chiến đấu với những vấn đề nan giải này, thì các chuyên gia đông cầm máu phác thảo và sửa đổi các hướng dẫn dựa trên dữ liệu tích lũy nhanh chóng, cần lưu ý rằng có thể tồn tại những khác biệt về sinh lý bệnh rối loạn đông máu do COVID-19. Dưới đây, chúng tôi tóm tắt các hướng dẫn và khuyến cáo hiện tại từ các tổ chức khác nhau, kể từ ngày bài viết này được viết, về vai trò của thuốc chống đông máu dự phòng và điều trị trong Bảng 6.
Mặc dù tất cả các hướng dẫn hiện nay đều khuyến cáo heparin trọng lượng phân tử thấp (LMWH) hoặc heparin không phân đoạn (UFH) tiêm dưới da để chống đông, một cách tiếp cận được đề xuất khác là sử dụng heparin dạng khí dung để tăng cường hiệu quả chống đông máu tại chỗ trong mạch máu phổi. Dữ liệu trước đây đã chứng minh rằng heparin khí dung làm giảm đáng kể kích hoạt đông máu trong phổi của bệnh nhân nguy kịch. Tuy nhiên, cũng như rất nhiều liệu pháp khác, phương pháp này vẫn chưa được nghiên cứu trong bối cảnh COVID-19.
5.2.2. Tương tác thuốc với thuốc chống đông và thuốc chống tiểu cầu
Cần chú ý đến các tương tác thuốc tiềm tàng giữa thuốc chống đông và thuốc thử nghiệm cho COVID-19. Hướng dẫn của ISTH khuyên nên “thận trọng” (mặc dù không đề cập là “tránh”) ở những bệnh nhân đang dùng thuốc chống đông uống trực tiếp (direct oral anticoagulant: DOAC), nhập viện vì COVID-19 do tương tác với thuốc kháng virus hoặc bất kỳ loại thuốc nào đang được nghiên cứu. Trong một nghiên cứu nhỏ của Testa, bệnh nhân đang dùng DOAC được điều trị bằng thuốc kháng virus cho thấy sự gia tăng đáng báo động về nồng độ DOAC trong huyết tương. Tác dụng của DOAC dường như được tăng cường bởi atazanavir, lopinavir/ritonavir, hydroxychloroquine và giảm đi do tocilizumab. Hơn nữa, apixaban có thể làm tăng nguy cơ kéo dài QT khi được sử dụng với hydroxychloroquine. Atazanavir và lopinavir/ritonavir có thể làm giảm chất chuyển hóa hoạt động của clopidogrel và prasugrel. Cả atazanavir, lopinavir/ ritonavir, remdesivir, hydroxychloroquine, tocilizumab và interferon beta, đều chưa ghi nhận có tương tác với các chế phẩm heparin, fondaparinux hoặc argatroban. Một danh sách các tương tác thuốc (được tham khảo từ Đại học Liverpool) có thể được tìm thấy tại https://www.covid19-druginteractions.org/ .
5.2.3. Thời gian chống đông máu
Dữ liệu về thời gian và phương pháp chống đông tối ưu cho bệnh nhân COVID- 19 sau xuất viện hiện không có sẵn. Aspirin đã được nghiên cứu để điều trị dự phòng VTE lâu dài ở bệnh nhân chỉnh hình có nguy cơ thấp và có thể được xem xét điều trị dự phòng VTE do COVID-19 nếu đáp ứng các tiêu chí sau xuất viện. Hội đồng chuyên gia ASH khuyến cáo rằng mọi quyết định sử dụng dự phòng huyết khối lâu dài sau xuất viện bằng thuốc chống đông hoặc aspirin nên xem xét các yếu tố nguy cơ VTE của từng bệnh nhân, như giảm khả năng vận động, rối loạn đông máu và nguy cơ chảy máu. Thang điểm nguy cơ VTE, IMPROVE, đã được sử dụng như một công cụ để xác định bệnh nhân sẽ được hưởng lợi từ dự phòng lâu dài với LMWH. Các phác đồ đề nghị rằng bệnh nhân nhập viện vì COVID-19, đặc biệt là những bệnh nhân có điểm VTE IMPROVE >3, nồng độ D-dimer cao (> 2 × giới hạn trên bình thường) và 2 hoặc nhiều hơn đặc điểm sau: tuổi >60, VTE trước đây, đã biết có hội chứng tăng đông (thrombophilia), hiện đang có ung thư, nên được xem xét mạnh mẽ cho điều trị dự phòng huyết khối kéo dài đến 39-45 ngày sau khi xuất viện với LMWH liều dự phòng hoặc rivaroxaban. Đối với những bệnh nhân đã bắt đầu chống đông máu liều điều trị theo kinh nghiệm vì nghi ngờ PE, hội đồng ASH khuyến cáo nên duy trì chống đông ít nhất 3 tháng, bất kể kết quả nghiên cứu khảo sát trong tương lai. Hơn nữa, các trường hợp đã xác nhận VTE nên được xem là “khởi kích” và cần điều trị trong thời gian 3-6 tháng.
5.3. Thuốc chống ly giải huyết khối
Đã có sự quan tâm trong việc sử dụng thuốc chống tiêu sợi huyết trong quản lý huyết khối và ARDS trong bối cảnh COVID-19. Sự lắng đọng fibrin trong phế nang và nhu mô phổi là một quan sát được thấy trong ARDS dẫn đến kết cục hô hấp tồi tệ hơn. Mặc dù ức chế sản xuất thrombin bằng các heparin có thể ngăn chặn sự lắng đọng fibrin thêm, nhưng không giống như việc sử dụng thuốc chống tiêu sợi huyết, nó không hiệu quả đối với fibrin lắng đọng trước đó. Việc sử dụng tPA để điều trị ARDS trong COVID-19 đã được đề xuất, sau loạt 3 bệnh nhân COVID-19 mà tPA có liên quan đến việc cải thiện tạm thời các thông số hô hấp. Tuy nhiên, biến chứng chảy máu vẫn là lo ngại lớn và do dữ liệu ít ỏi, nên việc sử dụng thuốc chống tiêu sợi huyết vẫn chưa phải là khuyến cáo mạnh mẽ. Một cách tiếp cận khác, an toàn hơn, có thể mang lại lợi ích trong ARDS do COVID-19 là sử dụng thuốc tiêu sợi huyết dạng khí dung. Vào năm 2019, một nghiên cứu trên 60 bệnh nhân ARDS cho thấy việc sử dụng streptokinase khí dung ở bệnh nhân ARDS nặng dẫn đến cải thiện oxy hóa và cơ học phổi nhanh hơn so với heparin khí dung. Cách tiếp cận này sẽ cần nghiên cứu thêm trong bối cảnh COVID-19.
Một thuốc khác có đặc tính tiêu sợi huyết đã được xem xét là Nafamostat. Nafamostat là một chất ức chế protease serine tổng hợp đã được sử dụng ở Nhật Bản để điều trị DIC trong viêm tụy qua nhiều thập kỷ. Nafamostat có cả tác dụng chống tiêu sợi huyết cũng như chống virus, và do đó đã được đề cập về việc tái sử dụng như một liệu pháp tiềm năng cho COVID- 19 trong các nghiên cứu đang diễn ra.
5.4. Mục tiêu trị liệu trong tương lai và các lĩnh vực nghiên cứu
Như đã nhấn mạnh trước đó, SARS- CoV-2 biểu hiện các cơ chế độc đáo gây ra rối loạn đông máu. Dữ liệu hạn chế cho thấy tỷ lệ huyết khối cao mặc dù sử dụng chống đông máu nhấn mạnh sự cần thiết của những cách tiếp cận điều trị mới để ngăn ngừa biến chứng huyết khối và tử vong. Chúng tôi liệt kê bên dưới các lĩnh vực nghiên cứu chính đang được theo đuổi hoặc cần nghiên cứu thêm, và cung cấp một bản tóm tắt các thử nghiệm quan sát và can thiệp đang diễn ra trong Bảng 6 và Bảng 7. Những cách tiếp cận này vẫn là lý thuyết hoặc thử nghiệm, nhưng đưa ra cái nhìn sâu sắc về các chiến lược tiềm năng đầy hứa hẹn trong tương lai.
5.4.1. Huyết khối viêm
Như đã đề cập, tương tác hai chiều giữa viêm và huyết khối, hay “huyết khối-miễn dịch”, đang nổi lên như một nền tảng chính của các biến chứng gây tăng đông trong COVID-19. Các thử nghiệm sử dụng thuốc ức chế miễn dịch có thể có khả năng làm giảm tiến trình viêm này ở bệnh nhân COVID-19 và đã được quan tâm.
5.4.1.1. Con đường bổ thể.
Như đã đề cập trước đây, ngày càng có nhiều bằng chứng ủng hộ vai trò của tình trạng tăng hoạt bổ thể góp phần vào COVID-19 nặng. Các nghiên cứu này cung cấp cơ sở gợi ý rằng những trường hợp COVID-19 nặng và tử vong, có những đặc điểm phù hợp với kích hoạt bổ thể quá mức, có thể làm tăng tính nhạy cảm với TMA do khuynh hướng di truyền đối với việc hoạt hóa bổ thể gây bệnh. Dữ liệu trước đây cho thấy rằng điều trị bằng kháng thể anti-C5a nhân tạo đã làm giảm đáng kể tổn thương và viêm phổi trong mô hình khỉ bị tổn thương phổi cấp tính do virus (virus H7N9). Trên thực tế, trong cùng một nghiên cứu ở Trung Quốc mà nồng độ C5a tăng cao đã được chứng minh trong COVID-19 nặng, các nhà nghiên cứu cũng điều trị hai trường hợp nặng bằng kháng thể đơn dòng C5a tái tổ hợp. Cả hai bệnh nhân đều cho thấy sự cải thiện đáng kể bằng việc hết sốt tăng oxy hóa máu. Do đó, ức chế bổ thể, với các thuốc như eculizumab, cũng có thể là một phương pháp điều trị đầy hứa hẹn cho COVID-19 nặng.
5.4.1.2. Bẫy ngoại bào bạch cầu trung tính.
Dữ liệu tích lũy cho thấy NETs có khả năng góp phần vào cả viêm và huyết khối. Như đã nhấn mạnh ở trên, NETs được cho là đóng vai trò tốt trong huyết khối-miễn dịch liên quan đến COVID-19. Điều này cho thấy vai trò tiềm năng của việc nhắm mục tiêu NETs để giảm mức độ nghiêm trọng lâm sàng của COVID-19. Barnes đề xuất một số cơ chế nhắm mục tiêu trực tiếp vào các phân tử tạo thành NETs hoặc tiến trình dẫn đến sự hình thành của chúng. Anakinra nhắm mục tiêu IL1β, đây là yếu tố tăng cường sự hình thành NETs và hiện đang được nghiên cứu trong các thử nghiệm COVID-19 (định danh ClinicalTrials.gov: NCT04324021, NCT04330638, NCT02735707).
5.4.1.3. Các cytokine viêm.
Tocilizumab, một chất ức chế interleukin-6, đã được sử dụng để điều trị hội chứng phóng thích cytokine trong COVID-19, và dữ liệu sơ bộ gần đây cho thấy lợi ích sống sót khi được sử dụng sớm trong diễn tiến của bệnh. Mặc dù tác động của tocilizumab lên kết cục huyết khối là chưa rõ, nhưng có thể lợi ích sống còn là thứ phát sau việc làm giảm viêm nội mô và huyết khối vi mạch. Dù là lý do gì thì việc nghiên cứu thêm là rất cần thiết. Trong báo cáo loạt ca ở Trung Quốc, việc thay huyết tương cho mục đích tương tự để giảm bão cytokine đã cho thấy lợi ích tiềm năng. Ngoài ra, việc sử dụng các phân tử giống như heparin nhưng không có tác dụng chống đông đã được đề xuất như một cơ chế để làm giảm sự phóng thích các cytokine viêm. LMWH được biết là có đặc tính chống viêm, có thể mang lại lợi ích bổ sung ở bệnh nhân COVID-19 phải chịu các cytokine tiền viêm. Các heparan sulfate oligosaccharides thiết kế đặc biệt với các protein tiền viêm trung hòa và tác dụng chống virus tiềm năng đang được nghiên cứu trong điều trị COVID-19.
5.4.2. Con đường chống đông máu tự nhiên
Vì sinh bệnh học viêm và rối loạn đông máu do nhiễm khuẩn huyết liên quan đến việc tạo ra thrombin và giảm protein chống đông máu tự nhiên, nhiều nghiên cứu đã khám phá lợi ích của việc sử dụng các chất ức chế đông máu như antithrombin trong những tình huống này. Hayakawa đã chứng minh rằng điều trị AT trong DIC do nhiễm khuẩn huyết có thể liên quan đến giảm tỷ lệ tử vong nội viện do mọi nguyên nhân. Tương tự, một nghiên cứu của Kato cho thấy lợi ích tử vong có thể có ở bệnh nhân nhiễm khuẩn huyết được điều trị rối loạn đông máu bằng thrombomodulin tái tổ hợp. Mặc dù không có nghiên cứu nào với thuốc chống đông cung cấp dữ liệu mạnh mẽ như thử nghiệm PROWESS, nghiên cứu protein C hoạt hóa (activated protein C: APC), nhưng lợi ích của việc sử dụng APC bị hạn chế bởi nguy cơ chảy máu tăng. Nói chung, những dữ liệu này cung cấp nhiên liệu để xem xét các liệu pháp thử nghiệm nhằm giải quyết các con đường chống đông sinh lý có khả năng bị ức chế hoặc bất hoạt nhất trong COVID-19. Cuối cùng, một nhóm ở Áo đã đăng ký một nghiên cứu với Clinicaltrials.gov để đánh giá khả năng tạo thrombin của bệnh nhân dương tính COVID-19, có và không có bổ sung thrombomodulin (NCT04356144). Kết quả từ các nghiên cứu này có thể cung cấp nền tảng cho các nghiên cứu can thiệp khám phá các thuốc chống đông máu như thrombomodulin tái tổ hợp hoặc antithrombin để điều trị rối loạn đông máu do COVID-19.
5.5. COVID-19 ở bệnh nhân có rối loạn chảy máu
Mặc dù chúng tôi vẫn chưa hiểu làm thế nào mà nhiễm COVID-19 có thể ảnh hưởng đến những người bị rối loạn chảy máu, nhưng chúng tôi biết rằng bệnh nặng thường liên quan đến rối loạn đông máu giống như DIC. Vì một số phương pháp điều trị được sử dụng hiện nay để kiểm soát rối loạn chảy máu cũng có thể làm ảnh hưởng đến các xét nghiệm đông máu, nên thông tin này rất quan trọng cho việc quản lý bệnh ở những bệnh nhân sử dụng các liệu pháp này.
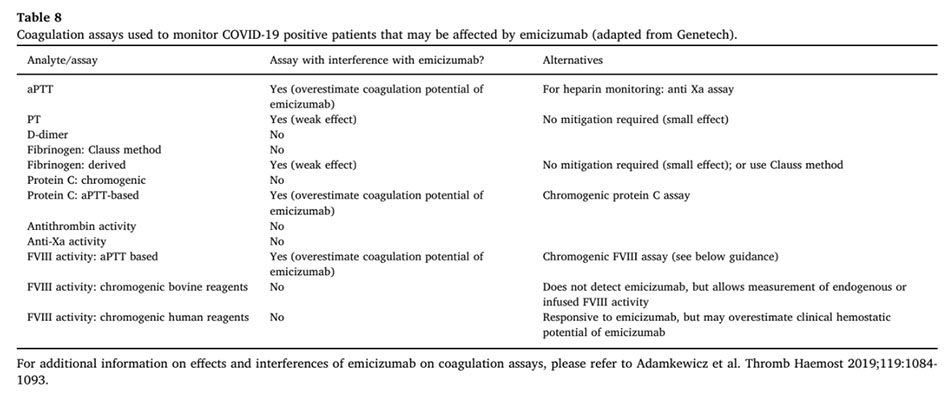
Điều này đặc biệt đúng với những bệnh nhân hemophilia được điều trị bằng emicizumab. Công ty dược phẩm sản xuất emicizumab, Genetech, đã cung cấp các hướng dẫn và thông tin cho bác sĩ tại các trung tâm điều trị bệnh hemophilia và các chuyên gia chăm sóc sức khỏe khác. Bảng 8 tóm tắt thông tin mà họ cung cấp, trong đó liệt kê các xét nghiệm đông máu thông thường có thể được sử dụng để theo dõi bệnh nhân bị rối loạn đông máu liên quan đến COVID-19 và nếu các xét nghiệm này bị ảnh hưởng bởi emicizumab.