Phạm vi vấn đề
Ở nhiều nước đang phát triển, tỷ lệ mắc hội chứng mạch vành cấp tính (ACS) vẫn đang gia tăng, trong khi các nước phát triển báo cáo tỷ lệ mắc đã giảm [1, 2]. Hiện nay, bệnh tim mạch vẫn là nguyên nhân quan trọng nhất gây tử vong ở các nước đang phát triển lẫn phát triển [3]. Bệnh nhân sống sót sau ACS, về lâu dài có nguy cơ cao hơn bị tái phát ACS và các vấn đề tim mạch khác như suy tim mạn, rối loạn nhịp tim, đột quỵ, bệnh động mạch ngoại biên, và các biến chứng tim mạch khác liên quan đến các vị trí động mạch khác nhau [4].
Chẩn đoán ACS có thể là một thách thức lớn. Khoảng 10% đến 20% bệnh nhân đến phòng cấp cứu (ER) vì đau ngực và nghi ngờ cao trên lâm sàng bị ACS [5, 6]. Một vài đối tượng bệnh nhân đặc biệt khác thậm chí có thể không bị đau ngực hoặc không có các triệu chứng điển hình. Các trường hợp khó chẩn đoán này thường ở phụ nữ, người già, và bệnh nhân đái tháo đường. Hiện tại, đau ngực vẫn là triệu chứng phổ biến nhất; tuy nhiên, biểu hiện lâm sàng ở các đối tượng đặc biệt (phụ nữ và người già) có thể có rất nhiều triệu chứng không điển hình như buồn nôn, khó thở, yếu, chóng mặt, ngất/dọa ngất, đau bụng, đánh trống ngực, suy giảm nhận thức, lú lẫn, hoặc thậm chí mê sảng [7-10]. Lựa chọn các chiến lược để tối ưu chẩn đoán và quản lý là rất quan trọng cho sự sống còn và tiên lượng lâu dài của bệnh nhân [11]. Các bác sĩ trong ER nên biết tất cả các biến thể này để cải thiện chất lượng chăm sóc ở các đối tượng đặc biệt khi có nghi ngờ lâm sàng cao về ACS.
Phân loại và định nghĩa
ACS có thể không thể phân biệt được về mặt lâm sàng với nhau và là khái niệm bao gồm nhồi máu cơ tim ST chênh lên (STEMI), nhồi máu cơ tim không ST chênh lên (NSTEMI), và đau thắt ngực không ổn định (UA) dựa trên điện tâm đồ, và sự phóng thích troponin. STEMI xảy ra sau khi tắc nghẽn 100% động mạch vành và UA/NSTEMI xảy ra sau khi tắc nghẽn mạch vành một phần (Hình 5.1) [1].
Điện tâm đồ (ECG) vẫn là yếu tố chính trong tình huống nghi ngờ lâm sàng cao trong ER. Theo các hướng dẫn và khuyến cáo hiện tại, mọi bệnh nhân trong ER mà nghi ngờ ACS phải được thực hiện và giải thích ECG trong vòng chưa đầy 10 phút. Với ECG, bệnh nhân có thể được phân loại thành các loại STEMI hoặc NSTEMI/UA [12]. Bệnh nhân có triệu chứng với ECG không chẩn đoán nên được thực hiện phân tích dấu ấn sinh học, đặc biệt là các troponin tim độ nhạy cao (HS- cTn). Nồng độ troponin có thể phát hiện trên bách phân vị thứ 99 của giới hạn trên bình thường (ULN) có mối liên quan chặt chẽ với hoại tử cơ tim và thiết lập chẩn đoán NSTEMI [12]. Theo cách tiếp cận về mặt lâm sàng, hoại tử cơ tim có thể xảy ra sớm nhất là 20 phút sau khi bắt đầu có triệu chứng đau. Do đó, bối cảnh nghi ngờ cao trên lâm sàng và đau ngực do thiếu máu cục bộ >20 phút là rất đáng nghĩ đến khả năng MI (STEMI/NSTEMI) và nên được xem xét trong quá trình ra quyết định [4, 13].
Đau thắt ngực không ổn định (UA) là biểu hiện lâm sàng của cơ tim bị thiếu máu cục bộ. Bệnh nhân biểu hiện là đau ngực, triệu chứng đáng ngờ, và các yếu tố nguy cơ tim mạch, không có ST chênh lên trên ECG, và không tăng troponin, sẽ được phân loại vào loại này. Điều quan trọng là phải xem xét rằng không có thay đổi điện tâm đồ liên quan đến UA; ngoài ra, một số bệnh nhân thậm chí có thể có ECG bình thường khi đến ER [4].
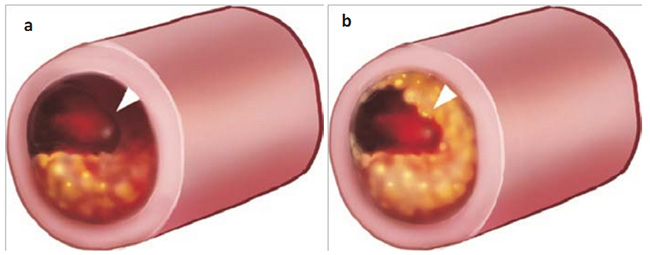
Hình 5.1 Mặt cắt ngang động mạch vành trong ACS. Bảng a cho thấy mảng xơ vữa động mạch bị vỡ với lõi giàu lipid và hình thành huyết khối tắc nghẽn một phần; hiện tượng này có thể được tìm thấy trong NSTEMI/UA. Bảng b cho thấy tắc nghẽn hoàn toàn, thường thấy trong STEMI.
NSTEMI sẽ được chẩn đoán trong trường hợp không có ST chênh lên dai dẳng và nồng độ HS-cTn cao hơn phân vị thứ 99 ULN (giá trị tùy theo mỗi phòng xét nghiệm) hoặc với HS-cTn ban đầu dưới ngưỡng ULN nhưng với độ thay đổi delta ít nhất 20% đến 30% tại thời điểm lấy máu lần thứ hai [14]. Troponin tăng có thể được hiểu là hoại tử mô và tổn thương cơ tim. Cũng giống như đối với UA, có tới một phần ba số bệnh nhân có thể có ECG bình thường khi nhập viện, và những người còn lại có thể có các bất thường ECG đặc trưng như ST chênh xuống, sóng T thay đổi/đảo ngược, sóng T cao không chẩn đoán hoặc thoáng qua [4].
Cuối cùng, chẩn đoán STEMI được thiết lập khi ST chênh lên đo được tại điểm J tương thích với tắc động mạch vành cấp toàn bộ. Nếu có nghi ngờ lâm sàng cao và các triệu chứng thiếu máu cục bộ kéo dài, xuất hiện block nhánh trái hoặc phải nên được điều trị như bệnh nhân STEMI. Chẩn đoán kịp thời là chìa khóa để cứu vãn (có nguy cơ) thiếu máu cục bộ cơ tim. Bệnh nhân STEMI trong ER không cần chờ kết quả của dấu ấn sinh học (troponin) để xác định chẩn đoán hoại tử cơ tim. Điều quan trọng là những bệnh nhân này cần phải được can thiệp bằng bất kỳ liệu pháp tái tưới máu khẩn cấp nào [15].
Theo định nghĩa toàn cầu lần thứ tư về nhồi máu cơ tim, nên sử dụng khái niệm tổn thương cơ tim khi có bằng chứng về HS-cTn với ít nhất một giá trị trên phân vị thứ 99 ULN. Tổn thương cơ tim được coi là cấp tính nếu có sự tăng/hoặc giảm nhanh chóng của các giá trị cTn [13]. Tuy nhiên, định nghĩa này vẫn chưa rõ ràng, và tính tiện ích của nó trên lâm sàng vẫn là dấu hỏi.
Khái niệm nhồi máu cơ tim cấp nên được sử dụng khi có tổn thương cơ tim cấp với bằng chứng lâm sàng là thiếu máu cục bộ cơ tim cấp và với việc phát hiện tăng và/hoặc giảm các giá trị HS-cTn với ít nhất một giá trị trên phân vị thứ 99 ULN và ít nhất một trong những điều sau đây [13, 15-17]:
- Triệu chứng của bệnh lý thiếu máu cục bộ cơ tim.
ST-T thay đổi mới hoặc block nhánh trái (LBBB) mới xuất hiện. - Sóng Q mới.
- Bằng chứng hình ảnh học mới về mất vận động cơ tim.
- Bất thường chuyển động phù hợp với nguyên nhân thiếu máu cục bộ.
- Huyết khối động mạch vành qua chụp mạch vành hoặc tử thiết.
Việc phân loại nhồi máu cơ tim (MI) có thể được mở rộng thành sáu loại khác nhau, bất kể những thay đổi điện tâm đồ xuất hiện tại thời điểm chẩn đoán [1].
- Type 1: Nhồi máu cơ tim do huyết khối mảng xơ vữa.
- Type 2: Nhồi máu cơ tim do bất tương xứng cung-cầu.
- Type 3: Nhồi máu cơ tim gây đột tử, mà không xác định được ECG hay dấu ấn sinh học.
- Type 4a: Nhồi máu cơ tim liên quan đến can thiệp mạch vành qua da (PCI).
- Type 4b: Nhồi máu cơ tim liên quan huyết khối trong stent.
- Type 5: Nhồi máu cơ tim liên quan đến phẫu thuật bắc cầu mạch vành (CABG).
Tỷ lệ hiện mắc
ACS là nguyên nhân quan trọng của tỷ lệ bệnh tật và tử vong. Tỷ lệ hiện mắc ACS khác nhau giữa các quốc gia phát triển và các nước thế giới thứ 3 [1]. Tỷ lệ mắc ACS ở Bắc Mỹ và Châu Âu đã giảm trong những thập kỷ qua. Tại Hoa Kỳ, có những báo cáo về sự giảm tỷ lệ mắc STEMI được điều chỉnh từ 133 trên 100,000 vào năm 1999 xuống còn 50 trên 100,000 bệnh nhân mỗi năm trong năm 2008 [15]. Trong năm 2016, chỉ riêng tại Hoa Kỳ, AHA báo cáo tỷ lệ mắc MI khoảng 550,000 cho lần đầu tiên và 220,000 cho tái phát hàng năm [1]. Nhìn chung, mỗi năm, khoảng ba phần tư triệu người sẽ mắc ACS ở Hoa Kỳ, trong đó khoảng 70% sẽ là NSTEMI [12]. Vương quốc Anh báo cáo tình huống tương tự trong đó hai phần ba số ACS của họ là NSTEMI và một phần ba còn lại là STEMI, với tỷ lệ giảm 33% được báo cáo trong năm 2010 so với năm 2002 [2].
Sinh lý bệnh
Nhiều yếu tố nguy cơ tim mạch thúc đẩy trạng thái tiền viêm kéo dài, gây ra các tác động xấu bên trong các mạch máu, đặc biệt là trên thành nội mạc. Tình trạng viêm gây ra sự biểu hiện quá mức của các chất trung gian tiền đông làm tăng nguy cơ biến cố thuyên tắc huyết khối [18].
Thêm vào đó, môi trường viêm kéo dài này thúc đẩy hoạt hóa tiền đông và kết tập tiểu cầu, xơ vữa động mạch đóng một vai trò quan trọng trong sự bắt đầu của ACS. Sinh lý bệnh của xơ vữa động mạch được đặc trưng bởi sự tích tụ lipid dọc theo thành động mạch. Các lipid này kích thích viêm mạch máu tại chổ và hơn nữa làm rối loạn chức năng nội mô [1, 18].
Như đã mô tả trước đây, lớp nội mạc bị tổn thương trở nên rối loạn chức năng; sự thư giãn nội mô trở nên suy yếu thông qua cơ chế giảm sự nhạy cảm và giảm giải phóng các chất điều hòa huyết khối như nitric oxide, prostacyclin nội mô, và ectonucleotidase CD39, là tuyến bảo vệ đầu tiên chống lại huyết khối [1, 19]. Những mảng vỡ trên thành mạch này có khả năng gây huyết khối cao vì chúng thu hút nhiều loại tế bào máu viêm thúc đẩy giải phóng các cytokine tiền viêm và các yếu tố tăng trưởng giúp tăng cường độ kết dính tiểu cầu và hóa hướng động các tế bào viêm như bạch cầu trung tính: quá trình này huy động tế bào và giải phóng interleukin dẫn đến sự hình thành và lan rộng huyết khối.
Cơ chế bệnh lý thường gặp nhất của ACS là sự xói mòn hoặc vỡ các mảng xơ vữa động mạch không ổn định dẫn đến vỡ mảng trên thành mạch làm tiếp xúc với các thành phần lõi và ma trận như collagen và yếu tố mô nội mạch (ITF) bên trong tuần hoàn máu bắt đầu hình thành cục huyết khối. Sự tiếp xúc với collagen cũng kích hoạt sự hoạt hóa và kết dính tiểu cầu, trong khi ITF khởi đầu việc tạo ra huyết khối, chuyển fibrinogen thành fibrin và họat hóa tiểu cầu. Sự hình thành cục huyết khối dẫn đến tắc hoàn toàn hoặc một phần của động mạch vành bị ảnh hưởng [1, 18, 19]. Những sự kiện này thiết lập mối liên hệ giữa các yếu tố nguy cơ huyết khối do xơ vữa và huyết khối động mạch, cũng như với vai trò của viêm là yếu tố kích hoạt các biến cố do huyết khối [19].
Nghi ngờ lâm sàng cao là ACS
Đánh giá ban đầu của bác sĩ lâm sàng nên tập trung vào khả năng mắc bệnh của bất kỳ bệnh nhân nào nghi ngờ chẩn đoán ACS. Phục vụ cho mục đích này, một số thang điểm chẩn đoán đã được phát triển để giúp các bác sĩ loại trừ hoặc xác nhận một cách an toàn và hiệu quả ACS tiềm tàng. Thang điểm HEART có một số lợi thế so với các thang điểm nguy cơ khác. Thang điểm TIMI (Thrombolysis in Myocardial Infarction) và GRACE (Global Registry of Acute Coronary Events) được dựa trên các dân số nguy cơ cao với bệnh mạch vành đã biết. Các thang điểm khác như T- MACS (Troponin-only Manchester Acute Coronary Syndromes) và TRAPID-AMI (High-Sensitivity Cardiac Troponin T Assay for Rapid Rule-out of Acute Myocardial Infarction) sử dụng các troponin tim độ nhạy cao nên có thể không có sẵn ở nhiều bệnh viện [14]. Mặt khác, thang điểm HEART dựa trên một phân tích gộp bao gồm hơn 11,000 bệnh nhân, và kết quả tổng hợp của các biến được nghiên cứu mang lại độ nhạy 96.7% cho một biến cố tim mạch bất lợi lớn (MACE) [5,14] (Bảng 5.1). Điểm HEART có tiện ích lâm sàng lớn hơn vì nó có thể xác định bệnh nhân có nguy cơ thấp với đau ngực không rõ ràng, có khả năng bị ACS [6, 14, 20].
Nguy cơ tim mạch của mỗi người rất đa dạng. Ở nhiều nước công nghiệp và nước đang phát triển, những thay đổi quan trọng trong lối sống có ảnh hưởng lớn đến việc xơ vữa động mạch toàn thân và bệnh tim thiếu máu cục bộ (IHD). Framingham Cohort ban đầu nghiên cứu các yếu tố nguy cơ tim mạch truyền thống như tuổi tác (>45 tuổi đối với nam hoặc >55 tuổi đối với nữ), tăng huyết áp, đái tháo đường, rối loạn lipid máu, sử dụng thuốc lá, chế độ ăn giàu năng lượng, ít vận động, béo phì, và tiền sử gia đình (+), và đang tiếp tục để tìm ra nguy cơ mạch vành ở mỗi cá thể [11]. Tuy nhiên, các tình trạng nguy cơ mới đã được xác định trong những thập kỷ qua, chẳng hạn như bệnh thận mãn, căng thẳng, trầm cảm, tình trạng viêm và bệnh tự miễn, ung thư, bệnh thoái hóa mãn tính (không phải tim mạch), và tình trạng kinh tế xã hội thấp là một trong những vấn đề quan trọng nhất [11]. Sự kết hợp của các yếu tố nguy cơ tim mạch và tiền sử y khoa đáng ngờ làm tăng khả năng chẩn đoán ACS [1].
Phân tầng nguy cơ
Sau khi chẩn đoán ACS được thiết lập, bước tiếp theo là xác định nguy cơ bệnh nhân mắc các biến chứng tim mạch và tỷ lệ tử vong. Việc phân tầng nguy cơ cấp trong biểu hiện ACS dựa trên đánh giá lâm sàng ban đầu của bác sĩ kết hợp với một vài xét nghiệm đơn giản như xác định ECG 12 chuyển đạo và cTn [21]. Một bệnh nhân bị buồn nôn/nôn, khó thở, rối loạn nhịp tim nhanh, huyết động không ổn định, ngất, hoặc tử vong đột ngột là một bệnh nhân có nguy cơ cao, cũng như bệnh nhân STEMI, được coi là những người có nguy cơ cao cần được chăm sóc y tế khẩn cấp. Cuối cùng, thông số đánh giá nguy cơ tiếp theo là nồng độ troponin trong huyết thanh. Bệnh nhân có nồng độ troponin cao có liên quan đến kết cục tim mạch xấu [4, 15, 21].
| Bảng 5.1 Thang điểm HEART [14] | ||
| Biến số | Điểm | |
| Bệnh sử | Cao | 2 |
| Trung bình | 1 | |
| Thấp | 0 | |
| Điện tâm đồ | ST chênh xuống có ý nghĩa | 2 |
| Thay đổi tái cực không đặc hiệu | 1 | |
| Bình thường | 0 | |
| Tuổi | ≥65 | 2 |
| 45-65 | 1 | |
| ≤45 | 0 | |
| Yếu tố nguy cơ | ≥3 yếu tố hoặc tiền sử bệnh xơ vữa động mạch vành | 2 |
| 1 hoặc 2 yếu tố nguy cơ | 1 | |
| Không yếu tố nguy cơ đã biết | 0 | |
| Troponin | ≥3x giới hạn trên bình thường | 2 |
| 1-3x giới hạn trên bình thường | 1 | |
| ≤giới hạn bình thường | 0 | |
0–3 điểm=nguy cơ thấp, xem xét xuất viện.
4–6 điểm=nguy cơ trung bình, theo dõi và thêm cận lâm sàng.
7–10 điểm=nguy cơ cao, can thiệp khẩn cấp.
Một vài bảng tính về nguy cơ tỷ lệ bệnh tật và tử vong đã được phát triển để cho phép các bác sĩ nhanh chóng phân loại nguy cơ cao và tử vong cao. Phân loại và phân tầng nguy cơ xác định bệnh nhân nào sẽ có lợi ích từ tái tưới máu ngay lập tức hoặc sớm và theo kế hoạch và cần được đánh giá thêm với thăm dò chẩn đoán xâm lấn [1]. Một trong những thang điểm được sử dụng rộng rãi nhất là TIMI (Thrombolysis in Myocardial Infarction) [12] (Bảng 5.2 và 5.3). Nó được sử dụng để phân loại và ước tính nguy cơ tử vong và/hoặc tái nhồi máu trong vòng 30 ngày kể từ khi bắt đầu biến cố cấp trong bối cảnh STEMI hoặc nguy cơ tử vong và tái nhồi máu hoặc nhu cầu tái thông mạch khẩn cấp trong vòng 2 tuần tới ở bệnh nhân NSTEMI/UA [4].
| Bảng 5.2 Phân tầng nguy cơ TIMI của ACS không ST chênh lên [4, 12, 22] | |
| Biến số | Điểm |
| Tuổi >65 (tuổi) | 1 |
| ≥3 yếu tố nguy cơ bệnh động mạch vành: Tăng huyết áp, tăng cholesterol máu, đái tháo đường, tiền sử gia đình bệnh mạch vành, hoặc hút thuốc lá. | 1 |
| Bệnh mạch vành đã biết (hẹp ≥50%). | 1 |
| Dùng aspirin (trong 7 ngày gần đây). | 1 |
| Đau thắt ngực nặng (≥2 cơn trong 24 giờ). | 1 |
| ECG ST thay đổi động học (≥0.5 mm). | 1 |
| Dương tính dấu ấn sinh học của tim (troponin). | 1 |
Tỷ lệ tử vong trong 2 tuần, tái nhồi máu, nguy cơ tái thông mạch máu. Nếu điểm 0–1 = 4.7%, 2 = 8.3%, 3 = 13.2%, 4 = 19.9%, 5 = 26.2%, 6–7 = 40.9%.
| Bảng 5.3 Phân tầng nguy cơ TIMI của STEMI [4, 12, 22] | |
| Biến số | Điểm |
| Tuổi | |
| <65 | 0 |
| 65-74 | 2 |
| ≥75 | 3 |
| Đái tháo đường, tăng huyết áp, đau thắt ngực | 1 |
| Huyết áp tâm thu <100 mmHg | 3 |
| Nhịp tim> 100 lần/phút | 2 |
| Killip II–IV | 2 |
| Cân nặng <67 kg | 1 |
| ST chênh lên thành trước hoặc LBBB (nếu có) | 1 |
| Thời gian để điều trị >4 giờ | 1 |
Nguy cơ tử vong 30 ngày. Nếu điểm 0 = 0.8%, 1 = 1.6%, 2 = 2.2%, 3 = 4.4%, 4 = 7.3%, 5= 12%, 6 = 16%, 7 = 23%, 8 = 27%, ≥9 = 36%.
Một hệ thống tính điểm khác được sử dụng rộng rãi là thang điểm nguy cơ GRACE (Global Registry of Acute Coronary Events), dùng để dự đoán nguy cơ tử vong nội viện và 6 tháng (Bảng 5.4, 5.5 và 5.6). Điểm GRACE có khả năng phân biệt tốt trong tất cả các nhóm nguy cơ, đặc biệt là ở những bệnh nhân có nguy cơ thấp. Hệ thống tính điểm này xem xét các biến số như tuổi tác, tần số tim, huyết áp tâm thu, mức creatinine, phân loại Killip và Kimball, ngừng tim khi nhập viện, thay đổi ST, và dấu ấn sinh học tim bất thường [21, 24].
Trong những năm gần đây, sự phát triển của lưu đồ GRACE 2.0 đã giải quyết được một hạn chế lớn của điểm GRACE ban đầu là mức creatinine nền và phân loại Killip và Kimball (Bảng 5.7). Điểm số này được đơn giản hóa về tổng thể tốt hơn so với phân loại trước đó về tiên đoán tỷ lệ tử vong sau khi xuất viện sau 1- 3 năm trong số tất cả các ACS (STEMI và NSTEMI/UA) [25]. GRACE 2.0 vẫn chưa được chấp nhận phổ biến vì chưa được xác nhận trong nhiều nhóm quần thể bệnh nhân khác nhau và thang điểm cũng không cho thấy hiệu quả tốt về tiên đoán tỷ lệ tử vong trong bệnh viện [25].
| Bảng 5.4 Điểm số nguy cơ GRACE [24] | |||||||
| Tuổi | Điểm | Tần số tim (lần/phút) | Điểm | Huyết áp tâm thu (mmHg) | Điểm | Creatinin máu(mg/dL) | Điểm |
| <30 | 0 | <50 | 0 | ≥200 | 0 | 0–0.39 | 1 |
| 30–39 | 8 | 50-69 | 3 | 160–199 | 10 | 0.40–0.79 | 4 |
| 40–49 | 25 | 70-89 | 9 | 140–159 | 24 | 0.8–1.19 | 7 |
| 50–59 | 41 | 90-109 | 15 | 120–139 | 34 | 1.20–1.59 | 10 |
| 60–69 | 58 | 110-149 | 24 | 100–119 | 43 | 1.6–1.99 | 13 |
| 70–79 | 75 | 150-199 | 38 | 80–99 | 53 | 2.0–3.99 | 21 |
| 80–89 | 91 | ≥200 | 46 | <80 | 58 | ≥4 | 28 |
| ≥90 | 100 | ||||||
| Phân loại Killip và Kimball của suy tim sung huyết trước đó/hiện tại | Điểm | ||||||
| Không suy tim mạn | 0 | ||||||
| Ran, S3, và/hoặc tĩnh mạch cảnh nổi | 20 | ||||||
| Phù phổi cấp | 39 | ||||||
| Choáng tim | 59 | ||||||
| Bất thường men tim | 14 | ||||||
| ST thay đổi | 28 | ||||||
| Ngừng tim lúc nhập viện | 39 | ||||||
| Bảng 5.5 Diễn giải điểm GRACE cho NSTEMI/UA [24] | ||||
| Nguy cơ | Tỷ lệ tử vong trong bệnh viện | Tỷ lệ tử vong trong 6 tháng | ||
| Điểm | Tỷ lệ tử vong | Điểm | Tỷ lệ tử vong | |
| Thấp | <109 | <1% | <89 | <3 % |
| Trung bình | 109–140 | 1–3% | 89–118 | 3 –8% |
| Cao | >140 | >3% | >118 | >8 % |
NSTEMI=nhồi máu cơ tim ST không chênh lên, UA=đau thắt ngực không ổn định.
Trong bối cảnh của STEMI, một hệ thống tính điểm lâm sàng đơn giản, như phân loại Killip và Kimball, có thể được sử dụng. Bệnh nhân được phân loại dựa trên sự thăm khám lâm sàng cho thấy suy tim và rối loạn chức năng tâm thất. Bốn loại chính được mô tả từ một nhồi máu cơ tim không biến chứng cho đến choáng tim. Với mỗi loại, có sự gia tăng đáng kể về nguy cơ tử vong ngắn hạn [26-28].
| Bảng 5.6 Diễn giải điểm GRACE cho STEMI [24] | ||||
| Nguy cơ | Tỷ lệ tử vong trong bệnh viện | Tỷ lệ tử vong trong 6 tháng | ||
| Điểm | Tỷ lệ tử vong | Điểm | Tỷ lệ tử vong | |
| Thấp | <126 | <2% | <100 | <4,5 % |
| Trung bình | 126–154 | 2–5% | 100–127 | 4,5 – 11% |
| Cao | >154 | >5% | >127 | >11 % |
STEMI=nhồi máu cơ tim ST chênh lên.
| Bảng 5.7 Phân loại Killip và Kimball [26–28] | ||
| Loại | Định nghĩa | Tỷ lệ tử vong 30 ngày |
| I | Không biến chứng nhồi máu | 2.1 %–6% |
| II | Suy tim trung bình: ran phổi ở đáy, gallop S3, nhịp tim nhanh. |
6.8 %–17% |
| III | Suy tim nặng với phù phổi cấp. | 14.4 %–38% |
| IV | Choáng tim | 45.9 %–81% |
Xem xét nguy cơ khác
Trong những năm gần đây, dân số nữ đã có được sự quan tâm đặc biệt về tỷ lệ mắc ACS và tỷ lệ tử vong liên quan đến ACS, do tỷ lệ mắc bệnh tim thiếu máu cục bộ có triệu chứng không điển hình cao hơn. Xu hướng gần đây cho thấy phụ nữ ngoài 50 tuổi thì có nguy cơ mắc bệnh mạch vành đặc biệt cao hơn vì họ thường mắc các bệnh kèm theo như đái tháo đường, béo phì, bệnh thận mãn, tăng huyết áp, hút thuốc, và trầm cảm. Ngay cả những phụ nữ có các yếu tố nguy cơ giống như nam giới vẫn dễ bị ACS hơn, ví dụ, phụ nữ mắc bệnh đái tháo đường có nguy cơ bị ACS cao gấp 1.5 lần so với đàn ông mắc bệnh đái tháo đường, cũng như phụ nữ bị trầm cảm có nguy cơ phát triển MI cao gấp đôi so với đàn ông bị trầm cảm [29, 30]. Bên cạnh đó, có một số yếu tố nguy cơ cụ thể của phụ nữ được xác định làm tăng nguy cơ tim mạch như mãn kinh, tiền sử tiền sản giật hoặc đái tháo đường thai kỳ và sử dụng thuốc tránh thai đường uống [29].
Trong số tất cả các bệnh nhân, phụ nữ cao tuổi nhập khoa cấp cứu do NSTEMI mà không đau ngực có tỷ lệ tử vong cao nhất [8]. Có lẽ điều này là do sự thiếu nhận thức cửa người dân và cộng đồng y khoa. Ngay cả khi bệnh nhân bị đau ngực, các bác sĩ ở khoa cấp cứu có xu hướng ít nghi ngờ về ACS khi bệnh nhân là nữ so với khi bệnh nhân là nam. Những chậm trễ chẩn đoán chuyển thành tỷ lệ tử vong cao hơn và tỷ lệ mắc bệnh dài hạn cao hơn ở nữ giới [29].
Cũng giống như dân số nữ, người già và bệnh nhân đái tháo đường có nguy cơ cao tim mạch; trong những người này, đau ngực là biểu hiện phổ biến nhất của ACS; cả hai nhóm cũng có tỷ lệ đau ngực thấp hơn nam giới trưởng thành. Khoảng 40-60% dân số lão khoa có biểu hiện đau ngực điển hình, trong khi ở những bệnh nhân trẻ tuổi, đau thắt ngực điển hình hiện diện lên tới 80-85% [7-9]. Giải thích có thể là họ đã giảm nhận thức đau, có lẽ do biến chứng thần kinh của đái tháo đường, rối loạn chức năng thần kinh tự chủ, hoặc sa sút trí tuệ [8]. Nói chung, triệu chứng không điển hình thường gặp ở bệnh nhân đái tháo đường, phụ nữ, và bệnh nhân cao tuổi [7, 9, 10, 17, 20, 29-31].
Biểu hiện này đặc biệt đáng lo ngại vì NSTEMI không đau ngực có nguy cơ tử vong cao gấp năm đến sáu lần so với MI có đau ngực [8].Nhìn chung, NSTEMI thường gặp ở phụ nữ hơn nam giới và ở bệnh nhân lớn tuổi hơn 75 tuổi [8, 31, 32]. Chẩn đoán kịp thời và phân tầng nguy cơ ACS đầy đủ có thể chỉ ra những bệnh nhân được hưởng lợi ích từ chiến lược tái tưới máu tích cực bất kể tuổi tác của họ. Ngay cả trong dân số lão khoa, những bệnh nhân cao tuổi còn khỏe được chẩn đoán MI hoặc UA sẽ được lợi ích từ tái tưới máu xâm lấn, thay vì điều trị nội khoa đơn thuần [9, 33-39].
Một điểm tương đồng khác giữa phụ nữ, người già, và bệnh nhân đái tháo đường là tỷ lệ mắc bệnh đồng mắc cao hơn, có ảnh hưởng đến tỷ lệ mắc ACS. Khoảng 1/3 của tất cả ACS xảy ra trong dân số cao tuổi, và gần 60% số ca tử vong do ACS xảy ra ở những người cao tuổi [9, 32, 40].
Biểu hiện lâm sàng
Bệnh nhân bị ACS có thể có các triệu chứng thiếu máu cục bộ điển hình bao gồm sự kết hợp khác nhau của đau ngực, chi trên, hàm, hoặc đau vùng thượng vị và khó chịu khi gắng sức hoặc khi nghỉ ngơi. Đau ngực thường dữ dội và có xu hướng lan lên ra cánh tay, cổ và hàm, và cơn đau thường kéo dài ít nhất 20 phút. Đau có thể liên quan đến triệu chứng học của nhồi máu cơ tim khác như yếu, buồn nôn, và khó thở. Hãy nhớ lại rằng các bệnh nhân đặc biệt như nữ giới, đái tháo đường, và người già có tỷ lệ mắc ACS mà biểu hiện không điển hình cao hơn [1, 4].
Khám thực thể trong ACS có xu hướng bình thường trừ khi có suy tim hoặc biến chứng cơ học [20]. Bệnh nhân có thể có một số đặc điểm lâm sàng làm tăng xác suất mắc ACS (Bảng 5.8).
Chẩn đoán phân biệt
Triệu chứng chủ yếu của ACS là đau ngực và bệnh nhân sẽ biểu hiện bằng nhiều cách khác nhau: đè nặng, như dao đâm, bóp nghẹt, râm ran, và nhiều triệu chứng khác. Tim tiếp xúc mật thiết với các cấu trúc khác bên trong lồng ngực và có cùng sự phân bố dây thần kinh với các cơ quan khác nên có thể đau ngực và triệu chứng học tương tự, tựa như ACS. Phản xạ đau tạng hoặc đau được chuyển đến các vị trí giải phẫu khác lồng ngực có thể làm cho chẩn đoán ACS là thử thách phức tạp. Nhiều tình trạng có thể giống với bệnh tim cấp (Bảng 5.9).
| Bảng 5.8 Đặc điểm lâm sàng tăng nguy cơ ACS theo tỷ số khả dĩ [6, 41] | |
| Tỷ số khả dĩ | |
| Đặc điểm cơn đau điển hình | |
| Đau lan lên cả cánh tay | 2.6-4.3 × |
| Đau giống thiếu máu cục bộ trước đó | 2.2 × |
| Có cơn đau ngực xảy ra trong 24 giờ trước đây | 2.0 × |
| Đau ngực như đè nặng | 1.9 × |
| Đau tăng khi gắng sức | 1.8 × |
| Đau lan lên cổ | 1.5 × |
| Triệu chứng thực thể thường gặp | |
| Tụt huyết áp (huyết áp tâm thu <100 mmHg) | 3.9 × |
| Ran phổi | 2.0 × |
| Nhịp thở nhanh | 1.9 × |
| Thay đổi trên điện tâm đồ | |
| ST chênh lên | 15.7 × |
| ST chênh xuống | 5.3-11.7 × |
| ST thay đổi động | 3.6 × |
| Sóng T âm | 1.8-3.6 × |
| Bảng 5.9 Chẩn đoán phân biệt ACS [4, 12] | ||
| Tim mạch | Cơn tăng huyết áp cấp cứu | Thuyên tắc phổi |
| Viêm cơ tim | Bóc tách động mạch chủ | |
| Viêm màng ngoài tim | Suy tim cấp (không do MI) | |
| Hô hấp | Viêm màng phổi | Tràn khí màng phổi |
| Viêm phổi | Viêm phế quản | |
| Tiêu hóa | Trào ngược dạ dày thực quản | Viêm thực quản |
| Co thắt thực quản | Viêm tụy cấp | |
| Loét dạ dày/loét đường tiêu hóa | ||
| Cơ xương khớp | Viêm sụn sườn | |
| Chấn thương ngực trước đó | ||
| Chấn thương cơ | ||
| Thần kinh/ Tâm thần | Bệnh rễ thần kinh | Trầm cảm |
| Herpes Zoster | Lo âu | |
| Khác | Thiếu máu | |
| Nhiễm độc giáp | ||
Tiếp cận chẩn đoán đa phương thức
Điện tâm đồ
Bệnh nhân đến phòng cấp cứu than đau ngực phải có điện tâm đồ trong vòng dưới 10 phút [4]. ST chênh lên thấy trên ECG là dấu hiệu đặc trưng của STEMI. Tuy nhiên, chỉ có 1/3 trong số tất cả các ACS là STEMI, các bệnh nhân còn lại có thể có nhiều thay đổi về điện tâm đồ, một số gợi ý về thiếu máu cục bộ, nhưng nhiều người khác thậm chí sẽ có ECG bình thường trong suốt thời gian nằm viện. Giống như dấu ấn sinh học tim, ECG đơn độc thường không đủ để chẩn đoán nhồi máu cơ tim (MI) cấp, và việc lặp lại nhiều lần làm tăng độ nhạy và độ đặc hiệu của ECG. Những thay đổi điện tâm đồ như sự thay đổi của ST có thể xuất hiện trong các bệnh lý khác, chẳng hạn như phì đại thất trái, block nhánh trái, hoặc viêm màng ngoài tim cấp [42, 43]. Trong ACS, chẩn đoán kịp thời là rất cần thiết, vì mỗi phút trôi qua, tổn thương cơ tim tăng lên, bằng chứng là những thay đổi động trong ECG tương quan với kết quả mô học (Bảng 5.10).
Để thiết lập chẩn đoán STEMI, các thay đổi ST phải có ít nhất hai chuyển đạo liên tiếp và ST chênh lên cần ít nhất là ≥0.25 mV ở nam giới <40 tuổi, ≥0.2 mV ở nam giới 40 ≥tuổi, ≥0.15 mV ở phụ nữ trong các chuyển đạo V2-V3, hoặc ≥0.1 mV ở bất kỳ chuyển đạo khác, miễn là những thay đổi này không xảy ra trong bối cảnh block nhánh trái (LBBB) [13, 15]. Một số hình ảnh điện tim khác của STEMI cấp là sự hiện diện của sóng T cao và đối xứng, còn được gọi là sóng T cao tối cấp [44]. Ở những bệnh nhân không có đặt máy tạo nhịp hoặc không có LBBB và với triệu chứng nghi ngờ thiếu máu cục bộ thì ECG có độ nhạy chẩn đoán khoảng 75% với độ đặc hiệu 85% trong chẩn đoán STEMI [44]. Các hình dưới đây mô tả mối tương quan giữa thay đổi điện tâm đồ và kết quả chụp động mạch vành (Hình 5.2, 5.3, 5.4, 5.5, 5.6, 5.7, 5.8 và 5.9).
Tiêu chuẩn Sgarbossa hiệu chỉnh được phát triển để cải thiện độ chính xác của chẩn đoán ở bệnh nhân STEMI kèm LBBB. Một quy tắc sửa đổi mô tả rằng cần có ST chênh lên với biên độ >25% độ sâu của sóng S đi trước có thể chẩn đoán dương tính STEMI [15, 44]. Tiêu chuẩn Sgarbossa hiệu chỉnh như sau [44, 46]:
- ≥ Một chuyển đạo có ST chênh lên ≥1 mm và QRS đồng hướng dương.
- ≥ Một chuyển đạo từ V1-V3 có ST chênh xuống ≥1mm và QRS đồng hướng âm.
- ≥ Bất kì một chuyển đạo nào có ST chênh lên ≥1 mm và ST chênh lên ngược hướng QRS lệch quá mức tương ứng, được xác định bằng ≥25% độ sâu của sóng S trước đó.
| Bảng 5.10 Diễn tiến của ECG trong nhồi máu cơ tim [45] | ||
| Thời gian | Dấu hiệu ECG | Dấu hiệu mô học |
| Phút | Sóng T tối cấp (sóng T cao) | Tổn thương do thiếu máu cục bộ có thể hồi phục. |
| ST chênh lên | ||
| Giờ | ST chênh lên, với sóng T âm ở đoạn cuối | Cơ tim bắt đầu hoại tử |
| Sóng T âm (có thể kéo dài vài ngày đến vài tháng) |
||
| Ngày | Sóng Q bệnh lý | Hình thành sẹo |
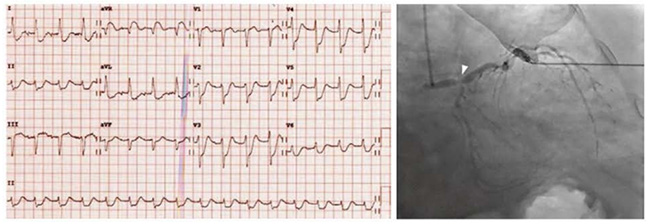
Hình 5.2 ECG với ST chênh xuống đáng kể ở các chuyển đạo bên và trước tim và ST chênh lên ở aVR. Chụp động mạch vành tương ứng mô tả là tổn thương tắc nghẽn chổ chia đôi (1,1,1 mũi tên) ở đoạn xa của thân chung động mạch vành trái kéo dài đến đoạn gần của nhánh gian thất trước và nhánh động mạch mũ.
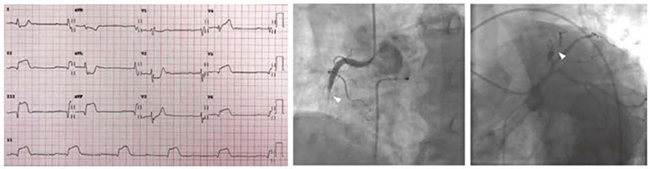
Hình 5.3 ECG với block AV III với nhịp thoát bộ nối và ST chênh lên trong các chuyển đạo thành dưới và V5-V6. Bệnh nhân chụp mạch vành cho thấy bệnh lý nhiều mạch máu với tắc 100% đoạn giữa của động mạch vành phải và hẹp nặng nhánh chéo thứ hai (mũi tên).
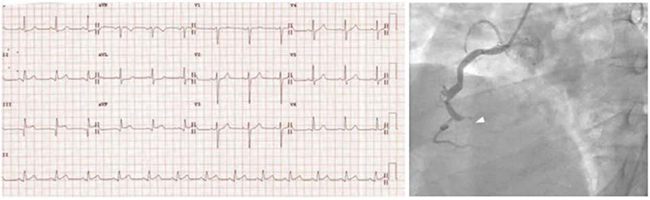
Hình 5.4 ECG với ST chênh lên ở thành dưới (DII, DIII, aVF) tương ứng với tắc hoàn toàn đoạn xa của động mạch vành phải (mũi tên).
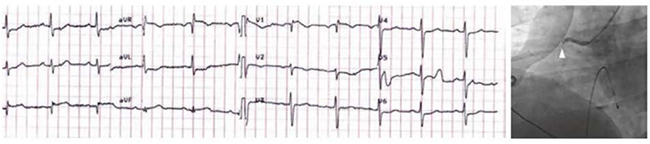
Hình 5.5 ECG cho thấy ST chênh lên thành dưới (DII, DIII) do tắc động mạch vành phải đoạn gần.
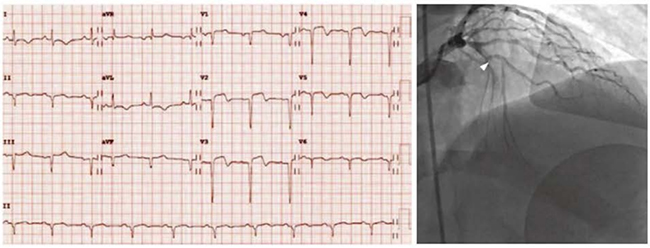
Hình 5.6 ECG với STEM thành trước. ST chênh lên được tìm thấy ở V2, V3 và mở rộng đến V4. Chụp mạch vành cho thấy tắc hoàn toàn của động mạch liên thất trước (mũi tên), ngay bên cạnh động mạch chéo thứ hai.
Bệnh nhân có nguy cơ cao với block nhánh phải (RBBB) và triệu chứng thiếu máu cục bộ kéo dài nên được xem xét cho chiến lược tái thông mạch sớm vì RBBB trong bệnh cảnh MI được xem là dấu hiệu của khả năng sống còn thấp.
Đặt máy tạo nhịp làm thay đổi tái cực trên ECG, đặt ra một thách thức đáng chú ý, làm phức tạp việc giải thích ECG thích hợp do thay đổi đoạn ST.
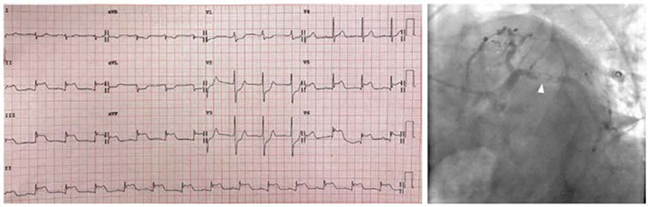
Hình 5.7 ECG với ST chênh lên ở thành dưới cũng như ST chênh lên ở V5-V6. Chụp động mạch vành thấy tắc nghẽn đoạn gần của động mạch mũ.
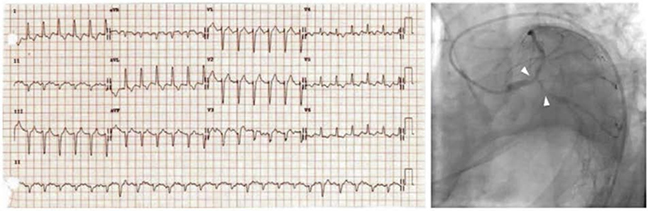
Hình 5.8 ECG với cuồng nhĩ và LBBB mới khởi phát được gây ra bởi một tổn thương chổ chia đôi 1,1,1 nằm ở thân chung động mạch vành trái và kéo dài đến đoạn gần của động mạch liên thất trước và động mạch mũ (mũi tên).
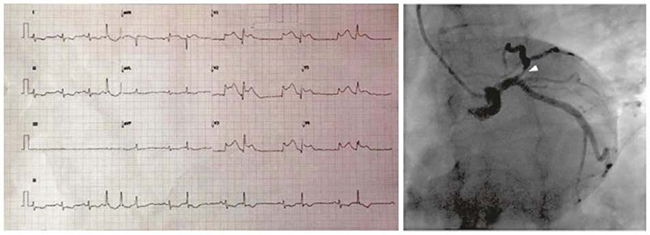
Hình 5.9 ECG với DII kéo dài cho thấy một vài ngoại tâm thu (NTT) trên thất, sau đó là ngoại tâm thu thất nhịp đôi. Nhịp cơ bản và NTT thất nhịp đôi cho thấy ST chênh lên ở tất cả các chuyển đạo trước tim và aVR. Chụp mạch vành tương ứng cho thấy hẹp nặng ở đoạn gần của nhánh liên thất trước của động mạch vành trái.
Bệnh nhân có đặt máy tạo nhịp có thể cần xét nghiệm troponin nối tiếp để loại trừ hoặc xác nhận một cách an toàn ACS tiềm tàng. Ở những bệnh nhân không ổn định kèm rối loạn nhịp nên nghĩ tới lâm sàng cao ACS, hình ảnh mạch vành khẩn cấp hoặc chụp mạch vành giúp xác định chẩn đoán và điều trị ban đầu [47].
X-quang ngực
Giá trị của X-quang ngực ở bệnh nhân được xác định là nguy cơ thấp bằng các triệu chứng cơ năng và khám thực thể vẫn chưa được xác định rõ. Vài báo cáo chỉ rằng chỉ có khoảng 12% X-quang ngực (CXR) trong ER được yêu cầu do đau ngực sẽ cung cấp thông tin chẩn đoán liên quan đến ACS [48] (Bảng 5.11). Đôi khi, nếu bệnh nhân có dấu hiệu và triệu chứng của ACS và suy tim, CXR có thể giúp chúng ta loại trừ các dấu hiệu tăng áp tĩnh/mao mạch, phù phổi, tràn dịch màng phổi, và các biến chứng khác của MI (Hình 5.10).
| Bảng 5.11 Hình ảnh sung huyết của X-quang ngực: | |
| Độ | Miêu tả |
| 0 | Không sung huyết |
| I | Tái phân bố dòng máu |
| II | Phù mô kẽ |
| III | Phù phế nang khu trú |
| IV | Phù phế nang lan tỏa |
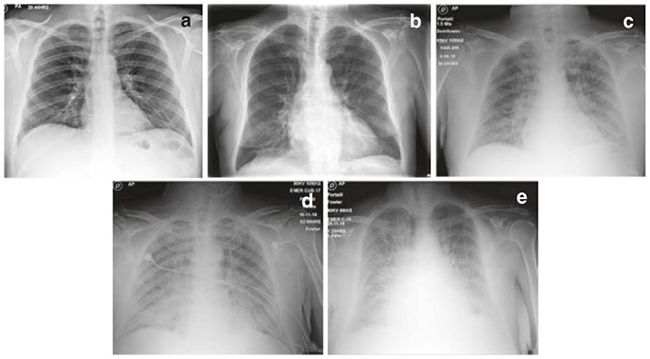
Hình 5.10. Hình a mô tả X-quang ngực với tuần hoàn phổi bình thường. Hình b có rốn tĩnh mạch và tái phân bố tuần hoàn. Hình c có dấu hiệu phù mô kẽ. Hình d có phù phế nang chủ yếu ở phần đáy của phổi phải. Hình e bị phù phế nang hai bên nghiêm trọng.
Đánh giá xét nghiệm
Troponin tim là dấu hiệu sinh hóa của tổn thương và hoại tử cơ tim. Độ tăng của men tim không chỉ ra cơ chế nền của thiếu máu cục bộ hoặc hoại tử và không phân biệt nguyên nhân tổn thương cơ tim là do thiếu máu cục bộ hoặc không do thiếu máu cục bộ. Một số tình trạng lâm sàng có khả năng dẫn đến thiếu máu cục bộ hoặc hoại tử cơ tim và gây tăng men tim, bao gồm thuyên tắc phổi cấp, suy tim, bệnh thận tiến triển, và viêm cơ tim [45, 49].
Ở những bệnh nhân có nghi ngờ cao về ACS nhưng cTn ban đầu âm tính hoặc không chẩn đoán, thì nên làm mẫu thứ hai trong vòng 3-6 giờ. Đối với các xét nghiệm troponin tim độ nhạy cao (HS-cTn), mẫu thứ hai phải được lấy trong vòng 1-3 giờ (xem Hình 5.11) [14, 20]. Các xét nghiệm troponin I và troponin T hiện đại có độ nhạy 80% và độ đặc hiệu 90% [49, 50]. Với mẫu thứ hai, xét nghiệm HS-cTn với lưu đồ khung thời gian ngắn có giá trị tiên đoán âm 99.7% để loại trừ nhồi máu cơ tim [50].
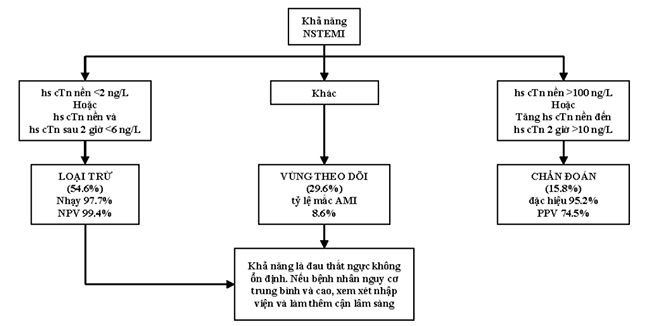
Hình 5.11 Lưu đồ loại trừ nhồi máu cơ tim 2 giờ bằng hs-cTn.
Lưu đồ 1 giờ của HS-cTnT thể hiện độ nhạy tốt khoảng 88- 98% và độ đặc hiệu 86-99% để loại trừ MI [5, 17].
Lưu đồ 1 giờ của HS-cTnI cũng có hiệu quả tốt loại trừ MI, với độ nhạy dao động khoảng 98.4% và độ đặc hiệu 99.8% [5, 38].
Các dấu ấn sinh học khác đóng vai trò quan trọng trong tiên lượng bệnh nhân bị ACS, chẳng hạn natriuretic peptide type B (BNP), protein phản ứng C (CRP), và creatinine và cystatin huyết thanh, là được sử dụng phổ biến nhất.
BNP có thể là một dấu ấn sinh học hữu ích trong ACS, cung cấp thông tin tiên lượng ngắn và dài hạn. Giải phóng BNP có thể được kích hoạt bởi thiếu máu cục bộ và căng thành cơ tim. Nồng độ cao tương quan tiên lượng xấu [4, 51].
CRP đóng một vai trò trong ACS như một yếu tố chỉ ra tình trạng căng thẳng của viêm nội mô và hình thành cục huyết khối. Độ tăng của nó có thể tương quan với sự gia tăng các biến cố tim mạch lớn và tỷ lệ tử vong [4, 16, 52].
Creatinine huyết thanh và độ lọc cầu thận ước tính (eGFR). eGFR càng thấp có liên quan đến biến chứng tim mạch và tỷ lệ tử vong càng cao [15].
HS-cTn biểu thị ngược lại với eGFR; trong trường hợp này, nồng độ cao hơn có nghĩa là tiên lượng xấu hơn.
Dữ liệu hiện tại ủng hộ sự gia tăng nguy cơ tim mạch liên quan đến tăng nồng độ cystatin [16].
Siêu âm tim
Hiện nay, siêu âm tim là một công cụ hình ảnh quan trọng có khả năng chẩn đoán và phân loại các bệnh nhân đau ngực trong khoa cấp cứu. Siêu âm tim qua thành ngực (TTE) đóng một vai trò quan trọng trong bối cảnh ECG không chẩn đoán được ở bệnh nhân nghi ngờ lâm sàng cao NSTEMI/UA. Việc sử dụng này rất hữu ích vì khảo sát hình ảnh TTE có sẵn trong hầu hết các ER; chúng là dễ di động, tương đối rẻ tiền, nhanh chóng, và dễ sử dụng. TTE là một công cụ không xâm lấn có thể sàng lọc các bất thường về chuyển động thành theo thời gian thực tương thích với rối loạn chức năng tâm trương và tâm thu, là một trong những thay đổi sớm nhất của dòng thác thiếu máu cục bộ. Trong đánh giá đau ngực, độ nhạy của TTE dao động trong khoảng 90-95% và độ đặc hiệu là 90-100% [53-57]. Các phương thức mới như TTE tương phản có khả năng quan sát các bất thường chuyển động thành và tưới máu cơ tim đồng thời [54].
Một ứng dụng chính khác là TTE có khả năng phát hiện một số biến chứng cơ học cấp tính liên quan đến MI. TTE trong ACS có thể đánh giá các chức năng thất trái và thất phải, cũng như chỉ số chuyển động thành, chức năng van, hở hai lá, đứt cơ nhú, nhồi máu cơ tim thất phải (30% của tất cả các MI thành dưới), vỡ cơ tim, và tràn dịch màng ngoài tim và các bệnh khác [53]. Bệnh nhân không có bất thường chuyển động thành trong siêu âm tim có kích thích thì có giá trị tiên đoán âm đối với các biến cố tim mạch >99% [58].
Siêu âm tim kích thích có độ nhạy 85-88% và độ đặc hiệu 80-83% [50, 59, 60], rất vượt trội so với nghiệm pháp gắng sức bằng máy chạy bộ đơn giản, với độ nhạy 62-70% và độ đặc hiệu 52-79% [50, 59, 60].
Chụp cắt lớp vi tính động mạch vành (CTA)
Chụp cắt lớp vi tính động mạch vành là một khảo sát hình ảnh tương đối nhanh chóng và rẻ tiền có thể loại trừ hiệu quả bệnh mạch vành và các nguyên nhân gây đau ngực khác, do đó làm giảm thời gian nằm ER và nhập viện. Khả năng của nó đã được chứng minh trong việc đánh giá nhanh các bệnh nhân bị đau ngực cấp vì nó cung cấp cái nhìn toàn diện về các đặc điểm giải phẫu mạch vành chính yếu liên quan đến bệnh mạch vành tắc nghẽn. Việc lấy hình ảnh diễn ra nhanh chóng, và việc dựng hình trên máy vi tính cho các góc nhìn khác nhau. Một số nhược điểm của CTA là chi phí và sự tiếp xúc của bệnh nhân với tia X và các chất tương phản đường tĩnh mạch. Nhìn chung, CTA có độ nhạy tốt 95-99% và độ đặc hiệu 80-90%, với giá trị tiên đoán âm 99-100%. CT tưới máu có thể tăng độ đặc hiệu của khảo sát lên đến 98% và độ nhạy tương tự [50, 58-62].
Hình ảnh cộng hưởng từ tim (CMR)
Cũng giống như CTA, CMR có phần mềm dựng lại hình ảnh có thể tạo ra các góc nhìn không giới hạn. CMR có thể phân biệt nhồi máu cơ tim cũ và mới và thậm chí phù nề. CMR tưới máu có thuốc giãn mạch có khả năng phát hiện thiếu máu cục bộ do gắng sức. Nhược điểm của nó là nó không phải là một giải pháp thay thế hiệu quả về mặt chi phí, quá trình lấy hình ảnh tốn nhiều thời gian, một số bệnh nhân mắc hội chứng sợ phòng kín khi ở trong máy CMR, thuốc tương phản đường tĩnh mạch và thuốc giãn mạch là cần thiết. Độ nhạy CMR tương phản nằm trong khoảng 87-95% và độ đặc hiệu 85% [58, 62] (Mahler, Scirica). CMR tưới máu có thuốc giãn mạch có độ nhạy 99-100% đối với bệnh mạch vành [58].
Xạ hình tưới máu cơ tim (MPI)
Một trong những điểm mạnh là có giá trị tiên đoán âm gần 100% để loại trừ nhồi máu cơ tim [63]. Với việc sử dụng các chất đánh dấu hạt nhân phóng xạ hiện đại hơn, độ nhạy của nó để phát hiện MI là 90-100%, nhưng độ đặc hiệu là khoảng 67-90% [50, 59, 63]. Nhược điểm khác của y học hạt nhân là chi phí và độ phân giải không gian giới hạn của nó (khoảng 3 mm), và mặc dù nó không tốn thời gian như cộng hưởng từ tim, nhưng bệnh nhân vẫn cần thời gian quét khoảng 15-60 phút. Những hạn chế khác ảnh hưởng đến cường độ tín hiệu và có thể giải thích sai như tương hợp tưới máu-chuyển hóa âm tính giả là khi bệnh nhân to lớn có quá nhiều mô mỡ ở ngực, đặc biệt là phụ nữ. Các mô mỡ quá nhiều làm suy giảm cường độ hạt nhân phóng xạ gây ra việc giải thích sai này. Một nhóm bệnh nhân khác cũng bị nhầm lẫn này là những bệnh nhân mắc bệnh nhiều mạch máu. Trong nhóm này, sự phân bố các chất đánh dấu hạt nhân phóng xạ có thể không tạo ra đủ chênh lệch cường độ tín hiệu ở các vùng cơ tim, và khảo sát có thể bị diễn giải nhầm là bình thường trong khi có lẽ bệnh nhân bị thiếu máu cục bộ toàn bộ tim.
Chụp động mạch vành
Chụp động mạch vành được coi là tiêu chuẩn vàng để chẩn đoán bệnh động mạch vành, có độ nhạy 86-95% với độ đặc hiệu 89-100% [50, 59].
Điều trị
Điều trị ACS ban đầu
Điều cần thiết là đánh giá bệnh nhân nghi ngờ ACS ngay lập tức để ngăn ngừa các biến chứng có thể gây tử vong và bệnh tim mạch mãn tính đồng mắc. Mỗi bệnh nhân ở ER phàn nàn về đau ngực phải được phân tầng nguy cơ sớm dựa trên tiền sử, khám thực thể, ECG, và đo dấu ấn sinh học tim, điểm HEART, TIMI, và GRACE (Hình 5.12). Phân tầng nguy cơ sớm có thể giúp xác định liệu bệnh nhân nên được quản lý bằng chiến lược xâm lấn sớm hay chiến lược bảo tồn ban đầu và có thể giúp xác định các liệu pháp dược lý được khuyến cáo [15, 64].
Việc quản lý ban đầu của ACS nên bao gồm việc nhập bệnh nhân vào đơn vị chăm sóc mạch vành hoặc một khu vực được thiết kế đặc biệt, trong đó bệnh nhân có thể được theo dõi huyết động liên tục. Theo dõi nhịp tim và dấu hiệu sinh tồn liên tục nên được thực hiện. Huyết động không ổn định nên được xử trí theo các protocol hỗ trợ sự sống-tim chuyên sâu, mặc dù đa số bệnh nhân được xem là ổn định huyết động; do đó các biện pháp hỗ trợ nên được đặt ra [1, 4, 20, 65].
Nếu một bệnh nhân được cho là quá lo lắng, thuốc an thần nhẹ hoặc một benzodiazepine có thể giúp ích rất nhiều nếu không bị chống chỉ định [4]. Việc sử dụng oxy nói chung không được khuyến cáo bởi các hướng dẫn thực hành lâm sàng hiện tại trừ khi bệnh nhân giảm độ bảo hòa O2 dưới 90% [4]. Nếu không bị chống chỉ định bởi loại ACS (nhồi máu thất phải) hoặc không ổn định huyết động (huyết áp thấp hoặc nhịp cực chậm), đau nên điều trị bằng cách sử dụng nitrate (ngậm dưới lưỡi, tiêm tĩnh mạch, uống), và sử dụng thuốc chẹn beta sớm là phù hợp với bằng chứng hiện tại trong trường hợp đau thắt ngực kháng trị hoặc bệnh nhân ổn định huyết động với MI [1, 4, 20, 65]. Đau ngực thường là cường độ cao, và để giảm triệu chứng thường cần thuốc giảm đau opioid.
Ngay khi chẩn đoán STEMI/NSTEMI/UA được thiết lập, bệnh nhân phải được bắt đầu điều trị kháng kết tập tiểu cầu. Liều tải ban đầu của aspirin không có bao tan trong ruột phải nằm trong khoảng từ 325 đến 500 mg. Ở những bệnh nhân STEMI, việc sử dụng thuốc chống kết tập tiểu cầu thứ hai (chất ức chế P2Y12) có thể được trì hoãn cho đến khi biết được giải phẫu động mạch vành (Bảng 5.12). Một chiến lược kháng đông phải được sử dụng cho đến khi động mạch thủ phạm được tái tưới máu (Bảng 5.13). Nếu không đạt được tái tưới máu hoặc chiến lược quản lý bảo tồn đã được chọn, nên sử dụng thuốc kháng đông máu trong tối đa 7 ngày. Sử dụng ACEI/ARB có thể có ích ở những bệnh nhân bị MI thành trước hoặc rối loạn chức năng tâm thất [1, 4, 20, 65].
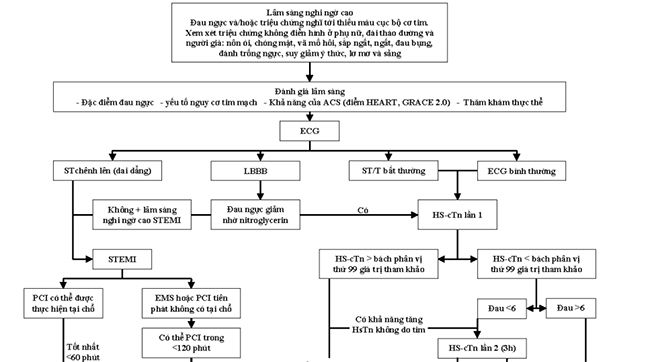
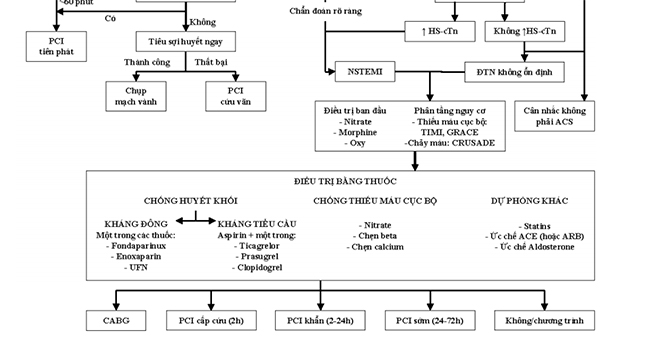
Hình 5.12 Lưu đồ chẩn đoán và điều trị ACS.
Khuyến cáo điều trị kháng kết tập tiểu cầu cho người cao tuổi [34, 66, 67]:
- Prasugrel ở người cao tuổi 5 mg thay vì 10 mg.
- Ticagrelor an toàn ở người cao tuổi. Không tăng nguy cơ chảy máu.
- Clopidogrel được ưu tiên ở bệnh nhân cao tuổi cần dùng thuốc kháng đông đồng thời.
| Bảng 5.12 Các loại ức chế P2Y12 đường uống thường dùng | |||
| Clopidogrel | Prasugrel | Ticagrelor | |
| Liều tải | PCI: 60 mg | PCI: 60 mg | PCI: 180 mg |
| Tiêu sợi huyết: 300 mg | Tiêu sợi huyết: Không khuyến cáo | Tiêu sợi huyết: Không khuyến cáo | |
| Liều tải ở người ≥75 tuổi | PCI: 300–600 mg | PCI: 60 mg, sử dụng không có lợi | PCI: 180 mg |
| Tiêu sợi huyết: Không khuyến cáo liều tải | Tiêu sợi huyết: Không khuyến cáo liều tải | Tiêu sợi huyết: Không khuyến cáo liều tải | |
| Liều duy trì | 75 mg /ngày | 10 mg/ngày | 90 mg x 2 lần/ngày |
| Liều duy trì ở người ≥75 tuổi | Không chỉnh liều | 5 mg/ngày | Không chỉnh liều |
| Liều cho CKD | Thận trọng khi eGFR <15 mL/phút/1.73 m2 | Không dùng khi eGFR <15 mL/phút/1.73 m2 | Không dùng khi eGFR <15 mL/phút/1.73 m2 |
| Liều cho bệnh gan | Thận trọng | Tránh dùng khi suy gan nặng | Tránh dùng khi suy gan nặng |
| Thời gian | 3–10 ngày | 7–10 ngày | 3 –5 ngày |
PCI=can thiệp mạch vành qua da; CKD=bệnh thận mạn; eGFR=độ lọc cầu thận ước tính.
| Bảng 5.13 Kháng đông đường tĩnh mạch và tiêm dưới da | ||||
| UFH | Enoxaparin | Fondaparinux | Bivalirudin | |
| Liều tải | PCI: 70–100 IU/kg TM Chụp mạch vành: 60–70 IU/kg TM Max: 5000 IU | PCI: 30 mg TM | N/A | PCI: 0.75 mg/kg TM |
| Liều tải ở người ≥75 tuổi | Không chỉnh liều | Không bolus tĩnh mạch | Không chỉnh liều | Không chỉnh liều |
| Liều duy trì | 12–15 IU/kg/giờ Max: 1000 IU/giờ | 1 mg/kg x2 TDD/ngày | 2.5 mg TDD/ngày | 1.75 mg/kg/giờ TM |
| Liều duy trì ở người ≥75 tuổi | Không chỉnh liều | 0.75 mg/kg x2 TDD/ngày | eGFR 20–50 mL/phút/1.73m2 Dùng 1.5 mg TDD/ngày | eGFR 30–59 mL/phút/1.73m2 Dùng 1.4 mg/kg/giờ Tránh dùng nếu eGFR <30 mL/phút/1.73m2 |
| Liều cho bệnh thận mạn | Không chỉnh liều | eGFR 15–30 mL/phút/1.73m2 Dùng 1 mg/kg TDD/ngày eGFR <15 mL/phút/1.73m2 tránh dùng | Tránh dùng nếu eGFR <20 mL/phút/1.73 m2 | eGFR 15–30 mL/phút/1.73m2 Dùng 1 mg/kg/giờ TM Tránh dùng khi eGFR <15 mL/phút/1.73m2 |
| Liều cho bệnh gan | Dùng cẩn thận theo dõi aPTT 50-70 giây | N/A | N/A | Không chỉnh liều |
| Thời gian | 60–90 phút | 12 giờ | 17–21 giờ | 1 giờ |
| Bảng 5.14 Thời điểm can thiệp tái tưới máu xâm lấn | ||
| Loại | Khung thời gian | Chỉ định |
| Ngay lập tức | <1–2 giờ | STEMI |
| MI có biến chứng (huyết động không ổn định, cơ học, triệu chứng dai dẳng, rối loạn nhịp nặng nguy cơ tử vong) | ||
| Sớm | <24 giờ | NSTEMI |
| STEMI (sau điều trị xâm lấn bằng thuốc) | ||
| Xâm lấn |
<72 giờ | NSTEMI nguy cơ trung bình (đây là khung thời gian tối đa cho PCI) |
| Chọn lọc | NA | Đau thắt ngực không ổn định |
| Đau thắt ngực ổn định | ||
| Bệnh nhân đau ngực tái phát | ||
Tái thông động mạch vành
Can thiệp mạch vành qua da (PCI) được ưa thích hơn so với tiêu sợi huyết [15].
Không phụ thuộc vào chiến lược tái tưới máu đã chọn, thời gian tối đa cho tái tưới máu động mạch thủ phạm không được vượt quá 90 phút [1, 4, 15, 20, 65] (Bảng 5.14). Tùy thuộc vào chẩn đoán và nguy cơ của từng bệnh nhân, thời điểm PCI có thể được phân thành bốn loại: ngay lập tức, xâm lấn sớm, xâm lấn, và chọn lọc.
Chỉ định mạnh mẽ của việc sử dụng chiến lược tái tưới máu tiên phát là ở những bệnh nhân STEMI khởi phát các triệu chứng thiếu máu cục bộ <12 giờ. Nếu không thể thực hiện PCI tiên phát trong khung thời gian 12 giờ, các bác sĩ lâm sàng nên áp dụng chiến lược tái tưới máu xâm lấn bằng thuốc (Bảng 5.15). Việc tái tưới máu xâm lấn bằng thuốc thành công phải được theo sau bởi một PCI sớm (6-24 giờ) [15]. Trong trường hợp tiêu sợi huyết thất bại, bệnh nhân nên thực hiện PCI cứu vãn càng sớm càng tốt [15]. Bệnh nhân NSTEMI hoặc nghi ngờ cao về MI có suy tim cấp, rối loạn nhịp đe dọa tính mạng, không ổn định huyết động, đau ngực kháng trị (đau thắt ngực), và các biến chứng cơ học liên quan đến MI cũng phải được tái tưới máu PCI [15].
| Bảng 5.15 Liều tiêu sợi huyết | |
| Thuốc | Liều |
| Tenecteplase | 30 mg cho cân nặng <60 kg |
| 35 mg cho cân nặng 60–69 kg | |
| 40 mg cho cân nặng 70–79 kg | |
| 45 mg cho cân nặng 80–89 kg | |
| 50 mg cho cân nặng >90 kg | |
| Reteplase | 10 U bolus TM 2 lần cách nhau 30 phút |
| Alteplase | Bolus 15 mg, truyền 0.75 mg/kg trong 30 phút (tối đa 50 mg), sau đó 0.5 mg/kg (tối đa 35 mg) trong 60 phút tiếp theo. |
| Tổng liều không quá 100mg. | |
a Tenecteplase giảm nửa liều có thể được sử dụng ở bệnh nhân cao tuổi (chưa được khuyến cáo trong hướng dẫn thực hành lâm sàng).
Nếu cần thiết, bệnh nhân cao tuổi vẫn được lợi ích từ tưới máu PCI tiên phát, và ở những người còn khỏe manh, được chọn lọc, còn khỏe, và ít nguy cơ chảy máu, thì tiêu sợi huyết có kết quả tốt [68]. Ở tất cả các type ACS, chiến lược xâm lấn có liên quan đến tỷ lệ tử vong thấp hơn trong dân số lão khoa [34, 39].
Các thử nghiệm gần đây đã làm sáng tỏ tầm quan trọng của việc dùng nửa liều tiêu sợi huyết Tenecteplase ở bệnh nhân cao tuổi bị STEMI. Các hướng dẫn thực hành hiện tại không hỗ trợ việc sử dụng phương pháp trị liệu này, nhưng kết quả sơ bộ cho thấy kết cục về hiệu quả tương tự và giảm các biến chứng xuất huyết [67-69].
Những điểm chính
NSTEMI thường gặp ở nữ hơn nam giới và bệnh nhân trên 75 tuổi [8, 31, 32].
Đau ngực là triệu chứng thường gặp nhất ở tất cả các bệnh nhân ACS [7, 8].
Triệu chứng không điển hình thường gặp ở những người mắc bệnh tiểu đường, phụ nữ, và bệnh nhân cao tuổi [7, 9, 10, 17, 20, 29-31].
Khoảng 40-60% dân số lão khoa có biểu hiện đau ngực điển hình; ở những bệnh nhân trẻ tuổi, đau thắt ngực điển hình lên đến 80-85% [7 -9].
Khám thực thể trong ACS có xu hướng bình thường trừ khi có suy tim hoặc biến chứng cơ học [20].
Trong ACS, bằng chứng hiện tại cho thấy bệnh nhân cao tuổi và khỏe mạnh được hưởng lợi từ chiến lược tái tưới máu, xâm lấn, thay vì chỉ điều trị nội khoa [9, 33-39].
Trong STEMI, bệnh nhân cao tuổi và khỏe mạnh được hưởng lợi từ các chiến lược tái tưới máu tích cực [9, 33].
Khoảng 1/3 của tất cả ACS xảy ra trong dân số cao tuổi [9, 32].
Khoảng 60% các trường hợp tử vong do ACS xảy ra ở người cao tuổi [40].
Các thử nghiệm gần đây đã làm sáng tỏ tầm quan trọng của việc dùng nửa liều tiêu sợi huyết Tenecteplase ở bệnh nhân cao tuổi STEMI. Các hướng dẫn thực hành hiện tại không hỗ trợ việc sử dụng phương pháp trị liệu này, nhưng kết quả sơ bộ cho thấy kết cục về hiệu quả tương tự và giảm biến chứng xuất huyết [67 -69].
Ở những bệnh nhân nghi ngờ cao về ACS nhưng với cTn ban đầu âm tính hoặc không chẩn đoán, nên lấy mẫu thứ hai trong vòng 3-6 giờ. Đối với các xét nghiệm HS-cTn, mẫu thứ hai phải được lấy trong vòng 1-3 giờ [14, 20].
Tài liệu tham khảo
1. Anderson JL, Morrow DA. Acute Myocardial Infarction. Campion EW, editor. N Engl J Med. 2017;376:2053–64.
2. Timmis A. Acute coronary syndromes. BMJ. 2015;351:1–13.
3. Alonso J, Bueno H, Bardají A, Garcia-Moll J, Badia X, Layola M, et al. Influence of Sex on Acute Coronary Syndrome Mortality and Treatment in Spain. Rev Esp Cardiol. 2008;8:8 D–22D.
4. Roffi M, Patrono C, Collet J-P, Mueller C, Valgimigli M, Andreotti F, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016;37:267–315.
5. Body R. Acute coronary syndromes diagnosis, version 2.0: Tomorrow’s approach to diagnosing acute coronary syndromes? Turk J Emerg Med. 2018;18:94–9.
6. Fanaroff A, Rymer J, Goldstein S, Simel D, Newby LK. Does this patient with chest pain have acute coronary syndrome? The Rational Clinical Examination Systematic Review. JAMA. 2015;314:1955–65.
7. Araujo C, Laszcznska O, Viana M, Melao F, Henriques A, Borges A. Sex differences in presenting symptoms of acute coronary syndrome: the EPIHeart cohort study. BMJ Open. 2018;8:e018798:1–13.
8. Chien D-K, Huang M-Y, Chien-Hsuan H, Shih S-C, Chang W-H. Do elderly females have a higher risk of acute myocardial infarction? Taiwan J Obstet Gynecol. 2016;55:563–7
9. Engberding N, Wenger NK. Acute coronary syndromes in the elderly. F1000 Faculty Rev. 2017;6:1791–8.
10. Grap MJ. Clinical Pearls. Am J Crit Care. 2012;21:84.
11. Tsao CW, Vasan R. Cohort Profile: The Framingham Heart Study (FHS): overview of milestones in cardiovascular epidemiology. Int J Epidemiol. 2015;44:1800–13.
12. Amsterdam EA, Wenger NK, Brindis RG, Casey DE, Ganiats TG, Holmes DR, et al. 2014 AHA/ACC guideline for the management of patients with non–ST-elevation acute coronary syndromes. J Am Coll Cardiol. 2014;64:e139–228.
13. Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, et al. Fourth universal definition of myocardial infarction. Eur Heart J. 2018;00:1–33.
14. Levy PD, McCord J. Emergency medicine and cardiologist perspective. Impact of high sensitivity troponin on the evaluation and treatment of patients with acute coronary syndrome. 2017. http://www.emcreg.org. Accessed 27 Nov 2018.
15. Ibanez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2018;39:119–77.
16. del Val Martin D, Sanmartin Fernandez M, Zamorano JL. Biomarkers in acute coronary syndrome. IJC Metabolic & Endocrine. 2015;8:20–3.
17. Vasile V, Jaffe A. High-sensitivity cardiac troponin for the diagnosis of patients with acute coronary syndromes. Curr Cardiol Rep. 2017;19:1–10.
18. Libby P. Mechanisms of acute coronary syndromes and their implications for therapy. N Engl J Med. 2013;368:2004–13.
19. Vazquez-Garza E, Jerjes-Sanchez C, Navarrete A, Joya-Harrison J, Rodriguez D. Venous thromboembolism: thrombosis, inflammation, and immunothrombosis for clinicians. J Thromb Thrombolysis. 2017;44:377–85.
20. Markel D, Kim J. Identifying emergency department patients with chest pain who are at low risk for acute coronary syndromes. Emerg Med Pract. 2017;19:1–2.
21. Elbarouni B, Goodman SG, Yan R, Welsh RC, Kornder JM, DeYoung P. Validation of the Global Registry of Acute Coronary Event (GRACE) risk score for in-hospital mortality in patients with acute coronary syndrome in Canada. Am Heart J. 2009;158:392–9.
22. Sakamoto JT, Liu N, Koh ZX, Fung NXJ, Heldeweg MLA, Ng JCJ, et al. Comparing HEART, TIMI, and GRACE scores for prediction of 30-day major adverse cardiac events in high acuity chest pain patients in the emergency department. Int J Cardiol. 2016;221:759– 64.
23. Abu-Assi E, Ferreira-Gonzalez I, Ribera A, Marsal J, Cascant P. Do GRACE (Global Registry of Acute Coronary events) risk scores still maintain their performance for predicting mortality in the era of contemporary management of acute coronary syndromes? Am Heart J. 2010;160:826–34.
24. Fox KAA, Dabbous O, Goldberg R, Pieper K, Eagle K, Van de Werf F, et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ. 2006;333:1091–4.
25. Huang W, Fitzgerald G, Goldberg R, Gore J, McManus R, Awad H, et al. Performance of the GRACE risk score 2.0 simplified algorithm for predicting 1-year death after hospitalization for an acute coronary syndrome in a contemporary multiracial cohort. Am J Cardiol. 2016; 118(8):1–6
26. Kurita T, Kumagai N, Hoshino K, Seko T, Koji T, Makino K, et al. Prognostic importance of Killip classification in modern pharmaco-invasive treatment era for the patients with acute myocardial infarction (Report from Mie ACS Registry). JACC. 2014;63(Supplement 2): TCTAP A -011
27. Khot UN, Jia G, Moliterno D, Lincoff M, Khot M, Harrington R, et al. Prognostic importance of physical examination for heart failure in non–ST-elevation acute coronary syndromes. JAMA. 2003;290:2174–81.
28. Gallindo de Mello B, Bernardes F, Oliveira G, Ramos RF, Baptista C Lopez B, Bitarães S, Barros C, de Oliveira Carvalho E. Validation of the Killip–Kimball classification and late mortality after acute myocardial infarction. Arq Bras Cardiol. 2014;103:107–17.
29. Pagidipati N, Peterson ED. Acute coronary syndromes in women and men. Nat Rev Cardiol. 2016;13:471–80.
30. Devon H, Ryan C, Ochs A, Shapiro M. Symptoms across the continuum of acute coronary syndromes: differences between women and men. AJCC. 2008;17:14–26.
31. Thompson P, McQuillan B. Acute coronary syndromes in women different presentation and poorer outcomes. Medicine Today. 2016 May;17:16–20.
32. Kass N, Helmy T, Patel A, Lerakis S. Evidence-based management of coronary artery disease in the elderly – current perspectives. Medscape General Medicina. 2005;7:75.
33. Montilla Padilla I, Martin-Asenjo R, Bueno H. Management of acute coronary syndromes in geriatric patients. Heart Lung Circ. 2017;26:107–13.
34. Gimbel ME, Ten Berg JM. Management of elderly patients with a non-ST-segment- elevation acute coronary syndrome. Neth Heart J. 2017;25:409–15.
35. Faubert C, Heckman G, McKelvie R. Management of non-ST-elevation myocardial infarction in elderly patients: time to consider frailty and quality of life. Can J Cardiol. 2018;34:241–3.
36. Tegn N, Abdelnoor M, Aaberge L, Endersen K, Smith P. Invasive versus conservative strategy in patients aged 80 years or older with non-ST-elevation myocardial infarction or unstable angina pectoris (After Eighty study): an open-label randomised controlled trial. Lancet. 2016;15:1–9.
37. Staehli BE, Wischnewsky MB, Jakob P, Kingeberg R, Obeid S, Heg D, et al. Gender-related outcomes in elderly (>75 years) patients presenting with acute coronary syndromes: results from the swiss acute coronary syndrome cohort. JACC. 2017;69(11 Supplement):1271
38. Garg P, Morris P, Fazlanie AL, Vijayan S, Dancso B. Cardiac biomarkers of acute coronary syndrome: from history to high-sensitivity cardiac troponin. Intern Emerg Med. mortality in the era of contemporary management of acute coronary syndromes? Am Heart J. 2010;160:826–34. 2017;12:147–55.
39. Toleva O, Ibrahim Q, Brass N, Sookram S, Welsh RC. Treatment choices in elderly patients with ST: elevation myocardial infarction—insights from the Vital Heart Response registry. Open Heart. 2015;2(1):e000235–7.
40. Husted S, James S, Becker R, Horrow J, Katus HA, Storey RF, et al. Ticagrelor versus Clopidogrel in elderly patients with acute coronary syndromes. Circ Cardiovasc Qual Outcomes. 2012;5:680–8.
41. Mokhtari A, Dryver E, Söderholm M, Ekelund U. Diagnostic values of chest pain history, ECG, troponin and clinical gestalt in patients with chest pain and potential acute coronary syndrome assessed in the emergency department. Springerplus. 2015;4(1):219–7.
42. Birnbaum Y, Wilson JM, Fiol M, de Luna AB, Eskola M, Nikus K. ECG diagnosis and classification of acute coronary syndromes: ECG classification in ACS. Ann Noninvasive Electrocardiol. 2014;19:4–14.
43. Gurm HS. The ECG in acute coronary syndromes: new tricks from an old dog. Heart. 2005;91:851–3.
44. Smith S. Updates on the electrocardiogram in acute coronary syndromes. Curr Emerg Hosp Med Rep. 2013;1:43–52.
45. Shah ASV, Anand A, Strachan FE, Ferry AV, Lee KK, Chapman AR, et al. High-sensitivity troponin in the evaluation of patients with suspected acute coronary syndrome: a stepped-wedge, cluster-randomised controlled trial. Lancet. 2018;392:919–28.
46. Meyers HP, Limkakeng AT, Jaffa EJ, Patel A, Theiling BJ, Rezaie SR, et al. Validation of the modified Sgarbossa criteria for acute coronary occlusion in the setting of left bundle branch block: a retrospective case-control study. Am Heart J. 2015;170:1255–64.
47. Freitas P, Santos MB, Faria M, Rodrigues G, Vale N, Teles RC, et al. ECG evaluation in patients with pacemaker and suspected acute coronary syndrome: which score should we apply? J Electrocardiol. 2016;49:744–8.
48. Goldschlager R, Roth H, Solomon J, Robson S, Green J, Green S, et al. Validation of a clinical decision rule: chest X-ray in patients with chest pain and possible acute coronary syndrome. Emerg Radiol. 2014;21:367–72.
49. Keller T, Zeller T, Peetz D, Tzikas S, Roth A, Czyz E, et al. Sensitive troponin I assay in early diagnosis of acute myocardial infarction. NEJM. 2009;361:868–77.
50. Barstow C, RIce M, McDivitt J. Acute coronary syndrome: diagnostic evaluation. Am Fam Physician. 2017;95:170–7.
51. Filippatos G, Farmakis D, Parissis J. Novel biomarkers in acute coronary syndromes. JACC. 2014;63:1654–6.
52. Filippatos G, Zannad F. An introduction to acute heart failure syndromes: definition and classification. Heart Fail Rev. 2007;12:87–90.
53. Aziz E, Herzog E. Echocardiography during angina pectoris and acute myocardial infarction in the emergency room. In: Echocardiography in acute coronary syndrome diagnosis, treatment and prevention. New York: Springer; 2009. p. 249–59.
54. Lancellotti P, Price S, Edvardsen T, Cosyns B, Neskovic AN, Dulgheru R, et al. The use of echocardiography in acute cardiovascular care: recommendations of the European Association of Cardiovascular Imaging and the Acute Cardiovascular Care Association. Eur Heart J. 2014; 4(1):1–28.
55. Sladojevic M, Sladojevic S, Culibrk D, Tadic S, Jung R. Echocardiographic parameters as predictors of in-hospital mortality in patients with acute coronary syndrome undergoing percutaneous coronary intervention. Sci World J. 2014;2014:1–10. 56. Singh Panjrath G, Herzog E, Chaudhry F. Introduction: Acute Coronary Syndrome and Echocardiography. In: Echocardiography in acute coronary syndrome diagnosis, treatment and prevention. London: Springer; 2009. 57. Bergmann I, Büttner BM, Teut E, Jacobshagen C, Hinz J, Quintel M. Pre-hospital transthoracic echocardiography for early identification of non-ST-elevation myocardial infarction in patients with acute coronary syndrome. Crit Care. 2018;22(1):29–6. 58. Mahler S, Miller CD. Diagnostic imaging to exclude acute coronary syndrome. Curr Emerg Hosp Med Rep. 2013;1:37–42. 59. Amsterdam EA, Kirk D, Bluemke D, Diercks DB, Farkouh M. Testing of low-risk patients presenting to the emergency department with chest pain. Circulation. 2010;122:1756– 76. 60. Yin X, Wang J, Zheng W, Ma J, Hao P, Chen Y. Diagnostic performance of coronary computed tomography angiography versus exercise electrocardiography for coronary artery disease: a systematic review and meta-analysis. J Thorac Dis. 2016;8:1688–96. 61. Goyal N, Stillman A. Coronary CT angiography in acute chest pain. F1000 Faculty Rev. 2017;6:1–7. 62. Scirica B. Acute coronary syndrome emerging tools for diagnosis and risk assessment. JACC. 2010;55:1403–15. 63. Lang O. Radionuclide imaging in acute coronary syndromes. Cor Vasa. 2014;56:e354– 61. 64. McCarthy CP, Vaduganathan M, McCarthy KJ, Januzzi JL, Bhatt DL, McEvoy JW. Left ventricular thrombus after acute myocardial infarction: screening, prevention, and treatment. JAMA Cardiol. 2018;3:642. 65. Jneid H, Addison D, Bhatt DL, Fonarow GC, Gokak S, Grady K, et al. 2017 AHA/ACC clinical performance and quality measures for adults with ST-elevation and non–ST-elevation myocardial infarction. JACC. 2017;10(10):1–43. 66. Leonardi S, Bueno H, Ahrens I, Hassager C, Bonnefoy E, Lettino M. Optimised care of elderly patients with acute coronary syndrome. Eur Heart J. 2018;7:287–95. 67. Andreotti F, Rocca B, Husted S, Ajjan R, Ten Berg J. Antithrombotic therapy in the elderly: expert position paper of the European Society of Cardiology Working Group on Thrombosis. Eur Heart J. 2015;36:3238–49. 68. Shavadia J, Bainey K, Tyrrell B, Brass N, Paterson C, Knapp D. Half-dose tenecteplase compared to conventional ST- Segment Myocardial Infarction (STEMI) reperfusion strategies in the elderly: an observational analysis. Can J Cardiol. 2015;31:S20–1. 69. Armstrong PW, ZHeng Y, Westerhout C, Rossell-Ortiz F, Sinnaeve P, Lambert Y. Reduced dose tenecteplase and outcomes in elderly ST-segment elevation myocardial infarction patients: insights from the STrategic reperfusion early after myocardial infarction trial. Am Heart J. 2015;169(6):1–10.





