Giới thiệu chung
Lịch sử ra đời
Năm 1955, một loại kháng sinh đã được phân lập từ một chủng xạ khuẩn Streptomyces trên đảo Reunion bởi các nhân viên nghiên cứu của Rhone-Poulenc tại Paris, đó là Azomycin – một loại thuốc hoạt động chống lại Trichomonas. Trước đó 2 năm, chất này cũng đã được phân lập tại Nhật Bản bởi Maeda và các cộng sự. Chất này sau đó được xác định cấu trúc hóa học là 2-nitroimidazole. Sau đó, các chất hóa học với cấu trúc tương tự đã được tổng hợp, trong đó có 5-nitroimidazole. 5-nitroimidazole cho thấy tác dụng chống động vật nguyên sinh tốt hơn so với các hợp chất tự nhiên. Trong số 150 chất có cấu trúc liên quan, hợp chất có nhóm thế β-hydroxyethyl ở vị trí số 1 cho thấy sự cân bằng giữa tác dụng và độc tính tốt nhất, chất này chính là Metronidazole – kháng sinh nhóm 5-nitroimidazole đầu tiên, với biệt dược nổi tiếng nhất là Flagyl.
Cho đến cuối thập kỷ đó, Metronidazole là thuốc đầu tiên sử dụng theo đường toàn thân có hiệu quả trên Trichomonas vaginalis and T. foetus. Trong thời gian tiếp theo, Giardia lamblia và Entamoeba histolytica (amip) cũng đã được chứng minh là nhạy cảm với Metronidazole. Metronidazole có khả năng điều trị cả amip trong ruột cũng như ngoài ruột. Không lâu sau đó, các nhà khoa học lại phát hiện thêm được rằng Metronidazole có tác dụng trên cả các vi khuẩn kỵ khí, và thừa nhận lợi ích của nó trong ngăn ngừa nhiễm trùng sau phẫu thuật do vi khuẩn kỵ khí nhạy cảm, đặc biệt là phẫu thuật phụ khoa, cắt ruột thừa và phẫu thuật đại tràng.
Sau này, các nhà khoa học tiếp tục tìm kiếm các hợp chất tương tự với mong muốn tìm ra một loại kháng sinh mới có hiệu lực cao hơn, dung nạp tốt hơn và ít tác dụng phụ hơn. Tuy vậy, việc cải thiện cấu trúc hóa học của Metronidazole là không hề dễ dàng. Chất tiếp theo ra đời có hoạt tính chống Trichomonas lại không phải là kháng sinh nhóm 5-nitroimidazole, mà lại là Nifuratel (Magmilor), một kháng sinh nhóm Nitrofuran, thuốc này được tìm ra bởi người Italia và được tiếp thị ở Anh từ năm 1960.
Kháng sinh nhóm 5-nitroimidazole thứ hai được tìm ra là Nimorazole (Naxogin), có tên gọi khác trước đây là Nitrimidazine. Thuốc này được tìm ra bởi các nhân viên khoa học của Carlo Erba, Italia và được giới thiệu năm 1970 ở Anh. Đến giữa năm 1977 thì vẫn chưa có kháng sinh nào khác cùng nhóm được phê duyệt trên lâm sàng ở Anh. Tuy nhiên, đã có hai loại khác được sử dụng ở châu Âu, đó là Tinidazole (Fasigyn, Pfizer) và Ornidazole (Tiberal, Hoffmann-La Roche). Tiếp theo sau đó là sự ra đời của ba loại thuốc cùng nhóm được quan tâm, đó là Secnidazole, Carnidazole và Ro 07-0582 (nhóm 2-nitroimidazole) hay còn gọi là Misonidazole.
Hiện tại trên thị trường Hoa Kỳ, chỉ có Metronidazole, Tinidazole và Secnidazole là được cấp phép lưu hành. Metronidazole mặc dù là thuốc ra đời đầu tiên trong nhóm này, nhưng lại là thuốc được sử dụng nhiều nhất trong nhóm.
Cấu trúc hóa học
Các kháng sinh nhóm này có cấu trúc hóa học đặc trưng gồm một nhân thơm imidazole, nhóm thế nitro (-NO2) ở vị trí số 5 và nhóm thế alkyl ở vị trí số 1.
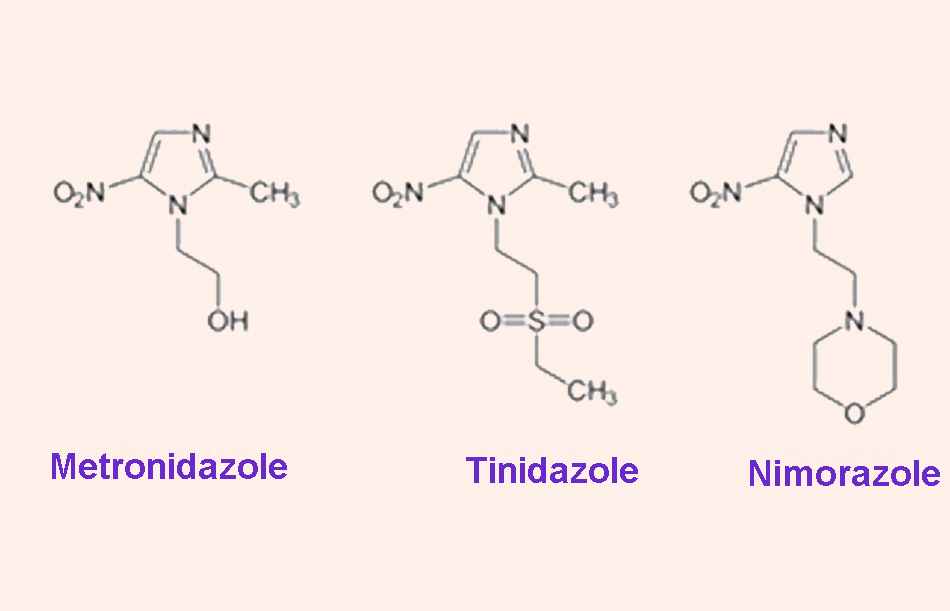
Dược lý học
Dược lực học
Cơ chế tác dụng
Các kháng sinh nhóm 5-nitroimidazole đều có tác dụng diệt khuẩn rất tốt. Và để làm được điều này, nhóm nitro (-NO2) ở vị trí số 5 của kháng sinh phải bị khử. Về bản chất, sản phẩm khử sẽ tồn tại trong một thời gian ngắn, hấu hết dưới dạng anion gốc nitro một electron được proton hóa, oxy hóa DNA, làm đứt gãy nhiễm sắc thể và gây chết tế bào.
Để có thể được khử hóa thành dạng hoạt động, phân tử kháng sinh phải vào được bên trong tế bào. Do đó, các kháng sinh nhóm 5-nitroimidazole thực chất chỉ là tiền thuốc (prodrug) không hoạt động. Phân tử kháng sinh đi qua màng tế bào vi khuẩn nhờ khuếch tán thụ động. Trong tế bào, nó bị khử thành dạng hoạt động, làm cho nồng độ kháng nội bào giảm và liên tục tạo ra chênh lệch gradient nồng độ kháng sinh giữa hai bên màng tế bào. Kết quả là quá trình khử phân tử kháng sinh nội bào lại tạo điều kiện cho các phân tử kháng sinh ngoại bào tiếp tục khuếch tán vào bên trong tế bào. Tốc độ và mức độ khử nhóm nitro phụ thuộc vào số lượng electron tham gia vào quá trình và thế oxy hóa – khử của thuốc. Với một hợp chất nitro thơm điển hình, về lý thuyết, sáu electron sẽ tham gia vào quá trình khử hoàn toàn nhóm nitro thành nhóm amine hoặc amino (-NH2). Quá trình khử nhóm nitro thành amine hoặc amino phải đi qua các hợp chất trung gian nitroso (-NO, cần hai electron) và hydroxylamino (-NH-OH, cần bốn electron).
Tuy nhiên, trên thực tế, quá trình khử các 5-nitroimidazole trong tế bào thành 5-aminoimidazole không xảy ra. Lý do là bởi năng lượng cần thiết để khử nhóm hydroxylamine về amine là quá lớn với tế bào, và quá trình khử dẫn đến một anion gốc nitro mang một electron, chất này nhanh chóng bị phân hủy tạo thành ion nitrite (NO2-) và gốc imidazole. Điều này làm cản trở các phản ứng khử phía sau. Hiệu suất tạo ra nhóm nitrite ở Tinidazole là 23%, ở Metronidazole và Ornidazole là 30%. Nói tóm lại, quá trình khử nhóm nitro của kháng sinh 5-nitroimidazole trong tế bào vi khuẩn cần ít hơn bốn electron.
Do quá trình chuyển hóa các kháng sinh nhóm 5-nitroimidazole thành dạng hoạt động cần dựa vào chuyển hóa kỵ khí của vi khuẩn, nên các kháng sinh nhóm này chỉ có tác dụng trên các vi khuẩn kỵ khí mà không có tác dụng trên các vi khuẩn hiếu khí. Nói cụ thể hơn, thế khử ở các vi khuẩn kỵ khí thấp hơn so với các vi khuẩn hiếu khí. Sự khử nhóm nitro ở các vi sinh vật kỵ khí điển hình là nhờ có phức hợp pyruvate – ferredoxin oxidoreductase (trước đây nó được gọi là phản ứng “phosphoroclastic”). Phân tử kháng sinh là chất nhận electron, chất cho electron là ferredoxin (dạng khử). Electron này sau đó sẽ được đưa vào các ion hydrogen để tạo thành khí H2 trong phản ứng hydrogenase. Ở các vi sinh vật kỵ khí không điển hình, bất kỳ phản ứng oxy hóa – khử nào có thế khử thấp hơn, hay âm hơn so với 5-nitroimidazole, đều sẽ ưu tiên đưa electron của nó vào phân tử kháng sinh. Hầu hết các vi sinh vật kỵ khí có thế khử của phản ứng oxy hóa – khử nằm trong khoảng -460 đến -430 mV, trong khi con số này với 5-nitroimidazole là -415 mV. Trong khi đó, ở các vi sinh vật hiếu khí, con số này lại cao hơn nhiều, kể cả các phản ứng có thế khử thấp nhất cũng lên đến -320 mV (cặp NAD+/NADH) và -324 mV (cặp NADP+/NADPH), tức là cao hơn nhiều 5-nitroimidazole. Do đó, trong tế bào vi sinh vật hiếu khí, nhóm nitro của kháng sinh không bị khử và không tạo ra dẫn chất hoạt động. Kể cả cho dù vì một lý do nào đó, dẫn chất khử của kháng sinh có được tạo ra đi chăng nữa, nó cũng sẽ nhanh chóng bị trung hòa bởi oxygen (O2), bởi khả năng nhận electron của O2 là cực kỳ tốt. Các nhà khoa học gọi con đường này là “chu trình vô ích”.
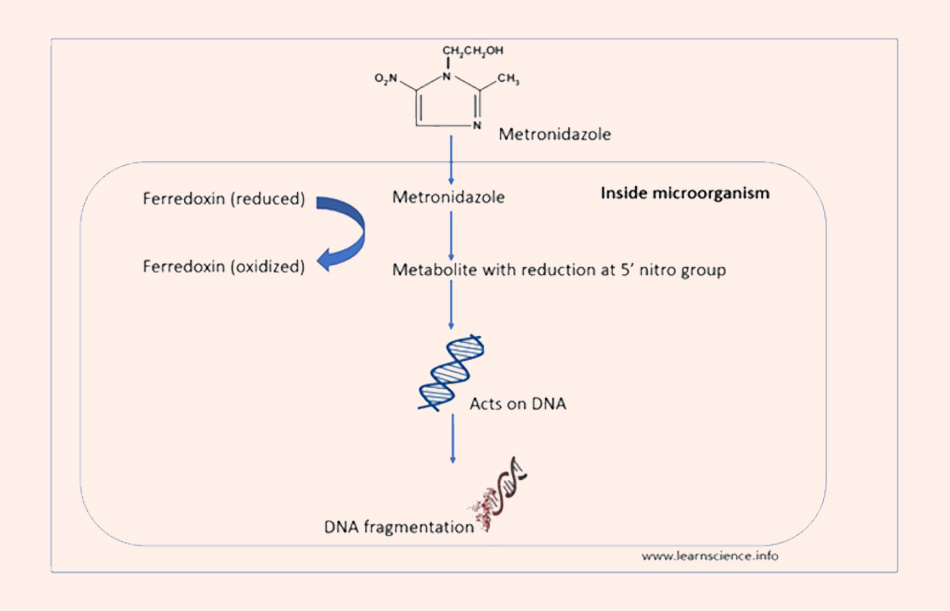
Mô tả ngắn gọn cơ chế tiêu diệt vi sinh vật kỵ khí điển hình của kháng sinh nhóm 5-nitroimidazole. Sau khi vào trong tế bào, nhóm nitro của phân tử kháng sinh bị khử hóa nhờ tác dụng của ferredoxin. Các sản phẩm khử hóa này có độc tính cao với tế bào, độc với vật chất di truyền, làm tổn thương DNA, đồng thời cũng làm tổn thương nhiều protein nội bào khác (thông qua phản ứng với nhóm thiol (-SH)). Kết quả là làm cho vi sinh vật chết.
Tuy vậy, cũng phải kể đến các trường hợp đặc biệt, đó là Helicobacter pylori. Đây là vi khuẩn gây ra viêm loét dạ dày – tá tràng cực kỳ phổ biến. Nó sống trong lòng dạ dày người và tồn tại được trong môi trường có pH acid của dạ dày là nhờ enzyme urease. Urease chịu trách nhiệm thủy phân urea thành khí carbonic (CO2) và amonia (NH3). Chính điều này làm xung quanh vi khuẩn tồn tại một vi môi trường có pH trung tính hoặc hơi kiềm, giúp bảo vệ vi khuẩn trước tác động của acid dịch vị.
Vi khuẩn H. pylori cần một môi trường chứa khoảng 5% O2 để tồn tại. Điều này khiến cho kháng sinh đi vào “chu trình vô ích”. Do đó, cơ chế tác dụng của kháng sinh trên H. pylori là khác biệt so với các vi khuẩn kỵ khí khác. Cơ chế được suy đoán ở đây là “chu trình vô ích” tạo ra nhiều superoxide. Superoxide không hoạt động và cũng không quá độc với tế bào, tuy nhiên, chúng vẫn bị coi là độc bởi tất cả tế bào, ngoại trừ vi khuẩn kỵ khí tuyệt đối, sở hữu enzyme superoxide dismutase có tác dụng “bất hoạt” chúng. Superoxide có thể tham gia nhiều phản ứng, nhưng phổ biến nhất là phản ứng “dismutation”. Phản ứng này được thực hiện nhờ superoxide dismutase, tạo ra hydrogen peroxide (H2O2) và O2.
H2O2 bị phá hủy bởi enzyme catalase, tạo ra nước (H2O) và O2. Nếu trong quá trình phản ứng có mặt một kim loại chuyển tiếp, thường là sắt (Fe) hoặc đồng (Cu), kim loại đó có thể bị khử và gốc hydroxy (OH•) hình thành. Đây được gọi là phản ứng Haber-Weiss.
Gốc hydroxy này gây tổn thương cho vi sinh vật. Tác dụng tiêu diệt vi khuẩn H. pylori có thể là do sự hình thành và tích tụ gốc hydroxy đó, dẫn đến làm tổn thương DNA. Khi đó, vi khuẩn không có khả năng khắc phục tác dụng này bằng các cơ chế thông thường. Tất nhiên, cơ chế này hoàn toàn là suy đoán.
Vi khuẩn đặc biệt thứ hai cần nói tới ở đây là Gardnerella vaginalis. Có bằng chứng cho thấy ở vi khuẩn này, tác dụng của Metronidazole ngoài cơ chế thông thường ra, còn có một cơ chế khác thông qua chất chuyển hóa oxy hóa của nó là dẫn chất 2-methoxy. Các nhà khoa học cũng đã tìm thấy tác dụng tương tự với Niridazole.
Phổ tác dụng
Các kháng sinh nhóm này có phổ tác dụng trên vi khuẩn kỵ khí và một số vi sinh vật đơn bào, cụ thể:
- Vi khuẩn kỵ khí: Bacteroides spp., Clostridium spp., H. pylori…
- Động vật nguyên sinh: E. histolytica, Giardia, Trichomonas…
Nhóm kháng sinh này không có tác dụng trên vi khuẩn hiếu khí.
Cơ chế đề kháng
Các cơ chế được đề kháng đã được phát hiện với Metronidazole (thuốc được nghiên cứu nhiều nhất trong nhóm) bao gồm:
- Giảm khuếch tán thuốc qua màng tế bào hoặc tăng cường đẩy thuốc ra khỏi nội bào nhờ bơm tống thuốc.
- Giảm hoạt hóa thuốc hoặc thay đổi mục tiêu sinh học của thuốc.
- Tăng khả năng thu nhận O2 (SOD/catalase/peroxidase).
- Tăng cường hoạt tính của các enzyme sửa chữa DNA.
Sự đề kháng chéo giữa các dẫn chất 5-nitroimidazole đã được ghi nhận.
Bacteroides:
Chủng B. fragilis đầu tiên được phát hiện đề kháng với Metronidazole được tìm thấy trên một bệnh nhân mắc bệnh Crohn được điều trị bằng Metronidazole kéo dài. Tuy nhiên, nhìn chung, sự đề kháng Metronidazole ở nhóm vi khuẩn này là khá hiếm.
Yếu tố di truyền quy định khả năng đề kháng với Metronidazole nằm trên nhiễm sắc thể hoặc plasmid và có thể được truyền từ vi khuẩn này sang vi khuẩn khác thông qua quá trình tiếp hợp. Các yếu tố di truyền cụ thể đã được xác định bao gồm gene nim, mã hóa cho nitroimidazole reductase, enzyme này chịu trách nhiệm cho việc chuyển nitroimidazole thành aminoimidazole, do đó tránh được độc tính của các dẫn chất trung gian nitroso. Có bảy gene nim đã được mô tả (nim A, B, C, D, E, F và G). Gene nim A là phổ biến nhất, tiếp theo ngay sau đó là nim B và nim E. Tuy rằng sự hiện diện của gene nim không phải lúc nào cũng đồng nghĩa với việc kháng Metronidazole, nhưng nếu vi khuẩn Bacteroides mang gene nim phơi nhiễm với Metronidazole kéo dài, sự chọn lọc đề kháng sẽ xảy ra.
Các chủng vi khuẩn kháng thuốc cũng cho thấy sự điều hòa lên lactate dehydrogenase và điều hòa xuống flavodoxin, đồng thời hoạt tính enzyme pyruvate – ferredoxin oxidoreductase cũng giảm xuống.
H. pylori:
Tỷ lệ đề kháng với Metronidazole trên toàn thế giới của H. pylori khá cao. Tỷ lệ này ở Tây Âu là 20-45% và cao hơn ở các nước đang phát triển, người nhập cư và những phụ nữ đã từng sử dụng Metronidazole trong quá khứ do nhiễm trùng vùng sinh dục hoặc nhiễm ký sinh trùng.
Các nghiên cứu cho thấy rằng nếu như bất hoạt gene recA (gene đóng vai trò quan trọng trong sửa chữa và tái tổ hợp DNA) thì vi khuẩn sẽ bị suy giảm khả năng đột biến chống lại các yếu tố bất lợi như tia UV, Ciprofloxacin và Metronidazole. Sự biểu hiện của bản sao gene recA của các chủng H. pylori kháng thuốc ở E. coli làm tăng mức độ kháng thuốc của vi khuẩn. Các chủng H. pylori kháng Metronidazole cũng cho thấy hoạt tính NADH oxidase nội bào thấp hơn đáng kể các chủng nhạy cảm. Cơ chế chính cho đề kháng Metronidazole ở H. pylori là đột biến vô hiệu hóa ở gene rdxA, mã hóa cho NAD(P)H nitroreductase không nhạy cảm với O2. Sau này, một nhóm nghiên cứu khác cũng đã báo cáo vai trò của một gene bổ sung là frxA, mã hóa cho NAD(P)H flavin oxidoreductase. Đột biến gây kết thúc sớm ở protein frxA cũng liên quan đến kháng Metronidazole ở H. pylori. Ngoài ra, bất hoạt gene mã hóa protein giống ferredoxin (fdxB) cùng với các gene frxA và rdxA làm tăng MIC (nồng độ ức chế tối thiểu) của các chủng nhạy cảm với Metronidazole.
Trichomonas:
Báo cáo đầu tiên về sự xuất hiện của chủng T. vaginalis kháng Metronidazole xuất hiện hai năm sau khi Metronidazole được giới thiệu trên lâm sàng. Ở vi sinh vật này, sự hoạt hóa Metronidazole diễn ra trong các bào quan riêng biệt được gọi là hydrogenosome, nó chứa enzyme pyruvate – ferredoxin oxidoreductase và ferredoxin. Pyruvate – ferredoxin oxidoreductase xúc tác cho quá trình decarboxy hóa pyruvate thành acetyl CoA, chuyển electron đến ferredoxin. Metronidazole thay thế cho proton làm chất nhận electron từ ferredoxin. Khi không có Metronidazole, proton sẽ bị khử thành phân tử H2. Sự hoạt hóa Metronidazole thông qua phản ứng khử có xu hướng giảm ở các chủng kháng thuốc so với các chủng nhạy cảm. Nồng độ ferredoxin và mRNA nội bào giảm trong các chủng kháng thuốc trên lâm sàng. Nguyên nhân được cho là giảm phiên mã gene quy định ferredoxin.
Các chủng T. foetus kháng Metronidazole mức độ cao thiếu hoạt tính enzyme pyruvate – ferredoxin oxidoreductase và hydrogenase. Cơ chế phân tử chưa rõ ràng.
Clostridium spp.:
Nhìn chung, các chủng Clostridium thường nhạy cảm nhưng C. rhamnosum có thể có nồng độ ức chế cao hơn. Cũng đã có những báo cáo về các chủng C. difficile đề kháng Metronidazole mức độ cao được phân lập từ ngựa. Tính đến tháng 1/2009, đã có một báo cáo đề kháng được ghi nhận (chủng này có MIC cao và điều trị bằng Metronidazole thất bại) ở chủng C. difficile được phân lập trên một bệnh nhân bị tiêu chảy do C. difficile.
Gen quy định flavodoxin và hydrogenase chịu trách nhiệm cho hệ thống vận chuyển electron và có thể đóng vai trò trong đề kháng với Metronidazole. Bằng chứng hóa sinh cho thấy hydrogenase 1 của C. pasteuranicum đóng vai trò enzyme quan trọng trong quá trình khử Metronidazole thông qua cơ chế liên kết với ferredoxin.
Entamoeba và Giardia:
Các chủng Giardia kháng thuốc được phân lập từ những bệnh nhân đã điều trị thất bại với Metronidazole. Không có đề kháng lâm sàng được báo cáo với Entamoeba, tuy nhiên các chủng đề kháng in vitro đã được quan sát thấy.
Pyruvate – ferredoxin oxidoreductase và ferredoxin tinh khiết đã chứng minh khả năng hoạt hóa Metronidazole in vitro. Ở các chủng đề kháng được phân lập trên lâm sàng, pyruvate – ferredoxin oxidoreductase có thể bị điều hòa xuống tới năm lần. Ferredoxin 1, chất nhận electron tiếp theo trong chuỗi vận chuyển, cũng bị điều hòa xuống tới 7 lần. Tăng cường hoạt động bơm tống thuốc (efflux pump) có thể bảo vệ được ký sinh trùng.
Entamoeba có khả năng tạo ra superoxide dismutase (SOD), catalase và peroxidase để giảm độc tính của O2. Chỉ có duy nhất một 2-oxoacid oxidoreductase, pyruvate – ferredoxin oxidoreductase, đã được tìm thấy trong Entamoeba và nó chủ yếu được liên kết với màng. Các chủng E. histolytica kháng Metronidazole có sự gia tăng rõ rệt hoạt tính superoxide dismutase, trong khi hoạt tính pyruvate – ferredoxin oxidoreductase không thay đổi. Biểu hiện của FE-SOD chứa sắt và peroxiredoxin cũng tăng lên, còn biểu hiện của flavin reductase và ferredoxin 1 thì giảm đi.
Dược động học
- Hấp thu: Sinh khả dụng đường uống nhìn chung cao (Metronidazole: 80%). Thời gian đạt nồng độ đỉnh trong huyết thanh (Tmax) của Metronidazole là 1-2 giờ, Tinidazole là 1.6 giờ và Secnidazole là 4-6 giờ (thức ăn giàu chất béo làm kéo dài Tmax).
- Phân bố: Phân bố rộng vào các mô trong cơ thể. Liên kết với protein huyết tương của Metronidazole là dưới 20%, Tinidazole là 12% và Secnidazole là dưới 5% (nhìn chung rất thấp). Thể tích phân bố của Tinidazole là 50 L và Secnidazole là 42 L.
- Chuyển hóa: Các kháng sinh nhóm này được chuyển hóa chủ yếu ở gan qua CYP3A4 thông qua các phản ứng oxy hóa, hydroxyl hóa và liên hợp. Chỉ có không quá 1% Secnidazole được chuyển thành chất chuyển hóa oxy hóa.
- Thải trừ: Metronidazole có thời gian bán hủy (t1/2) là 8 giờ (với trẻ sơ sinh là 25-75 giờ), bài tiết qua nước tiểu là 77% và phân là 14%. Tinindazole thải trừ chủ yếu qua nước tiểu (20-25% dưới dạng không đổi) và một phần nhỏ qua phân (12%). Secnidazole cũng được thải trừ chủ yếu qua nước tiểu với 15% dưới dạng không đổi (độ thanh thải 25 mL/phút).
Tác dụng – Chỉ định
Các kháng sinh nhóm này có tác dụng diệt khuẩn.
Chỉ định:
- Metronidazole: Nhiễm trùng do vi khuẩn kỵ khí gây ra, viêm đại tràng giả mạc do C. difficile, viêm âm đạo nhiễm khuẩn, các bệnh lây qua đường tình dục, nhiễm khuẩn vết mổ đại trực tràng, nhiễm Trichomonas, amip, Giardia (chỉ định ngoài nhãn), Gardnerella, viêm loét dạ dày – tá tràng do H. pylori (chỉ định ngoài nhãn), viêm niệu đạo không do lậu (chỉ định ngoài nhãn) và viêm vùng chậu (chỉ định ngoài nhãn). Thuốc còn có các chỉ định mồ côi là viêm túi cùng, bệnh Crohn (điều trị tại chỗ bệnh Crohn thể hoạt động quanh hậu môn) và viêm da quanh miệng.
- Tinidazole: Nhiễm amip ruột và áp xe gan do amip, nhiễm Giardia hoặc Trichomonas, nhiễm trùng âm đạo và viêm loét dạ dày – tá tràng do H. pylori.
- Secnidazole: Nhiễm khuẩn âm đạo.
Cách dùng – Liều dùng
Metronidazole:
+ Nhiễm trùng vi khuẩn kỵ khí: Liều nạp 15 mg/kg tĩnh mạch (IV), tối đa 4 g/ngày. Liều duy trì: 7.5 mg/kg đường uống (PO)/IV (truyền 1 giờ) mỗi 6 giờ trong 7-10 ngày (2-3 tuần nếu nặng).
+ Viêm âm đạo nhiễm khuẩn: Phụ nữ không mang thai: 500 mg PO 2 lần/ngày hoặc 750 mg PO giải phóng kéo dài 1 lần/ngày trong 7 ngày hoặc 2 g PO 1 liều duy nhất. Phụ nữ có thai: 500 mg PO 2 lần/ngày hoặc 250 mg PO 3 lần/ngày trong 7 ngày.
+ Bệnh lây qua đường tình dục (Dự phòng sau tấn công tình dục): 2 g PO 1 liều duy nhất kết hợp với Ceftriaxone hoặc Cefixime và Azithromycin hoặc Doxycycline (Hướng dẫn của CDC Hoa Kỳ năm 2010).
+ Nhiễm khuẩn vết mổ đại trực tràng (Dự phòng): 3 liều 1 g PO mỗi 6-8 giờ hoặc 15 mg/kg IV trong 30-60 phút, hoàn thành 1 giờ trước phẫu thuật, có thể sử dụng liều duy trì 7.5 mg/kg IV trong 30-60 phút vào các thời điểm 6 giờ và 12 giờ sau liều đầu tiên, ngừng thuốc trong vòng 12 giờ sau phẫu thuật.
+ Nhiễm Trichomonas: 250 mg PO mỗi 8 giờ hoặc 375 mg PO mỗi 12 giờ trong 7 ngày, hoặc 2 g PO 1 liều duy nhất hoặc 2 liều 1 g PO mỗi 12 giờ.
+ Nhiễm amip: 500-750 mg PO mỗi 8 giờ trong 5-10 ngày.
+ Nhiễm Gardnerella: 500 mg PO mỗi 12 giờ hoặc 750 mg PO giải phóng kéo dài hàng ngày trong 7 ngày (dùng khi dạ dày rỗng).
+ Nhiễm Giardia: 500 mg PO mỗi 12 giờ trong 5-7 ngày.
+ Viêm loét dạ dày – tá tràng do H. pylori: 250-500 mg 4 lần/ngày kết hợp với Tetracycline 500 mg PO và Bismuth subsalicylate 525 mg PO trong 14 ngày, nên kết hợp thêm với một thuốc ức chế bơm proton (ví dụ như Omeprazole hoặc Rabeprazole). Ở Việt Nam, phác đồ phối hợp ba kháng sinh Amoxicillin + Clarithromycin + Metronidazole và một thuốc ức chế bơm proton được sử dụng phổ biến.
+ Viêm niệu đạo không do lậu: 2 g PO 1 liều duy nhất kết hợp với Erythromycin 500 mg 4 lần/ngày trong 7 ngày.
+ Viêm vùng chậu: 500 mg PO mỗi 12 giờ trong 14 ngày, kết hợp với Ofloxacin hoặc Levofloxacin.
Với bệnh nhân suy giảm chức năng gan nặng (Child-Pugh C), cần giảm liều 50%. Còn với Child-Pugh A hoặc B (suy giảm chức năng gan nhẹ hoặc trung bình) thì không cần giảm liều nhưng cần giám sát các tác dụng không mong muốn của thuốc.
Với bệnh nhân suy giảm chức năng thận nặng hoặc có thẩm phân phúc mạc, cần giám sát các tác dụng không mong muốn của thuốc do nguy cơ tích lũy thuốc và các chất chuyển hóa. Không cần hiệu chỉnh liều ở bệnh nhân suy giảm chức năng thận nhẹ hoặc trung bình. Bệnh nhân đang điều trị bằng thẩm tách máu có thể cần bổ sung liều do Metronidazole và các chất chuyển hóa của nó bị mất qua thẩm tách máu.
Tinidazole: Dùng thuốc cùng với đồ ăn.
+ Nhiễm amip ruột: 2 g PO hàng ngày trong 3 ngày.
+ Áp xe gan do amip: 2 g PO hàng ngày trong 3-5 ngày.
+ Nhiễm Trichomonas hoặc Giardia: 2 g PO 1 liều duy nhất. Lưu ý với nhiễm Trichomonas, phải điều trị cả bạn tình với liều tương tự.
+ Viêm âm đạo nhiễm khuẩn (phụ nữ không có thai): 2 g PO hàng ngày trong 2 ngày hoặc 1 g PO hàng ngày trong 5 ngày.
Secnidazole:
+ Nhiễm khuẩn âm đạo ở phụ nữ trưởng thành: 2 g PO 1 liều duy nhất.
Tác dụng không mong muốn

- Bất thường vị giác: Lưỡi vị kim loại là tác dụng không mong muốn phổ biến của nhóm thuốc này.
- Phản ứng kiểu Disulfiram: Các kháng sinh nhóm này có khả năng ức chế enzyme aldehyde dehydrogenase đóng vai trò chuyển hóa acetaldehyde thành acid acetic trong con đường chuyển hóa rượu (ethanol) của cơ thể, điều này dẫn đến nếu bệnh nhân uống rượu bia, acetaldehyde có thể bị tích lũy với nồng độ cao trong cơ thể và gây ra phản ứng cai rượu, còn gọi là phản ứng kiểu Disulfiram, với các biểu hiện đau đầu, chóng mặt, đỏ mặt, đánh trống ngực, khó thở…
- Rối loạn thần kinh: Bệnh não, bệnh lý thần kinh ngoại biên, co giật, viêm màng não, chóng mặt, mất điều hòa, loạn vận ngôn, tê bì, dị cảm một chi…
- Rối loạn huyết học: Giảm bạch cầu, mất bạch cầu hạt…
- Bội nhiễm vi khuẩn hoặc nấm khi sử dụng kéo dài.
- Metronidazole có tác dụng kháng androgen và có thể gây nữ hóa tuyến vú ở nam giới.
Chống chỉ định
- Quá mẫn cảm với bất cứ thành phần nào của thuốc hoặc các dẫn xuất nitroimidazole khác.
- Tam cá nguyệt thứ nhất (ba tháng đầu) của thai kỳ.
- Chống chỉ định sử dụng Metronidazole khi đã sử dụng Disulfiram trong vòng 2 tuần gần nhất, sử dụng đồ uống, thực phẩm hoặc chế phẩm thuốc chứa cồn trong khi điều trị hoặc trong vòng 3 ngày sau hoàn thành điều trị.
Tương tác thuốc
Phối hợp với các thuốc chống đông máu đường uống kháng vitamin K (Warfarin, Acenocoumarol…): Tăng tác dụng chống đông máu của thuốc cùng cùng, tăng nguy cơ chảy máu. Thời gian prothrombin (PT) và tỷ số bình thường hóa quốc tế (INR) kéo dài. Cần hiệu chỉnh liều thuốc chống đông máu cẩn thận và theo dõi bệnh nhân về các triệu chứng chảy máu.
Nguyên nhân của tương tác này được cho là do các kháng sinh nhóm này tiêu diệt nhiều vi khuẩn kỵ khí đường ruột, điều này dẫn đến làm giảm lượng vitamin K cung cấp cho cơ thể (các vi khuẩn ruột là một nguồn cung cấp vitamin K quan trọng). Vitamin K là một yếu tố quan trọng tham gia vào quá trình đông máu, giảm hấp thu vitamin K vào cơ thể làm tăng tác dụng chống đông máu của các thuốc chống đông đường uống.
Phối hợp với Busulfan (thuốc điều trị ung thư nhóm alkyl hóa): Metronidazole làm tăng nồng độ Busulfan trong huyết tương, tăng nguy cơ gặp phải độc tính của Busulfan, bao gồm hội chứng tắc nghẽn mạch máu hình sin, viêm niêm mạc tiêu hóa và tắc tĩnh mạch gan. Phối hợp này chỉ sử dụng khi lợi ích là vượt trội so với nguy cơ.
Phối hợp với các thuốc ức chế CYP3A4 của gan (Cimetidine, các kháng sinh nhóm Macrolide như Clarithromycin, Erythromycin, các thuốc ức chế protease HIV như Saquinavir, Ritonavir, Lopinavir…): Các thuốc này làm giảm chuyển hóa kháng sinh, từ đó làm tăng nồng độ kháng sinh trong máu, tăng nguy cơ gặp phải độc tính.
Phối hợp với các thuốc cảm ứng CYP3A4 của gan (các thuốc điều trị động kinh như Phenytoin, Carbamazepine, các Barbiturate như Phenobarbital, các Sulfonylurea điều trị đái tháo đường như Tolbutamide, Gliclazide…): Các thuốc này làm tăng chuyển hóa kháng sinh, từ đó làm giảm nồng độ kháng sinh trong máu, giảm hiệu quả điều trị kháng sinh và tăng nguy cơ chọn lọc các chủng vi khuẩn đề kháng thuốc.
Phối hợp với các thuốc là cơ chất của CYP3A4 (Flibanserin, Lomitapide, Lonafarnib…): Nồng độ các thuốc dùng cùng trong máu có thể tăng lên do giảm chuyển hóa qua CYP3A4. Cần thận trọng với các phối hợp như thế này.
Phối hợp với 5-fluorouracil (5-FU, thuốc kháng chuyển hóa điều trị ung thư): Độ thanh thải của 5-FU giảm, có thể khiến cho bệnh nhân bị ngộ độc 5-FU. Thận trọng với phối hợp thuốc này.
Phối hợp với các cura giãn cơ (Vecuronium, Pancuronium, Atracurium…): Tăng tác dụng giãn cơ. Thận trọng với tương tác thuốc này. Tác dụng giãn cơ tăng quá mức có thể gây nguy hiểm cho người bệnh, đặc biệt là nếu các cơ liên quan đến hô hấp bị liệt.
Phối hợp với các vaccin BCG sống, vaccin tả và vaccin thương hàn sống: Giảm tác dụng của các vaccin dùng cùng. Nhìn chung trong thời gian sử dụng kháng sinh, không nên sử dụng các vaccin này vì kháng sinh có thể tiêu diệt vi khuẩn hoặc làm biến đổi kháng nguyên trên vi khuẩn, điều này có thể làm ảnh hưởng đến tính sinh miễn dịch của vaccin.
Lưu ý và thận trọng khi sử dụng thuốc
Cảnh báo hộp đen: Dữ liệu trên động vật (chuột) cho thấy thuốc có thể gây ung thư khi sử dụng kéo dài.

Các cảnh báo khác:
- Sử dụng thuốc khi không có bằng chứng hoặc dấu hiệu nhiễm trùng không đem lại bất cứ lợi ích nào mà chỉ làm tăng nguy cơ chọn lọc các chủng vi khuẩn đề kháng.
- Sử dụng liều cao và điều trị kéo dài có liên quan đến co giật và viêm màng não vô khuẩn.
- Nếu điều trị kéo dài, cần theo dõi công thức máu thường xuyên. Nếu phát hiện thấy có dấu hiệu bất thường, đặc biệt là giảm bạch cầu, thường bệnh nhân sẽ phải ngừng điều trị bằng kháng sinh nhóm này ngay lập tức.
- Một số chế phẩm thuốc tiêm chứa nhiều ion natri, thận trọng với bệnh nhân cần giảm lượng natri nạp vào cơ thể (suy tim, suy thận, phù nề do corticoid…).
- Sử dụng Metronidazole theo đường toàn thân có thể gây ra nhiễm độc gan nặng hoặc suy gan cấp tính và tử vong ở những bệnh nhân có hội chứng Cockayne. Chỉ sử dụng thuốc khi lợi ích là vượt trội so với nguy cơ ở những bệnh nhân này, theo dõi chức năng gan thường xuyên trong quá trình điều trị và ngừng thuốc ngay lập tức khi xuất hiện ra các triệu chứng có thể là dấu hiệu của tổn thương gan tiềm ẩn.
- Không uống rượu, bia hoặc sử dụng bất kỳ sản phẩm gì có thể chứa ethanol (ví dụ như hoa quả để quá chín cũng có thể xảy ra phản ứng lên men glucose sinh ra ethanol) trong quá trình dùng thuốc cũng như một thời gian sau quá trình dùng thuốc (thời gian cụ thể tùy từng loại thuốc, thuốc nào có thời gian bán thải càng lâu thì thời gian kiêng rượu, bia và các sản phẩm chứa ethanol càng dài). Nếu phạm phải điều này, phản ứng kiểu Disulfiram sẽ có thể xảy ra và làm cho bệnh nhân cực kỳ khó chịu.
Sử dụng thuốc trên đối tượng đặc biệt
Bệnh nhân suy giảm chức năng gan thận: Có thể cần hiệu chỉnh liều cho phù hợp tùy thuộc vào mức độ nặng của bệnh bởi các kháng sinh nhóm này đều được chuyển hóa qua gan và thải trừ một phần qua nước tiểu.
Hiệu chỉnh liều ở bệnh nhân suy giảm chức năng thận thường dễ hơn và chủ yếu dựa trên độ thanh thải creatinine (ClCr), được tính theo công thức Cockcroft-Gault. Còn ở bệnh nhân suy giảm chức năng gan, việc hiệu chỉnh liều khó hơn rất nhiều và thường sử dụng thang điểm Child-Pugh (có ba mức độ nặng là A, B và C), kết hợp với giám sát quá trình điều trị thường xuyên để hiệu chỉnh liều cho phù hợp.
Người già và trẻ em: Có thể cần hiệu chỉnh liều cho phù hợp do chức năng gan thận của người già thường suy giảm theo tuổi tác, còn của trẻ nhỏ, đặc biệt là trẻ sơ sinh, trẻ đẻ non thường chưa hoàn thiện.
Phụ nữ có thai và đang cho con bú: Chống chỉ định sử dụng Metronidazole và Tinidazole trong ba tháng đầu thai kỳ. Với Secnidazole, dữ liệu lâm sàng chưa đầy đủ nên tốt nhất là không nên dùng, trừ khi thực sự cần thiết.

Các kháng sinh nhóm này cũng có thể vào sữa mẹ và gây ra ảnh hưởng nhất định cho trẻ bú mẹ. Tốt nhất người mẹ đang cho con bú nên vắt bỏ sữa trong thời gian điều trị bằng kháng sinh cũng như 24 giờ sau liều Metronidazole cuối cùng (72 giờ với Tinidazole và 96 giờ với Secnidazole) và cho trẻ dùng sữa công thức thay thế trong giai đoạn đó.
Một số nghiên cứu và thử nghiệm lâm sàng
Thử nghiệm ngẫu nhiên tiền cứu so sánh Metronidazole với Vancomycin trong điều trị tiêu chảy và viêm đại tràng do C. difficile cho kết luận: Metronidazole và Vancomycin có hiệu lực và tỷ lệ tái phát tương đương nhau, mức độ dung nạp cũng tương tự nhau, nhưng Metronidazole có tính kinh tế hơn đáng kể.
Thử nghiệm lâm sàng đối chứng ngẫu nhiên so sánh Vancomycin với Metronidazole trong điều trị tiêu chảy liên quan đến C. difficile (CDAD) có phân tầng mức độ nặng của bệnh đưa ra kết luận: Hai thuốc này có hiệu quả tương đương nhau trong điều trị CDAD nhẹ, nhưng Vancomycin vượt trội hơn Metronidazole ở những bệnh nhân bị CDAD nặng.
Thử nghiệm lâm sàng so sánh Metronidazole với Tinidazole trong điều trị amip ruột đưa ra kết luận: Tỷ lệ chữa khỏi bằng Tinidazole cao hơn đáng kể so với Metronidazole trong điều trị amip ruột có triệu chứng, đồng thời cũng dung nạp tốt hơn Metronidazole.
Thử nghiệm lâm sàng so sánh Metronidazole và Chloroquine trong điều trị áp xe gan do amip đưa ra kết luận: Cả hai thuốc đều có hiệu quả cao, tuy nhiên Metronidazole có ưu điểm hơn là có thể điều trị amip ruột và độ dài đợt điều trị thường ngắn hơn. Tốc độ đáp ứng với Metronidazole cũng cao hơn một chút.
Đánh giá hệ thống và phân tích gộp về hiệu lực và độ an toàn của liệu pháp kết hợp chứa Metronidazole trong điều trị nhiễm khuẩn ổ bụng biến chứng (cIAIs) cho kết luận: Liệu pháp kết hợp chứa Metronidazole có hiệu lực và an toàn tương đương Carbapenem trong điều trị cIAIs. Đây là một sự thay thế hiệu quả cho Carbapenem với nguy cơ đề kháng thấp.
Thử nghiệm lâm sàng đối chứng ngẫu nhiên so sánh Mebendazole và Secnidazole trong điều trị bệnh nhiễm Giardia cho thấy kết quả tần suất khỏi bệnh ở hai nhóm sử dụng Mebendazole và Secnidazole là như nhau (khác biệt không có ý nghĩa thống kê). Cả hai phác đồ có hiệu lực như nhau, dung nạp tốt và ít tác dụng phụ.
Tài liệu tham khảo
The nitroimidazole family of drugs. Br J Vener Dis. 1978;54(2):69-71.
Available at https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1046363/
Edwards DI. Nitroimidazole drugs–action and resistance mechanisms. II. Mechanisms of resistance. J Antimicrob Chemother. 1993 Feb;31(2):201-10. doi: 10.1093/jac/31.2.201.
Available at https://academic.oup.com/jac/article-abstract/31/2/201/827849?redirectedFrom=fulltext
Dhand A., Snydman D.R. (2009). Mechanism of Resistance in Metronidazole. In: Mayers D.L. (eds). Antimicrobial Drug Resistance. Infectious Disease. Humana Press. doi: 10.1007/978-1-59745-180-2_19.
Available at https://link.springer.com/chapter/10.1007/978-1-59745-180-2_19
Teasley DG, Gerding DN, Olson MM, Peterson LR, Gebhard RL, Schwartz MJ, Lee JT Jr. Prospective randomised trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet. 1983 Nov 5;2(8358):1043-6. doi: 10.1016/s0140-6736(83)91036-x.
Available at https://pubmed.ncbi.nlm.nih.gov/6138597/
Zar FA, Bakkanagari SR, Moorthi KM, Davis MB. A comparison of vancomycin and metronidazole for the treatment of Clostridium difficile-associated diarrhea, stratified by disease severity. Clin Infect Dis. 2007 Aug 1;45(3):302-7. doi: 10.1086/519265.
Available at https://academic.oup.com/cid/article/45/3/302/358373
Swami B, Lavakusulu D, Devi CS. Tinidazole and metronidazole in the treatment of intestinal amoebiasis. Curr Med Res Opin. 1977;5(2):152-6. doi: 10.1185/03007997709110156.
Available at https://pubmed.ncbi.nlm.nih.gov/340131/
Cohen HG, Reynolds TB. Comparison of metronidazole and chloroquine for the treatment of amoebic liver abscess. A controlled trial. Gastroenterology. 1975 Jul;69(1):35-41.
Available at https://www.gastrojournal.org/article/S0016-5085(19)32633-2/fulltext
Mikamo H, Yuasa A, Wada K, Crawford B, Sugimoto N. Optimal Treatment for Complicated Intra-abdominal Infections in the Era of Antibiotic Resistance: A Systematic Review and Meta-Analysis of the Efficacy and Safety of Combined Therapy With Metronidazole. Open Forum Infect Dis. 2016;3(3):ofw143. Published 2016 Jul 7. doi:10.1093/ofid/ofw143.
Available at https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5047423/
Escobedo AA, Cañete R, Gonzalez ME, Pareja A, Cimerman S, Almirall P. A randomized trial comparing mebendazole and secnidazole for the treatment of giardiasis. Ann Trop Med Parasitol. 2003 Jul;97(5):499-504. doi: 10.1179/000349803235002380.
Available at https://pubmed.ncbi.nlm.nih.gov/12930613/
Xem thêm:





Bài viết rất bổ ích. Cảm ơn bạn đã chia sẻ bài viết.