Bài viết Giao tiếp chéo não-phổi: Tác dụng đối với bệnh nhân chăm sóc tích cực thần kinh được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: Brain-lung crosstalk: Implications for neurocritical care patients
Tóm tắt
Rối loạn phổi chính có thể xảy ra sau chấn thương não như viêm phổi do thở máy, hội chứng suy hô hấp cấp tính hoặc phù phổi do thần kinh. Đó là những điểm chính để quản lý bệnh nhân bị chấn thương não vì suy hô hấp và thở máy dường như là một yếu tố nguy cơ làm tăng tỷ lệ tử vong, kết cục thần kinh kém và thời gian nằm ICU dài hơn hoặc thời gian nằm viện dài hơn. Não và phổi tương tác mạnh mẽ không chỉ thông qua các con đường phức tạp từ não đến phổi mà còn từ phổi đến não. Một số giả thuyết đã được đề xuất với một mối quan tâm đặc biệt đối với mô hình cú đấm đôi được mô tả gần đây.
Cài đặt máy thở ở bệnh nhân chấn thương sọ não bị tổn thương phổi đã ít được nghiên cứu và những BS hồi sức tích cực thường lo sợ khi áp dụng một phần của thông khí bảo vệ phổi ở bệnh nhân chấn thương não. Tổng quan này nhằm mục đích mô tả dịch tễ học và sinh lý bệnh học của tổn thương phổi ở bệnh nhân chấn thương não, nhưng cũng nghiên cứu các tác động của các phương thức thở máy khác nhau lên não trong bối cảnh chấn thương não cấp tính.
Lời khuyên cốt lõi: Giao tiếp chéo não-phổi là một tương tác phức tạp từ não đến phổi nhưng cũng từ phổi đến não. Những người BS hồi sức tích cực thường rất sợ sử dụng một số phần của thông khí bảo vệ phổi ở những bệnh nhân bị chấn thương não nhưng nếu áp dụng đúng cách, thở máy có thể có tác dụng có lợi cho quá trình oxy hóa não, ngay cả khi sử dụng PEEP và thủ thuật huy động. Tổng quan này nhằm mục đích mô tả dịch tễ học và sinh lý bệnh học của tổn thương phổi ở bệnh nhân chấn thương não, nhưng cũng có nói đến tác động của các phương thức khác nhau của thở máy lên não trong bối cảnh chấn thương não cấp tính.
Giới thiệu
Giao tiếp chéo não-phổi là một tương tác phức tạp từ não đến phổi nhưng cũng từ phổi đến não. Sự xuất hiện của chấn thương phổi nghiêm trọng sau khi trải qua chấn thương não, chẳng hạn như chấn thương sọ não nặng (TBI, traumatic brain injury), xuất huyết dưới nhện (SAH, subarachnoid hemorrhage) hoặc đột quỵ, đã được mô tả [1-5]. Những tổn thương phổi này bao gồm viêm phổi liên quan đến máy thở (VAP, ventilator-associated pneumonia), hội chứng suy hô hấp cấp tính (ARDS, acute respiratory distress syndrome) và phù phổi do thần kinh (NPE, neurogenic pulmonary edema). Đó là những điểm chính để quản lý bệnh nhân bị chấn thương não vì suy hô hấp và thở máy dường như là một yếu tố nguy cơ làm tăng tỷ lệ tử vong, kết cục thần kinh kém và thời gian nằm đơn vị chăm sóc đặc biệt lâu hơn (ICU, intensive care unit) hoặc thời gian nằm viện (LOS, length of stay) lâu hơn [4 – 9]. Sinh lý bệnh của tương tác não-phổi rất phức tạp và một số giả thuyết đã được đề xuất với mối quan tâm đặc biệt đối với mô hình cú đấm đôi (double hit model) được mô tả gần đây [1].
Tổng quan này nhằm mục đích mô tả dịch tễ học và sinh lý bệnh học của tổn thương phổi ở bệnh nhân chấn thương não, nhưng cũng có nói đến tác động của các phương thức thở máy khác nhau lên não trong bối cảnh chấn thương não cấp tính.
Tổn thương phổi sau tổn thương não
Rối loạn phổi nặng có thể xảy ra sau chấn thương não như VAP, ARDS hoặc NPE. Trong tổng quan này, hậu quả trực tiếp của chấn thương ngực, chẳng hạn như gãy xương sườn, nhiễm trùng phổi hoặc tràn khí màng phổi/tràn khí màng phổi sẽ không được thảo luận trong tổng quan hiện nay. Zygun et al [6], trong một nghiên cứu đoàn hệ quan sát, đã báo cáo các rối loạn chức năng cơ quan không thần kinh ở 209 bệnh nhân mắc TBI nặng. 89% bệnh nhân có ít nhất một rối loạn chức năng không liên quan đến thần kinh (điểm thành phần hệ thống cơ quan ≥ 1) và 81% bệnh nhân bị rối loạn chức năng hô hấp [PaO2/FiO2 = 226 -300]. 35% bệnh nhân bị ít nhất một lần suy cơ quan (điểm thành phần hệ thống cơ quan ≥ 3) và suy hệ thống cơ quan không thần kinh phổ biến nhất là suy hô hấp nặng (PaO2/FiO2 ≤ 150), xảy ra ở 23% bệnh nhân. Các nghiên cứu đa trung tâm khác cũng đã báo cáo tỷ lệ cao các rối loạn chức năng cơ quan ngoài não sau TBI [10] hoặc SAH [11]. Những suy cơ quan ngoài não này, đặc biệt là suy hô hấp và nhiễm trùng huyết do ICU, dường như thường gặp hơn ở những bệnh nhân bị chấn thương não so với những bệnh nhân không mắc bệnh thần kinh [12].
Chấn thương phổi là thường xuyên và có thể dẫn đến hậu quả đáng kể cho bệnh nhân chấn thương não bằng cách thay đổi trực tiếp kết quả. Suy hô hấp và thở máy dường như là yếu tố nguy cơ làm tăng tỷ lệ tử vong và kết cục thần kinh kém ở bệnh nhân chấn thương não [6-9] và có liên quan đến thời gian ICU và LOS bệnh viện dài hơn [4,5]. Pelosi et al [13], trong một nghiên cứu quan sát và đa trung tâm tiền cứu gần đây, đã mô tả kết quả ở những bệnh nhân thở máy với nhiều loại chấn thương não (362 bệnh nhân bị đột quỵ do thiếu máu cục bộ hoặc xuất huyết và 190 bệnh nhân bị chấn thương não). Suy hô hấp là rối loạn chức năng cơ quan ngoài não thường gặp nhất ở bệnh nhân thần kinh. Bệnh nhân mắc bệnh thần kinh được thở máy có ngày ICU và ngày sử dụng máy thở dài hơn, yêu cầu phẫu thuật mở khí quản nhiều hơn, VAP nhiều hơn và tỷ lệ tử vong cao hơn so với bệnh nhân không mắc bệnh thần kinh.
VAP
Viêm phổi và VAP thường gặp ở bệnh nhân thần kinh do giảm mức độ ý thức và hít sặc lớn hoặc thậm chí là vi hít sặc (microaspirations) [14]. Các yếu tố nguy cơ phát triển VAP ở bệnh nhân chấn thương não đã được xác định: truyền máu nhiều lần, tuổi, béo phì, tiểu đường, tình trạng suy giảm miễn dịch, bệnh phổi mãn tính và sử dụng barbiturat [15]. Hơn nữa, thở máy, an thần và sử dụng giãn cơ, điều trị bằng kháng sinh trước đó và không có tư thế thuận lợi trong thở máy làm tăng nguy cơ phát triển VAP [16]. Ngoài ra, ức chế miễn dịch do chấn thương não thúc đẩy sự phát triển của các bệnh truyền nhiễm [17- 20].
Tỷ lệ mắc VAP ở bệnh nhân mắc TBI nặng là 21% đến 60% [15,21,22]. Staphylococcus aureus nhạy cảm với methicillin là mầm bệnh phổ biến nhất được báo cáo trong VAP ở bệnh nhân mắc TBI nặng. Cho ăn đường ruột và chăm sóc răng miệng sớm đã được chứng minh là làm giảm tỷ lệ mắc bệnh VAP trong ICU thần kinh [22,23]. Pelosi et al [13] đã báo cáo tỷ lệ VAP cao hơn ở những bệnh nhân mắc TBI so với bệnh nhân bị đột quỵ do thiếu máu cục bộ hoặc xuất huyết và bệnh nhân không mắc bệnh thần kinh.
Cinotti và cộng sự [24] đã báo cáo phân tích hồi cứu 193 bệnh nhân mắc SAH được thở máy. VAP xảy ra ở 48,7% bệnh nhân và mầm bệnh chịu trách nhiệm chính cũng là Staphylococcus aureus nhạy cảm với Methicillin. Nghiên cứu này không tìm thấy sự gia tăng tỷ lệ tử vong cho những bệnh nhân này, nhưng thời gian thở máy và ICU LOS lâu hơn [24]. Frontera et al [25] đã phân tích dữ liệu của 573 bệnh nhân bị SAH (có hoặc không thở máy) và định lượng mức độ phổ biến của các biến chứng nhiễm trùng bệnh viện. Biến chứng phổ biến nhất là viêm phổi với tỷ lệ lưu hành là 20%. Viêm phổi là một yếu tố độc lập cho tỷ lệ tử vong hoặc tàn tật nặng vào lúc 3 tháng [25].
Kasuya và cộng sự [26] đã quan sát thấy tỷ lệ VAP 28% ở 111 bệnh nhân đột quỵ khi thở máy. VAP kéo dài thời gian thở máy và ICU LOS. Bệnh phổi mãn tính, Điểm đột quỵ của Viện Y tế Quốc gia khi nhập viện và xuất huyết là những yếu tố nguy cơ độc lập đối với VAP. Các vi khuẩn chịu trách nhiệm phổ biến nhất là Staphylococcus aureus kháng Methicillin và Staphylococcus aureus nhạy cảm với Methicillin [26]. Ở những bệnh nhân bị đột quỵ thiếu máu cục bộ nặng, VAP tăng tỷ lệ tử vong lên gấp 3 lần [27].
ARDS
ARDS xảy ra với tỷ lệ mắc cao ở bệnh nhân chấn thương não. Định nghĩa về ARDS được sử dụng trong hầu hết các nghiên cứu là tiêu chí hội nghị đồng thuận Mỹ-Âu [28]. Một nghiên cứu gần đây đã báo cáo tỷ lệ mắc 35% ARDS trong đoàn hệ 192 bệnh nhân bị rối loạn thần kinh (đột quỵ xuất huyết, SAH, tụ máu dưới màng cứng, TBI và đột quỵ do thiếu máu cục bộ) [29]. Các nghiên cứu khác đã cho thấy tỷ lệ ARDS từ 19% đến 35% ở những bệnh nhân có thang điểm hôn mê (GCS) < 9 [12,29,30].
Bệnh nhân mắc TBI đơn độc hiện có 20- 25% ARDS [31,32] và bệnh nhân mắc SAH hiện có 20-38% ARDS [3,7,33]. Một nghiên cứu hồi cứu gần đây được thực hiện từ năm 1994 đến 2008 tại Hoa Kỳ đã báo cáo tỷ lệ mắc ARDS khi nhập viện của bệnh nhân bị đột quỵ thiếu máu cục bộ cấp tính là 4% [4]. ARDS liên quan đến hít sặc được chẩn đoán ở 3,6% bệnh nhân trong một nghiên cứu đoàn hệ hồi cứu gần đây trên 1495 bệnh nhân bị đột quỵ cấp tính [34].
Trong mọi trường hợp, ARDS ảnh hưởng đến tỷ lệ mắc bệnh và tử vong của bệnh nhân bị chấn thương não [4,7,30,35,36]. Xuất hiện ARDS sau TBI dẫn đến tỷ lệ tử vong của bệnh viện tăng gấp 3 lần [32]. ARDS là một yếu tố nguy cơ độc lập làm tăng tỷ lệ tử vong và kết quả thần kinh kém và có liên quan đến ICU và LOS bệnh viện dài hơn [4,30]. Các yếu tố rủi ro đã được xác định cho sự phát triển của ARDS. Đầu tiên, mức độ nghiêm trọng của chấn thương não ban đầu được tiết lộ bởi điểm hôn mê thấp ở Glasgow (GCS 3-4) và chụp cắt lớp vi tính não ban đầu (CT) bất thường (dịch chuyển đường giữa và dấu hiệu CT tổng thể) [31,35,36]. Thứ hai, tăng huyết áp, sử dụng thuốc vận mạch và tiền sử lạm dụng thuốc đã được báo cáo là yếu tố độc lập đối với ARDS trong TBI nặng [35]. Cuối cùng, các yếu tố nguy cơ chung đã được xác định như tuổi trẻ, giới tính nam, dân tộc, tiền sử tăng huyết áp động mạch mạn tính, tiểu đường, bệnh phổi tắc nghẽn mạn tính, phát triển nhiễm trùng huyết, rối loạn chức năng tim mạch, thận và huyết học [4,32,37]. Gần đây, Mascia và cộng sự [30] đã mô tả việc quản lý thông khí cho 82 bệnh nhân mắc TBI nặng trong một nghiên cứu quan sát đa trung tâm tiền cứu. 25% bệnh nhân đã phát triển ARDS và những bệnh nhân này ban đầu có thể tích khí lưu thông (Vt) cao hơn so với bệnh nhân không có ARDS. Tỷ lệ ARDS tăng lên với cài đặt Vt trong mối quan hệ đáp ứng liều. Trong những ngày trước ARDS, 72% bệnh nhân mắc ARDS có Vt ≥ 10 mL/kg trọng lượng cơ thể dự đoán (PBW) trung bình [30]. Việc quản lý máy thở của bệnh nhân mắc TBI nặng dường như là một điểm mấu chốt trong phát triển ARDS và phù hợp với mô hình cú đấm đôi của James sẽ được trình bày chi tiết sau trong tổng quan này.
Phân phối ARDS theo thời gian là lưỡng đỉnh, với đỉnh sớm vào ngày 2-3 sau khi bắt đầu thở máy và đỉnh sau vào ngày 7-8 [10], thường liên quan đến viêm phổi [15].
NPE
NPE đã được mô tả trong hơn 100 năm [38]. Nó đã được xác định là một thực thể lâm sàng với sự khởi phát cấp tính của phù phổi giàu protein sau khi bị tổn thương hệ thần kinh trung ương quan trọng như TBI, SAH, đột quỵ, chấn thương tủy sống, trạng thái động kinh, viêm màng não hoặc xuất huyết dưới màng cứng và loại trừ các nguyên nhân có thể khác [39-42].
Trong một đánh giá về các trường hợp NPE được báo cáo từ năm 1990 đến 2003, chấn thương thần kinh thường gặp nhất là SAH (42,9%) và khởi phát triệu chứng là < 4 giờ sau chấn thương não ở 71,4% bệnh nhân. Tỷ lệ tử vong của NPE cao, gần 10%, nhưng bệnh nhân sống sót thường hồi phục rất nhanh (<72 h trong 52,4%) [41]. Rogers et al [40] đã báo cáo một cơ sở dữ liệu khám nghiệm tử thi lớn các bệnh nhân bị thương ở đầu đã chết tại hiện trường hoặc trong vòng 96 giờ sau khi bị thương. Chẩn đoán NPE bao gồm sự hiện diện của phù, sung huyết và xuất huyết liên quan đến tăng trọng lượng phổi. Tỷ lệ mắc NPE ở những bệnh nhân TBI bị cô lập đã chết tại hiện trường là 32%. Nó đạt 50% cho những bệnh nhân đã chết trong vòng 96 giờ. Một mối tương quan nghịch giữa áp lực tưới máu não và tỷ lệ PaO2/FiO2 đã được quan sát, ngay cả khi X-quang ngực được coi là bình thường [40]. Tỷ lệ NPE trong SAH phình động mạch thay đổi từ 2% đến 25% [11,43]. Tỷ lệ mắc bệnh dường như cao hơn ở SAH gây tử vong [44]. Các yếu tố nguy cơ được xác định là tuổi già, trì hoãn phẫu thuật, phẫu thuật động mạch đốt sống và mức độ nghiêm trọng của điểm lâm sàng và CT-scan (điểm Hun-Hess và Fisher) [11,45]. Sự xuất hiện của NPE sau SAH có liên quan đến kết cục kém và tỷ lệ tử vong cao hơn [46,47].
NPE có thể được coi là một dạng ARDS với định nghĩa đồng thuận. Vì vậy, một số tác giả đã đề xuất các tiêu chuẩn chẩn đoán sau: (1) thâm nhiễm phổi 2 bên; (2) Tỷ lệ PaO2/FiO2 <200; (3) không có bằng chứng tăng áp lực nhĩ trái; (4) sự hiện diện của chấn thương hệ thần kinh trung ương nghiêm trọng đã gây ra tăng áp lực nội sọ (ICP); và (5) không có các nguyên nhân phổ biến khác của ARDS (ví dụ: hít sặc, truyền máu lượng lớn hoặc nhiễm trùng huyết) [48].
Sinh lý bệnh của giao tiếp chéo não- phổi
Não đến phổi
Sinh lý bệnh của chấn thương phổi sau chấn thương não cấp tính vẫn còn đang được tranh luận, và một số lý thuyết đã được đề xuất; Gần đây, mô hình cú đấm đôi đã được mô tả [1].
Đáp ứng giao cảm với tăng ICP có một vai trò quan trọng. Một số tác giả đã giải thích một số phần của NPE với các mô hình thần kinh-tim và thần kinh-huyết động [48]. Nó đã được chứng minh rằng chấn thương cơ tim trực tiếp với bệnh cơ tim Takotsubo, có thể tham gia NPE [49-51]. Xuất tiết giao cảm ồ ạt sau chấn thương não dường như gây ra tổn thương tế bào cơ trực tiếp với các bất thường chuyển động trên thành tế bào theo mô hình phân bố thần kinh giao cảm [52]. Lý thuyết huyết động học được xác định bởi suy giảm độ giãn nở tâm thất gián tiếp do sự gia tăng nhanh chóng của áp lực hệ thống và phổi. Thật vậy, sự chuyển vị của lưu lượng máu từ tuần hoàn hệ thống có sức đề kháng cao sang tuần hoàn phổi có sức đề kháng thấp gây ra một dạng thủy tĩnh của phù phổi [53]. Các mô hình động vật đã cho thấy sự gia tăng áp lực nhĩ trái, hệ thống và phổi liên quan đến NPE [54-56]. Mặc dù áp suất thủy tĩnh và suy tim rất có thể đóng vai trò trong sinh bệnh học của NPE, những lý thuyết này không giải thích được sự hiện diện của hồng cầu và protein trong dịch phế nang [57].
Lý thuyết vụ nổ (the blast theory)
Theodore và Robin lần đầu tiên định nghĩa lý thuyết vụ nổ của NPE là sự suy yếu tính thấm thành mạch [58]. Sự gia tăng tạm thời của áp lực nội mạch, gây ra bởi sự gia tăng cấp tính của ICP, làm hỏng màng mao mạch-phế nang. Vì vậy, tổn thương nội mô phổi gây ra rò rỉ huyết tương giàu protein [58]. Lý thuyết này bao gồm sự cùng tồn tại của áp suất thủy tĩnh cao và tổn thương nội mô phổi. Một số mức độ tăng huyết áp mao mạch dường như cần thiết cho sự xuất hiện của phù phổi này, và sự gia tăng phụ thuộc vào áp lực trong tính thấm có thể là một điểm chung trong NPE [59,60]. Các mô hình động vật đã cho phép khám phá lý thuyết này. Maron et al [59] đã báo cáo ở thùy phổi được tưới máu phân lập ở chó, tối thiểu 70 torr áp lực tĩnh mạch là cần thiết để có tính thấm protein và lưu ý một mối tương quan tuyến tính giữa sự gia tăng áp lực tĩnh mạch và hệ số phản xạ thẩm thấu đối với protein toàn phần [59]. Bosso et al [60] đã khám phá mối quan hệ giữa mức độ tăng áp phổi và hàm lượng nước ngoài phổi ngoài mạch máu (EVLW, extravascular lung water) sau khi chết ở thỏ với tăng áp lực nội sọ. Áp lực động mạch phổi phải vượt quá 25 torr để thấy được sự gia tăng của nước phổi ngoài mạch máu [60]. Ngược lại, Bowers et al [61] đã xác định ảnh hưởng của tăng áp nội sọ trong mô hình cừu bằng cách đo tốc độ dòng chảy và hàm lượng protein của bạch huyết phổi. Họ ghi nhận sự gia tăng liên tục tính thấm của mạch máu phổi nhưng với sự gia tăng không đáng kể về áp lực mạch máu phổi [61]. Rất ít báo cáo có sẵn ở người vì theo dõi huyết động tại thời điểm tăng ICP nghiêm trọng ban đầu là rất hiếm. Sau sự mất ổn định huyết động ban đầu này và đáp ứng giao cảm lớn, áp lực toàn thân và phổi có thể trở về giá trị bình thường, trong khi tổn thương màng mao mạch-phế nang vẫn tồn tại [58,62]. Một số tác giả quan sát không có thay đổi về áp lực hệ thống, mặc dù sự xuất hiện của NPE gây tổn thương nội mô phổi trực tiếp sau chấn thương não [63]. Khái niệm này đã được gọi là quá mẫn cảm adrenergic tĩnh mạch phổi (pulmonary venule adrenergic hypersensitivity).
Quá mẫn cảm adrenergic tĩnh mạch phổi
Một số trường hợp ở người có theo dõi huyết động liên tục báo cáo NPE mà không mất ổn định huyết động [63,64]. Vì vậy, NPE có thể dẫn đến, một phần, từ việc co thắt tĩnh mạch phổi chọn lọc sau khi xuất tiết giao cảm ồ ạt sau chấn thương não. Các mạch phổi có các thụ thể α- và -adrenergic có thể được kích hoạt dẫn đến thay đổi toàn vẹn nội mô [65]. Các mô hình động vật chứng minh sự gia tăng tính thấm của mạch máu phổi và sự hình thành phù nề mà không thể giải thích được bằng những thay đổi huyết động đơn thuần [61,66]. Ở những con chó được gây mê với ICP tăng, McClellan và cộng sự [66] đã ghi nhận sự gia tăng gấp 3 lần tính thấm của mạch máu phổi (phù nề) với sự gia tăng vừa phải của áp lực động mạch phổi và cung lượng tim. Tuy nhiên, khi họ tái tạo những thay đổi huyết động ở chó mà không bị tăng áp lực nội sọ, họ đã không báo cáo bất kỳ thay đổi nào trong chỉ số rò rỉ protein [66]. Peterson et al [67] đã dùng thuốc chẹn α- adrenergic cho cừu gây mê với mức tăng áp lực nội sọ tiến triển. Họ đã báo cáo việc ngăn ngừa sự hình thành phù phổi với các tác động áp lực động mạch hệ thống nhỏ hỗ trợ một tác động adrenergic trực tiếp trên giường mạch máu phổi [67].
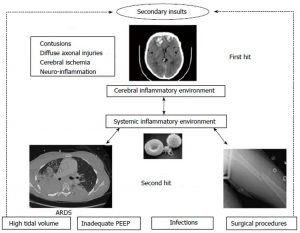
Mô hình cú đấm đôi
Phản ứng viêm toàn thân dường như đóng vai trò chính trong sự phát triển của suy phổi sau chấn thương não cấp tính. Quá trình sinh lý bệnh này hoàn thành lý thuyết chấn thương do vụ nổ [1,68]. Phản ứng viêm nội sọ xảy ra sau chấn thương não và các cytokine tiền viêm [interleukin 1 (IL-1), IL-6), yếu tố hoại tử khối u (TNF), IL-8] được sản xuất tại địa phương trong mô não bị tổn thương [69]. Microglia và tế bào hình sao là nguồn chính của các chất trung gian gây viêm. Sau đó, sự thay đổi của tính thấm hàng rào máu não (BBB, blood brain barrier) cho phép chúng thải vào tuần hoàn hệ thống với một gradient xuyên sọ. Điều này có thể chịu trách nhiệm cho các rối loạn chức năng ngoài não [70- 72]. Sự sản xuất có hệ thống các chất trung gian gây viêm này tạo thành một môi trường gây viêm: “cú đấm thứ nhất”. Do đó, cơ quan dễ bị ảnh hưởng bởi các sự kiện tiếp theo, “cú đấm thứ hai”, như thở máy, nhiễm trùng hoặc phẫu thuật, trong tình trạng bình thường vô hại [1] (Hình 1). López-Aguilar et al [73] nghiên cứu so sánh thỏ ngẫu nhiên nhóm kiểm soát hoặc nhóm bị tổn thương não với thông khí cơ học 120 phút với cùng cài đặt máy thở, sau đó là thở máy tích cực (aggressive). Trong nhóm bị tổn thương não, phổi có nhiều thay đổi về hệ số siêu lọc, trọng lượng và xuất huyết phế nang [73]. Bạch cầu đa nhân trung tính và tương tác tế bào nội mô bạch cầu có thể đã góp phần vào quá trình bệnh lý này [74]. Phản ứng viêm cấp tính ở cả não và phổi sau chấn thương não đã được thể hiện ở người và động vật. Chấn thương xuất huyết nội sọ thực nghiệm đi kèm với sự gia tăng phân tử bám dính nội bào-1 và yếu tố mô ở cả não và phổi. Huy động bạch cầu trung tính tiến triển và tổn thương phổi hình thái như sự phá vỡ cấu trúc phế nang đã được quan sát [75]. Kalsotra et al [76] cho thấy sự di cư lớn của đại thực bào và bạch cầu trung tính ở các đường dẫn khí chính và khoảng phế nang sau chấn thương não ở chuột, với sự gia tăng sản xuất leukotriene B4 trong phổi [76]. Những người hiến tặng não người chết có nồng độ IL-8 cao hơn đáng kể trong dịch rửa phế quản phế nang so với các đối tượng khỏe mạnh hoặc bệnh nhân không chết não thông khí. Hơn nữa, thâm nhiễm bạch cầu trung tính trong phổi tương quan tốt với mức độ IL-8 [77]. Trong một mô hình giảm cân chuột của TBI, tổn thương tế bào ở tế bào phổi loại II với không bào nội bào quan trọng và tăng peroxid hóa lipid đã được báo cáo [78]. Gần đây, Heuer et al [79] đã nghiên cứu lợn bị tăng áp lực nội sọ cấp tính. Họ đã báo cáo số điểm viêm, phù và hoại tử ở phổi và các cơ quan khác cao hơn so với lợn đối chứng không bị tăng áp lực nội sọ mặc dù không có giảm tưới máu và giảm oxy máu [79]. Trước đây, họ đã so sánh 4 nhóm lợn: đối chứng, với tăng áp lực nội sọ, với ARDS và tăng áp lực nội sọ + ARDS. Họ đã phân tích CT-scan phổi của từng nhóm. Tăng áp lực nội sọ đơn thuần làm tăng mật độ phổi và làm trầm trọng thêm sự gia tăng mật độ phổi ở lợn mắc ARDS. Hơn nữa, tỷ lệ khí-mô của phổi đã giảm do tăng áp lực nội sọ ở phổi bình thường và bị tổn thương với sự gia tăng của các khu vực phổi được sục khí và phổi xẹp. Những tổn thương CT-scan phổi này đã trở nên trầm trọng hơn do tăng áp lực nội sọ [74].
Cơn bão catecholamine, kết hợp với phản ứng viêm não và toàn thân (cú đấm đầu tiên) tạo ra một môi trường viêm dẫn đến sự nhạy cảm của phổi đối với các sự kiện gây tổn thương thêm (cú đấm thứ hai). Con đường này có thể là giường cho chấn thương phổi ở bệnh nhân bị tổn thương não cấp tính. Tuy nhiên, dòng thác viêm này không chỉ xảy ra theo một cách: từ não đến phổi, mà còn từ phổi đến não.
Trục hạ đồi-tuyến yên-thượng thận
Từ vài năm nay, trục hạ đồi-tuyến yên- thượng thận (HPA, Hypothalamo-pituitary adrenal axis) đã được khám phá trong các nghiên cứu thử nghiệm và lâm sàng và nó có thể tham gia vào rối loạn chức năng phổi. Thật vậy, nó có tác dụng chính đối với căng thẳng (stress) và phản ứng viêm toàn thân sau chấn thương [80,81]. Trong giai đoạn đầu của chấn thương, các chất trung gian gây viêm, như IL-6, kích hoạt trục HAP ồ ạt để gây ra chứng cường cortisone ban đầu, tác nhân chính của hội chứng đáp ứng viêm bù trừ [80,82,83]. Hypercortisolism này cho phép giảm tác dụng phụ của phản ứng viêm, vì nó lan rộng trong cơ thể và bảo vệ các cơ quan khác [81,84]. Hơn nữa, glucocorticoids nội sinh kích thích miễn dịch chống nhiễm trùng [85] và trục HAP có vai trò chính trong phản ứng huyết động và duy trì huyết áp [86,87]. Sau TBI, 25- 50% bệnh nhân bị suy thượng thận thứ phát cấp tính [88-91]. Những bệnh nhân này có kết quả xấu hơn và tiên lượng thần kinh, áp lực động mạch thấp hơn, sử dụng thuốc vận mạch lớn hơn và tỷ lệ tử vong cao hơn [88,89,92,93]. Hơn nữa, suy tuyến thượng thận do chấn thương có liên quan đến hội chứng đáp ứng viêm toàn thân [94]. Bệnh nhân suy thượng thận có nồng độ IL-6 huyết tương cao dài hơn so với bệnh nhân có đáp ứng tuyến thượng thận bình thường với stress [89,95]. Ở những bệnh nhân đa chấn thương, sự tồn tại của nồng độ IL-6 trong huyết tương cao vào ngày thứ 7 có liên quan đến tỷ lệ tử vong cao hơn và tỷ lệ mắc bệnh viêm phổi [96].
Sự tồn tại của hội chứng đáp ứng viêm toàn thân dường như được dự đoán là nhiễm trùng bệnh viện ở bệnh nhân chấn thương [97,98]. Lý thuyết chính là suy tuyến thượng thận thứ phát khiến bệnh nhân bị ảnh hưởng nghiêm trọng của viêm hệ thống không kiểm soát được với suy giảm miễn dịch, nhiễm trùng bệnh viện, đặc biệt là VAP và phản ứng viêm quá mức [90,98,99]. Vì vậy, rối loạn chức năng trục HAP này có thể tham gia làm suy yếu phổi sau TBI.
Một thử nghiệm ngẫu nhiên đa trung tâm đã báo cáo ở 150 bệnh nhân đặt nội khí quản bị chấn thương nặng và thiếu corticosteroid, giảm nguy cơ viêm phổi mắc phải tại bệnh viện với liều stress hydrocortisone, đặc biệt ở nhóm phụ bệnh nhân mắc TBI nặng [100]. Tuy nhiên, kết quả này không được xác nhận với thử nghiệm gần đây ở những bệnh nhân mắc TBI nặng [101]. Suy giảm miễn dịch do đột quỵ đã được mô tả với các bất thường liên quan đến trục HAP sau đột quỵ thiếu máu cục bộ cấp tính [102] và có lẽ liên quan đến tỷ lệ mắc bệnh viêm phổi cao [103].
Phổi đến não
Một con đường phức tạp trong suốt hệ thống tự trị, viêm thần kinh, thần kinh nội tiết và miễn dịch đã được mô tả. Con đường này có liên quan đến sinh lý bình thường để góp phần duy trì cân bằng nội môi, nhưng có thể dẫn đến tác dụng phụ [104]. Hai thành phần có thể liên quan đến con đường phổi đến não này: bản thân chấn thương phổi, như ARDS và thở máy.
Chấn thương phổi do cài đặt máy thở không đủ, có thể dẫn đến phản ứng viêm, ban đầu nằm trong nhu mô phổi. Nhưng điều này có thể mở rộng đến tuần hoàn hệ thống và sau đó đến các cơ quan khác và não. Suy đa tạng có thể xảy ra do chấn thương phổi [105]. Nguyên nhân chính gây tử vong ở bệnh nhân mắc ARDS là do suy đa tạng và không bị thiếu oxy hoặc rối loạn chức năng phổi [106]. Người ta đã mô tả rõ rằng những người sống sót ARDS bị suy giảm nhận thức bao gồm suy giảm trí nhớ, ngôn ngữ và nhận thức [107-109] và bệnh nhân thở máy trong thời gian dài bị suy yếu thần kinh với trí nhớ và thay đổi nhận thức [110]. Hồi hải mã, liên quan đến quá trình học tập và trí nhớ, đặc biệt dễ bị thiếu oxy [111]. Tuy nhiên, ARDS có thể dẫn đến chấn thương vùng đồi thị với khiếm khuyết trí nhớ, bất kể mức độ thiếu oxy [112]. ARDS, theo cách tương tự như sốc nhiễm trùng, có thể gây ra tổn thương thần kinh. Nguyen et al [113] đã nghiên cứu 170 bệnh nhân nhiễm trùng huyết nặng hoặc sốc nhiễm trùng trong một nghiên cứu tiền cứu. Họ đã tìm thấy sự gia tăng chỉ số gây tổn thương não do protein S-100β và enolase đặc hiệu cho tế bào thần kinh (NSE) tương ứng là 42% và 53% trong số những bệnh nhân này [114]. Nồng độ protein S-100β cao đã được báo cáo ở những bệnh nhân giảm ý thức và bệnh não. Trong các mô hình ARDS của lợn (mô hình rửa), nồng độ protein S-100β cao hơn đáng kể so với ở lợn bị thiếu oxy gây ra do rửa hơn so với khi thiếu oxy được tạo ra bằng cách giảm tỷ lệ oxy hít vào [115]. Hơn nữa, những thay đổi mô bệnh học ở vùng hải mã chỉ xảy ra ở những con lợn mắc ARDS. Các tác giả cho rằng tổn thương não chỉ có thể được quan sát trong ARDS một cách độc lập với tình trạng thiếu oxy. S-100β protein và NSE có thể đại diện cho chấn thương não và thay đổi BBB ở bệnh nhân mắc ARDS [113]. Tính thấm của cả hàng rào máu não và phổi có thể bị thay đổi bởi các tình huống sinh lý bệnh và cho phép giao tiếp giữa não và phổi [116].
Chấn thương phổi có thể làm nặng thêm sự nhạy cảm của não với các chấn thương cấp tính. Trong nghiên cứu trước đây của họ, Heuer và cộng sự [74] đã báo cáo tổn thương não ở lợn chỉ có ARDS và tác dụng hiệp đồng đối ứng giữa phổi và não với tình trạng tổn thương não trong nhóm bị ARDS + tăng áp lực nội sọ [74]. Thật vậy, oxy hóa mô não (PtiO2) và mật độ mô não (phản ánh phù não) giảm ở tất cả các động vật (tăng áp lực nội sọ, ARDS và ARDS + tăng áp lực nội sọ) so với nhóm đối chứng. Nồng độ protein NSE và S- 100β tăng đáng kể ở tất cả các loài động vật so với nhóm đối chứng, nhưng mức tăng rõ rệt nhất là ở nhóm có ARDS, như đối với IL-1β và IL-6. Vì vậy, ARDS có thể làm trầm trọng thêm tổn thương não trong tăng áp lực nội sọ cấp tính. Hegeman et al [105] đã mô tả, sau khi bị stress và strain ở phổi, viêm phế nang, huy động bạch cầu trung tính và sản xuất các cytokine. Các tế bào nội mô, được kích hoạt bởi các cytokine, tiết ra các chemokine và thể hiện các phân tử bám dính trên bề mặt của chúng, dẫn đến tăng cường độ bám của bạch cầu và sự di chuyển của các tế bào miễn dịch hoạt động trên nội mô [105]. Viêm cục bộ này sau đó có thể lan vào hệ thống tuần hoàn. Viêm phổi có thể lan đến hệ thống não thông qua con đường thể dịch, tế bào và thần kinh [116].
Ngoài chấn thương phổi, các chiến lược thở máy, được sử dụng hàng ngày trong ICU, có thể làm giảm lưu lượng máu khu vực và oxy hóa não. Thật vậy, Bickenbach et al [117] đã nghiên cứu PtiO2 và chuyển hóa não trong mô hình ARDS của lợn trong hơn 8 giờ. Lợn được chọn ngẫu nhiên theo 2 nhóm: thể tích khí lưu thông thấp (LT) (6 mL/kg) và thể tích khí lưu thông cao (HT) (12 mL/kg) [117]. Không có sự khác biệt giữa hai nhóm được tìm thấy về PaO2, PaCO2 và pH. ARDS gây ra sự sụt giảm đáng kể PtiO2 ở cả hai nhóm, nhưng PtiO2 tăng đáng kể ở 4 và 8 giờ ở nhóm LT so với nhóm HT. Lactate trong microdialysis cao hơn trong nhóm HT lúc 2, 4 và 8 giờ. Sau 2 giờ, mức protein S-100 bị co thắt giảm ở nhóm LT và IL-6 tăng ở nhóm HT. Do đó, thông khí thể tích LT đã cải thiện oxy hóa mô não so với thông khí thể tích HT trong ARDS. Thông khí thể tích HT có thể làm tăng phản ứng viêm và có thể làm giảm quá trình oxy hóa và chuyển hóa não. Quilez et al [118] đã nghiên cứu ảnh hưởng của Vt đến việc kích hoạt ở các vùng não trong mô hình chuột của MV với biểu hiện c-fos, một dấu hiệu kích hoạt tế bào thần kinh. Họ đã chọn ngẫu nhiên 3 nhóm chuột khỏe mạnh: cơ bản (không được thở máy), Vt thấp (8 mL/kg và PEEP là 0 cmH2O) và Vt cao (30 mL/kg và PEEP của 0 cmH2O). Phản ứng viêm (TNF-α) và biểu hiện c-fos ở vỏ võng mạc và đồi thị cao hơn ở nhóm Vt cao so với nhóm Vt thấp [118]. Vì vậy, thiết lập thông khí cơ học có thể ảnh hưởng trực tiếp đến não, rất có thể thông qua các chất trung gian gây viêm. Những dữ liệu này nhấn mạnh tầm quan trọng của cài đặt máy thở ở bệnh nhân thở máy và đặc biệt ở bệnh nhân bị chấn thương não.
Cuộc xung đột giữa phổi và não
Thông khí cơ học cho phép cung cấp oxy và loại bỏ carbon dioxide (CO2) với sự kiểm soát chặt chẽ PaO2 và PaCO2, mục tiêu là ngăn ngừa thiếu máu não thứ phát và tăng kết cục thần kinh.
Để ngăn chặn hoặc hạn chế tổn thương phổi do thông khí (VILI), khái niệm thông khí bảo vệ đã được phát triển bằng cách sử dụng Vt thấp, áp suất cao nguyên < 30 cmH2O và mức PEEP đầy đủ [119]. VILI đã được mô tả là kết quả của 3 cơ chế: volotrauma, atelectrauma và biotrauma [120,121]. Volotrauma là kết quả của sự tăng quá mức nhu mô phổi với Vt cao. Kết quả atelectrauma từ việc huy động phế nang phế nang do mức PEEP không đủ. Biotrauma xuất phát từ một quá trình viêm cục bộ do lượng khí lưu thông quá lớn và các đơn vị phổi đóng mở lặp đi lặp lại. Tuy nhiên, hầu hết các nghiên cứu đã tăng cường chiến lược thông khí ở bệnh nhân ARDS đã loại trừ bệnh nhân bị chấn thương não [122-124]. Khái niệm về việc mở phổi và giữ cho nó mở ra cho ARDS với chỉ số Vt thấp, PEEP và huy động cao, với chứng tăng huyết áp cho phép có thể gây ra hậu quả nghiêm trọng trên não và những người chuyên sâu thường sợ sử dụng một số phần của thông khí bảo vệ bệnh nhân chấn thương sọ não.
Thể tích khí lưu thông
Việc sử dụng Vt thấp làm giảm các phản ứng viêm toàn thân và phổi ở bệnh nhân mắc ARDS [124-126] mà còn ở những bệnh nhân có quá trình viêm như hít sặc, nhiễm trùng huyết, viêm phổi hoặc chấn thương [127,128]. Mascia và cộng sự [30] đã báo cáo rằng tỷ lệ ARDS ở bệnh nhân mắc TBI nặng tăng lên với cài đặt thể tích khí lưu thông ban đầu (Vt) cao hơn trong mối quan hệ đáp ứng liều [30]. Việc quản lý máy thở của bệnh nhân mắc TBI nặng dường như là một điểm chính của sự phát triển ARDS. Như chúng tôi đã mô tả trước khi Vt cao có thể ảnh hưởng đến não và có thể là một sự kiện gây thương tích (cú đánh thứ hai) trong phổi đặc biệt nhạy cảm do chấn thương não. Không có nghiên cứu trong tương lai về việc sử dụng Vt thấp ở bệnh nhân TBI. Tuy nhiên, gần đây, Krebs et al [129] đã báo cáo ở những con chuột bị tổn thương não rất nặng sử dụng Vt thấp (6 mL/kg) với PEEP phổi mở (đặt theo độ đàn hồi tĩnh tối thiểu của hệ hô hấp) so với Vt cao ( 12 mL/kg) và PEEP thấp, cải thiện oxy hóa, làm giảm tổn thương phổi theo mô học, phân tích bộ gen và phản ứng chuỗi polymerase định lượng thời gian thực với sự giảm IL-6 [129].
Thông khí cơ học bảo vệ cho ARDS bao gồm Vt thấp (6 mL/kg PBW) và sau đó thông khí phút thấp, do đó tăng CO2 máu cho phép. Tác dụng não của tăng CO2 máu đã được biết đến (giãn mạch) và nên tránh trong trường hợp tăng áp lực nội sọ [130]. Mục tiêu để quản lý TBI nặng là duy trì PaCO2 trong khoảng 35 đến 40 mmHg [131] nhưng mục tiêu này đôi khi không thể thực hiện được khi sử dụng thông khí cơ học bảo vệ phổi. Quản lý cá nhân với giám sát thần kinh có thể cho phép chúng tôi, trong những trường hợp khó khăn cụ thể, sử dụng giá trị cao hơn của PaCO2 và giám sát tác động của nó đối với cân bằng nội môi não. Một nghiên cứu hồi cứu nhỏ ở 12 bệnh nhân mắc SAH và ARDS báo cáo không tăng ICP khi thở máy bảo vệ phổi và tăng CO2 máu (50-60 mmHg) [132]. Gần đây, Westermaier et al [133] đã thực hiện tăng dần PaCO2 lên 40, 50 và 60 mmHg ở những bệnh nhân bị SAH kém. Lưu lượng máu não và bão hòa oxy mô não (StiO2) phản ứng với duy trì mức độ cao mà không tăng áp lực nội sọ [133].
PEEP
Áp dụng PEEP là một phần của thông khí cơ học bảo vệ để huy động phế nang bị sụp đổ, cải thiện PaO2 và độ giãn nở phổi [134]. Tuy nhiên, việc sử dụng PEEP có thể làm thay đổi lưu lượng máu não bằng cách điều trị lại qua trung gian CO2 và huyết động [135,136]. Do đó, Pelosi và cộng sự [13] đã báo cáo trong một nghiên cứu đa trung tâm quan sát tiền cứu rằng hơn 80% bệnh nhân thần kinh trong ICU được thở máy với PEEP ≤ 5 cmH2O [13]. PEEP là cần thiết để ngăn chặn sự sụp đổ và/hoặc huy động phế nang bị sụp đổ và do đó làm giảm xẹp phổi, đặc biệt là khi sử dụng Vt thấp. Ứng dụng của nó cũng là một điểm quan trọng của thông khí bảo vệ.
Một số nghiên cứu báo cáo tác dụng của PEEP đối với huyết động học não. Mascia et al [137] áp dụng ngẫu nhiên PEEP ở mức 5 và 10 cmH2O ở 12 bệnh nhân bị chấn thương não với ARDS. Những bệnh nhân được đáp ứng đã giảm độ đàn hồi và tăng PaO2, trong khi những bệnh nhân không đáp ứng có sự tăng độ đàn hồi và PaCO2. Áp lực nội sọ và bão hòa tĩnh mạch cảnh là không đổi ở các người có thể huy động nhưng tăng ở những người không huy động cho thấy những ảnh hưởng xấu trong nhóm này [137]. Do đó, việc sử dụng PEEP ở bệnh nhân bị chấn thương não dường như an toàn khi bệnh nhân đáp ứng với mức PEEP (tức là không tạo ra tình trạng quá căng phế nang, tăng khoảng chết và PaCO2) [138]. Khi PEEP gây ra sự huy động phổi, áp lực nội sọ và tưới máu não không thay đổi, và PaO2 tăng [1]. PEEP có thể được sử dụng an toàn và có thể phải được sử dụng ở những bệnh nhân bị chấn thương não nếu PEEP tối ưu được tìm kiếm và điều chỉnh riêng lẻ, như đối với bệnh nhân mắc ARDS và não khỏe mạnh.
Muench et al [139] đã kiểm tra ảnh hưởng của mức độ PEEP đến áp lực nội sọ, PtiO2, lưu lượng máu não và huyết động học toàn thân ở lợn khỏe mạnh và bệnh nhân mắc SAH [139]. Mức độ PEEP cao không ảnh hưởng đến các thông số não ở lợn. Ở những bệnh nhân bị SAH, những thay đổi trong lưu lượng máu não khu vực đã được báo cáo, kết quả từ sự thay đổi áp lực động mạch và thay đổi tự động não. Bình thường hóa áp lực hệ thống phục hồi lưu lượng máu não. Gần đây, Schramm et al [140] đã đo lưu lượng máu não ở 20 bệnh nhân mắc ARDS. Sự gia tăng PEEP từ 9 đến 14 cmH2O không ảnh hưởng đến tốc độ dòng máu. Caricato et al [141] đã kiểm tra ảnh hưởng của việc độ giãn nở hệ hô hấp đối với các tác động nội sọ của PEEP. Không có tác động đến huyết động học hệ thống và não được báo cáo với 0, 5, 8 hoặc 12 cmH2O PEEP [141]. Việc sử dụng PEEP dường như an toàn, nếu huyết áp động mạch được duy trì. Đẳng thể tích có lẽ là một điều kiện có thể giảm thiểu ảnh hưởng của PEEP đối với huyết áp động mạch [139,142,143].
Hơn nữa, một số tác giả khuyến nghị tối ưu hóa độ cao của đầu giường để tăng cường dẫn lưu tĩnh mạch não qua hệ thống tĩnh mạch đốt sống, không phải chịu áp lực nội sọ và duy trì PEEP thấp hơn ICP để hạn chế can thiệp với dòng chảy tĩnh mạch [1,144,145].
Một giám sát chính xác các thông số vĩ mô, hệ hô hấp và não là cần thiết để tối ưu hóa việc sử dụng PEEP ở bệnh nhân chấn thương não.
Huy động
Một số nghiên cứu ở bệnh nhân điều trị ARDS khuyến nghị huy động (RM) để huy động phế nang phổi bị xẹp và mở phổi theo PEEP thích hợp để duy trì việc huy động phổi dẫn đến cải thiện oxy và độ giãn nở hệ hô hấp [146,147]. Tuy nhiên, vì những lý do tương tự như PEEP, RM có thể làm giảm huyết áp động mạch và tăng ICP bằng cách can thiệp vào máu trở lại tĩnh mạch và gây ra sự gia tăng áp lực nội sọ [137]. Bein et al [148] đã báo cáo ở 11 bệnh nhân bị tổn thương não nghiêm trọng (do chấn thương và không chấn thương) và ARDS, tác dụng của RM, bao gồm duy trì 60 cmH2O trong 30 giây [148]. Họ đã ghi nhận sự gia tăng ICP, giảm áp lực động mạch trung bình, áp lực tưới máu não (< 65 mmHg) và độ bão hòa oxy của tĩnh mạch cảnh (< 55%) vào cuối RM. Sự cải thiện oxy hóa động mạch đã được báo cáo ngay sau RM nhưng không được duy trì sau đó. Do đó, các tác giả đã không đề nghị thủ thuật huy động này. Tác động lên lưu lượng máu não và áp lực nội sọ phụ thuộc vào khả năng chịu đựng huyết động của RM. Tái thông khí của các đơn vị phổi không chỉ phụ thuộc vào áp suất bơm mà còn phụ thuộc vào thời gian áp lực duy trì (tích số của áp lực x thời gian bơm hơi) [149- 151]. Constantin et al [146] đã so sánh 2 RM: áp lực đường thở liên tục (CPAP) với 40 cmH2O trong 40 giây và nhịp thở sâu (eSigh) với PEEP duy trì ở mức 10 cmH2O trên điểm uốn dưới 15 phút [146]. Họ báo cáo rằng chỉ có eSigh tăng thể tích được huy động và eSigh được dung nạp tốt hơn về mặt huyết động so với CPAP và gây ra sự gia tăng oxy hóa động mạch lớn hơn và kéo dài hơn. Hơn nữa, phản ứng với RM dường như phụ thuộc vào hình thái phổi. Bệnh nhân mất sục khí lan tỏa đáp ứng nhanh hơn so với bệnh nhân mất sục khí khu trú [152]. Các thông số này phải được xem xét trước khi sử dụng RM. Do đó, eSigh có thể thích nghi tốt hơn với những bệnh nhân bị chấn thương não nghiêm trọng do khả năng chịu đựng huyết động tốt hơn. Nemer et al [153] đã so sánh 2 RM: CPAP ở 35 cmH2O trong 40 giây và PEEP là 15 cmH2O và kiểm soát áp suất trên PEEP là 35 cmH2O trong 2 phút ở bệnh nhân SAH và ARDS [153]. Huy động CPAP dẫn đến áp lực nội sọ cao hơn (> 20 mmHg) và áp lực tưới máu não thấp hơn (< 65 mmHg). Trong một nghiên cứu khác, 28 RM đã được thực hiện ở 9 bệnh nhân bị ARDS và chấn thương sọ não theo từng bước với mức tăng 3 cmH2O và giảm PEEP. Không có sự khác biệt đáng kể được tìm thấy đối với áp lực động mạch trung bình, áp lực nội sọ và áp lực tưới máu não sau các RM so với giá trị cơ bản [154]. Do đó, việc sử dụng RM có thể an toàn và khả thi với sự giám sát chặt chẽ các thông số hệ thống và não và sử dụng các thao tác tiến bộ và mềm.
Wolf và cộng sự [155] đã đánh giá tính khả thi của phương pháp tiếp cận phổi mở với thể tích khí lưu thông thấp, mức PEEP và RM cao ở 13 bệnh nhân bị chấn thương não cấp tính và ARDS [155]. Họ đã báo cáo mức giảm FiO2 từ 0,85 xuống 0,55, 24 giờ sau lần đầu tiên với mức tăng PaO2/FiO2 từ 142 xuống còn 257. Song song, áp lực nội sọ, PaCO2 và PtiO2 vẫn ổn định. Các tác giả kết luận rằng thông khí bảo vệ là an toàn ở bệnh nhân phẫu thuật thần kinh và cải thiện oxy mà không có tác dụng phụ.
Nằm sấp
Nằm sấp sử dụng trong 30 năm ở bệnh nhân mắc ARDS. Nó đã được chứng minh là làm tăng quá trình oxy hóa với các cơ chế khác nhau như huy động ròng, phân phối đồng nhất hơn về bơm phồng phế nang và bảo vệ VILI. Lợi ích về kết quả và tỷ lệ tử vong đã được thể hiện trong ARDS thiếu oxy nghiêm trọng nếu sử dụng đủ thời gian của nằm sấp [156-158]. Quản lý hô hấp này đã được nghiên cứu một cách thưa thớt ở những bệnh nhân bị chấn thương não. Một số tác giả đã báo cáo các trường hợp hoặc một loạt các nằm sấp [159-161]. Reinprecht và cộng sự [159] đã phân tích ảnh hưởng của vị trí này ở 16 bệnh nhân bị SAH và ARDS nặng. Họ đã báo cáo sự gia tăng đáng kể PaO2 và PtiO2 với mức tăng đáng kể, nhưng không gây khó chịu, tăng áp lực nội sọ và giảm áp lực tưới máu não [159]. Một báo cáo trường hợp bệnh nhân bị chấn thương nặng ở ngực và não cho thấy sự cải thiện oxy với mức độ vừa phải, nhưng rất thoáng qua, tăng áp lực nội sọ sau 20 giờ ở nằm sấp [161].

Bảng 1 tóm tắt ảnh hưởng của các phần khác nhau của thông khí bảo vệ lên huyết động và chuyển hóa não.
Các phương pháp thay thế để kiểm soát CO2 chặt chẽ và thiếu oxy kháng trị như thông khí dao động tần số cao và kỹ thuật hỗ trợ phổi ngoài cơ thể (hỗ trợ phổi ngoài cơ thể và oxy hóa màng ngoài cơ thể) đã được đánh giá kém ở bệnh nhân chấn thương đầu [145].
Quản lý lâm sàng bệnh nhân tổn thương phổi trong bệnh nhân tổn thương não
Trong thực hành lâm sàng, thực tế không có khuyến nghị nào cho chiến lược máy thở của bệnh nhân bị chấn thương não ngoại trừ các mục tiêu PaO2 và PaCO2 [131].
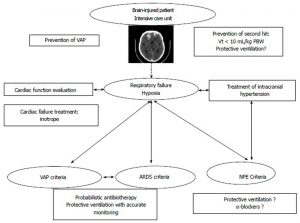
Điều trị VAP không đặc hiệu cho bệnh nhân chấn thương sọ não nhưng điều quan trọng cần lưu ý là phòng ngừa dường như là một điểm quan trọng. Điều trị VAP phải được bắt đầu nhanh chóng vì VAP có liên quan đến tỷ lệ tử vong cao hơn và kết cục thần kinh kém. Nó có thể tuân theo các hướng dẫn đối với bệnh viện và VAP [162]. Các yếu tố nguy cơ của VAP ở bệnh nhân chấn thương não là rất nhiều và các biện pháp phòng ngừa phải tập trung vào những điều này, bao gồm chăm sóc răng miệng [23,103,163]. Tỷ lệ VAP cao ở bệnh nhân chấn thương não, một phần, được giải thích bởi thời gian thở máy kéo dài [164]. Vì vậy, Roquilly và cộng sự [165] đã báo cáo trước/sau khi đánh giá gói (bundle) sẵn sàng rút ống, giảm thời gian thở máy ở bệnh nhân chấn thương sọ não [165]. Các thành phần gói là (1) thông khí bảo vệ (Vt: 6-8 mL/kg PBW, PEEP > 3 cmH2O) (2) dinh dưỡng đường ruột sớm (ngày bắt đầu 1 và 25 kCal/kg mỗi ngày trước ngày 3) (3) tối ưu hóa xác suất điều trị bằng kháng sinh cho VAP và (4) phương pháp rút ống có hệ thống (cai máy thở và loại bỏ ống nếu thang điểm hôn mê Glasgow 10 và ho). Mặc dù độ tuân thủ các yếu tố gói chỉ 21% trong giai đoạn can thiệp, họ đã quan sát thấy giảm thời gian thở máy, tốc độ VAP và tốc độ rút ống ngoài ý muốn so với pha quan sát kiểm soát. Trong đột quỵ cấp tính, biện pháp chính là tránh dinh dưỡng đường miệng cho đến khi nuốt được đánh giá và xác nhận [166-168]. Không có sự khác biệt giữa mở thông dạ dày qua da hoặc ống thông mũi về tỷ lệ viêm phổi nhưng mở thông dạ dày qua da dường như an toàn và hiệu quả hơn khi cho ăn [169]. Đối với TBI, trước tình trạng suy tuyến thượng thận do chấn thương, việc sử dụng steroid liều stress trong quá trình điều trị ban đầu vẫn còn được tranh luận để phòng ngừa VAP nhưng tài liệu không cho phép trả lời [101].
Liên quan đến NPE, một số nghiên cứu đã báo cáo điều trị cụ thể ở người. Một số nghiên cứu trên động vật đã tập trung vào điều trị ức chế α để hạn chế xuất tiết giao cảm lớn sau chấn thương não [48,170]. Hai trường hợp NPE ở người đã được công bố về việc sử dụng thuốc chẹn adrenergic (phentolamine hoặc chlorpro- mazine) và điều trị thành công với việc cải thiện tình trạng mất ổn định huyết động và oxy hóa [171,172]. Nghiên cứu sâu hơn là cần thiết để khám phá theo cách này. Nhưng điểm mấu chốt của quản lý NPE là điều trị các chấn thương não tiềm ẩn để giảm ICP, giảm thiểu xuất tiết giao cảm và cải thiện oxy hóa [41,48].
Liên quan đến ARDS, thông khí bảo vệ đã được thảo luận chủ yếu trong phần trước. Một giám sát chính xác các thông số vĩ mô, hô hấp và não là cần thiết để tối ưu hóa việc quản lý.
Khi một bệnh nhân bị chấn thương não biểu hiện thiếu oxy, tất cả các chẩn đoán gợi lên trong tổng quan này có thể được thảo luận. Hình 2 tóm tắt các bước khác nhau trong quản lý và phòng ngừa suy hô hấp ở bệnh nhân bị chấn thương não. Phản ứng của hệ thống tim phổi rất khác nhau giữa các bệnh nhân bị chấn thương não (chấn thương cơ tim trực tiếp, cơ chế không gây bệnh tim mạch, v.v.). Vì vậy, trước hết, điều quan trọng là phải đánh giá chức năng tim để điều chỉnh quản lý của chúng tôi và bắt đầu điều trị suy tim nếu cần thiết. Hơn nữa, bình thường hóa ICP là một bước quan trọng để giảm xuất tiết giao cảm và hậu quả của nó. Các tiêu chí của VAP, ARDS và NPE phải được nghiên cứu và đối với một số bệnh nhân trong đó sự khác biệt giữa NPE và ARDS có thể khó khăn, việc đo cate- cholamine trong huyết thanh có thể hữu ích [48].
Phần kết luận
Não và phổi tương tác mạnh mẽ thông qua các con đường phức tạp. Trong trường hợp chấn thương não, các chiến lược điều trị nên bảo vệ não nhưng cũng là bảo vệ phổi để tránh làm xấu đi cả rối loạn chức năng não và phổi. Nếu được áp dụng đúng cách, thở máy có thể có tác dụng có lợi cho quá trình oxy hóa não, ngay cả khi sử dụng PEEP và thao tác huy động. Các nghiên cứu thực nghiệm và lâm sàng là cần thiết để khám phá các quá trình sinh lý bệnh và đánh giá thiết lập máy thở tối ưu ở những bệnh nhân bị chấn thương não với chấn thương phổi. Một giám sát chặt chẽ các thông số hệ thống, hô hấp và não có lẽ là cần thiết để tối ưu hóa việc quản lý những bệnh nhân này.