Bài viết Hướng dẫn ESC/EAS 2019 về quản lý rối loạn lipid máu: Điều chỉnh lipid để giảm nguy cơ tim mạch được dịch bởi Bác sĩ Nguyễn Thành Luân – ICU bệnh viện Hoàn Mỹ Cửu Long từ bài gốc 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS).
Nhóm chuyên trách về quản lý rối loạn lipid máu của Hiệp hội Tim mạch Châu Âu và Hiệp hội Xơ vữa Động mạch Châu Âu
Lời tựa
Quý III năm 2019, Hiệp hội Tim mạch học Châu Âu công bố đồng thời năm khuyến cáo Hướng dẫn chẩn đoán và quản lý những rối loạn liên quan đến tim mạch và chuyển hóa. Các khuyến cáo này có tương tác với nhau đáng kể. Để quản lý tốt các vấn đề tim mạch-chuyển hóa đòi hỏi phải đọc đồng thời các khuyến cáo này để phối hợp điều trị cho những người có nhiều rối loạn đồng mắc.
Chúng ta đang ở kỷ nguyên cá thể hóa điều trị, vì vậy việc hiểu sâu sắc các khuyến cáo sẽ góp phần rất lớn đạt được những mục tiêu điều trị cụ thể cho từng bệnh nhân. Cùng nhau, chúng tôi chuyển thể toàn bộ các bài toàn văn Hướng dẫn của ESC sang Tiếng Việt để, các đồng nghiệp ở nơi chúng tôi làm việc, thuận tiện hơn khi tham khảo, thống nhất trong thực hành lâm sàng.
Các bản dịch này chúng tôi lưu hành nội bộ.
1. Lời nói đầu
Hướng dẫn tóm tắt và đánh giá bằng chứng hiện có với mục đích hỗ trợ các chuyên gia y tế trong việc đề xuất các chiến lược quản lý tốt nhất cho một bệnh nhân cụ thể với một bệnh cảnh nhất định. Các hướng dẫn và khuyến cáo này sẽ hỗ trợ cho các chuyên gia y tế ra quyết định trong thực hành hàng ngày của họ. Tuy nhiên, các quyết định cuối cùng liên quan đến từng bệnh nhân cần phải thảo luận ý kiến với bệnh nhân và người chăm sóc của họ khi thích hợp.
Một số lượng lớn các hướng dẫn đã được ban hành trong những năm gần đây bởi Hiệp hội Tim mạch Châu Âu (ESC) và các hiệp hội liên quan như Hiệp hội Xơ vữa Động mạch Châu Âu (EAS), cũng như bởi các tổ chức khác. Do tác động của chúng đối với thực hành lâm sàng, các tiêu chí chất lượng để xây dựng hướng dẫn đã được thiết lập nhằm làm cho tất cả các quyết định trở nên rõ ràng. Có thể tìm thấy các khuyến cáo cho việc xây dựng và ban hành Hướng dẫn ESC trên trang web của ESC (http://www.escardio.org/Guidelines-&-Education/Clinical-Practice- Guidelines/Guidelines-development/Writing-ESCGuidelines). Hướng dẫn ESC thể hiện vai trò chính thức của ESC về một chủ đề nhất định và được cập nhật thường xuyên.
ESC thực hiện một số nghiên cứu rất cần thiết để đánh giá các quá trình chẩn đoán/điều trị, sử dụng các nguồn lực và việc tuân thủ các Hướng dẫn. Các nghiên cứu này nhằm mục đích cung cấp sự hiểu biết tốt hơn về thực hành y khoa ở Châu Âu và trên toàn thế giới, dựa trên dữ liệu được thu thập trong quá trình thực hành lâm sàng thông thường.
Các hướng dẫn được phát triển cùng với tài liệu giáo dục phái sinh để giải quyết nhu cầu văn hóa và chuyên nghiệp cho các chuyên gia tim mạch và các chuyên gia thuộc những chuyên ngành gần. Thu thập dữ liệu quan sát chất lượng cao, vào khoảng thời gian thích hợp sau khi công bố Hướng dẫn ESC, sẽ giúp đánh giá mức độ thực hiện Hướng dẫn, đánh giá mức độ ưu tiên của các kết cục quan trọng được xác định bởi Ủy ban giáo dục và Hướng dẫn ESC và các thành viên của Nhóm chuyên trách.
Các Thành viên của Nhóm chuyên trách này đã được ESC và EAS lựa chọn, bao gồm đại biểu từ các nhóm chuyên khoa sâu của ESC, để đại diện cho những người tham gia vào việc chăm sóc y tế cho những bệnh nhân mắc bệnh lý này. Các chuyên gia được lựa chọn trong lĩnh vực từ cả hai hiệp hội đã tiến hành đánh giá toàn diện các bằng chứng được công bố để quản lý một bệnh cảnh nhất định theo chính sách của Ủy ban ESC về Hướng dẫn Thực hành (CPG). Một đánh giá quan trọng về các quy trình chẩn đoán và điều trị đã được thực hiện, bao gồm đánh giá tỷ số nguy cơ – lợi ích. Mức độ bằng chứng và sức mạnh khuyến cáo của các tùy chọn quản lý cụ thể đã được cân nhắc và phân loại theo thang điểm ESC xác định từ trước, như được nêu trong các bảng dưới đây.
Các chuyên gia của hội đồng viết và đánh giá đã cung cấp các biểu mẫu cần thiết cho tất cả các mối quan hệ có thể được xem là nguồn xung đột lợi ích thực sự hoặc tiềm năng. Các biểu mẫu này được tổng hợp thành một tệp và có thể tìm thấy trên trang web ESC (http://www.escardio.org/guidelines). Mọi thay đổi trong tuyên bố về lợi ích phát sinh trong thời gian viết đã được thông báo cho Chủ tịch ESC và EAS và được cập nhật. Nhóm chuyên trách đã nhận toàn bộ hỗ trợ tài chính từ ESC và EAS mà không có bất kỳ sự tham gia nào từ ngành công nghiệp chăm sóc sức khỏe.
ESC CPG giám sát và điều phối việc chuẩn bị các Hướng dẫn mới. Ủy ban cũng chịu trách nhiệm về quy trình chứng thực của các Hướng dẫn này. Hướng dẫn ESC trải qua đánh giá sâu rộng của CPG và các chuyên gia bên ngoài. Sau khi sửa đổi cho phù hợp, Hướng dẫn được tất cả các chuyên gia tham gia Nhóm chuyên trách phê duyệt. Tài liệu hoàn thiện được CPG và EAS phê duyệt để công bố trên Tạp chí Tim mạch Châu Âu và Tạp chí Xơ vữa Động mạch Châu Âu. Hướng dẫn được phát triển sau khi xem xét cẩn thận các kiến thức khoa học và y khoa cũng như bằng chứng hiện có tại thời điểm họ triển khai cuộc họp.
Nhiệm vụ phát triển Hướng dẫn ESC/EAS cũng bao gồm việc tạo ra các công cụ giáo dục và chương trình thực hiện khuyến cáo, kể cả các phiên bản hướng dẫn bỏ túi cô đọng, trang trình bày tóm tắt, sổ tay với thông điệp cần thiết, thẻ tóm tắt cho người không chuyên và phiên bản điện tử cho các ứng dụng số (điện thoại thông minh, v.v.). Các phiên bản này được rút ngắn, nếu muốn có thông tin chi tiết hơn, người dùng phải truy cập phiên bản Hướng dẫn toàn văn, hiện có miễn phí thông qua các trang web ESC và EAS cũng như được lưu trữ trên các trang web tạp chí chuyên ngành (Tạp chí EHJ và Xơ vữa Động mạch). Các Hiệp hội Tim mạch Quốc gia của ESC được khuyến khích xác nhận, dịch và thực hiện tất cả các Hướng dẫn ESC. Cần phải có các chương trình thực hiện bởi vì bằng chứng cho thấy kết cục của bệnh lý có thể được tác động thuận lợi từ việc áp dụng triệt để các khuyến cáo lâm sàng.
Các chuyên gia y tế được khuyến khích sử dụng toàn văn Hướng dẫn ESC/EAS vào thực hành chuyên môn lâm sàng, cũng như trong việc quyết định và thực hiện các chiến lược y tế dự phòng, chẩn đoán hoặc điều trị. Tuy nhiên, Hướng dẫn ESC/EAS không quan trọng bằng trách nhiệm cá nhân của các chuyên gia y tế khi đưa ra quyết định phù hợp và chính xác trong việc cân nhắc từng tình trạng sức khỏe của bệnh nhân và thảo luận với bệnh nhân hoặc người chăm sóc của họ khi thích hợp và/hoặc khi cần thiết. Đây cũng là trách nhiệm của chuyên gia y tế trong việc xác nhận các quy tắc và quy định áp dụng ở mỗi quốc gia về thuốc và trang thiết bị tại thời điểm kê đơn.
Bảng 1. Phân loại khuyến cáo
| Định nghĩa | Ý nghĩa | |
| Loại I | Bằng chứng hoặc thỏa thuận chung về điều trị hay thủ thuật là có lợi, hữu ích, hiệu quả | Khuyến cáo hoặc chỉ định |
| Loại II | Bằng chứng không thống nhất và/hoặc ý kiến khác nhau về tính hữu ích/hiệu quả của điều trị hay thủ thuật | |
| IIa | Sức mạnh bằng chứng/ý kiến là ủng hộ tính hiệu quả/hữu ích | Nên xem xét |
| IIb | Bằng chứng/ý kiến cho thấy tính hiệu quả/hữu ích là không rõ ràng | Có thể xem xét |
| Loại III | Bằng chứng hoặc thỏa thuận chung về điều trị hay thủ thuật là không hữu ích/hiệu quả và trong một số trường hợp có thể gây hại. | Không khuyến cáo |
Bảng 2. Mức độ chứng cứ
| A | Dữ liệu có nguồn gốc từ nhiều thử nghiệm lâm sàng ngẫu nhiên đối chứng hoặc phân tích gộp. |
| B | Dữ liệu có nguồn gốc từ một thử nghiệm lâm sàng ngẫu nhiên đối chứng hoặc các nghiên cứu không ngẫu nhiên lớn. |
| C | Đồng thuận hoặc ý kiến chuyên gia và/hoặc các nghiên cứu nhỏ, nghiên cứu hồi cứu, các nghiên cứu chất lượng thấp khác. |
2. Mở đầu
Hướng dẫn về lipid của ESC/EAS trước đây đã được công bố vào tháng 8 năm 2016 [1]. Trong vài năm qua đã có một lượng bằng chứng mới đáng kể nên việc cập nhật Hướng dẫn mới là điều tất yếu.
Bằng chứng mới đã xác nhận rằng biến cố khởi đầu quan trọng trong quá trình tạo ra xơ vữa mạch là việc giữ lại cholesterol lipoprotein mật độ thấp (LDL-C) và lipoprotein chứa apolipoprotein-B (ApoB) giàu cholesterol khác trong các thành động mạch [2]. Một số nghiên cứu lâm sàng đối chứng-giả dược gần đây đã chỉ ra rằng việc bổ sung ezetimibe hoặc kháng thể đơn dòng (mAbs) anti-proprotein convertase subtilisin/kexin type 9 (PCSK9) vào liệu pháp statin giúp giảm nguy cơ mắc bệnh tim mạch xơ vữa (ASCVD) tương quan thuận trực tiếp với việc tăng dần khả năng đạt được giảm LDL-C tuyệt đối. Hơn nữa, các thử nghiệm lâm sàng này đã chỉ ra rõ ràng rằng đạt được giá trị LDL-C càng thấp thì nguy cơ biến cố tim mạch (CV) trong tương lai càng thấp, không có giới hạn dưới đối với giá trị LDL- C hoặc hiệu ứng đường cong J. Ngoài ra, các nghiên cứu về tính an toàn trên lâm sàng của các giá trị LDL-C đạt được rất thấp này đã được chứng minh là đảm bảo, mặc dù cần phải theo dõi trong thời gian dài hơn. Đối với việc tăng cholesterol lipoprotein mật độ cao (HDL-C), các nghiên cứu gần đây đã chỉ ra rằng những liệu pháp hiện có không làm giảm nguy cơ ASCVD. Cuối cùng, các nghiên cứu ngẫu nhiên Mendel ở người đã chứng minh vai trò quan trọng của LDL-C và các lipoprotein chứa ApoB giàu cholesterol khác đối với sự hình thành mảng xơ vữa động mạch và các biến cố CV sau đó. Vì vậy, không còn ‘giả thuyết LDL-C’, mà sự thật đã được khẳng định rằng giá trị LDL-C tăng có liên quan nhân quả với ASCVD và việc làm giảm các hạt LDL cũng như các lipoprotein chứa ApoB khác càng nhiều càng tốt để làm giảm biến cố CV.
Để phù hợp với những phát hiện mới này, các thành viên Nhóm chuyên trách ESC/EAS, những người viết Hướng dẫn này đã đề xuất các mục tiêu LDL-C mới, cũng như sửa đổi phân tầng nguy cơ CV, đặc biệt thích hợp với những bệnh nhân có nguy cơ cao và rất cao.
Những Hướng dẫn ESC/EAS mới này về lipid cung cấp lời khuyên mới quan trọng về quản lý bệnh nhân, điều này sẽ cho phép nhiều bác sĩ lâm sàng làm giảm nguy cơ CV một cách hiệu quả và an toàn thông qua điều chỉnh lipid.
2.1 Hướng dẫn 2019 có gì mới?
Các khuyến cáo mới, các khái niệm mới và sửa đổi, được trình bày trong Bảng 3.
Bảng 3. Những khuyến cáo mới, các khái niệm mới và được sửa đổi
| Khuyến cáo mới | |||
| Đánh giá nguy cơ ASCVD bằng hình ảnh tim mạch | |||
| Đánh giá gánh nặng mảng xơ vữa động mạch (động mạch cảnh và/hoặc động mạch đùi) trên siêu âm động mạch nên được xem là một công cụ điều chỉnh nguy cơ ở các cá nhân có nguy cơ thấp hoặc trung bình. | |||
| Đánh giá nguy cơ ASCVD bằng hình ảnh tim mạch | |||
| Đánh giá điểm CAC với CT có thể được xem là công cụ điều chỉnh nguy cơ trong đánh giá nguy cơ CV của các cá nhân không có triệu chứng có nguy cơ thấp hoặc trung bình. | |||
| Xét nghiệm lipid để ước tính nguy cơ CVD | |||
| Định lượng Lp (a) nên được xem xét ít nhất một lần trong đời ở người trưởng thành để xác định những người có mức Lp (a) di truyền rất cao >180 mg/dL (>430 nmol/L), là người có thể có nguy cơ ASCVD trọn đời tương đương với nguy cơ liên quan đến tăng cholesterol máu gia đình dị hợp tử. | |||
| Điều trị bằng thuốc cho bệnh nhân tăng triglyceride máu | |||
| Ở những bệnh nhân có nguy cơ cao (hoặc cao hơn) với TG trong khoảng 1.5 đến 5.6 mmol/L (135-499 mg/dL) mặc dù đã điều trị statin, PUFA n-3 (icosapent ethyl 2 x 2g/ngày) nên được xem xét kết hợp với statin. | |||
| Điều trị bệnh nhân FH dị hợp tử | |||
| Trong phòng ngừa tiên phát, đối với những người mắc FH có nguy cơ rất cao, nên xem xét giảm LDL-C ≥50% so với ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL). | |||
| Điều trị rối loạn lipid máu ở người cao tuổi | |||
| Ở người ≤75 tuổi, điều trị statin được khuyến cáo để phòng ngừa tiên phát, tùy theo mức độ nguy cơ. | |||
| Điều trị rối loạn lipid máu ở người cao tuổi | |||
| Ở người >75 tuổi, có thể xem xét bắt đầu điều trị statin để phòng ngừa tiên phát, nếu có nguy cơ cao hoặc cao hơn. | |||
| Điều trị rối loạn lipid máu ở DM | |||
| Ở những bệnh nhân T2DM có nguy cơ rất cao, khuyến cáo giảm LDL-C ≥50% so với mức ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL). | |||
| Ở những bệnh nhân T2DM có nguy cơ cao, khuyến cáo giảm LDL-C ≥50% so với mức ban đầu và mục tiêu LDL-C <1.8 mmol/L (< 70 mg/dL). Statin được khuyến cáo ở những bệnh nhân T1DM có nguy cơ cao hoặc rất cao. | |||
| Điều trị rối loạn lipid máu ở DM | |||
| Đẩy mạnh liệu pháp statin nên được xem xét trước khi đưa ra liệu pháp kết hợp. Nếu không đạt được mục tiêu, nên xem xét kết hợp statin với ezetimibe. | |||
| Điều trị rối loạn lipid máu ở DM | |||
| Liệu pháp statin không được khuyến cáo ở những bệnh nhân tiền mãn kinh mắc DM đang cân nhắc có thai hoặc không sử dụng biện pháp tránh thai đầy đủ. | |||
| Điều trị hạ lipid máu ở bệnh nhân ACS | |||
| Đối với những bệnh nhân nhập viện vì ACS và có nồng độ LDL-C không ở mức mục tiêu mặc dù đã dùng liều statin tối đa dung nạp được và ezetimibe, nêm xem xét thêm một chất ức chế PCSK9 sớm sau biến cố (nếu có thể, trong khi nằm viện cho biến cố ACS). | |||
| Thay đổi trong khuyến cáo | |||
| Nâng cấp | |||
| 2016 | 2019 | ||
| Xét nghiệm lipid để ước tính nguy cơ CVD | Xét nghiệm lipid để ước tính nguy cơ CVD | ||
| ApoB nên được xem xét như là một dấu hiệu nguy cơ thay thế bất cứ khi nào có sẵn, đặc biệt là ở những người có TG cao. | Xét nghiệm ApoB được khuyến cáo để đánh giá nguy cơ, đặc biệt ở những người có TG cao, DM, béo phì hoặc hội chứng chuyển hóa hoặc LDL-C rất thấp. Nó có thể được sử dụng để thay thế cho LDL-C, nếu có, như là xét nghiệm chính để sàng lọc, chẩn đoán và quản lý, có thể được ưu tiên hơn so với non- HDL-C ở những người có TG cao, DM, béo phì hoặc LDL-C rất thấp. | ||
| Thuốc làm giảm LDL-C | Thuốc làm giảm LDL-C | ||
| Nếu không đạt được mục tiêu LDL, nên xem xét kết hợp statin với chất ức chế hấp thu cholesterol. | Nếu các mục tiêu không đạt được với liều statin tối đa dung nạp được, khuyến cáo kết hợp với ezetimibe. | ||
| Thuốc làm giảm LDL-C | Thuốc làm giảm LDL-C | ||
| Ở những bệnh nhân có nguy cơ rất cao, với LDL-C cao kéo dài mặc dù điều trị với liều statin tối đa dung nạp được, có thể xem xét kết hợp với ezetimibe hoặc ở bệnh nhân không dung nạp statin, có thể cân nhắc dùng thuốc ức chế PCSK9. | Để phòng ngừa thứ phát, bệnh nhân có nguy cơ rất cao mà không đạt được mục tiêu với liều statin tối đa dung nạp được và ezetimibe, khuyến cáo kết hợp với chất ức chế PCSK9. | ||
| Đối với những bệnh nhân FH có nguy cơ rất cao (nghĩa là, ASCVD hoặc một yếu tố nguy cơ chính khác) mà không đạt được mục tiêu về liều statin dung nạp tối đa và ezetimibe, khuyến cáo kết hợp với chất ức chế PCSK9. | |||
| Thuốc điều trị tăng triglyceride máu | Thuốc điều trị tăng triglyceride máu | ||
| Điều trị statin có thể được xem xét là thuốc đầu tiên được lựa chọn để giảm nguy cơ CVD ở những người có nguy cơ cao bị tăng triglyceride máu. | Điều trị statin được khuyến cáo là thuốc đầu tiên được lựa chọn để giảm nguy cơ CVD ở những người có nguy cơ cao bị tăng triglyceride máu [TG >2.3 mmol/L (200 mg/dL)]. | ||
| Điều trị bệnh nhân FH dị hợp tử | Điều trị bệnh nhân FH dị hợp tử | ||
| Điều trị nên được xem xét nhằm đạt LDL-C <2.6 mmol/L (<100 mg/dL) hoặc <1.8 mmol/L (<70 mg/dL) nếu có CVD. Nếu không thể đạt được mục tiêu, giảm tối đa LDL-C bằng cách xem xét kết hợp thuốc thích hợp. | Đối với bệnh nhân FH bị ASCVD mà có nguy cơ rất cao, khuyến cáo điều trị để đạt được giảm tối thiểu 50% so với mức ban đầu và LDL-C <1.4 mmol/L (<55 mg/dL). Nếu mục tiêu không thể đạt được, khuyến cáo kết hợp thuốc. | ||
| Điều trị bệnh nhân FH dị hợp tử | Điều trị bệnh nhân FH dị hợp tử | ||
| Điều trị bằng kháng thể PCSK9 nên được xem xét ở bệnh nhân FH mắc CVD hoặc có các yếu tố khác khiến họ có nguy cơ mắc CHD rất cao, chẳng hạn như các yếu tố nguy cơ CV khác, tiền sử gia đình, Lp (a) cao hoặc không dung nạp statin. | Khuyến cáo điều trị thuốc ức chế PCSK9 ở những bệnh nhân mắc FH có nguy cơ rất cao nếu mục tiêu điều trị không đạt được với liều statin dung nạp tối đa cộng với ezetimibe. | ||
| Điều trị rối loạn lipid máu cơ người cao tuổi | Điều trị rối loạn lipid máu cơ người cao tuổi | ||
| Vì người cao tuổi thường có bệnh đồng mắc và thay đổi dược động học, thuốc hạ lipid nên được bắt đầu ở liều thấp và sau đó chuẩn độ thận trọng để đạt được mức lipid mục tiêu giống như ở người trẻ tuổi. | Statin được khuyến cáo bắt đầu với liều thấp nếu có suy thận đáng kể và/hoặc khả năng tương tác thuốc, sau đó chuẩn độ lên để đạt được mục tiêu điều trị LDL-C. | ||
| Điều trị hạ lipid ở bệnh nhân ACS | Điều trị hạ lipid ở bệnh nhân ACS | ||
| Nếu không đạt được mục tiêu LDL-C với liều statin dung nạp cao nhất và/hoặc ezetimibe, thuốc ức chế PCSK9 có thể được xem xét đứng đầu liệu pháp hạ lipid máu; hoặc đơn độc hoặc kết hợp với ezetimibe ở những bệnh nhân không dung nạp statin hoặc ở những người bị chống chỉ định statin. | Nếu mục tiêu LDL-C không đạt được sau 4 – 6 tuần mặc dù điều trị statin dung nạp tối đa và ezetimibe, khuyến cáo thêm chất ức chế PCSK9. | ||
| Mức độ khuyến cáo | |||
| Loại I | Loại IIa | Loại IIb | Loại III |
| Phần mới | |||
|
|||
| Các khái niệm mới/sửa đổi | |||
| Làm giảm LDL-C tích cực hơn trong các phân loại nguy cơ CV
• Để phòng ngừa thứ phát ở những bệnh nhân có nguy cơ rất cao, khuyến cáo giảm LDL-C>=50% so với ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL). o Đối với bệnh nhân ASCVD gặp biến cố mạch máu thứ hai trong vòng 2 năm (không nhất thiết phải cùng loại với biến cố đầu tiên) trong khi dùng liệu pháp statin dung nạp tối đa, có thể xem xét mục tiêu LDL-C là <1.0 mmol/L (<40 mg/dL). • Trong phòng ngừa tiên phát, đối với những người có nguy cơ rất cao nhưng không bị FH, khuyến cáo giảm LDL-C >=50% so với ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL). Đối với những người có nguy cơ rất cao (nghĩa là, với một yếu tố nguy cơ khác nhưng không có ASCVD), trong phòng ngừa tiên phát, nên xem xét các mục tiêu tương tự cho việc hạ LDL-C. • Đối với những bệnh nhân có nguy cơ cao, khuyến cáo giảm LDL-C >=50% so với ban đầu và mục tiêu LDL-C <1.8 mmol/L (<70 mg/dL). • Đối với những người có nguy cơ trung bình, nên xem xét mục tiêu LDL-C <2.6 mmol/L (<100 mg/dL). • Đối với những người có nguy cơ thấp, có thể xem xét mục tiêu LDL-C <3.0 mmol/L (<116 mg/dL). Lý do cho sự thay đổi các mục tiêu LDL-C thấp hơn là trong phân loại nguy cơ CV được thảo luận, dựa trên sự tổng hợp quan trọng của bằng chứng có sẵn từ các can thiệp điều chỉnh lipid làm giảm nguy cơ CV. Các chiến lược giảm LDL-C bằng thuốc:
Phân loại nguy cơ ở bệnh nhân FH:
Tác dụng phụ của statin:
Thuốc ức chế PCSK9:
Hiệu quả chi phí:
|
|||
ACS = hội chứng mạch vành cấp tính; ApoB = apolipoprotein B; ASCVD = bệnh tim mạch xơ vữa động mạch; CAC = vôi hóa động mạch vành; CHD = bệnh động mạch vành; CT = chụp cắt lớp vi tính; CV = tim mạch; CVD = bệnh tim mạch; DM = đái tháo đường; FH = tăng cholesterol máu gia đình; HDL = lipoprotein mật độ cao; LDL-C = cholesterol lipoprotein mật độ thấp; Lp (a) = lipoprotein (a); PCSK9 = proprotein convertase subtilisin/kexin type 9; PUFA = acid béo không bão hòa; RCT= thử nghiệm ngẫu nhiên có đối chứng; T1DM = đái tháo đường type 1; T2DM = đái tháo đường type 2; TG = triglyceride.
3. Phòng ngừa bệnh tim mạch là gì?
3.1 Định nghĩa và lý do
Bệnh tim mạch (CVD), trong đó ASCVD là thành phần chính, chịu trách nhiệm cho >4 triệu trường hợp tử vong ở Châu Âu mỗi năm. Nó giết chết nhiều phụ nữ (2.2 triệu) hơn so với nam giới (1.8 triệu), mặc dù tử vong CV trước 65 tuổi thường gặp hơn ở nam giới (490,000 so với 193,000) [3]. Phòng ngừa được định nghĩa là một tập hợp hành động phối hợp ở cấp độ quần thể hoặc cá nhân, nhằm mục đích loại bỏ hoặc giảm thiểu tác động của các bệnh CV và tàn tật liên quan. Nhiều bệnh nhân đang sống sót sau biến cố CVD đầu tiên và có nguy cơ tái phát cao. Ngoài ra, tỷ lệ mắc một số yếu tố nguy cơ, đáng chú ý là đái tháo đường (DM) và béo phì, đang gia tăng. Tầm quan trọng của việc phòng ngừa ASCVD đã được khẳng định và nên thực hiện ở cấp độ dân số chung bằng cách thúc đẩy hành vi lối sống lành mạnh [4], ở cấp độ cá nhân bằng cách từ bỏ lối sống không lành mạnh và làm giảm mức gia tăng các yếu tố nguy cơ CV nguyên nhân như mức LDL-C hoặc huyết áp (BP).
3.2 Xây dựng Hướng dẫn của Hội đồng Nhóm chuyên trách để quản lý rối loạn lipid máu
Hướng dẫn hiện tại là đồng thuận dựa trên bằng chứng của Nhóm chuyên trách Châu Âu, bao gồm ESC và EAS.
Thông qua việc đánh giá bằng chứng hiện tại và xác định những lỗ hổng kiến thức đang tồn tại trong quản lý chứng rối loạn lipid máu, Nhóm chuyên trách đã đưa ra các khuyến cáo để hướng dẫn hành động trong thực hành lâm sàng nhằm phòng ngừa ASCVD bằng cách điều chỉnh nồng độ lipid huyết tương.
Tài liệu này được phát triển cho các chuyên gia chăm sóc sức khỏe để tạo điều kiện cung cấp thông tin cho mọi người về nguy cơ CV và lợi ích của việc áp dụng và duy trì lối sống lành mạnh, điều chỉnh sớm nguy cơ CV liên quan đến lipid máu. Ngoài ra, Hướng dẫn cũng cung cấp các công cụ cho các chuyên gia chăm sóc sức khỏe để thúc đẩy các chiến lược can thiệp cập nhật, tích hợp các chiến lược này vào các khuôn khổ phòng ngừa quốc gia hoặc khu vực, và để chuyển chúng thành các dịch vụ chăm sóc sức khỏe được cung cấp tại địa phương, phù hợp với các khuyến cáo của Tổ chức Y tế Thế giới (WHO) dựa vào Báo cáo Tình trạng Toàn cầu về các bệnh không lây nhiễm năm 2014 [5].
Cần xem xét cách tiếp cận trọn đời đối với nguy cơ CV [1]. Tức là, ngoài việc cải thiện thói quen sinh hoạt và giảm mức độ yếu tố nguy cơ ở bệnh nhân được xác định ASCVD, và ở những người có nguy cơ mắc ASCVD – mọi người ở mọi lứa tuổi nên được khuyến khích áp dụng hoặc duy trì một lối sống lành mạnh.
4. Nguy cơ tim mạch tổng thể
4.1 Ước tính nguy cơ tim mạch tổng thể
Nguy cơ CV trong bối cảnh của Hướng dẫn này có nghĩa là khả năng một người phát triển biến cố CV xơ vữa động mạch trong một khoảng thời gian xác định. Tổng nguy cơ CVD thể hiện tác động kết hợp của một số yếu tố nguy cơ lên ước tính nguy cơ này. Trong Hướng dẫn này, chúng tôi đề cập đến sự góp phần của lipid vào tổng nguy cơ CV và cách quản lý nó ở cấp độ lâm sàng.
4.1.1 Cơ sở lý luận để đánh giá tổng nguy bệnh tim mạch
Tất cả các hướng dẫn hiện nay về phòng ngừa ASCVD trong thực hành lâm sàng đều khuyến cáo đánh giá tổng nguy cơ CVD. Việc phòng ngừa ASCVD ở một người cụ thể phải liên quan đến tổng nguy cơ CV của người đó: nguy cơ càng cao thì hành động phải càng tích cực.
Có nhiều hệ thống đánh giá nguy cơ và chúng đã được xem xét toàn diện (Bảng 1 trong Dữ liệu bổ sung). Hầu hết các hướng dẫn đều sử dụng một trong những hệ thống đánh giá nguy cơ này [6-8]. Lý tưởng nhất, biểu đồ nguy cơ nên dựa trên dữ liệu đoàn hệ cụ thể theo quốc gia, nhưng chúng không có sẵn cho hầu hết các quốc gia. Hệ thống SCORE (Systematic Coronary Risk Estimation – Ước tính nguy cơ mạch vành có hệ thống) có thể được hiệu chuẩn lại để sử dụng trong các quần thể khác nhau bằng cách điều chỉnh những thay đổi dài hạn về tỷ lệ tử vong CVD và sự phổ biến của yếu tố nguy cơ. Các phiên bản cho từng quốc gia được hiệu chuẩn có sẵn cho nhiều nước Châu Âu và có thể được tìm thấy tại http:// www.heartscore.org. Chúng hiện đang được cập nhật để cung cấp sự hiệu chuẩn lại, biểu đồ đồng thời cho từng nước trên toàn Châu Âu. Các hệ thống ước tính nguy cơ khác – sử dụng cả hai loại biến cố là gây tử vong và không gây tử vong – cũng có thể được hiệu chuẩn lại, nhưng quá trình này dễ dàng và mạnh mẽ hơn về mặt khoa học đối với tỷ lệ tử vong so với tổng số biến cố. Hướng dẫn Châu Âu về phòng ngừa CVD trong thực hành lâm sàng (cả phiên bản 2012 [9] và 2016 [10]) khuyến cáo sử dụng hệ thống SCORE vì nó dựa trên bộ dữ liệu đoàn hệ Châu Âu lớn, có tính đại diện và bởi vì nó tương đối đơn giản để hiệu chuẩn lại cho từng quốc gia.
Những người có ASCVD được ghi nhận, DM loại 1 hoặc loại 2 (tương ứng là T1DM và T2DM), là yếu tố nguy cơ cá nhân rất cao hoặc bệnh thận mạn tính (CKD) thường có nguy cơ CV tổng thể rất cao hoặc cao. Những đối tượng này không cần mô hình ước tính nguy cơ; tất cả họ cần được quản lý tích cực mọi yếu tố nguy cơ. Đối với những người khỏe mạnh, việc sử dụng hệ thống ước tính nguy cơ như SCORE, ước tính nguy cơ tích lũy 10 năm của một biến cố xơ vữa động mạch gây tử vong đầu tiên, được khuyến cáo để ước tính tổng nguy cơ CV, vì nhiều người có một số yếu tố nguy cơ mà chúng có thể kết hợp để dẫn đến mức nguy cơ CV cao.
Các ước tính nguy cơ đã được tạo ra dưới dạng biểu đồ cho các khu vực ở Châu Âu có nguy cơ cao và thấp (Hình 1 và 2) [11]. Tất cả các phân loại quốc tế về các mã bệnh liên quan đến tử vong có nguồn gốc mạch máu do xơ vữa động mạch đều được đưa vào. Việc giữ lại một hệ thống ước tính gây tử vong trái ngược với tổng số các biến cố không gây tử vong + gây tử vong là do các biến cố không gây tử vong phụ thuộc vào định nghĩa, sự phát triển các xét nghiệm chẩn đoán và phương pháp xác định, tất cả trong đó đều có thể thay đổi dẫn đến hệ số nhân rất thay đổi để chuyển từ gây tử vong thành tổng số biến cố. Ngoài ra, biểu đồ biến cố tổng thể, đối lập với các biểu đồ dựa trên tỷ lệ tử vong, gây nhiều khó khăn hơn để hiệu chuẩn lại cho phù hợp với các quần thể khác nhau. Điều đó nói rằng, công việc đang được tiến hành để tạo ra các biểu đồ biến cố tổng thể cho từng khu vực.
Dữ liệu SCORE chỉ ra rằng tổng nguy cơ biến cố CVD cao hơn khoảng ba lần so với nguy cơ CVD gây tử vong đối với nam, do đó nguy cơ SCORE 5% tương ứng với nguy cơ CVD là 15% trong toàn bộ (không gây tử vong + tử vong) kết cục CVD; hệ số nhân này cao hơn ở phụ nữ và thấp hơn ở người già.
Bác sĩ lâm sàng thường yêu cầu ngưỡng để kích hoạt một số can thiệp nhất định. Đây là vấn đề thực sự vì nguy cơ là một sự liên tục và không có ngưỡng nào mà ở đó, ví dụ, một loại thuốc được tự động chỉ định. Điều này đúng với tất cả các yếu tố nguy cơ liên tục như cholesterol huyết tương hoặc HA tâm thu (SBP). Do đó, các mục tiêu được đề xuất trong tài liệu này phản ánh khái niệm này.
Một vấn đề cụ thể liên quan đến những người trẻ tuổi có yếu tố nguy cơ ở mức cao; nguy cơ tuyệt đối thấp có thể che lấp nguy cơ tương đối rất cao, sẽ cần ít nhất là tư vấn lối sống chuyên sâu. Để thúc đẩy những người trẻ tuổi (tức là <40 tuổi) không trì hoãn việc thay đổi lối sống không lành mạnh của họ, một ước tính nguy cơ tương đối – minh họa rằng sự thay đổi lối sống có thể làm giảm đáng kể nguy cơ tương đối – có thể rất hữu ích (Hình 1 Phần bổ sung).
Một cách tiếp cận khác cho vấn đề này là sử dụng độ tuổi nguy cơ CV. Độ tuổi nguy cơ của một người có nhiều yếu tố nguy cơ CV là độ tuổi của một người có cùng mức độ nguy cơ nhưng có các yếu tố nguy cơ ở mức lý tưởng. Do đó, một người 40 tuổi nguy cơ cao sẽ có độ tuổi nguy cơ ≥65 tuổi. Độ tuổi nguy cơ có thể được ước tính trực quan bằng cách nhìn vào biểu đồ SCORE (như minh họa trong Hình 2 Phần bổ sung). Trong biểu đồ này, độ tuổi nguy cơ của một người có các yếu tố nguy cơ được xác định là độ tuổi mà một người có mức độ yếu tố nguy cơ lý tưởng sẽ đạt đến mức nguy cơ tương tự. Các yếu tố nguy cơ lý tưởng là không hút thuốc, cholesterol toàn phần (TC) ≤4 mmol/L (≤155 mg/dL) và SBP ≤120 mmHg.
Độ tuổi nguy cơ cũng được tự động tính toán như là một phần của phiên bản HeartScore mới nhất (http://www.HeartScore.org). Độ tuổi nguy cơ đã cho thấy là độc lập với kết cục CV [6,8], có thể được sử dụng trong mọi dân số bất kể nguy cơ nền tảng hoặc thay đổi lâu dài về tỷ lệ tử vong, và do đó tránh được yêu cầu phải hiệu chuẩn lại.
Nguy cơ trọn đời là một cách tiếp cận khác để minh họa tác động của các yếu tố nguy cơ có thể hữu ích ở người trẻ [12]. Gánh nặng của các yếu tố nguy cơ càng cao thì nguy cơ trọn đời càng cao. Cách tiếp cận này tạo ra hình ảnh nguy cơ cao hơn cho những người trẻ tuổi vì thời gian trong nguy cơ trọn đời lâu hơn. Do đó, nó hữu ích như một cách minh họa nguy cơ hơn là hướng dẫn điều trị, bởi vì các thử nghiệm điều trị đã được dựa trên một khoảng thời gian theo dõi cố định và không phải là trên nguy cơ suốt đời.
Một vấn đề khác liên quan đến người cao tuổi. Ở một số nhóm tuổi, phần lớn mọi người, đặc biệt là nam giới, sẽ có nguy cơ tử vong CV tích lũy 10 năm vượt quá mức 5-10%, chỉ dựa trên tuổi, ngay cả khi các mức độ yếu tố nguy cơ CV là tương đối thấp. Do đó, trước khi bắt đầu điều trị ở người cao tuổi, bác sĩ lâm sàng nên đánh giá bệnh nhân cẩn thận. Sức mạnh tương đối của các yếu tố nguy cơ thay đổi theo độ tuổi và SCORE ước tính quá mức nguy cơ ở người cao tuổi (tức là những người Khuyến cáo 2019 từ ESC Rối loạn lipid máu 15 >65 tuổi) [11]. Những Hướng dẫn này bao gồm các biểu đồ minh họa cho người cao tuổi (xem Hình 1 và 2). Trong khi những người cao tuổi được hưởng lợi từ việc cai thuốc lá, kiểm soát tăng huyết áp và tăng lipid máu (xem phần 9.3), thì cần phải có phán đoán lâm sàng để tránh tác dụng phụ do quá liều thuốc. Tác động khác của HDL-C lên ước tính nguy cơ được minh họa trong Hình 3 và 4 Phần bổ sung; HDL-C có thể được sử dụng để gia tăng độ chính xác của đánh giá nguy cơ. Trong các biểu đồ này, HDL-C được sử dụng một cách phân loại. Phiên bản điện tử của SCORE, HeartScore (http://www.heartscore.org/en_GB/), đã được sửa đổi để đưa HDL-C vào xem xét như một biến liên tục. Các bác sĩ lâm sàng cần lưu ý rằng ở các giá trị HDL-C cực cao [trên 2.3 mmol/L (90 mg/dL)] dường như có nguy cơ tăng ASCVD, do đó ở nồng độ như vậy, HDL-C không thể được sử dụng như một dự đoán nguy cơ.
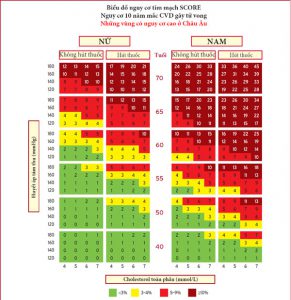
Hình 1. Biểu đồ ước tính nguy cơ mạch vành có hệ thống cho dân số Châu Âu có nguy cơ cao mắc bệnh tim mạch. Nguy cơ 10 năm mắc bệnh tim mạch gây tử vong trong dân số có nguy cơ cao mắc bệnh tim mạch dựa trên các yếu tố nguy cơ sau: tuổi, giới tính, hút thuốc, huyết áp tâm thu và cholesterol toàn phần. Để chuyển đổi nguy cơ mắc bệnh tim mạch gây tử vong sang tổng nguy cơ mắc bệnh tim mạch (gây tử vong không gây tử vong), nhân 3 cho nam và 4 cho nữ và ít hơn một chút ở người cao tuổi. Lưu ý: biểu đồ ước tính nguy cơ mạch vành có hệ thống được sử dụng ở những người không mắc bệnh tim mạch thực sự, đái tháo đường (loại 1 và 2), bệnh thận mạn tính, tăng cholesterol máu gia đình hoặc các yếu tố nguy cơ cá nhân rất cao vì những người này đã có sẵn nguy cơ cao và cần quản lý yếu tố nguy cơ tích cực. Cholesterol: 1 mmol/L = 38.67 mg/dL. Các biểu đồ nguy cơ SCORE được trình bày ở trên hơi khác so với các biểu đồ trong Hướng dẫn của Hiệp hội Tim mạch/Xơ vữa động mạch Châu Âu 2016 về quản lý rối loạn lipid và Hướng dẫn Châu Âu 2016 về phòng ngừa bệnh tim mạch trong thực hành lâm sàng, trong đó: (i) độ tuổi đã được mở rộng từ 65 đến 70 tuổi; (ii) sự tương tác giữa độ tuổi và từng yếu tố nguy cơ khác đã được kết hợp, do đó làm giảm việc đánh giá quá mức nguy cơ ở người cao tuổi trong các biểu đồ SCORE ban đầu; và (iii) dải cholesterol 8 mmol/L đã bị loại bỏ, vì những người đó cần phải được đánh giá thêm trong mọi trường hợp. SCORE = Ước tính nguy cơ mạch vành có hệ thống.
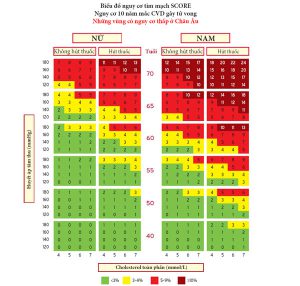
4.1.2 Cách sử dụng biểu đồ ước tính nguy cơ
Việc sử dụng các biểu đồ SCORE có nguy cơ thấp hoặc nguy cơ cao sẽ phụ thuộc vào tử vong CVD thực tế ở mỗi quốc gia. Mặc dù bất kỳ ngưỡng cắt nào cũng là không hợp lý và mở ra một cuộc tranh luận, nhưng trong Hướng dẫn này, ngưỡng cắt để gọi một quốc gia có ‘nguy cơ CVD thấp’ là dựa trên dữ liệu của WHO lấy được từ Nghiên cứu gánh nặng bệnh tật toàn cầu.
Các quốc gia được phân loại là có nguy cơ thấp nếu tỷ lệ tử vong CVD năm 2016 ở đó được điều chỉnh theo độ tuổi là < 150/100,000 (đối với nam và nữ) (http://www.who.int/healthinfo/global_burden_disease/estimates/en/).Các quốc gia có tỷ lệ tử vong CVD ≥150/100,000 trở lên được xem là có nguy cơ cao.
Các Box từ 1 đến 5 tóm tắt những điểm chính liên quan đến biểu đồ ước tính nguy cơ và cách sử dụng chúng.
Xã hội thiếu thốn và căng thẳng tâm lý xã hội làm tăng nguy cơ [13]. Đối với những người có nguy cơ trung bình, những yếu tố khác – bao gồm các yếu tố chuyển hóa như tăng ApoB, lipoprotein (a) [Lp (a)], triglyceride (TG) hoặc protein phản ứng C (CRP); xuất hiện albumin niệu; có mảng xơ vữa động mạch ở động mạch cảnh hoặc động mạch đùi; hoặc điểm calci động mạch vành (CAC) – có thể cải thiện phân loại nguy cơ. Nhiều dấu ấn sinh học khác cũng có liên quan với tăng nguy cơ CVD, mặc dù một vài trong số này cho thấy là làm phân loại lại đáng kể. Tổng nguy cơ CV cũng sẽ cao hơn so với được chỉ ra trong biểu đồ SCORE ở những người không có triệu chứng nhưng có các chỉ dấu bất thường của tổn thương mạch máu xơ vữa động mạch dưới lâm sàng. Phân loại lại có giá trị ở những người được xác định là có nguy cơ CV mức độ trung bình bằng cách sử dụng các chỉ dấu như điểm CAC >100 đơn vị Agatston, chỉ số huyết áp mắt cá chân-cánh tay (ABI) <0.9 hoặc >1.40, tốc độ sóng xung động mạch cảnh-đùi > 10 m/s, hoặc sự hiện diện của các mảng xơ vữa khi siêu âm động mạch cảnh hoặc đùi. Trong các nghiên cứu so sánh các chỉ dấu hiệu, CAC có khả năng phân loại lại tốt nhất [14-16].
Một số yếu tố như HDL-C cao lên tới 2.3 mmol/L (90mg/dL) [17] hoặc tiền sử gia đình có tuổi thọ cao cũng có thể liên quan đến nguy cơ thấp hơn.
Box 1. Cách sử dụng biểu đồ ước tính nguy cơ
| Để ước tính nguy cơ tử vong CVD 10 năm của một người, hãy tìm bảng về giới tính, tình trạng hút thuốc lá và tuổi của ông/bà. Trong bảng này, tìm thấy ô gần nhất với BP và TC của người đó. Ước tính nguy cơ sẽ cần phải điều chỉnh tăng lên khi người đó tiệm cận nhóm tuổi tiếp theo. |
| Nguy cơ ban đầu được đánh giá dựa trên nồng độ TC và HA tâm thu trước khi điều trị, nếu biết. Điều trị càng lâu và hiệu quả càng cao thì giảm nguy cơ càng lớn, nhưng nói chung, nó sẽ không nhiều hơn khoảng một phần ba nguy cơ ban đầu. Ví dụ, đối với một người đang điều trị thuốc chống tăng huyết áp mà không biết HA trước điều trị, nếu tổng nguy cơ CV SCORE là 6%, thì tổng nguy cơ CV trước điều trị có thể là 9%. |
| Những người có nguy cơ thấp nên được tư vấn để duy trì tình trạng nguy cơ thấp này. Mặc dù không có ngưỡng nào thường được áp dụng nhưng cường độ tư vấn sẽ phải tăng lên khi nguy cơ ngày càng tăng. |
| Các biểu đồ có thể được sử dụng để đưa ra một số dấu hiệu về tác động của việc làm giảm các yếu tố nguy cơ, mặc dù rõ ràng là có độ trễ về thời gian trước khi nguy cơ giảm. Nói chung, những người ngừng hút thuốc giảm một nửa nguy cơ tích lũy trong một khoảng thời gian tương đối ngắn. |
HA = huyết áp; CV = tim mạch; CVD = bệnh tim mạch; SCORE = Ước tính nguy cơ mạch vành có hệ thống; TC = cholesterol toàn phần.
Box 2. Biểu đồ ước tính nguy cơ cho những quốc gia khác nhau
| Các biểu đồ nguy cơ thấp nên được xem xét để sử dụng ở Áo, Bỉ, Síp, Đan Mạch, Phần Lan, Pháp, Đức, Hy Lạp, Iceland, Ireland, Israel, Ý, Luxembourg, Hà Lan, Na Uy, Malta, Bồ Đào Nha, Slovenia, Tây Ban Nha, Thụy Điển , Thụy Sĩ và Vương quốc Anh. |
| Các biểu đồ nguy cơ cao nên được xem xét để sử dụng ở Albania, Algeria, Armenia, Bosnia và Herzegovina, Croatia, Cộng hòa Séc, Estonia, Hungary, Latvia, Lebanon, Libya, Litva, Montenegro, Morocco, Ba Lan, Romania, Serbia, Slovakia, Tunisia và Thổ Nhĩ Kỳ. |
| Một số quốc gia có tỷ lệ tử vong do bệnh tim mạch >350/100,000 và biểu đồ nguy cơ cao có thể đánh giá thấp nguy cơ. Đó là Azerbaijan, Belarus, Bulgaria, Ai Cập, Georgia, Kazakhstan, Kyrgyzstan, Bắc Macedonia, Cộng hòa Moldova, Liên bang Nga, Syria, Tajikistan, Turkmenistan, Ukraine và Uzbekistan. |
Xem thêm ở http://apps.who.int/gho/data/node.home.
Box 3. Đối tượng áp dụng
| Các biểu đồ có thể hỗ trợ đánh giá và quản lý nguy cơ, nhưng phải được hiểu theo kiến thức và kinh nghiệm của bác sĩ lâm sàng, và về khả năng CVD tiền kiểm của bệnh nhân. |
| Nguy cơ sẽ được đánh giá quá mức ở các quốc gia có tỷ lệ tử vong CVD đang giảm và bị đánh giá dưới mức ở các quốc gia có tỷ lệ tử vong đang tăng. Điều này được giải quyết bằng cách hiệu chuẩn lại (http://www.heartscore.org/en_GB/). |
| Ước tính nguy cơ ở phụ nữ thấp hơn nam giới. Tuy nhiên, nguy cơ chỉ bị hoãn lại ở phụ nữ; nguy cơ của phụ nữ 60 tuổi tương tự như nam giới 50 tuổi. Sau cùng, nhiều phụ nữ chết vì CVD hơn nam. |
| Nguy cơ tương đối có thể cao ngoài dự kiến ở những người trẻ tuổi, ngay cả khi mức độ nguy cơ tuyệt đối là thấp. Biểu đồ nguy cơ tương đối (Hình 1 Phần bổ sung) và tuổi nguy cơ ước tính (Hình 2 Phần bổ sung) có thể hữu ích trong việc xác định và tư vấn cho những người như vậy. |
Box 4. Các yếu tố nguy cơ SCORE hiệu chỉnh
| Tầng lớp thấp trong xã hội: nguồn gốc của nhiều nguyên nhân CVD
Béo phì và béo phì trung tâm được đo lần lượt bằng BMI và chu vi vòng eo. Không hoạt động thể chất. Căng thẳng tâm lý xã hội bao gồm kiệt sức nặng. Tiền sử gia đình mắc CVD sớm (nam <55 tuổi và nữ <60 tuổi). Rối loạn viêm qua trung gian miễn dịch mãn tính. Rối loạn tâm thần lớn. Điều trị nhiễm HIV. Rung nhĩ. Phì đại thất trái. Bệnh thận mạn. Hội chứng ngưng thở khi ngủ tắc nghẽn. Bệnh gan nhiễm mỡ không do rượu. |
4.2 Mức độ nguy cơ
Ước tính tổng nguy cơ CV là một phần của sự liên tục. Các ngưỡng được sử dụng để xác định nguy cơ cao có thể thay đổi và dựa trên mức độ nguy cơ mà lợi ích được thể hiện rõ trong các thử nghiệm lâm sàng. Trong thực hành lâm sàng, cần xem xét các vấn đề thực tế liên quan đến các hệ thống chăm sóc sức khỏe tại địa phương. Không chỉ những người có nguy cơ cao phải được xác định và quản lý, mà những người có nguy cơ trung bình cũng nên nhận được lời khuyên về thay đổi lối sống; trong một số trường hợp, điều trị bằng thuốc sẽ là cần thiết để làm giảm nguy cơ xơ vữa động mạch.
Những người có nguy cơ thấp nên được tư vấn để giúp họ duy trì tình trạng này. Do đó, cường độ của các hành động phòng ngừa nên được điều chỉnh theo nguy cơ CV của bệnh nhân. Yếu tố thúc đẩy mạnh nhất của tổng nguy cơ CV là độ tuổi, có thể được xem là “thời gian tiếp xúc” với các yếu tố nguy cơ.
Vì những lý do này, Nhóm chuyên trách đề xuất phân loại mục tiêu nguy cơ và mục tiêu LDL-C sau đây, dựa trên bằng chứng tốt nhất hiện có và trong một môi trường lý tưởng với nguồn lực không giới hạn. Những phân loại này đi cùng với một thông điệp hoàn hảo, nhưng những điều lý tưởng này chỉ mang tính hướng dẫn và việc ra quyết định thực tế phải dựa trên những gì phù hợp với tình hình địa phương.
Với những cân nhắc này như vậy, chúng tôi đề xuất các mức độ tổng nguy cơ CV được trình bày trong Bảng 4.
Box 5. Ước tính nguy cơ: thông điệp quan trọng
| Ở người khỏe mạnh, nguy cơ CVD thường là kết quả của nhiều yếu tố nguy cơ và sự tương tác giữa chúng. Đây là cơ sở để ước tính tổng nguy cơ CV và quản lý. |
| Sàng lọc yếu tố nguy cơ bao gồm bộ lipid nên được xem xét ở nam giới >40 tuổi và ở phụ nữ >50 tuổi hoặc sau mãn kinh. |
| Một hệ thống ước tính nguy cơ như SCORE có thể hỗ trợ trong việc đưa ra các quyết định quản lý phù hợp và có thể giúp tránh điều trị dưới mức và quá mức. |
| Một số cá nhân tuyên bố mình có nguy cơ CVD cao hoặc rất cao mà không cần chấm điểm nguy cơ, và tất cả các yếu tố nguy cơ đòi hỏi sự quan tâm ngay lập tức. Điều này đúng với những bệnh nhân được ghi nhận CVD, những người cao tuổi bị DM lâu năm, tăng cholesterol máu gia đình, bệnh thận mạn tính, mảng xơ vữa động mạch cảnh hoặc động mạch đùi, điểm calci động mạch vành >100 hoặc tăng Lp (a) cực cao. |
| Tất cả các hệ thống ước tính nguy cơ là tương đối thô sơ và đòi hỏi phải quan tâm đến các báo cáo đầy đủ hơn. |
| Các yếu tố khác ảnh hưởng đến nguy cơ có thể được cung cấp trong các hệ thống ước tính nguy cơ điện tử như HeartScore (www.heartscore.org). |
| Tiếp cận tổng nguy cơ cần phải linh hoạt; nếu kiểm soát tối ưu không thể đạt được với một yếu tố nguy cơ, thì cố gắng hơn với các yếu tố khác sẽ vẫn có thể làm giảm nguy cơ. |
CV = tim mạch; CVD = bệnh tim mạch; DM = đái tháo đường; SCORE = Ước tính nguy cơ mạch vành có hệ thống.
Bảng 4. Phân loại nguy cơ tim mạch
| Nguy cơ rất cao | Những người có bất kỳ điều nào sau đây:
– Có ASCVD, trên lâm sàng hoặc không rõ ràng về hình ảnh. Có ASCVD bao gồm ACS trước đó (MI hoặc đau thắt ngực không ổn định), đau thắt ngực ổn định, tái thông mạch vành (PCI, CABG và các thủ thuật tái thông động mạch khác), đột quỵ và TIA, bệnh động mạch ngoại biên. Có ASCVD không rõ ràng trên hình ảnh bao gồm những dấu hiệu có thể dự đoán được các biến cố lâm sàng, chẳng hạn như mảng xơ vữa đáng kể trên chụp mạch vành hoặc CT scan (bệnh nhiều nhánh động mạch vành với hai động mạch vành chính hẹp >50%) hoặc mảng xơ vữa động mạch cảnh trên siêu âm. – DM tổn thương cơ quan đích (a), hoặc ít nhất ba yếu tố nguy cơ chính hoặc khởi phát sớm T1DM trong thời gian dài (>20 năm). – CKD nặng (eGFR <30 mL/phút/1.73 m2 ). – Một SCORE được tính ≥10% cho nguy cơ CVD gây tử vong trong 10 năm. – FH kèm ASCVD hoặc có một yếu tố nguy cơ chính khác. |
| Nguy cơ cao | Những người có:
– Các yếu tố nguy cơ đơn lẻ tăng rõ rệt, đặc biệt là TC >8 mmol/L (>310 mg/dL), LDL-C >4.9 mmol/L (>190 mg/dL), hoặc HA ≥180/110 mmHg. – Bệnh nhân FH không có các yếu tố nguy cơ chính khác. – Bệnh nhân DM không có tổn thương cơ quan đích (a), có thời gian DM ≥10 năm hoặc một yếu tố nguy cơ khác. – CKD trung bình (eGFR 30-59 mL/phút/1.73 m2). – Một SCORE được tính ≥5% và <10% cho nguy cơ CVD gây tử vong trong 10 năm. |
| Nguy cơ trung bình | Bệnh nhân trẻ tuổi (T1DM <35 tuổi; T2DM <50 tuổi) với thời gian DM <10 năm, không có các yếu tố nguy cơ khác. SCORE được tính ≥1% và <5% cho nguy cơ CVD gây tử vong trong 10 năm. |
| Nguy cơ thấp | SCORE được tính <1% cho nguy cơ CVD gây tử vong trong 10 năm. |
ASCVD = bệnh tim mạch xơ vữa động mạch; ACS = hội chứng mạch vành cấp; HA = huyết áp; CABG = phẫu thuật bắc cầu động mạch vành; CKD = bệnh thận mạn; CT = chụp cắt lớp vi tính; CVD = bệnh tim mạch; DM = đái tháo đường; eGFR = độ lọc cầu thận ước tính; FH = tăng cholesterol máu gia đình; LDL-C = cholesterol lipoprotein mật độ thấp; MI = nhồi máu cơ tim; PCI = can thiệp mạch vành qua da; SCORE = Ước tính nguy cơ mạch vành có hệ thống; T1DM = DM loại 1; T2DM = DM loại 2; TC = cholesterol toàn phần; TIA = cơn thiếu máu não thoáng qua. (a) Tổn thương cơ quan đích được định nghĩa là microalbumin niệu, bệnh võng mạc hoặc bệnh thần kinh.
4.2.1 Vai trò của kỹ thuật chẩn đoán hình ảnh tim mạch không xâm lấn trong đánh giá tổng nguy cơ bệnh tim mạch
Kỹ thuật chẩn đoán hình ảnh không xâm lấn có thể phát hiện sự hiện diện, ước tính mức độ và đánh giá hậu quả lâm sàng của tổn thương mạch máu do xơ vữa động mạch. Phát hiện vôi hóa động mạch vành bằng chụp cắt lớp vi tính (CT) không tương phản cho một ước tính tốt về gánh nặng xơ vữa động mạch và có liên quan chặt chẽ với các biến cố CV [18]. Một phân tích gộp gần đây tóm tắt các bằng chứng hiện có về giá trị của các yếu tố nguy cơ không thường gặp để dự đoán nguy cơ và nhận thấy rằng, mặc dù không có thử nghiệm ngẫu nhiên nào cho thấy việc sử dụng CAC làm giảm kết cục sức khỏe, tuy nhiên nó giúp cải thiện khả năng phân định và phân loại lại [19]. Đánh giá gánh nặng mảng xơ vữa động mạch cảnh hoặc đùi bằng siêu âm cũng đã được chứng minh là có thể dự đoán được các biến cố CV, có thể so sánh với CAC [20-23], trong khi phép đo độ dày lớp trung-nội mạc động mạch cảnh kém hơn so với điểm CAC và mảng xơ vữa động mạch cảnh [16,24,25].
Ở những bệnh nhân không triệu chứng có nguy cơ thấp hoặc trung bình mà đủ điều kiện điều trị bằng statin (xem Bảng 5), đánh giá ASCVD bằng hình ảnh có thể có tác động đến điều trị nội khoa, cả từ quan điểm của bác sĩ và quan điểm của bệnh nhân. Dữ liệu từ nghiên cứu MESA cho thấy 41-57% cá nhân đủ điều kiện điều trị statin có điểm CAC bằng 0 và tỷ lệ biến cố CVD do xơ vữa động mạch theo dõi trong khoảng thời gian 10 năm là thấp (1.5-4.9%) [26]. Ngược lại, tỷ lệ ASCVD và bệnh tim mạch vành (CHD) ở những người có điểm CAC >100 Agatston lần lượt là 18.9 và 12.7 trên 1000 người-năm [18]. So với chiến lược điều trị cho tất cả bệnh nhân, việc sử dụng điểm CAC để hướng dẫn điều trị statin dài hạn đã được chứng minh là có hiệu quả về chi phí [27]. Lưu ý rằng điểm CAC thường rất thấp ở bệnh nhân dưới 45 tuổi bị tăng cholesterol máu gia đình (FH) nặng, bao gồm FH đồng hợp tử (HoFH), và có độ đặc hiệu thấp trong dân số này.
Đánh giá hẹp lòng động mạch vành >50% và thành phần mảng bám với chụp CT mạch vành cũng cung cấp giá trị tiên lượng tốt hơn so với các mô hình phân tầng nguy cơ truyền thống [28]. Kết quả là, ở những người không triệu chứng có nguy cơ trung bình thì điểm CAC >100 Agatston và mảng xơ vữa động mạch cảnh hoặc đùi trên siêu âm, có thể phân loại lại chúng thành một phân nhóm nguy cơ cao hơn. Do đó, việc sử dụng các phương pháp để phát hiện những chỉ dấu này cần được quan tâm trong nhóm đó (xem Khuyến cáo về chẩn đoán hình ảnh tim mạch để đánh giá nguy cơ bệnh tim mạch do xơ vữa động mạch ở bên dưới) [14-16]. Nhìn chung, đánh giá điểm CAC bằng CT có thể được xem xét ở những cá nhân có nguy cơ thấp hoặc trung bình mà mục tiêu LDL-C tương ứng không đạt được chỉ bằng can thiệp lối sống và liệu pháp dược lý là một lựa chọn (xem Bảng 5). Việc sử dụng các kỹ thuật hình ảnh để xác định sự hiện diện và mức độ tổn thương mạch máu do xơ vữa động mạch ở những người có nguy cơ thấp mà hiện không được xem xét điều trị statin là không hợp lý do khả năng tiên lượng thấp cũng như có liên quan đến chi phí và nguy cơ phóng xạ khi đo điểm CAC, đặc biệt là ở những phụ nữ có nguy cơ thấp [29]. Lưu ý, điểm CAC tăng sau khi điều trị statin; do đó, điểm CAC của bệnh nhân được điều trị statin nên được giải thích thận trọng.
Khuyến cáo về hình ảnh tim mạch để đánh giá nguy cơ bệnh tim mạch do xơ
vữa động mạch
| Khuyến cáo | Loại | Mức |
| Gánh nặng mảng xơ vữa động mạch (cảnh và/hoặc đùi) trên siêu âm động mạch nên được xem là một yếu tố điều chỉnh nguy cơ ở những người có nguy cơ thấp hoặc trung bình [29,30]. | IIa | B |
| Đánh giá điểm CAC bằng CT có thể được xem là một yếu tố điều chỉnh nguy cơ khi đánh giá nguy cơ CV ở những người không triệu chứng ở mức nguy cơ thấp hoặc trung bình [14-16,24,26]. | IIb | B |
CAC = vôi hóa động mạch vành; CT = chụp cắt lớp vi tính; CV = tim mạch.
Bảng 5. Chiến lược can thiệp như là một hàm số của tổng nguy cơ tim mạch và nồng độ cholesterol lipoprotein mật độ thấp chưa điều trị
| Tổng nguy cơ CV (SCORE) % | Nồng độ LDL-C chưa điều trị | ||||||
| <1.4mmol/L
(55mg/dL) |
1.4 đến <1.8 mmol/L (55 đến <70 mg/dL) | 1.8 đến <2.6 mmol/L (70 đến <100 mg/dL) | 2.6 đến <3.0 mmol/L (100 đến <116 mg/dL) | 3.0 đến <4.9 mmol/L (116 đến <190 mg/dL) | ≥4.9mmol/L
(≥190mg/dL) |
||
| Phòng ngừa tiên phát | <1, nguy cơ thấp | Khuyên thay đổi lối sống | Khuyên thay đổi lối sống | Khuyên thay đổi lối sống | Khuyên thay đổi lối sống | Can thiệp lối sống, xem xét thêm thuốc nếu không kiểm soát được | Can thiệp lối sống và đồng thời can thiệp thuốc |
| Loại/Mức | I/C | I/C | I/C | I/C | IIa/A | IIa/A | |
| ≥1 đến <5, hoặc nguy cơ trung bình (xem Bảng 4) | Khuyên thay đổi lối sống | Khuyên thay đổi lối sống | Khuyên thay đổi lối sống | Can thiệp lối sống, xem xét thêm thuốc nếu không kiểm soát được | Can thiệp lối sống, xem xét thêm thuốc nếu không kiểm soát được | Can thiệp lối sống và đồng thời can thiệp thuốc | |
| Loại/Mức | I/C | I/C | IIa/A | IIa/A | IIa/A | IIa/A | |
| ≥5 đến <10, hoặc nguy cơ cao (xem Bảng 4) | Khuyên thay đổi lối sống | Khuyên thay đổi lối sống | Can thiệp lối sống, xem xét thêm thuốc nếu không kiểm soát được | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc | |
| Loại/Mức | IIa/A | IIa/A | IIa/A | I/A | I/A | I/A | |
| ≥10, hoặc nguy cơ rất cao do tình trạng nguy cơ (xem Bảng 4) | Khuyên thay đổi lối sống | Can thiệp lối sống, xem xét thêm thuốc nếu không kiểm soát được | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc | |
| Loại/Mức | IIa/B | IIa/A | I/A | I/A | I/A | I/A | |
| Phòng ngừa thứ phát | Nguy cơ rất cao | hiệp lối sống, xem xét thêm thuốc nếu không kiểm soát được | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc | Can thiệp lối sống và đồng thời can thiệp thuốc |
| Loại/Mức | IIa/A | I/A | I/A | I/A | I/A | I/A | |
4.2.2 Chiến lược can thiệp dựa trên nguy cơ
Bảng 5 trình bày các chiến lược can thiệp được đề xuất như là một hàm số của tổng nguy cơ CV và mức LDL-C. Cách tiếp cận được phân loại này dựa trên bằng chứng từ nhiều phân tích gộp và các thử nghiệm ngẫu nhiên có đối chứng (RCT) theo cá nhân, cho thấy giảm bậc nguy cơ ASCVD một cách đồng nhất khi đáp ứng với việc giảm mức TC và LDL-C (xem Khuyến cáo ước tính nguy cơ bệnh tim mạch dưới đây) [31-41]. Những dữ liệu này là nhất quán trong việc chỉ ra rằng, vì việc giảm nguy cơ tương đối là tỷ lệ thuận với giảm LDL-C tuyệt đối và giảm LDL-C tuyệt đối do một phác đồ thuốc cụ thể chỉ phụ thuộc vào LDL-C ban đầu, ở bất kỳ mức độ nguy cơ nền nhất định nào, mức LDL-C ban đầu càng cao thì càng giảm nguy cơ tuyệt đối. Tư vấn về điều trị thuốc cho từng cá nhân được đưa ra trong Phần 8.
Khuyến cáo về ước tính nguy cơ bệnh tim mạch
| Khuyến cáo | Loại | Mức |
| Ước tính tổng nguy cơ bằng cách sử dụng hệ thống ước tính nguy cơ như SCORE được khuyến cáo cho người lớn không triệu chứng >40 tuổi mà không có bằng chứng về CVD, DM, CKD, tăng cholesterol máu gia đình hoặc LDL-C >4.9 mmol/L (> 190 mg/dL). | I | C |
| Khuyến cáo rằng các cá nhân có nguy cơ cao và rất cao được xác định dựa trên ghi nhận CVD, DM, bệnh thận từ trung bình đến nặng, các yếu tố nguy cơ cá nhân ở mức rất cao, FH hoặc nguy cơ SCORE cao. Khuyến cáo rằng các bệnh nhân như vậy được xem là ưu tiên để tư vấn và quản lý tất cả các yếu tố nguy cơ. | I | C |
| Điểm nguy cơ được phát triển cho dân số chung không được khuyến cáo đánh giá nguy cơ CV ở bệnh nhân DM hoặc FH. | III | C |
CKD = bệnh thận mạn; CV = tim mạch; CVD = bệnh tim mạch; DM = đái tháo đường; FH = tăng cholesterol máu gia đình; LDL-C = cholesterol lipoprotein mật độ thấp; SCORE = Ước tính nguy cơ mạch vành có hệ thống.
5. Lipid và lipoprotein
5.1 Vai trò sinh học của lipid và lipoprotein
Lipoprotein trong huyết tương vận chuyển lipid đến các mô để sử dụng năng lượng, lắng đọng lipid, sản xuất hormone steroid và tạo acid mật. Lipoprotein bao gồm cholesterol ester hóa và không được ester hóa, TG, phospholipid và các thành phần protein có tên là apolipoprotein hoạt động như các thành phần cấu trúc, phối tử để liên kết với thụ thể tế bào và các chất kích hoạt hoặc ức chế enzyme.
Có sáu loại lipoprotein chính trong máu: chylomicron, lipoprotein mật độ rất thấp (VLDL), lipoprotein mật độ trung bình (IDL), LDL; Lp (a) và HDL (Bảng 6 và Hình 5 Phần bổ sung).
5.2 Vai trò của lipid và lipoprotein trong sinh lý bệnh xơ vữa động mạch
Tất cả các lipoprotein chứa ApoB có đường kính <70 nm, bao gồm các lipoprotein giàu TG nhỏ hơn và các hạt còn sót lại của chúng, có thể vượt qua hàng rào nội mô, đặc biệt là khi có rối loạn chức năng nội mô, nơi chúng có thể bị bắt giữ lại sau khi tương tác với các cấu trúc ngoại bào như proteoglycan [42]. Lipoprotein chứa ApoB được giữ lại trong thành động mạch gây ra một quá trình phức tạp dẫn đến sự lắng đọng lipid và đây là sự khởi đầu của một mảng xơ vữa [43].
Tiếp xúc lâu dài với các lipoprotein chứa ApoB làm cho các hạt được giữ lại ngày càng nhiều trong thành động mạch theo thời gian, dẫn đến sự phát triển và tiến triển của các mảng xơ vữa động mạch. Trung bình, những người có nồng độ lipoprotein chứa ApoB trong huyết tương cao hơn sẽ giữ lại nhiều hạt hơn và tích lũy lipid nhanh hơn, khiến cho sự tăng trưởng và tiến triển của các mảng xơ vữa động mạch nhanh hơn.
Bảng 6. Đặc điểm sinh lý và hóa học của lipoprotein người
| Đường
kính(nm) |
TG(%) | Choles- teryl ester (%) | PL(%) | Choles-terol(%) | Apolipoprotein | |||
| Chính | Khác | |||||||
| Chylomicron | <0.95 | 80-100 | 90-95 | 2-4 | 2-6 | 1 | ApoB-48 | ApoA-I, A-II, A- IV, A-V |
| VLDL | 0.95-1.006 | 30-80 | 50-65 | 8-14 | 12-16 | 4-7 | ApoB-100 | ApoA-I, C-II, C- III, E, A-V |
| IDL | 1.006-1.019 | 25-30 | 25-40 | 20-35 | 16-24 | 7-11 | ApoB-100 | ApoC- II, C-III, E |
| LDL | 1.019-1.063 | 20-25 | 4-6 | 34-34 | 22-26 | 6-15 | ApoB-100 | |
| HDL | 1.063-1.210 | 8-13 | 7 | 10-20 | 55 | 5 | ApoA-I | ApoA- II, C-III, E, M |
| Lp(a) | 1.006-1.125 | 25-30 | 4-8 | 35-46 | 17-24 | 6-9 | Apo(a) | ApoB-100 |
Apo = apolipoprotein; HDL = high-density lipoprotein; IDL = intermediate-density lipoprotein; LDL = low-density lipoprotein; Lp(a) = lipoprotein(a); PL = phospholipid; TG = triglyceride; VLDL = very low-density lipoprotein.
Bởi vì các mảng xơ vữa động mạch phát triển theo thời gian khi ngày càng nhiều các hạt lipoprotein chứa ApoB được giữ lại, nên kích thước của tổng các mảng xơ vữa động mạch có thể được xác định bởi nồng độ LDL-C lưu hành và các lipoprotein chứa ApoB khác cũng như tổng thời gian tiếp xúc với các lipoprotein này. Do đó, tổng kích thước mảng xơ vữa động mạch của một người có thể tỷ lệ thuận với khả năng tiếp xúc tích lũy với các lipoprotein này [44]. Cuối cùng, sự gia tăng gánh nặng mảng xơ vữa động mạch cùng với sự thay đổi thành phần của mảng xơ vữa đạt đến một điểm quan trọng mà sự phá vỡ của một mảng có thể dẫn đến sự hình thành huyết khối bên trên mảng gây tắc nghẽn dòng máu chảy cấp tính dẫn đến đau thắt ngực không ổn định, nhồi máu cơ tim (MI), hoặc tử vong. Do đó, nguy cơ gặp phải một biến cố ASCVD cấp tính tăng nhanh khi nhiều lipoprotein chứa ApoB bị giữ lại và gánh nặng mảng xơ vữa động mạch tăng lên. Điều này cung cấp cơ sở lý luận cho việc khuyến khích một lối sống lành mạnh để duy trì nồng độ thấp của các lipoprotein chứa ApoB trong suốt cuộc đời để làm chậm tiến trình xơ vữa động mạch; nó cũng giải thích động cơ thúc đẩy khuyến cáo điều trị làm giảm LDL-C và các lipoprotein có chứa ApoB khác, cho cả phòng ngừa ASCVD nguyên phát và phòng ngừa thứ phát các biến cố CV tái phát [44].
5.3 Bằng chứng về ảnh hưởng nhân quả của lipid và lipoprotein lên nguy cơ bệnh tim mạch do xơ vữa động mạch
5.3.1 Cholesterol lipoprotein mật độ thấp và nguy cơ xơ vữa động mạch
LDL-C huyết tương là phép đo khối lượng cholesterol được mang theo bởi các hạt LDL, mà phần lớn các lipoprotein chứa ApoB, và là một ước tính về nồng độ LDL lưu hành. Nhiều nghiên cứu dịch tễ học, nghiên cứu ngẫu nhiên Mendel và RCT đã liên tục chứng minh mối quan hệ tuyến tính-log giữa thay đổi tuyệt đối LDL-C huyết tương và nguy cơ ASCVD [34,45-50]. Tính nhất quán đáng chú ý giữa các nghiên cứu này, ngoài bằng chứng sinh học và thực nghiệm, cung cấp chứng cứ thuyết phục rằng LDL-C có liên quan nhân quả với nguy cơ ASCVD và việc hạ LDL-C làm giảm nguy cơ ASCVD tỷ lệ thuận với mức giảm tuyệt đối LDL-C đạt được [2,51].
Hơn nữa, các nghiên cứu ngẫu nhiên Mendel đã chứng minh rằng việc tiếp xúc lâu dài với mức LDL-C càng thấp có liên quan đến nguy cơ biến cố CV càng thấp hơn nhiều so với tiếp xúc ngắn hạn với LDL-C thấp (như đạt được trong các thử nghiệm ngẫu nhiên) [48,52]. Những dữ liệu này cung cấp hỗ trợ mạnh mẽ cho khái niệm rằng các hạt LDL có cả ảnh hưởng nhân quả và tích lũy lên nguy cơ ASCVD. Do đó, ảnh hưởng của LDL-C đến nguy cơ ASCVD dường như được xác định bởi cả cường độ tuyệt đối và tổng thời gian tiếp xúc với LDL-C [2].
Lợi ích lâm sàng của việc giảm LDL-C được xác định bằng việc làm giảm các hạt LDL lưu hành theo ước tính bởi ApoB, thường được phản chiếu thông qua việc giảm cholesterol do các hạt đó mang theo [2,53]. Vì vậy, lợi ích lâm sàng của các liệu pháp nhằm hạ LDL-C bằng cách làm giảm khối lượng hạt LDL sẽ tỷ lệ thuận với mức giảm tuyệt đối của LDL-C, bởi vì – về mặt trung bình – việc giảm các hạt LDL-C và LDL sẽ là đồng thời [34,50,54,55]. Ngược lại, lâm sàng lợi ích của các liệu pháp nhằm hạ LDL-C theo cơ chế làm thay đổi thành phần thực tế của chúng có thể không tỷ lệ thuận với mức giảm tuyệt đối LDL-C quan sát được, nhưng thay vào đó nó được kỳ vọng sẽ tỷ lệ thuận với sự thay đổi tuyệt đối về nồng độ hạt LDL thông qua việc giảm ApoB đo được [2,53].
5.3.2 Lipoprotein giàu triglyceride và nguy cơ xơ vữa động mạch
Các hạt VLDL giàu TG và phần còn sót lại của chúng mang hầu hết các TG lưu hành. Do đó, nồng độ TG huyết tương phản ánh nồng độ lipoprotein giàu TG chứa ApoB lưu hành.
Nồng độ TG huyết tương tăng có liên quan đến tăng nguy cơ ASCVD, nhưng mối liên quan này không còn sau khi điều chỉnh cho non-HDL-C, là một ước tính tổng nồng độ của tất cả các lipoprotein chứa ApoB [45]. Tương tự, hạ TG bằng fibrate làm giảm nguy cơ các biến cố CV tương đương với các liệu pháp hạ LDL-C khi được đo trên mỗi đơn vị thay đổi non-HDL-C [50], cho thấy ảnh hưởng của TG huyết tương lên ASCVD thông qua sự thay đổi nồng độ của các lipoprotein giàu TG theo ước tính bởi non-HDL-C.
Các nghiên cứu ngẫu nhiên Mendel cũng cho thấy mối liên quan giữa TG huyết tương và nguy cơ CHD có thể là nhân quả; tuy nhiên, bằng chứng này phải được giải thích một cách thận trọng vì gần như tất cả các biến thể liên quan đến TG cũng liên quan đến HDL-C, LDL-C hoặc Lp (a) [56-59]. Một nghiên cứu ngẫu nhiên Mendel gần đây đã chứng minh rằng biến thể lipoprotein lipase (LPL) TG thấp và biến thể thụ thể LDL LDL-C thấp có ảnh hưởng như nhau đến nguy cơ ASCVD trên mỗi đơn vị thay đổi ApoB, cho thấy rằng tất cả các lipoprotein chứa ApoB đều có ảnh hưởng tương tự lên nguy cơ CHD [53]. Cùng nhau, các nghiên cứu này cho thấy mạnh mẽ rằng ảnh hưởng nhân quả của lipoprotein giàu TG và phần còn sót lại của chúng lên nguy cơ ASCVD được quyết định bởi nồng độ lưu hành của các hạt có chứa ApoB, chứ không phải bởi chính hàm lượng TG.
5.3.3 Cholesterol lipoprotein mật độ cao và nguy cơ xơ vữa động mạch
Mối liên quan nghịch đảo giữa HDL-C huyết tương và nguy cơ ASCVD là một trong những mối liên quan nhất quán và có thể lặp lại được trong quan sát dịch tễ học [45,60]. Ngược lại, các nghiên cứu ngẫu nhiên Mendel không cung cấp bằng chứng thuyết phục rằng HDL-C có liên quan đến nguyên nhân nguy cơ ASCVD [49,61,62]. Tuy nhiên, bằng chứng này phải được giải thích một cách thận trọng vì hầu hết các biến thể di truyền liên quan đến HDL-C cũng liên quan đến những thay đổi ngược chiều về TG, LDL-C hoặc cả hai, do đó, ước tính ảnh hưởng của HDL-C lên nguy cơ ASCVD rất khó sử dụng thiết kế nghiên cứu ngẫu nhiên Mendel. Hơn nữa, không có bằng chứng từ các thử nghiệm ngẫu nhiên cho thấy tăng HDL-C trong huyết tương làm giảm nguy cơ biến cố CV [63-67]. Trong thử nghiệm dal- OUTCOMES gần đây, việc điều trị bằng dalcetrapib, một chất ức chế protein vận chuyển cholesteryl ester (CETP) làm tăng HDL-C mà không có bất kỳ tác dụng nào đối với LDL-C hoặc ApoB, đã không làm giảm nguy cơ biến cố CV chính. Tương tự, trong thử nghiệm ACCELERATE và REVEAL, chất ức chế CETP làm tăng gấp đôi nồng độ HDL-C, nhưng không làm giảm nguy cơ xảy ra các biến cố ASCVD vượt quá mong đợi từ việc làm giảm nhẹ nồng độ ApoB [2,63,64]. Ngoài ra, một số thử nghiệm ngẫu nhiên cho thấy việc truyền trực tiếp một chất tương tự HDL làm tăng nồng độ HDL huyết tương, nhưng không làm giảm sự tiến triển của bệnh xơ vữa động mạch thông qua phép đo bằng siêu âm nội mạch [68,69].
Do đó, hiện tại không có thử nghiệm ngẫu nhiên hoặc bằng chứng di truyền nào cho thấy rằng việc làm tăng HDL-C huyết tương có khả năng làm giảm nguy cơ biến cố ASCVD. Liệu các liệu pháp làm thay đổi chức năng của các hạt HDL sẽ làm giảm nguy cơ ASCVD hay không thì chưa rõ.
5.3.4 Lipoprotein (a) và nguy cơ xơ vữa động mạch
Lp (a) là một hạt LDL với một phân tử Apo (a) liên kết cộng hóa trị với thành phần ApoB của nó. Nó có đường kính <70 nm và có thể tự do đi qua hàng rào nội mô, nơi nó có thể – giống như LDL – được giữ lại trong thành động mạch và do đó có thể làm tăng nguy cơ ASCVD. Tác dụng gây xơ vữa của Lp (a) được cho là do khả năng thúc đẩy đông máu vì Lp (a) có cấu trúc tương tự như plasminogen, và tác dụng tiền viêm của nó rất có thể liên quan đến tải lượng phospholipid bị oxy hóa được Lp (a) mang theo [71].
Nồng độ Lp (a) trong huyết tương càng cao càng làm tăng nguy cơ ASCVD, nhưng dường như nó là yếu tố nguy cơ yếu hơn nhiều so với LDL-C ở hầu hết mọi người [72,73]. Ngược lại, các nghiên cứu ngẫu nhiên Mendel đã chứng minh một cách nhất quán rằng sự tiếp xúc suốt đời với mức Lp (a) cao có liên quan nhân quả mạnh mẽ với tăng nguy cơ ASCVD [74,75]. Trong khi các thử nghiệm ngẫu nhiên đánh giá những liệu pháp làm giảm Lp (a) 20-30% (bao gồm niacin và thuốc ức chế CETP) đã không cung cấp bằng chứng cho thấy việc hạ Lp (a) làm giảm nguy cơ ASCVD vượt quá mức dự kiến từ việc làm giảm lượng lipoprotein chứa ApoB, dữ liệu gần đây với chất ức chế PCSK9 đã đề xuất vai trò có thể của hạ Lp (a) trong việc làm giảm nguy cơ CV [76].
Bằng chứng mâu thuẫn này dường như đã được khẳng định bởi một nghiên cứu ngẫu nhiên Mendel gần đây cho thấy ảnh hưởng của Lp (a) lên nguy cơ ASCVD tỷ lệ thuận với sự thay đổi tuyệt đối về nồng độ Lp (a) huyết tương. Nghiên cứu này cũng cho thấy rằng những người có mức Lp (a) cực cao >180 mg/dL (> 430 nmol/L) có thể tăng nguy cơ ASCVD trọn đời tương tự như những người FH dị hợp tử (HeFH). Bởi vì khoảng 90% mức Lp (a) của một người là di truyền, Lp (a) cực cao có thể biểu hiện một rối loạn lipid di truyền mới có liên quan đến nguy cơ ASCVD trọn đời cực cao và có tần suất cao gấp hai lần so với HeFH [77]. Tuy nhiên, nghiên cứu này [77] và một nghiên cứu khác dựa trên thử nghiệm HPS2-THRIVE [78] đã chỉ ra rằng những thay đổi lớn về nồng độ tuyệt đối Lp (a) có thể cần thiết để làm giảm có ý nghĩa lâm sàng nguy cơ biến cố ASCVD.
5.4 Định lượng lipid và lipoprotein trong phòng xét nghiệm
Định lượng lipid và lipoprotein được sử dụng để ước tính nguy cơ ASCVD và hướng dẫn ra quyết định điều trị. Định lượng lipid huyết tương có thể được thực hiện trên huyết tương toàn phần và định lượng lipoprotein có thể được thực hiện bằng cách đo từng thành phần protein của chúng. Một cách hệ thống, lipoprotein được phân loại dựa trên mật độ ngậm nước của chúng (xem Bảng 6).
5.4.1 Định lượng lipoprotein
Với vai trò nguyên nhân trung tâm của các lipoprotein chứa ApoB trong sự khởi đầu và tiến triển của xơ vữa động mạch, việc đo trực tiếp nồng độ lưu hành của các lipoprotein chứa ApoB gây xơ vữa để ước tính nguy cơ và hướng dẫn quyết định điều trị sẽ là lý tưởng. Bởi vì tất cả các lipoprotein chứa ApoB – bao gồm VLDL, các hạt còn sót lại giàu TG, và LDL – đều chứa một phân tử ApoB, định lượng ApoB trực tiếp ước tính số lượng các hạt gây xơ vữa trong huyết tương. Hiện nay đã có các phương pháp tiêu chuẩn hóa, tự động hóa, chính xác và rẻ tiền để đo ApoB. Không cần nhịn ăn vì ngay cả ở trạng thái sau bữa ăn, chylomicron chứa ApoB48 thường chiếm <1% tổng nồng độ lipoprotein chứa ApoB lưu hành. Hơn nữa, hiệu suất phân tích của các phương pháp đo ApoB vượt trội hơn so với định lượng hoặc tính toán LDL-C và non-HDL-C [79].
5.4.2 Định lượng lipid
Trong thực hành lâm sàng, nồng độ lipoprotein huyết tương thường không được đo trực tiếp mà thay vào đó được ước tính bằng cách đo hàm lượng cholesterol của chúng. TC ở người được phân bố chủ yếu trong ba nhóm lipoprotein chính: VLDL, LDL và HDL. Một lượng nhỏ cholesterol cũng được chứa trong hai nhóm lipoprotein phụ: IDL và Lp (a). Một bộ xét nghiệm lipid huyết thanh tiêu chuẩn bao gồm nồng độ của TC và HDL-C, cũng như TG. Với các giá trị này, nồng độ LDL- C có thể được ước tính.
LDL-C huyết tương có thể được đo trực tiếp bằng cách sử dụng các kỹ thuật enzyme hoặc siêu ly tâm, nhưng trong y học lâm sàng, nó thường được tính toán bằng công thức Friedewald:
LDL-C = TC − HDL-C − (TG/2.2) [tính bằng mmol/L] hoặc là
LDL-C = TC − HDL-C − (TG/5) [tính bằng mg/dL]
Mặc dù thuận tiện nhưng giá trị tính toán Friedewald của LDL-C có một số hạn chế đã được xác định rõ: (i) các lỗi về mặt phương pháp có thể tích lũy do công thức yêu cầu ba phân tích TC, TG và HDL-C riêng biệt; và (ii) tỷ số cholesterol/TG được giả định không đổi trong VLDL. Với giá trị TG cao (> 4.5 mmol/L hoặc >400 mg/dL), công thức không thể được sử dụng. Điều này đặc biệt nên được xem xét trong các mẫu thử không nhịn ăn.
Để khắc phục các vấn đề liên quan đến LDL-C tính toán, phương pháp enzyme trực tiếp để đo LDL-C đã được phát triển. Các phương pháp này có sẵn trên thị trường, sử dụng các công cụ để phân tích tự động. Định nghĩa LDL-C theo công thức Friedewald và bằng phép đo trực tiếp là như nhau: non-HDL-C − VLDL-C, đại diện cho tổng cholesterol được mang bởi tiểu phần phụ về mặt sinh hóa là LDL, IDL và Lp (a).
Đối với dân số nói chung, LDL-C tính toán và LDL-C trực tiếp cho thấy mối tương quan rất mạnh [80-83]. Tuy nhiên, LDL-C tính toán đã được chứng minh là ước tính thấp LDL-C ở nồng độ TG ≥2 mmol/L (177 mg/dL ) [81,82]. Tương tự, ở mức LDL-C rất thấp, LDL-C tính toán có thể gây hiểu nhầm, đặc biệt là khi có sự hiện diện của TG cao [81,84-86]. Để tránh một số vấn đề với công thức Friedewald, một số sửa đổi để tính LDL-C đã được đề xuất, nhưng vẫn phải cần chứng minh liệu các sửa đổi này có vượt trội so với công thức Friedewald trong việc ước tính nguy cơ CV [81,85-87]. Điều quan trọng cần lưu ý là các phép đo LDL-C trực tiếp cũng có những hạn chế, bao gồm sai lệch hệ thống và không chính xác ở bệnh nhân rối loạn lipid máu, đặc biệt khi nồng độ TG cao [88-90].
Là một LDL-C tính toán thay thế, non-HDL-C có thể được tính là TC − HDL-C và là phép đo TC được mang bởi tất cả các lipoprotein chứa ApoB gây xơ vữa, bao gồm các hạt giàu TG trong VLDL và phần còn sót lại của chúng [100].
Hiện có một số phương pháp xác định Lp (a). Cấu trúc phân tử phức tạp của Lp (a) và sự thay đổi kích thước của Apo (a) là một thách thức trong việc phát triển các phương pháp phân tích cho Lp (a). Một số phương pháp – ở mức độ khác nhau – bị ảnh hưởng bởi đồng dạng Apo (a) [91]. Ngoài ra, nhiều xét nghiệm trả kết quả nồng độ Lp (a) là nồng độ mol (nmol/L) hoặc dưới dạng khối lượng (mg/dL), việc chuyển đổi giữa nồng độ mol và khối lượng đã được chứng minh là phụ thuộc vào kích thước và nồng độ [91-93]. Do đó, tiêu chuẩn hóa giữa các loại xét nghiệm là cần thiết để thiết lập một phương pháp đáng tin cậy và có thể lặp lại để định lượng khối lượng hoặc số hạt Lp (a) [92].
5.4.3 Có cần nhịn ăn trước xét nghiệm?
Theo truyền thống, mẫu máu để phân tích lipid được khuyến cáo ở trạng thái nhịn ăn. Các nghiên cứu có hệ thống gần đây so sánh các mẫu máu nhịn ăn và không nhịn ăn đã cho thấy rằng sự khác biệt là nhỏ đối với hầu hết các thông số lipid [85,94- 100]. Mẫu không nhịn ăn đã được sử dụng trong các nghiên cứu dựa trên dân số lớn [100]. Trong hầu hết các nghiên cứu, mẫu không nhịn ăn cho mức TG cao hơn khoảng 0.3 mmol/L (27 mg/dL) [100,101]. Trung bình, và đối với hầu hết các cá nhân, sự gia tăng này sẽ không có ý nghĩa lâm sàng. Thật vậy, một số hướng dẫn khuyến cáo mẫu thử không nhịn ăn [100,102,103].
Đối với tầm soát nguy cơ chung, mẫu không nhịn ăn dường như có tối thiểu giá trị tiên lượng giống như mẫu nhịn ăn [104]. Ưu điểm thực tế của mẫu không nhịn ăn, bao gồm sự chấp nhận của bệnh nhân tốt hơn, vượt trội hơn so với khả năng không chính xác ở một số bệnh nhân, mặc dù việc xác định một số xét nghiệm quan trọng, chẳng hạn như glucose lúc đói, có thể không thực hiện được. Hơn nữa, ngay cả khi mẫu không nhịn ăn có thể được sử dụng trong hầu hết các trường hợp, ở những bệnh nhân mắc hội chứng chuyển hóa (MetS), DM hoặc tăng triglyceride máu (HTG), LDL-C tính toán nên được giải thích một cách thận trọng.
5.5 Khuyến cáo về định lượng lipid và lipoprotein để ước tính nguy cơ mắc bệnh tim mạch do xơ vữa động mạch
Việc đo TC huyết tương là cần thiết để tính toán nguy cơ khi sử dụng SCORE, trong khi việc đưa vào mức HDL-C huyết tương có thể cải thiện ước tính nguy cơ bằng cách tính SCORE trực tuyến. Do đó, cả TC và HDL-C nên được đo để ước tính nguy cơ ASCVD của một người bằng SCORE hoặc một trong những cách tính nguy cơ khác (hầu hết tất cả đều bao gồm phép đo TC và HDL-C).
Nên đo LDL-C huyết tương để ước tính nguy cơ ASCVD có thể được điều chỉnh bằng các liệu pháp hạ LDL-C, và để xác định xem liệu mức LDL-C có tăng cao rõ rệt hay không, có thể cho thấy nguy cơ ASCVD cao trọn đời do tiếp xúc tích lũy suốt đời với nồng độ cao của các lipoprotein gây xơ vữa, như trong FH. LDL-C huyết tương có thể được tính toán hoặc đo trực tiếp.
TG huyết tương nên được đánh giá để xác định những người có nguy cơ ASCVD có thể thay đổi nhiều hơn so với được phản ánh bởi LDL-C, do sự hiện diện của nồng độ lipoprotein giàu TG chứa ApoB và phần còn sót lại của chúng gây xơ vữa, và để xác định những người mà LDL-C tính toán và đo trực tiếp có thể ước tính thấp nguy cơ ASCVD do đánh giá thấp nồng độ các hạt LDL lưu hành hoặc hàm lượng cholesterol được mang bởi các hạt đó, chẳng hạn như những hạt có nồng độ LDL rất thấp. Điều này có thể đặc biệt liên quan ở những bệnh nhân DM hoặc MetS.
Nhìn chung, nồng độ LDL-C, non-HDL-C và ApoB có mối tương quan rất cao. Kết quả là, trong hầu hết các trường hợp, chúng cung cấp thông tin rất giống nhau về nguy cơ ASCVD [45,105-108]. Tuy nhiên, trong một số trường hợp nhất định, bao gồm những người có nồng độ TG cao, DM, béo phì hoặc mức LDL-C đạt được rất thấp, thì nồng độ LDL-C tính toán hoặc đo trực tiếp có thể đánh giá thấp cả tổng nồng độ cholesterol được mang bởi LDL và, quan trọng hơn là đánh giá thấp tổng nồng độ lipoprotein chứa ApoB, do đó ước tính thấp nguy cơ ASCVD. Khoảng 20% bệnh nhân có thể có sự không phù hợp giữa mức LDL-C và ApoB đo được [85,109].
Xem xét khả năng thiếu chính xác của LDL-C trong rối loạn lipid máu, ở những bệnh nhân DM hoặc nồng độ TG cao, và ở những bệnh nhân có mức LDL-C rất thấp, nên đo cả ApoB và non-HDL-C như một phần của phân tích lipid thường quy trong đánh giá nguy cơ bệnh nhân có TG huyết tương cao. Do ApoB cung cấp ước tính chính xác về tổng nồng độ các hạt gây xơ vữa trong mọi trường hợp, nên đây là phép đo được ưu tiên để tinh chỉnh thêm ước tính nguy cơ ASCVD có thể điều chỉnh được bằng liệu pháp hạ lipid.
Lp (a) có cấu trúc tương tự như plasminogen và liên kết với thụ thể plasminogen, dẫn đến tăng huyết khối (yếu tố thúc đẩy huyết khối). Việc đo Lp (a) nên được xem xét ít nhất một lần trong đời của mỗi người, nếu có thể, để xác định những người được di truyền mức Lp (a) ≥180 mg/dL (≥430 nmol/L) và do đó, có nguy cơ ASCVD trọn đời rất cao tương đương với nguy cơ liên quan đến HeFH. Ngoài ra, chiến lược này có thể xác định những người có mức cao Lp (a) cực thấp, là những người có thể có nguy cơ ASCVD cao hơn nhưng không được phản ánh bởi hệ thống SCORE hoặc mức lipid/lipoprotein khác. Đo Lp (a) đã được chứng minh là cung cấp tái phân loại nguy cơ được cải thiện đáng kể về mặt lâm sàng trong một số bệnh cảnh nhất định, và do đó nên được xem xét ở những bệnh nhân có nguy cơ ước tính ASCVD trong10 năm gần với ngưỡng giữa nguy cơ cao và trung bình [110-112]. Các khuyến cáo về định lượng lipid và lipoprotein để ước tính nguy cơ ASCVD được tóm tắt dưới đây.
Khuyến cáo về phân tích lipid để ước tính nguy cơ bệnh tim mạch
| Khuyến cáo | Loại | Mức |
| TC được sử dụng để ước tính tổng nguy cơ CV bằng phương pháp hệ thống SCORE. | I | C |
| Phân tích HDL-C được khuyến cáo để tinh chỉnh thêm ước tính nguy cơ bằng hệ thống SCORE trực tuyến. | I | C |
| Phân tích LDL-C được khuyến cáo là phương pháp phân tích lipid chính để tầm soát, chẩn đoán và quản lý. | I | C |
| Phân tích TG được khuyến cáo là một phần của quá trình phân tích lipid thường quy. | I | C |
| Đánh giá non-HDL-C được khuyến cáo để đánh giá nguy cơ, đặc biệt ở những người có nồng độ TG cao, DM, béo phì hoặc mức LDL-C rất thấp. | I | C |
| Phân tích ApoB được khuyến cáo để đánh giá nguy cơ, đặc biệt ở những người có nồng độ TG cao, DM, béo phì, hội chứng chuyển hóa hoặc mức LDL-C rất thấp. Nó có thể được sử dụng như một thay thế cho LDL-C, nếu có sẵn, như là phép đo chính cho tầm soát, chẩn đoán và quản lý, và có thể được ưu tiên hơn so với non-HDL- C ở những người có TG cao, DM, béo phì hoặc mức LDL-C rất thấp. | I | C |
| Đo Lp (a) nên được xem xét ít nhất một lần trong đời của mỗi người trưởng thành để xác định những người có nồng độ Lp (a) rất cao di truyền >180 mg/dL (> 430nmol/L), là người có thể có nguy cơ ASCVD trọn đời tương đương với nguy cơ liên quan với tăng cholesterol máu gia đình dị hợp tử. | IIA | C |
| Lp (a) nên được xem xét ở những bệnh nhân chọn lọc có tiền sử gia đình CVD sớm và để tái phân loại ở những người có nguy cơ lân cận giữa trung bình và cao. | IIA | C |
Apo = apolipoprotein; ASCVD = bệnh tim mạch xơ vữa động mạch; CV = tim mạch; CVD = bệnh tim mạch; DM = đái tháo đường; HDL-C = cholesterol lipoprotein mật độ cao; LDL-C = cholesterol lipoprotein mật độ thấp; Lp (a) = lipoprotein (a); SCORE = Ước tính nguy cơ mạch vành có hệ thống; TC = cholesterol toàn phần; TG = triglyceride.
6. Mục tiêu và mục đích của điều trị
Trong Hướng dẫn EAS/ESC trước đây về quản lý rối loạn lipid máu [1,113] và các hướng dẫn chính khác về điều trị cholesterol máu để làm giảm nguy cơ CV xơ vữa động mạch ở người trưởng thành [40,114] nhấn mạnh đến tầm quan trọng của việc hạ LDL-C để dự phòng ASCVD. Nhóm chuyên trách Châu Âu cảm thấy rằng việc giới hạn kiến thức hiện tại về phòng ngừa CV chỉ dựa vào kết quả từ RCT làm giảm việc khai thác tiềm năng sẵn có để ngăn ngừa ASCVD. Chính sự phù hợp của các kết luận từ nhiều cách tiếp cận khác nhau (từ khoa học cơ bản, quan sát lâm sàng, di truyền học, dịch tễ học, RCT, v.v.) đã đóng góp vào sự hiểu biết về nguyên nhân của ASCVD và vào tiềm năng phòng ngừa. Nhóm chuyên trách nhận thức được những hạn chế của một số nguồn chứng cứ và thừa nhận rằng RCT đã không đánh giá các mục tiêu LDL-C khác nhau một cách hệ thống, nhưng cảm thấy rằng việc xem xét tổng thể bằng chứng là phù hợp. Đặc biệt là xem xét các kết quả từ các phân tích gộp xác nhận việc giảm ASCVD phụ thuộc liều của các thuốc hạ LDL-C; càng giảm mức LDL-C tuyệt đối thì càng giảm nguy cơ CV [35,36,50,115]. Những lợi ích liên quan đến việc giảm LDL-C là không chuyên biệt cho liệu pháp statin [33]. Không có mức giới hạn dưới LDL-C hết hữu ích hoặc gây hại đã được xác định.
Đáp ứng LDL-C của từng cá nhân có sự thay đổi đáng kể đối với chế độ ăn kiêng và điều trị thuốc [31], là phương pháp quản lý truyền thống được áp dụng theo cách tiếp cận dung nạp dần. Giảm tổng nguy cơ CV nên được cá nhân hóa, và điều này có thể cụ thể hơn nếu mục tiêu được xác định. Việc sử dụng các mục tiêu cũng có thể hỗ trợ sự giao tiếp giữa bác sĩ và bệnh nhân. Người ta đánh giá rằng cách tiếp cận mục tiêu có thể tạo điều kiện cho việc tuân thủ điều trị, mặc dù ý kiến đồng thuận này chưa được kiểm tra đầy đủ. Vì tất cả những lý do như vậy, Nhóm chuyên trách Châu Âu vẫn duy trì cách tiếp cận mục tiêu đối với các mục tiêu điều trị và quản lý lipid được điều chỉnh theo tổng mức nguy cơ CV. Cũng có bằng chứng cho thấy rằng việc hạ LDL-C vượt quá mục tiêu đã được đặt ra trong Hướng dẫn EAS/ESC trước đây có liên quan đến biến cố ASCVD ít hơn [34,116,117]. Do đó, giảm LDL-C xuống mức thấp nhất có thể dường như là phù hợp, ít nhất là ở những bệnh nhân có nguy cơ CV rất cao và vì lý do này, nên giảm tối thiểu LDL 50%, cùng với việc đạt được mục tiêu phù hợp.
Các mục tiêu lipid là một phần của chiến lược giảm nguy cơ CV toàn diện và được tóm tắt trong Bảng 7. Cơ sở lý luận cho các mục tiêu không phải lipid được đề cập trong Hướng dẫn phòng ngừa chung ESC 2016 [10].
Cách tiếp cận mục tiêu để quản lý lipid chủ yếu nhằm mục đích giảm nguy cơ xơ vữa động mạch thông qua việc làm giảm đáng kể LDL-C xuống mức đã đạt được trong các thử nghiệm quy mô lớn về thuốc ức chế PCSK-9 gần đây. Do đó, đối với bệnh nhân có nguy cơ CV rất cao, dù là phòng ngừa thứ phát hoặc (hiếm khi) là phòng ngừa tiên phát, việc giảm LDL-C ≥50% so với mức ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL ) được khuyến cáo. Đối với bệnh nhân ASCVD gặp biến cố mạch máu thứ hai trong vòng 2 năm (không nhất thiết phải cùng loại với biến cố đầu tiên) mặc dù đang dùng liệu pháp dựa trên statin dung nạp tối đa, mục tiêu LDL-C <1.0 mmol/L (<40 mg/dL) có thể được xem xét [119,120]. Đối với những người có nguy cơ CV cao, giảm LDL-C ≥50% so với mức ban đầu và mục tiêu LDL-C <1.8 mmol/L (<70 mg/dL) được khuyến cáo. Ở bệnh nhân có nguy cơ CV trung bình, mục tiêu LDL-C <2.6 mmol/L (<100 mg/dL) nên được xem xét, trong khi đối với những người có nguy cơ thấp, mục tiêu <3.0 mmol/L (<116 mg/dL) có thể được xem xét (xem Khuyến cáo về mục tiêu điều trị đối với cholesterol lipoprotein mật độ thấp dưới đây và Bảng 2 Phần bổ sung).
Khuyến cáo về mục tiêu điều trị đối với cholesterol lipoprotein mật độ thấp
| Khuyến cáo | Loại | Mức |
| Trong phòng ngừa thứ phát cho những bệnh nhân có nguy cơ rất caoc , giảm LDL-C ≥50% so với mức ban đầud và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL) được khuyến cáo [33-35,119,120]. | I | A |
| Trong phòng ngừa tiên phát cho những người có nguy cơ rất cao nhưng không FHc , giảm LDL-C ≥50% so với mức ban đầud và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL) được khuyến cáo [34 36]. | I | C |
| Trong phòng ngừa tiên phát cho những người FH có nguy cơ rất cao, giảm LDL-C ≥50% so với ban đầu và LDL-Cmục tiêu <1.4 mmol/L (<55 mg/dL) nên được xem xét. | IIa | C |
| Đối với bệnh nhân ASCVD bị biến cố mạch máu thứ hai trong vòng 2 năm (không nhất thiết phải cùng loại với biến cố đầu tiên) trong khi dùng liệu pháp dựa trên statin dung nạp tối đa, mục tiêu LDL-C <1.0 mmol/L (<40 mg/dL) có thể được xem xét [119,120]. | IIb | B |
| Ở những bệnh nhân có nguy cơ caoc , giảm LDL-C ≥50% so với mức ban đầud và mục tiêu LDL-C <1.8 mmol/L (<70 mg/dL) được khuyến cáo [34,35]. | I | A |
| Ở những người có nguy cơ trung bìnhc , nên xem xét mục tiêu LDL- C <2.6 mmol/L (<100 mg/dL) [34]. | IIa | A |
| Ở những người có nguy cơ thấpc , có thể xem xét mục tiêu LDL-C <3.0 mmol/L (<116 mg/dL) [36]. | IIb | A |
ASCVD = bệnh tim mạch xơ vữa động mạch; FH = tăng cholesterol máu gia đình; LDL-C = cholesterol lipoprotein mật độ thấp. c Xem Bảng 4 để biết định nghĩa. d Thuật ngữ ‘mức ban đầu’ đề cập đến mức LDL-C ở một người không dùng bất kỳ loại thuốc hạ LDL-C nào. Ở những người đang dùng thuốc hạ LDL-C, mức LDL-C ban đầu dự kiến (chưa điều trị) cần được ước tính mức, dựa trên hiệu quả hạ LDL-C trung bình của thuốc đã chỉ định hoặc thuốc kết hợp.
Bảng 7. Mục tiêu và mục đích điều trị để dự phòng bệnh tim mạch
| Hút thuốc | Không tiếp xúc với thuốc lá dưới mọi hình thức. |
| Chế độ ăn | Chế độ ăn uống lành mạnh ít chất béo bão hòa, tập trung vào các sản phẩm nguyên hạt, rau, trái cây và cá. |
| Hoạt động thể chất | 3.5-7 h hoạt động thể chất mạnh khỏe vừa phải mỗi tuần hoặc 30-60 phút hầu hết các ngày. |
| Cân nặng | BMI 20-25 kg/m2 và chu vi vòng eo <94 cm (nam) và <80 cm (nữ). |
| Huyết áp | <140/90 mmHg. a |
| LDL-C | Nguy cơ rất cao trong phòng ngừa tiên phát hoặc thứ phát: Phác đồ điều trị đạt được mức giảm ≥50% LDL-C so với mức ban đầu b và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL). Hiện tại không sử dụng statin: điều này có thể yêu cầu liệu pháp hạ LDL cường độ cao. Hiện đang điều trị hạ LDL: cần tăng cường độ điều trị. Nguy cơ cao: Phác đồ điều trị đạt được giảm ≥50% LDL-C so với ban đầu b và mục tiêu LDL-C <1.8 mmol/L(<70 mg/dL). Nguy cơ trung bình: Mục tiêu <2.6 mmol/L (<100 mg/dL). Nguy cơ thấp: Mục tiêu <3.0 mmol/L (<116 mg/dL). |
| Non-HDL-C | Các mục tiêu phụ non-HDL-C là <2.2, 2.6 và 3.4 mmol/L (<85, 100 và 130 mg/dL) lần lượt ở người có nguy cơ rất cao, cao và trung bình. |
| ApoB | Các mục tiêu phụ ApoB là <65, 80 và 100 mg/dL lần lượt ở người có nguy cơ rất cao, cao và trung bình. |
| Triglyceride | Không có mục tiêu, nhưng <1.7 mmol/L (<150 mg/dL) cho thấy nguy cơ thấp hơn và nồng độ cao hơn cho thấy cần phải tìm kiếm các yếu tố nguy cơ khác. |
| Đái tháo đường | HbA1c: <7% (<53 mmol/mol). |
Apo = apolipoprotein; BMI = chỉ số khối cơ thể; HDL-C = cholesterol lipoprotein mật độ cao; LDL-C = cholesterol lipoprotein mật độ thấp.
a Mục tiêu điều trị thấp hơn được khuyến cáo cho hầu hết bệnh nhân tăng huyết áp được điều trị, với điều kiện là điều trị được dung nạp tốt [118].
b Thuật ngữ ‘mức ban đầu’ đề cập đến nồng độ LDL-C ở một người không dùng bất kỳ loại thuốc hạ lipid nào hoặc giá trị ban đầu được ngoại suy cho những người đang được điều trị.
Các mục tiêu phụ cũng đã được xác định bằng suy luận cho non-HDL-C và ApoB; chúng nhận được một phân cấp trung bình, vì chúng chưa được nghiên cứu rộng rãi trong các RCT. Mục tiêu cụ thể đối với non-HDL-C nên cao hơn 0.8 mmol/L (30 mg/dL) so với mục tiêu LDL-C thích hợp; việc điều chỉnh liệu pháp hạ lipid theo các mục tiêu phụ này có thể được xem xét ở những bệnh nhân có nguy cơ CV rất cao sau khi đạt được mục tiêu LDL-C, mặc dù những ưu điểm lâm sàng của cách tiếp cận này đối với khía cạnh kết cục chưa chứng minh. Khi sử dụng các mục tiêu phụ, thì khuyến cáo là: (i) non-HDL-C <2.2 mmol/L (<85 mg/dL), <2.6 mmol/L (<100 mg/dL) và <3.4 mmol/L (<130 mg/dL) lần lượt ở người có nguy cơ CV rất cao, cao và trung bình [121-123], và (ii) ApoB <65 mg/dL, <80 mg/dL và <100 mg/dL lần lượt ở người có tổng nguy cơ CV rất cao, cao và trung bình [121,123,124].
Cho đến nay, không có mục tiêu cụ thể nào về nồng độ HDL-C hoặc TG được xác định trong các thử nghiệm lâm sàng, mặc dù HDL-C tăng dự đoán thoái lui xơ vữa động mạch, và HDL-C thấp có liên quan đến các biến cố và tỷ lệ tử vong quá mức ở bệnh nhân mắc bệnh mạch vành (CAD), ngay cả ở mức LDL thấp. Bác sĩ lâm sàng nên sử dụng phán đoán lâm sàng khi xem xét tăng cường điều trị thêm ở những bệnh nhân có tổng nguy cơ CV cao hoặc rất cao.
7. Thay đổi lối sống để cải thiện bộ lipid huyết tương
Vai trò quan trọng của dinh dưỡng trong phòng ngừa ASCVD đã được đánh giá sâu rộng [125-129]. Các yếu tố của chế độ ăn uống ảnh hưởng đến sự phát triển CVD trực tiếp hoặc thông qua tác động của chúng lên những yếu tố nguy cơ truyền thống, chẳng hạn như lipid huyết tương, HA hoặc mức glucose.
Tuy nhiên, bằng chứng thuyết phục về mối liên hệ nhân quả giữa chế độ ăn và nguy cơ ASCVD là gián tiếp có được từ các nghiên cứu ngẫu nhiên ‘chuyển hóa’ cho thấy lượng chất béo bão hòa cao làm tăng nồng độ LDL-C và từ các nghiên cứu đoàn hệ, nghiên cứu dịch tễ học di truyền và các thử nghiệm ngẫu nhiên cho thấy mức LDL-C cao gây ra ASCVD.
Việc thiếu sự phù hợp giữa các nghiên cứu là do (i) vấn đề phương pháp (đặc biệt là cỡ mẫu không đủ hoặc thời gian nghiên cứu ngắn) và (ii) những khó khăn trong đánh giá tác động của một yếu tố chế độ ăn đơn lẻ với bất kỳ thay đổi nào khác trong chế độ ăn [130]. Thực tế, vì thực phẩm là hỗn hợp của các chất dinh dưỡng khác nhau và nhiều thành phần khác, nên việc quy kết ảnh hưởng sức khỏe của thực phẩm đối với chỉ một trong các thành phần của nó là không phù hợp. Hơn nữa, nếu lượng năng lượng phải được giữ không đổi thì ăn ít chất dinh dưỡng đa lượng có nghĩa là bắt buộc phải ăn nhiều chất khác. Chất lượng của loại dinh dưỡng thay thế (ví dụ, chất béo không bão hòa vs. các loại hạt tinh chế cao) có thể ảnh hưởng đến tác dụng quan sát được, điều chỉnh đáng kể tác động đến sức khỏe của chất dinh dưỡng được thay thế. Với những hạn chế này, cần phải thận trọng trong việc diễn giải kết quả của RCT hoặc thậm chí phân tích gộp các RCT liên quan đến ảnh hưởng của thay đổi chế độ ăn lên ASCVD [130].
Để khắc phục những vấn đề này, ít nhất là một phần, trong những năm gần đây, nghiên cứu dinh dưỡng đã tập trung vào mối quan hệ giữa ASCVD và, một mặt là các loại thực phẩm, mặt khác là chế độ ăn – thay vì các chất dinh dưỡng đơn lẻ. Bằng chứng nhất quán từ các nghiên cứu dịch tễ học chỉ ra rằng ăn nhiều trái cây, rau quả không chứa tinh bột, các loại hạt, đậu, cá, dầu thực vật, sữa chua và hạt toàn phần, cùng với giảm thịt đỏ và thịt chế biến, thực phẩm có hàm lượng carbohydrate tinh chế cao và muối có liên quan đến tỷ lệ mắc mới biến cố CV thấp hơn [131]. Ngoài ra, điều đó chứng tỏ rằng việc thay thế chất béo động vật, bao gồm cả chất béo từ sữa, bằng nguồn chất béo thực vật và acid béo đa không bão hòa (PUFA) có thể làm giảm nguy cơ CVD [132].
Các chế độ ăn kiêng đã được đánh giá rất sâu rộng là chế độ DASH (Dietary Approaches to Stop Hypertension, Phương pháp Ăn kiêng để Phòng ngừa Tăng huyết áp) – đặc biệt liên quan đến kiểm soát HA – và chế độ ăn Địa Trung Hải; cả hai đều được chứng minh là có hiệu quả trong việc giảm các yếu tố nguy cơ CV và dường như có thể góp phần ngăn ngừa ASCVD [133]. Dầu ô liu tinh khiết chưa qua chế biến là khác biệt rõ nhất của chế độ ăn Địa Trung Hải và chế độ ăn DASH. Chế độ ăn Địa Trung Hải có liên quan đến giảm tần suất CV và các bệnh không lây truyền khác trong nhiều nghiên cứu dịch tễ học [134,135] và đã được chứng minh bằng RCT về hiệu quả giảm biến cố CV trong dự phòng tiên phát và thứ phát [136]. Đặc biệt là thử nghiệm PREDIMED đã cho thấy những người trong nhóm chế độ ăn kiểu Địa Trung Hải, được bổ sung dầu ô liu tinh khiết hoặc các loại hạt, có tỷ lệ mắc mới biến cố CV chính thấp hơn đáng kể (khoảng 30%) so với những người trong nhóm chế độ ăn ít chất béo [137].
Tóm lại, mặc dù kết quả của PREDIMED và một vài nghiên cứu can thiệp khác với kết cục ASCVD đã hỗ trợ lối sống lành mạnh để phòng ngừa ASCVD, nhưng RCT không thể là cơ sở duy nhất để khuyến cáo chế độ ăn uống. Khuyến cáo cũng cần phải dựa trên sự kết hợp giữa các nghiên cứu đoàn hệ quan sát lớn và các thử nghiệm ngẫu nhiên tương đối ngắn hạn có các yếu tố nguy cơ trung gian (như lipid máu) như là kết cục.
Bảng 8 tóm tắt bằng chứng hiện có về ảnh hưởng của thay đổi lối sống và thực phẩm chức năng lên lipoprotein, cho thấy mức ảnh hưởng và mức độ bằng chứng liên quan đến tác động lên loại lipoprotein cụ thể; vì những lý do nêu trên, mức độ bằng chứng không dựa trên RCT với kết cục ASCVD. Ngoài ra, trong Hướng dẫn về quản lý rối loạn lipid máu, thông tin về khả năng cải thiện bộ lipoprotein huyết tương bằng chế độ ăn uống là có liên quan đến lâm sàng, ngay cả khi không có minh chứng rõ ràng về lợi ích CV.
Bảng 8. Tác động của thay đổi lối sống cụ thể đến nồng độ lipid
| Cường độ ảnh hưởng | Mức | TLTK | |
| Can thiệp lối sống để giảm nồng độ TC và LDL-C | |||
| Tránh chất béo trans | ++ | A | 129,138 |
| Giảm chất béo bão hòa trong chế độ ăn uống | ++ | A | 129,139 |
| Tăng chất xơ trong chế độ ăn uống | ++ | A | 140,141 |
| Sử dụng thực phẩm chức năng làm giàu với phytosterol | ++ | A | 142,143 |
| Sử dụng men gạo đỏ dinh dưỡng | ++ | A | 144-146 |
| Giảm trọng lượng cơ thể dư thừa | ++ | A | 147,148 |
| Giảm cholesterol trong chế độ ăn uống | + | B | 149,150 |
| Tăng hoạt động thể chất theo thói quen | + | B | 151 |
| Can thiệp lối sống để giảm nồng độ lipoprotein giàu TG | |||
| Giảm trọng lượng cơ thể dư thừa | + | A | 147,148 |
| Giảm lượng rượu uống | +++ | A | 152,154 |
| Tăng hoạt động thể chất theo thói quen | ++ | A | 151,154 |
| Giảm tổng lượng carbohydrate chế độ ăn uống | ++ | A | 147,155 |
| Sử dụng bổ sung chất béo đa không bão hòa n-3 | ++ | A | 156,157 |
| Giảm nhập lượng mono- và disaccharide | ++ | B | 158,159 |
| Thay thế chất béo bão hòa bằng chất béo đơn hoặc đa không bão hòa | + | B | 129,137 |
| Can thiệp lối sống để tăng nồng độ HDL-C | |||
| Tránh chất béo trans | ++ | A | 129,160 |
| Tăng hoạt động thể chất theo thói quen | +++ | A | 151,161 |
| Giảm trọng lượng cơ thể dư thừa | ++ | A | 147,148 |
| Giảm carbohydrate chế độ ăn uống và thay thế chúng bằng chất béo không bão hòa | ++ | A | 147,162 |
| Có thể tiếp tục sử dụng rượu nhưng với lượng ít | ++ | B | 153 |
| Bỏ thuốc lá | + | B | 163 |
Cường độ ảnh hưởng (+++ = >10%, ++ = 5-10%, + = <5%) và mức độ bằng chứng đề cập đến tác động của từng thay đổi chế độ ăn uống đối với nồng độ trong huyết tương của một loại lipoprotein cụ thể.
7.1 Ảnh hưởng của lối sống lên nồng độ cholesterol toàn phần và cholesterol lipoprotein mật độ thấp
Acid béo bão hòa (SFA) là yếu tố chế độ ăn có tác động lớn nhất đến mức LDL-C (tăng 0.02-0.04 mmol/L hoặc 0.8-1.6 mg/dL LDL-C cho mỗi 1% năng lượng đến từ chất béo bão hòa) [164]. Về mặt định lượng, các acid béo trans trong chế độ ăn có tác dụng làm tăng LDL-C tương tự như với SFA; tuy nhiên, trong khi SFA làm tăng nồng độ HDL-C, chất béo trans lại làm giảm chúng [137]. Acid béo không bão hòa trans có thể được tìm thấy với số lượng hạn chế (thường là <5% tổng lượng chất béo) trong các sản phẩm sữa và trong thịt của động vật nhai lại. ‘Acid béo hydro hóa một phần’ có nguồn gốc công nghiệp là nguồn acid béo trans chính trong chế độ ăn; mức tiêu thụ trung bình của acid béo trans dao động từ 0.2-6.5% tổng năng lượng trong các quần thể khác nhau [165]. Dầu giàu chất béo không bão hòa từ nghệ tây, hướng dương, hạt cải dầu, hạt lanh, ô liu, hoặc đậu nành đã được chứng minh là làm giảm nồng độ LDL-C (-0.42 đến -0.20 mmol/L) khi được sử dụng thay thế cho thực phẩm giàu SFA như bơ hoặc mỡ lợn [166]. Ảnh hưởng của việc tiêu thụ carbohydrate lên LDL-C được mô tả trong phần 7.4.3.
Giảm trọng lượng cơ thể cũng ảnh hưởng đến nồng độ TC và LDL-C, nhưng mức độ ảnh hưởng là rất nhỏ: ở người béo phì, nồng độ LDL-C giảm 0.2 mmol/L (8 mg/dL) được ghi nhận cho mỗi 10 kg cân nặng giảm [147,167]. Việc giảm mức LDL-C do tập thể dục thường xuyên thậm chí còn nhỏ hơn [151,168]. Lợi ích của cân nặng giảm và tập thể dục trên hồ sơ nguy cơ CV có thể tác động lên các yếu tố nguy cơ khác, đặc biệt là tăng huyết áp và đái tháo đường.
Bảng 9 tóm tắt các lựa chọn thực phẩm có thể có để làm giảm mức TC và LDL- C. Với sự đa dạng về văn hóa của các cộng đồng Châu Âu, chúng nên được chuyển thành những hành vì thực tế, cân nhắc những thói quen và yếu tố kinh tế xã hội tại địa phương.
Bảng 9. Lựa chọn thực phẩm để giảm cholesterol lipoprotein mật độ thấp và cải thiện bộ lipoprotein tổng thể
| Được ưu tiên | Được sử dụng có chừng mực | Thỉnh thoảng được chọn với số lượng hạn chế | |
| Ngũ cốc | Các loại hạt | Bánh mì, gạo, mì ống, bánh quy, bột ngô | Bánh ngọt, bánh nướng xốp, bánh nướng, bánh sừng bò |
| Rau | Rau sống và chín | Khoai tây | Chế phẩm rau trong bơ hoặc kem |
| Cây họ đậu | Đậu lăng, các loại đậu, đậu tằm, đậu Hà Lan, đậu xanh, đậu tương | ||
| Trái cây | Trái cây tươi hoặc đông lạnh | Trái cây sấy khô, thạch, mứt, trái cây đóng hộp, kem, kem/kẹo que, nước ép trái cây | |
| Kẹo và chất ngọt | Chất làm ngọt không calo | Sucrose, mật ong, sô cô la, kẹo | Bánh, kem, fructose, nước ngọt |
| Thịt và cá | Thịt nạc và cá béo, gia cầm không da | Thịt nạc của bò, cừu, lợn, và thịt bê, hải sản, động vật có vỏ | Xúc xích, xúc xích ý, thịt xông khói, sườn non, hot dogs, thịt nội tạng |
| Thức ăn từ sữa và trứng | Sữa tách kem và sữa chua | Sữa ít béo, phô mai ít béo và các sản phẩm sữa khác, trứng | Phô mai thông thường, kem, sữa toàn phần và sữa chua |
| Dầu ăn và nước chấm | Giấm, mù tạt, nước sốt không béo | Dầu ô liu, dầu thực vật không nhiệt đới, bơ thực vật mềm, trộn salad, mayonnaise, sốt cà chua | Chất béo trans và bơ thực vật cứng (tốt hơn là tránh chúng), dầu cọ và dầu dừa, bơ, mỡ lợn, mỡ thịt xông khói |
| Hạt | Tất cả, không ướp muối (trừ dừa) | Dừa | |
| Cách chế biến | Nướng, luộc, hấp | Xào, rang | Chiên |
7.2 Ảnh hưởng của lối sống lên nồng độ triglyceride
Giảm cân giúp cải thiện độ nhạy insulin và giảm lượng TG. Tập thể dục thường xuyên làm giảm nồng độ TG huyết tương hơn và trên tác dụng của giảm cân nặng [151,168,169]. Uống rượu có một tác động lớn đến nồng độ TG, đặc biệt ở những người HTG [153,170]. Tác động bất lợi của chế độ ăn giàu carbohydrate đối với TG xảy ra chủ yếu khi tiêu thụ thực phẩm giàu carbohydrate tinh chế, trong khi chúng ít nổi bật hơn nếu chế độ ăn chủ yếu dựa trên thực phẩm có chỉ số đường huyết thấp, giàu chất xơ. Điều này đặc biệt áp dụng cho những người mắc DM hoặc MetS [171,172].
Sử dụng theo thói quen một lượng fructose đáng kể (> 10% năng lượng) trong chế độ ăn góp phần làm tăng TG, đặc biệt ở những người HTG hoặc béo phì bụng. Những tác dụng này phụ thuộc vào liều; với mức tiêu thụ fructose theo thói quen từ 15-20% tổng năng lượng, TG huyết tương tăng tới 30-40%. Sucrose, một disaccharide chứa glucose và fructose, là một nguồn fructose quan trọng trong chế độ ăn uống [159,173,174].
7.3 Ảnh hưởng của lối sống đến nồng độ cholesterol lipoprotein mật độ cao
Giảm cân làm tăng nồng độ HDL-C; tăng 0.01 mmol/L (0.4 mg/dL) cho mỗi kg trọng lượng cơ thể giảm khi tình trạng giảm cân đã ổn định. Hoạt động thể chất hiếu khí, chẳng hạn như đi bộ nhanh 25-30 km mỗi tuần (hoặc bất kỳ hoạt động tương đương nào), có thể làm tăng mức HDL-C thêm 0.08-0.15 mmol/L (3.1-6 mg/dL) [169]. Ngừng hút thuốc lá cũng có thể góp phần làm tăng HDL-C, với điều kiện không bị tăng cân [163].
7.4 Khuyến cáo về lối sống để cải thiện bộ lipid huyết tương
Giảm LDL-C là mục tiêu chính để giảm nguy cơ CV và do đó xứng đáng được nhấn mạnh đặc biệt trong đánh giá các biện pháp can thiệp về lối sống. Chế độ ăn uống được khuyến cáo cho dân số nói chung và đặc biệt là cho những người có nguy cơ CV tăng, cũng có thể điều chỉnh nồng độ TG và HDL-C huyết tương (Bảng 9). Phần này tập trung vào chế độ ăn uống và các yếu tố lối sống khác có thể được thực hiện để cải thiện bộ lipoprotein tổng thể.
7.4.1 Trọng lượng cơ thể và hoạt động thể chất
Vì thừa cân, béo phì và đặc biệt là tình trạng béo phì bụng thường góp phần vào rối loạn lipid máu, nên giảm lượng nhập calo và tăng chi tiêu năng lượng ở những người thừa cân và/hoặc béo phì bụng.
Trong trường hợp thừa cân, giảm trọng lượng cơ thể, ngay cả khi ít (5-10% trọng lượng cơ thể), cũng cải thiện các bất thường về lipid và ảnh hưởng tốt đến các yếu tố nguy cơ CV khác thường xuất hiện ở những người rối loạn lipid [148]. Trong khi các tác dụng có lợi của giảm cân nặng lên những chỉ dấu chuyển hóa và thay thế đã được chứng minh, thì lợi ích của việc giảm cân đối với tỷ lệ tử vong và kết cục CV là không rõ ràng [175].
Giảm cân có thể đạt được bằng cách giảm tiêu thụ thực phẩm đậm đặc năng lượng, làm thâm hụt calo từ 300-500 kcal/ngày. Can thiệp nên kết hợp chế độ ăn uống và tập thể dục; cách tiếp cận này cũng dẫn đến sự cải thiện lớn nhất về hiệu suất thể chất và chất lượng cuộc sống, và hạn chế làm giảm khối lượng cơ và xương, đặc biệt ở người lớn tuổi [176]. Khuyên những người bị rối loạn lipid máu nên tập thể dục thường xuyên ở cường độ vừa phải ≥30 phút/ngày là luôn luôn thích hợp, ngay cả khi họ không bị thừa cân [168].
7.4.2 Chất béo trong chế độ ăn
Tránh tiêu thụ bất kỳ chất béo trans là một biện pháp quan trọng trong phòng ngừa CVD bằng chế độ ăn uống. Các acid béo trans được tạo ra trong quá trình tạo nước một phần của dầu thực vật chiếm 80% tổng lượng ăn vào. Nhờ vào nỗ lực thực hiện ở những khu vực khác nhau trên toàn thế giới, lượng acid béo trans trong chế độ ăn đã giảm đáng kể trong vòng 10-15 năm qua.
Đối với chất béo bão hòa, mức tiêu thụ của nó nên <10% tổng lượng calo và nên giảm hơn nữa (<7% năng lượng) khi bị tăng cholesterol máu. Đối với hầu hết mọi người, tổng lượng chất béo ăn vào rất khác nhau nhưng đều được chấp nhận và sẽ phụ thuộc vào sở thích và đặc điểm của từng người. Tuy nhiên, chất béo chiếm >35- 40% lượng calo thường liên quan đến việc tăng tiêu thụ chất béo bão hòa và calo. Ngược lại, tiêu thụ ít chất béo và dầu làm tăng nguy cơ cung cấp không đủ vitamin E và các acid béo thiết yếu, có thể góp phần làm giảm HDL-C [164].
Lượng chất béo nên chủ yếu đến từ các nguồn acid béo đơn bão hòa, bao gồm PUFA n-6 và n-3. Không đủ dữ liệu để đưa ra khuyến cáo về tỷ lệ acid béo n-3 : n- 6 tối ưu [177,178]. Lượng cholesterol trong chế độ ăn nên giảm (<300 mg/ngày), đặc biệt ở những người có mức cholesterol huyết tương cao.
7.4.3 Carbohydrate là chất xơ trong chế độ ăn
Carbohydrate trong chế độ ăn có tác dụng ‘trung tính’ đối với LDL-C, mặc dù tiêu thụ quá mức được biểu hiện bằng các tác dụng không mong muốn lên nồng độ TG và HDL-C huyết tương [164]. Chất xơ (đặc biệt là loại hòa tan) – có trong cây họ đậu, trái cây, rau và ngũ cốc nguyên hạt (ví dụ như yến mạch và lúa mạch) – có tác dụng hạ cholesterol máu và là một chất thay thế tốt cho chất béo bão hòa trong chế độ ăn để tối đa hóa tác dụng của chế độ ăn lên mức LDL-C và để giảm thiểu tác dụng không mong muốn của carbohydrate cao trên các lipoprotein khác trong chế độ ăn [140,179].
Lượng carbohydrate nên nằm trong khoảng từ 45-55% tổng năng lượng, vì tỷ lệ phần trăm cao hơn hoặc thấp hơn của carbohydrate có liên quan đến tăng tỷ lệ tử vong [180,181]. Chế độ ăn thay đổi theo chất béo cung cấp 25-40 g tổng lượng chất xơ mỗi ngày, bao gồm ≥7-13 g chất xơ hòa tan, được dung nạp tốt, hiệu quả và được khuyến cáo để kiểm soát lipid huyết tương; ngược lại, không có lý do nào để khuyến cáo về chế độ ăn carbohydrate rất thấp [182].
Lượng đường bổ sung không được vượt quá 10% tổng năng lượng (ngoài lượng có trong thực phẩm tự nhiên như trái cây và các sản phẩm từ sữa); lời khuyên hạn chế hơn liên quan đến đường có thể hữu ích cho những người cần giảm cân hoặc nồng độ TG huyết tương cao, MetS hoặc DM. Nước uống có gas nên được sử dụng với mức độ vừa phải theo dân số chung, và nên hạn chế đáng kể ở những người có mức TG cao hoặc béo phì tạng [158,159,174]. Nghiên cứu PURE là một nghiên cứu đoàn hệ lớn về dịch tễ học trên 135 335 người tại 18 quốc gia với bảng câu hỏi ghi nhận về tần suất thực phẩm. Tổng lượng và các loại chất béo không liên quan đến tỷ lệ tử vong CVD, MI hoặc CVD, trong khi chất béo bão hòa có mối liên hệ nghịch đảo với đột quỵ [181]. Tuy nhiên, một phân tích gộp các nghiên cứu dịch tễ học bao gồm nghiên cứu PURE cho thấy mối quan hệ hình chữ U giữa lượng carbohydrate và tỷ lệ tử vong: chế độ ăn liên quan đến tỷ lệ tử vong cao nhất có lượng carbohydrate chiếm >70% và <40% năng lượng, với nguy cơ tối thiểu quan sát thấy khi lượng carbohydrate nằm trong khoảng 45-55% tổng năng lượng [180].
7.4.4 Rượu
Uống rượu vừa phải [≤10 g/ngày (1 đơn vị) cho nam và nữ] được chấp nhận đối với những người quen uống thức uống có cồn, nếu nồng độ TG không cao [183,184].
7.4.5 Hút thuốc Ngưng hút thuốc có lợi ích rõ ràng về nguy cơ CV tổng thể, và cụ thể là đối với nồng độ HDL-C [163].
7.5 Thực phẩm bổ sung và thực thẩm chức năng trong chế độ ăn để điều trị rối loạn lipid máu
Đánh giá mặt dinh dưỡng của thực phẩm chức năng không chỉ bao gồm tìm kiếm bằng chứng lâm sàng về tác dụng có lợi liên quan đến cải thiện sức khỏe hoặc làm giảm nguy cơ mắc bệnh, mà còn chứng minh khả năng dung nạp tốt. Nhìn chung, cho đến nay, bằng chứng hiện có về thực phẩm chức năng được xác định trong lĩnh vực này là không đầy đủ; khoảng trống chủ yếu là không có các thử nghiệm can thiệp dựa trên chế độ ăn đủ thời gian để bộc lộ rối loạn lipid máu và CVD một cách tự nhiên.
7.5.1 Phytosterol
Các phytosterol chủ yếu là sitosterol, campesterol và stigmasterol; chúng có sẵn trong dầu thực vật và một lượng nhỏ hơn trong rau, trái cây tươi, các loại hạt, ngũ cốc và các loại đậu. Lượng sterol thực vật ăn trung bình vào khoảng từ 250 mg/ngày ở Bắc Âu đến 500 mg/ngày ở các nước Địa Trung Hải. Phytosterol cạnh tranh với cholesterol để hấp thụ ở đường ruột, do đó điều chỉnh nồng độ TC.
Tiêu thụ 2 g phytosterol hàng ngày có thể có hiệu quả làm giảm mức TC và LDL- C xuống 7-10% ở người (với một mức độ không đồng nhất nhất định giữa các cá nhân), trong khi nó ít hoặc không ảnh hưởng đến mức HDL-C và TG [143]. Tuy nhiên, cho đến nay, không có nghiên cứu nào được thực hiện về tác động sau đó đến CVD. Dựa trên việc giảm LDL-C và không có dấu hiệu bất lợi, thực phẩm chức năng có sterol/stanol thực vật (≥2 g/ngày trong bữa ăn chính) có thể được xem xét: (i) ở người có mức cholesterol cao với mức nguy cơ CV tổng thể trung bình hoặc thấp, là những người chưa cần điều trị thuốc; (ii) như là liệu pháp bổ trợ cho liệu pháp dược lý ở những bệnh nhân có nguy cơ cao và rất cao, là những người không đạt được mục tiêu LDL-C bằng statin hoặc không thể điều trị statin; và (iii) ở người lớn và trẻ em (từ >6 tuổi) bị FH, phù hợp với hướng dẫn hiện hành [142].
7.5.2 Monacolin và gạo men đỏ
Gạo men đỏ (RYR) là một nguồn sắc tố lên men đã được sử dụng ở Trung Quốc như một chất làm tăng màu thực phẩm và tăng hương vị trong nhiều thế kỷ. Tác dụng hạ cholesterol máu của RYR có liên quan đến cơ chế giống như statin – ức chế hydroxymethylglutaryl-coenzyme A (HMG-CoA) reductase – của monacolin, là thành phần sinh học có hoạt tính. Các chế phẩm thương mại khác nhau của RYR có nồng độ monacolin khác nhau, làm giảm nồng độ TC và LDL-C ở những mức độ khác nhau, nhưng người tiêu dùng không thể tạo ra sự khác biệt đó [144,185]. Hơn nữa, tính an toàn khi sử dụng những sản phẩm này về lâu dài đã không được ghi nhận đầy đủ và những vấn đề an toàn do trong một số chế phẩm có thể chứa các chất nguy hiểm. Những tác dụng phụ giống như với statin cũng đã được báo cáo.
Trong RCT duy nhất trên bệnh nhân ASCVD, một chiết xuất được tinh chế một phần của RYR đã làm giảm 45% các biến cố tái phát [146]. Hiệu quả hạ cholesterol máu có ý nghĩa lâm sàng (giảm tới 20%) đã được quan sát thấy với các chế phẩm RYR dùng một lần mỗi ngày [o.d – once daily (omni die)] liều 2.5-10 mg monacolin K [145]. Thực phẩm dinh dưỡng chứa RYR tinh chế có thể được xem xét ở người có nồng độ cholesterol huyết tương cao, là những người chưa cần thiết phải điều trị statin khi đánh giá nguy cơ CV tổng thể của họ. Tuy nhiên, cần phải có quy định tốt hơn về việc bổ sung RYR. Thông tin về thành phần chính xác của các sản phẩm này, số lượng các thành phần của chúng và độ tinh khiết của chúng nên được công bố đầy đủ [185].
7.5.3 Chất xơ trong chế độ ăn
Bằng chứng hiện nay chứng minh nhất quán tác dụng hạ TC và LDL-C của β-glucan, một chất xơ nhớt từ yến mạch và lúa mạch. Thực phẩm được làm giàu các chất xơ hoặc chất bổ sung này được dung nạp tốt, hiệu quả và được khuyến cáo để làm giảm LDL-C [186]. Tuy nhiên, liều lượng cần thiết để đạt được mức giảm LDL-C có ý nghĩa lâm sàng 3-5% thay đổi từ 3-10 g mỗi ngày theo từng loại chất xơ cụ thể [187].
7.5.4 Đậu nành
Tác dụng làm giảm cholesterol của đậu nành thường được cho là do hàm lượng isoflavone và phytoestrogen của nó, mức độ chế biến đậu nành càng cao sẽ làm hàm lượng các chất này càng giảm. Protein đậu nành cũng đã cho thấy là có thể làm hạ LDL-C nhẹ khi là thực phẩm thay thế cho protein động vật. Tuy nhiên, điều này đã không được xác nhận khi thay đổi thành phần dinh dưỡng khác cũng được đưa vào chế độ ăn [187,188].
7.5.5 Policosanol và berberine
Policosanol là một hỗn hợp tự nhiên của rượu aliphatic chuỗi dài được chiết xuất chủ yếu từ sáp mía [189]. Các nghiên cứu cho thấy rằng policosanol từ mía, lúa hoặc mầm lúa mì có ảnh hưởng không đáng kể lên LDL-C, HDL-C, TG, ApoB, Lp ( a), homocysteine, protein phản ứng C độ nhạy cao, fibrinogen hoặc nồng độ yếu tố đông máu [190].
Đối với berberine, một phân tích gộp gần đây đã đánh giá ảnh hưởng của nó lên lipid huyết tương ở người [191]. Nghiên cứu so sánh của berberine và can thiệp lối sống hoặc giả dược cho thấy trong nhóm berberine, nồng độ LDL-C và TG huyết tương đã giảm hiệu quả hơn so với nhóm đối chứng. Tuy nhiên, do thiếu các RCT chất lượng cao nên hiệu quả của berberine trong điều trị rối loạn lipid máu cần phải được xác nhận thêm. Hơn nữa, sinh khả dụng của các chế phẩm berberine khác nhau là một vấn đề tranh luận [187].
7.5.6 Acid béo không bão hòa n-3
Bằng chứng quan sát chỉ ra rằng ăn cá (ít nhất hai lần một tuần) và thực phẩm thực vật giàu acid béo n-3 (acid α-linoleic có trong quả óc chó, một số loại rau và một số loại dầu hạt) làm giảm nguy cơ tử vong CV và đột quỵ, nhưng không có tác dụng chính lên chuyển hóa lipoprotein huyết tương [178,192]. Liều dược lý của acid béo n-3 chuỗi dài (2-3 g/ngày) làm giảm nồng độ TG khoảng 30% và cũng làm giảm phản ứng lipid máu sau bữa ăn, nhưng liều cao hơn có thể làm tăng nồng độ LDL- C. Acid α-linolenic kém hiệu quả trong việc thay đổi nồng độ TG [156,193]. Một nghiên cứu gần đây cho thấy liều ethyl icosapent 2 g hai lần một ngày (b.i.d.) làm giảm đáng kể nguy cơ thiếu máu cục bộ, bao gồm tử vong CV, ở những bệnh nhân có nồng độ TG cao mặc dù sử dụng statin liều điều trị [194].
Các đặc điểm khác của chế độ ăn uống lành mạnh góp phần ngăn ngừa CVD được trình bày trong Dữ liệu bổ sung.
8. Các loại thuốc điều trị rối loạn lipid máu
8.1 Statin
8.1.1 Cơ chế tác dụng
Statin làm giảm tổng hợp cholesterol ở gan bằng cách ức chế hoàn toàn enzyme HMG-CoA reductase, là bước hạn chế tỷ lệ trong sinh tổng hợp cholesterol. Việc giảm lượng cholesterol nội bào thúc đẩy tăng biểu hiện thụ thể LDL (LDLR) ở bề mặt tế bào gan, từ đó làm tăng tiêu thụ LDL từ máu, dẫn đến giảm nồng độ LDL- và các lipoprotein khác chứa ApoB trong huyết tương, bao gồm các hạt giàu TG.
8.1.2 Tác dụng trên lipid
8.1.2.1 Cholesterol lipoprotein mật độ thấp
Mức giảm LDL-C phụ thuộc vào liều và khác nhau giữa các statin khác nhau. Phác đồ cường độ cao được định nghĩa là liều statin làm giảm LDL-C ≥50% (trung bình); Liệu pháp cường độ trung bình được định nghĩa là liều statin dự kiến sẽ giảm 30- 50% LDL-C. Đáng chú ý, có sự khác biệt đáng kể giữa các cá thể trong việc giảm LDL-C với cùng một liều statin [31]. Đáp ứng kém với điều trị statin trong các nghiên cứu lâm sàng ở một mức độ nào đó là do tuân thủ kém, nhưng cũng có thể được giải thích bởi nền tảng di truyền [195,196]. Vì có sự khác nhau giữa các cá thể trong đáp ứng với statin nên cần theo dõi đáp ứng khi bắt đầu điều trị.
Ở những bệnh nhân không thể dung nạp phác đồ cường độ statin được khuyến cáo do tác dụng phụ hoặc những người không đạt được mục tiêu điều trị, khuyến cáo là bổ sung một thuốc điều chỉnh lipid không phải statin vào statin dung nạp tối đa [197,198].
8.1.2.2 Triglyceride
Statin thường làm giảm nồng độ TG từ 10-20% so với mức ban đầu [199]. Các loại statin mạnh (atorvastatin, rosuvastatin và pitavastatin) cho thấy làm giảm mạnh nồng độ TG, đặc biệt ở liều cao và ở những bệnh nhân tăng TG (HTG) – tức là tăng nguy cơ tuyệt đối – và do đó giảm nguy cơ tuyệt đối mạnh hơn.
Cơ chế của tác dụng hạ TG chưa được xác định rõ ràng, nhưng dường như nó độc lập một phần với con đường LDLR. Nó có thể liên quan đến việc điều hòa tăng cường sự hấp thu VLDL của tế bào gan, cũng như giảm tốc độ sản xuất VLDL; những tác dụng này dường như phụ thuộc vào nồng độ VLDL trước điều trị [200].
8.1.2.3 Cholesterol lipoprotein mật độ cao
Trong một phân tích gộp [201], nồng độ HDL-C bị thay đổi theo liều giữa các statin tương ứng; độ cao như vậy dao động từ 1-10%. Tuy nhiên, vì các lipoprotein chứa ApoB gây xơ vữa giảm rõ rệt qua trung gian statin, dẫn đến mức ảnh hưởng rất nhẹ đến nồng độ HDL-C cũng có thể góp phần làm giảm nguy cơ CV tổng thể được quan sát thấy là đồng nhất trong các thử nghiệm can thiệp statin có thể đáng tin cậy.
8.1.2.4 Lipoprotein (a)
Statin chỉ ảnh hưởng nhẹ đến nồng độ Lp (a) huyết tương. Các nghiên cứu trước đây cho thấy không ảnh hưởng hoặc làm tăng Lp (a) sau khi điều trị statin [202,203]. Cơ chế mà statin làm tăng phospholipid oxy hóa trên Lp (a) cần phải nghiên cứu thêm.
8.1.3 Tác dụng khác của statin
Mặc dù tác dụng chính của statin là làm giảm nồng độ LDL-C, một số tác dụng khác, có thể có ảnh hưởng quan trọng đã được đề xuất (tác dụng nhiều hướng của statin) [204,205]. Trong số các tác dụng này thì tác dụng có ý nghĩa tiềm năng ngăn ngừa CVD là kháng viêm và tác dụng chống oxy hóa của điều trị statin. Những tác dụng này đã được chứng minh trong phòng thí nghiệm và thực nghiệm, nhưng ý nghĩa lâm sàng của chúng vẫn chưa được chứng minh [18,206].
8.1.3.1 Ảnh hưởng đến tỷ lệ mắc bệnh và tử vong do tim mạch
Một số lượng lớn các phân tích gộp đã được thực hiện để phân tích tác động của statin trong quần thể và trong các phân nhóm [34-36,38,51,207-214]. Trong phân tích gộp CTT dựa trên dữ liệu cá nhân tham gia (IPD) với >170,000 người trong 26 RCT về statin vs. nhóm chứng hoặc phác đồ statin nhiều vs. ít tích cực [34], đối với mỗi 1 mmol/L LDL-C giảm đi, statin/statin tích cực hơn làm giảm các biến cố mạch máu lớn (MI, tử vong CAD, hoặc bất kỳ đột quỵ hay tái thông mạch vành) khoảng 22%, biến cố mạch vành lớn 23%, tử vong CAD 20%, tổng đột quỵ 17% và tổng tỷ lệ tử vong 10% trong 5 năm. Hiệu quả tỷ lệ thuận (mỗi mmol/L LDL-C giảm đi) đối với các biến cố mạch máu lớn là tương tự nhau trong tất cả các phân nhóm được đánh giá, vì vậy giảm nguy cơ tuyệt đối là tỷ lệ thuận với nguy cơ ban đầu tuyệt đối. Lợi ích tương đối lớn hơn 50% trong năm đầu tiên so với các năm tiếp theo. Không có nguy cơ gia tăng đối với bất kỳ nguyên nhân tử vong nào không do CV, bao gồm cả ung thư, ở những người trong nhóm statin. Lợi ích tuyệt đối từ việc điều trị statin thấp hơn ở những người với mục đích phòng ngừa tiên phát, là những người thường có nguy cơ thấp [36,38,214,215]. Trong phân tích gộp CTT về điều trị ở những người có nguy cơ thấp bị bệnh mạch máu [36], việc giảm nguy cơ tương đối của các biến cố mạch máu chính trên mỗi mmol/L LDL-C giảm đi tối thiểu cũng lớn ở những người có nguy cơ thấp (ví dụ như trong phòng ngừa tiên phát). Ở những người không có tiền sử bệnh mạch máu, liệu pháp statin làm giảm nguy cơ tử vong do mọi nguyên nhân xuống 9% mỗi mmol/L LDL-C giảm đi. Các kết quả tương tự đã được báo cáo trong tổng quan Cochrane 2013 [213]. Dữ liệu của nghiên cứu WOSCOPS gần đây đã được phân tích lại và chứng minh rằng ngay cả những người không DM và dự đoán nguy cơ ASCVD 10 năm <7.5% cũng được hưởng lợi từ việc điều trị statin. Về lâu dài, statin cũng có lợi ích sống còn là 18% đối với tử vong do mọi nguyên nhân trong 20 năm [216]. Statin có hiệu quả phòng ngừa ASCVD ở người cao tuổi, bao gồm cả những người >75 tuổi [217]. Statin không hiệu quả trong một số ít các phân nhóm cụ thể, đặc biệt là những người bị suy tim (HF) hoặc bệnh nhân được chạy thận nhân tạo [214,218-222].
Bằng chứng hiện có từ các phân tích gộp cho thấy rằng lợi ích lâm sàng của điều trị statin phần lớn là hiệu quả theo loại, nhờ làm giảm LDL-C tuyệt đối; do đó, loại statin được sử dụng sẽ phản ánh mục tiêu điều trị cho một bệnh nhân nhất định.
Thứ tự sau đây có thể được đề xuất.
• Đánh giá tổng nguy cơ CV của cá nhân.
• Xác định mục tiêu điều trị (tùy thuộc vào nguy cơ hiện tại).
• Mời bệnh nhân tham gia vào các quyết định về quản lý nguy cơ CV.
• Chọn một phác đồ statin và, khi cần thiết, các điều trị bổ sung (ví dụ: ezetimibe hoặc thuốc ức chế PCSK9) để có thể đạt được mục tiêu điều trị (phần trăm và giá trị tuyệt đối).
• Đáp ứng với điều trị statin là khác nhau, do đó có thể cần phải tăng liều statin trước khi bắt đầu phối hợp thuốc điều trị hạ LDL.
Đây là những tiêu chí chung cho việc lựa chọn thuốc. Các yếu tố như tình trạng lâm sàng của bệnh nhân, những thuốc sử dụng đồng thời, khả năng dung nạp thuốc, truyền thống điều trị ở địa phương và chi phí thuốc sẽ đóng vai trò chính trong việc quyết định lựa chọn cuối cùng về loại statin và liều dùng.
Hơn nữa, tác dụng của statin trên một số bệnh cảnh lâm sàng khác đã được đánh giá. Đối với ung thư, một phân tích gộp về IPD từ các thử nghiệm ngẫu nhiên đã chỉ ra rằng statin không có bất kỳ ảnh hưởng đáng kể nào đến bệnh ung thư, ít nhất là trong khoảng thời gian 5 năm [223]. Các bệnh cảnh khác, chẳng hạn như chứng mất trí nhớ [224], gan nhiễm mỡ [225], thuyên tắc huyết khối tĩnh mạch [226], rung nhĩ [227,228] và hội chứng buồng trứng đa nang [229] cũng đã được nghiên cứu, và việc statin không có ảnh hưởng đến các tình trạng này đã được chứng minh một cách đáng tin cậy.
Việc ảnh hưởng đến bệnh Alzheimer gần đây đã được đánh giá trong phân tích Cochrane cho thấy không có tác động rõ ràng nào từ statin [230]. Ngoài ra, các chức năng nhận thức thần kinh đã được khảo sát rộng rãi trong nghiên cứu EBBINGHAUS [231] và không có nguy cơ quá mức được tìm thấy ở những bệnh nhân dùng phác đồ statin được phân ngẫu nhiên vào nhóm PCSK9 mAb.
8.1.4 Tác dụng phụ và tương tác của statin
Các statin khác nhau về hấp thu, sinh khả dụng, liên kết protein huyết tương, bài tiết và tính ưa chất béo. Người ta thường khuyến cáo sử dụng statin vào buổi tối. Lovastatin và simvastatin là tiền chất, trong khi các loại statin có sẵn khác được sử dụng ở dạng hoạt động. Sinh khả dụng của chúng tương đối thấp, do trước tiên phải đi qua gan và nhiều statin bị chuyển hóa đáng kể tại gan thông qua các isoenzyme cytochrome (CYP) P450, ngoại trừ pravastatin, rosuvastatin và pitavastatin. Các enzyme này được biểu hiện chủ yếu ở gan và thành ruột. Mặc dù statin thường được dung nạp rất tốt, nhưng chúng có một số tác dụng phụ đặc biệt lên cơ, cân bằng nội môi glucose và đột quỵ xuất huyết. Tuy nhiên, cũng có thông tin sai lệch phổ biến về các tác dụng phụ tiềm năng, như được đánh giá gần đây [232,233].
8.1.4.1 Tác dụng phụ trên cơ
Bệnh cơ là tác dụng phụ có ý nghĩa lâm sàng nhất của statin. Trong số các yếu tố nguy cơ gây bệnh cơ, thì yếu tố đặc biệt quan trọng được xem xét là sự tương tác với thuốc sử dụng đồng thời (xem bên dưới). Tiêu cơ vân là dạng tổn thương cơ nghiêm trọng nhất do statin gây ra, đặc trưng bởi đau cơ nghiêm trọng, hoại tử cơ và myoglobin niệu có khả năng dẫn đến suy thận và tử vong. Trong tiêu cơ vân, nồng độ creatine kinase (CK) tăng ≥10 lần và thường ≥40 lần giới hạn trên của mức bình thường (ULN) [234]. Tần suất tiêu cơ vân đã được ước tính là 1-3 trường hợp/100,000 bệnh nhân-năm [235]. Bệnh nhân sử dụng liệu pháp statin thường xuyên cho biết các triệu chứng cơ [còn gọi là ‘triệu chứng cơ liên quan đến statin’ (SAMS)], và trong các nghiên cứu quan sát không ngẫu nhiên, statin có liên quan đến đau và nhứt cơ mà không tăng CK hoặc mất chức năng chính của cơ, với tần suất SAMS được báo cáo trong các nghiên cứu như vậy là khác nhau giữa 10-15% ở những người được điều trị statin [236-238]. Tuy nhiên, một phần vì những người trong nghiên cứu quan sát không mù với phương pháp điều trị mà họ đang được áp dụng, nên những nghiên cứu như vậy không đáng tin cậy khi được sử dụng để đánh giá tác dụng phụ của statin [233]. Ngược lại, trong các thử nghiệm ngẫu nhiên mù về statin vs. giả dược thì không có, hoặc chỉ có một chút, tăng tần suất triệu chứng cơ trong các nhóm được nhận statin [239,240]. Nghiên cứu ASCOT-LLA đã giải quyết vấn đề này bằng cách so sánh tỷ lệ mắc mới của bốn tác dụng phụ khác nhau, bao gồm các triệu chứng liên quan đến cơ, trong cả khoảng thời gian mù và khoảng thời gian kéo dài sang nhãn mở của thử nghiệm đối chứng giả dược [238]. Họ kết luận rằng hiệu ứng “tôi sẽ gây hại” (nghĩa là nỗi ám ảnh statin gây ra triệu chứng cơ làm cho bệnh nhân dễ báo cáo họ bị triệu chứng cơ hơn) có thể giải thích phần nào tần suất cao hơn của SAMS trong các nghiên cứu quan sát so với trong các thử nghiệm. Đề xuất quản lý thực tế các triệu chứng cơ được trình bày trong Hình 6 Phần bổ sung [198,234,241]. Một số nghiên cứu đã cho thấy tác dụng hạ LDL-C đáng kể của liều thay thế, chẳng hạn như cách ngày hoặc hai lần một tuần, với atorvastatin hoặc rosuvastatin [242]. Mặc dù không thử nghiệm lâm sàng nào lấy kết cục làm trung tâm, nhưng chiến lược này nên được xem xét ở những bệnh nhân có nguy cơ cao mà việc điều trị statin với liều hàng ngày là không thể.
8.1.4.2 Tác dụng phụ trên gan
Hoạt động của alanine aminotransferase (ALT) trong huyết tương thường được sử dụng để đánh giá tổn thương tế bào gan. Tăng nhẹ ALT xảy ra ở 0.5-2% bệnh nhân đang điều trị statin, thường gặp hơn với statin mạnh hoặc liều cao. Định nghĩa chung về tăng ALT có ý nghĩa lâm sàng là tăng gấp ba lần ULN trong hai lần xét nghiệm liên tiếp. Mức tăng nhẹ ALT chưa được chứng minh là có liên quan đến nhiễm độc gan thực sự hoặc thay đổi chức năng gan. Tiến triển thành suy gan là cực kỳ hiếm, do đó, việc theo dõi ALT thường quy trong quá trình điều trị statin không còn được khuyến cáo nữa [43]. Bệnh nhân bị tăng nhẹ ALT do nhiễm mỡ đã được nghiên cứu trong thời gian điều trị statin và không có dấu hiệu nào cho thấy statin làm bệnh gan xấu hơn [244-246].
8.1.4.3 Tăng nguy cơ mắc đái tháo đường mới khởi phát
Bệnh nhân đang điều trị statin đã được chứng minh là có biểu hiện tăng nguy cơ rối loạn đường huyết và phát triển đái tháo đường type 2 (T2DM). Một số nghiên cứu đã chỉ ra rằng đây là một tác dụng phù hợp, liên quan đến liều [232]. Việc tăng nhẹ HbA1c không có ý nghĩa lâm sàng cũng đã được quan sát thấy. Con số cần thiết để gây ra một trường hợp đái tháo đường được ước tính là 255 trong 4 năm điều trị statin [247]. Tuy nhiên, nguy cơ cao hơn khi dùng statin mạnh hơn ở liều cao [248] và cũng cao hơn ở người cao tuổi, và có các yếu tố nguy cơ khác của đái tháo đường như thừa cân hoặc kháng insulin [249]. Nhìn chung, việc giảm tuyệt đối nguy cơ CVD ở bệnh nhân có nguy cơ cao rõ ràng vượt xa tác dụng phụ làm tăng nhẹ tỷ lệ mắc mới đái tháo đường [233]. Tác dụng này có lẽ liên quan đến cơ chế hoạt động của statin, vì các nghiên cứu ngẫu nhiên Mendel đã xác nhận tăng nguy cơ mắc DM ở những người có HMG-CoA reductase đa hình làm giảm tổng hợp cholesterol [250].
8.1.4.4 Tăng nguy cơ đột quỵ xuất huyết
Trong các nghiên cứu quan sát, TC có liên quan tiêu cực với đột quỵ xuất huyết và trong phân tích gộp CTT, hạ LDL-C mỗi 1 mmol/L có liên quan đến tăng tương đối 21% [95% CI 5-41%; P = 0.01] nguy cơ đột quỵ xuất huyết [34,251,252]. Tuy nhiên, các phân tích gộp khác đã cho kết quả mâu thuẫn và cần phải tìm hiểu thêm về nguy cơ đột quỵ xuất huyết ở các nhóm bệnh nhân cụ thể. Tuy nhiên, lưu ý rằng lợi ích chung cho các loại đột quỵ khác vượt xa nguy cơ nhỏ (và không chắc chắn) này [34,36].
8.1.4.5 Ảnh hưởng xấu đến chức năng thận
Không có bằng chứng rõ ràng rằng statin có tác dụng có lợi hoặc bất lợi có ý nghĩa lâm sàng đối với chức năng thận [253]. Tần suất tăng protein niệu đã được báo cáo cho tất cả các loại statin, nhưng đã được phân tích chi tiết hơn đối với rosuvastatin. Với liều 80 mg, tần suất là 12%. Với liều <40 mg được phê duyệt, tần suất thấp hơn nhiều và phù hợp với tần suất của các statin khác. Protein niệu do statin có nguồn gốc ống thận, thường là thoáng qua và được cho là do ống thận giảm tái hấp thu và không phải do rối loạn chức năng cầu thận [254,255]. Trong các thử nghiệm lâm sàng, tần suất protein niệu nói chung là thấp và trong hầu hết các trường hợp, không cao hơn so với giả dược [256].
8.1.4.6 Tương tác
Một số tương tác thuốc quan trọng với statin đã được mô tả rằng có thể làm tăng nguy cơ tác dụng phụ. Chất ức chế và kích thích các con đường enzyme liên quan đến chuyển hóa statin được tóm tắt trong Bảng 10. Tất cả các statin hiện có – ngoại trừ pravastatin, rosuvastatin và pitavastatin – đều đượ chuyển hóa chủ yếu ở gan qua CYP. Các isoenzyme này phần lớn được biểu hiện ở gan và ruột. Pravastatin không được chuyển hóa qua hệ thống CYP, nhưng được chuyển hóa bằng quá trình sulfate hóa và liên hợp. Các isoenzyme CYP3A4 là phong phú nhất, nhưng các isoenzyme khác như CYP2C8, CYP2C9, CYP2C19 và CYP2D6 thường tham gia vào quá trình chuyển hóa statin. Do đó, các chất nền có tính dược lý khác của những CYP này có thể cản trở quá trình chuyển hóa statin. Ngược lại, liệu pháp statin có thể cản trở quá trình dị hóa của các thuốc khác được chuyển hóa bởi cùng một hệ thống enzyme.
Kết hợp statin với gemfibrozil làm tăng nguy cơ mắc bệnh lý cơ và phải tránh sự sự kết hợp này. Nguy cơ mắc bệnh lý cơ không tăng hoặc tăng rất ít khi kết hợp statin với các fibrate khác, chẳng hạn như fenofibrate, bezafibrate hoặc ciprofibrate [259,260].
Bảng 10. Thuốc có khả năng tương tác với statin được chuyển hóa bởi cytochrome P450 3A4 dẫn đến tăng nguy cơ bệnh cơ và tiêu cơ vân
| Thuốc chống nhiễm khuẩn | Đối kháng calci | Khác |
| Itraconazole | Verapamil | Ciclosporin |
| Ketoconazole | Diltiazem | Danazol |
| Posaconazole | Amlodipine | Amiodarone |
| Erythromycin | Ranolazine | |
| Clarithromycin | Grapefruit juice | |
| Telithromycin | Nefazodone | |
| Chất ức chế HIV protease | Gemfibrozil |
Chuyển thể từ Egan và Colman [ 257] và Wiklund et al [258]. HIV = virus suy giảm miễn dịch ở người.
8.2 Thuốc ức chế hấp thu cholesterol
8.2.1 Cơ chế tác dụng
Ezetimibe ức chế ruột hấp thu cholesterol trong chế độ ăn uống và trong dịch mật ở cấp độ bờ bàn chải của ruột [bằng cách tương tác với Niemann-Pick C1-like protein 1 (NPC1L1)] mà không ảnh hưởng đến sự hấp thu các chất dinh dưỡng tan trong chất béo. Bằng cách ức chế hấp thu cholesterol, ezetimibe làm giảm lượng cholesterol được chuyển đến gan. Để đáp lại việc giảm cholesterol đến, gan phản ứng bằng cách điều hòa tăng biểu hiện LDLR, từ đó dẫn đến tăng thanh thải LDL trong máu.
8.2.2 Ảnh hưởng đến lipid
Trong các nghiên cứu lâm sàng, đơn trị liệu ezetimibe 10 mg/ngày làm giảm LDL- C 15-22% ở bệnh nhân tăng cholesterol máu với sự thay đổi tương đối cao giữa các cá nhân [261]. Phân tích gộp các RCT bao gồm hơn 2700 người cho thấy LDL-C giảm 18.5% so với giả dược [262]. Ngoài ra, HDL-C cũng đã tăng đáng kể 3%, TG giảm đáng kể 8% và TC giảm 13% với ezetimibe so với giả dược.
Ezetimibe được thêm vào liệu pháp statin làm giảm LDL-C thêm 21-27% so với giả dược ở bệnh nhân tăng cholesterol máu có hoặc không có CHD được chẩn đoán. Ở những bệnh nhân sử dụng statin thông thường, liệu pháp phối hợp ezetimibe và statin đã giúp giảm LDL-C khoảng 15% khi so sánh với cùng một loại statin và liều đơn trị liệu. Trong các nghiên cứu khác, sự kết hợp này cũng đã cải thiện đáng kể việc làm giảm LDL-C khi so sánh với liệu pháp tăng gấp đôi liều statin (13-20%), và sau khi chuyển từ đơn trị liệu statin sang liệu pháp kết hợp ezetimibe và statin (11-15%) [263].
Việc sử dụng đồng thời ezetimibe và chất cô lập acid mật (colesevelam, colestipol hoặc cholestyramine) cho thấy làm giảm thêm 10-20% LDL-C khi so sánh với liệu pháp cô lập acid mật ổn định đơn độc. Phối hợp ezetimibe với chất ức chế PCSK9 cũng dẫn đến hiệu quả bổ sung [265].
8.2.3 Ảnh hưởng đến tỷ lệ mắc bệnh và tử vong do tim mạch
Hiệu quả của ezetimibe kết hợp với simvastatin đã được đề cập ở những người bị hẹp động mạch chủ trong thử nghiệm SEAS [266] và ở bệnh nhân CKD trong thử nghiệm SHARP [222]. Trong cả hai thử nghiệm SEAS và SHARP, việc giảm các biến cố CV đã được chứng minh trong nhánh simvastatin-ezetimibe so với giả dược [266,267].
Trong thử nghiệm IMPROVE-IT, ezetimibe đã được thêm vào simvastatin (40 mg) ở bệnh nhân sau hội chứng mạch vành cấp (ACS) [33]. Tổng cộng có 18,144 bệnh nhân được phân ngẫu nhiên vào statin hoặc statin cộng với ezetimibe và 5314 bệnh nhân đã trải qua một biến cố CV trong 7 năm; 170 biến cố ít hơn (32.7 so với 34.7%) đã được ghi nhận trong nhóm dùng simvastatin cộng ezetimibe (P = 0.016). LDL-C trung bình trong nghiên cứu là 1.8 mmol/L (70 mg/dL) ở nhóm simvastatin và 1.4 mmol/L (55 mg/dL) nhóm ezetimibe cộng simvastatin. Cũng thế, đột quỵ thiếu máu cục bộ đã giảm 21% trong thử nghiệm này (P = 0.008). Không có bằng chứng về tác hại do ezetimibe hoặc giảm LDL-C hơn nữa. Trong nhóm bệnh nhân này đã được điều trị bằng statin để đạt được mục tiêu, lợi ích CV tuyệt đối được thêm vào từ ezetimibe là nhỏ, mặc dù có ý nghĩa và phù hợp với kỳ vọng của CTT [268]. Do đó, nghiên cứu ủng hộ đề xuất rằng hạ LDL-C bằng các liệu pháp khác ngoài statin là có lợi và an toàn. Tác dụng có lợi của ezetimibe cũng được hỗ trợ bởi các nghiên cứu di truyền về đột biến ở NPC1L1; các đột biến xảy ra tự nhiên làm bất hoạt protein được tìm thấy có là liên quan đến giảm LDL-C huyết tương và giảm nguy cơ CAD [55,269,270].
Được thực hiện cùng với các nghiên cứu khác [271]. IMPROVE-IT ủng hộ đề xuất rằng ezetimibe nên được sử dụng như liệu pháp bậc hai kết hợp với statin khi không đạt được mục tiêu điều trị ở liều statin dung nạp tối đa, hoặc trong trường hợp không thể kê đơn statin [272,273].
8.2.4 Tác dụng phụ và tương tác
Ezetimibe được hấp thu nhanh chóng và chuyển hóa rộng rãi thành chất có tác dụng ezetimibe glucuronide. Liều khuyến cáo của ezetimibe là 10 mg/ngày có thể được dùng vào buổi sáng hoặc tối bất kể bữa ăn. Không có tác dụng đáng kể về mặt lâm sàng của tuổi tác, giới tính hoặc chủng tộc đối với dược động học của ezetimibe và không cần điều chỉnh liều ở bệnh nhân suy gan nhẹ hoặc suy thận từ nhẹ đến nặng. Suy gan đe dọa tính mạng với ezetimibe đơn trị liệu hoặc kết hợp statin là cực kỳ hiếm. Việc thêm ezetimibe vào liệu pháp statin dường như không làm tăng tỷ lệ mới xuất hiện nồng độ CK cao so với statin đơn độc [261].
8.3 Chất cô lập acid mật
8.3.1 Cơ chế tác dụng
Acid mật được tổng hợp tại gan từ cholesterol và được phóng thích vào lòng ruột, nhưng phần lớn acid mật được đưa trở lại gan từ đoạn cuối hồi tràng thông qua hấp thu chủ động. Hai chất cô lập acid mật đã có từ lâu, cholestyramine và colestipol, đều là các loại nhựa trao đổi liên kết với acid mật. Colesevelam tổng hợp hiện cũng có ở một số nước. Vì các chất cô lập acid mật không được hấp thu hoặc không được thay đổi một cách có hệ thống bởi các enzyme tiêu hóa, nên hiệu quả lợi ích trên lâm sàng là gián tiếp. Bằng cách liên kết acid mật, các loại thuốc ngăn chặn sự tái hấp thu của cả thuốc và cholesterol vào máu, và do đó loại bỏ một phần lớn acid mật ra khỏi tuần hoàn gan-ruột. Gan sau khi bị cạn kiệt mật, sẽ tổng hợp nhiều mật hơn từ cholesterol trong gan, do đó làm tăng nhu cầu của gan đối với cholesterol và tăng biểu hiện LDLR, từ đó làm giảm LDL lưu hành.
8.3.2 Tác dụng trên lipid
Ở liều cao hàng ngày là 24 g cholestyramine, 20 g colestipol, hoặc 4.5 g colesevelam làm giảm LDL-C từ 18-25%. Không có tác dụng nhiều trên HDL-C, trong khi TG có thể tăng ở một số bệnh nhân nhạy cảm [274]. Colesevelam cũng có thể làm giảm nồng độ glucose ở bệnh nhân tăng đường huyết [275].
8.3.3 Ảnh hưởng đến tỷ lệ mắc bệnh và tử vong do tim mạch
Trong các thử nghiệm lâm sàng, các chất cô lập acid mật đã góp phần rất lớn vào việc chứng minh hiệu quả của hạ LDL-C để làm giảm các biến cố CV ở người tăng cholesterol máu, trong đó lợi ích tỷ lệ thuận với mức độ hạ LDL-C. Đáng chú ý, những nghiên cứu này được thực hiện trước khi có nhiều lựa chọn điều trị hiện đại [276-278].
8.3.4 Tác dụng phụ và tương tác
Tác dụng phụ đường tiêu hóa (GI) (hay gặp nhất là đầy hơi, táo bón, khó tiêu và buồn nôn) thường xuất hiện với các loại thuốc này, ngay cả ở liều thấp, làm hạn chế sử dụng thực tế của chúng. Những tác dụng phụ này có thể được giảm thiểu bằng cách bắt đầu điều trị ở liều thấp và uống thuốc với thật nhiều nước. Nên tăng liều dần dần. Giảm hấp thu vitamin tan trong chất béo đã được báo cáo. Hơn nữa, những loại thuốc này có thể làm tăng nồng độ TG lưu hành ở một số bệnh nhân.
Các chất cô lập acid mật có tương tác chủ yếu với một số loại thuốc thường được kê đơn, và do đó phải được dùng 4 giờ trước hoặc 1 giờ sau các thuốc khác. Colesevelam được dung nạp tốt hơn và có ít tương tác hơn với các loại thuốc khác, có thể được uống cùng với statin và một số loại thuốc khác [279].
8.4 Chất ức chế proprotein convertase subtilisin/kexin type 9
8.4.1 Cơ chế tác dụng
Gần đây, một nhóm thuốc mới, chất ức chế PCSK9, có tác dụng nhắm mục tiêu một protein (PCSK9) tham gia vào việc kiểm soát LDLR [280]. Tăng nồng độ hoặc chức năng của protein này trong huyết tương làm giảm biểu hiện LDLR bằng cách thúc đẩy, khi gắn kết, sự dị hóa lysosome LDLR và nồng độ LDL huyết tương tăng sau đó, trong khi giảm nồng độ hoặc chức năng của PCSK9 có liên quan đến LDL-C huyết tương thấp [281]. Chiến lược điều trị đã được phát triển chủ yếu bằng mAb; cơ chế tác dụng liên quan đến việc làm giảm mức độ PCSK9 trong huyết tương, do đó không có sẵn để liên kết LDLR. Vì tương tác này làm thoái giáng LDLR nội bào, nên nồng độ lưu hành của PCSK9 thấp sẽ làm cho LDLR tăng biểu hiện ở bề mặt tế bào và do đó làm giảm LDL-C lưu hành [281]. Hiện tại, chất ức chế PCSK9 được phê duyệt là hai mAb hoàn toàn của người, alirocumab và evolocumab. Điều trị statin làm tăng nồng độ huyết thanh PCSK9 lưu hành [282] và do đó hiệu quả tốt nhất của các mAb này là khi kết hợp với statin.
8.4.2 Tác dụng trên lipid
8.4.2.1 Cholesterol lipoprotein mật độ thấp
Trong các thử nghiệm lâm sàng, alirocumab và evolocumab – chỉ dùng đơn trị liệu hoặc kết hợp với statin và/hoặc các liệu pháp hạ lipid máu khác – đã làm giảm đáng kể nồng độ LDL-C trung bình 60%, tùy thuộc vào liều. Hiệu quả dường như không phụ thuộc nhiều vào bất kỳ liệu pháp nền nào. Kết hợp với statin cường độ cao hoặc dung nạp tối đa, alirocumab và evolocumab làm giảm LDL-C nhiều hơn 46-73% so với giả dược và hơn 30% so với ezetimibe. Ở những bệnh nhân không thể kê đơn statin, ức chế PCSK9 làm giảm LDL-C khi dùng kết hợp với ezetimibe [283]. Cả alirocumab và evolocumab cũng có hiệu quả làm giảm LDL-C ở những bệnh nhân có nguy cơ CV cao, kể cả những người có DM [284].
Dựa trên cơ chế tác dụng, những thuốc này có hiệu quả làm giảm LDL-C ở tất cả các bệnh nhân có khả năng biểu hiện LDLR tại gan. Do đó, cách tiếp cận dược lý này có hiệu quả ở hầu hết mọi bệnh nhân, bao gồm cả những người HeFH và, mặc dù ở mức độ thấp hơn, ở những người HoFH vẫn còn biểu hiện LDLR. HoFH suy giảm thụ thể LDLR áp ứng kém với liệu pháp này [285].
8.4.2.2 Triglyceride và cholesterol lipoprotein mật độ cao
Các thuốc làm giảm LDL có hiệu quả cao này cũng làm giảm nồng độ TG, đồng thời làm tăng các HDL-C và ApoA-I như là một chức năng của phác đồ liều dùng. Trong các thử nghiệm giai đoạn II, evolocumab đã làm giảm TG xuống 26% và tăng HDL-C và ApoA-I lần lượt lên 9 và 4%; những phát hiện tương tự đã được báo cáo cho alirocumab [286,287]. Tuy nhiên, tác dụng trên TG cần phải được xác nhận trong các quần thể có nồng độ TG huyết tương ban đầu cao hơn.
8.4.2.3 Lipoprotein (a)
Trái ngược với statin, ức chế PCSK9 bằng mAb cũng làm giảm nồng độ Lp (a) huyết tương. Kết quả tổng hợp của các thử nghiệm pha II cho thấy liệu pháp này đlàm giảm Lp (a) khoảng 30-40% [288,289]. Mặc dù các nghiên cứu gần đây đã cố gắng để làm sáng tỏ cơ chế, nhưng điều này vẫn chưa rõ ràng. Tuy nhiên, nó dường như khác với statin, vì statin cũng giúp tăng cường chức năng LDLR nhưng không làm giảm mức Lp (a) lưu hành ở người. Tác dụng này đóng góp tương đối vào việc giảm nguy cơ cần được chứng minh trong các nghiên cứu được thiết kế phù hợp.
8.4.3 Ảnh hưởng đến tỷ lệ mắc bệnh và tử vong của tim mạch
Dữ liệu sơ bộ ban đầu từ các thử nghiệm pha III cho thấy các biến cố CV giảm phù hợp với việc đạt được LDL-C giảm [286,290,291].
Gần đây, hai nghiên cứu lớn đã được hoàn thành: thử nghiệm FOURIER (nghiên cứu việc ức chế PCSK9) ODYSSEY Outcomes (nghiên cứu hiệu quả của alirocumab) [119,120]. Thiết kế của hai thử nghiệm là tương tự nhau liên quan đến bối cảnh phòng ngừa thứ phát và điều trị nền; tuy nhiên, lần lượt, một nghiên cứu đưa vào dân số có CHD ổn định, bệnh động mạch ngoại biên (PAD) hoặc đột quỵ; nghiên cứu còn lại đưa vào những bệnh nhân có một ACS gần đây (trung bình 2.6 tháng). Lợi ích tương đối dao động từ giảm 15-20% nguy cơ các kết cục chính. Cả hai nghiên cứu đều có khoảng thời gian theo dõi tương đối ngắn và bằng chứng từ các thử nghiệm statin chỉ ra rằng lợi ích lâm sàng của việc làm giảm LDL chỉ có thể xuất hiện sau khoảng 1 năm [51], vì vậy những thử nghiệm này có thể đã đánh giá thấp tác động tiềm tàng của điều trị lâu dài [120,290].
Trong thử nghiệm FOURIER [119], 27,564 bệnh nhân mắc CVD xơ vữa động mạch và mức LDL-C là 1.8 mmol/L (70 mg/dL) hoặc cao hơn đang điều trị statin, được phân ngẫu nhiên để nhận evolocumab hoặc giả dược. Nhóm evolocumab làm giảm LDL-C trung bình ban đầu là 2.38 mmol/L (92 mg/dL) xuống mức trung bình 0.78 mmol/L (30 mg/dL) sau 48 tuần. Sau thời gian theo dõi trung bình 2.2 năm, evolocumab làm giảm đáng kể nguy cơ kết cục chính (kết hợp tử vong CV, nhồi máu cơ tim, đột quỵ, nhập viện vì đau thắt ngực không ổn định hoặc tái thông mạch vành) 15% [tỷ số nguy cơ (HR) 0.85, KTC 95% 0.79-0.92]. Một phân tích về thời gian để hưởng lợi ích cũng cho thấy rằng lợi ích thấp hơn trong năm đầu tiên so với những năm tiếp theo, giống với tác dụng của statin được quan sát trong phân tích gộp CTT [268].Trong thử nghiệm FOURIER, nhóm ngẫu nhiên evolocumab không làm giảm nguy cơ tử vong CV (HR 1.05, 95% CI 0.88-1.25) hoặc tử vong do mọi nguyên nhân.
Thử nghiệm ODYSSEY Outcomes đã chọn ngẫu nhiên 18,924 bệnh nhân sau khi nhập viện vì nhồi máu cơ tim cấp hoặc đau thắt ngực không ổn định, được điều trị statin và với LDL-C ≥1.8 mmol/L (≥70 mg/dL), cholesterol non-HDL ≥2.6 mmol/L (≥100 mg/dL) hoặc ApoB ≥80 mg/dL, vào nhóm alirocumab loại tiêm hoặc giả dược tương hợp. Nhóm alirocumab làm giảm LDL-C ban đầu trung bình là 2.38 mmol/L (92 mg/dL) xuống 1.24 mmol/L (48 mg/dL) sau 12 tháng. Kết cục chính giảm tương đối 15% (kết hợp tử vong CHD, MI không tử vong, đột quỵ do thiếu máu cục bộ hoặc đau thắt ngực không ổn định cần nhập viện) (HR 0.85, KTC 95% 0.78-0.93) sau thời gian theo dõi trung bình 2.8 năm [120]. Mặc dù tử vong do mọi nguyên nhân giảm đáng kể trong thử nghiệm ODYSSEY, nhưng đây là một kết cục phát hiện tình cờ và không được hỗ trợ bởi ảnh hưởng đáng kể đến tử vong CV.
8.4.4 Tác dụng phụ và tương tác
Anti-PCSK9 mAb được tiêm dưới da, mỗi tuần hoặc mỗi tháng một lần với liều khác nhau tùy thuộc vào loại thuốc. Khả năng tương tác với các thuốc hấp thu qua đường uống là không có, vì chúng không ảnh hưởng đến dược động học hoặc dược lực học. Trong số các tác dụng phụ, được báo cáo thường xuyên nhất là ngứa ở vị trí tiêm và các triệu chứng giống như cúm [292]. Một số nghiên cứu thấy sự gia tăng ảnh hưởng nhận thức thần kinh của bệnh nhân [293]. Tuy nhiên, thử nghiệm EBBINGHAUS [231] được thiết kế đặc biệt để phát hiện các thay đổi chức năng nhận thức thần kinh đã mang đến sự an tâm, cũng như các báo cáo an toàn trong cả hai thử nghiệm FOURIER và ODYSSEY. Các nghiên cứu ngẫu nhiên Mendel cũng cho thấy ức chế PCSK9 có thể làm tăng nguy cơ mắc DM với tác dụng liên quan đến LDL-C, giống như đã xảy ra đối với statin [294]. Cho đến nay, không có tín hiệu mới nào từ các RCT [295-297]. Mặc dù các thử nghiệm dài hạn lớn về chất ức chế PCSK9 là cần thiết để loại trừ những tác dụng phụ này và các tác dụng phụ tiềm tàng khác của việc ức chế PCSK9 [298], dữ liệu 7 năm từ nghiên cứu IMPROVE- IT chỉ ra rằng nồng độ LDL-C thấp kéo dài không liên quan đến bất kỳ tác dụng phụ rõ ràng nào [299].
Một vấn đề tiềm tàng của điều trị kháng thể trong thời gian dài là sự xuất hiện của tự kháng thể. Evolocumab và alirocumab là kháng thể hoàn toàn của con người và do đó, về mặt lý thuyết ít có khả năng gây ra tự kháng thể. Cho đến nay, chỉ có rất ít trường hợp kháng thể kháng thuốc đã được báo cáo, và không thấy làm giảm mức hạ LDL-C, nhưng cần phải theo dõi khi sử dụng lâu dài. Thật vậy, chương trình phát triển một chất ức chế PCSK9 thứ ba, bococizumab, một kháng thể được làm cho giống kháng thể người, đã bị dừng lại vì sự gia tăng kháng thể trung hòa, dẫn đến làm giảm khả năng hạ LDL-C theo thời gian, cũng như tỷ lệ phản ứng tại chỗ tiêm cao hơn [300]. Tuy nhiên, mặc dù các thuốc ức chế PCSK9 là những thuốc rất hiệu quả có thể làm giảm LDL-C và các biến cố CV hơn điều trị statin và/hoặc ezetimibe, xem xét chi phí điều trị và dữ liệu hạn chế về an toàn lâu dài, những thuốc này có khả năng chỉ được xem là hiệu quả về mặt chi phí ở những bệnh nhân có nguy cơ ASCVD rất cao và việc sử dụng chúng có thể không khả thi một số quốc gia với nguồn lực chăm sóc sức khỏe hạn chế.
8.5 Lomitapide
Protein vận chuyển TG microsome (MTP) chuyển TG và phospholipid từ mạng lưới nội chất sang ApoB, là một bước cần thiết trong quá trình hình thành VLDL. Do đó ức chế MTP ngăn chặn sự hình thành VLDL tại gan và chylomicron tại ruột.
Lomitapide là một chất ức chế MTP được thiết kế uống mỗi ngày một lần trong điều trị HoFH. Trong một nghiên cứu nhãn mở, đánh giá lomitapide như là liệu pháp bổ trợ cho statin, có hoặc không có thay huyết tương (apheresis) và chế độ ăn ít chất béo [301], LDL-C đã giảm 50% so với mức ban đầu sau 26 tuần và giảm 44% sau 56 tuần. Lomitapide cũng cho thấy làm giảm tần suất apheresis ở bệnh nhân HoFH. Cần lưu ý rằng tác dụng của thuốc lên kết cục CV vẫn chưa được xác định.
Do hậu quả của cơ chế hoạt động của nó, lomitapide làm tăng nồng độ aminotransferase, có khả năng phản ánh tình trạng tăng chất béo trong gan, cũng như khả năng dung nạp đường tiêu hóa kém [301,302]. Tác dụng phụ đường tiêu hóa là lý do thường gặp nhất ngăn chặn việc tăng thêm liều lomitapide trong các thử nghiệm lâm sàng [301]. Tuy nhiên, lưu ý rằng tần suất và cường độ của tác dụng phụ đường tiêu hóa thường giảm theo thời gian. Do đó, việc kê đơn lomitapide đòi hỏi giáo dục bệnh nhân cẩn thận và theo dõi chức năng gan trong quá trình điều trị.
8.6 Mipomersen
Mipomersen là một oligonucleotide antisense có khả năng liên kết RNA thông tin (mRNA) của ApoB-100, gây ra sự giáng hóa có chọn lọc các phân tử mRNA. Sau khi tiêm dưới da, oligonucleotide này được ưu tiên vận chuyển đến gan, nơi nó liên kết với một mRNA chuyên biệt ngăn cản sự dịch mã của protein ApoB, từ đó làm giảm sản xuất lipid và lipoprotein gây bệnh xơ vữa, kể cả LDL và Lp (a) [303]. Như là một thuốc bổ trợ cho thuốc hạ lipid và chế độ ăn kiêng, mipomersen được chỉ định để giảm LDL-C ở bệnh nhân HoFH. Mipomersen hiện đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận, nhưng Cục Dược phẩm Châu Âu (EMA) thì chưa.
Tác dụng phụ phổ biến nhất ở những bệnh nhân được điều trị bằng mipomersen là phản ứng tại vị trí tiêm [304]. Tuy nhiên, những lo ngại chính liên quan đến tính an toàn của mipomersen là độc tính gan. Mipomersen có thể gây phát triển gan nhiễm mỡ. Mỡ gan tăng cao hơn ở bệnh nhân được điều trị bằng mipomersen so với giả dược [303]. Hiệu quả và an toàn của điều trị mipomersen về lâu dài hiện đang được đánh giá ở bệnh nhân HeFH nặng và ở người không dung nạp statin.
8.7 Fibrate
8.7.1 Cơ chế tác dụng
Fibrate là chất đồng vận của thụ thể kích hoạt peroxisome proliferator-α (PPAR- α), tác dụng thông qua các yếu tố phiên mã điều hòa các bước khác nhau trong chuyển hóa lipid và lipoprotein. Như một hậu quả, fibrate có hiệu quả tốt trong việc hạ TG của chế độ ăn, cũng như các hạt còn sót lại của TG và các hạt lipoprotein giàu TG (TRL) sau bữa ăn.
8.7.2 Tác dụng trên lipid
Tác động lâm sàng trên bộ lipid khác nhau giữa các loại thuốc trong nhóm fibrate, nhưng ước tính sẽ làm giảm 50% mức TG, giảm ≤20% mức LDL-C (nhưng tăng LDL-C nhẹ nghịch lý có thể được quan sát thấy ở mức TG cao) và làm tăng HDL- C ≤20%. Mức độ ảnh hưởng phụ thuộc rất nhiều vào nồng độ lipid ban đầu [305]. Cả tác dụng tăng HDL và hạ TG của fibrate đều được báo cáo là giảm rõ rệt (lần lượt khoảng 5 và 20%) trong các thử nghiệm can thiệp dài hạn ở những người bị T2DM nhưng không tăng nồng độ TG [306,307].
8.7.3 Ảnh hưởng đến tỷ lệ mắc bệnh và tử vong do tim mạch
Các tác dụng lâm sàng của fibrate được diễn tả chủ yếu bởi sáu RCT: HHS, VA- HIT, BIP, LEADER, FIELD và ACCORD; trong thử nghiệm sau cùng, fenofibrate đã được thêm vào liệu pháp statin [306-311]. Trong các thử nghiệm fibrate lấy kết cục CV làm trung tâm, mức nguy cơ giảm dường như tỷ lệ thuận với mức độ hạ non-HDL-C [50].
Mặc dù HHS báo cáo việc giảm đáng kể kết cục CVD với gemfibrozil, nhưng cả nghiên cứu FIELD cũng như ACCORD về fenofibrate đều cho thấy làm giảm kết cục CVD tổng thể. Thử nghiệm LEADER trên nam giới bị bệnh động mạch chi dưới và không cho thấy bezafibrate có thể làm giảm các kết cục CVD kết hợp quan trọng trên lâm sàng. Giảm tỷ lệ MI không tử vong đã được báo cáo, mặc dù thường là kết quả của các phân tích sau nghiên cứu (post hoc). Hiệu quả rõ rệt nhất là ở những người có nồng độ TG cao/HDL-C thấp. Tuy nhiên, dữ liệu về các thông số kết cục khác vẫn không rõ ràng. ACCORD là nghiên cứu duy nhất đã phân tích tác dụng của fibrate như một điều trị bổ sung cho statin. Không có lợi ích tổng thể nào được báo cáo trong hai phân tích gộp gần đây [312,313]. Kết quả từ các phân tích gộp khác cho thấy giảm các biến cố CVD lớn ở bệnh nhân có TG cao và HDL-C thấp được điều trị fibrate, nhưng không giảm CVD hoặc tử vong tổng thể [314-316]. Do đó, hiệu quả chung của fibrate trên kết cục CVD ít mạnh mẽ hơn nhiều so với statin. Gần đây, một chất điều hòa PPAR-α có chọc lọc mới hơn (pemafibrate) đã được báo cáo là có hiệu quả rõ rệt trong việc làm giảm TRL [317]. Nghiên cứu PROMINENT là một thử nghiệm kết cục CVD đang diễn ra được thiết kế để đánh giá hiệu quả của pemafibrate trên khoảng 10,000 bệnh nhân đái tháo đường nguy cơ cao có nồng độ TG cao và HDL-C thấp [318]. Nhìn chung, lợi ích CV tiềm năng của fibrate cần phải xác nhận thêm.
8.7.4 Tác dụng phụ và tương tác
Fibrate thường được dung nạp tốt với tác dụng phụ nhẹ, rối loạn tiêu hóa được báo cáo ở <5% bệnh nhân và phát ban da ở 2% [319]. Nói chung, bệnh cơ, tăng men gan và sỏi túi mật là tác dụng phụ thường nhất có liên quan đến fibrate [319]. Nguy cơ bệnh lý cơ được báo cáo là lớn hơn gấp 5.5 lần khi đơn trị liệu fibrate (chủ yếu với gemfibrozil) so với statin, và nó thay đổi theo các loại fibrate và statin khác nhau được sử dụng kết hợp. Điều này được giải thích bởi những tương tác dược lý giữa quá trình chuyển hóa các fibrate khác nhau và con đường glucuronide hóa statin. Gemfibrozil ức chế chuyển hóa statin thông qua con đường glucuronide, làm tăng rõ rệt nồng độ statin trong huyết tương [320]. Vì fenofibrate không đi cùng con đường dược động học như gemfibrozil, nên nguy cơ mắc bệnh lý cơ là ít hơn khi dùng liệu pháp kết hợp [319].
Vì là một nhóm thuốc, các fibrate đã được báo cáo là làm tăng nồng độ creatinine và homocysteine huyết thanh trong cả hai nghiên cứu ngắn và dài hạn. Tăng creatinine huyết thanh do fibrate dường như hồi phục hoàn toàn khi ngừng thuốc. Dữ liệu từ các phân tích gộp cho thấy việc giảm mức lọc cầu thận ước tính (GFR) không phản ánh bất kỳ tác dụng phụ nào đối với chức năng thận [315]. Fibrate làm tăng nhẹ nguy cơ viêm tụy [321]. Tăng nồng độ homocysteine do fibrate được xem là tương đối trung lập đối với khía cạnh nguy cơ CVD. Tuy nhiên, tăng homocysteine do fibrate có thể làm giảm mức tăng của HDL-C và ApoA1, và tác dụng này có thể góp phần làm nhỏ đi những ước tính lợi ích của fenofibrate trong các thông số cục CV [322].
8.8 Acid béo n-3
8.8.1 Cơ chế tác dụng
Các acid béo n-3 (hoặc omega-3) [acid eicosapentaenoic (EPA) và acid docosa – hexaenoic (DHA)] có thể được sử dụng ở liều dược lý để làm giảm TG. Acid béo n- 3 (2-4 g/ngày) tác động đến lipid và lipoprotein huyết thanh, đặc biệt là nồng độ VLDL. Cơ chế nền chưa được hiểu rõ, mặc dù có thể liên quan, ít nhất là một phần, đến khả năng tương tác với PPAR và giảm bài tiết ApoB.
8.8.2 Ảnh hưởng đến lipid
Acid béo n-3 làm giảm TG, nhưng tác dụng của chúng lên các lipoprotein khác là không đáng kể. Dữ liệu chi tiết hơn về kết cục lâm sàng là cần thiết để chứng minh việc kê đơn sử dụng rộng rãi các acid béo n-3 [323]. Liều khuyến cáo của tổng EPA và DHA để làm giảm TG thay đổi trong khoảng 2-4 g/ngày. Ba nghiên cứu gần đây ở những người có TG cao sử dụng EPA cho thấy giảm đáng kể nồng độ TG huyết thanh lên tới 45% theo cách phụ thuộc liều [324-326]. Hiệu quả của acid béo omega- 3 trong việc làm giảm TG huyết thanh cũng đã được báo cáo trong phân tích gộp [157]. Gần đây, thử nghiệm EVOLVE II đã xác nhận hiệu quả làm giảm TG huyết thanh của acid béo omega-3 [327].
8.8.3 Ảnh hưởng đến tỷ lệ mắc bệnh và tử vong do tim mạch
Một phân tích gộp của Cochrane, bao gồm 112,059 người từ 79 thử nghiệm, cho thấy không có ảnh hưởng tổng thể của PUFA omega-3 đối với tỷ lệ tử vong chung (nguy cơ tương đối 0.98, 95% CI 0.90-1.03) hoặc biến cố CV (nguy cơ tương đối 0.99, 95% CI 0.94-1.04), với chỉ một phát hiện rằng acid béo omega-3 làm giảm biến cố CHD (nguy cơ tương đối 0.93, 95% CI 0.88-0.97) [328]. Gần đây, thử nghiệm ASCEND [329] phân ngẫu nhiên 15,480 bệnh nhân DM nhưng không có bệnh CV xơ vữa động mạch vào nhóm acid béo n-3 hoặc giả dược, cho thấy không có sự khác biệt đáng kể về nguy cơ biến cố mạch máu nghiêm trọng sau khi theo dõi trung bình 7.4 năm (nguy cơ tương đối 1.00, 95% Cl 0.91-1.09).
Dữ liệu vẫn không mang tính kết luận và hiệu quả lâm sàng của acid béo omega- 3 dường như có liên quan đến tác dụng không lipid [330,331]. Ngoài ra, các nghiên cứu với acid béo omega-3 dùng liều 1 g/ngày, không ảnh hưởng nhiều đến lipid huyết tương, vì liều cần thiết để giảm TG huyết tương là > 2 g/ngày. Thử nghiệm REDUCE-IT [195] nhằm đánh giá lợi ích tiềm năng của dầu omega-3 (EPA) trên kết cục ASCVD ở những người có TG huyết thanh cao; thử nghiệm đã đưa vào khoảng 8000 bệnh nhân đang điều trị statin, với mức LDL-C trong khoảng 1.0-2.6 mmol/L (41-100 mg/dL) và yếu tố nguy cơ CV khác nhau, bao gồm TG cao kéo dài trong khoảng 1.7-5.6 mmol/L (150-499 mg/dL), được chẩn đoán ASCVD hoặc DM, và có tối thiểu một yếu tố nguy cơ CV khác. Sử dụng liều cao (2 g, hai lần mỗi ngày) EPA so với giả dược (dầu khoáng) làm giảm khoảng 25% nguy cơ tương đối (P <0.001) các biến cố CV bất lợi lớn (major adverse CV events – MACE). Một RCT đối chứng giả dược khác, STRENGTH [332], nhằm mục đích xác định liệu làm giảm TRL và bệnh nhân được điều trị statin nhưng không đạt mục tiêu lipid có làm giảm thêm nguy cơ ASCVD, đang diễn ra. Thử nghiệm VITAL vừa được báo cáo gần đây, là một nghiên cứu thiết kế 2 x 2, trong đó các đối tượng khỏe mạnh được phân ngẫu nhiên theo tỷ lệ 1 : 1 vào nhóm vitamin D3 (với liều 2000 IU mỗi ngày) vs. giả dược tương hợp và acid béo n-3 (1 g mỗi ngày dưới dạng viên nang dầu cá chứa 840 mg acid béo n-3, bao gồm 460 mg EPA và 380 mg DHA) vs. giả dược tương hợp. Nghiên cứu cho thấy bổ sung acid béo n-3 với liều 1 g/ngày, hoặc vitamin D3 với liều 2000 IU/ngày, không có hiệu quả phòng ngừa CV nguyên phát hoặc các biến cố ung thư ở nam giới và phụ nữ khỏe mạnh tuổi trung niên trong 5 năm theo dõi [333].
8.8.4 Tính an toàn và tương tác
Việc sử dụng acid béo n-3 dường như an toàn và không có tương tác có ý nghĩa lâm sàng. Tác dụng phụ thường gặp nhất là rối loạn tiêu hóa. Tác dụng chống huyết khối có thể làm tăng xu hướng chảy máu, đặc biệt là khi dùng cùng với aspirin/clopidogrel. Gần đây, dữ liệu từ một nghiên cứu cho thấy nguy cơ ung thư tuyến tiền liệt với chế độ tiêu thụ cao PUFA n-3 [334].
8.9 Acid nicotinic
Acid nicotinic có vị trí tác dụng chính trong cả mô gan và mô mỡ. Ở gan, acid nicotinic ức chế diacylglycerol acyltransferase-2 dẫn đến giảm bài tiết các hạt VLDL, điều này cũng được phản ánh thông qua việc giảm nồng độ huyết tương của cả hai hạt IDL và LDL [335]. Acid nicotinic chủ yếu làm tăng HDL-C và ApoA1 bằng cách kích thích sản xuất ApoA1 ở gan [335]. Hai thử nghiệm ngẫu nhiên lớn với acid nicotinic – một trong số đó với niacin phóng thích kéo dài [66] và một với niacin cộng với laropiprant [67] – cho thấy không có tác dụng lợi ích mà lại làm tăng tần suất tác dụng phụ nghiêm trọng. Không có thuốc nào chứa acid nicotinic hiện đang được phê duyệt ở Châu Âu.
8.10 Các chất ức chế protein vận chuyển ester cholesteryl
Cho đến nay, phương pháp dược lý làm tăng cao nhất nồng độ HDL-C là ức chế trực tiếp CETP bởi các chất ức chế phân tử nhỏ, có thể làm tăng HDL-C lên ≥100% trên cơ sở phụ thuộc liều. Torcetrapib đã được nghiên cứu trong thử nghiệm ILLUMINATE, đã bị dừng sớm do tỷ lệ tử vong tăng [336]. Dalcetrapib làm tăng mức HDL-C lên 30-40% mà không có tác dụng đáng kể nào đến LDL-C, cung cấp một phương pháp chuyên biệt nâng cao HDL-C đơn thuần. Tuy nhiên, dalcetrapib không cho thấy bất kỳ lợi ích nào ở bệnh nhân ACS trong thử nghiệm dal- OUTCOMES. Evacetrapib, làm tăng mức HDL-C lên 130% và giảm LDL-C xuống 37%, đã được nghiên cứu trong thử nghiệm ACCELERATE [63], bị chấm dứt do không thấy lợi ích nào. Gần đây, anacetrapib, làm tăng mức HDL-C và ApoA-I (lần lượt là 104% và 36%), đồng thời làm giảm LDL-C và ApoB (lần lượt là 17% và 18%), đã được nghiên cứu trong thử nghiệm REVEAL. Anacetrapib làm giảm 9% các biến cố mạch vành lớn trong khoảng thời gian trung bình 4.1 năm [64]. Mức độ giảm nguy cơ tương đối có vẻ phù hợp với mức độ giảm LDL-C- hoặc non-HDL-C [337]. Thuốc này không đã được đệ trình để phê duyệt theo quy định.
8.11 Quan điểm trong tương lai
8.11.1 Các cách tiếp cận mới để giảm cholesterol lipoprotein mật độ thấp
Một phương pháp thay thế nhắm mục tiêu PCSK9 bao gồm can thiệp RNA. Trong thử nghiệm pha I và pha II, thuốc ức chế phân tử nhỏ RNA (siRNA), inclisiran – có tác dụng ức chế quá trình tổng hợp PCSK9 – làm giảm LDL-C tới 50% và phụ thuộc liều. Giảm PCSK9 và LDL-C được duy trì trong ≤6 tháng [338,339]. Không có biến cố bất lợi nghiêm trọng cụ thể nào được quan sát thấy. HPS4/TIMI65/ORION4, với thời gian trung bình theo kế hoạch là 5 năm, hiện đang so sánh giữa inclisiran với giả dược trong số 15,000 bệnh nhân bị MI hoặc đột quỵ từ trước.
Acid bempedoic là một thuốc ức chế phân tử nhỏ mới, đầu tiên trong nhóm, dạng uống, có tác dụng ức chế tổng hợp cholesterol bằng cách ức chế tác dụng của ATP citrate lyase, một loại enzyme cytosolic ngược dòng 3-hydroxy-3-methylglutaryl- coenzyme A reductase [340]. Cho đến nay, nó đã được đánh giá ở bệnh nhân đái tháo đường và bệnh nhân có hoặc không có ‘không dung nạp’ statin. Trong đơn trị liệu, acid bempedoic làm giảm mức LDL-C 30% và khoảng 50% khi kết hợp với ezetimibe. Acid bempedoic hiện đang được đánh giá trong các thử nghiệm pha III và một số thử nghiệm đã được hoàn thành [341,342].
8.11.2 Các cách tiếp cận mới để giảm lipoprotein giàu triglyceride và phần còn sót lại của chúng
Vì các nghiên cứu di truyền chỉ ra rằng thiếu angiopoietin-like protein 3 (ANGPTL3) bảo vệ chống lại bệnh xơ vữa động mạch và mối quan hệ này là nhân quả [343], kháng thể ANGPTL3 (evinacumab) đang được phát triển. Evinacumab đã được chứng minh là làm giảm nồng độ TG, LDL-C và Lp (a) ở bệnh nhân HoFH [344]. Một cách tiếp cận khác hiện đang được nghiên cứu là ức chế sản xuất ANGPTL3 bằng antisense oligonucleotide [345]. IONIS-ANGPTL3-LRx, một antisense oligonucleotide nhắm mục tiêu ANGPTL3, một protein quan trọng khác trong việc loại bỏ TRL, làm giảm khoảng 85% TG huyết tương. Do đó, tương lai có thể mang lại các công cụ để cải thiện loại bỏ TRL sẽ được phản ánh trong tải lượng các hạt còn sót lại gây xơ vữa.
Sự phát triển nhanh chóng của công nghệ làm im lặng gen đã cho phép các protein (ApoC-III), rất quan trọng trong điều hòa quá trình loại bỏ TRL, được nhắm mục tiêu. Một antisense oligonucleotide thế hệ thứ hai nhắm mục tiêu ApoC-III mRNA đã được phát triển [346]. Hai thử nghiệm pha III đánh giá tính an toàn và hiệu quả của volanesorsen ở những bệnh nhân có nồng độ TG cao [347,348].
Volanesorsen làm giảm TG 70% và ApoC-III 90% [349]. EMA gần đây đã ban hành một ủy quyền tiếp thị cho Waylivra (volanesorsen) như là một bổ trợ cho chế độ ăn uống ở bệnh nhân người lớn mắc hội chứng chylomicron máu gia đình (FCS) đã được xác nhận bằng xét nghiệm di truyền, là những người có nguy cơ cao bị viêm tụy, đáp ứng không đầy đủ với chế độ ăn kiêng và điều trị hạ TG.
8.11.3 Các cách tiếp cận mới để tăng cholesterol lipoprotein mật độ cao
Mặc dù các nghiên cứu di truyền cho thấy mức HDL-C thấp không phải là nguyên nhân của ASCVD, đặt ra nghi ngờ về khả năng lựa chọn điều trị trong tương lai để làm tăng mức HDL-C kèm theo làm giảm CVD, một phát triển lớn trong việc tìm kiếm các thuốc hiệu quả để làm tăng mức HDL-C và ApoA1 cùng với các lợi ích đồng thời đối với chứng xơ vữa động mạch và biến cố CV sắp xảy ra. Một mặt, sự quan tâm tập trung vào các peptide tương tự ApoA1 và các dạng HDL tái tổ hợp có tiềm năng tái cấu trúc hạt HDL trong cơ thể sống và tăng cường hoạt động bảo vệ tim mạch [350]. Mặt khác, các thuốc giúp tăng cường quá trình dị hóa lipoprotein giàu TG, chẳng hạn như antisense oligonucleotide thành ApoC-III, làm giảm đồng thời TG (70%) và tăng HDL-C (40%) ở những người bị tăng triglyceride máu, đang được phát triển [351]. Tuy nhiên, quan trọng là hiện tại chúng tôi chưa hiểu rõ về mối quan hệ giữa phương thức làm tăng mức HDL/ApoA-I và hoạt động chống gây xơ vữa tiềm năng của các hạt HDL.
8.11.4 Các cách tiếp cận mới để làm giảm mức lipoprotein (a)
Một cách tiếp cận khác đang được nghiên cứu là làm giảm nồng độ Lp (a) có chọn lọc. Các liệu pháp dựa trên RNA hiện đang được đánh giá trong bối cảnh lâm sàng. Kết quả từ các nghiên cứu về một antisense oligonucleotide ở những bệnh nhân có giá trị Lp (a) bình thường cũng như ở những bệnh nhân có nồng độ Lp (a) cao đã cho thấy giảm >90% [352]. Phương pháp này hiện đang được đánh giá trong các nghiên cứu pha II-III và một thử nghiệm có kết cục lâm sàng được lên kế hoạch để nghiên cứu xem liệu làm giảm Lp (a) có chuyển thành làm giảm nguy cơ hay không.
8.12 Chiến lược kiểm soát cholesterol huyết tương
Mặc dù các mục tiêu LDL-C đạt được bằng đơn trị liệu ở nhiều bệnh nhân, nhưng một tỷ lệ đáng kể bệnh nhân có nguy cơ cao hoặc có mức LDL-C rất cao cần điều trị bổ sung. Trong trường hợp này, liệu pháp kết hợp là hợp lý. Ở những bệnh nhân có nguy cơ rất cao và có nguy cơ cao dai dẳng mặc dù được điều trị statin dung nạp tối đa thì khuyến cáo nên kết hợp với ezetimibe, và nếu vẫn không đạt mục tiêu, thì khuyến cáo nên bổ sung chất ức chế PCSK9 (xem Hình 4 và Khuyến cáo về thuốc hạ cholesterol lipoprotein mật độ thấp). Lưu ý, việc bổ sung chất ức chế PCSK9 trực tiếp vào statin cũng khả thi [120,290] (Hình 4).
Khuyến cáo về thuốc hạ cholesterol lipoprotein mật độ thấp
| Khuyến cáo | Loại | Mức |
| Khuyến cáo rằng statin cường độ cao được kê đơn đến liều dung nạp cao nhất để đạt các mục tiêu đã đề ra đối với từng mức độ nguy cơ cụ thể [32,34,38]. | I | A |
| Nếu không đạt c được mục tiêu với liều statin dung nạp tối đa, khuyến cáo kết hợp với ezetimibe [33]. | I | B |
| Đối với bệnh nhân dự phòng tiên phát có nguy cơ rất cao, nhưng không FH, nếu không đạt mục tiêu LDL-C với liều statin và ezetimibe dung nạp tối đa, có thể xem xét kết hợp với thuốc ức chế PCSK9. | IIb | C |
| Để phòng ngừa thứ phát, bệnh nhân có nguy cơ rất cao không đạt mục tiêuc với liều statin và ezetimibe dung nạp tối đa, khuyến cáo kết hợp với thuốc ức chế PCSK9 [119,120]. | I | A |
| Đối với bệnh nhân FH có nguy cơ rất cao (nghĩa là có ASCVD hoặc có một yếu tố nguy cơ chính khác) không đạt mục tiêuc với liều statin và ezetimibe dung nạp tối đa, khuyến cáo kết hợp với thuốc ức chế PCSK9. | I | C |
| Nếu phác đồ điều trị dựa trên statin không dung nạp được ở bất kỳ liều nào (ngay cả sau khi thử thách lại), ezetimibe nên được xem xét [197,265,353]. | IIa | C |
| Nếu phác đồ điều trị dựa trên statin không dung nạp được ở bất kỳ liều nào (ngay cả sau khi thử thách lại), có thể xem xét thêm thuốc ức chế PCSK9 vào ezetimibe [197,265,353]. | IIb | C |
| Nếu không đạt mục tiêuc , kết hợp statin với chất cô lập acid mật có thể được xem xét. | IIb | C |
ASCVD = bệnh tim mạch xơ vữa động mạch; FH = tăng cholesterol máu gia đình; LDL-C = cholesterol lipoprotein mật độ thấp; PCSK9 = proprotein convertase subtilisin/kexin type 9.
c Xem bảng 7 về định nghĩa
Như được thể hiện trong Hình 3, có thể ước tính lợi ích lâm sàng mong đợi của điều trị hạ LDL-C ở bất kỳ người nào; nó phụ thuộc vào cường độ liệu pháp, mức LDL-C ban đầu và nguy cơ ASCVD được ước tính ban đầu. Thuật toán đơn giản này có thể được sử dụng để giúp các bác sĩ lâm sàng lựa chọn liệu pháp phù hợp và định lượng các lợi ích dự kiến của liệu pháp hạ LDL-C nhằm giúp đưa thông tin thảo luận với bệnh nhân. Để dễ tham khảo, Bảng 3 Phần bổ sung cung cấp một bản tóm tắt về việc giảm LDL-C tuyệt đối có thể đạt được bằng các liệu pháp khác nhau ở các mức LDL-C ban đầu cụ thể.

Hình 3. Lợi ích lâm sàng dự kiến của các liệu pháp hạ cholesterol lipoprotein mật độ thấp (LDL-C). Những lợi ích lâm sàng dự kiến của điều trị hạ LDL-C cho bất kỳ người nào có thể được ước tính; nó phụ thuộc vào cường độ liệu pháp, mức LDL-C ban đầu, mức LDL-C giảm tuyệt đối dự kiến và nguy cơ ước tính bệnh tim mạch do xơ vữa động mạch. Cường độ điều trị nên được lựa chọn để đạt mức giảm tỷ lệ LDL- C được khuyến cáo dựa trên nguy cơ ước tính bệnh tim mạch do xơ vữa động mạch của người đó. Nhân tỷ lệ giảm LDL-C với mức LDL-C ban đầu để ước tính mức giảm LDL-C tuyệt đối dự kiến có khả năng đạt được với liệu pháp đó. Bởi vì giảm LDL-C tuyệt đối mỗi 1.0 mmol/L làm giảm 20% nguy cơ biến cố tim mạch, nên việc giảm LDL-C tuyệt đối càng lớn dẫn đến giảm nguy cơ theo tỷ lệ càng lớn. Nhân số giảm nguy cơ theo tỷ lệ dự kiến đạt được giảm LDL-C tuyệt đối với nguy cơ bệnh tim mạch xơ vữa động mạch ước tính ban đầu để xác định mức giảm nguy cơ tuyệt đối dự kiến cho người đó. LDL-C = cholesterol lipoprotein mật độ thấp; PCSK9 = proprotein convertase subtilisin/kexin loại 9.


ASCVD = bệnh tim mạch xơ vữa động mạch; HA = huyết áp; CKD = bệnh thận mạn tính; CV = tim mạch; DM = đái tháo đường; eGFR = độ lọc cầu thận ước tính; FH = tăng cholesterol máu gia đình; LDL- C = cholesterol lipoprotein mật độ thấp; PCSK9 = proprotein convertase subtilisin/kexin loại 9; SCORE = Ước tính nguy cơ mạch vành có hệ thống; T1DM = loại 1 DM; T2DM = loại 2 DM; TC = cholesterol toàn phần.
8.13 Chiến lược kiểm soát triglyceride huyết tương
Mặc dù nguy cơ CVD tăng lên khi TG lúc đói >1.7 mmol/L (>150 mg/dL) [56], nhưng việc sử dụng thuốc làm giảm nồng độ TG chỉ có thể được xem xét ở những bệnh nhân có nguy cơ cao khi TG >23 mmol/L (>200 mg/dL) và TG có thể được hạ xuống bằng các biện pháp lối sống. Các can thiệp bằng thuốc hiện có bao gồm statin, fibrate, thuốc ức chế PCSK9 và PUFA n-3. Một phân tích gộp gồm 10 thử nghiệm bao gồm những người được điều trị bằng nhiều loại thuốc hạ TG huyết thanh (fibrate, niacin và PUFA n-3) cho thấy giảm 12% kết cục CV [354]. Gần đây, thử nghiệm REDUCE-IT [194] đã chứng minh rằng ở những bệnh nhân có nguy cơ CV cao với TG đói trong khoảng 135-499 mg/dL (1.52-1.63 mmol/L) đang được điều trị statin, thì ethyl icosapent liều cao, một EPA tinh khiết cao và ổn định (2 g) dùng hai lần mỗi ngày, làm giảm đáng kể nguy cơ biến cố thiếu máu cục bộ, bao gồm tử vong CV, khoảng một phần tư trong thời gian theo dõi trung bình 4.9 năm. Ngoài ra, thử nghiệm VITAL cho thấy acid béo n-3 với liều thấp 1 g/ngày không có hiệu quả dự phòng CV nguyên phát hoặc các biến cố ung thư ở nam giới và phụ nữ tuổi trung niên khỏe mạnh sau 5 năm theo dõi [333]. Khuyến cáo về điều trị HTG được trình bày dưới đây.
Khuyến cáo điều trị bằng thuốc cho bệnh nhân tăng triglyceride máu
| Khuyến cáo | Loại | Mức |
| Điều trị statin được khuyến cáo là lựa chọn đầu tay để giảm nguy cơ CVD ở những người có nguy cơ cao mà bị tăng triglyceride máu [nồng độ TG >2.3 mmol/L (>200 mg/dL)] [355]. | I | B |
| Ở những bệnh nhân có nguy cơ cao (hoặc ở trên) với nồng độ TG trong khoảng 1.5-5.6 mmol/L (135-499 mg/dL) mặc dù đã điều trị statin, nên xem xét sử dụng PUFA n-3 (ethyl icosapent 2×2 g/ngày) kết hợp với statin [194]. | IIa | B |
| Ở những bệnh nhân dự phòng tiên phát đạt được mục tiêu LDL-C với nồng độ TG >2.3 mmol/L (>200 mg/dL), fenofibrate hoặc bezafibrate có thể được xem xét kết hợp với statin [305-307,356]. | IIb | B |
| Ở những bệnh nhân có nguy cơ cao mà đã đạt mục tiêu LDL-C với mức TG >2.3 mmol/L (>200 mg/dL), fenofibrate hoặc bezafibrate có thể được xem xét kết hợp với statin [305-307,356]. | IIb | C |
CVD = bệnh tim mạch; LDL-C = cholesterol lipoprotein mật độ thấp; PUFA = acid béo đa không bão hòa; TG = triglyceride.
9. Quản rối loạn lipid máu trong các bối cảnh lâm sàng khác nhau
9.1 Rối loạn lipid máu gia đình
Nồng độ lipid huyết tương, ở một mức độ rất lớn, được quyết định bởi các yếu tố di truyền. Ở những dạng cực độ hơn, nó biểu hiện là chứng rối loạn lipid máu gia đình. Một số rối loạn lipid đơn gen đã được xác định; trong số này, FH là thường gặp nhất và liên quan chặt chẽ đến CVD (Bảng 11). Nói chung, ở một bệnh nhân rối loạn lipid máu, kiểu di truyền thường không gợi ý rằng có một rối loạn gen đơn lớn gây ra sự bất thường này; thay vào đó, nó bắt nguồn từ sự di truyền của hơn một biến thể gen ảnh hưởng đến quá trình chuyển hóa lipoprotein mà bản thân nó có thể có ảnh hưởng tương đối ít, nhưng kết hợp với một hoặc nhiều biến thể khác thì lại có ảnh hưởng lớn hơn đến TC, TG hoặc HDL-C. Kiểu di truyền là đa gen [357]. Người ta thường thấy rằng mức LDL-C cao, TG cao hoặc HDL-C thấp ảnh hưởng đến một số thành viên của gia đình.
9.1.1 Tăng lipid máu kết hợp gia đình
Tăng lipid máu kết hợp gia đình (FCH) là một rối loạn lipid máu hỗn hợp rất phổ biến (1 : 100-200) được đặc trưng bởi nồng độ LDL-C, TG, hoặc cả hai đều cao, và là một nguyên nhân quan trọng của CAD sớm. FCH là một bệnh lý phức tạp và kiểu hình được quyết định bởi sự tương tác của nhiều gen nhạy cảm và môi trường. Nó có sự trùng lặp đáng kể với các kiểu hình rối loạn lipid máu của T2DM và MetS. Ngay cả trong một gia đình, kiểu hình cũng khác nhau rất nhiều giữa những cá thể và trong cùng cá thể dựa trên các giá trị lipid (TG, LDL-C, HDL-C và ApoB). FCH không có thành phần đơn gen gây bệnh và không liên kết với một nguyên nhân di truyền đơn độc, nhưng kiểu hình là LDL-C cao và/hoặc TG cao [358,359]. Do đó, chẩn đoán thường bị bỏ qua trong thực hành lâm sàng; sự kết hợp của ApoB >120 mg/dL và TG >1.5 mmol/L (>133 mg/dL) với tiền sử gia đình CVD sớm có thể được sử dụng để xác định những người có khả năng mắc FCH [360].
Bảng 11. Các rối loạn di truyền chuyển hóa lipoprotein
| Rối loạn | Tần suất | Gen | Ảnh hương đến lipoprotein |
| HeFH | 1 trong 200- 250 | LDLR APO B PCSK9 | ↑ LDL-C |
| HoFH | 1 trong 160,000- 320,000 | LDLR APO B PCSK9 | ↑↑ LDL-C |
| FCH | 1 trong 100- 200 | USF1 + gen điều chỉnh | ↑ LDL-C, ↑ VLDL-C, ↑ ApoB |
| Rối loạn betalipoprotein máu gia đình | 1 trong 5000 | APO E | ↑↑ IDL và chylomicron còn sót lại (bVLDL) |
| Familial lipoprotein lipase deficiency (familial chylomicron syndrome) | 2 trong 10ˆ6 | LPL APO C2 ApoAV, GPIHBP1 LMF1 | ↑↑ chylomicron và VLDL-C |
| Tangier disease (analphalipoproteinaemia) | 1 trong 10ˆ | ABCA1 | ↓↓ HDL-C |
| Thiếu LCAT gia đình | 1 trong 10ˆ | LCAT | ↓ HDL-C |
Apo = apolipoprotein; FCH = tăng lipid máu kết hợp gia đình; HDL-C = cholesterol lipoprotein mật độ cao; HeFH = tăng cholesterol máu gia đình dị hợp tử; HoFH = tăng cholesterol máu gia đình đồng hợp tử; IDL = lipoprotein mật độ trung gian; LCAT = lecithin cholesterol acyltransferase; LDL-C = cholesterol lipoprotein mật độ thấp; VLDL = cholesterol lipoprotein mật độ rất thấp.
Khái niệm về rối loạn lipid máu hỗn hợp cũng có giá trị lâm sàng trong việc đánh giá nguy cơ CV. Nó nhấn mạnh tầm quan trọng của việc xem xét lịch sử gia đình trong việc quyết định mức độ nghiêm ngặt của việc điều trị rối loạn lipid máu và mức LDL-C cao báo hiệu nguy cơ cao hơn khi HTG cũng cao. Điều trị statin ở người bị HTG làm giảm nguy cơ CV gần tương tự như ở những người không HTG. Bởi vì nguy cơ tuyệt đối thường lớn hơn ở những người này, do đó họ có thể hưởng lợi rất nhiều từ liệu pháp hạ LDL.
Bảng 12. Tiêu chuẩn Dutch Lipid Clinic Network để chẩn đoán tăng cholesterol máu gia đình
| Tiêu chí | Điểm |
| 1) Tiền sử gia đình | |
| Họ hàng một đời mắc bệnh mạch máu hoặc mạch vành sớm (nam <55 tuổi; nữ <60 tuổi), hoặc họ hàng một đời có LDL-C trên bách phân vị thứ 95 | 1 |
| Họ hàng một đời bị u vàng gân và/hoặc đục rìa giác mạc, hoặc trẻ em dưới 18 tuổi có LDL-C trên bách phân vị thứ 95 | 2 |
| 2) Bệnh sử lâm sàng | |
| Bệnh nhân bị CAD sớm (nam <55 tuổi; nữ <60 tuổi) | 2 |
| Bệnh nhân bị bệnh mạch máu não hoặc ngoại biên sớm (nam <55 tuổi; nữ <60 tuổi) | 1 |
| 3) Khám thực thể a | |
| U vàng gân | 6 |
| Đục rìa giác mạc trước 45 tuổi | 4 |
| 4) Nồng độ LDL-C (chưa điều trị) | |
| LDL-C ≥8.5 mmol/L (≥325 mg/dL) | 8 |
| LDL-C 6.5-8.4 mmol/L (251-325 mg/dL) | 5 |
| LDL-C 5.0-6.4 mmol/L (191-250 mg/dL) | 3 |
| LDL-C 4.0-4.9 mmol/L (155-190 mg/dL) | 1 |
| 5) Phân tích DNA | |
| Đột biến chức năng trong các gen LDLR, apoB hoặc PCSK9 | 8 |
| Chỉ chọn một điểm cho mỗi nhóm, mức áp dụng cao nhất; chẩn đoán dựa trên tổng số điểm thu được
Chẩn đoán ‘xác định’ FH yêu cầu >8 điểm Chẩn đoán ‘có khả năng’ FH yêu cầu 6-8 điểm Chẩn đoán ‘có thể’ FH yêu cầu 3-5 điểm |
|
CAD = bệnh động mạch vành; FH = tăng cholesterol máu gia đình; LDL-C = cholesterol lipoprotein mật độ thấp; PCSK9 = proprotein convertase subtilisin/kexin loại 9.
a Loại bỏ tiêu chí còn lại nhau (nghĩa là tối đa 6 điểm nếu cả 2 cùng hiên diện)
9.1.2 Tăng cholesterol máu gia đình
9.1.2.1 Tăng cholesterol máu gia đình dị hợp tử
FH là một rối loạn lipid máu đơn gen đồng trội thường gặp gây ra CVD sớm do tăng LDL-C huyết tương suốt đời. Nếu không được điều trị, nam giới và phụ nữ mắc HeFH thường phát triển CAD sớm lần lượt trước tuổi 55 và 60. Nguy cơ CHD ở những người có thể mắc hoặc đã xác định mắc HeFH được ước tính tăng ít nhất 10 lần. Tuy nhiên, chẩn đoán sớm và điều trị thích hợp có thể làm giảm đáng kể nguy cơ CAD.
Tỷ lệ hiện mắc HeFH trong dân số được ước tính là 1/200-250 [361], tức là tổng số khoảng 14-34 triệu trường hợp trên toàn thế giới [362,363]. Chỉ một phần nhỏ trong số các trường hợp này được xác định và điều trị thích hợp.
FH là một bệnh đơn gen được gây ra bởi đột biến mất chức năng trong các gen LDLR hoặc apoB, hoặc đột biến tăng chức năng trong gen PCSK9; khoảng 95% trường hợp FH là do đột biến LDLR. Hơn 1000 đột biến khác nhau gây ra FH đã được xác định trong LDLR. Các đột biến khác nhau gây giảm chức năng hoặc mất hoàn toàn chức năng, kiểu đột biến mất hoàn toàn chức năng có liên quan đến tăng cholesterol máu nặng hơn và CVD.
Chẩn đoán FH thường dựa trên biểu hiện lâm sàng. Các tiêu chí thường được sử dụng từ Dutch Lipid Clinic Network được trình bày trong Bảng 12. Ngoài ra còn có các tiêu chí khác như Simon Broome hoặc tiêu chí của WHO [364,365].
Chẩn đoán có thể được khẳng định bằng cách chứng minh các đột biến nguyên nhân tại các gen gây bệnh. Tuy nhiên, trong hầu hết các nghiên cứu, tần suất đột biến có thể phát hiện ở bệnh nhân xác định/có thể HeFH là từ 60-80%. Điều này cho thấy rằng một tỷ lệ đáng kể bệnh nhân FH có nguyên nhân gây bệnh đa gen hoặc liên quan đến các gen khác chưa được xác định.
Xét nghiệm di truyền và tầm soát phả hệ. Người đầu tiên trong phả hệ được xác định mắc bệnh (proband/index case) cần được xác định theo các tiêu chí sau:
• TC chưa điều trị ≥8 mmol/L (≥310 mg/dL) ở người trưởng thành hoặc thành viên trưởng thành trong gia đình (hoặc >95 bách phân vị theo tuổi và giới tính theo quốc gia);
• CHD sớm ở bệnh nhân hoặc thành viên gia đình;
• U vàng ở gân ở bệnh nhân hoặc thành viên gia đình; hoặc là
• Đột tử tim sớm ở một thành viên trong gia đình.
Tầm soát phả hệ các thành viên gia đình của một proband đã biết cho phép xác định một cách hiệu quả các trường hợp mới. Tầm soát phả hệ được thực hiện tốt nhất bởi một phòng khám lipid. Trong hầu hết các gia đình, những trường hợp bệnh lý có thể được xác định bằng phân tích TC hoặc LDL-C; tuy nhiên, xét nghiệm di truyền được khuyến cáo để biết đột biến nguyên nhân.
Điều trị hạ cholesterol nên được bắt đầu càng sớm càng tốt sau khi chẩn đoán được đưa ra. Để cải thiện đánh giá nguy cơ, khuyến cáo sử dụng các kỹ thuật hình ảnh để phát hiện xơ vữa động mạch không triệu chứng. Khái niệm về gánh nặng cholesterol tích lũy minh họa tầm quan trọng của điều trị sớm (đối với trẻ em, xem bên dưới). Điều trị nên được bắt đầu bằng liệu pháp statin cường độ cao, kết hợp với ezetimibe trong hầu hết các trường hợp. Ở những bệnh nhân FH có nguy cơ ASCVD rất cao do có tiền sử ASCVD trước đó hoặc có yếu tố nguy cơ chính khác, mục tiêu LDL-C giảm ≥50% so với LDL-C ban đầu và mức LDL-C là <1.4 mmol/L (<55 mg/dL). Trong trường hợp không có ASCVD hoặc một yếu tố nguy cơ chính khác, bệnh nhân FH được phân nhóm là có nguy cơ cao và mục tiêu LDL-C là giảm ≥50% so với LDL-C ban đầu và mức LDL-C là <1.8 mmol/L (<70 mg/dL).
Chất ức chế PCSK9 hạ LDL-C tới 60% trên statin. Hai RCT đã báo cáo tác dụng có lợi đối với các kết cục lâm sàng ở bệnh nhân ASCVD không FH [119,120]. Chất ức chế PCSK9 được khuyến cáo ở những bệnh nhân có nguy cơ rất cao mắc FH nếu mục tiêu điều trị không đạt được với statin dung nạp tối đa cộng ezetimibe. Chất ức chế PCSK9 cũng được khuyến cáo ở bệnh nhân FH không dung nạp statin [366,367].
Các khuyến cáo về việc phát hiện và điều trị bệnh nhân HeFH được trình bày bên dưới.
9.1.2.2 Tăng cholesterol máu gia đình đồng hợp tử
HoFH là một bệnh hiếm gặp và đe dọa tính mạng. Hình ảnh lâm sàng được đặc trưng bởi các u vàng nhiều nơi, CVD sớm và tiến triển rõ rệt, TC >13 mmol/L (>500 mg/dL). Hầu hết bệnh nhân phát triển CAD và hẹp động mạch chủ trước 20 tuổi và chết trước 30 tuổi. Tần suất HoFH được ước tính là 1/160,000-1/320,000. Việc xác định sớm những đứa trẻ này và giới thiệu kịp thời đến một phòng khám chuyên khoa là rất quan trọng. Bệnh nhân nên được điều trị bằng liệu pháp hạ LDL tích cực và, khi có sẵn, lọc huyết tương loại bỏ lipoprotein. Điều trị này (mỗi 1-2 tuần) có thể làm giảm nồng độ LDL-C huyết tương xuống 55-70%. Tần suất thủ thuật có thể được điều chỉnh cho từng bệnh nhân khi nồng độ lipid, triệu chứng và các thông số khác liên quan đến bệnh thay đổi. Phải duy trì liệu pháp dược lý dung nạp tối đa [368]. Để thảo luận chi tiết hơn về HoFH, xem các tuyên bố đồng thuận EAS [366,368].
9.1.2.3 Tăng cholesterol máu gia đình ở trẻ em
FH được chẩn đoán ở trẻ em dựa trên các tiêu chí kiểu hình bao gồm LDL-C cao cộng với tiền sử gia đình LDL-C cao, CAD sớm và/hoặc xét nghiệm di truyền dương tính [369]. Xét nghiệm trong thời thơ ấu là tối ưu để phân định giữa FH và không FH bằng cách sử dụng LDL-C. Ở trẻ em có tiền sử gia đình cholesterol cao hoặc CHD sớm, ngưỡng được chấp nhận là ≥4.0 mmol/L (≥160 mg/dL). Nếu cha mẹ có khiếm khuyết di truyền đã biết, nồng độ có ý nghĩa chẩn đoán cho trẻ là ≥3.5 mmol/L (≥130 mg/dL). Nếu có thể, nên xét nghiệm di truyền cho trẻ.
Mặc dù chưa có thử nghiệm đối chứng giả dược ở trẻ em, nhưng các nghiên cứu quan sát cho thấy điều trị sớm có thể làm giảm gánh nặng LDL-C, cải thiện chức năng nội mô, làm giảm đáng kể sự phát triển của xơ vữa động mạch và cải thiện kết cục động mạch vành [369-371]. Điều trị cho trẻ em FH bao gồm statin và lối sống lành mạnh. Một chế độ ăn có lợi cho tim nên được áp dụng sớm suốt đời và điều trị statin nên được xem xét ở độ tuổi 6-10. Điều trị statin nên được bắt đầu với liều thấp và tăng dẫn liều để đạt mục tiêu [372]. Mục tiêu ở trẻ >10 tuổi là LDL-C <3.5 mmol/L (<135 mg/dL) và ở độ tuổi thiếu niên là giảm >50% LDL-C.
Khuyến cáo về việc phát hiện và điều trị bệnh nhân tăng cholesterol máu gia đình dị hợp tử
| Khuyến cáo | Loại | Mức |
| Khuyến cáo chẩn đoán FH được xem xét ở bệnh nhân CHD độ tuổi <55 đối với nam và <60 đối với nữ, ở những người có họ hàng mắc CVD sớm gây tử vong hoặc không tử vong, ở những người có họ hàng bị u vàng gân, những người có LDL-C tăng nghiêm trọng [ở người lớn >5 mmol/L (>190 mg/dL), ở trẻ em >4 mmol/L (>150 mg/dL)], và ở những người thân một đời của bệnh nhân FH. | I | C |
| Khuyến cáo FH nên được chẩn đoán bằng các tiêu chí lâm sàng và xác nhận thông qua phân tích DNA khi có thể. | I | C |
| Một khi proband được chẩn đoán, khuyến cáo tầm soát phả hệ gia đình. | I | C |
| Khuyến cáo bệnh nhân FH có ASCVD hoặc những người có yếu tố nguy cơ chính khác đang điều trị phải được xem là có nguy cơ rất cao và những bệnh nhân không có tiền sử ASCVD hoặc các yếu tố nguy cơ khác đang điều trị được xem là có nguy cơ cao. | I | C |
| Đối với bệnh nhân FH có ASCVD, là những người có nguy cơ rất cao, khuyến cáo điều trị để đạt mức giảm ≥50% so với ban đầu và LDL-C <1.4 mmol/L (<55 mg/dL). Nếu không thể đạt mục tiêu, khuyến cáo kết hợp thuốc. | I | C |
| Trong phòng ngừa tiên phát, đối với những người mắc FH có nguy cơ rất cao, nên xem xét giảm LDL-C ≥50% so với ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL). | IIa | C |
| Điều trị thuốc ức chế PCSK9 được khuyến cáo ở những bệnh nhân FH có nguy cơ rất cao nếu không đạt mục tiêu điều trị bằng statin dung nạp tối đa cộng ezetimibe. | II | C |
| Ở trẻ em, xét nghiệm FH được khuyến cáo từ 5 tuổi hoặc sớm hơn nếu nghi ngờ HoFH. | I | C |
| Trẻ em bị FH nên được giáo dục để áp dụng chế độ ăn hợp lý và được điều trị bằng statin từ 8-10 tuổi. Mục tiêu điều trị nên là LDL- C <3.5 mmol/L (<135 mg/dL) khi >10 tuổi. | IIa | C |
ASCVD = bệnh tim mạch xơ vữa động mạch; CHD = bệnh tim mạch vành; CVD = bệnh tim mạch; FH = tăng cholesterol máu gia đình; HoFH = FH đồng hợp tử; LDL-C = cholesterol lipoprotein mật độ thấp; PCSK9 = proprotein convertase subtilisin/kexin loại 9; proband = người đầu tiên trong phả hệ được xác định mắc bệnh
9.1.3 Rối loạn betalipoprotein máu gia đình
Rối loạn betalipoprotein máu gia đình (nghĩa là tăng lipoprotein máu loại III; remnant removal disease) là rất hiếm và thường được di truyền như một rối loạn lặn nhiễm sắc thể thường với độ thâm nhập của gen khác nhau. Rối loạn betalipoprotein máu gia đình tạo ra một hội chứng lâm sàng đặc trưng trong đó cả TC và TG đều cao trước khi điều trị, thường cả hai trong khoảng 7-10 mmol/L. Trong trường hợp nặng, bệnh nhân phát triển các tuberoerupive xanthomas(u vàng có tình trạng viêm), đặc biệt là ở khuỷu tay và đầu gối, và palmar xanthomata (một dạng u vàng ở nếp nhăn da của bàn tay và cổ tay). Nguy cơ CAD là rất cao, và xơ vữa động mạch ở động mạch đùi và động mạch chày tiến triển nhanh cũng rất phổ biến. Hội chứng này thường không biểu hiện ở tuổi thiếu niên hoặc ở phụ nữ trước khi mãn kinh. Phần lớn các trường hợp là đồng hợp tử cho đồng phân E2 của ApoE. ApoE rất quan trọng trong việc loại bỏ chylomicron còn sót lại và IDL tại gan. ApoE2 liên kết với các thụ thể ở gan ít dễ dàng hơn các đồng phân E3 và E4. Tuy nhiên, không có một số nguyên nhân trùng khớp ngẫu nhiên gây ra rối loạn lipid máu chẳng hạn như rối loạn lipid máu liên quan đến HTG, DM, béo phì hoặc hạ nhược giáp [373-375], ApoE2 đồng hợp tử thường không gây ra rối loạn betalipoprotein máu gia đình.
Việc phát hiện ApoE2 đồng hợp tử ở một bệnh nhân rối loạn lipid máu là chẩn đoán và phân tích các đồng phân ApoE hiện có sẵn trong hầu hết các phòng xét nghiệm lâm sàng. Sự hiện diện của cholesterol sót lại đặc trưng của rối loạn betalipoprotein máu gia đình có thể được dự đoán một cách đáng tin cậy dựa trên nồng độ cholesterol, TG và ApoB trong huyết tương [376]. Nếu nghi ngờ được xác nhận, kiểu gen ApoE có thể được phân tích. Ở bệnh nhân lớn tuổi bị xanthomata giống như người bị rối loạn betalipoprotein máu gia đình, là những người không phải đồng hợp tử đối với ApoE2, một paraprotein nên được tìm kiếm. Việc điều trị rối loạn betalipoprotein máu gia đình nên được thực hiện tại phòng khám chuyên khoa. Hầu hết các trường hợp đáp ứng tốt với điều trị statin hoặc nếu bị chi phối bởi TG cao thì sự kết hợp giữa statin và fibrate có thể cần thiết.
9.1.4 Nguyên nhân di truyền của tăng triglyceride máu
Mặc dù nguyên nhân di truyền của HTG dường như rất phức tạp, nhưng dữ liệu gần đây đã mở rộng sự hiểu biết về di truyền của HTG, đặc biệt là tăng chylomicron máu [37,226,377]. Mức độ cao trung bình của TG (giữa 2.0-10.0 mmol/L) là do tác động đa gen của nhiều gen ảnh hưởng đến cả sản xuất và loại bỏ VLDL. HTG nặng đơn gen gây ra bệnh tăng chylomicron máu, viêm tụy và lắng đọng lipid. Cho đến nay, đột biến ở sáu gen (LPL, apoC2, apoA5, LMF1, GPIHBP1 và GPD1) với các tác động đơn gen đã được công nhận là gây ra tăng nặng TG huyết thanh do gián đoạn các con đường loại bỏ chylomicron. Những đột biến này được di truyền qua những gen lặn nhiễm sắc thể thường và rất hiếm. Rối loạn sâu sắc trong quá trình dị hóa chylomicron và VLDL dẫn đến tăng chylomicron máu và nồng độ TG >11.2 mmol/L (>1000 mg/dL), với huyết thanh đục như sữa. HTG nặng được thấy ở những bệnh nhân đồng hợp tử hoặc dị hợp tử kép do đột biến enzyme LPL và ở các gen khác liên quan đến quá trình dị hóa của lipoprotein giàu TG. Người mang gen dị hợp tử của các đột biến gen giống nhau này thường biểu hiện tăng trung bình nồng độ TG huyết thanh làm cho họ tăng nguy cơ CVD [378]. Gần đây, liệu pháp gen đối với thiếu LPL đã được phát triển và đánh giá trong các thử nghiệm lâm sàng [379], và tiparvovec alipogene đã được phê duyệt bởi EMA vào năm 2013. Tuy nhiên, liệu pháp này hiện không còn nữa. Đột biến tăng chức năng trong apoC3 dẫn đến đến nồng độ ApoC-III cao cũng có thể gây ra HTG nặng do ức chế hoạt động của LPL, trong khi đột biến mất chức năng có liên quan đến bộ lipid thuận lợi với nồng độ TG thấp [380]. Những phát hiện này đã làm tăng khả năng ApoC-III trở thành mục tiêu của thuốc nhắm trúng đích lipid mới.
9.1.4.1 Hành động để ngăn ngừa viêm tụy cấp ở bệnh nhân tăng triglyceride nặng
Nguy cơ viêm tụy có ý nghĩa lâm sàng nếu TG >10 mmol/L (880 mg/dL), đặc biệt khi xảy ra liên quan đến tăng chylomicron máu gia đình và bắt buộc phải có các hành động để ngăn ngừa viêm tụy cấp [381,382]. Lưu ý, HTG là nguyên nhân của khoảng 10% tất cả các trường hợp viêm tụy và bệnh nhân có thể bị viêm tụy ngay cả khi nồng độ TG của họ là 5-10 mmol/L (440-880 mg/dL). Dữ liệu gần đây từ một nghiên cứu đoàn hệ tiến cứu báo cáo rằng nguy cơ viêm tụy cấp tăng đáng kể so với các khoảng tứ phân vị TG huyết thanh, nhấn mạnh thực tế là, TG huyết thanh có thể bị đánh giá thấp như là một yếu tố nguy cơ gây viêm tụy cấp [383]. Bất kỳ yếu tố nào làm tăng sản xuất VLDL đều có thể làm nặng thêm nguy cơ viêm tụy, với việc uống rượu là yếu tố góp phần thường gặp nhất. Một bệnh nhân, hoặc nên được nhập viện nếu có triệu chứng, hoặc nên theo dõi cẩn thận và chặt chẽ các giá trị TG của họ. Hạn chế lượng calo và chất béo (khuyến cáo 10-15%) trong chế độ ăn, và kiêng rượu là bắt buộc. Điều trị fibrate (fenofibrate) nên được bắt đầu, với acid béo n-3 (2-4 g/ngày) là liệu pháp bổ trợ. Lomitapide cũng có thể được xem xét trong trường hợp nặng [37]. Ở bệnh nhân DM, nên bắt đầu điều trị insulin để đạt được kiểm soát đường huyết tốt. Nói chung, giá trị TG giảm mạnh được nhìn thấy trong vòng 2-5 ngày. Trong bối cảnh cấp tính, thay huyết tương có thể nhanh chóng hạ TG [384]. Volanesorsen gần đây đã được EMA chấp thuận như là một thuốc bổ sung vào chế độ ăn ở những bệnh nhân trưởng thành bị FCS được xác nhận di truyền, là những người có nguy cơ cao bị viêm tụy.
9.1.5 Các rối loạn chuyển hóa lipoprotein di truyền khác
Đôi khi bệnh nhân đối mặt với mức LDL-C hoặc HDL-C cực kỳ thấp. Dạng thường gặp của hạ lipid máu di truyền là hạ betalipoprotein máu, được di truyền chủ yếu và thường là do cắt ngắn ApoB. LDL-C huyết thanh thường nằm trong khoảng 0.5-1.5 mmol/L (20-60 mg/dL). Một sự thiếu hụt ApoB sâu sắc hơn xảy ra trong bệnh lý abetalipoprotein máu khi chảy mồ hôi đầu và bệnh thần kinh hoặc các biến chứng khác cần được điều trị chuyên khoa. Hầu như không có HDL-C xảy ra trong bệnh Tangier (analphalipoprotein máu) và nồng độ HDL-C rất thấp xảy ra khi thiếu lecithin cholesterol acyltransferase (LCAT). Cả hai tình trạng này đều liên kết với các hội chứng lâm sàng riêng biệt và cần đánh giá chuyên khoa. Nồng độ HDL-C rất cao được phát hiện ở những bệnh nhân bị thiếu CETP. Ở dạng dị hợp tử, mức 2.0-2.3 mmol/L (80-90 mg/dL) thường được quan sát thấy và mức ≥5 mmol/L (≥200 mg/dL) được quan sát thấy ở người đồng hợp tử. Điều này không liên quan đến bệnh xơ vữa động mạch và có thể làm giảm nguy cơ.
Thiếu lysosomal acid lipase hoặc bệnh dự trữ cholesterol ester (ở trẻ em mắc bệnh Wolman) là một nguyên nhân hiếm gặp (truyền qua gen lặn) làm tăng LDL-C và HDL-C thấp, kèm theo bệnh gan to và gan nhiễm mỡ vi hạt. Điều trị statin làm giảm nồng độ LDL-C và do đó có thể ngăn ngừa ASCVD ở những bệnh nhân này, nhưng nó không thể ngăn chặn sự tiến triển của tổn thương gan. Điều trị bằng chất ức chế PCSK9 có thể dẫn đến tình trạng quá tải lysosome nhiều hơn [385]. Liệu pháp thay thế enzyme bằng sebelipase alfa có thể cung cấp giải pháp điều trị trong tương lai gần [386].
9.2 Phụ nữ
Vài thử nghiệm ngẫu nhiên về liệu pháp statin đã báo cáo lợi ích CV đáng kể độc lập ở phụ nữ [387,389], chủ yếu vì phụ nữ chưa được đại diện đầy đủ trong các thử nghiệm statin.
9.2.1 Tác dụng của statin trong phòng ngừa tiên phát và thứ phát
Trước đây người ta tranh cãi về việc liệu statin có hiệu quả trong phòng ngừa tiên phát ở phụ nữ hay không. Sử dụng dữ liệu được công bố, một phân tích Cochrane năm 2013 cho thấy liệu pháp statin làm giảm tỷ lệ tử vong do mọi nguyên nhân, giảm biến cố mạch máu và giảm tái thông mạch máu trong phòng ngừa tiên phát và các tác dụng theo tỷ lệ ở phụ nữ tương tự như ở nam giới [213]. Nghiên cứu CTT đã cung cấp đánh giá đầy đủ hơn về bằng chứng thông qua phân tích toàn diện IPD từ 22 thử nghiệm statin vs. đối chứng và năm thử nghiệm liệu pháp statin nhiều vs. ít tích cực hơn. Nhìn chung, 46,675 (27%) trong số 174,149 người tham gia là phụ nữ và sau khi điều chỉnh không sự khác biệt về giới tính, mức giảm theo tỷ lệ trên mỗi mmol/L LDL-C giảm đi là tương tự ở phụ nữ và nam giới đối với các biến cố mạch máu chính, các biến cố mạch vành, tái thông mạch vành và đột quỵ [35].
9.2.2 Thuốc hạ lipid không phải statin
Bằng chứng rõ ràng về tác dụng bảo vệ tim của các thuốc hạ lipid không phải statin hiện cũng có sẵn và tác dụng lợi ích là tương tự ở phụ nữ và nam giới. Trong nghiên cứu IMPROVE-IT [33], lợi ích tương đối của việc thêm ezetimibe vào simvastatin là tương tự ở phụ nữ và nam giới [33]. Trong nghiên cứu lipid ACCORD, không có bằng chứng nào cho thấy fenofibrate làm tăng tác dụng của simvastatin ở bệnh nhân T2DM [306], nhưng phân tích nghiên cứu FIELD cho thấy giảm đồng nhất biến cố CV ở phụ nữ và nam giới [389]. Một số thử nghiệm về kết cục đánh giá tác dụng của việc thêm chất ức chế PCSK9 vào liệu pháp statin cường độ cao đã được báo cáo, với tỷ lệ giảm các biến cố mạch máu chính tương tự ở phụ nữ và nam giới [120,286,290].
9.2.3 Liệu pháp nội tiết tố
Hiện nay, việc kê đơn thuốc tránh thai uống estrogen-progestin liều thấp thế hệ thứ ba dường như không làm tăng các biến cố mạch vành bất lợi [390] và có thể được sử dụng, sau khi đánh giá bộ lipid nền, ở phụ nữ có nồng độ TC chấp nhận được. Ngược lại, nên sử dụng các biện pháp tránh thai thay thế ở những phụ nữ bị tăng cholesterol máu [LDL-C >4 mmol/L (>160 mg/dL)] hoặc với nhiều yếu tố nguy cơ và ở những người có nguy cơ cao bị biến chứng huyết khối [391]. Liệu pháp thay thế estrogen, mặc dù có một số ảnh hưởng thuận lợi đối với bộ lipid, nhưng đã không làm giảm nguy cơ CV và không thể được khuyến cáo để phòng ngừa CVD ở phụ nữ [392]. Không nên dùng thuốc hạ lipid trong khi mang thai và thời kỳ cho con bú vì dữ liệu về tác dụng phụ tiềm tàng đang thiếu. Tuy nhiên, chất cô lập acid mật có thể được xem xét.
Box 6 liệt kê các biện pháp chính trong quản lý rối loạn lipid máu ở phụ nữ.
Box 6. Quản lý rồi loạn lipid máu ở phụ nữ
| Điều trị statin được khuyến cáo để phòng ngừa tiên phát ASCVD ở phụ nữ có nguy cơ cao [34,35]. |
| Statin được khuyến cáo để phòng ngừa thứ phát ở phụ nữ có cùng chỉ định và mục tiêu như ở nam giới [34,35]. |
| Không nên dùng thuốc hạ lipid khi có kế hoạch mang thai, trong khi mang thai hoặc trong thời kỳ cho con bú. Tuy nhiên, đối với những bệnh nhân FH nặng, các chất cô lập acid mật (không được hấp thu) và/hoặc lọc huyết tương có thể được xem xét. |
ASCVD = xơ vữa động mạch; FH = tăng cholesterol máu gia đình; LDL = lipoprotein mật độ thấp.
9.3 Người cao tuổi
Tỷ lệ người cao tuổi (được xác định ở đây là những người >65 tuổi) trong xã hội ngày càng tăng và do đó, >80% số người chết vì CVD là >65 tuổi. Tỷ lệ bệnh nhân bị MI >85 tuổi đã tăng gấp nhiều lần [393]. Một phân tích gộp các nghiên cứu quan sát đã chỉ ra rằng TC cao hơn có liên quan đến tăng tỷ lệ tử vong CAD ở mọi lứa tuổi [62,394]. Tuy nhiên, vì nguy cơ tuyệt đối CAD cao hơn ở người già, nên tăng nguy cơ tuyệt đối có liên quan đến sự gia tăng nhất định về TC là lớn hơn so với tăng tuổi [217].
9.3.1 Tác dụng của statin trong dự phòng tiên phát và thứ phát
Việc sử dụng liệu pháp statin giảm dần theo tuổi, phản ánh sự khác biệt trong việc kê đơn cũng như tuân thủ [395,396]. Xu hướng này thậm chí còn nổi bật hơn ở những bệnh nhân lớn tuổi không mắc bệnh mạch máu tắc nghẽn [396]. Một giải thích cho vấn đề này có thể là không chắc chắn về tác dụng của statin ở người già do số người >75 tuổi được đưa vào thử nghiệm statin là tương đối ít [233,397,398]. Nghiên cứu CTT gần đây đã đưa ra đánh giá toàn diện bằng chứng ngẫu nhiên về tác dụng của liệu pháp statin ở các độ tuổi khác nhau [217]. Với 186,854 người tham gia trong 28 thử nghiệm, có 14,483 (8%) ở độ tuổi >75 ở thời điểm phân ngẫu nhiên. Nhìn chung, liệu pháp statin làm giảm tương đối 21% các biến cố mạch máu chính (nguy cơ tương đối 0.79, CI 95% 0.77-0.81) với mỗi 1.0 mmol/L LDL-C giảm đi, và có bằng chứng trực tiếp về lợi ích ở những người >75 tuổi. Việc giảm tương đối các biến cố mạch máu chính là tương tự nhau, không phân biệt tuổi tác, ở những bệnh nhân có bệnh mạch máu từ trước, nhưng xảy ra nhỏ hơn ở những người lớn tuổi không được biết là có bệnh mạch máu trước khi đưa vào nghiên cứu. Do đó, bằng chứng từ các thử nghiệm chỉ ra rằng liệu pháp statin làm giảm đáng kể các biến cố mạch máu chính không liên quan đến tuổi tác. Tuy nhiên, có ít bằng chứng trực tiếp về lợi ích ở những bệnh nhân >75 tuổi không rõ bệnh mạch máu tắc nghẽn và hạn chế này hiện đang được giải quyết bằng thử nghiệm STAREE ở Australia.
9.3.2 Tác dụng phụ, tương tác và tuân thủ
Sự an toàn và tác dụng phụ của statin là lo ngại đặc biệt ở người lớn tuổi vì họ thường có nhiều bệnh đồng mắc, uống nhiều loại thuốc đồng thời và dược động học/dược lực học bị thay đổi. Tương tác thuốc khác với statin là một mối bận tâm, chủ yếu là do khả năng làm tăng các tác dụng phụ do statin liên quan đến cơ như đau cơ mà không tăng CK, bệnh cơ kèm theo tăng CK, và tiêu cơ vân là hiếm gặp nhưng nghiêm trọng. Khuyến cáo là bắt đầu statin với liều thấp nếu có suy thận đáng kể và/hoặc khả năng tương tác với thuốc khác, sau đó điều chỉnh tăng liều dần để đạt được mục tiêu điều trị LDL-C.
Các khuyến cáo về điều trị rối loạn lipid máu ở người lớn tuổi được trình bày bên dưới.
9.4 Đái tháo đường và hội chứng chuyển hóa
Số người bị DM sẽ tăng từ 415 triệu ở hiện lên tới 550 triệu vào năm 2030, nhưng tình hình có thể còn tồi tệ hơn [399]. Mặc dù có những thuận lợi đáng kể trong các chiến lược quản lý làm giảm yếu tố nguy cơ CVD xơ vữa động mạch, nhưng CVD vẫn là nguyên nhân hàng đầu gây ra bệnh suất và tử suất ở bệnh nhân T2DM. Tin tốt là các kết cục CVD gây tử vong đã giảm đáng kể ở cả T1DM và T2DM trong giai đoạn 1998 đến 2014 [400]. Bản thân DM là một yếu tố nguy cơ độc lập đối với CVD và có liên quan đến nguy cơ CVD cao hơn, thậm chí nhiều hơn ở phụ nữ. Sự khác biệt về nguy cơ CVD giữa những người có và không có DM đã thu hẹp đáng kể trong vài thập kỷ qua [401], và có mối liên hệ chặt chẽ giữa DM và kết cục mạch máu [402,403]. Dữ liệu gần đây cho thấy DM tự nó làm tăng nguy cơ CVD trung bình gấp hai lần, nhưng nguy cơ có thể thay đổi nhiều tùy thuộc vào quần thể và liệu pháp dự phòng tích cực hiện nay [401,404]. Điều quan trọng, những người mắc DM và CAD có nguy cơ CVD cao hơn đáng kể đối với các biến cố trong tương lai. Ở T2DM, nguy cơ ASCVD được quyết định mạnh mẽ bởi sự hiện diện của tổn thương cơ quan đích – bao gồm bệnh thận (microalbumin niệu), bệnh lý thần kinh hoặc bệnh võng mạc – với nguy cơ gia tăng liên quan đến số lượng các tình trạng hiện diện [405]. Tăng huyết áp, rối loạn lipid máu, béo phì bụng và bệnh gan nhiễm mỡ không do rượu (NAFLD) thường cùng tồn tại với T2DM và làm tăng thêm nguy cơ, cao nhất ở những người mắc T2DM và nhiều yếu tố nguy cơ rối loạn chuyển hóa tim [406-408]. Điều quan trọng là DM có nguy cơ tử vong cao sau ACS mặc cho các liệu pháp hiện đại, nhấn mạnh tiên lượng xấu của bệnh nhân mạch vành bị T2DM và sự cần thiết phải điều trị tích cực [409].
Làm thế nào để nhận ra thêm nguy cơ ngoài các yếu tố nguy cơ truyền thống trong thực hành lâm sàng là một vấn đề tranh cãi. Một cách tiếp cận thực tế là nếu một thành phần được xác định, thì một tìm kiếm có hệ thống nên được thực hiện cho các thành phần khác [410].
Khuyến cáo về điều trị rối loạn lipid máu ở người cao tuổi (tuổi >65)
| Khuyến cáo | Loại | Mức |
| Điều trị statin được khuyến cáo cho người già mắc ASCVD theo cách tương tự như đối với bệnh nhân trẻ tuổi [217]. | I | A |
| Điều trị statin được khuyến cáo để phòng ngừa tiên phát, theo mức độ nguy cơ, ở người cao tuổi ≤75 tuổi [217]. | I | A |
| Bắt đầu điều trị statin để phòng ngừa tiên phát ở người già >75 tuổi có thể được xem xét, nếu có nguy cơ cao hoặc rất cao [217]. | IIb | B |
| Khuyến cáo statin được bắt đầu với liều thấp nếu có suy thận đáng kể và/hoặc có khả năng tương tác với thuốc khác, và sau đó tăng liều dần để đạt được mục tiêu điều trị LDL-C. | I | C |
ASCVD = bệnh tim mạch xơ vữa động mạch; LDL-C = cholesterol lipoprotein mật độ thấp.
9.4.1 Đặc điểm chuyên biệt của rối loạn lipid máu trong kháng insulin và đái tháo đường type 2
Rối loạn lipid máu trong đái tháo đường là một nhóm các bất thường lipid và lipoprotein huyết tương có liên quan với nhau về mặt chuyển hóa. Sự gia tăng các hạt VLDL lớn trong T2DM khởi đầu một chuỗi các sự kiện tạo ra chất dư còn lại gây xơ vữa, LDL đậm đặc nhỏ và các hạt HDL đậm đặc giàu TG [411]. Các thành phần này không phải là bất thường biệt lập mà chúng liên kết chặt chẽ với nhau. Cả hai hạt LDL và HDL đều cho thấy những thay đổi thành phần khác nhau được phản ánh trong các chức năng của chúng. Đáng chú ý, nồng độ ApoC-III tăng lên ở những người bị T2DM [412]. Nồng độ ApoC-III cao ngăn chặn loại bỏ TRL và chất dư còn lại, dẫn đến thời gian cư trú kéo dài của các hạt này trong tuần hoàn [413,414]. Trên thực tế, sự dị hóa không hoàn toàn của TRL dường như là yếu tố quan trọng hơn góp phần làm TG huyết tương tăng cao hơn so với tốc độ sản xuất tăng dẫn đến dư thừa các hạt còn sót lại. Cùng với nhau, các chất dư còn lại của TRL, LDL đậm đặc nhỏ và HDL đậm đặc nhỏ bao gồm bộ lipid gây xơ vữa, cũng được đặc trưng bởi sự gia tăng nồng độ ApoB do số lượng hạt chứa ApoB tăng lên. Quan trọng là TRL – bao gồm chylomicron, VLDL và chất dư còn lại của chúng – mang một phân tử ApoB đơn lẻ, cũng giống như các hạt LDL. Do đó, bản chất ác tính của rối loạn lipid máu trong đái tháo đường không phải lúc nào cũng được tiết lộ bằng các phép đo lipid được sử dụng trong thực hành lâm sàng, vì mức LDL-C có thể vẫn nằm trong phạm vi bình thường. Nó có thể được tiết lộ rõ hơn bởi nồng độ non-HDL-C [415]. TG cao hoặc HDL-C thấp ở trạng thái nhịn ăn hoặc sau bữa ăn được nhìn thấy ở khoảng một nửa số người mắc T2DM [416,417], và cũng thường xuất hiện ở những người bị béo phì bụng, đề kháng insulin hoặc giảm dung nạp glucose [413].
Box 7 tóm tắt rối loạn lipid máu trong MetS và T2DM.
9.4.2 Bằng chứng cho liệu pháp hạ lipid máu
9.4.2.1 Cholesterol lipoprotein mật độ thấp
LDL-C là mục tiêu chính của điều trị hạ lipid máu ở bệnh nhân DM. Các thử nghiệm chuyên biệt được thực hiên ở những người mắc T2DM, cũng như các phân nhóm của những các thể DM trong các thử nghiệm statin lớn, đã chứng minh một cách nhất quán lợi ích đáng kể của liệu pháp statin đối với biến cố CVD ở những người bị T2DM [418]. Liệu pháp statin làm giảm tỷ lệ mắc mới biến cố CVD chính trong 5 năm là 23% trên 1 mmol/L LDL-C giảm đi, bất kể mức LDL-C ban đầu hay những đặc điểm ban đầu khác dựa trên phân tích gộp [418]. Phân tích gộp CTT tiếp tục chỉ ra rằng những người bị T2DM sẽ có nguy cơ tương đối giảm tương đương với bệnh nhân không đái tháo đường; tuy nhiên, do có nguy cơ tuyệt đối cao hơn nên lợi ích tuyệt đối sẽ lớn hơn, dẫn đến số lượng điều trị cần thiết (NNT) thấp hơn (NNT là số người cần điều trị để có được một người nhận lợi ích). Do đó, liệu pháp statin là phương pháp điều trị đầu tay để hạ LDL-C và giảm gánh nặng CVD [419].
Box 7. Tóm tắt rối loạn lipid máu trong hội chứng chuyển hóa và đái tháo đường type 2
| Rối loạn lipid máu đại diện cho một nhóm các bất thường về lipid và lipoprotein, bao gồm TG, ApoB và LDL đậm đặc nhỏ cao lúc đói hoặc sau bữa ăn, HDL-C và ApoA1 thấp. |
| Non-HDL-C hoặc ApoB là những chỉ dấu tốt của TRL và chất dư còn lại, và là mục tiêu phụ của điều trị. Non-HDL-C <2.6 mmol/L (<100 mg/dL) và ApoB <80 mg/dL là mong muốn ở những người có nguy cơ cao và non-HDL-C <2.2 mmol/L (<85 mg/dL) và ApoB <65 mg/dL ở những người có nguy cơ rất cao. Đối với những người có nguy cơ rất cao kèm theo các biến cố ASCVD tái phát, có thể xem xét mục tiêu non-HDL-C <1.8 mmol/L (<70 mg/dL) và ApoB <55 mg/dL. |
| Rối loạn lipid máu gây xơ vữa động mạch là một trong những yếu tố nguy cơ chính của CVD ở những người đái tháo đường type 2, những người béo phì bụng và kháng insulin hoặc giảm dung nạp glucose. |
Apo = apolipoprotein; ASCVD = bệnh tim mạch xơ vữa động mạch; CVD = bệnh tim mạch; HDL-C = cholesterol lipoprotein mật độ cao; LDL-C = cholesterol lipoprotein mật độ thấp; TG = triglyceride; TRL = lipoprotein giàu triglyceride.
Ezetimibe làm giảm 24% LDL-C và khi được thêm vào statin, sẽ giảm nguy cơ biến cố mạch máu lớn [33]. Giảm nguy cơ tương đối biến cố mạch máu lớn tỷ lệ thuận với mức độ giảm LDL-C tuyệt đối và phù hợp với mối liên quan được nhìn thấy cho statin. Phân nhóm bệnh nhân mắc DM trong IMPROVE-IT, theo dự kiến, có tỷ lệ biến cố mạch máu chính cao hơn so với bệnh nhân không DM (46 vs. 37% về tỷ lệ Kaplan-Meier ở nhóm giả dược trong 7 năm). Ezetimibe dường như đặc biệt hiệu quả ở bệnh nhân DM, với giảm nguy cơ tương đối 15% (95% CI 6-22%) và giảm nguy cơ tuyệt đối 5.5% [299].
Chất ức chế mAb PCSK9 evolocumab và alirocumab làm giảm 60% LDL-C và khi được thêm vào statin, sẽ làm giảm nguy cơ biến cố mạch máu chính [119]. Trong nghiên cứu FOURIER, việc giảm nguy cơ tương đối biến cố mạch máu chính là tương tự ở bệnh nhân có và không có DM; tuy nhiên, với nguy cơ ban đầu cao hơn ở bệnh nhân DM, mức giảm nguy cơ tuyệt đối có xu hướng lớn hơn ở bệnh nhân DM (giảm tuyệt đối 2.7% các biến cố mạch máu chính trong 3 năm) [297]. Lưu ý, LDL-C đạt được trong nhóm evolocumab là 0.8 mmol/L. Những lợi ích tương tự gần đây cũng được chứng minh cho bệnh nhân đái tháo đường sau ACS trong thử nghiệm ODYSSEY [420].
Các nghiên cứu gần đây cho thấy tỷ lệ mắc mới DM tăng ở những bệnh nhân được điều trị statin [247]. Những quan sát này đã được thấy trong các nghiên cứu ngẫu nhiên Mendel và trong các thử nghiệm lâm sàng, mặc dù ảnh hưởng dường như lớn nhất ở những bệnh nhân có nguy cơ cao mắc DM (ví dụ như những người tiền đái tháo đường ). Những quan sát này sẽ không làm giảm xu hướng của chúng tôi đối với việc điều trị bệnh nhân, vì lợi ích tổng thể khi làm giảm biến cố CV vẫn còn và vượt xa sự gia tăng tỷ lệ mắc mới DM. Trong các RCT, cả ezetimibe và chất ức chế PCSK9 đều được báo cáo không làm tăng nguy cơ DM [297].
9.4.2.2 Triglyceride và cholesterol lipoprotein mật độ cao
Thay đổi lối sống là lựa chọn đầu tiên để cải thiện bệnh rối loạn lipid máu gây xơ vữa do tác dụng nhiều mặt của nó. Giảm cân, trong hầu hết các trường hợp, là biện pháp hiệu quả nhất vì nó có liên quan đến các ảnh hưởng rất rõ rệt đến TG và HDL huyết tương, cùng với việc giảm nhẹ TC và LDL-C. Tập thể dục nhịp điệu từ trung bình đến nặng cũng có liên quan đến việc cải thiện bộ lipid huyết tương do làm giảm TG và tăng HDL-C. Liên quan đến thành phần trong chế độ ăn, bên cạnh nhu cầu loại bỏ chất béo trans, bằng chứng hiện nay hỗ trợ việc giảm lượng chất béo bão hòa và thay nó bằng chất béo không bão hòa, cũng như thay thế một tỷ lệ lớn các loại thực phẩm tinh bột chế biến và đường đơn bằng thực phẩm giàu chất xơ như trái cây, rau quả và nguyên hạt [179].
Những lợi ích lâm sàng đạt được khi điều trị mức TG cao và HDL-C thấp (thường thấy với DM) vẫn còn là một vấn đề tranh luận, vì tác dụng của fenofibrate đối với kết cục chính (MACE) vẫn âm tính trong nghiên cứu FIELD và ACCORD được thực hiện trên các đoàn hệ T2DM [306,307]. Trong một phân tích post hoc của nghiên cứu FIELD, fenofibrate làm giảm 27% biến cố CVD ở những người có TG cao [2.3 mmol/L (200 mg/dL)] và làm tăng HDL-C (NNT = 23) [416]. Thử nghiệm ACCORD đã xác nhận như sau: những bệnh nhân có mức TG cao thứ ba [2.3 mmol/L (200 mg/dL)] và mức HDL-C thấp thứ ba [≤0.4 mmol/L (≤34 mg/dL)], chiếm 17% tất cả người tham gia, dường như được hưởng lợi từ việc bổ sung fenofibrate vào simvastatin [306].
Gần đây, theo dõi sau thử nghiệm của những người tham gia thử nghiệm lipid ACCORD đã báo cáo tác dụng có lợi của fenofibrate ở những người bị HTG và mức HDL-C thấp ở thời điểm ban đầu [421]. Đồng nhất với những phát hiện này, một phân tích gộp các fibrate trong dự phòng CVD ở 11,590 người bị T2DM cho thấy rằng fibrate làm giảm đáng kể nguy cơ MI không gây tử vong xuống 21%, nhưng không ảnh hưởng đến nguy cơ tử vong chung hoặc tử vong do mạch vành [422]. Trong các thử nghiệm kết cục CV của fibrate, việc làm giảm nguy cơ dường như chỉ tỷ lệ thuận với mức độ hạ non-HDL-C [50].
Nhìn chung, dữ liệu hiện có chỉ ra rằng bệnh nhân đái tháo đường bị rối loạn lipid máu gây xơ vữa có thể nhận được lợi ích lâm sàng từ liệu pháp hạ TG như là một bổ sung cho điều trị statin [354]. Thử nghiệm PROMINENT đang diễn ra nhằm tìm hiểu hiệu quả của pemafibrate, một chất điều hòa PPAR-α có chọn lọc mới, trong việc làm giảm kết cục CVD ở 10,000 bệnh nhân đái tháo đường bị rối loạn lipid máu gây xơ vữa đang điều trị statin [317,423]. Có dữ liệu hạn chế về tác động lên CVD khi thêm acid béo omega-3 vào statin ở những bệnh nhân có nồng độ TG huyết tương cao đang được điều trị bằng statin. Thử nghiệm REDUCE-IT đánh giá ảnh hưởng của ethyl icosapent 2 g hai lần mỗi ngày lên các biến cố CV ở 8179 bệnh nhân có nguy cơ cao bị HTG đang dùng statin. Trong khoảng thời gian trung bình là 4.9 năm, có giảm đáng kể 25% (P <0.001) kết cục chính kết hợp của tử vong do CV, MI không gây tử vong, đột quỵ không gây tử vong, tái thông mạch vành hoặc đau thắt ngực không ổn định, tương ứng với mỗi 4% giảm tuyệt đối được đánh đổi bằng tăng 1% nguy cơ tuyệt đối nhập viện vì rung hoặc cuồng nhĩ [194]. Thử nghiệm STRENGTH đang nghiên cứu tác dụng của acid béo omega-3, thêm vào statin, ở những người bị HTG và HDL-C thấp có nguy cơ mắc CVD cao. Thử nghiệm ASCEND là một nghiên cứu thiết kế ngẫu nhiên 2×2 về aspirin và việc bổ sung acid béo omega-3 để phòng ngừa tiên phát biến cố CV ở những người bị DM, nhưng không chuyên biệt cho HTG. Trong số 15,480 người được chọn ngẫu nhiên để bổ sung acid béo omega-3 vs. giả dược trong thời gian theo dõi trung bình 7.4 năm, không có tác dụng đáng kể (HR 0.97, CI 95% 0.87- 1.08) đến các biến cố mạch máu nghiêm trọng [MI không gây tử vong, đột quỵ không gây tử vong, cơn thiếu máu não thoáng qua (TIA) hoặc tử vong do mạch máu] [329,424-426].
9.4.3 Đái tháo đường type 1
T1DM có liên quan đến nguy cơ CVD cao, đặc biệt ở những bệnh nhân có microalbumin niệu và bệnh thận [427]. Bằng chứng thuyết phục ủng hộ đề xuất rằng tăng đường huyết làm tăng tốc độ xơ vữa động mạch. Bằng chứng mới đây cho thấy MetS và T1DM thường xuyên cùng tồn tại, dẫn đến cái gọi là đái tháo đường làm tăng gấp đôi nguy cơ CVD [428].
Bộ lipid ở bệnh nhân T1DM có kiểm soát đường huyết tốt là ‘cực kỳ bình thường’, và được đặc trưng bởi nồng đồ TG và LDL-C dưới mức bình thường, trong khi HDL-C thường nằm trong giới hạn bình thường trên hoặc tăng nhẹ. Điều này được giải thích bởi insulin tiêm dưới da làm tăng hoạt động LPL trong mô mỡ và cơ xương, do đó làm tăng tốc độ giáng hóa – tạo mới của các hạt VLDL [429]. Tuy nhiên, có những thay đổi có khả năng gây xơ vữa về thành phần của cả hai hạt HDL và LDL.
Dữ liệu đồng nhất đã chứng minh hiệu quả của statin trong việc phòng ngừa biến cố CV và giảm tỷ lệ tử vong CV ở bệnh nhân DM, không có bằng chứng về sự khác biệt giới tính [430,431]. Một phân tích gộp bao gồm 18,686 bệnh nhân DM đã chứng minh rằng giảm LDL-C do statin đã giúp làm giảm 9% tỷ lệ tử vong do mọi nguyên nhân và giảm 21% tỷ lệ mắc mới các biến cố CV chính trên 1.0 mmol/L (40mg/dL) cholesterol LDL giảm đi [418]. Tương tự, lợi ích đã được nhìn thấy ở những bệnh nhân T1DM và T2DM. Ở những bệnh nhân đái tháo đường bị ACS, điều trị statin tích cực đã dẫn đến giảm tỷ lệ tử vong do mọi nguyên nhân và tử vong CV, đồng thời góp phần làm giảm tiến triển của mảng xơ vữa [432].
9.4.4 Quản lý rối loạn lipid máu cho phụ nữ mang thai mắc đái tháo đường
Ở bệnh nhân T1DM cũng như bệnh nhân T2DM khởi phát khi còn trẻ, có rất ít bằng chứng để chỉ ra độ tuổi nên bắt đầu liệu pháp statin. Để hướng dẫn một cách tiếp cận, statin không được chỉ định trong thai kỳ [433], và nên tránh ở những người T1DM và T2DM đang có kế hoạch mang thai. Nếu những người bị đái tháo đường ở độ tuổi ≤30 không có tổn thương mạch máu và đặc biệt là không có microalbumin niệu, thì có vẻ hợp lý khi trì hoãn liệu pháp statin ở bệnh nhân không có triệu chứng cho đến tuổi 30. Dưới độ tuổi này, liệu pháp statin nên được áp dụng dựa trên từng trường hợp cụ thể, có tính đến sự hiện diện của microalbumin niệu, tổn thương cơ quan đích và ngưỡng dao động LDL-C. Các khuyến cáo về điều trị rối loạn lipid máu ở DM được trình bày trong bảng dưới đây.
Khuyến cáo về điều trị rối loạn lipid máu ở bệnh đái tháo đường
| Khuyến cáo | Loại | Mức |
| Ở những bệnh nhân T2DM có nguy cơ rất caoc , khuyến cáo giảm LDL-C ≥50% so với ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL) [34,418,432]. | I | A |
| Ở những bệnh nhân T2DM có nguy cơ rất caoc , khuyến cáo giảm LDL-C ≥50% so với ban đầu và mục tiêu LDL-C <1.8 mmol/L (<70 mg/dL) [418]. | I | A |
| Statin được khuyến cáo ở những bệnh nhân T1DM có nguy cơ cao hoặc rất cao c [427]. | I | A |
| Nên xem xét tăng cường liệu pháp statin trước khi đưa ra liệu pháp phối hợp. | IIa | C |
| Nếu không đạt được mục tiêu, nên xem xét kết hợp statin với ezetimibe [33,299]. | IIa | B |
| Liệu pháp statin không được khuyến cáo ở bệnh nhân tiền mãn kinh bị đái tháo đường đang cân nhắc mang thai hoặc không sử dụng biện pháp tránh thai đầy đủ. | III | C |
| Liệu pháp statin có thể được xem xét ở bệnh nhân T1DM và T2DM trong độ tuổi ≤30 với bằng chứng tổn thương cơ quan đích và/hoặc mức LDL-C >2.5 mmol/L, miễn là không có kế hoạch mang thai. | IIb | C |
LDL-C = cholesterol lipoprotein mật độ thấp; T1DM = đái tháo đường type 1; T2DM = đái tháo đường type 2.
c xem Bảng 6.
9.5 Bệnh nhân mắc hội chứng mạch vành cấp và bệnh nhân trải qua can thiệp mạch vành qua da
Bệnh nhân nhập viện vì ACS có nguy cơ cao tái phát biến cố CV. Đối với những bệnh nhân này, việc quản lý lipid nên được thực hiện trong bối cảnh chiến lược giảm thiểu nguy cơ toàn cầu toàn diện bao gồm điều chỉnh lối sống, quản lý yếu tố nguy cơ và thực hiện chiến lược thuốc bảo vệ tim mạch. Tốt nhất, bệnh nhân nên đăng ký các chương trình phục hồi chức năng tim để tăng cường kiểm soát nồng độ lipid [434] và cải thiện khả năng sống sót tổng thể sau ACS [435]. Mặc dù đã nhận thấy lợi ích lâm sàng khi hạ LDL-C ở bệnh nhân ACS [436], nhưng việc đạt được giá trị mục tiêu LDL-C vẫn ở mức dưới tối ưu trong bối cảnh nguy cơ rất cao này [437].
9.5.1 Liệu pháp hạ lipid ở bệnh nhân mắc hội chứng mạch vành cấp
Nồng độ LDL-C có xu hướng giảm trong những ngày đầu tiên của ACS và do đó cần phải xét nghiệm bộ lipid càng sớm càng tốt sau khi nhập viện vì ACS. Bệnh nhân không cần phải nhịn ăn vì điều này ít ảnh hưởng đến mức LDL-C [100]. Điều trị hạ lipid nên được bắt đầu càng sớm càng tốt để tăng cường sự tuân thủ điều trị của bệnh nhân sau khi xuất viện. Nồng độ lipid nên được đánh giá lại sau 4-6 tuần sau ACS để xác định mục tiêu điều trị đã đạt được hay chưa và để kiểm tra bất kỳ vấn đề an toàn nào; phác đồ điều trị sau đó có thể được điều chỉnh cho phù hợp.
9.5.1.1 Statin
Dữ liệu từ RCT và phân tích gộp chỉ ra rằng việc sử dụng sớm thường quy liệu pháp statin cường độ cao có liên quan đến lợi ích lâm sàng nhanh chóng và bền vững [438-442]. Chúng tôi khuyến cáo bắt đầu liệu pháp statin cường độ cao ở tất cả các bệnh nhân ACS chưa sử dụng statin mà không có chống chỉ định, bất kể giá trị LDL- C ban đầu; mục tiêu điều trị là đạt mức giảm 50% LDL-C so với ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL). Ở những người có biến cố tái phát trong vòng 2 năm trong khi dùng liệu pháp statin dung nạp tối đa, nên xem xét mục tiêu LDL-C <1.0 mmol/L (<40 mg/dL). Cường độ của liệu pháp statin nên được tăng lên ở những bệnh nhân đang điều trị statin cường độ thấp hoặc trung bình tại thời điểm nhập viện, trừ khi có tiền sử không dung nạp với liệu pháp statin cường độ cao. Nên xem xét sử dụng liệu pháp statin cường độ thấp ở những bệnh nhân có nguy cơ tăng tác dụng phụ với liệu pháp statin cường độ cao, chẳng hạn như ở người già, bệnh nhân được chẩn đoán bị suy gan hoặc thận, hoặc trong trường hợp có nguy cơ tiềm tàng của statin – tương tác thuốc với các liệu pháp đồng thời cần thiết khác.
Về thời điểm bắt đầu điều trị statin, thử nghiệm ngẫu nhiên, đối chứng giả dược SECURE-PCI gần đây đã đánh giá tác động của liều tải quanh thủ thuật tái thông mạch máu bằng atorvastatin [hai liều tải 80 mg, trước và 24 giờ sau can thiệp mạch vành qua da (PCI)] theo chương trình trên MACE sau 30 ngày ở 4191 bệnh nhân ACS và quản lý xâm lấn theo chương trình [443]. Tất cả bệnh nhân đều dùng atorvastatin 40 mg mỗi ngày bắt đầu 24 giờ sau liều tải thứ hai. Các tác giả không tìm thấy lợi ích điều trị đáng kể trong toàn bộ dân số nghiên cứu. Trong một phân tích được chỉ định trước, thấy có giảm đáng kể 28% nguy cơ tương đối trong MACE ở những bệnh nhân trải qua PCI (65% tổng số bệnh nhân). Lợi ích thậm chí còn rõ rệt hơn (giảm 46% nguy cơ tương đối) trong phân tích post hoc bao gồm 865 bệnh nhân MI ST chênh lên (STEMI) trải qua tái tưới máu bằng PCI tiên phát [443]. Dựa trên bằng chứng hiện tại, chúng tôi khuyến cáo bắt đầu liệu pháp statin cường độ cao trong 1-4 ngày đầu nhập viện vì ACS [438-442]. Hơn nữa, điều trị trước (hoặc tải liều cho bệnh nhân đang dùng statin) với statin cường độ cao nên được xem xét ở bệnh nhân ACS có quản lý xâm lấn theo chương trình [443].
9.5.1.2 Ezetimibe
Trong thử nghiệm IMPROVE-IT, việc thêm ezetimibe vào liệu pháp simvastatin mang lại lợi ích bổ sung (giảm 6.4% nguy cơ tương đối trong kết cục lâm sàng tổng hợp) cho bệnh nhân sau ACS [33]. Lợi ích lâm sàng của việc thêm ezetimibe là đồng nhất giữa các phân nhóm bệnh nhân [299,444] và cũng làm giảm tổng số các biến cố CV [445], đột quỵ [446] và tái nhập viện [447]. Bệnh nhân có nguy cơ huyết khối động mạch cao hơn [theo đánh giá bằng điểm nguy cơ TIMI (Thrombolysis In Myocardial Infarction) để phòng ngừa thứ phát] là được lợi ích nhất từ việc thêm ezetimibe [448]. Trong một thử nghiệm nhãn mở, ngẫu nhiên khác bao gồm 1734 bệnh nhân ACS, việc thêm ezetimibe vào liệu pháp statin cường độ trung bình (pitavastatin 2 mg) đã không cải thiện kết cục tổng thể, nhưng đã làm giảm kết cục chính tổng hợp (tử vong, nhồi máu cơ tim, đột quỵ, đau thắt ngực không ổn định và thiếu máu cục bộ cần phải tái thông mạch) trong thời gian theo dõi 3.9 năm ở bệnh nhân tăng hấp thu cholesterol ở ruột (như được đánh giá bằng nồng độ sitosterol cao) [449]; tuy nhiên, phát hiện này cần phải được xác nhận thêm.
9.5.1.3 Chất ức chế proprotein convertase subtilisin/kexin loại 9
Trong thử nghiệm FOURIER, bao gồm 27,564 bệnh nhân mắc bệnh CV xơ vữa động mạch, việc bổ sung evolocumab vào liệu pháp statin (liệu pháp cường độ cao 69%) giúp giảm 15% nguy cơ tương đối của kết cục chính tổng hợp qua 2.2 năm theo dõi. Kết quả đồng nhất ở phân nhóm bệnh nhân có tiền sử MI (81% tất cả bệnh nhân) [119,450]. Một phân tích thử nghiệm FOURIER cho thấy những bệnh nhân đạt được giá trị LDL-C thấp nhất với PCSK9 cũng có nguy cơ MACE thấp nhất trong tương lai [451]. Trong thử nghiệm ODYSSEY Outcomes, bao gồm 18,924 bệnh nhân bị ACS gần đây (1-12 tháng trước khi đưa vào nghiên cứu, trung bình 2.6 tháng), alirocumab được thêm vào liệu pháp statin (liệu pháp cường độ cao 89%) cũng cho kết quả giảm nguy cơ tương đối 15% ở kết cục tổng hợp chính và có liên quan đến giảm tương đối 15% tỷ lệ tử vong do mọi nguyên nhân qua 2.8 năm theo dõi [120]. Không có tác dụng phụ nghiêm trọng hoặc lo ngại về mặt an toàn nào được báo cáo trong hai thử nghiệm lớn này. Thời điểm tối ưu để bắt đầu ức chế PCSK9 sau ACS và tác động của nó đến kết cục lâm sàng vẫn được xác định. Liên quan đến thời điểm bắt đầu điều trị thuốc ức chế PCSK9, phân tích post hoc từ thử nghiệm FOURIER đã chỉ ra rằng thời điểm bắt đầu PCSK9 càng gần với biến cố này thì càng tốt. Bắt đầu điều trị thuốc ức chế PCSK9 trong giai đoạn cấp của ACS đang được nghiên cứu trong thử nghiệm EVOPACS [452]. Dựa trên bằng chứng hiện tại, chúng tôi khuyến cáo bắt đầu điều trị thuốc ức chế PCSK9 ở những bệnh nhân ACS không đạt được mục tiêu LDL-C tương ứng (như được nêu trong Bảng 7) sau 4-6 tuần liệu pháp statin dung nạp tối đa và ezetimibe. Ở những bệnh nhân nhập viện vì ACS và ở những người có mức LDL-C không nằm trong mục tiêu, mặc dù đã dùng liều statin dung nạp tối đa và ezetimibe trước khi xảy ra biến cố, việc thêm chất ức chế PCSK9 sớm sau biến cố (trong thời gian nhập viện vì biến cố ACS nếu có thể) nên được xem xét.
9.5.1.4 Acid béo đa không bão hòa n-3
Bổ sung đường uống PUFA n-3 tinh khiết cao đã làm giảm tỷ lệ tử vong ở những người sống sót sau MI trong một nghiên cứu (GISSI-P) nhưng không ảnh hưởng đến kết cục lâm sàng trong các thử nghiệm tiếp theo sử dụng liệu pháp dự phòng thứ phát đương đại. Một phân tích gộp gần đây của các RCT hiện có cho thấy không làm giảm tỷ lệ tử vong, MI hoặc các biến cố mạch máu chính liên quan đến PUFA n-3, bao gồm phân nhóm bệnh nhân CAD đã biết [453]. Do đó, điều trị thường quy PUFA n-3 không được khuyến cáo.
9.5.1.5 Chất ức chế protein vận chuyển ester cholesteryl
Vào năm 2007, một nghiên cứu tiến cứu lớn sử dụng thuốc ức chế CETP torcetrapib đã không cho thấy bất kỳ lợi ích lâm sàng nào ở hơn 15,000 bệnh nhân có nguy cơ cao mà lại có khả năng gây hại [336]. Thuốc ức chế CETP dalcetrapib (trong >30,000 bệnh nhân mắc ACS gần đây [65]) và evacetrapib (trong >12,000 bệnh nhân nguy cơ cao [63]) đã được nghiên cứu lần lượt vào năm 2012 và 2017. Không có nghiên cứu lâm sàng nào có thể cho thấy bất kỳ lợi ích lâm sàng liên quan đến thuốc ức chế CETP. Gần đây, thử nghiệm REVEAL đã nghiên cứu anacetrapib ở >30,000 bệnh nhân bị bệnh mạch máu xơ vữa động mạch và kết quả làm giảm tỷ lệ mắc mới MACE so với giả dược sau 4 năm, không có lo ngại nào về tính an toàn [64]. Tuy nhiên, hợp chất này đã không được đệ trình cho ủy quyền tiếp thị.
9.5.2 Liệu pháp hạ lipid máu ở bệnh nhân được can thiệp mạch vành qua da
Trong một phân tích gộp của 13 nghiên cứu ngẫu nhiên bao gồm 3341 bệnh nhân được PCI chương trình, điều trị trước bằng statin liều cao (bệnh nhân chưa dùng statin, 11 nghiên cứu) hoặc liều tải statin liều cao làm giảm nguy cơ MACE (tử vong, MI, hoặc tái thông mạch máu mục tiêu) xuống 44% cho cả MI quanh thủ thuật và MACE sau 30 ngày [454]. Trong tất cả trừ một nghiên cứu, PCI được thực hiện trong bối cảnh đau thắt ngực ổn định hoặc bối cảnh ACS không ST chênh lên (NSTE-ACS) không cấp cứu. Một trong những nghiên cứu được đưa vào phân tích gộp cho thấy sự cải thiện lưu lượng mạch vành khi PCI tiên phát được sử dụng để điều trị STEMI [455]. Chiến lược thường quy là điều trị trước hoặc liều tải gần với thủ thuật (trên nền liệu pháp statin đã có từ trước) với statin liều cao trước PCI nên được xem xét trong PCI chương trình hoặc NSTE-ACS [454,456,457].
Ngoài ra, điều trị trước bằng statin cũng được chứng minh là làm giảm nguy cơ tổn thương thận cấp do chất tương phản sau khi chụp hoặc can thiệp mạch vành [458].
Các khuyến cáo về liệu pháp hạ lipid máu ở bệnh nhân ACS và bệnh nhân trải qua PCI được tóm tắt dưới đây.
Khuyến cáo về liệu pháp hạ lipid ở bệnh nhân mắc hội chứng mạch vành cấp tính có nguy cơ rất cao
| Khuyến cáo | Loại | Mức |
| Ở tất cả các bệnh nhân ACS không có chống chỉ định hoặc không có tiền sử không dung nạp, khuyến cáo liệu pháp statin liều cao được bắt đầu hoặc tiếp tục càng sớm càng tốt, bất kể giá trị LDL-C ban đầu [438,440,442]. | I | A |
| Cần đánh giá lại mức lipid 4-6 tuần sau ACS để xác định xem có giảm ≥50% so với mức ban đầu và mục tiêu của LDL-C <1.4 mmol/L (<55 mg/dL) hay không. Vấn đề an toàn cần được đánh giá tại thời điểm này và điều chỉnh liều điều trị statin phù hợp. | IIa | C |
| Nếu mục tiêu LDL-C không đạt được sau 4-6 tuần với liều statin dung nạp tối đa, khuyến cáo kết hợp với ezetimibe [33]. | I | B |
| Nếu mục tiêu LDL-C không đạt được sau 4-6 tuần mặc dù điều trị statin dung nạp tối đa và ezetimibe, khuyến cáo thêm chất ức chế PCSK9 [119,120]. | I | B |
| Ở những bệnh nhân được xác nhận không dung nạp statin hoặc ở những bệnh nhân chống chỉ định với statin, nên xem xét sử dụng ezetimibe. | IIa | C |
| Đối với những bệnh nhân nhập viện vì ACS và có mức LDL-C không ở mức mục tiêu, mặc dù đã dùng liều statin dung nạp tối đa và ezetimibe, nên xem xét thêm chất ức chế PCSK9 sớm sau biến cố (trong thời gian nằm viện vì biến cố ACS nếu có thể). | IIa | C |
ACS = hội chứng mạch vành cấp; LDL-C = cholesterol lipoprotein mật độ thấp; PCSK9 = proprotein convertase subtilisin/kexin loại 9.
Khuyến cáo về liệu pháp hạ lipid ở bệnh nhân trải qua can thiệp mạch vành qua da có nguy cơ rất cao
| Khuyến cáo | Loại | Mức |
| Điều trị trước hoặc liều tải thường quy (trên nền của liệu pháp statin mạn tính) với statin liều cao nên được xem xét ở những bệnh nhân trải qua PCI vì ACS hoặc PCI chương trình [443,454,456]. | IIa | B |
ACS = hội chứng mạch vành cấp; PCI = can thiệp mạch vành qua da.
9.6 Đột quỵ
Đột quỵ có bệnh nguyên không đồng nhất, bao gồm huyết khối từ tim [thường liên quan đến rung nhĩ, nhưng cũng có nguồn không rõ ràng (đột quỵ thuyên tắc mạch máu nguồn gốc không xác định)], thuyên tắc huyết khối và xơ vữa động mạch chủ gần và động mạch cảnh, CVD mạch máu nhỏ, và xuất huyết nội sọ (bao gồm xuất huyết trong mô não và xuất huyết dưới nhện). Rối loạn lipid máu có thể đóng vai trò khác nhau trong sinh bệnh học của đột quỵ tùy theo nguyên nhân cụ thể. Mối quan hệ giữa rối loạn lipid máu và các biến cố huyết khối động mạch, bao gồm đột quỵ do thiếu máu cục bộ và TIA, đã được công nhận rõ ràng; trong khi mối liên quan của rối loạn lipid máu với các loại đột quỵ khác là không chắc chắn. Mặc dù vậy, việc kiểm soát đồng thời các yếu tố căn nguyên khác, chẳng hạn như tăng huyết áp, là rất quan trọng.
Sau đột quỵ thiếu máu cục bộ hoặc TIA, bệnh nhân có nguy cơ không chỉ các biến cố mạch máu não tái phát, mà còn các biến cố CV chính khác, bao gồm MI. Điều trị dự phòng thứ phát bằng statin làm giảm nguy cơ đột quỵ tái phát (giảm 12% trên 1 mmol/L LDL-C giảm đi), MI và tử vong do bệnh mạch máu [459,460]. Điều trị trước bằng statin ở thời điểm khởi phát TIA có liên quan đến giảm nguy cơ đột quỵ tái phát sớm ở bệnh nhân bị hẹp động mạch cảnh trong phân tích dữ liệu gộp, ủng hộ bắt đầu statin càng sớm càng tốt sau đột quỵ [460-462]. Liệu pháp statin có thể làm tăng nhẹ nguy cơ đột quỵ xuất huyết, nhưng bằng chứng về nguy cơ này là không chắc chắn [34,36,251,252].
Khuyến cáo về liệu hạ lipid để phòng ngừa các biến cố bệnh tim mạch do xơ vữa động mạch ở bệnh nhân đột quỵ thiếu máu cục bộ trước đó
| Khuyến cáo | Loại | Mức |
| Bệnh nhân có tiền sử đột quỵ thiếu máu cục bộ hoặc TIA có nguy cơ mắc ASCVD rất cao, đặc biệt là đột quỵ thiếu máu cục bộ tái phát, do đó, khuyến cáo liệu pháp hạ LDL-C tích cực cho những bệnh nhân này [459,460]. | I | A |
ASCVD = bệnh tim mạch xơ vữa động mạch; LDL-C = cholesterol lipoprotein mật độ thấp; TIA = cơn thiếu máu não thoáng qua.
9.7 Suy tim và bệnh van tim
9.7.1 Phòng ngừa suy tim ở bệnh nhân mắc bệnh mạch vành
Hạ cholesterol bằng statin làm giảm tỷ lệ HF ở bệnh nhân mắc CAD (CAD ổn định hoặc có tiền sử ACS) mà không có HF trước đó; điều này đã được chứng minh một cách nhất quán trong các RCT so sánh giữa điều trị vs. không điều trị statin [463,464], cũng như điều trị statin tích cực vs. không tích cực [465-468]. Một phân tích gộp quy mô lớn các RCT dự phòng tiên phát và thứ phát bằng statin cho thấy giảm nhẹ (10%) số lần nhập viện vì HF đầu tiên không gây tử vong khi điều trị statin, không có tác dụng lên tử vong HF trong giới hạn thời gian RCT [469]. Không có bằng chứng nào cho thấy statin có thể dự phòng HF có nguồn gốc không do thiếu máu cục bộ.
9.7.2 Suy tim mạn tính
Hai RCT [466,470] lớn (chủ yếu đưa vào các bệnh nhân bị HF tâm thu), cũng như phân tích gộp 24 RCT, cho thấy không có lợi ích gì khi điều trị statin đối với tử vong CV hoặc đột quỵ [471]; giảm số lần nhập viện [218,471] cũng như giảm MI, đã được quan sát trong một phân tích gộp của thử nghiệm CORONA và GISSI-HF [472]. Dựa trên bằng chứng hiện tại, việc sử dụng statin thường quy ở bệnh nhân HF mà không có chỉ định khác cho việc sử dụng statin (ví dụ CAD) là không được khuyến cáo. Do không có bằng chứng về tác hại ở bệnh nhân đang điều trị statin sau khi xuất hiện HF, nên không cần phải ngừng statin cho bệnh nhân đã điều trị.
Không có bằng chứng về tác dụng của việc ức chế PCSK9 ở bệnh nhân HF mạn tính. Trong các thử nghiệm có kết cục lâm sàng về PCSK9 gần đây, FOURIER [119] và ODYSSEY Outcomes [120], ức chế PCSK9 ở bệnh nhân CVD xơ vữa động mạch hoặc sau ACS không làm giảm nguy cơ nhập viện vì HF. Trong nghiên cứu BIOSTAT-CHF trên 2174 bệnh nhân HF tiến triển xấu, phân tích đa biến cho thấy mối liên quan tuyến tính dương giữa mức PCSK9 và nguy cơ tử vong, tổng hợp của tỷ lệ tử vong và nhập viện đột xuất vì HF [473]. Tương tự, có mối liên quan âm giữa mức LDLR và tỷ lệ tử vong, cho thấy mối quan hệ tiềm năng giữa trục PCSK9- LDLR và kết cục ở những bệnh nhân HF cần nghiên cứu thêm [473,474].
Điều trị bằng PUFA n-3 1 gram một lần mỗi ngày có thể mang lại một lợi ích nhỏ ở những bệnh nhân HF mạn tính, như thể hiện bằng việc giảm đáng kể 9% nguy cơ tương đối về tỷ lệ tử vong trong RCT GISSI-HF [475].
9.7.3 Bệnh van tim
Hẹp động mạch chủ làm tăng nguy cơ biến cố CV và tử vong, và thường cùng tồn tại với CVD xơ vữa động mạch. Nồng độ LDL-C [476] và Lp (a) [477] cao suốt đời có liên quan đến tỷ lệ mắc hẹp van động mạch chủ và vôi hóa van động mạch chủ trong các nghiên cứu ngẫu nhiên di truyền Mendel. Các nghiên cứu quan sát đã cho thấy tác dụng có lợi tiềm năng của việc hạ lipid tích cực trong việc làm chậm tiến triển của hẹp van động mạch chủ bẩm sinh [478]. Tuy nhiên, điều này chưa được chứng minh trong các RCT [266,479-481], hoặc trong phân tích gộp của các nghiên cứu quan sát và các thử nghiệm ngẫu nhiên [482,483]. Ba thử nghiệm có cỡ mẫu [479-481] và một thử nghiệm ngẫu nhiên lớn (SEAS, bao gồm 1873 bệnh nhân được điều trị bằng simvastatin 40 mg cộng với ezetimibe 10 mg hoặc giả dược) [266] không cho thấy giảm tiến triển lâm sàng của hẹp động mạch chủ bệnh nhân hẹp van động mạch chủ bẩm sinh nhẹ đến trung bình. Trong một phân tích post hoc của thử nghiệm SEAS, hiệu quả của liệu pháp hạ lipid máu trong việc ngăn chặn sự tiến triển của hẹp động mạch chủ tăng lên theo mức LDL-C cao và vận tốc dòng qua van động mạch chủ thấp trước điều trị (tức là hẹp nhẹ ở thời điểm ban đầu) [484]. Tương tự, một phân tích post hoc của ba RCT, bao gồm cả những bệnh nhân không biết hẹp van động mạch chủ ở thời điểm ban đầu (TNT, IDEAL, SPARCL) cho thấy không có tác động của liệu pháp statin liều cao vs. liều thông thường trên tỷ lệ mắc mới hẹp van động mạch chủ [485]. Ở những bệnh nhân được thay van động mạch chủ qua catheter, liệu pháp statin có liên quan đến cải thiện kết cục trong một nghiên cứu quan sát nhỏ [486].
Xơ cứng van động mạch chủ (vôi hóa các lá van động mạch chủ mà chênh áp xuyên van không đáng kể) có liên quan đến tăng nguy cơ CAD ngay cả khi không có nguy cơ tổng thể cao. Liệu statin có thể hữu ích cho cả bệnh van động mạch chủ và CAD tiến triển ở những bệnh nhân như vậy hay không thì cần phải nghiên cứu thêm [487].
Khuyến cáo về liệu pháp hạ lipid máu ở bệnh nhân HF và bệnh van tim được trình bày dưới đây.
Khuyến cáo về điều trị rối loạn lipid máu trong suy tim mạn tính hoặc bệnh van tim
| Khuyến cáo | Loại | Mức |
| Không khuyến cáo bắt đầu liệu pháp hạ lipid máu ở những bệnh nhân HF trong trường hợp không có chỉ định khác cho việc sử dụng chúng [466,470]. | III | A |
| Không khuyến cáo bắt đầu điều trị hạ lipid máu ở bệnh nhân hẹp van động mạch chủ mà không bị CAD để làm chậm tiến triển hẹp van động mạch chủ trong trường hợp không có chỉ định khác cho việc sử dụng chúng [266,479-481]. | III | A |
CAD = bệnh động mạch vành; HF = suy tim.
9.8 Bệnh thận mạn tính
CKD được định nghĩa là bất thường về cấu trúc hoặc chức năng thận, xuất hiện trong >3 tháng, có ý nghĩa đối với sức khỏe. CKD được phân loại dựa trên nguyên nhân, nhóm GFR và nhóm albumin niệu [488]. Trong dân số trưởng thành, GFR giảm có liên quan đến tăng nguy cơ CVD, độc lập với các yếu tố nguy cơ CV khác [489- 492]. Có sự gia tăng nguy cơ của cả bệnh mạch máu xơ vữa động mạch và bệnh tim cấu trúc [492]. Bệnh nhân CKD và CVD có tỷ lệ tử vong cao hơn nhiều so với bệnh nhân CVD và chức năng thận bình thường [493]. Do đó, bệnh nhân CKD được xem là có nguy cơ cao (giai đoạn 3 CKD) hoặc rất cao (giai đoạn 4-5 CKD hoặc đang lọc máu) của CVD, và không cần sử dụng các mô hình ước tính nguy cơ ở những bệnh nhân này.
9.8.1 Bộ lipoprotein ở bệnh thận mạn tính
Trong giai đoạn đầu của CKD, mức TG là đặc biệt cao và mức HDL-C thấp. Có một sự dịch chuyển sang dư thừa các hạt LDL đậm đặc nhỏ. Các nghiên cứu cho thấy thận có vai trò trong quá trình dị hóa Lp (a) và mức Lp (a) tăng lên có liên quan với bệnh thận. Những bất thường mắc phải như thế có thể được đảo ngược bằng cách ghép thận hoặc làm giảm tình trạng viêm trong thận.
9.8.2 Bằng chứng về giảm nguy cơ thông qua liệu pháp dựa trên statin ở bệnh nhân mắc bệnh thận mạn tính
Trong thử nghiệm Die Deutsche Diabetes Dialyse Studie (4D), bao gồm 1200 bệnh nhân mắc đái tháo đường đang chạy thận nhân tạo, atorvastatin không có tác dụng đáng kể nào trên nguy cơ CVD [220]. Kết quả tương tự đã thu được trong thử nghiệm AURORA bao gồm 2776 bệnh nhân đang chạy thận nhân tạo [221].
Trong nghiên cứu SHARP [222], liệu pháp kết hợp simvastatin và ezetimibe làm giảm nguy cơ mắc các biến cố xơ vữa động mạch chính (tử vong do mạch vành, nhồi máu cơ tim, đột quỵ không xuất huyết hoặc mọi tái thông mạch máu) so với giả dược ở những người mắc CKD giai đoạn 3-5. Thử nghiệm không đủ sức mạnh để đánh giá riêng lẻ các ảnh hưởng đến kết cục chính ở bệnh nhân có và không chạy thận nhân tạo. Mặc dù liệu pháp dựa trên statin rõ ràng có hiệu quả trong CKD từ nhẹ đến trung bình, nhưng một cuộc tranh cãi lớn vẫn còn sau khi công bố các nghiên cứu 4D, AURORA và SHARP, liệu điều trị statin có hiệu quả ở bệnh nhân CKD tiến triển hơn hay không, đặc biệt là bệnh nhân chạy thận nhân tạo. Bằng cách kết hợp dữ liệu từ ba thử nghiệm CKD với các thử nghiệm khác trong cơ sở dữ liệu hiện có, các nghiên cứu viên của CTT nhận thấy rằng, ngay cả sau khi điều chỉnh mức giảm LDL-C nhỏ đạt được ở những bệnh nhân CKD tiến triển và về sự khác biệt trong định nghĩa kết cục giữa các thử nghiệm thận nhân tạo, có xu hướng giảm tương đối nhỏ trên mỗi mmol/L LDL-C giảm đi đối với các biến cố xơ vữa động mạch chính do GFR ước tính (eGFR) giảm (với rất ít bằng chứng về lợi ích ở bệnh nhân chạy thận) [214]. Điều này làm hạn chế sự giảm nguy cơ tương đối khi GFR giảm ngụ ý rằng, ít nhất là ở những bệnh nhân không lọc máu, cần có phác đồ hạ LDL tích cực hơn để đạt được lợi ích tương tự.
9.8.3 An toàn quản lý lipid ở bệnh nhân mắc bệnh thận mạn
Các vấn đề an toàn và điều chỉnh liều là rất quan trọng trong những giai đoạn tiến triển của CKD (giai đoạn 3-5), vì tác dụng phụ thường liên quan đến liều và do nồng độ các hợp chất này trong máu tăng lên. Mặc dù có ý kiến cho rằng nên ưu tiên cho các phác đồ và liều đã được chứng minh là có lợi trong RCT thiết kế chuyên biệt cho những bệnh nhân này [494], nhưng phân tích gộp CTT cho thấy rõ rằng mục tiêu – như ở bệnh nhân không có CKD – nên đạt được mức giảm tuyệt đối LDL-C lớn nhất có thể một cách an toàn. Mặc dù không có mối lo ngại về an toàn cụ thể nào được đưa ra bởi các thử nghiệm 4D, AURORA hoặc SHARP, nhưng statin được chuyển hóa qua CYP3A4 có thể dẫn đến tác dụng phụ do tương tác thuốc-thuốc và cần thận trọng.
Dựa trên bằng chứng về quản lý lipid ở bệnh nhân CKD, tổ chức KDIGO đã xây dựng một hướng dẫn thực hành lâm sàng cập nhật về quản lý lipid ở CKD [494]. Phù hợp với hướng dẫn vừa nêu, nhưng với sự tập trung vào những bệnh nhân có nguy cơ cao hoặc rất cao phát triển CVD, khuyến cáo được tóm tắt dưới đây.
Khuyến cáo về quản lý lipid ở bệnh nhân bệnh thận mạn từ trung bình đến nặng (KDOQI giai đoạn 3-5)
| Khuyến cáo | Loại | Mức |
| Khuyến cáo bệnh nhân CKD KDOQI giai đoạn 3-5c được xem là có nguy cơ cao hoặc rất cao ASCVD [489-493]. | I | A |
| Khuyến cáo sử dụng statin hoặc kết hợp statin/ezetimibe ở bệnh nhân CKD giai đoạn 3-5 không phụ thuộc lọc máu [214,222,495, 496,496]. | I | A |
| Ở những bệnh nhân đã sử dụng statin, ezetimibe hoặc phối hợp statin/ezetimibe tại thời điểm bắt đầu lọc máu, nên xem xét tiếp tục sử dụng các thuốc này, đặc biệt ở những bệnh nhân mắc ASCVD. | IIa | C |
| Ở những bệnh nhân bị CKD phụ thuộc lọc máu, nhưng không ASCVD, không khuyến cáo bắt đầu điều trị statin [220,221]. | III | A |
ASCVD = bệnh tim mạch xơ vữa động mạch; CKD = bệnh thận mạn tính; eGFR = độ lọc cầu thận ước tính.
c Được định nghĩa là eGFR <60mL/phút/1.73m2 qua hai lần đo cách nhau hơn 3 tháng.
9.9 Cấy ghép cơ quan
Rối loạn lipid máu rất phổ biến ở những bệnh nhân đã được cấy ghép tế bào gốc tạo máu alen lặn, tim, phổi, thận, và khiến những bệnh nhân này tăng nguy cơ phát triển ASCVD và bệnh lý mạch máu động mạch tạng ghép. Bệnh nhân CKD được ghép thận, nguy cơ ASCVD có thể được xác định, ít nhất là một phần, bởi nguy cơ gia tăng do chính CKD.
Liệu pháp thuốc ức chế miễn dịch có thể có tác dụng phụ đối với chuyển hóa lipid dẫn đến tăng TC, VLDL và TG, và về kích thước và mật độ của các hạt LDL. Những tác dụng này là khác nhau giữa thuốc ức chế miễn dịch [497,498,502-506].
Việc kiểm soát rối loạn lipid máu ở người nhận cơ quan ghép có thể tương tự với những gì được khuyến cáo cho bệnh nhân có nguy cơ ASCVD cao hoặc rất cao, mặc dù cần chú ý nhiều hơn về nguyên nhân gây rối loạn lipid và tác dụng phụ có thể xảy ra do tương tác thuốc-thuốc (xem Khuyến cáo về lipoprotein mật độ thấp ở bệnh nhân ghép tạng đặc dưới đây).
Khuyến cáo về hạ lipoprotein mật độ thấp ở bệnh nhân ghép tạng đặc
| Khuyến cáo | Loại | Mức |
| Statin nên được xem xét như là thuốc đầu tay ở bệnh nhân ghép tạng. Nên bắt đầu ở liều thấp rồi tăng liều cẩn thận và thận trọng về khả năng tương tác thuốc-thuốc, đặc biệt đối với bệnh nhân dùng ciclosporin [507]. | IIa | B |
| Ở những bệnh nhân không dung nạp statin hoặc những người bị rối loạn lipid máu đáng kể mặc dù điều trị statin dung nạp tối đa, có thể xem xét liệu pháp thay thế hoặc bổ sung bằng ezetimibe. | IIb | C |
Hiệu quả lâm sàng của statin ở bệnh nhân ghép thận là không chắc chắn do thiếu các thử nghiệm ngẫu nhiên trong dân số này. Một tổng quan hệ thống về lợi ích và tác hại của statin ở bệnh nhân ghép thận chức năng bao gồm 3465 bệnh nhân, không CHD, từ 22 nghiên cứu. Mặc dù các tác giả kết luận rằng statin có thể làm giảm các biến cố CV, nhưng họ cũng cho rằng cần phải nghiên cứu thêm [253]. Tuy nhiên, ở những bệnh nhân ghép thận chức năng tăng bị nguy cơ CVD, điều đó có thể là phù hợp khi ngoại suy từ các bằng chứng rõ ràng về lợi ích từ liệu pháp statin, mà không cần lo ngại về an toàn, ở những người có mức GFR giảm vừa phải [214].
Một số tương tác thuốc tiềm năng cũng phải được xem xét, đặc biệt là với ciclosporin, được chuyển hóa qua CYP3A4, và có thể làm tăng tiếp xúc statin toàn thân và nguy cơ gây bệnh lý cơ. Ciclosporin làm tăng nồng độ tất cả các statin trong máu.
Fluvastatin, pravastatin, pitavastatin và rosuvastatin đều được chuyển hóa qua nhiều loại enzyme CYP khác nhau so với các loại statin khác và ít có khả năng tương tác [507].
Tacrolimus cũng được chuyển hóa bởi CYP3A4, nhưng dường như khả năng tương tác có hại với statin ít hơn ciclosporin. Các loại thuốc khác ảnh hưởng đến hoạt động CYP3A4 nên tránh nếu có thể, và được sử dụng hết sức thận trọng ở những bệnh nhân có dùng thuốc ức chế calcineurin và statin.
Đối với bệnh nhân ghép tạng bị rối loạn lipid máu, ezetimibe có thể được xem là một biện pháp thay thế cho những bệnh nhân không thể dùng statin hoặc thêm vào liều statin dung nạp cao nhất [507-509]. Không có dữ liệu kết cục nào cho ezetimibe, thường được sử dụng như là thuốc thứ hai. Ciclosporin có thể làm tăng 2-12 lần nồng độ ezetimibe.
Cần phải cẩn thận khi sử dụng fibrate, vì chúng có thể làm giảm nồng độ ciclosporin và có khả năng gây ra bệnh lý cơ. Cần hết sức thận trọng nếu liệu pháp fibrate được lên kế hoạch kết hợp với statin. Cholestyramine không hiệu quả như là một đơn trị liệu ở bệnh nhân ghép tim và có khả năng làm giảm sự hấp thu thuốc ức chế miễn dịch; khả năng này được giảm thiểu bằng cách sử dụng thuốc riêng biệt.
9.10 Bệnh động mạch ngoại biên
PAD gồm tất cả các vị trí mạch máu, như động mạch cảnh, đốt sống, chi trên, mạc treo, thận và chi dưới. Động mạch chủ thường được bao gồm trong thuật ngữ này [510]. PAD là biểu hiện thường gặp của chứng xơ vữa động mạch và những bệnh nhân này có nguy cơ cao mắc các biến cố mạch vành, đồng thời PAD đại diện cho một yếu tố nguy cơ độc lập đối với MI và tử vong CV [510,511]. Bệnh nhân mắc PAD có nguy cơ rất cao và nên được quản lý theo các khuyến cáo trong Bảng 7. Nguy cơ CV tăng cao đã dẫn đến việc đưa PAD vào danh sách các tình trạng ‘tương đương nguy cơ’ và các chiến lược điều trị dự phòng thứ phát nên được thực hiện [xem Khuyến cáo về thuốc hạ lipid ở những bệnh nhân bị bệnh động mạch ngoại biên (bao gồm bệnh động mạch cảnh) bên dưới]. Tuy nhiên, mặc dù nguy cơ mắc bệnh và tử vong CV cao, những bệnh nhân PAD thường được quản lý không đầy đủ so với bệnh nhân CAD [511].
9.10.1 Bệnh động mạch chi dưới
ABI thấp (0.90) là chẩn đoán cho bệnh động mạch chi dưới (LEAD). ABI Thấp (0.90) hoặc cao (1.40, do các động mạch bị xơ cứng) là dự đoán về tỷ lệ mắc bệnh và tử vong CV. Giảm LDL-C làm giảm nguy cơ biến cố CV thiếu máu cục bộ và làm giảm tiến triển xấu của tình trạng khập khiễng, đồng thời cũng cải thiện hiệu suất đi bộ. Đối với các biến cố tim, một tổng quan hệ thống của 18 thử nghiệm bao gồm 10,000 bệnh nhân, với mức cholesterol từ bình thường đến cao, báo cáo rằng liệu pháp hạ lipid ở những người bị ảnh hưởng bởi chứng xơ vữa động mạch chi dưới có liên quan đến giảm 20% tổng biến cố CV, cùng với việc giảm không có ý nghĩa 14% tử vong do mọi nguyên nhân [512]. Trong nghiên cứu Heart Protection Study, nhu cầu tái thông mạch máu (không phải mạch vành) giảm 16% với liệu pháp statin [513].
Ngoài statin, thuốc ức chế PSCK9 cũng đã được chứng minh là làm giảm các biến cố CV ở bệnh nhân PAD. Trong một phân tích dưới nhóm được chỉ định trước của thử nghiệm FOURIER, evolocumab làm giảm đáng kể kết cục chính ở bệnh nhân PAD [514]. PAD có mức giảm nguy cơ tuyệt đối lớn hơn đối với kết cục chính (3.5% nếu có PAD và 1.6% nếu không có PAD ). Evolocumab cũng làm giảm 42% nguy cơ biến cố chi bất lợi chính ở những bệnh nhân, với các tác dụng đồng nhất trên những người biết và không biết PAD. Trong thử nghiệm FIELD, fenofibrate làm giảm nguy cơ cắt cụt, đặc biệt là cắt cụt ít ở những người không biết bệnh mạch máu lớn, có thể thông qua các cơ chế không lipid [515].
9.10.2 Bệnh động mạch cảnh
Mặc dù hiện tại không có nghiên cứu ngẫu nhiên nào đánh giá liệu điều trị hạ lipid máu có làm giảm tỷ lệ mắc mới biến cố CV ở bệnh nhân có nền bệnh xơ vữa động mạch cảnh và không biến cố CV trước đó hay không, nhưng liệu pháp hạ lipid máu đã làm giảm đột quỵ trong nhiều nghiên cứu. Trong một phân tích gộp các RCT với > 90,000 bệnh nhân, liệu pháp statin đã giúp giảm 21% tỷ lệ mắc mới tất cả các cơn đột quỵ ở các dân số khác nhau; tác dụng này là chủ yếu được thúc đẩy bởi mức độ giảm LDL-C [460].
9.10.3 Bệnh mạch máu võng mạc
Thay đổi xơ vữa động mạch của động mạch võng mạc tương quan với mức TC, LDL-C, TG và apoB và cũng tương quan với CAD [516]. Fenofibrate làm giảm sự tiến triển của bệnh võng mạc do đái tháo đường [517,518].
9.10.4 Dự phòng thứ phát ở bệnh nhân phình động mạch chủ bụng
Sự hiện diện của phình động mạch chủ bụng cho thấy tình trạng ‘tương đương nguy cơ’ đối với CAD và liên quan đến tuổi tác, nam giới, tiền sử cá nhân bị CVD xơ vữa động mạch, hút thuốc, tăng huyết áp và rối loạn lipid máu [519]. Ngược lại, bệnh nhân đái tháo đường có nguy cơ giảm.
Hiện tại không có thử nghiệm lâm sàng nào về việc làm giảm nguy cơ CV bằng liệu pháp hạ lipid máu ở những bệnh nhân bị ảnh hưởng bởi tình trạng này. Các tổng quan hệ thống [520], chủ yếu dựa trên các nghiên cứu không ngẫu nhiên hồi cứu, đã báo cáo rằng vẫn còn bằng chứng không thuyết phục về liệu pháp statin làm giảm tỷ lệ mắc và tử vong CV quanh phẫu thuật. Trong một RCT so sánh atorvastatin 20 mg với giả dược, kết cục tổng hợp của tử vong do tim, nhồi máu cơ tim và đau thắt ngực không ổn định giảm đáng kể ở 100 bệnh nhân được phẫu thuật mạch máu không phải tim, bao gồm sửa chữa phình động mạch chủ bụng [521]. Trong một thử nghiệm đối chứng-giả dược mù đôi khác ở 497 bệnh nhân được phẫu thuật mạch máu, liệu pháp fluvastatin quanh phẫu thuật (80 mg/ngày) làm cải thiện kết cục tim sau phẫu thuật [522].
9.10.5 Xơ vữa động mạch mạch máu thận
Điều trị hạ lipid chưa bao giờ được đánh giá trong RCT ở những bệnh nhân bị ảnh hưởng bởi xơ vữa động mạch thận; tuy nhiên, một nghiên cứu dựa trên dân số không ngẫu nhiên gần đây cho thấy ở những bệnh nhân trên 65 tuổi bị bệnh mạch máu thận xơ vữa đã đưa ra giả thuyết rằng việc điều trị như thế có thể mang lại lợi ích tim- thận; nguy cơ của một kết cục tổng hợp tim-thận chính (MI, đột quỵ, HF, suy thận cấp, lọc máu và tử vong) ở người sử dụng statin thấp hơn đáng kể so với người không sử dụng [523].
Khuyến cáo về thuốc hạ lipid ở bệnh nhân mắc bệnh động mạch ngoại biên (bao gồm bệnh động mạch cảnh)
| Khuyến cáo | Loại | Mức |
| Ở những bệnh nhân PAD, liệu pháp hạ lipid máu, bao gồm liều statin dung nạp tối đa, cộng với ezetimibe hoặc kết hợp với thuốc ức chế PCSK9 nếu cần, được khuyến cáo để làm giảm nguy cơ biến cố ASCVD [512,524]. | I | A |
ASCVD = bệnh tim mạch xơ vữa động mạch; PAD = bệnh động mạch ngoại biên; PCSK9 = proprotein convertase subtilisin/kexin loại 9.
9.11 Các dân số đặc biệt khác có nguy cơ mắc bệnh tim mạch xơ vữa động mạch
Nhìn chung, ảnh hưởng của việc hạ LDL-C được quyết định bởi nguy cơ tuyệt đối ASCVD và mức giảm LDL-C đã đạt được, vì vậy điều quan trọng là phải xác định và điều trị tất cả những người bị tăng nguy cơ ASCVD. Có một vài nhóm bệnh nhân cụ thể trong số những người có bệnh lý tiềm ẩn bị tăng nguy cơ như vậy, và thêm vào đó, ở những người mà điều trị tiêu chuẩn có thể tự gây ra rối loạn lipid máu thì có thể góp phần vào nguy cơ ASCVD. Chúng bao gồm: (i) bệnh lý có tình trạng viêm qua trung gian miễn dịch mạn tính, (ii) bệnh nhân bị nhiễm virus suy giảm miễn dịch ở người (HIV) và (iii) bệnh nhân mắc bệnh tâm thần nặng. Các nguyên tắc quản lý là giống nhau trong các nhóm bệnh nhân này, nhưng quản lý của họ có thể cần giải quyết các vấn đề cụ thể liên quan đến chứng rối loạn lipid máu của từng các nhân và an toàn thuốc. Chi tiết được cung cấp trong tài liệu Dữ liệu bổ sung.
10.Tình trạng viêm
Những tiến bộ gần đây trong khoa học cơ bản đã thiết lập vai trò nền tảng của tình trạng viêm mạn tính làm trung gian ở tất cả các giai đoạn xơ vữa động mạch, từ khởi đầu cho đến tiến triển và cuối cùng là vỡ mảng bám rồi đến biến chứng huyết khối do xơ vữa động mạch. Các tương tác giữa tế bào và phân tử có liên quan trong quá trình tạo xơ vữa, về cơ bản không khác biệt so với các bệnh lý có tình trạng viêm mạn tính – các bệnh lý tăng sinh sợi, chẳng hạn như viêm khớp dạng thấp (RA), xơ cứng cầu thận, hoặc xơ hóa phổi [525]. Hầu hết tất cả các loại tế bào của hệ thống viêm – miễn dịch, như đại thực bào, và tế bào T và B, cũng như nhiều cytokine và chemokine tiền viêm và kháng viêm, đã được xác định trong quá trình xơ vữa động mạch [526].
Điều thú vị là sự tích tụ cholesterol trong các tế bào kích hoạt phản ứng viêm và dẫn đến việc sản xuất các chất trung gian gây viêm như interleukin (IL)-1β. Nhiều nghiên cứu trên động vật, sử dụng mô hình loại bỏ gen mục tiêu (knockout model), đã chứng minh rằng tình trạng viêm và hệ thống miễn dịch, cả hai đều đóng vai trò quan trọng trong quá trình tạo xơ vữa [527].
Trong quá trình viêm, một số lượng lớn protein giai đoạn cấp đã được xác định, và một số nghiên cứu lâm sàng đã báo cáo protein phản ứng C [528] là dấu hiệu viêm huyết thanh hữu ích nhất, mặc dù nó có tính đặc hiệu kém đối với bất kỳ quá trình viêm cụ thể nào, bao gồm cả xơ vữa động mạch. Xét nghiệm chẩn đoán protein phản ứng C độ nhạy cao đã được phát triển để phát hiện nồng độ rất thấp của protein phản ứng C, và do đó cho phép đánh giá tình trạng viêm mạn tính đầy đủ và chính xác hơn so với protein phản ứng C tiêu chuẩn [529]. Công cụ chẩn đoán này chỉ khác ở phạm vi nồng độ protein phản ứng C mà nó có thể phát hiện. Một số nghiên cứu thấy rằng tăng nồng độ protein phản ứng C độ nhạy cao trong máu có liên quan đến việc tăng nguy cơ biến cố CV và có thể được sử dụng để dự đoán kết cục lâm sàng độc lập với nồng độ cholesterol [530,531]. Các nghiên cứu khác không thể cho thấy bất kỳ mối quan hệ nào giữa tình trạng viêm mãn tính ở mức độ thấp, được biểu thị bằng nồng độ protein phản ứng C độ nhạy cao và tăng nguy cơ CV [532- 535]. Cuối cùng, các nghiên cứu di truyền của đoàn hệ dân số lớn đã không chứng minh rằng tăng mạn tính protein phản ứng C độ nhạy cao làm tăng nguy cơ biến cố xơ vữa động mạch [536]. Tuy nhiên, trong một số hướng dẫn, protein phản ứng C độ nhạy cao đã được thêm vào các yếu tố nguy cơ truyền thống đối với thông tin tiên lượng, đặc biệt đối với bệnh nhân có nguy cơ trung gian [537,538].
Statin đã được chứng minh là làm giảm bài tiết protein phản ứng C từ tế bào gan [539], và một loạt các thử nghiệm lâm sàng và phân tích post hoc nhận thấy rằng kết cục có lợi sau liệu pháp statin liên quan đến việc giảm nồng độ cholesterol và giảm viêm [540-544]. Thử nghiệm JUPITER [542] đã chứng minh rằng trong dự phòng tiên phát cho những người có protein phản ứng C tăng cao mạn tính (>2 mg/L), điều trị statin làm giảm rõ rệt các biến cố CV [545]. Lưu ý rằng các chất hạ lipid khác, chẳng hạn như ezetimibe và gần đây là mAb kháng PCSK9, không ảnh hưởng đến nồng độ protein phản ứng C độ nhạy cao [546,547] nhưng dẫn đến giảm đáng kể các biến cố CV khi thêm vào liệu pháp statin.
Điều trị kháng viêm chuyên biệt đã được đánh giá trong thử nghiệm CANTOS [548]. Ở bệnh nhân bị MI trước đó và nồng độ protein phản ứng C độ nhạy cao tăng mạn tính, tất cả đều được điều trị nội khoa tối ưu, bao gồm statin, thuốc kháng IL- 1β mAb canakinumab phụ thuộc liều đã làm giảm protein phản ứng C độ nhạy cao và làm giảm đáng kể tỷ lệ các biến cố CV tái phát so với giả dược, độc lập với mức độ hạ lipid máu. Không có gì đáng ngạc nhiên, có một sự gia tăng nhẹ về nguy cơ nhiễm trùng nặng và gây tử vong liên quan đến canakinumab. Nghiên cứu này là nghiên cứu đầu tiên nêu bật mối tương quan dương giữa protein phản ứng C độ nhạy cao và các biến cố CV, trong đó việc làm giảm được giá trị protein phản ứng C độ nhạy cao tương quan trực tiếp với làm giảm nguy cơ các biến cố CV trong tương lai [548]. Tuy nhiên, FDA đã từ chối phê duyệt canakinumab cho giảm nguy cơ CV theo độ mạnh của dữ liệu từ nghiên cứu CANTOS. Vì canakinumab chưa được đánh giá chống lại kháng PCSK9 mAb và/hoặc ezetimibe được thêm vào liệu pháp statin, câu hỏi về nguy cơ tồn dư vẫn còn đối với bệnh nhân bị tăng protein phản ứng C độ nhạy cao mặc dù đạt được LDL-C rất thấp (dưới mục tiêu) và liệu bệnh nhân có LDL-C rất thấp sẽ được hưởng lợi từ điều trị chống IL-1β hoặc các chất kháng viêm khác. Ngoài ra, tất cả khuyến cáo về thuốc hạ lipid hiện nay bao gồm mAb kháng PCSK9, đã chứng minh tác dụng có lợi đối với thành phần mảng xơ vữa động mạch cũng như làm giảm thể tích mảng xơ vữa; những kết quả như vậy vẫn còn thiếu vắng điều trị chống viêm. Một phương pháp chống viêm khác là sử dụng methotrexate đã được đánh giá trong thử nghiệm CIRT [549]. Methotrexate liều rất thấp (10 mg mỗi tuần), một phác đồ kháng viêm đã chứng minh làm giảm yếu tố hoại tử khối u (TNF), IL-6, và nồng độ protein phản ứng C và được sử dụng rộng rãi trong điều trị RA, được phân ngẫu nhiên vs. giả dược cho 7000 bệnh nhân CAD ổn định. Nghiên cứu này đã bị dừng sớm do vô ích. Điều thú vị là phác đồ methotrexate này không có tác dụng đối với nồng độ IL-6 hay protein phản ứng C độ nhạy cao trong dân số này, điều này có thể giải thích kết quả trung tính của thử nghiệm [550]. Dựa trên mức độ bằng chứng hiện tại, không thể đưa ra khuyến cáo thêm về việc sử dụng các chất kháng viêm [551].
11.Theo dõi lipid và enzyme ở bệnh nhân đang điều trị hạ lipid máu
Bằng chứng về những xét nghiệm nào nên được thực hiện để theo dõi lipid ở bệnh nhân đang điều trị còn hạn chế. Bằng chứng để thực hiện các xét nghiệm về độc tính có thể, chẳng hạn như ALT và CK, cũng gặp hạn chế tương tự. Khuyến cáo xuất phát từ sự đồng thuận chứ không phải y học chứng cứ.
Đáp ứng với liệu pháp có thể được đánh giá sau 6-8 tuần kể từ khi bắt đầu điều trị, nhưng đáp ứng với lối sống có thể mất nhiều thời gian hơn. Thực hành tiêu chuẩn cho theo dõi tiếp theo là 6-12 tháng, nhưng các khoảng thời gian theo dõi như vậy là tùy hoàn cảnh. Tối thiểu, LDL-C nên được đánh giá bất cứ khi nào có thể, nhưng các quyết định quản lý tốt hơn có thể sẽ xảy ra nếu một bộ lipid đầy đủ được thực hiện, bao gồm HDL-C và TG. Non-HDL-C hoặc ApoB cũng nên được phân tích và sử dụng làm mục tiêu điều trị thứ hai. Một vấn đề khác là tác động của việc theo dõi lipid thường xuyên lên việc thúc đẩy sự tuân thủ của bệnh nhân đối với thay đổi lối sống hoặc phác đồ thuốc, có tác động tích cực đến sức khỏe của họ, như được tìm thấy trong một loạt các nghiên cứu. Không rõ liệu chỉ có quá trình theo dõi là rất quan trọng trong việc đạt được điều này hay liệu một sự kết hợp giữa giáo dục, liên lạc thường xuyên và đánh giá tuân thủ là cần thiết.
Khi áp dụng liệu pháp hạ lipid bằng thuốc, nên thực hiện các xét nghiệm máu về tính an toàn, bao gồm ALT và CK ở thời điểm bắt đầu, để xác định số bệnh nhân bị giới hạn vì chống chỉ định điều trị. Cần kiểm tra CK ở những bệnh nhân có nguy cơ cao mắc bệnh lý cơ, chẳng hạn như người già có bệnh đồng mắc, bệnh nhân có tiền sử triệu chứng cơ hoặc bệnh nhân dùng thuốc tương tác. ALT tăng nhẹ và thường thoáng qua được thấy ở khoảng 2% bệnh nhân và bình thường hóa được nhìn thấy khi tiếp tục điều trị [240,244,552]. Các tổng quan gần đây rất đáng khích lệ về sự an toàn của liệu pháp statin lâu dài và tổn thương gan do statin được báo cáo là rất không thường gặp [243,244,553-555]. ALT được khuyến cáo trước khi bắt đầu liệu pháp statin; kiểm soát thường quy ALT trong khi điều trị không được khuyến cáo nhưng nên được thực hiện, nếu có chỉ định, dựa trên quan sát lâm sàng. Trong quá trình điều trị fibrate, việc kiểm soát ALT thường xuyên vẫn được khuyến cáo. Ở những bệnh nhân có các xét nghiệm chức năng gan tăng lên trên ba lần ULN, cần tìm nguyên nhân như uống rượu bia hoặc NAFLD, và theo dõi nồng độ. Nếu nồng độ vẫn cao thì nên ngừng liệu pháp hạ lipid máu, nhưng có thể được khởi đầu lại một cách thận trọng dưới sự theo dõi chặt chẽ sau khi ALT đã trở lại bình thường.
Không có giá trị tiên đoán của xét nghiệm CK lặp lại thường quy đối với tiêu cơ vân vì nồng độ có thể tăng do nhiều lý do, bao gồm tổn thương cơ hoặc tập thể dục cơ quá mức. Tuy nhiên, CK phải được đánh giá ngay lập tức ở những bệnh nhân bị đau và yếu cơ, đặc biệt ở người cao tuổi và dừng điều trị nếu CK tăng lên >10 lần trên ULN. Các chiến lược để xử lý CK cao được đưa ra trong Bảng 13.
Do tần suất DM tăng trong quá trình điều trị statin [247,249,556,557], nên xem xét kiểm tra thường xuyên HbA1c ở bệnh nhân có nguy cơ cao phát triển DM và đang điều trị statin liều cao. Các nhóm được xem xét để kiểm soát glucose là người lớn tuổi hoặc những người bị MetS, béo phì hoặc có dấu hiệu kháng insulin.
Bảng 13. Tóm tắt các khuyến cáo về theo dõi lipid và enzyme ở bệnh nhân, trước và trong điều trị hạ lipid máu
| Xét nghiệm lipid |
| Bao lâu thì nên xét nghiệm lipid?
• Trước khi bắt đầu điều trị thuốc hạ lipid máu, ít nhất phải thực hiện hai xét nghiệm, trong khoảng thời gian 1-12 tuần, ngoại trừ các tình trạng được đề nghị điều trị thuốc kịp thời, như ACS và bệnh nhân có nguy cơ rất cao. Bao lâu thì nên xét nghiệm lipid của bệnh nhân sau khi bắt đầu điều trị hạ lipid máu? • Sau khi bắt đầu điều trị: 8 (± 4) tuần. • Sau khi điều chỉnh điều trị: 8 (± 4) tuần cho đến khi đạt được mục tiêu. Bao lâu thì nên xét nghiệm lipid một khi bệnh nhân đã đạt được mức lipid mục tiêu hoặc tối ưu? • Hàng năm (trừ khi có vấn đề tuân thủ hoặc lý do cụ thể khác để đánh giá thường xuyên hơn). |
| Theo dõi enzyme gan và cơ |
| Bao lâu thì nên xét nghiệm enzyme gan (ALT) thường xuyên ở bệnh nhân dùng thuốc hạ lipid máu?
• Trước khi điều trị. • Một lần, 8-12 tuần sau khi bắt đầu điều trị thuốc hoặc sau khi tăng liều. • Việc kiểm soát ALT thường quy sau đó không được khuyến cáo trong quá trình điều trị statin, trừ khi các triệu chứng gợi ý bệnh gan tiến triển. Trong quá trình điều trị fibrate, kiểm soát ALT vẫn được khuyến cáo. Điều gì xảy ra nếu enzyme gan tăng cao ở người dùng thuốc hạ lipid máu? Nếu ALT <3 ULN: • Tiếp tục liệu pháp. • Kiểm tra lại men gan sau 4-6 tuần. Nếu ALT tăng lên ≥3 ULN: • Ngừng liệu pháp hạ lipid máu hoặc giảm liều và kiểm tra lại men gan trong vòng 4-6 tuần. • Việc sử dụng lại liệu pháp một cách thận trọng có thể được xem xét sau khi ALT trở lại bình thường. • Nếu ALT vẫn tăng, kiểm tra các nguyên nhân khác. Bao lâu thì nên xét nghiệm CK ở bệnh nhân dùng thuốc hạ lipid máu? Điều trị trước • Trước khi bắt đầu liệu pháp. • Nếu CK ban đầu >4 ULN, không bắt đầu điều trị thuốc; kiểm tra lại. Theo dõi: • Không cần theo dõi thường quy CK. • Kiểm tra CK nếu bệnh nhân bị đau cơ. Cảnh giác về bệnh cơ và tăng CK ở bệnh nhân có nguy cơ, chẳng hạn như: bệnh nhân cao tuổi, những người đang điều trị can thiệp đồng thời, uống nhiều loại thuốc, bệnh gan hoặc thận, hoặc vận động viên. Điều gì xảy ra nếu CK tăng cao ở người đang dùng thuốc hạ lipid máu? Đánh giá lại chỉ định điều trị statin. Nếu ≥4 ULN: • Nếu CK >10 ULN: ngừng điều trị, kiểm tra chức năng thận và theo dõi CK mỗi 2 tuần. • Nếu CK <10 ULN: nếu không có triệu chứng, tiếp tục liệu pháp hạ lipid máu và vẫn theo dõi CK trong khoảng từ 2 đến 6 tuần. • Nếu CK <10 ULN: nếu có triệu chứng, ngừng statin và theo dõi quá trình bình thường hóa của CK, trước khi khởi đầu lại với liều statin thấp hơn. • Xem xét khả năng tăng CK thoáng qua vì những lý do khác như gắng sức. • Xem xét bệnh cơ nếu CK vẫn tăng. • Xem xét liệu pháp kết hợp hoặc dùng thuốc thay thế. Nếu <4 ULN: • Nếu không có triệu chứng cơ, tiếp tục dùng statin (bệnh nhân cần được cảnh báo để báo cáo các triệu chứng; kiểm tra CK). • Nếu có triệu chứng cơ, theo dõi triệu chứng và CK thường xuyên. • Nếu các triệu chứng kéo dài, ngừng statin và đánh giá lại các triệu chứng sau 6 tuần; đánh giá lại chỉ định điều trị statin. • Xem xét khởi đầu lại với cùng loại hoặc một loại statin khác. • Xem xét statin liều thấp, phác đồ liều thay thế mỗi ngày hoặc một lần/hai lần mỗi tuần hoặc liệu pháp kết hợp. Để biết chi tiết về tăng CK và điều trị các triệu chứng cơ trong quá trình điều trị statin, xem lưu đồ trong Hình 4 Phần bổ sung. Những bệnh nhân nào nên được kiểm tra HbA1c máu hoặc glucose máu? • Nên xem xét kiểm tra thường xuyên HbA1c hoặc glucose ở những bệnh nhân có nguy cơ cao phát triển đái tháo đường và những người đang điều trị statin liều cao. • Các nhóm được xem xét để kiểm soát glucose là người lớn tuổi và bệnh nhân mắc hội chứng chuyển hóa, béo phì hoặc các dấu hiệu khác của kháng insulin. |
ACS = hội chứng mạch vành cấp; ALT = alanine aminotransferase; CK = creatine kinase; ULN = giới hạn trên khoảng bình thường.
12.Hiệu quả chi phí phòng ngừa bệnh tim mạch bằng cách điều chỉnh lipid
Trong năm 2015, có >85 triệu người ở Châu Âu sống với CVD [558,559]. Dân số già [559], chế độ ăn uống không lành mạnh, hút thuốc, lối sống ít vận động, tăng béo phì và đái tháo đường [560-563] là những yếu tố đóng góp chính. CVD tiêu tốn của Liên minh Châu Âu khoảng 210 tỷ USD vào năm 2015, một nửa trong số đó là chi phí chăm sóc sức khỏe (8% tổng chi phí chăm sóc sức khỏe), và nửa còn lại là tổn thất sản suất và chăm sóc không chính thức [558]. Trong Hướng dẫn này, Nhóm chuyên trách chung khuyến cáo một loạt các hành động để làm giảm CVD bằng cách nhắm mục tiêu lipid huyết tương, từ việc khởi xướng mọi người để thúc đẩy lối sống lành mạnh đến các can thiệp ở cấp độ cá thể để giảm các yếu tố nguy cơ CVD, như chế độ ăn uống không lành mạnh và nồng độ lipid cao. Phân tích hiệu quả chi phí có thể giúp nhắm mục tiêu nguồn lực cho các can thiệp trong đó mức độ tăng sức khỏe ròng là lớn nhất dựa vào nguồn lực có sẵn, và ngày càng được yêu cầu trên khắp Châu Âu [564]. Tuy nhiên, hiệu quả chi phí phụ thuộc vào nguồn lực sẵn có, chi phí dịch vụ, nguy cơ mắc bệnh trong dân số, và kết quả thu được ở một quốc gia có thể không tương tự ở quốc gia khác [565]. Ngoài ra, để nắm bắt đầy đủ những ảnh hưởng lâu dài của can thiệp, các nghiên cứu về hiệu quả chi phí kết hợp bằng chứng từ RCT với mô hình hóa và sự hạn chế đều có thể ảnh hưởng đến độ tin cậy của các phát hiện. Ở đây, bằng chứng về hiệu quả chi phí của các can thiệp dự phòng ASCVD liên quan đến điều chỉnh lipid được tóm tắt; xem xét kỹ lưỡng hơn trong hoàn cảnh địa phương được khuyến cáo. Kim tự tháp ảnh hưởng sức khỏe tóm tắt bằng chứng về nỗ lực tương đối liên quan đến tác động sức khỏe (Hình 5), với các can thiệp với tác động rộng nhất đến dân số ở dưới đáy và các can thiệp đòi hỏi nỗ lực cá nhân đáng kể ở trên đỉnh [566]. Có sự đồng thuận rằng tất cả các cấp độ của kim tự tháp nên được nhắm mục tiêu nhưng cần nhấn mạnh ở các cấp độ thấp hơn. Điều này sẽ giải quyết sự phân chia kinh tế xã hội dai dẳng về sức khỏe CV mặc dù có những cải thiện lớn trong điều trị ASCVD [558].

Hơn một nửa mức giảm tỷ lệ tử vong CV trong ba thập kỷ qua được cho là do những thay đổi ở cấp độ quần thể về các yếu tố nguy cơ tim mạch, chủ yếu là giảm cholesterol huyết thanh, mức huyết áp, và hút thuốc lá [560-563,567]. Thay đổi lối sống ở cấp độ quần thể có có hiệu quả chi phí hơn so với can thiệp lối sống và thuốc ở cấp độ cá thể, đặc biệt là khi nhắm mục tiêu đến dân số có nguy cơ cao. Nhận thức và kiến thức về cách mà các yếu tố nguy cơ lối sống gây ra CVD đã tăng lên trong những thập kỷ gần đây. Hơn nữa, pháp luật thúc đẩy một lối sống lành mạnh, chẳng hạn như ăn giảm lượng muối và cấm hút thuốc lá, đã được báo cáo là có chi phí hiệu quả trong việc ngăn ngừa CVD [568-573], việc cải thiện cơ sở hạ tầng và thúc đẩy hoạt động thể chất đã cho thấy đầy hứa hẹn [574,575]. Kết hợp một chiến lược cấu trúc ở cấp quốc tế, quốc gia và khu vực có thể làm giảm đáng kể tỷ lệ mắc bệnh và tử vong CVD [576,577]. Can thiệp ở cấp độ cá thể để cải thiện chế độ ăn uống [578,579], tăng hoạt động thể chất [580] và ngừng hút thuốc lá [581] cũng có thể có hiệu quả chi phí [582]. Tuy nhiên, việc tuân thủ dưới mức tối ưu làm hạn chế lợi ích [583,584] và các biện pháp can thiệp để cải thiện sự tuân thủ, như nhắc nhở bằng thiết bị điện tử để khôi phục các hành vi có lợi cho sức khỏe, đang ngày càng được nghiên cứu [585].
Tất cả các phác đồ statin và ezetimibe hiện đang có sẵn trên khắp Châu Âu. Có bằng chứng mạnh mẽ cho thấy việc hạ mức cholesterol máu bằng cách sử dụng statin chi phí thấp có hiệu quả chi phí sâu rộng [586-590] ở nhiều phân nhóm bệnh nhân. Để phòng ngừa thứ phát CVD, bằng chứng cho thấy điều trị statin có hiệu quả cao về chi phí [586,590,591], và thêm ezetimibe chi phí thấp vào liệu pháp statin cường độ cao giúp giảm LDL-C và nguy cơ CVD có hiệu quả thêm nữa về chi phí [592]. Trong dự phòng tiên phát ASCVD, bằng chứng chỉ ra rằng điều trị dựa trên statin generic rất hiệu quả chi phí cho những người tối thiểu giảm xuống tới 1% tổng nguy cơ CVD hàng năm và có thể có hiệu quả chi phí thậm chí ở mức nguy cơ thấp hơn [589], với liều statin dung nạp tối đa cao nhất dường như có hiệu quả chi phí nhất [591,593,594]. Điều quan trọng là, nhiều bệnh nhân đang điều trị statin không dùng thuốc đầy đủ và/hoặc không đạt được các mục tiêu điều trị của họ [595], có các hậu quả lâm sàng và kinh tế [596,597]. Các biện pháp tăng cường nhằm cải thiện việc tuân thủ điều trị cũng có hiệu quả chi phí [598-600].
Các nghiên cứu đã chỉ ra rằng vào giữa năm 2018, giá của thuốc ức chế PCSK9 phần lớn không hiệu quả chi phí [601-604]. Hiệu quả chi phí của chúng được cải thiện ở những bệnh nhân có nguy cơ cao được chọn lọc, chẳng hạn như những người mắc CVD trên lâm sàng hoặc FH, bệnh đồng mắc khác và mức LDL-C cao [605,606]. Tuy nhiên, khi giá thấp hơn, thuốc ức chế PCSK9 sẽ trở nên hiệu quả về mặt chi phí trong phạm vi rộng hơn của bệnh nhân có nguy cơ cao; do đó, việc giảm giá gần đây có thể dẫn đến tăng sử dụng [607]. Bằng chứng về hiệu quả chi phí đối với các liệu pháp điều chỉnh lipid khác hiện còn thiếu.
Các biện pháp can thiệp hiệu quả để ngăn ngừa ASCVD, bao gồm statin, thường biểu hiện giảm nguy cơ tương đối tương tự giữa các phân nhóm bệnh nhân, bao gồm giảm nguy cơ ASCVD; vì vậy, lợi ích sức khỏe và hiệu quả chi phí lớn hơn ở những người có nguy cơ ASCVD cao hơn (Hình 6) [36,233]. Do đó, tăng cường nỗ lực và can thiệp cường độ cao hơn nên được nhắm vào các cá nhân và quần thể có nguy cơ ASCVD cao hơn. Box 8 liệt kê các thông điệp chính về hiệu quả chi phí của phòng ngừa CVD bằng cách điều chỉnh lipid và Box 9 nêu bật các khoảng trống chứng cứ.
![Hình 6. Giảm tuyệt đối trong các biến cố mạch máu chính bằng liệu pháp statin [233].](https://www.healcentral.org/wp-content/uploads/2020/07/Untitled-1-300x198.jpg)
Box 8. Thông điệp chính
| Phòng ngừa CVD bằng cách thay đổi lối sống, dùng thuốc hoặc cả hai đều có hiệu quả về chi phí trong nhiều tình huống, bao gồm các tiếp cận và hành động dựa trên dân số nhắm vào các cá nhân tăng nguy cơ CVD. |
| Hiệu quả chi phí phụ thuộc vào một số yếu tố, bao gồm nguy cơ CVD và mức LDL ban đầu, chi phí điều trị và tiếp thu các chiến lược phòng ngừa. Các biện pháp can thiệp để ngăn ngừa CVD có hiệu quả hơn về chi phí ở các cá nhân và dân số có nguy cơ CVD cao hơn. |
| Các phân tích về hiệu quả chi phí được cung cấp thông tin quan trọng bởi các giả định về tiên lượng bệnh dài hạn và hiệu quả điều trị. Việc tăng cường các bằng chứng để cung cấp thông tin cho các giả định này được khuyến khích. |
CVD = bệnh tim mạch; LDL = lipoprotein mật độ thấp.
Box 9. Khoảng trống chứng cứ
| Hiệu quả chi phí đòi hỏi bằng chứng về ảnh hưởng của các can thiệp đối với sức khỏe và chăm sóc sức khỏe trong một thời gian dài; kỹ thuật mô hình lấp đầy khoảng trống. Cần thêm dữ liệu từ RCT và nghiên cứu quan sát. |
| Bằng chứng trực tiếp về tác dụng của các liệu pháp điều chỉnh lipid trên tỷ lệ tử vong chung, đặc biệt ở những người có nguy cơ CVD từ thấp đến trung bình, người lớn tuổi và đối với các can thiệp mới hơn, là thiếu. Nên theo dõi lâu dài sau thử nghiệm RCT. |
| Hiệu quả chi phí của việc sử dụng nguy cơ CVD trọn đời và điểm nguy cơ CVD chính xác hơn để can thiệp mục tiêu cần được nghiên cứu thêm. |
CVD = bệnh tim mạch; RCT = thử nghiệm ngẫu nhiên đối chứng.
13. Chiến lược khuyến khích áp dụng thay đổi lối sống lành mạnh và tuân thủ các liệu pháp điều chỉnh lipid
Giúp bệnh nhân thay đổi thói quen lối sống lành mạnh hơn là đạt được hiệu quả nhất thông qua các chương trình chăm sóc phòng ngừa chính thức, có thể là vì sự theo dõi tích cực và chuyên môn đa chuyên khoa mà họ cung cấp [608]. Tuy nhiên, trong chăm sóc hàng ngày, việc tuân thủ thay đổi lối sống lành mạnh và phác đồ thuốc là một thách thức đối với cả bệnh nhân và chuyên gia.
Một cách tiếp cận toàn diện tập trung vào bệnh nhân và gia đình nằm trong một bối cảnh chăm sóc sức khỏe được khuyến cáo thay vì giải quyết các yếu tố nguy cơ đơn lẻ với nhiều hơn một can thiệp ở các địa điểm khác nhau. Box 10 có một số kỹ thuật hữu ích khi tư vấn cho bệnh nhân thay đổi hành vi.
Box 10. Các phương pháp tăng cường tuân thủ thay đổi lối sống
| 1. Khám phá động lực và xác định môi trường xung quanh. Cân ưu và nhược điểm cho sự thay đổi, đánh giá và xây dựng tính tự hiệu quả và sự tự tin, và tránh thảo luận tròn. |
| 2. Cung cấp hỗ trợ, và thiết lập mối quan hệ với bệnh nhân và gia đình họ. |
| 3. Mời chồng/vợ, các thành viên khác trong gia đình, hoặc người chăm sóc tham gia, đây là những người có thể có ảnh hưởng trong lối sống của bệnh nhân. |
| 4. Sử dụng phương pháp OARS (Câu hỏi mở, Khẳng định, Nghe phản ánh, Tóm tắt) khi thảo luận về thay đổi hành vi (www.smartrecovery.org/wp- content/uploads/2017/03/UsingMIinSR.pdf). |
| 5. Tư vấn phù hợp với văn hóa, thói quen và tình huống của từng bệnh nhân. |
| 6. Sử dụng thiết lập mục tiêu SMART (đàm phán các mục tiêu để thay đổi mà nó phải Cụ thể, Đo lường được, Có thể đạt được, Thực tế và Kịp thời). Theo dõi các mục tiêu và ghi lại tiến độ trên một hồ sơ được chia sẻ. |
Một cách tiếp cận toàn diện để cải thiện sự tuân thủ thuốc được mô tả trong tài liệu Dữ liệu bổ sung.
14.Thông điệp chính
(1) Cholesterol và nguy cơ. Các nghiên cứu tiến cứu, thử nghiệm ngẫu nhiên và nghiên cứu ngẫu nhiên Mendel đều cho thấy LDL-C tăng là nguyên nhân của ASCVD. Trong toàn bộ phạm vi của mức LDL-C, “càng thấp càng tốt”, không có ngưỡng dưới, ít nhất là xuống tới khoảng 1 mmol/L. Giảm LDL-C có thể mang lại lợi ích đáng giá ở những bệnh nhân có LDL-C trung bình hoặc dưới trung bình đang điều trị hạ LDL-C. Việc giảm tỷ lệ nguy cơ ASCVD đạt được bằng cách hạ LDL-C (chẳng hạn bằng một statin, ezetimibe, hoặc chất ức chế PCSK9) phụ thuộc vào việc giảm tuyệt đối LDL-C, với mỗi 1 mmol/L giảm đi tương ứng với giảm khoảng một phần năm ASCVD.
(2) Chất ức chế PCSK-9. Các thử nghiệm lớn đã chỉ ra rằng chất ức chế PCSK9 làm giảm hơn nữa nguy cơ ASCVD khi được thêm vào ở đỉnh của liệu pháp dựa trên statin và có thể chỉ nên sử dụng chúng ở những người có nguy cơ ASCVD cao nhất.
(3) Sử dụng hình ảnh tim để phân tầng nguy cơ. Đánh giá điểm CAC bằng CT có thể hữu ích trong việc đưa ra quyết định điều trị ở những người có nguy cơ ASCVD trung bình. Thu được điểm số này có thể hỗ trợ trong các cuộc thảo luận về chiến lược điều trị ở những bệnh nhân không đạt được mục tiêu LDL- C bằng can thiệp lối sống đơn độc và có một câu hỏi là liệu có nên thực hiện điều trị hạ LDL-C hay không. Đánh giá gánh nặng mảng bám động mạch (cảnh hoặc đùi) trên siêu âm cũng có thể là thông tin cần thiết trong những trường hợp này.
(4) Sử dụng ApoB trong phân tầng nguy cơ. ApoB có thể là một phép đo tốt hơn về tiếp xúc của một cá nhân đối với các lipoprotein gây xơ vữa, và do đó việc sử dụng nó có thể đặc biệt hữu ích để đánh giá nguy cơ ở những người mà phép đo LDL-C đánh giá thấp gánh nặng này, chẳng hạn như những người có TG cao, DM, béo phì, hoặc LDL-C rất thấp.
(5) Sử dụng Lp (a) trong phân tầng nguy cơ. Phép đo Lp (a) một lần có thể giúp xác định những người có mức Lp (a) di truyền rất cao, là những người có thể có nguy cơ trọn đời đáng kể về ASCVD. Nồng độ Lp (a) cao trong huyết tương cũng có thể hữu ích trong việc phân tầng nguy cơ cao hơn nữa đối với những bệnh nhân có nguy cơ ASCVD cao, ở những bệnh nhân có tiền sử gia đình CVD sớm và để quyết định chiến lược điều trị ở những người có nguy cơ ước tính nằm ở ranh giới của các phân nhóm nguy cơ.
(6) Tăng cường các mục tiêu điều trị. Điều quan trọng là phải đảm bảo điều trị cho những bệnh nhân có nguy cơ cao nhất đạt được mức giảm LDL-C lớn nhất có thể. Hướng dẫn này nhằm hỗ trợ điều này bằng cách đặt tỷ lệ giảm LDL-C tối thiểu (50%) và mục tiêu điều trị LDL-C tuyệt đối <1.4 mmol/L (<55 mg/dL) cho bệnh nhân có nguy cơ rất cao và <1.8 mmol/L (<70 mg/dL) cho bệnh nhân có nguy cơ cao. Khuyến cáo rằng bệnh nhân FH có ASCVD hoặc có yếu tố nguy cơ chính khác được điều trị là nguy cơ rất cao và những bệnh nhân không có ASCVD từ trước hoặc các yếu tố nguy cơ khác là nguy cơ cao.
(7) Điều trị bệnh nhân bị ACS gần đây. Các thử nghiệm ngẫu nhiên mới đây hỗ trợ chiến lược tăng cường điều trị hạ LDL-C ở những bệnh nhân có nguy cơ rất cao bị ACS (MI hoặc đau thắt ngực không ổn định). Nếu mục tiêu điều trị LDL- C cụ thể không đạt sau 4-6 tuần với liều statin dung nạp cao nhất và ezetimibe, thì việc bổ sung chất ức chế PCSK9 là thích hợp.
(8) Tính an toàn của nồng độ LDL-C thấp. Đến nay không có tác dụng phụ nào đã biết của nồng độ LDL-C rất thấp [ví dụ: <1 mmol/L (40 mg/dL)].
(9) Quản lý ‘không dung nạp’ statin. Trong khi statin hiếm khi gây tổn thương cơ nghiêm trọng (bệnh cơ hoặc tiêu cơ vân trong những trường hợp nặng nhất), có nhiều lo ngại công khai rằng statin thường có thể gây ra các triệu chứng cơ ít nghiêm trọng. Các bác sĩ lâm sàng thường xuyên đối mặt với ‘không dung nạp’ statin như vậy và có thể rất khó khăn để quản lý. Tuy nhiên, các thử nghiệm ngẫu nhiên so sánh với giả dược đã chỉ ra rất rõ rằng thật sự không dung nạp statin là hiếm, và nói chung có thể đưa ra một số hình thức của liệu pháp statin (ví dụ: bằng cách thay đổi loại statin hoặc giảm liều statin) ở phần lớn bệnh nhân có nguy cơ ASCVD.
(10) Điều trị statin cho người lớn tuổi. Một phân tích gộp các thử nghiệm ngẫu nhiên đã chỉ ra rằng tác dụng của liệu pháp statin được quyết định bởi việc giảm tuyệt đối LDL-C cũng như nguy cơ ASCVD ban đầu và độc lập với tất cả các yếu tố nguy cơ đã biết, bao gồm cả độ tuổi. Do đó, liệu pháp statin ở người lớn tuổi nên được xem xét theo mức nguy cơ ước tính và LDL-C ban đầu, mặc dù có liên quan đến tình trạng sức khỏe nền của từng cá nhân và nguy cơ tương tác thuốc. Tác dụng của statin ở những người >75 tuổi là không chắc chắn, đặc biệt trong phòng ngừa tiên phát. Liệu pháp statin nên được bắt đầu bằng liều thấp nếu có suy thận đáng kể và/hoặc khả năng tương tác thuốc, rồi sau đó tăng liều lên để đạt được các mục tiêu điều trị LDL-C.
15.Khoảng trống chứng cứ
• Các nghiên cứu tiến cứu là cần thiết để khảo sát giá trị gia tăng của việc tái phân loại tổng nguy cơ CV và xác định đủ điều kiện điều trị hạ lipid dựa trên điểm số CAC ở những người có nguy cơ trung bình hoặc cao.
• Các so sánh dựa trên kết cục của điểm CAC vs. đánh giá gánh nặng mảng xơ vữa động mạch (động mạch cảnh hoặc đùi) bằng siêu âm để tái phân loại nguy cơ CV ở những người có nguy cơ trung bình hoặc cao là cần thiết.
• Mặc dù các phiên bản cho từng quốc gia cụ thể của hệ thống SCORE hiệu chỉnh hiện có cho nhiều nước Châu Âu, nhưng biểu đồ nguy cơ dựa trên dữ liệu đoàn hệ cụ thể theo quốc gia là không có đối với hầu hết các nước. Biểu đồ tổng biến cố khu vực (vs. biểu đồ chỉ tỷ lệ tử vong) là cần thiết.
• Ước tính tổng nguy cơ CV bằng hệ thống SCORE và theo đó, các khuyến cáo về việc đủ điều kiện dùng statin cũng như mục tiêu điều trị dựa trên TC, trong khi LDL-C là phương pháp phân tích lipid chính để tầm soát, chẩn đoán và quản lý.
• Không có so sánh dựa trên kết cục của LDL-C vs. ApoB như là phương pháp đo lường chính để tầm soát, chẩn đoán và quản lý.
• Trong bối cảnh các bằng chứng thử nghiệm lâm sàng ngẫu nhiên và di truyền cho thấy không có ảnh hưởng đáng kể nào của việc tăng mức HDL trên nguy cơ biến cố CVD, thì tác động lâm sàng của các liệu pháp làm thay đổi chức năng của các hạt HDL vẫn chưa được biết. Cần thêm bằng chứng về mối liên quan bất lợi rõ ràng của mức HDL-C cực kỳ cao với kết cục lâm sàng.
• Các nghiên cứu chuyên dụng đánh giá kết cục bằng các liệu pháp chuyên biệt hạ Lp (a) được cảnh báo.
• Cần thêm bằng chứng về thuốc ức chế PCSK9 ở các dân số cụ thể, bao gồm bệnh nhân suy thận nặng và đang lọc máu, bệnh nhân nhiễm HIV, ở trẻ em và thanh thiếu niên bị FH, sau ghép tim, và trong khi mang thai.
• Tác dụng ức chế PCSK9 trên các khoang cơ thể cụ thể (như với siRNA hoặc antisense) hoặc chỉ trong huyết tương (như với các kháng thể đơn dòng) vẫn chưa được thiết lập.
• Liệu có nên khởi đầu thuốc ức chế PCSK9 sớm ở bệnh nhân ACS hoặc đột quỵ? Theo các bằng chứng về lợi ích lâm sàng bền vững liên quan đến việc bắt đầu điều trị statin sớm trong giai đoạn cấp của ACS hoặc đột quỵ, thời điểm tối ưu của điều trị thuốc ức chế PCSK9 ở bệnh nhân ACS và đột quỵ vẫn chưa được giải quyết trong các nghiên cứu kết cục.
• Liệu mức LDL-C rất thấp đạt được khi kết hợp statin, ezetimibe và chất ức chế PCSK9 có làm giảm nhu cầu PCI thêm hay không vẫn chưa được giải quyết trong các nghiên cứu kết cục.
• Ở những bệnh nhân HF mạn tính, một lợi ích nhỏ của PUFA n-3 đã được thể hiện trong một RCT và đáng để nghiên cứu thêm.
• Chương trình tầm soát tối ưu để phát hiện FH là gì?
• Theo quan điểm về khả năng tiếp cận hạn chế xét nghiệm di truyền trong một số môi trường, cần có thêm bằng chứng liên quan đến kết cục chỉ với tầm soát và chẩn đoán FH bằng lâm sàng vs. gen.
• Cần có thêm bằng chứng RCT để hỗ trợ việc sử dụng điều trị dựa trên statin ở người cao tuổi (tuổi ≥75, nhưng đặc biệt ở những người ≥80 tuổi).
• Cần thêm bằng chứng RCT để điều trị statin ở người nhận ghép thận.
• Không có dữ liệu về tác dụng của statin, ezetimibe hoặc fibrate trên các biến cố CV ở bệnh nhân nhiễm HIV rối loạn lipid máu.
• Cần thêm bằng chứng về việc đạt được các mục tiêu LDL được khuyến cáo ở những bệnh nhân có nguy cơ rất cao trong thực hành của thế giới thực ở kỷ nguyên liệu pháp kết hợp ngày càng được kê đơn để hạ LDL.
16.Thông điệp “làm gì” và “ không nên làm gì” từ Hướng dẫn này
| Khuyến cáo | Loại | Mức |
| Ước tính nguy cơ CVD | ||
| Ước tính tổng nguy cơ bằng cách sử dụng hệ thống ước tính nguy cơ như SCORE được khuyến cáo cho người lớn không triệu chứng >40 tuổi mà không có bằng chứng về CVD, DM, CKD, tăng cholesterol máu gia đình hoặc LDL-C >4.9 mmol/L (> 190 mg/dL). | I | C |
| Khuyến cáo rằng các cá nhân có nguy cơ cao và rất cao được xác định dựa trên ghi nhận CVD, DM, bệnh thận từ trung bình đến nặng, các yếu tố nguy cơ cá nhân ở mức rất cao, FH hoặc nguy cơ SCORE cao. Khuyến cáo rằng các bệnh nhân như vậy được xem là ưu tiên để tư vấn và quản lý tất cả các yếu tố nguy cơ. | I | C |
| Điểm nguy cơ được phát triển cho dân số chung không được khuyến cáo đánh giá nguy cơ CV ở bệnh nhân DM hoặc FH. | III | C |
| Phân tích lipid để ước tính nguy cơ CVD | ||
| TC được sử dụng để ước tính tổng nguy cơ CV bằng phương pháp hệ thống SCORE. | I | C |
| Phân tích HDL-C được khuyến cáo để tinh chỉnh thêm ước tính nguy cơ bằng hệ thống SCORE trực tuyến. | I | C |
| Phân tích LDL-C được khuyến cáo là phương pháp phân tích lipid chính để tầm soát, chẩn đoán và quản lý. | I | C |
| Phân tích TG được khuyến cáo là một phần của quá trình phân tích lipid thường quy. | I | C |
| Đánh giá non-HDL-C được khuyến cáo để đánh giá nguy cơ, đặc biệt ở những người có nồng độ TG cao, DM, béo phì hoặc mức LDL-C rất thấp. | I | C |
| Phân tích ApoB được khuyến cáo để đánh giá nguy cơ, đặc biệt ở những người có nồng độ TG cao, DM, béo phì, hội chứng chuyển hóa hoặc mức LDL-C rất thấp. Nó có thể được sử dụng như một thay thế cho LDL-C, nếu có sẵn, như là phép đo chính cho tầm soát, chẩn đoán và quản lý, và có thể được ưu tiên hơn so với non-HDL- C ở những người có TG cao, DM, béo phì hoặc mức LDL-C rất thấp. | I | C |
| Mục tiêu điều trị đối với LDL-C | ||
| Trong phòng ngừa thứ phát cho những bệnh nhân có nguy cơ rất cao, giảm LDL-C ≥50% so với mức ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL) được khuyến cáo. | I | A |
| Trong phòng ngừa tiên phát cho những người có nguy cơ rất cao nhưng không FH, giảm LDL-C ≥50% so với mức ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL) được khuyến cáo. | I | C |
| Ở những bệnh nhân có nguy cơ cao c, giảm LDL-C ≥50% so với mức ban đầu và mục tiêu LDL-C <1.8 mmol/L (<70 mg/dL) được khuyến cáo. | I | A |
| Thuốc hạ LDL-C | ||
| Khuyến cáo rằng statin cường độ cao được kê đơn đến liều dung nạp cao nhất để đạt các mục tiêu đã đề ra đối với từng mức độ nguy cơ cụ thể. | I | A |
| Nếu không đạt được mục tiêu với liều statin dung nạp tối đa, khuyến cáo kết hợp với ezetimibe. | I | B |
| Để phòng ngừa thứ phát, bệnh nhân có nguy cơ rất cao không đạt mục tiêuc với liều statin và ezetimibe dung nạp tối đa, khuyến cáo kết hợp với thuốc ức chế PCSK9. | I | A |
| Đối với bệnh nhân FH có nguy cơ rất cao (nghĩa là có ASCVD hoặc có một yếu tố nguy cơ chính khác) không đạt mục tiêu với liều statin và ezetimibe dung nạp tối đa, khuyến cáo kết hợp với thuốc ức chế PCSK9. | I | C |
| Điều trị bằng thuốc cho bệnh nhân HTG | ||
| Điều trị statin được khuyến cáo là lựa chọn đầu tay để giảm nguy cơ CVD ở những người có nguy cơ cao mà bị tăng triglyceride máu [nồng độ TG >2.3 mmol/L (>200 mg/dL)]. | I | B |
| Quản lý bệnh nhân HeFH | ||
| Khuyến cáo chẩn đoán FH được xem xét ở bệnh nhân CHD độ tuổi <55 đối với nam và <60 đối với nữ, ở những người có họ hàng mắc CVD sớm gây tử vong hoặc không tử vong, ở những người có họ hàng bị u vàng gân, những người có LDL-C tăng nghiêm trọng [ở người lớn >5 mmol/L (>190 mg/dL), ở trẻ em >4 mmol/L (>150 mg/dL)], và ở những người thân một đời của bệnh nhân FH. | I | C |
| Khuyến cáo FH nên được chẩn đoán bằng các tiêu chí lâm sàng và xác nhận thông qua phân tích DNA khi có thể. | I | C |
| Một khi proband được chẩn đoán, khuyến cáo tầm soát phả hệ gia đình. | I | C |
| Khuyến cáo bệnh nhân FH có ASCVD hoặc những người có yếu tố nguy cơ chính khác đang điều trị phải được xem là có nguy cơ rất cao và những bệnh nhân không có tiền sử ASCVD hoặc các yếu tố nguy cơ khác đang điều trị được xem là có nguy cơ cao. | I | C |
| Đối với bệnh nhân FH có ASCVD, là những người có nguy cơ rất cao, khuyến cáo điều trị để đạt mức giảm ≥50% so với ban đầu và LDL-C <1.4 mmol/L (<55 mg/dL). Nếu không thể đạt mục tiêu, khuyến cáo kết hợp thuốc. | I | C |
| Điều trị thuốc ức chế PCSK9 được khuyến cáo ở những bệnh nhân FH có nguy cơ rất cao nếu không đạt mục tiêu điều trị bằng statin dung nạp tối đa cộng ezetimibe. | I | C |
| Ở trẻ em, xét nghiệm FH được khuyến cáo từ 5 tuổi hoặc sớm hơn nếu nghi ngờ HoFH. | I | C |
| Điều trị rối loạn lipid máu ở người cao tuổi | ||
| Điều trị statin được khuyến cáo cho người già mắc ASCVD theo cách tương tự như đối với bệnh nhân trẻ tuổi. | I | A |
| Điều trị statin được khuyến cáo để phòng ngừa tiên phát, theo mức độ nguy cơ, ở người cao tuổi ≤75 tuổi. | I | A |
| Khuyến cáo statin được bắt đầu với liều thấp nếu có suy thận đáng kể và/hoặc có khả năng tương tác với thuốc khác, và sau đó tăng liều dần để đạt được mục tiêu điều trị LDL-C. | I | C |
| Điều trị rối loạn lipid máu ở DM | ||
| Ở những bệnh nhân T2DM có nguy cơ rất caoc , khuyến cáo giảm LDL-C ≥50% so với ban đầu và mục tiêu LDL-C <1.4 mmol/L (<55 mg/dL). | I | A |
| Ở những bệnh nhân T2DM có nguy cơ rất caoc , khuyến cáo giảm LDL-C ≥50% so với ban đầu và mục tiêu LDL-C <1.8 mmol/L (<70 mg/dL). | I | A |
| Statin được khuyến cáo ở những bệnh nhân T1DM có nguy cơ cao hoặc rất cao c | I | A |
| Liệu pháp statin không được khuyến cáo ở bệnh nhân tiền mãn kinh bị đái tháo đường đang cân nhắc mang thai hoặc không sử dụng biện pháp tránh thai đầy đủ. | III | C |
| Quản lý bệnh nhân bị ACS | ||
| Ở tất cả các bệnh nhân ACS không có chống chỉ định hoặc không có tiền sử không dung nạp, khuyến cáo liệu pháp statin liều cao được bắt đầu hoặc tiếp tục càng sớm càng tốt, bất kể giá trị LDL-C ban đầu. | I | A |
| Nếu mục tiêu LDL-C không đạt được sau 4-6 tuần với liều statin dung nạp tối đa, khuyến cáo kết hợp với ezetimibe. | I | B |
| Nếu mục tiêu LDL-C không đạt được sau 4-6 tuần mặc dù điều trị statin dung nạp tối đa và ezetimibe, khuyến cáo thêm chất ức chế PCSK9. | I | B |
| Liệu pháp hạ lipid để dự phòng biến cố ASCVD ở bệnh nhân có tiền sử đột quỵ thiếu máu cục bộ | ||
| Bệnh nhân có tiền sử đột quỵ thiếu máu cục bộ hoặc TIA có nguy cơ mắc ASCVD rất cao, đặc biệt là đột quỵ thiếu máu cục bộ tái phát, do đó, khuyến cáo liệu pháp hạ LDL-C tích cực cho những bệnh nhân này. | I | A |
| Điều trị rối loạn lipid máu ở HF mạn hoặc bệnh van tim | ||
| Không khuyến cáo bắt đầu liệu pháp hạ lipid máu ở những bệnh nhân HF trong trường hợp không có chỉ định khác cho việc sử dụng chúng. | III | A |
| Không khuyến cáo bắt đầu điều trị hạ lipid máu ở bệnh nhân hẹp van động mạch chủ mà không bị CAD để làm chậm tiến triển hẹp van động mạch chủ trong trường hợp không có chỉ định khác cho việc sử dụng chúng. | III | A |
| Quản lý lipid ở bệnh nhân CKD trung bình đến nặng (KDOQI giai đoạn 3- 5) | ||
| Khuyến cáo bệnh nhân CKD KDOQI giai đoạn 3-5c được xem là có nguy cơ cao hoặc rất cao ASCVD. | I | A |
| Khuyến cáo sử dụng statin hoặc kết hợp statin/ezetimibe ở bệnh nhân CKD giai đoạn 3-5 không phụ thuộc lọc máu. | I | A |
| Ở những bệnh nhân bị CKD phụ thuộc lọc máu, nhưng không ASCVD, không khuyến cáo bắt đầu điều trị statin. | III | A |
| Các thuốc hạ lipid ở bệnh nhân PAD (bao gồm bệnh động mạch cảnh) | ||
| Ở bệnh nhân PAD, liệu pháp hạ lipid máu, bao gồm liều statin dung nạp tối đa, cộng với ezetimibe hoặc kết hợp với thuốc ức chế PCSK9 nếu cần, được khuyến cáo để làm giảm nguy cơ biến cố ASCVD. | I | A |
| Các thuốc hạ lipid ở bệnh nhân CIID | ||
| Không khuyến cáo sử dụng thuốc hạ lipid máu trên nền có sự hiện diện của CIID. | III | C |
| Các thuốc hạ lipid ở bệnh nhân SMI | ||
| Khuyến cáo SMI được sử dụng làm yếu tố điều chỉnh để ước tính tổng nguy cơ ASCVD. | I | C |
| Khuyến cáo rằng các hướng dẫn tương tự để quản lý tổng nguy cơ ASCVD được sử dụng ở bệnh nhân SMI như được sử dụng ở các bệnh nhân không mắc bệnh này. |
I |
C |
| Khuyến cáo rằng ở những bệnh nhân SMI, cần chú ý tăng cường tuân thủ thay đổi lối sống và tuân thủ thuốc điều trị. | I | C |
ACS = hội chứng mạch vành cấp; Apo = apolipoprotein; ASCVD = bệnh tim mạch xơ vữa động mạch; CAD = bệnh động mạch vành; CHD = bệnh tim mạch vành; CIID = bệnh lý có tình trạng viêm mạn tính qua trung gian miễn dịch; CKD = bệnh thận mạn tính; CV = tim mạch; CVD = bệnh tim mạch; DM = đái tháo đường; FH = tăng cholesterol máu gia đình; HDL-C = cholesterol lipoprotein mật độ cao; HeFH = FH dị hợp tử; HF = suy tim; HoFH = FH đồng hợp tử; HTG = tăng triglyceride máu; LDL-C = cholesterol lipoprotein mật độ thấp; MetS = hội chứng chuyển hóa; PAD = bệnh động mạch ngoại biên; PCSK9 = proprotein convertase subtilisin/kexin loại 9; SCORE = Ước tính nguy cơ mạch vành có hệ thống; SMI = bệnh tâm thần nặng; TC = cholesterol toàn phần; TG = triglyceride; TIA = cơn thiếu máu não thoáng qua; T1DM = DM type 1; T2DM = DM type 2.